KELOMPOK II
Kurnia Hendra Pratama
(1707113955)
Mertwysef Devraj
(1707123109)
Rismalita Wardani
(1707122911)
Valentin Lilis Suriani
(1707111378)
Vanny Efia Triwahyuni
(1707111010)
Percobaan 2
Reaksi Asilasi
“
Pembuatan Asetanilida
”
Asisten :
Mustapa Ardi
Dosen pengampu :
Drs. Irdoni,Hs.MS.
Program sarjana teknik kimia
Fakultas teknik universitas riau
Pekanbaru
Praktikum Kimia Organik/Kelompok II/S. Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
ABSTRAKAsetanilida adalah senyawa yang terbentuk dari turunan amina aromatik yang digolongkan sebagai amida primer karena satu atom hidrogen pada anilin digantikan dengan gugus asil pada asetat anhidrat. Salah satu proses pembuatan asetanilida adalah mereaksikan anilin dengan asetat anhidrat. Tujuan dari praktikum ini adalah mempelajari pembuatan turunan amida aromatik melalui reaksi amina aromatik dengan turunan asam karboksilat yaitu anhidrat asam. Pada pembuatan asetanilida 1, 4 ml anilin direaksikan dengan 4,5 ml asetat anhidrat kemudian ditambahkan 2,5 ml asam glasial kemudian diaduk. Setelah itu diencerkan larutan tersebut dengan 25 ml aquades sehingga terbentuk kristal. Kristal tersebut disaring dengan pompa vakum dan dilakukan rekristalisasi dengan campuran 25 ml etanol-air. Pada pembuatan asetanilida 2, 6 ml anilin direaksikan 8 ml asam asetat lalu direklistalisasi dengan penambahan 150 ml aquades dan penambahan sedikit karbon aktif. Namun pada percobaan 1 maupun percobaan 2 tidak ada hasil yang di dapat yaitu yang berupa kristal asetanilida.
Kata kunci : asetanilida, anilin, rekristalisasi
ABSTRACT
Acetylylides are compounds formed from aromatic amine derivatives which are classified as primary amides because one hydrogen atom in aniline is replaced by an acyl group of acetate anhydrous. One of the process of making acetylchide is reacting aniline with anhydrous acetate. The purpose of this lab is to study the manufacture of aromatic amide derivatives by the reaction of aromatic amines with carboxylic acid derivatives, anhydrous acids. In the preparation of 1, 4 ml of aniline is reacted with 4.5 ml of anhydrous acetate then 2.5 ml of glacial acid is added and then stirred. After that diluted the solution with 25 ml of aquades to form crystals. The crystals are filtered with a vacuum pump and recrystallized with a 25 ml ethanol-water mixture. In the preparation of acetylamide 2, 6 ml aniline was reacted with 8 ml of acetic acid then rececalized by addition of 150 ml of aquadest and the addition of less activated carbon. However, in experiment 1 and experiment 2 there is no result that can be in the form of crystal of acetylamide.
Reaksi Asilasi “ Pembuatan Asetanilida”
DAFTAR ISIABSTRAK ... i
DAFTAR ISI... ii
DAFTAR GAMBAR ... iv
DAFTAR TABEL ... v
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Tujuan ... 2
1.3 Manfaat ... 2
BAB II LANDASAN TEORI ... 3
2.1 Anilin ... 3
2.2 Asam Asetat Glasial ... 6
2.3 Etanol ... 9
2.4 Asetat Anhidrat ... 11
2.5 Reaksi dan Mekanisme Asetanilida ... 12
2.6 Reaksi Asilasi ... 14
2.7 Rekristalisasi... 15
2.8 Penyaringan ... 15
2.9 Perhitungan kadar air dan rendemen ... 16
BAB III METODOLOGI PERCOBAAN ... 18
3.1 alat ... 18
3.2 bahan ... 19
3.3 prosedur percobaan ... 19
3.4 rangkaian alat ... 20
Praktikum Kimia Organik/Kelompok II/S. Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
BAB V PENUTUP ... 22
5.1 Kesimpulan ... 22 5.2 Saran ... 22
DAFTAR PUSTAKA
Reaksi Asilasi “ Pembuatan Asetanilida”
DAFTAR GAMBAR
Gambar 2.1 Struktur Kimia Anilin ... 3
Gambar 2.2 Struktur Asam Asetat Glasial ... 6
Gambar 2.3 Reaksi Pembentukan Asetanilida ... 12
Gambar 2.4 Gugus asil ... 14
Gambar 2.5 Contoh reaksi asilasi ... 14
Praktikum Kimia Organik/Kelompok II/S. Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
DAFTAR TABEL
Tabel 2.1 Sifat fisika anilin ... 4
Tabel 2.3 Sifat fisika etanol ... 9
Reaksi Asilasi “ Pembuatan Asetanilida”
BAB IPENDAHULUAN
1.1 Latar Belakang
Asetanilida atau sering disebut phenilasetamida mempunyai rumus molekul C6H5NHCOCH3merupakan merupakan senyawa turunan asetil amina aromatis yang
digolongkan sebagai amida primer, dimana satu atom hidrogen pada anilin digantikan dengan satu gugus asetil. Asetanilida dapat dibuat dengan proses kristalisasi antara anilin dan asetat asam asetat glasial. Kristalisasi adalah pemisahan bahan padat berbentuk kristal dari suatu larutan atau lelehan.
Kebutuhan asetanilida di Indonesia yang masih mengandalkan impor dari luar. Ini disebabkan karena minimnya teknologi yang dibutuhkan untuk industri pembuatan asetanilida. Nilai impor asetanilida tiap tahun terus meningkat. Sehingga dalam menyongsong era industrialisasi yang merupakan program pemerintah yang sangat penting dalam rangka proses alih teknologi dan membuka lapangan pekerjaan yang baru serta untuk penghematan devisa negara dan untuk merangsang pertumbuhan industri kimia yang lain, maka perlu dibangun pabrik asetanilida untuk mencukupi kebutuhan asetanilida dalam negeri.
Melihat banyaknya kegunaan dan kebutuhan akan asetanilida, karena itulah dilakukan praktikum pembuatan asetanilida dalam skala labor untuk mengamati reaksi yang terjadi dalam proses pembuatan asetanilida tersebut (Hartanti, 2011).
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
1.2 Tujuan PercobaanMempelajari pembuatan turunan aminda aromatik melalui reaksi amina aromatik dengan turunan asam karboksilat, yaitu anhidrida asam.
1.3 Manfaat
1. Praktikan dapat memahami cara pembuatan Asetanilida dalam skala lab 2. Praktikan dapat mempelajari dan mengetahui reaksi-reaksi yang terjadi selama
Reaksi Asilasi “ Pembuatan Asetanilida”
BAB IILANDASAN TEORI
2.1 Anilin
2.1.1 Pengertian anilin
Gambar 2.1 Struktur Kimia Anilin (Ahmad, 2011)
Anilin pertama kali diisolasi dari distilasi destruktif indigo pada tahun 1826 oleh Otto Unverdorben, yang menamainya kristal. Pada tahun 1834, Friedrich Runge terisolasi dari tar batubara zat yang menghasilkan warna biru yang indah pada pengobatan dengan klorida kapur, yang bernama kyanol atau cyanol Pada tahun 1841, CJ Fritzsche menunjukkan bahwa, dengan memperlakukan indigo dengan potas api, itu menghasilkan minyak, yang ia beri nama anilina, dari nama spesifik dari salah satu-menghasilkan tanaman nila, dari Portugis anil "yang semak indigo" dari bahasa Arab an- nihil "nila" asimilasi dari al-nihil, dari nila Persia, dari nili "indigo" dengan Indigofera anil, anil yang berasal dari Sansekerta nila, biru tua, nila, dan pabrik nila (Ahmad, 2011).
Anilin merupakan senyawa turunan benzene yang dihasilkan dari reduksi nitrobenzene. Anilin memiliki rumus molekul C6H5NH2. Anilin merupakan cairan
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
2.1.2 Sifat Fisika dan Kimia Anilin1. Sifat Fisika Anilin
Menurut Ahmad (2011), sifat kimia dari anilin yaitu:
a) Halogenasi senyawa anilin dengan brom dalam larutan sangat encer menghasilkan endapan 2, 4, 6 tribromo anilin. Pemanasan anilin hipoklorid dengan senyawa anilin sedikit berlebih pada tekanan sampai 6 atm menghasilkan senyawa diphenilamine.
b) Hidrogenasi katalitik pada fase cair pada suhu 135°C – 170oC dan tekana 50 – 500 atm menghasilkan 80% cyclohexamine ( C6H11NH2 ). Sedangkan
hidrogenasi anilin pada fase uap dengan menggunakan katalis nikel menghasilkan 95% cyclohexamine.
c) Nitrasi anilin dengan asam nitrat pada suhu -20oC menghasilkan mononitroanilin, dan nitrasi anilin dengan nitrogen oksida cair pada suhu 0oC menghasilkan 2, 4 dinitrophenol. Aniline merupakan senyawa yang bersifat basa, dengan titik didih 180oC dan indeks bias 158 .jika kontak dengan cahaya matahari aniline akan mengalami reaksi oksidasi dilaboratorium aniline digunakan untuk dan dalam kehidupan sehari hari digunakan untuk zat warna.
Reaksi Asilasi “ Pembuatan Asetanilida”
2.1.3 Proses Pembuatan Anilin1. Aminasi Chlorobenzene
Pada proses aminasi chlorobenzene menggunakan zat pereaksi amoniak cair, dalam fasa cair dengan katalis tembaga oxide dipanaskan akan menghasilkan 85 - 90% anilin. Sedangkan katalis yang aktif untuk reaksi ini adalah tembaga khlorid yang terbentuk dari hasil reaksi samping ammonium khlorid dengan tembaga oxide. Mula - mula amoniak cair dimasukkan ke dalam mixer dan pada saat bersamaan chlorobenzen dimasukkan pula, tekanan di dalam mixer adalah 200 atm. Dari mixer campuran chlorobenzen dengan amoniak dilewatkan ke pre-heater kemudian masuk ke reaktor dengan suhu reaksi 235°C dan tekanan 200 atm. Pada reaksi ini ammonia cair yang digunakan adalah berlebihan. Dengan menggunakan katalis tertentu, reaksi yang terjadi adalah sebagai berikut :
C6H5Cl + 2 NH3 ===> C6H5NH2+ NH4Cl (1)
Pada proses aminasi chlorobenzen, hasil yang diperoleh berupa nitro anilin dengan yield yang dihasilkan adalah 96%.
2. Reduksi Nitrobenzen a) Reduksi fasa cair
Untuk fasa cair, nitrobenzen direduksi dengan hidrogen dalam suasana asam (HCl) serta adanya iron boring, dengan suhu sekitar 135°C - 170°C dan tekanan antara 50 - 500 atm, dimana asam ini akan mengikat oksigen sehingga akan terbentuk air.
Dengan bantuan katalis Fe2O3 reaksinya sebagai berikut :
4C6H5NO2 + 11 H2 ===> 4 C6H5NH2 + 8 H2O (2)
Proses reduksi dalam fasa cair sudah tidak digunakan lagi karena tekanan yang digunakan tinggi sehingga kurang efisien dari segi ekonomis dan teknis. Yield yang dihasilkan adalah 95% (Ahmad, 2011).
b) Reduksi fasa gas
Proses pembuatan anilin dari reduksi nitrobenzen dalam fasa gas, sebagai pereduksi adalah gas hidrogen dan untuk mempercepat reaksi dibantu dengan katalisator nikel oksida, reaksinya sebagai berikut :
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
Pada proses reduksi fasa gas dengan suhu didalam reaktor sekitar 275°C - 350°C dan tekanan 1,4 atm, reaksi yang terjadi adalah reaksi eksotermis karena mengeluarkan panas. Yield yang dihasilkan pada proses ini adalah 98% dan kemurnian dari hasil (anilin) yang tinggi ini (99%) mengakibatkan anilin dari segi komersial dapat digunakan (Ahmad, 2011)
2.1.4 Kegunaan Anilin
Menurut Bresnick (2003), adapun kegunaan dari anilin: a. Bahan bakar roket.
b. Pembuatan zat warna diazo. c. Obat-obatan
d. Bahan peledak.
2.2 Asam Asetat Glasial
2.2.1 Pengertian Asam Asetat Glasial
Asam asetat, asam etanoat atau asam cuka adalah senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam cuka memiliki rumus empiris C2H4O2. Asam asetat murni (disebut asam asetat glasial) adalah cairan higroskopis tak berwarna dan memiliki titik beku 16,7°C (Priyatmono, 2008).
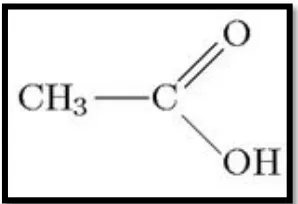
Gambar 2.2 Struktur Asam Asetat Glasial
2.2.2 Sifat Fisika dan Kimia Asetat Glasial
1. Sifat Fisika Asam Asetat Glasial a)Rumus molekul : CH3COOH
Reaksi Asilasi “ Pembuatan Asetanilida”
2. Sifat Kimia Asam Asetat Glasial
Menurut Priyatmono (2008), adapun sifat kimia asam asetat glasial:
a) Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+(proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya
adalah asetat (CH3COO−). Sebuah larutan 1,0 Masam asetat (kira-kira sama
dengan konsentrasi pada cuka rumah) memiliki pH sekitar 2,4.
b) Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6,2, sehingga ia bisa melarutkan baik senyawa polar seperi garam anorganik dan gula maupun senyawa non-polar seperti minyak dan unsur-unsur seperti sulfur dan iodin.
c) Bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng membentuk gas hidrogen dan garam-garam asetat.
d) Baunya khas
2.2.3 Proses Pembuatan Asam Asetat Glasial
1. Karbonilasi metanol
Kebanyakan asam asetat murni dihasilkan melalui karbonilasi.Dalam reaksiini, metanol dan karbon monoksida bereaksi menghasilkan asam asetat.
CH3OH + CO →CH3COOH (4)
Proses ini melibatkan iodometana sebagai zat antara, dimana reaksi itu sendiri terjadi dalam tiga tahap dengan katalis logam komplekspada tahap kedua.
a. CH3OH + HI → CH3I + H2O (5)
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
c. CH3COI + H2O → CH3COOH + HI (7)
Jika kondisi reaksi diatas diatur sedemikian rupa, proses tersebut juga dapat menghasilkan anhidrida asetat sebagai hasil tambahan (Priyatmono, 2008)
2. Oksidasi asetaldehida
Asetaldehida yang digunakan dihasilkan melalui oksidasi butana atau nafta ringan, atau hidrasi dari etilena. Saat butena atau nafta ringan dipanaskan bersama udara disertai dengan beberapa ion logam, termasuk ion mangan, kobalt dan kromium, terbentuk peroksida yang selanjutnya terurai menjadi asam asetat sesuai dengan persamaan reaksi dibawah ini.
2 C4H10 + 5 O2→ 4 CH3COOH + 2H2O (8)
Umumnya reaksi ini dijalankan pada temperatur dan tekanansedemikian rupa sehingga tercapai suhu setinggi mungkin namunbutana masih berwujud cair. Kondisi reaksi pada umumnya sekitar 150°C and 55 atm. Produk sampingan seperti butanon, etil asetat,asam format dan asam propionat juga mungkin terbentuk. Produk sampingan ini bernilai komersial dan jika diinginkan kondisi reaksi dapat diubah untuk menghasilkan lebih banyak produk samping, namun pemisahannya dari asam asetat menjadi kendala karena membutuhkan biaya lebih banyak lagi. Melalui kondisi dan katalisyang sama asetaldehida dapat dioksidasi oleh oksigenudaramenghasilkan asam asetat.
2 CH3CHO + O2→ 2 CH3COOH (9)
Dengan menggunakan katalis modern, reaksi ini dapat memiliki rasio hasil (yield) lebih besar dari 95%. Produk samping utamanya adalah etil asetat, asam format dan formaldehida, semuanya memiliki titik didih yang lebih rendah daripada asam asetat sehingga dapat dipisahkan dengan mudah melalui distilasi (Priyatmono, 2008).
2.2.4 Kegunaan Asam Asetat Glasial
Menurut Austin (2008), adapun kegunaan dari asam asetat glasial sebagai berikut:
Reaksi Asilasi “ Pembuatan Asetanilida”
2. Asam asetat digunakan sebagai pereaksi kimia untuk menghasilkan berbagai senyawa kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi monomer vinil asetat (vinyl acetate monomer, VAM).
3. Selain itu asam asetat juga digunakan dalam produksi anhidrida asetat dan juga ester. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil. Sekitar larutan 12,5% untuk makanan.
4. Reagen untuk analisa.
5. Untuk membuat putih timbal, dll.
2.3 Etanol
2.3.1 Pengertian Etanol
Etanol adalah alkohol 2-karbon dengan rumus molekul CH3CH2OH.Rumus
molekul dari etanol itu sendiri adalah C2H5OH dengan rumus empirisnya C2H6O.Sebuah
notasi alternatif adalah CH3-CH2-OH, yang mengindikasikan bahwa karbon dari gugus
metil (CH3-) melekat pada karbon dari gugus metilen (-CH2 -), yang melekat pada
oksigen dari gugus hidroksil (OH-). Etanol sering disingkat sebagai EtOH, menggunakan notasi kimia organik umum mewakili gugus etil (C2H5) (Nurhasnawati,2015).
Etanol termasuk dalam alkohol primer, yang berarti bahwa karbon yang berikatan dengan gugus hidroksil paling tidak memiliki dua hidrogen atom yang terikat dengannya juga.Reaksi kimia yang dijalankan oleh etanol kebanyakan berkutat pada gugus hidroksilnya.
2.3.2 Sifat Fisika dan Kimia Etanol
1. Sifat Fisika Etanol
Tabel 2.3 Sifat fisika etanol
Massa Molekul Relatif 46,07 gram/mol
Titik Didih Normal 78,32oC
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
2. Sifat Kimia Etanol
Menurut Nurhasnawati (2015), adapun sifat kimia etanol:
a) Sebagai pelarut berbagai bahan-bahan kimia yang ditujukan untuk konsumsi dan kegunaan manusia.
b) Dalam sejarahnya etanol telah lama digunakan sebagai bahan bakar. c) Etanol juga dapat membentuk senyawa ester dengan asam anorganik.
d) Etanol dapat dioksidasi menjadi asetaldehida, yang kemudian dapat dioksidasi lebih lanjut menjadi asam asetat. Dalam tubuh manusia, reaksi oksidasi ini dikatalisis oleh enzim tubuh. Pada laboratorium, larutan akuatik oksidator seperti asam kromatataupun kalium permanganat digunakan untuk mengoksidasi etanol menjadi asam asetat.
e) Pembakaran etanol akan menghasilkan karbon dioksida dan air.
2.3.3 Proses Pembuatan Etanol
Etanol dapat diproduksi secara petrokimia melalui hidrasietilena ataupun secara biologis melalaui fermentasi gula dengan ragi.
1. Hidrasi etilena
Etanol yang digunakan untuk kebutuhan industri sering kali dibuat dari senyawa petrokimia, utamanya adalah melalui hidrasietilena:
C2H4(g) + H2O(g)→ CH3CH2OH(l) (10)
Katalisa yang digunakan umumnya adalah asam fosfat.Katalis ini digunakan pertama kali untuk produksi skala besar etanol oleh Shell Oil Company pada tahun 1947.Reaksi ini dijalankan dengan tekanan uap berlebih pada suhu 300°C. Proses lama yang pernah digunakan pada tahun 1930 oleh Union Carbide adalah dengan menghidrasi etilena secara tidak langsung dengan mereaksikannya dengan asam sulfat pekat untuk mendapatkan etil sulfat. Etil sulfat kemudian dihidrolisis dan menghasilkan etanol (Nurhasnawati, 2015).
2. Fermentasi
Etanol untuk kegunaan konsumsi manusia (seperti minuman beralkohol) dan kegunaan bahan bakar diproduksi dengan cara fermentasi. Spesies ragi tertentu (misalnya
Saccharomy cescerevisiae) mencerna gula dan menghasilkan etanol dan karbon dioksida:
Reaksi Asilasi “ Pembuatan Asetanilida”
Proses membiakkan ragi untuk mendapatkan alkohol disebut sebagai fermentasi. Konsentrasi etanol yang tinggi akan beracun bagi ragi. Pada jenis ragi yang paling toleran terhadap etanol, ragi tersebut hanya dapat bertahan pada lingkungan 15% etanol berdasarkan volume (Nurhasnawati,2015).
2.3.4 Kegunaan Etanol
Etanol digunakan untuk bahan baku industri atau pelarut (kadang-kadang disebut sebagai etanol sintetis) yang terbuat dari petrokimia saham pakan, terutama oleh asam – katalis hidrasi etilena.
Etanol merupakan cairan yang mudah menguap dengan aroma yang khas dan tak berwarna. Dapat juga terbakar tanpa adanya asap dengan timbulnya lidah api berwarna biru yang kadang-kadang tidak dapat terlihat pada cahaya biasa. Etanol diartikan sebagai cairan yang sangat mudah terbakar, mudah menguap, alkohol yang sering digunakan dalam kehidupan sehari-hari, etanol juga tidak berwarna. Sifat gugus hidroksil yang polar menyebabkan dapat larut dalam banyak senyawa ion, utamanya natrium hidroksida, kalium hidroksida, magnesium klorida, kalsium klorida, amonium klorida, amonium bromida, dan natrium bromida. Natrium klorida dan kalium klorida sedikit larut dalam etanol. Oleh karena itu, etanol juga memiliki rantai karbon nonpolar, ia juga larut dalam senyawa nonpolar, meliput kebanyakan minyak atsiri dan banyak perasa, pewarna, dan obat. Ikatan hidrogen menyebabkan etanol murni sangat higroskopis, sehingga akan menyerap air dari udara (Fessenden, 1997).
2.4 Asetat Anhidrat
Anhidrida asam asetat, (Nama IUPAC: etanoil etanoat) dan disingkat sebagai Ac2O, adalah salah satu anhidrida asam paling sederhana. Rumus kimianya adalah
(CH3CO)2O. Senyawa ini merupakan reagen penting dalam sintesis organik. Senyawa ini
tidak berwarna, dan berbaucuka karena reaksinya dengan kelembapan di udara membentuk asam asetat.
Anhidrida asetat mengalami hidrolisis pada suhu kamar, membentuk asam asetat. Ini adalah kebalikan dari reaksi kondensasi pembentukan anhidrida asetat
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
Selain itu, senyawa ini juga bereaksi dengan alkohol membentuk sebuah ester dan asam asetat. Contohnya reaksi dengan etanol membentuk etil asetat dan asam asetat.
(CH3CO)2O + CH3CH2OH → CH3COOCH2CH3 + CH3COOH (13)
Anhidrida asetat merupakan senyawa korosif, iritan, dan mudah terbakar. Untuk memadamkan api yang disebabkan anhidrida asetat jangan menggunakan air, karena sifatnya yang reaktif terhadap air. Karbon dioksida adalah pemadam yang disarankan.
2.5 Reaksi dan Mekanisme Asetanilida
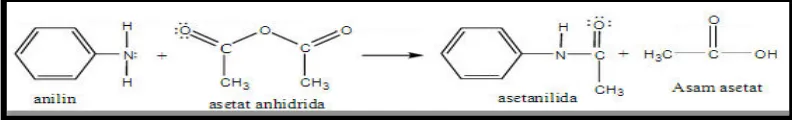
Gambar 2.3 dibawah ini adalah gambar pembuatan asetanilida,yang mana mula-mula anilin bereaksi dengan asetat anhidrat membentuk suatu amida yaitu asetanilida dan asam asetat.
Gambar 2.3 Reaksi Pembentukan Asetanilida (Austin, 2008)
Cincin aromatik dari anilin C6H5NH2, sangat kaya dengan elektron. Pasangan
elektron sunyi dari N, bisa melakukan delokalisasi dengan sistem π dari inti benzen.
Akibatnya anilin sangat mudah mengalami reaksi substitusi elektrofilik. Interkonversi gugus fungsi amina jadi amida dapat dilakukan dengan mereaksikan amina dengan asetat anhidrat, suatu senyawa turunan asam karboksilat. Anilin, suatu amina primer aromatik mengalami interkonversi gugus fungsi jadi asetanilida, suatu zat antipiretik (zat penurun panas), dengan asetat anhidrat.
Beberapa pembuatan asetanilida yaitu:
1. Pembuatan asetanilida dari asetat anhidrat dan anilin
C6H5NH2 + (CH2CO)2O C6H5NHCOCH3 + CH3COOH (14)
Reaksi Asilasi “ Pembuatan Asetanilida”
2. Pembuatan asetanilida dari asam asetat dan anilin
Metode ini merupakan metode awal yang masih digunakan. Karena anilin dan asam asetat berlebih 100% direaksikan dalam sebuah tangki yang dilengkapi dengan pengaduk (Kirk dan Othmer, 1981).
C6H5NH2 + CH3COOH C6H5NHCOCH3 + H2O (15)
Reaksi berlangsung selama 6 jam pada suhu 150oC – 160oC. Produk dalam keadaan panas rekristalisasi dengan menggunakan kristalizer.
1. Pembuatan asetanilida dari keten dan anilin
Keten (gas) dicampur kedalam anilin di bawah kondisi yang diperkenankan akan menghasilkan asetanilida.
C6H5NH2 + H2C=C=O C6H5NHCOCH3 (16)
2. Pembuatan asetanilida dari asam thioasetat dan anilin
Asam thioasetat direaksikan dengan anilin dalam keadaan dingin akan menghasilkan asetanilida dengan membebaskan H2S.
C6H5NH2 + CH3COSH C6H5NHCOCH3 + H2S (17)
Dalam percobaan asetanilida ini digunakan proses antaraasetat anhidrat dengan anilin.
2.5.1 Kegunaan Produk Asetanilida
Asetanilida banyak digunakan dalam industri kimia, antara lain :
a. Sebagai bahan baku pembuatan obat-obatan seperti parasetamol (keperluan analgesik dan antipretik), lidokain (keperluan anestesi).
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
2.6 Reaksi Asilasi
2.6.1 Pengertian Asilasi
Sebuah asil merupakan alkil yang terikat pada ikatan rangkap oksigen dan karbon. Jika R mewakili alkil, maka asil mempunyai formula.
Gambar 2.4 Gugus asil
Asil yang umum dipakai adalah CH3CO-. Ini disebut sebagai
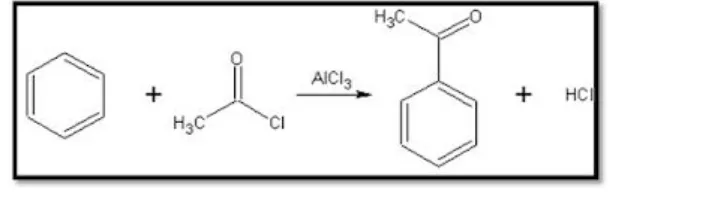
etanoil.Dalam kimia, asilasi (secara formal, namun jarang digunakan alkanoilasi) adalah proses adisi gugus asil ke sebuah senyawa. Senyawa yang menyediakan gugus asil disebut sebagaiagen pengasil.Asil halida sering digunakan sebagai agen pengasil karena dapat membentuk elektrofil yang kuat ketika diberikan beberapa logam katalis. Sebagai contoh pada asilasi Friedel-Crafts menggunakan asetil klorida, CH3COCl, sebagai agen
dan aluminium klorida (AlCl3) sebagai katalis untuk adisi gugus asetil ke benzena.
Gambar 2.5 Contoh reaksi asilasi
Reaksi Asilasi “ Pembuatan Asetanilida”
suksinasi terjadi ketika lebih dari satu suksinat diadisi ke sebuah senyawa tunggal. Contoh industri asilasi adalah sintesis aspirin, di mana asam salisilat diasilasi oleh asetat anhidrida.
2.7 Rekristalisasi
Rekristalisasi merupakan salah satu cara pemurnian zat padat dimana zat-zat tersebut tersebut dilarutkan dalam suatu pelarut kemudian dikristalkan kembali. Cara ini bergantung pada kelarutan zat dalam pelarut tertentu di kala suhu diperbesar. Konsentrasi total impuriti biasanya lebih kecil dari konsentrasi zat yang dimurnikan, bila dingin, maka konsentrasi impuriti yang rendah tetapi dalam larutan sementara produk yang berkonsentrasi tinggi akan mengendap (pinalla,2011).
Rekristalisasi merupakan metode yang sangat penting untuk pemurnian komponen larutan organik. Ada tujuh metode dalam rekristalisasi yaitu: memilih pelarut, melarutkan zat terlarut, menghilangkan warna larutan, memindahkan zat padat, mengkristalkan larutan, mengumpul dan mencuci kristal, serta mengeringkan produknya (hasil) (pinalla,2011).
Kristal adalah benda padat yang mempunyai permukaan-permukaan datar.Banyak zat padat seperti garam, kuarsa, dan salju ada dalam bentuk-bentuk yang jelas simetris, telah lama para ilmuwan menduga bahwa atom, ion ataupun molekul zat padat ini juga tersusun secara simetris. Penampilan luar suatu partikel kristal besar tidak menentukan penataan partikel. Bila suatu zat dalam keadaan cair atau larutan mengkristal, kristal dapat terbentuk dengan tumbuh lebih ke satu arah daripada ke lain arah. Kristal-kristal itu akan turun keluar dari larutan yang berfungsi membantu penyaringan (pinalla,2011).
2.8 Penyaringan
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
2.9 Perhitungan kadar air dan rendemen
Pengukuran kadar air dalam suatu bahan sangat diperlukan dalam berbagai bidang. Salah satu bidang yang memerlukan pengukuran kadar air adalah bidang industri bahan kimia. Prinsip dari metode oven pengering adalah bahwa air yang terkandung dalam suatu bahan akan menguap bila bahan tersebut dipanaskan pada suhu 105oC selama waktu tertentu. Perbedaan antara berat sebelum dan sesudah dipanaskan adalah kadar air(Fessenden,1989).
Kadar air dalam makanan dapat ditentukan dengan berbagai cara: 1. Metode Pengeringan (Thermogravimetri)
Prinsipnya menguapkan air yang ada dalam bahan dengan jalan pemanasan.Kemudian menimbang bahan sampai berat konstan berarti semua air sudah diuapkan.Cara ini relatif mudah dan murah. Kelemahannya antara lain:
a) Bahan lain di samping air juga ikut menguap dan ikut hilang bersama dengan uap misalnya alkohol, asam asetat, minyak atsiri, dan lain-lain.
b) Dapat terjadi reaksi selama pemanasan yang menghasilkan air atau zat mudah menguap lain. Contoh gula mengalami dekomposisi atau karamelisasi, lemak mengalami oksidasi dan sebagainya.
c) Bahan yang mengandung bahan yang dapat mengikat air secara kuat sulit melepaskan airnya meskipun sudah dipanaskan.
2. Metode Destilasi (Thermovolumetri)
Prinsip penentuan kadar air dengan destilasi adalah menguapkan air dengan“pembawa” cairan kimia yang mempunyai titik didih lebih tinggi daripada air dan tidak dapat campur dengan air serta mempunyai berat jenis lebih rendah daripada air. Zat kimia yang dapat digunakan antara lain: toluen, xylen, benzen, tetrakhlorethilen dan xylol.
Reaksi Asilasi “ Pembuatan Asetanilida”
Penentuan kadar air dengan cara pemanasan yang dimaksud disini adalah pengeringan sample dengan menggunakan oven (pemanas). Metode penentuan kadar air dengan cara pemanasan ini adalah yang paling sering dilakukan dan paling sederhana.
Berat awal - Berat akhir X 100% = % Kadar Air
Berat awal
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
BAB IIIMETODOLOGI PERCOBAAN
3.1 Alat alat percobaan
1. Pompa vacum 2. Erlenmeyer vacum
3. Gelas ukur (50 ml & 250 ml) 4. Baskom
5. Labu didih dasar bulat 6. Penangas air
7. Kertas saring 8. Corong bucher
9. Termometer
10. Timbanagan analitik 11. Pipet tetes 3 buah 12. Oven
3.2 Bahan bahan percobaan
1.
Asam asetat anhidrat
2.
Asam asetat glacial
3.
Anilin
4.
Alkohol
5.
Aquades
Reaksi Asilasi “ Pembuatan Asetanilida”
3.3 Metodologi percobaan
3.3.1
Perlakuan 1
1.
Di ambil labu didih dasar bulat lalu campurkan 4,5 ml asam asetat
anhidrat kemudian ditambahkan 2,5ml anilin, setelah itu ditambahkan
4ml asam asetat glacial. Pencampuran dilakukan di dalam lemari asam
dikarenakan reaksi terjadi eksoterm.
2.
Setelah itu,aduk dan lakukan penyetaraan suhu kamar selama 5 menit
3.
Setelah itu encerkan larutan dengan 75ml
aquades
, sehingga terbentuk
kristal asetanilida.
4.
Kemudian timbang kertas saring.
5.
Apabila kristal sudah terbentuk sempurna, saring kristal dengan
pompa vakum.
6.
Setelah itu keringkan kristal dan pisahkan kristal dengan zat pengotor.
7.
Lalu
rekristalisasi
pada
kristal
asetanilida
dengan
25ml
alkohol(etanol) dan 25ml air panas.
8.
Setelah itu larutkan pengotor dengan 25ml air panas.
9.
Setelah itu campurkan pengotor dan kristal hingga homogen.
10.
Setelah itu dinginkan selama 120 menit hingga kristal terbentuk.
11.
Keringkan kristal dengan pompa vakum dan oven kristal yang didapat
selama 10 menit dan hitung berat kristal.
12.
Setelah itu hitumg
yield
dan kadar air.
3.3.2 Perlakuan 2
1.
Tambahakn 6ml anilin dan 8ml asam asetat glasial dan batu didih
dalam labu didih dasar bulat. Pencampuran dilakukan dalam lemari
asam karna reaksi eksoterm.
2.
Lalu di panasakan dengan penangas air selama 45 menit dan di aduk
perlahan lahan.
3.
Setelah itu tuangkan larutan ke gelas 250ml, lalu letak di wadah es
selama 1,5 jam
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
5.
Setelah itu saring kristal dengan pompa vakum. Bila kristal masih
kotor lakukan rekristalisasi dengan 150ml
aquadest
dan tambahakan
karbon aktif dan panaskan setelah itu saring dengan cepat
6.
Kemudain di tuang kedalam gelas beker, diniginkan dan saring kristal
dengan pompa vakum
7.
Dilakukan pengovenan selama selama 5-10 menit dengan 50-60
derajat celcius
8.
Kemudian timbang hasil
9.
Setelah itu hitumg
yield
dan kadar air
3.4 Rangkaian Alat
Gambar 3.1 Rangkaian alat vakum
Keterangan:
1. Selang pembuangan gas 2. Pompa vakum
3. Erlenmeyer 4. Saklar
Reaksi Asilasi “ Pembuatan Asetanilida”
BAB IVHASIL DAN PEMBAHASAN
Pada percobaan pembuatan asetanilida kami melakukan dalam 2 perlakuan. Pada perlakuan pertama dengan mencampurkan 4,5 ml asetat anhidrat ,4 ml anilin dan 2,4 ml asam asetat glasial. Kemudian campuran diaduk sempurna hingga campuran homogen dan didiamkan dalam suhu kamar selama 5 menit. Selanjutnya larutan diencerkan dengan menambahkan 75 ml aquades hingga terbentuk kristal asetanilida namun, setelah ditunggu beberapa menit tidak terbentuk kristal. Hal ini dikarenakan larutan tidak dipananskan sehingga reaksi cenderung berlangsung lama.
Praktikum Kimia Organik/Kelompok II/S.Genap/2017-2018
Reaksi Asilasi “ Pembuatan Asetanilida”
BAB VPENUTUP
5.1 Kesimpulan
Kesimpulan dari pratikum Reaksi Asilasi “PembuatanAsetanilida” adalah:
1. Reaksi asilasi merupakan suatu reaksi memasukkan gugus asil kedalam suatu substrat yang sesuai. Dalam percobaan ini gugus asil adalah gugus asetat dari asetat glasial (CH3COOH) dan substratnya yaitu anilin (C6H5NH2) dan hasil samping air
(H2O).
2. Asetanilida dapat dibuat dengan cara mereaksikan senyawa anilin dan asam asetat glasial dengan konsentrasi tertentu, dimana proses selanjutnya yaitu penambahan pelarut yang sesuai, pendinginan pada suhu kamar, rekristalisasi, serta pengovenan kristal asetanilida yang telah terbentuk.
5.2 Saran
Saran untuk pratikan saat melakukan pratikum Reaksi Asilasi “Pembuatan Asetanilida” adalah:
1. Proses pencampuran sebaiknya dilakukan dalam lemari asam karena reaksi bersifat eksoterm.
2. Jangan sampai lupa untuk melakukan pemanasan sebelum melakukan kristalisasi, karena jika tidak kristal asetanilida tidak akan terbentuk.
3. Jaga suhu saat pemanasan agar tetap konstan sehingga reaksi dapat berlangsung sempurna
4. Berhati-hatilah saat praktikum berlangsung dan gunakan selalu alat pelindung diri seperi sarung tangan dan masker.