i SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperolah Gelar Sarjana Farmasi (S. Farm)
Progrram Studi Ilmu Farmasi
Oleh:
Yohanes Pungki Prabowo NIM : 068114070
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperolah Gelar Sarjana Farmasi (S. Farm)
Progrram Studi Ilmu Farmasi
Oleh:
Yohanes Pungki Prabowo NIM : 068114070
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
Tak ada kata menyerah,
selama ada Dia yang selalu
menyertai kita.
Aku persembahkan karyaku ini kepada:
Bapak dan Ibu yang selalu mencintaiku dan menyayangiku,
simbah kakung dan putri yang mendukungku,
adik-adikku (Irma, Tito, dan Wawan) yang kusayangi,
vii
dan Ibuprofen dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik” dapat dikerjakan dengan sebaik-baiknya. Skripsi ini disusun untuk memenuhi salah satu persyaratan untuk memperoleh gelar Sarjana Strata Satu Program Studi Ilmu Farmasi (S. Farm).
Dalam menyelesaikan skripsi ini, penulis mengalami permasalahan dan kesulitan. Namun demikian dengan adanya bantuan dari berbagai pihak, penulis dapat menyelesaikan skripsi ini dengan baik. Oleh karena itu dengan segala hormat, penulis ingin mengucapkan terima kasih atas bantuan yang telah diberikan, kepada :
1. Rita Suhadi, M. Si., Apt, selaku dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
2. Jeffry Julianus, M.Si. selaku dosen pembimbing yang telah membimbing penulis, memberikan masukan, dan dukungan selama penyusunan skripsi ini. 3. Christine Patramurti, M.Si., Apt. selaku penguji yang ikut mengarahkan
penulis, memberikan masukan, dan memberikan dukungan selama penyusunan skripsi serta besedia menguji skripsi ini.
4. Dra. MM. Yetty Tjandrawati,M.Si. selaku dosen penguji yang memberikan kritik dan saran untuk skripsi ini.
viii
7. Micell dan Angel serta Aan, Yoki, Boim, dan Toni yang telah berjuang bersama dalam menganalisis ibuprofen dan parasetamol.
8. Jimmy, Anton, Jati, dan kos Progresif yang telah bersama-sama dalam memberikan dukungan bagi penulis.
9. Teman-teman seperjuangan yang tidak dapat saya sebutkan satu persatu namanya.
Penulis menyadari bahwa dalam skripsi ini masih terdapat banyak kekurangan mengingat keterbatasan kamampuan dan pengetahuan penulis. Maka penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir kata, semoga skripsi ini berguna bagi kemajuan ilmu pengetahuan.
x
Dewasa ini telah banyak digunakan kombinasi zat aktif dalam suatu obat untuk memperoleh efek yang diharapkan. Salah satu kombinasi yang dapat dijumpai di pasaran adalah parasetamol dan ibuprofen sebagai obat antiinflamasi. Penetapan kadar campuran tersebut dilakukan dengan Kromatografi Cair Kinerja Tinggi (KCKT) namun digunakan fase gerak asetonitril. Dalam penelitian ini akan dicoba pemisahan campuran parasetamol dan ibuprofen dengan metode KCKT dengan fase gerak campuran metanol : aquabidest.
Penelitian ini merupakan penelitian non eksperimental deskriptif dengan metode KCKT fase terbalik menggunakan kolom C18, fase gerak metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial, kecepatan alir 1,5 ml/menit, dan detektor Ultraviolet pada panjang gelombang 230 nm.
Hasil penelitian ini menunjukkan campuran parasetamol dan ibuprofen dapat dipisahkan dengan metode KCKT fase terbalik. Kondisi optimal sistem KCKT yang diperoleh adalah fase gerak metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial dan kecepatan alir 1,5 ml/menit; detektor UV pada panjang gelombang pengamatan 230 nm.
xi
Today has been widely used combinations of active substances in a drug to obtain the desired effect. One of the combinations that can be found in the market are paracetamol and ibuprofen as an anti-inflammatory drugs. Determination of levels of the mixture before, with High Performance Liquid Chromatography (HPLC) but used acetonitrile mobile phase. In this study, tried separation mixture of paracetamol and ibuprofen with HPLC method with the mobile phase of methanol-aquabidest.
This study is a non-experimental descriptive research method used HPLC reversed phase C18 column, mobile phase with methanol: aquabidest (90:10) pH 4 by adding glacial acetic acid, flow rate 1.5 ml / min, and Ultraviolet detector at wavelength 230 nm.
The results of this study showed a mixture of paracetamol and ibuprofen may be separated by HPLC methods reversed phase. Optimal conditions obtained HPLC system is the mobile phase of methanol: aquabidest (90:10) pH 4 by adding glacial acetic acid and flow rate 1.5 ml / min; UV detector at wavelength 230 nm observations.
xii
HALAMAN JUDUL ii
HALAMAN PERSETUJUAN PEMBIMBING iii
HALAMAN PENGESAHAN iv
HALAMAN PERSEMBAHAN v
PERNYATAAN PERSETUJUAN PUBLIKASI vi
PRAKATA vii
PERNYATAAN KEASLIAN KARYA ix
INTISARI x
BAB I. PENGANTAR 1
A. Latar Belakang 1
1. Permasalahan 3
2. Keaslian Penelitian 3
3. Manfaat Penelitian 4
xiii
C. Ibuprofen 8
D. Spektrofotometri UV 9
E. Kromatografi Cair Kinerja Tinggi 10
1. Definisi dan Instrumentasi 10
2. Kromatografi Partisi 15
3. Pemisahan yang Optimal dalam Kromatografi 17
F. Landasan Teori 24
G. Hipotesis 26
BAB III. METODE PENELITIAN 27
A. Jenis dan Rancangan Penelitian 27
B. Variabel 27
C. Definisi Operasional 28
D. Bahan Penelitian 28
E. Alat Penelitian 28
F. Tata Cara Penelitian 29
1. Pembuatan Fase Gerak 29
2. Pembuatan Larutan Baku Parasetamol dan Ibuprofen untuk
Spektrofotometri 30
3. Pembuatan Larutan Baku Parasetamol dan Ibuprofen untuk
xiv
Campuran Parasetamol dan Ibuprofen dengan Perbandingan
7:4 dengan KCKT Fase Terbalik 32
BAB IV. HASIL DAN PEMBAHASAN 35
A. Pembuatan Fase Gerak 35
B. Pembuatan Larutan Baku 36
C. Optimasi penentuan Panjang Gelombang Overlaping Parasetamol dan Ibuprofen dengan Spektrofotometer UV 38 D. Optimasi Pemisahan Parasetamol dan Ibuprofen dengan KCKT
Fase Terbalik 44
1. Fase Gerak Metanol : Aquabidest dengan Perbandingan 70:30
dengan Kecepatan Alir 1 ml/menit 49
2. Fase Gerak Metanol : Aquabidest dengan Perbandingan 70:30 pH 4 dengan Penambahan Asam Asetat Glasial pada
Kecepatan Alir 1,5 ml/menit 52
3. Fase Gerak Metanol : Aquabidest dengan Perbandingan 70:30 pH 4 dengan Penambahan Asam Asetat Glasial pada
Kecepatan Alir 2 ml/menit 55
4. Fase Gerak Metanol : Aquabidest dengan Perbandingan 90:10 pH 4 dengan Penambahan Asam Asetat Glasial pada
xv
BAB V. KESIMPULAN DAN SARAN 65
A. Kesimpulan 65
B. Saran 65
DAFTAR PUSTAKA 66
LAMPIRAN 69
xvi
Tabel 1. Nilai Indeks Polaritas Pelarut 13
xvii
Gambar 1. Struktur Parasetamol 7
Gambar 2. Struktur Ibuprofen 8
Gambar 3. Peralatan KCKT 11
Gambar 4. Mekanisme Pemisahan Kromatografi Partisi 15
Gambar 5. Reaksi Silanisasi 16
Gambar 6. Reaksi Pembuatan Kolom Oktadesilsilan 17
Gambar 7. Difusi Eddy 19
Gambar 8. Transfer Massa Fase Diam 20
Gambar 9. Transfer Massa Fase Gerak 21
Gambar 10. Pemisahan Dua Senyawa 22
Gambar 11. PenentuanPeak AsymetrydanPeak Tailing Factors 23 Gambar 12. Distribusi Analit dalam Fase Gerak dan Fase Diam 23 Gambar 13. Reaksi Kolom Oktadesilsilan dengan Asam Asetat 36 Gambar 14. Gugus Kromofor dan Auksokrom pada Parasetamol dan
Ibuprofen 39
Gambar 15. Spektrum Serapan Parasetamol dengan λmaks= 243,5 nm 41 Gambar 16. Spektrum Serapan Ibuprofen dengan λmaks= 223 nm 42 Gambar 17. Spektrum Serapan Gabungan Parasetamol (A) Konsentrasi
1,05 mg/100 ml dan Ibuprofen (B) Konsentrasi 0,6 mg/100
ml 43
xviii
Gambar 21. Interaksi Ibuprofen dengan Fase Diam 47 Gambar 22. Interaksi Parasetamol dengan Fase Diam 48 Gambar 23. Pemisahan dari Campuran Parasetamol (A) dan Ibuprofen (B)
dengan Fase Gerak Metanol : Aquabidest (70:30) Kecepatan
Alir 1 ml/menit 50
Gambar 24. Reaksi Ionisasi Ibuprofen 51
Gambar 25. Pemisahan dari Campuran Parasetamol (A) dan Ibuprofen (B) dengan Fase Gerak Metanol : Aquabidest (70:30) pH 4
Kecepatan Alir 1,5 ml/menit 54
Gambar 26. Pemisahan dari Campuran Parasetamol (A) dan Ibuprofen (B) dengan Fase Gerak Metanol : Aquabidest (70:30) pH 4
Kecepatan Alir 2 ml/menit 56
Gambar 27. Pemisahan dari Campuran Parasetamol (A) konsentrasi 175 ppm dan Ibuprofen (B) konsentrasi 100 ppm dengan Fase Gerak Metanol : Aquabidest (90:10) pH 4 Kecepatan Alir 1
ml/menit 58
Gambar 28. Pemisahan dari Campuran Parasetamol (A) dan Ibuprofen (B) dengan Fase Gerak Metanol : Aquabidest (90:10) pH 4
xix
Lampiran 2. Sertifikat Analisis Ibuprofen 71
Lampiran 3. Data Penimbangan Bahan 72
Lampiran 4. Spektra panjang gelombang maksimum parasetamol 73 Lampiran 5. Spektra panjang gelombang maksimum ibuprofen 75 Lampiran 6. Spektra panjang gelombangoverlaping 77 Lampiran 7. Perhitungan kepolaran fase gerak 78 Lampiran 8. Kromatogram pada fase gerak metanol : aquabidest (70:30)
pada kecepatan alir 1 ml/menit 79
Lampiran 9. Kromatogram pada fase gerak metanol : aquabidest (70:30) pH 4 dengan penambahan asam asetat glasial pada
kecepatan alir 1,5 ml/menit 82
Lampiran 10. Kromatogram pada fase gerak metanol : aquabidest (70:30) pH 4 dengan penambahan asam asetat glasial pada
kecepatan alir 2 ml/menit 84
Lampiran 11. Kromatogram pada fase gerak metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial pada
kecepatan alir 1 ml/menit 86
Lampiran 12. Kromatogram pada fase gerak metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial pada
1
A. Latar Belakang
Parasetamol dan ibuprofen merupakan obat analgesik yang telah umum digunakan. Saat ini telah dikembangkan obat dengan komposisi campuran parasetamol dan ibuprofen. Perlu dilakukan penentuan kadar dari senyawa tersebut dalam suatu obat. Hal ini dilakukan sebab dalam membuat suatu obat digunakan aturan dosis tertentu. Dosis merupakan hal yang penting dalam obat. Bila kadar parasetamol dan ibuprofen dalam obat kurang dari dosis maka obat tersebut tidak akan memberikan efek terapi atau sebaliknya bila kadarnya melebihi dosis yang seharusnya dapat menyebabkan terjadinya overdosis yang nantinya membahayakan pasien. Farmakope Indonesia Edisi IV (1995) menyebutkan batasan rentang kadar zat aktif yang diperbolehkan dari suatu bentuk sediaan.
Spektrofotometri UV, dan metode KCKT (Kromatografi Cair Kinerja Tinggi) fase terbalik. Dalam penelitian ini dipilih analisis dengan metode KCKT fase terbalik karena metode KCKT merupakan metode analisis kualitatif dan kuantitatif yang dapat digunakan untuk analisis senyawa multikomponen dalam sampel yang berupa campuran (Johnson dan Stevenson, 1978).
Sebelum dilakukan penetapan kadar dari sampel, perlu dilakukan optimasi untuk mengetahui sistem yang optimal untuk penetapan kadar parasetamol dan ibuprofen dalam tablet. Kondisi sistem KCKT yang optimal perlu dicari agar diperoleh hasil pemisahan yang baik dari campuran parasetamol dan ibuprofen. Kondisi optimal dapat diperoleh dengan optimasi fase gerak dan kecepatan alir yang digunakan dalam sistem KCKT. Optimasi fase gerak dalam hal ini adalah optimasi komposisi dari fase gerak tersebut. Fase gerak yang digunakan adalah campuran metanol dengan aquabidest. Pemilihan campuran ini sebagai fase gerak karena belum ada penelitian yang melakukan pemisahan campuran parasetamol dan ibuprofen dengan fase gerak tersebut.
dapat dipisahkan dengan fase gerak campuran air-asetonitril-asam fosfat (1340:680:1).
Kondisi yang optimal ditentukan dari nilai resolusi pemisahan antara parasetamol dan ibuprofen serta nilai waktu retensi (tR) yang tidak terlalu lama. Nilai resolusi (R) yang optimal adalah ≥ 1,5 (Sastrohamidjojo, 2002). Namun, sebisa mungkin jarak pemisahan juga tidak terlalu jauh dan waktu retensi campuran tidak terlalu lama sehingga penggunaan fase gerak untuk pemisahan lebih efisien.
Sistem KCKT fase terbalik yang optimal digunakan untuk validasi metode dan penetapan kadar campuran parasetamol dan ibuprofen dalam tablet merk “X” yang terdapat di pasaran.
1. Permasalahan
a. Apakah campuran parasetamol dan ibuprofen dapat dipisahkan dengan fase gerak metanol : aquabidest?
b. Bagaimana kondisi optimal dari sistem Kromatografi Cair Kinerja Tinggi untuk pemisahan campuran parasetamol dan ibuprofen terkait komposisi fase gerak dan kecepatan alirnya?
2. Keaslian Penelitian
Oktadesilsilan (kolom C18) dan fase gerak asetonitril : bufer fosfat (60:40, v/v, pH 7,0) pada kecepatan alir 0,8 ml/menit dengan detektor Ultraviolet pada 260 nm (Prasanna Reddy Battu dan MS Reddy, 2009). Asetonitril memiliki sifat kepolaran yang mirip dengan metanol sehingga dalam penelitian ini akan dilakukan optimasi metode KCKT fase terbalik untuk pemisahan campuran parasetamol dan ibuprofen dengan fase gerak metanol : aquabidest.
3. Manfaat Penelitian
Penelitian ini memberikan manfaat:
1. Manfaat teoritis: diharapkan penelitian ini dapat memberikan sumbangan untuk ilmu pengetahuan tentang KCKT dalam pemisahan campuran parasetamol dan ibuprofen.
2. Manfaat metodologis: diharapkan penelitian ini dapat digunakan sebagai dasar untuk melakukan analisis kuantitatif campuran parasetamol dan ibuprofen.
B. Tujuan Penelitian Tujuan dilakukannya penelitian ini.
1. Untuk melakukan pemisahan campuran parasetamol dan ibuprofen dengan fase gerak metanol : aquabidest dengan metode KCKT.
6 A. Tablet
Tablet adalah suatu sediaan padat mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatannya, tablet dapat digolongkan tablet kempa dan tablet cetak. Tablet kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja. Tablet cetak dibuat dengan cara menekan massa serbuk lembab dengan tekanan rendah ke dalam lubang cetakan (Anonim, 1995). Keuntungan dari tablet antara lain adalah relatif murah dan relatif mudah digunakan pada masyarakat (Voight, 1984).
Tablet merupakan bentuk sediaan yang banyak digunakan saat ini. Kebanyakan tablet digunakan dengan pemberian secara oral, dan kebanyakan ditambahkan zat warna, zat pemberi rasa, dan lapisan-lapisan dalam berbagai jenis. Tablet juga dapat digunakan secara sublingual, bukal, atau melalui vaginal. Tablet dapat berbeda-beda dalam bentuk, ukuran, berat, kekerasan, ketebalan, dan waktu hancur tergantung cara pemakaian dan pembuatannya (Ansel, 1985).
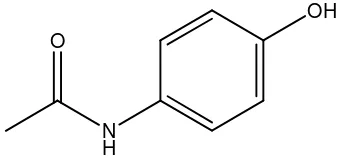
B. Parasetamol
Parasetamol dengan nama lain asetaminofen atau 4’- hidroksiasetanilida dengan rumus molekul C8H9NO2 memiliki bobot molekul 151,6 gram/mol (Anonim, 1995). Rumus bangun parasetamol digambarkan sebagai berikut seperti gambar 1.
O
N H
OH
Gambar 1. Struktur Parasetamol
Parasetamol mengandung tidak kurang dari 98,0% dan tidak lebih dari 101,0% C8H9NO2, dihitung terhadap zat anhidrat. Parasetamol merupakan serbuk hablur putih, tidak berbau, dan berasa sedikit pahit (Anonim, 1995). Satu bagian parasetamol larut dalam 70 bagian air, 7-10 bagian etanol dan 13 bagian aseton, agak sukar larut dalam kloroform, praktis tidak larut dalam eter (Clarke, 1986).
Parasetamol diindikasikan untuk sakit kepala, nyeri muskuloskeletal sementara, dismenore dan demam. Parasetamol tidak memiliki aktivitas antinflamasi yang berarti dan kurang mengiritasi lambung dibandingkan dengan asetosal (Anonim, 2000).
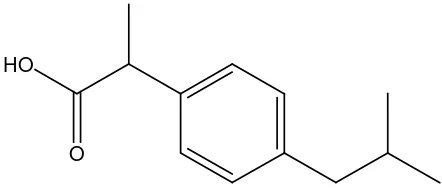
C. Ibuprofen
Ibuprofen dengan nama lain (R,S)-2-(-p-Isobutilfenil)asam propionat memilki rumus molekul C13H18O2 dan berbobot molekul 206,28 gram/mol (Anonim, 1995). Rumus bangun ibuprofen digambarkan seperti tampak pada gambar 2.
O HO
Gambar 2. Struktur Ibuprofen
Ibuprofen mengandung tidak kurang dari 97,0% dan tidak lebih dari 103,0% C13H18O2dihitung terhadap zat anhidrat. Ibuprofen berupa serbuk hablur, putih hingga hampir putih; berbau khas lemah. Ibuprofen praktis tidak larut dalam air, sangat mudah larut dalam etanol, dalam metanol, dalam aseton dan dalam kloroform. Ibuprofen sukar larut dalam etil asetat (Anonim, 1995).
D. Spektrofotometri UV
Teknik spektroskopik merupakan salah satu teknik analisis fisiko-kimia yang mengamati interaksi atom atau molekul dengan suatu radiasi elektromagnetik (REM). Spektrofotometri ultraviolet adalah anggota teknik analisis spektroskopik yang menggunakan sumber radiasi elektromagnetik ultraviolet dekat (190-380 nm) dengan menggunakan instrument spektrofotometer. Radiasi ultraviolet jauh (100-190 nm) tidak dipakai, sebab pada daerah tersebut REM diabsorpsi oleh udara (Mulja dan Suharman, 1995).
Molekul suatu senyawa dapat memberikan serapan radiasi elektromagnetik jika memiliki kromofor, yaitu gugus penyerap dalam molekul. Molekul yang mengandung kromofor disebut kromogen. Pada senyawa organik dikenal pula gugus auksokrom, yaitu gugus yang tidak menyerap radiasi namun bila terikat bersama kromofor dapat meningkatkan penyerapan oleh kromofor atau mengubah panjang gelombang serapan maksimum (Christian, 2004).
terhadap intensitas radiasi atau konsentrasi zat yang dianalisis dan tebal larutan yang mengabsorbsi sebagai:
(1)
(2) Keterangan : T = persen transmitan
Io= intensitas radiasi yang datang It= intesitas radiasi yang diteruskan
= daya serap molar (Liter.mol-1.cm-1) c = konsentrasi (mol/Liter)
b = tebal larutan (cm)
A = serapan (Mulja dan Suharman, 1995)
Ikatan konjugasi merupakan ikatan rangkap yang berselang-seling dengan satu ikatan tunggal. Dalam orbital molekul, elektron pada orbital p mengalami delokalisasi lanjut dengan adanya ikatan terkonjugasi. Adanya efek delokalosasi ini akan menyebabkan penurunan tingkat energi π*dan memberikan pengurangan karakter antiikatan. Sebagai konsekuensinya, panjang gelombang molekul yang mempunyai ikatan rangkap terkonjugasi akan mengalami pergeseran batokromik (Rohman dan Gandjar, 2007).
E. Kromatografi Cair Kinerja Tinggi 1. Definisi dan Instrumentasi
distribusi masing-masing senyawa di antara dua fase yang saling bersinggungan dan tidak saling campur, yang disebut sebagai fase gerak (mobile phase) yang berupa zat cair atau zat gas, dan fase diam (stationary phase) yang berupa zat cair atau zat padat (Noegrohati, 1994). Kromatografi bertujuan memisahkan komponen dari matriks sampel dan tetap dibiarkan dalam fase diam kemudian ditentukan untuk analisis (Mulja dan Suharman, 1995)
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu metode kromatografi cair yang fase geraknya dialirkan secara cepat dengan bantuan tekanan dan hasilnya dideteksi dengan instrument. KCKT memiliki fase diam yang lebih banyak jenisnya sehingga memungkinkan lebih banyak interaksi spesifik untuk terjadinya pemisahan senyawa (Willard, Merrit, Dean, dan Settle, 1988). Tujuan dari KCKT adalah memperoleh hasil pemisahan yang baik dalam waktu relatif singkat (Mulja dan Suharman, 1995). Berikut komponen-komponen dalam KCKT pada gambar 2.
Variabel-variabel yang harus diperhatikan dalam KCKT adalah
a. Fase gerak. Fase gerak pada KCKT sangat berpengaruh terhadap tambatan dan pemisahan senyawa (Munson, 1984). Fase gerak untuk analisis secara KCKT harus murni untuk mencegah adanya peak pengganggu yang dapat tumpang tindih dengan peak analit, tidak bereaksi atau mempengaruhi kolom, dapat melarutkan analit, memiliki titik didih 20-50o C di atas temperatur kolom, viskositasnya rendah (tidak lebih dari 50 cP) dan memungkinkan untuk memperoleh kembali analit dengan mudah, tidak mudah terbakar dan toksisitasnya rendah, memiliki harga yang wajar (Skoog et al., 1985). Fase gerak KCKT juga harus bebas dari gas terlarut karena dapat mempengaruhi respon detektor sehingga memunculkan sinyal palsu dan akan mempengaruhi kolom (Gritter et al., 1985). Maka fase gerak perlu
di-degassinguntuk menghilangkan gas terlarut (Dean, 1995).
Komposisi fase gerak yang digunakan dapat mempengaruhi variasi retensi analit untuk pemisahan yang optimal. Sehingga fase gerak dapat disesuaikan komposisinya agar diperoleh kepolaran relatif yang mirip dengan sampel untuk memperoleh pemisahan yang optimal (Willardet al., 1988).
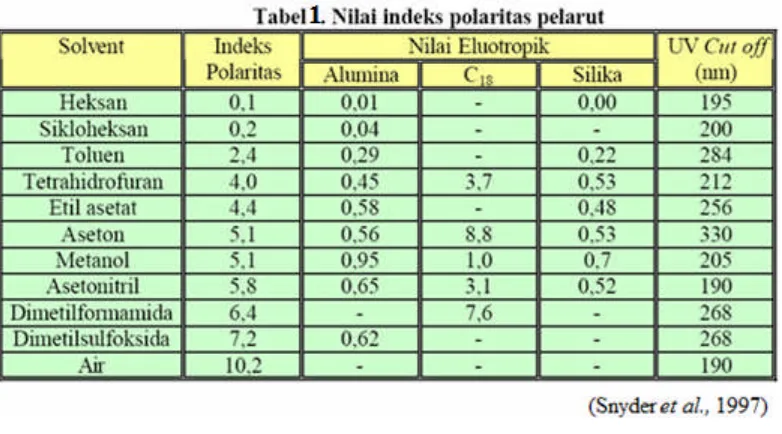
Kepolaran pelarut merupakan ukuran kekuatan pelarut untuk mengelusi suatu senyawa. Kepolaran pelarut dinyatakan dalam bentuk P’ (indeks polaritas). Besarnya polaritas campuran pelarut dapat dihitung dengan persamaan berikut.
dengan adalah fraksi pelarut dalam campuran dan n adalah jenis pelarut yang digunakan (Skooget al.,1988).
Tabel 1. berikut ini menampilkan indeks polaritas beberapa pelarut yang sering digunakan :
b. Fase diam. Fase diam dari KCKT berupa kolom kromatografi yang merupakan bagian penting karena pemisahan komponen-komponen sampel terjadi di dalam kolom. Keberhasilan pemisahan komponen-komponen sampel sangat bergantung pada keadaan kolom sehingga pemilihan kolom yang tepat sangatlah penting (Mulja dan Suharman, 1995).
dengan klorosilan Cl-Si-(R)n (Mulja dan Suharman, 1995). Oktadesil silika (ODS) merupakan fase diam yang paling banyak dipakai karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi (Rohman dan Gandjar, 2007).
c. Detektor. Detektor yang baik untuk KCKT memiliki kepekaan tinggi, rentang respon liniernya lebar, tidak dipengaruhi perubahan suhu dan aliran, memberikan hasil keterulangan yang baik, dan tidak banyak derau. Secara umum detektor dibagi menjadi 2 kategori, yaitu:
Bulk property detectors, merupakan detektor yang mengukur perubahan sifat fisik fase gerak dan solut. Detektor tipe ini cenderung relatif tidak sensitif dan menghendaki temperatur yang terkendali, contohnya detektor bias.
Solut property detectors, merupakan detektor yang hanya mengukur sifat fisik solut. Detektor tipe ini 1000 kali lebih sensitif dan mampu mengukursolut sampai satuan nanogram atau lebih kecil lagi. Contoh detektor jenis ini yaitu detektor fluorensensi, detektor penyerapan (UV-Vis) dan detektor elektrokimia (Munson, 1984).
2. Kromatografi partisi
Prinsip dasar kromatografi partisi pada partisi analit di antara dua fase yang tidak saling campur, karena adanya perbedaan koefisien distribusi dari masing-masing senyawa. Jika solut ditambahkan ke dalam sistem yang terdiri dari dua pelarut tidak saling campur dan keseluruhan sistem dibiarkan setimbang, maka solut akan tersebar di antara kedua fase menurut persamaan :
(4) K adalah koefisien distribusi, Csadalah konsentrasi solut dalam fase diam, dan Cmadalah konsentrasi solut dalam fase gerak (Johnson dan Stevenson, 1978). Mekanisme pemisahan pada kromatografi partisi dapat digambarkan sebagai berikut:
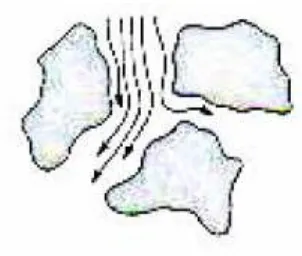
Gambar 4. Mekanisme pemisahan kromatografi partisi (Munson, 1984)
maka analit akan mengalami ionisasi. Terbentuknya spesies yang terionisasi ini menyebabkan ikatannya dengan fase diam menjadi lemah dibandingkan jika analit dalam bentuk spesies yang tidak terionisasi, karena spesies yang terionisasi akan terelusi lebih cepat (Rohman dan Gandjar, 2007).
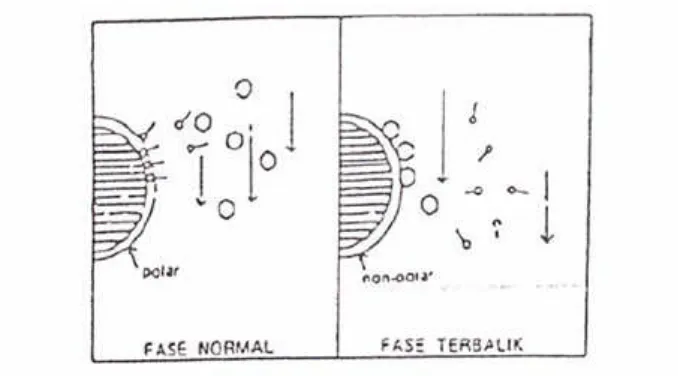
Kolom yang biasa digunakan dalam kromatografi partisi fase terbalik adalah kolom dengan kemasan fase terikat yang memiliki sifat stabil karena fase diamnya terikat secara kimia pada penyangga, sehingga tidak mudah terbawa oleh fase gerak. Penyangga pada kemasan fase terikat biasanya terbuat dari silika yang sudah diseragamkan, berpori, dan umumnya partikel mempunyai diameter 3,5 atau 10 µm (Skogget al.,1998).
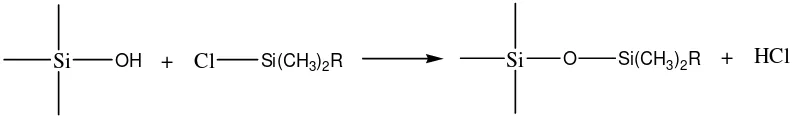
Kromatografi Cair Kinerja Tinggi partisi fase terbalik biasanya mengandung bagian organik yang terikat secara kimia dengan gugus silanol pada permukaan silika. Bagian organik tersebut umumnya hidrokarbon rantai panjang, sehingga fase gerak umumnya polar. Gugus silanol permukaan dapat direaksikan dengan berbagai cara menempelkan berbagai jenis gugus organik. Kolom dengan tipe ikatan siloksan (Si-O-Si-O) dibuat dengan mereaksikan organoklorosilan dengan gugus silanol pada permukaan silika gel sebagai berikut :
Si OH + Cl Si(CH3)2R Si O Si(CH3)2R + HCl
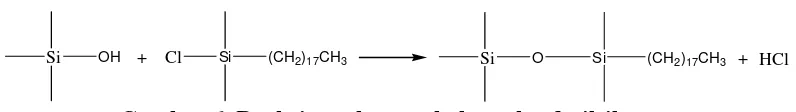
Reaksi tersebut digunakan untuk membuat isian kolom oktadesililan (ODS) gugus silanol dan oktadesilklorosilan sebagai berikut :
Si OH + Cl Si (CH2)17CH3 Si O Si (CH2)17CH3 + HCl
Gambar 6. Reaksi pembuatan kolom oktadesilsilan
Pada kromatografi partisi fase terbalik dengan kemasan fase terikat, R pada siloksan biasanya berupa gugus C18atau C8. Panjang pendeknya rantai karbon mempengaruhi tertambatnya senyawa pada fase diam (Skooget al.,1998).
3. Pemisahan yang optimal dalam kromatografi
a. Efisiensi kolom. Pemisahan dari puncak-puncak dalam kromatografi berhubungan dengan efisiensi kolom. Pada efisiensi kolom terdapat dua teori yang menjelaskan mengenai pemisahan puncak kromatografi, yaitu:
Teori lempeng menyatakan bahwa jumlah lempeng (N) yang didasarkan pada konsep lempeng teoritis pada distilasi kolom digunakan sebagai ukuran efisiensi kolom N didefinisikan sebagai berikut.
(5) Dimana merupakan lebar setengah puncak kromatogram, tR merupakan waktu retensi (Rohman dan Gandjar, 2007).
(HETP = Height Equivalint Theoritical Plate). Hubungan antara HETP dan jumlah lempeng (N) serta panjang kolom (L) dapat dirumuskan dengan:
(6) Kolom yang memberikan jumlah lempeng (N) yang besar dan nilai HETP yang kecil akan mampu memisahkan komponen-komponen dalam suatu campuran, yang berarti efisiensi kolom adalah besar (Rohman dan Gandjar, 2007)
Teori laju dapat menggambarkan pengaruh variabel-variabel lain yang menyebabkan terjadinya pelebaran peak. Pada waktu migrasi, solut mengalami transfer antara fase diam dan fase gerak berkali-kali. Karena solut hanya dapat bergerak jika berada dalam fase gerak, migrasi di dalam kolom juga tidak teratur, dan mengakibatkan laju rata-rata solut relatif terhadap fase gerak juga sangat bervariasi, sehingga terjadi pelebaran peak solut (Noegrohati, 1994).
Menurut teori laju ini, efisiensi kolom dinyatakan dengan persamaan van Deemter yang dapat dinyatakan sebagai berikut (Willardet al.,1988) :
atau (7)
(8)
µ = kecepatan alir
γ = faktor koreksi kelikuan saluran dalam kolom
Terdapat tiga variabel yang mempengaruhi efisiensi kolom, yaitu:
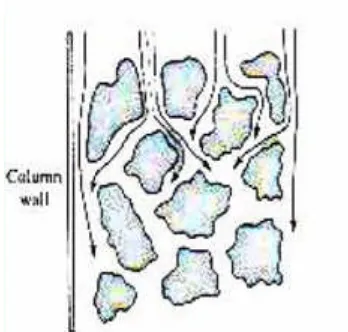
Difusi Eddy, dinyatakan sebagai A (2λdp). Difusi Eddy menggambarkan ketidakhomogenan kecepatan alir dan panjang lintasan di sekitar partikel yang terpack-ing. Lintasan alir yang tidak sama pasti ditemukan dalam setiap kolom terpack-ing. Suatu molekul solut dapat melewati kolom dekat dinding kolom di mana kerapatan kolom rendah dengan cepat mencapai akhir kolom, khususnya pada kolom dengan diameter kecil. Sedangkan suatu molekul solut yang melewati bagian tengah kolom, akan mencapai akhir kolom lebih lambat. Hal ini menyebabkan perbedaan laju tiap molekul melalui kolom berbeda-beda. Untuk meminimalkan difusi Eddy ini, maka diameter rata-rata partikel dalam kolom harus sekecil mungkin dan seseragam mungkin.
Gambar 7. Difusi Eddy (Willardet al.,1988)
difusi longitudinal terhadap ketinggian lempeng menjadi signifikan hanya pada kecepatan fase gerak yang lambat. Kecepatan difusi dari solut yang tinggi pada fase gerak dapat menyebabkan molekul solut terdispersi secara aksial sementara dengan lambat bermigrasi melalui kolom.
Transfer massa, dinyatakan dengan nilai Cstationary dan Cmobile. Cstationary merupakan hasil dari ditahannya solut karena adanya fase diam. Suatu molekul bergerak lambat dalam fase diam, sementara molekul lainnya melaju melalui kolom bersama dengan fase gerak. Untuk mengatasi hal ini diperlukan fase diam yang lebih encer (tidak terlalu kental). Peristiwa ini dapat digambarkan sebagai berikut :
Gambar 9. Transfer massa fase gerak (Willardet al.,1988)
b. Waktu retensi (tR) dan resolusi. Waktu retensi (tR) atau waktu tambat (retention time) adalah selang waktu yang diperlukan oleh analit mulai saat injeksi sampai keluar dari kolom dan sinyalnya ditangkap detektor. Selain waktu tambat analit, dikenal pula waktu tambat untuk pelarut pengembang atau pengembang campur yang dinyatakan sebagai tM (Mulja dan Suharman, 1995).
Waktu tambat analit dikurang waktu tambat pelarut pengembang atau pelarut pengembang campur disebut waktu tambat yang terkoreksi yang dinyatakan sebagai tR’ (Mulja dan Suharman, 1995). Jika harga D (perbandingan distribusi) kecil maka analit akan lebih banyak di dalam fase gerak atau (Cm>Cs) yang berarti analit akan lebih lama tinggal di dalam fase gerak dan memiliki waktu retensi lebih cepat (Mulja dan Suharman, 1995).
Faktor resolusi (R) adalah ukuran pemisahan dari dua puncak berdekatan yang dapat diukur dengan persamaan :
Harga tR1 dan tR2 merupakan waktu retensi senyawa yang diukur pada titik maksimum puncak, harga w1 dan w2 merupakan lebar alas puncak (Johnson and Setevenson, 1978). Pemisahan dua senyawa dapat digambarkan sebagai berikut :
Gambar 10. Pemisahan dua senyawa (Johnson dan Setevson, 1978)
Harga R > 1,5 disebut baseline resolution, yaitu pemisahan sempurna dari dua puncak dengan ukuran yang sama. Dalam prakteknya, pemisahan dengan harga R = 1,0 (kedua puncak berhimpit lebih kurang 2%) dianggap memadai (Pescok et al., 1976). Untuk pemisahan yang baik R harus ≥ 1,5 karena berarti pemisahan kedua senyawa≥99,7% (Sastrohamidjojo, 2002).
ekor puncak, serta waktu retensi yang tidak reprodusibel. Parameter yang digunakan untuk menilai bentuk puncak adalah peak asymmetry factor (As), yang diukur pada 10% tinggi puncak. Puncak yang simetri memiliki nilai As sama dengan 1, sedangkan puncak dengan nilai As pada rentang 0,95-1,1 masih dikatakan baik. Parameter lain yang dapat digunakan yaitu peak tailing factor, yang diukur pada 5% tinggi puncak (Synderet al.,1997).
Gambar 11. Penentuanpeak asymmetrydanpeak tailing factors(Snyderet al.,
1997)
Distribusi analit dalam fase gerak dan fase diam pada saat terjadi tailing
Gambar 12. Distribusi analit dalam fase gerak dan fase diam (Kuwana, 1980) Gugus silanol yang tidak bereaksi karena adanya halangan sterik dapat memberikan kepolaran yang tidak dikehendaki dan menyebabkan pengekoran pada puncak kromatogram. Untuk mengurangi jumlah gugus silanol yang masih bebas, reaksi dilanjutkan dengan penambahan trimetilklorosilan yang dapat mencapai gugus silanol karena ukurannya yang lebih kecil dibandingkan organoklorosilan lain. Penambahan trimetilklorosilan dapat menutupi banyak gugus silanol yang masih bebas, namun tidak semua gugus tersebut dapat tertutupi (Skooget al.,1998).
Puncak kromatogram yang tidak simetri (tailing dan leading) sering dijumpai bila konsentrasi solut dalam fase gerak terlalu besar. Senyawa-senyawa polar juga berpotensi menimbulkan tailing apabila masih terdapat residu gugus silanol pada fase diam. Penyebab tailing yang lain yaitu ketidaksesuaian antara solut dan kolom, pengemasan kolom yang tidak seragam dan faktor yang terjadi di luar kolom, seperti injektor (Noegrohati, 1994).
F. LANDASAN TEORI
tidaklah mudah untuk melakukan pemisahan campuran tersebut. Saat ini telah berkembang berbagai metode yang dapat dilakukan untuk pemisahan dan penepatan kadar suatu senyawa tunggal dari bentuk sediaan tertentu. Dalam kasus ini pemisahan dan penetapan kadar akan dilakukan untuk suatu campuran dua senyawa yaitu campuran parasetamol dan ibuprofen yang memiliki sifat kelarutan hampir sama. Metode untuk pemisahan campuran yang umum digunakan adalah metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik.
Kromatografi Cair Kinerja Tinggi dapat digunakan untuk analisis kualitatif dan kuantitatif dari sampel selain untuk memisahkan senyawa dalam sampel. Waktu retensi akan menggambarkan identitas dari suatu senyawa yang spesifik untuk setiap senyawa. Analisis kuantitatif dilakukan dengan membandingkan tinggi atau luas puncak kromatogram senyawa dengan baku standar. KCKT juga dapat digunakan untuk pemisahan campuran dan penetapan kadar campuran dua senyawa dalam sampel.
campuran parasetamol dan ibuprofen dengan fase gerak campuran metanol dan aquabidest. Hasil dari penelitian ini nantinya dapat digunakan untuk penetapan kadar campuran parasetamol dan ibuprofen dari sediaan tablet merk “X” yang terdapat di pasaran. Kandungan yang tertera di etiket tablet merk “X” tersebut 350 mg parasetamol dan 200 mg ibuprofen. Perbandingan ini menunjukkan bahwa campuran parasetamol dan ibuprofen adalah 7:4. Dalam analisis ini akan digunakan campuran parasetamol-ibuprofen dengan perbandingan 7:4 untuk menyesuaikan dengan sampel yang ada di pasaran.
G. HIPOTESIS
1. Pemisahan campuran parasetamol dan ibuprofen dapat dilakukan dengan metode KCKT fase terbalik menggunakan fase gerak campuran metanol dan aquabidest.
27
A. Jenis dan Rancangan Penelitian
Jenis rancangan penelitian berjudul “Optimasi Metode Penetapan Kadar Campuran Parasetamol dan Ibuprofen dalam Tablet Merk “X” dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik” bersifat noneksperimental deskriptif. Penelitian dilakukan di Laboratorium Kimia Analisis Instrumental dan Kimia Organik Fakultas Farmasi Universitas Sanata Dharma.
B. Variabel
Variabel-variabel yang digunakan dalam penelitian :
1. Variabel bebas yang ditentukan adalah perbandingan fase gerak dan kecepatan alir (flow rate) sistem KCKT.
C. Definisi Operasional
1. Campuran parasetamol dan ibuprofen adalah campuran antara parasetamol dan ibuprofen dengan perbandingan 7 : 4.
2. Sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik yang digunakan adalah KCKT dengan fase diam kolom C18 dengan fase gerak metanol : aquabidest pH 4 dengan perbandingan optimal.
3. Kadar parasetamol dan Ibuprofen dalam ppm dan mg/100 ml.
D. Bahan Penelitian
Parasetamol (Working Standard dari PT. Konimex), ibuprofen (Working Standard dari PT. Konimex), metanol pro analysi (E. Merck), Aquabidest (PT. Ikapharmindo Putranas, Pharmaceutical Laboratories), asam asetat glasial (E. Merck).
E. Alat Penelitian
Spektrofotometer UV/Vis merk Optima SP 3000 F, sistem KCKT (yang terdiri dari pompa merk Shimadzu model LC-10 AD No. C20293309457 J2, detektor UV-Vis merk Shimadzu model SPD-10AV No. C20343502697 KG, injektor jenis katup suntik, model 7725i, kolom oktadesilsilan (C18) merk
Retsch Tipe T 460 No. V935922013 EY, vakum merk Gast, model DOA-P104-BN, penyaring Whatman, indikator pH, penyaringMillipore,mikropipetSocorex,
neraca Analitik merk Scaltec max 60/210 g; d = 0,01/0,1 mg; e = 1 mg,
seperangkat alat gelas merk Pyrex.
F. Tata Cara Penelitian 1. Pembuatan fase gerak
a. Fase gerak metanol : aquabidest dengan perbandingan 70:30, dibuat dengan metanol sebanyak 350,0 ml dimasukkan dalam labu takar 500,0 ml dicampur dengan aquabidestadhingga tanda batas.
b. Fase gerak metanol : aquabidest dengan perbandingan 70:30 pH 4, dibuat dengan metanol sebanyak 350,0 ml dimasukkan dalam labu takar 500,0 ml dicampur dengan aquabidest ad hingga tanda batas. Ditambahkan asam asetat glasial hingga pH 4.
2. Pembuatan larutan baku parasetamol dan ibuprofen untuk spektrofotometri
a. Pembuatan larutan baku parasetamol. Sebanyak kurang lebih 10 mg parasetamol ditimbang seksama dan dilarutkan dalam metanol hingga 10,0 ml. Kemudian 1,0 ml larutan tersebut diencerkan dengan metanol hingga 10,0 ml. Setelah itu, dibuat larutan dengan seri kadar 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 mg/100 ml, yakni dengan mengencerkan 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 ml dalam metanol hingga 10,0 ml.
b. Pembuatan larutan baku ibuprofen. Sebanyak kurang lebih 10 mg ibuprofen ditimbang seksama dan dilarutkan dalam metanol hingga 10,0 ml. Kemudian 1,0 ml larutan tersebut diencerkan dengan metanol hingga 10,0 ml. Setelah itu, dibuat larutan dengan seri kadar 0,7; 0,9; 1,1; 1,2; 1,3; 1,4 mg/100ml, yakni dengan mengencerkan 0,7; 0,9; 1,1; 1,2; 1,3; 1,4 ml dalam metanol hingga 10,0 ml.
3. Pembuatan larutan baku parasetamol dan ibuprofen untuk KCKT a. Larutan stok parasetamol. Parasetamol baku lebih kurang 10 mg ditimbang seksama dan dilarutkan dengan metanol dalam labu takar 10,0 ml hingga tanda batas.
c. Larutan stok ibuprofen. Ibuprofen baku lebih kurang 10,0 mg ditimbang seksama dan dilarutkan dengan metanol dalam labu takar 10,0 ml hingga tanda batas.
d. Larutan baku ibuprofen. Larutan stok ibuprofen diambil 0,2; 0,4; dan 0,5 ml dan diencerkan dengan metanol dalam labu takar 5,0 ml hingga tanda batas, sehingga didapatkan konsentrasi sebesar 40; 80; dan 100 ppm. Saring denganmiliporedan didegassingselama 15 menit.
e. Pembuatan campuran parasetamol dan ibuprofen. Campuran parasetamol : ibuprofen 70 ppm : 40 ppm (rendah) dibuat dengan 0,350 ml stok parasetamol dicampur dengan 0,2 ml stok ibuprofen dicampurkan dalam labu takar 5 ml. Saring dengan milipore dan degassing selama 15 menit. Campuran parasetamol : ibuprofen 140 ppm : 80 ppm (tengah) dibuat dengan 0,700 ml stok parasetamol dicampur dengan 0,4 ml stok ibuprofen dicampurkan dalam labu takar 5 ml. Saring dengan milipore dan degassing
selama 15 menit. Campuran parasetamol : ibuprofen 175 ppm : 100 ppm (tinggi) dibuat dengan 0,875 ml stok parasetamol dicampur dengan 0,5 ml stok ibuprofen dicampurkan dalam labu takar 5 ml. Saring dengan milipore
dandegassingselama 15 menit.
4. Penetapan panjang gelombang maksimum parasetamol dan ibuprofen dengan spektrofotometer UV
masing-masing diambil satu seri kadar dan dilakukan pengukuran absorbansi kedua larutan pada rentang panjang gelombang 220-280 nm, sehingga dapat diketahui absorbansi masing-masing larutan pada berbagai panjang gelombang.
Kemudian dibuat spektrum serapan antara panjang gelombang lawan absorbansi. Setelah itu, ditentukan 5 panjang gelombang pada daerah tumpang tindih dari kedua spektrum serapan yang diperoleh. Panjang gelombang yang diperoleh digunakan untuk mengukur absorbansi larutan baku parasetamol-ibuprofen.
5. Optimasi pemisahan parasetamol dan ibuprofen dalam campuran parasetamol dan ibuprofen dengan perbandingan 7:4 dengan KCKT fase terbalik
a. Pengamatan waktu retensi parasetamol. Larutan baku parasetamol 175 ppm yang telah dibuat sebanyak 50 µl disuntikkan ke dalam sistem KCKT dengan kolom ODS (5 mm × 30 cm). Optimasi dilakukan pada panjang gelombang pengamatan. Perbandingan fase gerak dan kecepatan alir pada sistem KCKT diubah-ubah hingga waktu retensi parasetamol dan ibuprofen memiliki resolusi lebih dari 1,5 dan tidak terlalu jauh.
alir 1,5 ml/menit dan 2 ml/menit pada panjang gelombang pengamatan, dan fase gerak metanol : aquabidest dengan perbandingan 90 : 10 kecepatan alir 1 ml/menit dan 1,5 ml/menit pada panjang gelombang pengamatan.
b. Pengamatan waktu retensi ibuprofen. Larutan baku ibuprofen konsentrasi 100 ppm sebanyak 50 µl disuntikkan ke dalam sistem KCKT dengan kolom ODS (5 mm × 30 cm). Optimasi dilakukan pada panjang gelombang pengamatan. Perbandingan fase gerak dan kecepatan alir pada sistem KCKT diubah-ubah hingga waktu retensi ibuprofen dan parasetamol memiliki resolusi lebih dari 1,5 dan tidak terlalu jauh.
Sistem KCKT yang digunakan: fase gerak metanol : aquabidest dengan perbandingan 70 : 30 kecepatan alir 1 ml/menit pada panjang gelombang pengamatan, fase gerak metanol : aquabidest dengan perbandingan 70 : 30 pH 4 dengan penambahan asam asetat glasial kecepatan alir 1,5 ml/menit dan 2 ml/menit pada panjang gelombang pengamatan, dan fase gerak metanol : aquabidest dengan perbandingan 90 : 10 kecepatan alir 1 ml/menit dan 1,5 ml/menit pada panjang gelombang pengamatan.
pH 4 dengan penambahan asam asetat glasial kecepatan alir 1,5 ml/menit dan 2 ml/menit pada panjang gelombang pengamatan, dan fase gerak metanol : aquabidest dengan perbandingan 90 : 10 kecepatan alir 1 ml/menit dan 1,5 ml/menit pada panjang gelombang pengamatan. Melakukan perhitungan nilai resolusi dari pemisahan campuran parasetamol dan ibuprofen.
35
A. Pembuatan Fase Gerak
Sistem kromatografi yang digunakan dalam analisis senyawa parasetamol dan ibuprofen adalah fase terbalik karena senyawa yang dipisahkan memiliki bobot molekul kurang dari 2000 (BM parasetamol = 151,6 gram/mol dan BM ibuprofen 206,28 gram/mol dengan sifat larut dalam air-tak berion (Johnson dan Stevenson, 1978). Fase gerak yang akan dioptimasi dalam penelitian ini ada tiga yaitu metanol : aquabidest dengan perbandingan 70:30 dengan indeks polaritas sebesar 6,63; metanol : aquabidest dengan perbandingan 70:30 pada pH 4 dengan penambahan asam asetat glasial dengan indeks polaritas sebesar 6,63; serta metanol : aquabidest dengan perbandingan 90:10 pada pH 4 dengan penambahan asam asetat glasial dengan indeks polaritas sebesar 5,61. Pemilihan komposisi ini didasarkan dari penyesuaian agar diperoleh kepolaran yang mendekati fase gerak asetonitril : buffer fosfat (60 : 40, v/v, pH 7) dengan indeks polaritas 6,63 yang telah dilakukan oleh Prasanna Reddy Battu dan MS Reddy (2009).
oktadesilnya sehingga akan mempengaruhi kepolaran dari kolom (menjadi semakin polar). Asam akan bereaksi dengan oktadesilsilan sehingga kembali ke bentuk silanol. Berikut ini gambaran reaksinya:
Si OH + O Si (CH2)17CH3
Gambar 13. Reaksi kolom oktadesilsilan dengan asam asetat
Pengaturan pH dilakukan karena dari hasil studi pustaka diketahui bahwa dalam pemisahan ibuprofen digunakan fase gerak dengan pH 4 atau larutan buffer pH 7. Pemilihan pH 4 dilakukan karena lebih efisien daripada penggunaan buffer karena buffer tertambat kuat pada fase diam (kolom C18) sehingga waktu elusi lebih lama, tekanan pompa lebih tinggi, dan perlu waktu lebih lama saat mencuci kolom dari hasil sisa fase gerak dengan buffer.
Metanol dapat melarutkan dengan baik parasetamol dan ibuprofen serta memiliki viskositas yang rendah 0,54cP, sehingga dapat mengurangi tekanan pada kolom dan dapat memisahkan parasetamol dan ibuprofen. Fase gerak metanol dengan aquabidest memiliki sifat lebih polar dibandingkan dengan fase diam yang digunakan yaitu kolom oktadesilsilan (C18) sehingga kromatografi yang digunakan merupakan kromatografi fase terbalik.
B. Pembuatan Larutan Baku
mengetahui hasil pemisahan dari campuran. Larutan baku dibuat dengan pelarut metanol yang memiliki kemurnian tinggi. Metanol digunakan sebagai pelarut karena persentase metanol dalam fase gerak cukup banyak sehingga akan mudah terelusi bersama fase gerak. Pembuatan baku untuk analisis pemisahan campuran parasetamol dan ibuprofen disesuaikan dengan kadar yang tertera dalam kemasan sampel merk “X” yaitu 200 mg ibuprofen dan 350 mg parasetamol tiap tablet (perbandingan parasetamol : ibuprofen adalah 7 : 4).
Larutan baku parasetamol dan ibuprofen dibuat sebagai larutan baku dan campurannya dengan parasetamol : ibuprofen adalah 7 : 4 dalam tiga level konsentrasi. Larutan baku ibuprofen dibuat tiga level konsentrasi yaitu 40 ppm, 80 ppm, dan 100 ppm sedangkan untuk larutan baku parasetamol yaitu 70 ppm, 140 ppm, dan 175 ppm. Larutan baku campuran parasetamol : ibuprofen dengan perbandingan 7 : 4 adalah 70 ppm dengan 40 ppm untuk konsentrasi rendah; 140 ppm dengan 80 ppm untuk konsentrasi tengah; dan 175 ppm dengan 100 ppm untuk konsentrasi tinggi. Pembuatan tiga level konsentrasi campuran baku ini dilakukan untuk mengetahui bahwa pada ketiga level konsentrasi hasil pemisahan dari campuran parasetamol dan ibuprofen baik. Larutan baku yang dibuat ini digunakan untuk analisis pemisahan campuran parasetamol dan ibuprofen dengan metode KCKT fase terbalik.
Baku untuk pengukuran panjang gelombang maksimum (λmaks) dibuat
dilakukan dengan kadar parasetamol : ibuprofen dengan perbandingan 7:4 yaitu 1,05 mg/100ml untuk parasetamol dan 0,6 mg/100ml untuk ibuprofen.
C. Optimasi Penentuan Panjang GelombangOverlapingParasetamol dan Ibuprofen dengan Spektrofotometer UV
Panjang gelombang overlaping ditentukan untuk mengetahui panjang gelombang dimana parasetamol dan ibuprofen memberikan serapan secara bersamaan dan optimal pada sistem detektor KCKT. Pada sistem KCKT ini digunakan spektrofotometer UV sebagai detektor. Penentuan panjang gelombang serapan dilakukan dengan scanning panjang gelombang maksimum (λmaks) dari masing-masing senyawa yaitu parasetamol dan ibuprofen menggunakan spektrofotometer UV. Scanning λmaks dilakukan masing-masing untuk
parasetamol dan ibuprofen dengan pelarut menggunakan metanol.
Penentuan panjang gelombang dilakukan dengan pembacaan serapan pada rentang panjang gelombang 220-280 nm karena secara teoritis panjang gelombang maksimum dari parasetamol dan ibuprofen berada pada rentang tersebut. Panjang gelombang maksimum ibuprofen lebih kurang 221 nm (Anonim, 1995) dan panjang gelombang maksimum parasetamol sebesar kurang lebih 244 nm pada pelarut air.
Suatu senyawa dapat dianalisis dengan spektrofotometri ultraviolet harus memiliki gugus kromofor yang bertanggung jawab dalam penyerapan radiasi ultraviolet. Parasetamol dan ibuprofen memiliki gugus kromofor yang merupakan ikatan rangkap yang memiliki elektron orbital p yang mudah tereksitasi ke tingkat yang lebih tinggi yaitu π*. Selain memiliki gugus kromofor, parasetamol juga memiliki gugus auksokrom yang terikat langsung pada gugus kromofornya. Gugus auksokrom ini berperan dalam pergeseran panjang gelombang dan intensitas serapan maksimum dari parasetamol. Gambar gugus kromofor dan auksokrom dari masing-masing senyawa dapat dilihat pada gambar berikut.
O
Gambar 14. Gugus kromofor dan auksokrom pada parasetamol dan ibuprofen
Gambar 15. Spektrum serapan parasetamol dengan λmaks= 243,5 nm Keterangan : A = konsentrasi 0,4mg/100ml (konsentrasi rendah); B = konsentrasi 0,6 mg/100ml (konsentrasi tengah); dan C = konsentrasi 1,1
mg/100ml (konsentrasi tinggi)
Gambar 16. Spektrum serapan ibuprofen dengan λmaks= 223 nm Keterangan : A = konsentrasi 0,6mg/100ml (konsentrasi rendah); B = konsentrasi 1,0 mg/100ml (konsentrasi tengah); dan C = konsentrasi 1,4
Dari gambar tersebut dapat dilihat bahwa ketiga seri kadar ibuprofen dalam pelarut metanol memiliki hasil spektrum yang menunjukkan serapan maksimum pada 223 nm. Dalam Farmakope Indonesia Edisi VI (1995) dicantumkan panjang gelombang maksimum ibuprofen dalam pelarut asam sebesar 221 nm. Dari hasil diketahui bahwa panjang gelombang hasil pengukuran menyimpang tidak lebih dari 2 nm. Dengan demikian panjang gelombang maksimum ibuprofen sesuai dengan panjang gelombang teoritis. Sehingga dapat dipastikan bahwa senyawa tersebut adalah ibuprofen.
Dalam melakukan analisis dengan KCKT diperlukan suatu panjang gelombang di mana senyawa tersebut memberikan serapan yang optimal untuk dapat diukur pada detektor UV dalam sistem KCKT. Panjang gelombang ini disebut dengan panjang gelombang pengamatan. Panjang gelombang pengamatan untuk campuran dua senyawa menggunakan panjang gelombang overlaping di mana terjadi tumpang tindih serapan parasetamol dan ibuprofen. Berikut ini gambar serapan parasetamol dan ibuprofen dengan perbandingan 7 : 4.
Gambar tersebut menampilkan absorbansi antara parasetamol dan ibuprofen saling tumpang tindih antara 220 nm sampai 240 dan berpotongan pada panjang gelombang 230 nm. Analisis dengan sistem KCKT menggunakan panjang gelombang 230 nm sebagai panjang gelombang pengamatan karena merupakan panjang gelombang perpotongan kedua senyawa. Campuran parasetamol dengan ibuprofen (7:4) memiliki perbandingan yang lebih kecil untuk ibuprofen sehingga pemilihan penjang gelombang pengamatan lebih diutamakan untuk memperoleh serapan yang tinggi untuk ibuprofen. Akan tetapi serapan maksimum ibuprofen berdekatan dengan panjang gelombang serapan dari metanol sampai dengan 205 nm. Bila panjang gelombang pengamatan dilakukan pada panjang gelombang maksimum parasetamol, ditakutkan serapan ibuprofen terlalu kecil atau bahkan tidak memberikan serapan.
D. Optimasi Pemisahan Parasetamol dan Ibuprofen dengan KCKT Fase Terbalik
O
Gambar 18. Gugus nonpolar ibuprofen dan parasetamol Keterangan : = gugus nonpolar
Pada campuran sifat dari parasetamol lebih polar dari ibuprofen, hal ini dapat dilihat dari strukturnya diatas. Keduanya memiliki gugus nonpolar namun dari gambar 17 nampak bahwa gugus nonpolar dari ibuprofen lebih banyak dibandingkan dengan parasetamol. Selain itu, dengan nilai log P parasetamol sebesar 0,28 dan log P ibuprofen sebesar 3,75 (diperoleh dariChemical properties
O
Gambar 19. Interaksi parasetamol dengan fase gerak metanol : aquabidest
O
berinteraksi dengan fase geraknya campuran metanol dan aquabidest. Metanol sendiri berinteraksi dengan aquabidest dengan ikatan hidrogen. Kemudian campuran dari metanol dan aquabidest akan berinteraksi dengan parasetamol dan ibuprofen dengan membentuk ikatan hidrogen. Kekuatan interaksi dari parasetamol lebih kuat jika dibandingkan dengan ibuprofen, hal ini nampak dari gambar 18 dan gambar 19 yang menunjukkan bahwa interakasi parasetamol dengan fase gerak lebih banyak dibandingkan interaksi ibuprofen dengan fase gerak.
O
Gambar 22. Interaksi parasetamol dengan fase diam
Fase gerak yang digunakan harus dioptimasi terlebih dahulu untuk memperoleh pemisahan yang baik antara parasetamol dengan ibuprofen. Pemisahan optimal dilihat dari hasil pemisahannya dan nilai resolusi (resolusi yang baik lebih dari 1,5) dari pemisahan campuran parasetamol dengan ibuprofen. Fase gerak yang digunakan merupakan campuran metanol dengan aquabidest. Berikut ini kondisi yang digunakan untuk pemisahan campuran parasetamol dan ibuprofen :
1. Fase gerak metanol : aquabidest dengan perbandingan 70:30 dengan kecepatan alir 1 ml/menit
Gambar 23. Pemisahan dari campuran parasetamol (A) dan ibuprofen (B) dengan fase gerak metanol : aquabidest (70:30) kecepatan alir 1 ml/menit
i. Baku parasetamol konsentrasi 175 ppm (konsentrasi tinggi) ii. Baku ibuprofen konsentrasi 100 ppm (konsentrasi tinggi)
Penggunaan fase gerak metanol : aquabidest dengan perbandingan 70:30 dengan kecepatan alir 1 ml/menit seperti tampak pada gambar 22 menunjukkan hasil pemisahan yang cukup baik antara parasetamol dengan ibuprofen namun padapeakparasetamol terjaditailingsehingga terbentuk dua
peak sedangkan pada ibuprofen peak yang terbentuk tidak runcing. Peak
parasetamol yang membentuk tailing ini disebabkan karena parasetamol memlilki gugus amin yang dapat berinteraksi dengan gugus silanol pada fase diam kolom kromatografi C18. Sedangkan pada peak ibuprofen yang landai dan tidak runcing disebabkan interaksi yang terlalu kuat terhadap salah satu fase. Kemungkinan besar interaksi ibuprofen lebih kuat terhadap fase gerak dibandingkan terhadap fase diamnya. Hal ini karena terjadinya ionisasi sebab tidak dilakukan pengaturan pH dari fase gerak yang digunakan. Ionisasi ini menyebabkan analit tidak terelusi secara serentak. Analit akan terlusi sedikit demi sedikit sehingga terjadi fronting. Berikut ini ionisasi yang terjadi pada ibuprofen.
Gambar 24. Reaksi ionisasi Ibuprofen
Ibuprofen yang berada dalam bentuk molekul akan berinteraksi dengan fase diam sehingga lebih tertambat pada kolom. Adanya bentuk ion dan molekul ini menyebabkan elusi ibuprofen tidak serentak. Ibuprofen akan terelusi bentuk ionnya dulu diikuti bentuk molekul.
Tampak pada gambar 23 bahwa pemisahan membentuk fronting
dengan bentuk lebih besar pada bagian belakang, hal ini menunjukkan bahwa jumlah ibuprofen dalam bentuk molekul lebih banyak dari bantuk ionnya. Ibuprofen akan membentuk molekul bila dalam suasana asam, namun kesamaan fase gerak belum bisa menggeser seluruh ibuprofen dalam bentuk molekul. Keasaman dari fase gerak ini sekitar pH 5-6, sehingga untuk membuat seluruh ibuprofen berada dalam bentuk molekul, maka dilakukan perlu dilakuan penurunan pH fase gerak.
2. Fase gerak metanol : aquabidest dengan perbandingan 70:30 pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 1,5 ml/menit
Hasil pemisahan fase gerak pertama menunjukkan fronting pada peak
Gambar 25. Pemisahan dari campuran parasetamol (A) dan ibuprofen (B) dengan fase gerak metanol : aquabidest (70:30) pH 4 kecepatan alir 1,5
ml/menit
i. Baku parasetamol konsentrasi 175 ppm (konsentrasi tinggi) ii. Baku ibuprofen konsentrasi 100 ppm (konsentrasi tinggi)
iii.Campuran parasetamol dan ibuprofen dengan perbandingan 7:4
Hasil pemisahan campuran parasetamol dan ibuprofen seperti tampak pada gambar 24 menunjukkan peak yang baik (runcing) pada ibuprofen dengan waktu retensi 13,463 menit sedangkan parasetamol masih terjadi
peakyang cukup besar pada menit ke 11,357 (C) hal ini dimungkinkan analit lain yang terikut saat preparasi yang tidak diketahui.
3. Fase gerak metanol : aquabidest dengan perbandingan 70:30 pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 2 ml/menit
Gambar 26. Pemisahan dari campuran parasetamol (A) dan ibuprofen (B) dengan fase gerak metanol : aquabidest (70:30) pH 4 kecepatan alir 2
ml/menit
i. Baku parasetamol konsentrasi 175 ppm (konsentrasi tinggi) ii. Baku ibuprofen konsentrasi 100 ppm (konsentrasi tinggi) iii.Campuran parasetamol dan ibuprofen dengan perbandingan
Hasilnya pemisahan dengan fase gerak metanol : aquabidest dengan perbandingan 70:30 pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 2 ml/menit menunjukkan peak parasetamol yang runcing dan tidak memisah namun jarak pemisahan antara parasetamol dengan ibuprofen masih terlalu jauh dengan nilai resolusi 20,47. Hasil resolusi yang terlalu jauh ini akan mengurangi efektifitas dari proses pemisahan sehingga perlu dilakukan pengaturan komposisi fase gerak untuk memperoleh hasil pemisahan yang baik dengan resolusi yang optimal.
4. Fase gerak metanol : aquabidest dengan perbandingan 90:10 pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 1 ml/menit
Gambar 27. Pemisahan dari campuran parasetamol (A) konsentrasi 175 ppm dan ibuprofen (B) konsentrasi 100 ppm dengan fase gerak metanol :
aquabidest (90:10) pH 4 kecepatan alir 1 ml/menit
5. Fase gerak metanol : aquabidest dengan perbandingan 90:10 pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 1,5 ml/menit
Gambar 28. Pemisahan dari campuran parasetamol (A) dan ibuprofen (B) dengan fase gerak metanol : aquabidest (90:10) pH 4 kecepatan alir 1,5
ml/menit
i. Baku parasetamol konsentrasi 175ppm (konsentrasi tinggi) ii. Baku ibuprofen konsentrasi 100ppm (konsentrasi tinggi) iii.Campuran parasetamol dan ibuprofen dengan perbandingan
7:4 konsentrasi 70 ppm : 40 ppm
iv. Campuran parasetamol dan ibuprofen dengan perbandingan 7:4 konsentrasi 140 ppm : 80 ppm
v. Campuran parasetamol dan ibuprofen dengan perbandingan 7:4 konsentrasi 175 ppm: 100 ppm
Diperoleh hasil pemisahan dengan waktu retensi parasetamol kira-kira 1,6 menit dan waktu retensi ibuprofen kira-kira 3 menit, pemisah campuran sempurna dengan resolusi yang lebih dari 1,5 yaitu sebesar 6,7 dan peak
menit. Optimasi fase gerak ini tidak dilanjutkan dengan meningkatkan kecepatan alir menjadi 2 ml/menit karena kolom oktadesilsilan yang digunakan memiliki batas tekanan 0 kPa hingga 380 kPa. Peningkatan kecepatan alir akan meningkatkan tekanan pompa sehingga dapat melebihi batas, hal ini menyebabkan kerusakan kolom oktadesilsilan. Penggunaan kecepatan alir 1,5 ml/menit dilakukan untuk menjaga agar tekanan pompa tidak lebih dari 380 kPa.
Dilakukan pemisahan dengan fase gerak metanol : aquabidest (90:10) pH 4 pada kecepatan alir 1,5 ml/menit terhadap tiga level konsentrasi dengan parasetamol : ibuprofen sebesar 70 ppm : 40 ppm (rendah), 140 ppm : 80 ppm, dan 175 ppm : 100 ppm untuk membuktikan reliabilitas dari pemisahan campuran parasetamol dan ibuprofen. Hasil pemisahan dilihat dari nilai CV dari tR parasetamol dan ibuprofen dari ketiga level konsentrasi. Harga CV < 2% dapat dikatakan memiliki presisi yang bagus (Mulja dan Hanwar, 2003). Diperoleh pemisahan parasetamol dan ibuprofen dengan waktu retensi (tR) parasetamol ketiga level konsentrasi dengan nilai CV memenuhi syarat presisi (<2%) yaitu sebesar 0,0906% dan untuk ibuprofen juga memenuhi syarat dengan nilai CV sebesar 0,8078%.
demikian diharapkan sistem hasil optimasi metode KCKT fase terbalik yang dilakukan dapat digunakan untuk analisis sampel. Secara rinci nilainya ditampilkan pada tabel 2 berikut ini.
Tabel 2. Tabel nilai waktu retensi (tR) parasetamol-ibuprofen dan nilai resolusi pemisahan campuran parasetamol dan ibuprofen
Metanol :
70:30 1 ml/menit 175 ppm :
100 ppm
1,5ml/menit 175 ppm :
100 ppm
1,498 11,385 20,47 Memisah
1 ml/menit 175 ppm :
100 ppm
(tinggi)
2,468 4,492 7,203 Memisah
90:10 pH 4
1,5ml/menit 70 ppm : 40
140 ppm : 80
90:10 pH 4dengan kecepatan alir 1,5 dari
ketiga level kadar diperoleh:
1,677
65
1. Pemisahan campuran parasetamol dan ibuprofen dengan perbandingan 7:4 dapat dilakukan dengan fase gerak metanol : aquabidest dengan metode KCKT.
2. Kondisi yang optimal untuk memisahkan campuran parasetamol dan ibuprofen dengan metode KCKT fase terbalik adalah :
Instrument :Shimadzumodel LC-10 AD No. C20293309457 J2 Kolom : Oktadesilsilan (C18) merkKNAUER;Order
No.25EE181KSJ(B115YG20); Dimension. 250x4,6 mm; Batch no. 0003358; Column SN. XI 27
Fase gerak : Metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial
Kecepatan alir : 1,5 ml/menit Detektor : UV pada 230 nm
B. Saran
1. Perlu dilakukan validasi metode penetapan kadar campuran parasetamol dan ibuprofen dengan metode KCKT fase terbalik dalam kondisi optimal.
DAFTAR PUSTAKA
Anonim, 1995, Farmakope Indonesia, Edisi IV, 4, 450, 649, 650, Departeman Kesehatan RI, Jakarta
Anonim, 2000, Informatorium Obat Nasional Indonesia 2000, 184, Departemen Kesehatan Republik Indonesia Direktorat Jendral Pengawasan Obat dan Makanan, Jakarta.
Ansel, H. C., 1985,Introduction to Pharmaceutical Dosage Forms,diterjemahkan oleh Farida Ibrahim, 244-245, Penerbit Universitas Indonesia, Jakarta. Aulton, M., and Summer, M., 1994, Pharmaceutitics : The Science of Dosage
Form Design,2nded., 305-306, Churchill Living Stone, London.
Battu, P. R. dan Reddy, M. S., 2009, RP-HPLC Method for Simultaneous Estimation of Paracetamol and Ibuprofen in Tablets, http://www.ajrconline.org/AJRC%20V0l2%20%281%29%20PDF%20Fin al/19.pdf diakses pada tanggal 11 November 2009
Christian, G. D., 2004, Analytical Chemmistry,6th ed., 465, Jhon Willey & Sons, Inc., USA.
Clarke, E. G. C.,1986, Isolation and identificationof Drugs,Second Edition, 849-850, 883-884, The Pharmaceutical Press, London.
Dean, J. A., 1995, Analytical Chemistry, 6th ed, 234, 253, 465, John Willey & Sons, Inc., USA.
Johnson, E. L., and Stevenson, R., 1978, Basic Liquid Chromatography,
diterjemahkan oleh Kosasih padmawinata, 6-9, 17-25, 90-91, 99-103, Penerbit ITB, Bandung.
Kazakevich, Y. and Nair, H. M., 1996, Basic Liquid Chromatography Textbook on KCKT,http://KCKT.chem.shu.edu/NEW/KCKT Book. diakses pada 25 Oktober 2009
Khopkar, S. M., 1990, Konsep Dasar Kimia Analitik, 3-5, 167-172, Penerbit Universitas Indonesia, Jakarta.
Kuwana, T., 1980, Physical Methods In Modern Chemical Analysis, Vol. II, 13, Academic Press, London.
Mulja, M., dan Suharman, 1995, Analisis Instrumental, 19-32, 164, Airlangga University Press, Surabaya.
Munson, J. W., 1984, Pharmaceutical Analysis Modern Methods, diterjemahkan oleh Harjana Parwa B, Bagian B, 14-16, Airlangga University Press, Surabaya.
Noegrohati, S., 1994,Pengantar Kromatografi, dalam Noegrohati, S dan Narsito, (Eds.), Risalah Prinsip dan Aplikasi Beberapa Teknik Analisis Instrumental, 16-17, Laboratorium Analisis Kimia dan Fisika Pusat UGM, Yogyakarta.
Pescok, R. L., Shields, L.D., and Caims, T., 1976, Modern Methods of Chemical Analysis,2nded., 51, John Wiley & Sons, Canada.
Rohman, A. dan Gandjar, I. G., 2007,Kimia Farmasi Analisis, Cetakan kedua, 33, 323-345, 378-389, 456-470, Penerbit Pustaka Pelajar, Yogyakarta.
Skoog, D. A, Holler, F. J., and Nieman, T. A., 1985, Principles of Instrumental Analysis,3thEd., 490, Harcourt bace College, Philadelphia.
Skoog D. A., Holler, F. J., and Nieman, T. A., 1988, Principles of Instrumental Analysis,5thEd., 329-351, Harcourt bace College, Philadelphia.
Snyder, L. R., Kirkland, J. J., and Glajh,J, L., 1997, Practical HPLC Method Development,2nded, 236, John Willey Sons, Inc, New York.
Voight, R., 1984, Lehrbuch der Pharmacezeutischen Technologie, diterjemahkan oleh Soendani Noerono, Edisi ke-5, 163-164, Gadjah Mada University Press, Yogyakarta.
Willard, H. H., Merrit, Jr, Dean, J. A., and Settle Jr, F. A., 1988,Instrumental Methods of Analysis,7thed, 525-529, 580, 619, Wadworth Publishing Company,
Lampiran 3. Data Penimbangan Bahan
Replikasi Bobot parasetamol (mg) Bobot Ibuprofen (mg) I
II III
0,0100 0,01006 0,0095
Lampiran 4. Spektrum panjang gelombang maksimum parasetamol
1. Konsentrasi 0,4 mg/100ml (konsentrasi rendah) dengan panjang gelombang maksimum 244,0 nm; absorbansi 0,285 A
Lampiran 5. Spektrum panjang gelombang maksimum ibuprofen
1. Konsentrasi 0,6 mg/100ml (konsentrasi rendah) dengan panjang gelombang maksimum 223,0 nm ; absorbansi 0,345 A
Lampiran 6. Spektra panjang gelombangoverlaping
1. Parasetamol dan ibuprofen perbandingan absorbansi 1:1 (0,482 A : 0,469 A) dengan konsentrasi parasetamol 0,6 mg/100 ml dan konsentrasi parasetamol 1,0 mg/100 ml
Lampiran 7. Perhitungan kepolaran fase gerak
Diketahui :
Asetonitril dengan log P = 0,17; indeks polaritas = 5,8 Metanol dengan log P = -0,27; indeks polaritas = 5,1 Aquabidest dengan indeks polaritas = 10,2
Fase gerak :
1. Asetonitril : aquabidest = 60 : 40 Indeks polaritas =
2. Asetonitril : aquabidest = 70 : 30 Indeks polaritas =
3. Metanol : aquabidest = 70 : 30 Indeks polaritas =
4. Metanol : aquabidest = 80 : 20 Indeks polaritas =
Lampiran 8. Kromatogram pada fase gerak metanol : aquabidest (70:30) pada kecepatan alir 1 ml/menit
1. Fase gerak
3. Kromatogram baku parasetamol
Lampiran 9. Kromatogram pada fase gerak metanol : aquabidest (70:30) pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 1,5 ml/menit
1. Kromatogram baku parasetamol
Lampiran 10. Kromatogram pada fase gerak metanol : aquabidest (70:30) pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 2 ml/menit
1. Fase Gerak
3. Kromatogram baku ibuprofen
Lampiran 11. Kromatogram pada fase gerak metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 1 ml/menit
1. Fase Gerak
Lampiran 12. Kromatogram pada fase gerak metanol : aquabidest (90:10) pH 4 dengan penambahan asam asetat glasial pada kecepatan alir 1,5 ml/menit
1. Fase Gerak
3. Kromatogram baku parasetamol a. Kadar 70 ppm (konsentrasi rendah)
Replikasi II
c. Kadar 175 ppm (konsentrasi tinggi)
4. Kromatogram baku ibuprofen
b. Kadar 80 ppm (konsentrasi tengah) Replikasi I
Replikasi III
5. Kromatogram campuran parasetamol dan ibuprofen (7:4)
a. Campuran parasetamol : ibuprofen konsentrasi 70 ppm : 40 ppm (campuran rendah)
Replikasi I
Replikasi III
b. Campuran parasetamol : ibuprofen konsentrasi 140 ppm : 80 ppm (campuran tengah)
Replikasi II
c. Campuran parasetamol : ibuprofen konsentrasi 175 ppm : 100 ppm (campuran tinggi)
Replikasi I
Lampiran 13. Contoh perhitungan resolusi pemisahan campuran parasetamol-ibuprofen (7:4)
Diketahui : tRparasetamol = 1,677 menit; w1= 0,265 menit tRibuprofen = 3,044 menit; w2= 0,176 menit Perhitungan :
6,199
BIOGRAFI PENULIS