UJI AKTIVITAS ANTIBAKTERI FRAKSI DARI EKSTRAK KLOROFORM DAUN Piper crocatum Ruiz & Pav. TERHADAP
Staphylococcus aureus RESISTEN AMPICILLIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Diajukan oleh:
Nadia Chandra Prasdiyanti
NIM : 158114025
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIBAKTERI FRAKSI DARI EKSTRAK KLOROFORM DAUN Piper crocatum Ruiz & Pav. TERHADAP
Staphylococcus aureus RESISTEN AMPICILLIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Diajukan oleh:
Nadia Chandra Prasdiyanti
NIM : 158114025
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
iv
HALAMAN PERSEMBAHAN
Kupersembahkan untuk:
Tuhan Yesus Kristus sebagai sumber berkat dan pengharapanku
Bapak, Ibu, dan Adik serta keluarga tercinta yang selalu mendukungku
Arsa, sahabat dan teman-teman tercinta
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
segala rahmat dan berkat kasih-Nya yang melimpah sehingga penulis dapat
menyelesaikan penelitian skripsi yang berjudul “UJI AKTIVITAS ANTIBAKTERI FRAKSI DARI EKSTRAK KLOROFORM DAUN Piper crocatum Ruiz & Pav. TERHADAP Staphylococcus aureus RESISTEN AMPICILLIN” dengan baik.
Penulis menyadari dalam penyusunan skripsi ini mendapatkan banyak
bantuan, dukungan, bimbingan, dan doa dari berbagai pihak. Pada kesempatan ini,
penulis ingin mengucapkan terima kasih kepada:
1. Tuhan Yesus Kristus dan Bunda Maria karena atas berkat-Nya yang luar
biasa sehingga penulis diberikan kelancaran untuk menyelesaikan skripsi
ini.
2. Ibu Dr. Yustina Sri Hartini, Apt. selaku dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta, Dosen Pembimbing Akademik,
sekaligus Dosen Pembimbing skripsi yang dengan sabar telah memberikan
dukungan, bimbingan, saran dan doa selama proses penyusunan skripsi ini
sehingga dapat terselesaikan dengan baik.
3. Ibu Damiana Sapta Candrasari, S.Si., M.Sc., selaku Kepala Laboratorium
Fakultas Farmasi Universitas Sanata Dharma sekaligus dosen penguji
skripsi atas kritik dan saran yang diberikan selama penyusunan skripsi.
4. Ibu Dr. Erna Tri Wulandari, Apt. selaku dosen penguji skripsi atas kritik
dan saran yang diberikan selama penyusunan skripsi.
5. Mas Antonius Dwi Priyana dan Mas Sarwanto selaku Sekretariat S1
Fakultas Farmasi Universitas Sanata Dharma yang memberikan informasi
mengenai perkuliahan dan proses pengerjaan skripsi.
6. Pak Wagiran dan Mbak Intan yang telah membantu proses pengerjaan
ix ABSTRAK
Latar belakang : Penyakit infeksi masih merupakan salah satu masalah kesehatan masyarakat yang penting dan biasa diobati dengan antibiotik. Penggunaan antibiotik yang tidak rasional menyebabkan terjadinya resistensi antibiotik. Salah satu bakteri yang mengalami resistensi adalah Staphylococcus aureus. Adanya resistensi bakteri mendorong penggalian obat dari bahan alam. Piper crocatum Ruiz & Pav. adalah salah satu bahan alam yang memiliki aktivitas antibakteri. Dalam penelitian ini, fraksi hasil VLC dari ekstrak kloroform daun Piper crocatum Ruiz & Pav. diuji untuk melihat aktivitas antibakteri terhadap Staphylococcus aureus resisten ampicillin.
Metode : Uji aktivitas antibakteri dilakukan dengan metode difusi sumuran, dilanjutkan dengan uji KHM dan KBM secara dilusi cair, serta metode bioautografi terhadap bakteri Staphylococcus aureus resisten ampicillin. Uji statistic dilakukan menggunakan Kruskal-Wallis dilanjutkan dengan Mann-Whitney.
Hasil : Hasil uji aktivitas antibakteri fraksi dari ekstrak kloroform daun Piper crocatum Ruiz & Pav. menunjukkan zona hambat yang dihasilkan oleh fraksi 2 adalah 10,3333±0,7638 mm dan zona hambat yang dihasilkan oleh fraksi 3 adalah 7,8333±0,5774 mm, dengan nilai KBM 125 mg/ml. Analisis statistik dengan post hoc Mann-Whitney menunjukkan adanya perbedaan bermakna dari tiap perlakuan dengan nilai signifikansi <0,05.
Kesimpulan : fraksi 2 dari ekstrak kloroform daun Piper crocatum Ruiz & Pav. memiliki aktivitas antibakteri dengan diameter zona hambat 10,3333±0,7638 mm dan nilai KBM 125 mg/ml.
x ABSTRACT
Background : Infection is one of the most important public health problems and is usually avoided by antibiotics. Irrational use of antibiotics causes antibiotic resistance, such as in the bacteria Staphylococcus aureus. Therefore, it is necessary to explore antibacterial drugs from natural ingredients. Piper crocatum Ruiz & Pav. Is a plant species that contain natural ingredient with antibacterial activity. In this study, the chloroform extract fraction of the Piper crocatum Ruiz & Pav. leaf was tested to determine its antibacterial activity against ampicillin-resistant Staphylococcus aureus.
Metode : Diffusion method was used to test the antibacterial activity, liquid dilution method used to determine MIC and MBC, bioautography was apply on ampicillin-resistant Staphylococcus aureus bacteria. Data of inhibition zone was statistically tested with Kruskal-Wallis followed by Mann-Whitney.
Result : The results of the antibacterial activity test of the Piper crocatum Ruiz & Pav. leaf chloroform extract showed that the inhibition zone produced by fraction 2 was 10.3333 ± 0.7638 mm and the inhibition zone produced by fraction 3 was 7.8333 ± 0.5774 mm, with a KBM value of 125 mg / ml. The post hoc Mann-Whitney statistical analysis showed a significant difference of each treatment with the significance value <0.05.
Conclusion : fraction 2 of Piper crocatum Ruiz & Pav. leaf chloroform extract has antibacterial activity with inhibitory zone diameter of 10.3333 ± 0.7638 mm and KBM value of 125 mg / ml.
xi DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI... vi
PRAKATA ... vii
ABSTRAK ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
METODE PENELITIAN ... 2
HASIL DAN PEMBAHASAN ... 8
KESIMPULAN DAN SARAN ... 20
DAFTAR PUSTAKA ... 21
LAMPIRAN ... 24
xii
DAFTAR TABEL
xiii
DAFTAR GAMBAR
Gambar 1. Profil KLT fraksi VLC dari ekstrak kloroform daun sirih merah ... 11
Gambar 2. Uji resistensi bakteri Staphyloccous aureus ... 12
Gambar 3. Kontrol media dan kontrol pertumbuhan ... 12
Gambar 4. Zona hambat fraksi VLC dari ekstrak kloroform daun sirih merah 13 Gambar 5. Uji KHM fraksi VLC dari ekstrak kloroform daun sirih merah ... 14
Gambar 6. Uji KBM fraksi VLC dari ekstrak kloroform daun sirih merah ... 15
Gambar 7. Fraksi pada plat KLT untuk uji bioautografi kontak ... 15
Gambar 8. Uji aktivitas antibakteri dengan metode bioautografi kontak ... 16
Gambar 9. Uji kualitatif senyawa flavonoid dengan uji tabung ... 17
xiv
DAFTAR LAMPIRAN
Lampiran 1. Surat determinasi tanaman Piper crocatum Ruiz & Pav. ... 24
Lampiran 2. Surat identifikasi bakteri Staphyloccous aureus ... 25
Lampiran 3. Sertifikat pengujian statistik dengan SPSS ... 26
1
PENDAHULUAN
Penyakit infeksi masih merupakan salah satu masalah kesehatan
masyarakat yang penting, khususnya di negara berkembang. Salah satu obat
andalan untuk mengatasi masalah tersebut adalah antimikroba antara lain
antibakteri/antibiotik, antijamur, antivirus, antiprotozoa (Kemenkes RI, 2011).
Berbagai jenis antibiotik digunakan untuk menanggulangi penyakit infeksi.
Penggunaan antibiotik yang tidak rasional sebagai terapi terutama pada pasien
kelompok usia 0-14 tahun dapat berisiko resistensi antibiotik dini. Penggunaan
obat dikatakan rasional apabila memenuhi syarat yaitu tepat indikasi pasien, tepat
pemilihan obat, tepat penilaian kondisi pasien, tepat dosis, tepat lama pemberian,
dan tepat interval waktu pemberian (Kemenkes RI, 2011).
Salah satu permasalahan yang cukup meresahkan adalah munculnya
resistensi bakteri Staphylococcus aureus terhadap antibiotik golongan penisilin
atau biasa disebut dengan bakteri Methicillin Resistant Staphylococcus aureus
(MRSA). MRSA menyebabkan berbagai penyakit, dari infeksi kulit dan luka
hingga pneumonia dan infeksi aliran darah yang dapat menyebabkan sepsis dan
kematian (CDC, 2013). Menurut data Centers for Disease Control and Prevention
(2013), terdapat 80.461 kasus infeksi MRSA dan sebanyak 11.285 kasus kematian
terjadi pada tahun 2013. Adanya bakteri yang resisten terhadap antibakteri
mendorong pentingnya penggalian sumber obat-obatan antimikroba dari bahan
alam (Hertiani, 2003). Penggunaan obat herbal meningkat di masyarakat
khususnya di negara berkembang dan dipercaya dapat mengobati berbagai
penyakit, salah satunya adalah penyakit infeksi (Wendakoon, Calderon, dan
Gagnon, 2012).
Sirih merah (Piper crocatum Ruiz & Pav) adalah salah satu tumbuhan
yang digunakan sebagai obat alternatif oleh masyarakat. Daun sirih merah
mengandung senyawa golongan flavonoid, alkaloid, tanin-polifenol,
steroi-terpenoid, dan saponin (Parfati dan Windono, 2016). Senyawa-senyawa yang
terdapat pada daun sirih merah memiliki aktivitas antimikroba terhadap bakteri
2
sebagai antibakteri untuk mengatasi infeksi (Wardani dkk, 2012). Hasil penelitian
yang dilakukan oleh Soleha, dkk. (2015) menunjukkan bahwa ekstrak daun sirih
merah lebih kuat menghambat pertumbuhan bakteri gram positif yaitu
Staphylococcus aureus dibandingkan dengan bakteri gram negatif yaitu
Salmonella typhi. Juliantina, dkk. (2010), melaporkan bahwa ekstrak etanol daun
sirih merah dengan kuat dapat menghambat pertumbuhan bakteri Staphylococcus
aureus dan Escherchia coli dengan menggunakan metode dilusi. Hasil penelitian
yang dilakukan oleh Thie (2018) menunjukkan bahwa ekstrak kloroform daun
sirih merah memiliki zona hambat terhadap bakteri Staphylococcus aureus
resisten ampicillin, dengan nilai KHM 12,5 mg/ml dan nilai KBM 50 mg/ml.
Berdasarkan uraian diatas, peneliti ingin mengetahui potensi fraksi hasil VLC dari
ekstrak kloroform daun sirih merah dalam penghambatan pertumbuhan bakteri
Staphylococcus aureus resisten antibiotik dengan metode difusi sumuran.
Dilakukan juga uji KHM dan KBM terhadap fraksi teraktif hasil VLC dari ekstrak
kloroform daun sirih merah. Selain itu dalam penelitian ini dilakukan uji
bioautografi kontak terhadap fraksi teraktif hasil VLC ekstrak kloroform daun
sirih merah untuk melihat aktivitas antibakteri yang terdapat didalamnya serta
dilakukan uji kualitatif senyawa flavonoid untuk melihat ada tidaknya senyawa
flavonoid pada fraksi tersebut.
METODE PENELITIAN Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah daun sirih merah,
bakteri Staphylococcus aureus, media Nutrient Agar, Nutrient Broth, DMSO
100%, Buffer Pepton Water, etil asetat, n-heksana, kloroform, metanol, aquadest
steril, antibiotik ciprofloxacin, cakram ampisilin 10µg, standar kuarsetin, dan
alkohol 70%.
Alat yang digunakan dalam penelitian ini adalah erlenmeyer, tabung
reaksi, corong, labu ukur, pipet tetes, glasfirn, pipet volume, cawan petri, batang
3
autoclave (Model KT-40, ALP Co. Ltd Hamurasi Tokyo Japan, oven (Memmert),
rotary evaporator, incubator, microbiology safety cabinet, bunsen, jarum ose,
spreader, flakon, chamber, mikrokapiler, kertas saring, lempeng KLT, timbangan
analitik, mistar, ayakan no 50, vortex.
Penyiapan Bahan Uji dan Determinasi Tanaman Sirih
Tanaman sirih merah didapatkan dari Kabupaten Sleman, Yogyakarta.
Bagian yang diambil adalah bagian daun. Daun sirih merah yang dipilih adalah
daun sirih dengan permukaan halus, tidak berlubang, berwarna merah keperakan,
dan berdiameter 5-8cm. Determinasi tanaman dilakukan di Laboratorium
Sistematika Tumbuhan, Fakultas Biologi, Universitas Gadjah Mada, Yogyakarta.
Pembuatan Simplisia Daun Sirih
Daun sirih merah yang telah dikumpulkan dipisahkan dari pengotor,
dicuci dengan air mengalir sebanyak 3 kali, kemudian dikeringkankan dengan
oven dengan suhu 40°C. Daun yang telah kering kemudian dipisahkan dari bahan
pengganggu, lalu diserbuk dengan blender dan di ayak dengan pengayak nomor
50, dan kemudian disimpan (Direktorat Jendral Bina Kefarmasian dan Alat
Kesehatan RI, 2011).
Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode destilasi toluena
(Direktorat Jendral Bina Kefarmasian dan Alat Kesehatan RI, 2011). Pereaksi
toluena jenuh air disiapkan dengan cara mengocok toluene P dengan sedikit air
kemudian air dipisahkan menggunakan corong pisah. Simplisia kering sebanyak
10 gram dan 200 ml dimasukkan toluena jenuh air ke dalam labu. Toluena jenuh
air dimasukkan ke tabung penerima melalui pendingin sampai leher alat
penampung dan labu dipanaskan selama 15 menit. Setelah toluena mulai
mendidih, penyulingan diatur dengan kecepatan lebih kurang 2 tetes tiap detik,
hingga sebagian besar air tersuling, kemudian kecepatan penyulingan dinaikkan
4
didinginkan hingga suhu ruang dan kemudian volume air dibaca setelah air dan
toluena terpisah.
Kadar air dihitung dengan rumus:
Pembuatan Ekstrak Kloroform Daun Sirih Merah
Pembuatan ekstrak kloroform daun sirih merah dilakukan dengan
maserasi menurut Badan Pengawas Obat dan Makanan RI (2010) dengan jumlah
serbuk yang dimaserasi adalah 10 gram dan pelarut kloroform sebanyak 100 ml.
Serbuk daun sirih merah sebanyak 10 gram (10 bagian serbuk) dimasukkan ke
dalam Erlenmeyer kemudian dilarutkan dalam 100 ml pelarut kloroform. Maserasi
dilakukan selama 1x24 jam dengan bantuan shaker. Hasil maserat yang diperoleh
disaring dengan corong Buchner yang dilapisi kertas saring Whatman No. 1
dengan menggunakan bantuan pompa vakum. Serbuk hasil penyaringan
dimaserasi dengan pelarut baru sebanyak 75 ml selama 1x24 jam. Kemudian
diremaserasi sekali lagi menggunakan 25 ml pelarut baru selama 1x24 jam.
Maserat pertama, kedua, dan ketiga kemudian diuapkan dengan rotary evaporator
pada suhu 60°C untuk menghilangkan pelarut pada ekstrak. Selanjutnya ekstrak
diletakkan pada cawan porselen dan diuapkan kembali dengan menggunakan
waterbath pada suhu 60°C untuk menghilangkan sisa pelarut yang mungkin
masih ada dalam ekstrak. Ekstrak yang didapat merupakan ekstrak kental dengan
bobot tetap sesuai yang dipersyaratkan.
Rendemen dihitung dengan rumus:
Pembuatan Fraksi dari Ekstrak Kloroform Daun Sirih Merah
Ekstrak klorofom daun sirih merah difraksinasi lebih lanjut dengan
metode Vacuum Liquid Chromatography (VLC). Sintered Glass Buchner dan
5
Kertas saring dimasukkan ke dalam kolom sesuai diameter kolom. Sillica Gel
GF254 dimasukkan ke dalam kolom sedikit demi sedikit sambil di vakum sebagai
fase diam. Bobot Silica Gel GF254 yang digunakan sebagai fase diam adalah
sebanyak ± 4 kali bobot esktrak yang didapat. Kemudian Sillica Gel GF254
disiapkan lagi sebanyak ± 2 kali bobot esktrak dan dicampurkan dengan ekstrak
kering menggunakan mortir dan stamper sambil diaduk perlahan hingga
didapatkan campuran homogen dan kering (free flowing). Serbuk ekstrak free
flowing dimasukkan sedikit demi sedikit ke dalam sintered glass Buchner diatas
fase diam sambil divakum. Dua lembar kertas saring sebesar diameter kolom
dimasukkan diatas serbuk ekstrak free flowing. Sebanyak 200ml pelarut
dituangkan secara perlahan-lahan pada permukaan kertas saring melalui dinding
sambil divakum. Pelarut yang digunakan berturut-turut metanol, metanol -
kloroform (7:3 v/v), metanol - kloroform (5:5 v/v), metanol - kloroform (3:7 v/v),
dan kloroform. Hasil fraksinasi ditampung dalam cawan porselen. Fraksi yang
didapat kemudian dianalisis menggunakan KLT dengan fase diam silika gel
GF254, fase gerak metanol : klorofom dengan perbandingan 9:1, dan deteksi UV
dengan panjang gelombang 365 nm. Fraksi dengan profil KLT yang mirip akan
digabungkan menjadi satu fraksi.
Preparasi Bakteri Uji
Bakteri Staphylococcus aureus disiapkan dengan cara kultur bakteri
diambil dengan jarum ose dan diinokulasikan ke dalam media Nutrient Broth
(NB) steril, setelah itu diinkubasi pada suhu 37oC selama 20 jam untuk
mendapatkan stok bakteri uji (CLSI, 2017).
Berikutnya dilakukan pengujian sebagai penegasan bahwa bakteri
tersebut adalah bakteri yang resisten terhadap ampicillin. Sebanyak 5 ml Nutrient
Agar (NA) steril dituangkan ke dalam cawan petri steril, dibiarkan memadat
sebagai base layer agar. Sebanyak 1 ml bakteri uji diinokulasikan ke dalam 15 ml
media NA secara pour plate, kemudian dituangkan secara merata sebagai seed
layer agar di atas base layer agar, dan dibiarkan memadat. Paper disk berisi
6
diinkubasi selama 24 jam kemudian diamati zona jernih yang terbentuk. Bakteri
dikatakan z h h h ≤28 , z h ≥29 CLSI, 2017).
Apabila sudah dipastikan bahwa bakteri yang didapatkan adalah bakteri
resisten, stok bakteri diambil dan diencerkan dengan Bufferd Pepton Water
(BPW) kemudian disetarakan kekeruhnnya dengan larutan Mac Farland 0,5
menggunakan alat nephelometer.
Pembuatan Kontrol Pertumbuhan Bakteri
Sebanyak 5 ml Nutrient Agar (NA) steril dituangkan ke dalam cawan
petri steril, dibiarkan memadat sebagai base layer agar. Kemudian diambil 1 ml
suspensi bakteri uji, diinokulasikan ke dalam 15 ml media NA secara pour plate,
kemudian dituangkan secara merata sebagai seed layer agar di atas base layer
agar, dan dibiarkan memadat.
Pembuatan Kontrol Kontaminasi Media
Sebanyak 20 ml media Nutrient Agar (NA) dituangkan ke dalam petri
steril dan ditunggu hingga memadat.
Pembuatan Larutan Stok Antibiotik
Tablet ciprofloxacin 500 mg digerus dan dilarutkan dalam 100 ml
aquadest sehingga didapatkan konsentrasi 5mg/ml. Kemudian diambil 1 ml dan
ditambahkan 100 ml aquadest steril sehingga didapatkan konsentrasi 50 µm/ml.
Uji Daya Antibakteri Fraksi dari Ekstrak Kloroform Daun Sirih Merah Sebanyak 5 ml Nutrient Agar (NA) steril dituangkan ke dalam cawan
petri steril, dibiarkan memadat sebagai base layer agar. Kemudian diambil 1 ml
suspensi bakteri uji, diinokulasikan ke dalam 15 ml media Nutrient Agar (NA)
dalam tabung reaksi dan divortex. NA yang telah dicampur dengan suspensi
bakteri tersebut kemudian dituang ke dalam petri steril sebagai seed layer agar di
atas base layer agar kemudian digoyang-goyangkan hingga merata dan dibiarkan
7
berdiameter 6 mm pada NA yang sudah disiapkan. Setiap sumuran diberikan
masing-masing 50 µl larutan kontrol positif (antibiotik), larutan kontrol negatif
(pelarut), dan dua fraksi uji dengan konsentrasi yang sama yaitu 250 mg/ml.
Kemudian dilihat fraksi yang memiliki aktivitas antibakteri paling baik. Aktivitas
antibakteri yang dihasilkan dilihat dari zona hambat yang dihasilkan. Zona
hambat yang diukur adalah zona disekitar sumuran yang keruh tetapi sudah
berkurang kekeruhannya dibandingkan dengan daerah sekitarnya.
Preparasi Fraksi Teraktif
Fraksi yang memiliki aktivitas antibakteri paling baik dibuat variasi
konsetrasi 250 mg/ml; 125 mg/ml; 62,5 mg/ml; 31,3 mg/ml; 15,6 mg/ml; 7,8
mg/ml; 3,9 mg/ml; dan 1,9 mg/ml. Pembuatan variasi konsentrasi ini dilakukan
dengan cara pengenceran terhadap fraksi menggunakan pelarut DMSO 100%.
Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM)
Sebanyak 8 tabung reaksi steril disiapkan kemudian 1 ml suspensi bakteri
diinokulasikan ke dalam 20 ml Nutrient Broth (NB) dan ditambahkan 8 variasi
konsentrasi ekstrak kemudian divortex kemudian diinkubasi selama 24 jam.
Setelah itu kekeruhannya dibandingkan menggunakan kontrol media dan kontrol
bakteri uji untuk menentukan KHM.
Sebanyak 20 ml Nutrient Agar (NA) dituangkan ke dalam cawan petri
steril dan dibiarkan memadat. Dibuat masing-masing 4 kuadran. Masing-masing
tabung reaksi yang berisi bakteri dan variasi konsentrasi fraksi kemudian di streak
plate pada masing-masing kuadran. Variasi konsentrasi terendah dari fraksi yang
tidak menunjukkan adanya pertumbuhan bakteri ditentukan sebagai KBM.
Identifikasi Kualitatif Senyawa Flavonoid
Fraksi dilarutkan dalam metanol 50% (1-2 mL), dengan pemanasan
kemudian ditambahkan logam Mg dan 5-6 tetes asam hidroklorida, larutan akan
menjadi merah apabila mengandung flavonol dan berwarna oranye untuk
8
(9:1 v/v) sebagai fase gerak, adanya flavonoid ditunjukkan dengan terbentuknya
warna kuning pada sinar tampak, pemadaman pada sinar UV 254 nm, dan warna
hitam, kuning, biru atau hijau pada sinar UV 365 nm (Hartini, 2013). Kemudian
kromatogram disemprot dengan FeCl3.
Uji Bioautografi
Senyawa antibakteri pada fraksi teraktif hasil VLC dari ekstrak
kloroform daun sirih merah dideteksi dengan metode bioautografi kontak, dengan
KLT fase diam Silica Gel GF254 dan fase gerak etil asetat : toluen (9:1 v/v). Fraksi
yang memiliki daya antibakteri paling tinggi kemudian ditotolkan pada plat KLT
dan dielusi dalam chamber yang berisi fase gerak yang sudah dibuat. Plat KLT
kemudian ditempelkan pada media NA yang sudah diinokulasikan bakteri dan
sudah memadat. Ditunggu 45 menit kemudian plat diangkat. Media NA kemudian
diinkubasi selama 24 jam untuk melihat daya hambatnya.
Teknik Analisis Data Penelitian
Data analisis seecara statistik diawali dengan menguji distribusi
normalitas dengan uji Shapiro-Wilk. Uji homogenitas dilakukan dengan uji
Levene. Apabila data yang didapatkan terdistribusi normal (nilai P > 0,05), maka
dilanjutkan dengan uji One Way ANOVA, dan apabila ditemukan perbedaan
maka dilanjutkan dengan Post-Hoc Tukey pada taraf kepercayaan 95%.
Sedangkan apabila didapakan data yang tidak terdistribusi normal (nilai P < 0,05),
maka dilanjutkan dengan uji Kurskal-Wallis, dan apabila ditemukan perbedaan
maka dilanjutkan dengan uji Mann-Whitney pada taraf kepercayaan 95%.
HASIL DAN PEMBAHASAN
Determinasi tanaman bertujuan untuk menghindari kesalahan dalam
penelitian dan memastikan bahwa tanaman yang digunakan adalah sirih merah
(Piper crocatum Ruiz & Pav.). Determinasi dilakukan dengan melihat ciri-ciri
tanaman yang digunakan dalam penelitian ini. Determinasi ini dilakukan di
Laboratorium Sistematika Tumbuhan Fakultas Biologi Universitas Gadjah Mada,
9
dalam penelitian ini merupakan tanaman sirih merah (Piper crocatum Ruiz &
Pav.) seperti yang tercantum dalam surat keterangan (Lampiran 1).
Sirih merah yang dipanen dipisahkan antara salur dan daunnya,
ditimbang, lalu dilakukan sortasi basah untuk memisahkan dari kotoran dan bahan
asing, selanjutnya ditimbang kembali. Daun sirih merah kemudian dicuci dengan
air mengalir lalu dipotong-potong dan dikeringkan. Pengeringan bertujuan untuk
mengurangi kadar air pada daun sirih merah dan dilakukan hingga daun sirih
merah mudah hancur saat diremas. Selanjutnya simplisia kering diserbuk dan
diayak. Hasil penyerbukan simplisia yang didapatkan adalah 236 gram.
Penetapan kadar air yang dilakukan mengacu pada Farmakope Herbal
(2011) yaitu dengan destilasi toluena. Serbuk simplisia daun sirih merah yang
ditimbang adalah 10,2294 gram dan volume air yang didapatkan adalah 0,5 ml
sehingga kadar air serbuk simplisia daun sirih merah yang didapatkan yaitu
4,8879%. Hal ini berarti bahwa serbuk simplisia yang digunakan sudah memenuhi h ≤ .
Metode yang dilakukan untuk pembuatan ekstrak kloroform daun sirih
merah adalah maserasi. Pada metode maserasi, serbuk simplisia akan kontak
dengan pelarut, dan dengan bantuan pengadukan maka senyawa aktif simplisia
akan larut dan berpindah ke pelarut. Daun sirih merah mengandung senyawa
thermolabile seperti flavonoid dan minyak atsiri sehingga metode maserasi dipilih
untuk porses ekstraksi karena metode ini sederhana dan tidak membutuhkan
pemanasan sehingga cocok untuk senyawa thermolabile (Pandey, 2014). Hasil
maserasi kemudian disaring menggunakan corong buchner dan dengan bantuan
vakum. Hasil penyaringan kemudian diuapkan dengan rotary evaporator pada
suhu 60°C untuk menguapkan pelarut pada ekstrak. Setelah didapatkan ekstrak
kental kemudian dilakukan bobot tetap untuk memastikan bahwa pelarut yang
digunakan sudah tidak ada lagi didalam ekstrak. Bobot tetap diperoleh apabila
perbedaan dua kali penimbangan selama 1jam berturut-turut tidak melebihi 0,5mg
10
kloroform yang didapatkan adalah 19,3952 gram dan rendemen yang didapatkan
adalah 9,6902 %.
Ekstrak klorofom daun sirih merah difraksinasi lebih lanjut dengan
metode Vacuum Liquid Chromatography (VLC). Fraksinasi dilakukan dengan
metode VLC karena metode ini dapat digunakan untuk fraksinasi dengan jumlah
ekstrak dalam skala besar dan dalam waktu yang singkat. Pertama-tama Sintered
Glass Buchner dan Erlenmeyer serta vakum yang digunakan untuk fraksinasi
disiapkan dan dipasang. Kertas saring dimasukkan ke dalam kolom sesuai
diameter kolom. Sillica Gel GF254 dimasukkan ke dalam kolom sedikit demi
sedikit sambil di vakum sebagai fase diam. Bobot Silica Gel GF254 yang
digunakan sebagai fase diam adalah sebanyak ± 4 kali bobot esktrak yang didapat.
Kemudian Sillica Gel GF254 disiapkan lagi sebanyak ± 2 kali bobot esktrak dan
dicampurkan dengan ekstrak kering menggunakan mortir dan stamper sambil
diaduk perlahan hingga didapatkan campuran homogen dan kering (free flowing).
Serbuk ekstrak free flowing dimasukkan sedikit demi sedikit ke dalam sintered
glass Buchner diatas fase diam sambil divakum. Dua lembar kertas saring sebesar
diameter kolom dimasukkan diatas serbuk ekstrak free flowing. Sebanyak 200ml
pelarut dituangkan secara perlahan-lahan pada permukaan kertas saring melalui
dinding sambil divakum. Pelarut yang digunakan berturut-turut metanol (fraksi a),
metanol - kloroform (7:3) (fraksi b), metanol - kloroform (5:5) (fraksi c), metanol
- kloroform (3:7) (fraksi d), dan kloroform (fraksi e). Hasil fraksinasi ditampung
dalam cawan porselen. Fraksi yang didapat kemudian dianalisis menggunakan
KLT dengan fase diam silika gel GF254, fase gerak metanol : kloroform dengan
perbandingan 9:1, dan deteksi UV 365 nm. Fase gerak metanol : kloroform
dengan perbandingan 9:1 yang digunakan untuk metode KLT ini dipilih setelah
sebelumnya dilakukan optimasi fase gerak. Fraksi yang memiliki profil KLT yang
mirip akan digabungkan menjadi satu fraksi. Berdasarkan kemiripan profil KLT,
dilihat dari warna, bercak, posisi, dan bentuknya, fraksi tersebut digabungkan
menjadi tiga fraksi yaitu fraksi 1 yang terdiri dari fraksi a; fraksi 2 yang terdiri
11
tersebut kemudian diuapkan dengan rotary evaporator pada suhu 60°C untuk
menguapkan pelarut pada fraksi.
(a) UV 254 nm (b) UV 365 nm
Gambar 1. Profil KLT fraksi VLC dari ekstrak kloroform daun sirih merah
Keterangan: a. fraksi dengan fase gerak metanol; b. fraksi dengan fase gerak metanol - kloroform (7:3); c. fraksi dengan fase gerak metanol - kloroform (5:5); d. fraksi dengan fase gerak metanol - kloroform (3:7); e. fraksi dengan fase gerak kloroform
Selanjutnya dilakukan uji aktivitas antibakteri untuk melihat fraksi
teraktif dari tiga fraksi yang didapatkan. Fraksi 1 tidak dilanjutkan untuk
penelitian ini karena jumlahnya tidak memenuhi untuk pengujian. Masing-masing
fraksi diencerkan menggunakan DMSO 100% hingga konsentrasi 250 mg/ml.
Pengujian fraksi teraktif dilakukan dengan difusi sumuran. Bakteri yang
digunakan dalam penelitian ini adalah Staphylococcus aureus resisten ampicillin.
Bakteri Staphylococcus aureus dikatakan resisten terhadap ampicillin apabila z h ≤ 28 dan dikatakan intermediet dan sensitive bila z h ≥29 (CLSI, 2017). Zona hambat yang didapatkan adalah 1 mm sehingga disimpulkan bahwa bakteri uji telah resisten terhadap ampicillin
12
Gambar 2. Uji resistensi bakteri Staphyloccous aureus
Kontrol media (Gambar 3a) yang dibuat tampak bening yang
menunjukkan bahwa tidak terdapat kontaminasi. Pada kontrol pertumbuhan
(Gambar 3b) bakteri tampak keruh merata yang berarti bahwa bakteri
Staphylococcus aureus resisten ampicillin dapat tumbuh pada media Nutrient
Agar (NA).
(a) (b)
Gambar 3. Kontrol media (a) dan kontrol pertumbuhan (b) Pada setiap petri dibuat 4 sumuran yang masing-masing berisi kontrol
positif yaitu ciprofloxacin 50µg/ml, kontrol negatif yaitu DMSO 100%, fraksi 2,
dan fraksi 3 dengan konsentrasi masing-masing 250mg/ml. Potensi antibakteri
pada metode difusi dilihat berdasarkan pengamatan zona jernih yang terbentuk di
sekitar tempat penginokulasian senyawa karena terdifusinya senyawa tersebut
(Jawetz, dkk., 2005). Dari hasil pengamatan diketahui bahwa fraksi 2 memiliki
aktivitas antibakteri yang lebih besar daripada fraksi 3. Hasil pengamatan
menunjukkan juga menunjukkan bahwa DMSO 100% tidak menghambat
13
sehingga dapat digunakan sebagai pelarut. Hal ini serupa dengan penelitian yang
dilakukan oleh Cahyono (2013) dan Yulianingsih (2012), pelarut DMSO 100%
tidak memiliki daya hambat terhadap bakteri, dilihat dari tidak terbentuknya zona
hambat disekitar sumuran yang berisi DMSO 100%.
Gambar 4. Zona hambat fraksi dari ekstrak kloroform daun sirih merah Keterangan gambar: 1. DMSO 100% ; 2. Ciprofloxacin 50µm/ml ; 3. Fraksi 2 konsentrasi 250mg/ml ; 4. Fraksi 3 konsentrasi 250mg/ml
Dilakukan 3 kali replikasi pada uji aktivitas antibakteri dengan data sebagai berikut:
Tabel 1. Hasil uji aktivitas antibakteri Replikasi Kontrol Positif Kontrol
Negatif
Mean±SD 17, 6667±1, 4434 0±0 10,3333±0,7638 7,8333±0,5774
Setelah diketahui bahwa fraksi 2 adalah fraksi teraktif maka dilanjutkan
pengujian selanjutnya. Dilakukan pengujian KHM dan KBM pada fraksi 2 hasil
VLC dari ekstrak kloroform daun sirih merah. Penentuan KHM dilakukan
menggunakan dilusi cair. Penentuan KHM dilihat berdasarkan pertumbuhan
bakteri pada media NB dengan cara membandingkan dengan kontrol media dan
14
masing-masing tabung terlihat keruh akibat penambahan masing-masing variasi
konsentrasi fraksi sehingga pengamatan tidak bisa terlihat jelas (Gambar 5).
Gambar 5. Uji KHM fraksi 2 VLC dari ekstrak kloroform daun sirih merah Keterangan: 1. Kontrol media ; 2. Kontrol pertumbuhan ; 3. Fraksi 2 konsentrasi 250mg/ml ; 4. Fraksi 2 konsentrasi 125mg/ml ; 5. Fraksi 2 konsentrasi 62,5mg/ml ; 6. Fraksi 2 konsentrasi 31,25mg/ml ; 7. Fraksi 2 konsentrasi 15,625mg/ml ; 8. Fraksi 2 konsentrasi 7,8125mg/ml ; 9. Fraksi 2 konsentrasi 3,90625mg/ml ; 10. Fraksi 2 konsentrasi 1,953125mg/ml
Kemudian dilanjutkan penentuan nilai KBM dengan cara sub kultur dari
media NB ke dalam media NA steril secara streak plate lalu diinkubasi selama 24
jam. Hasil pengamatan menunjukkan bahwa pada konsentrasi 250mg/ml dan
125mg/ml tidak menunjukkan adanya pertumbuhan bakteri sehingga nilai KBM
dari fraksi 2 ekstrak kloroform daun sirih merah adalah pada konsenstrasi
125mg/ml (Gambar 6). Menurut penelitian yang dilakukan oleh Thie (2018),
ekstrak kloroform daun sirih merah memiliki nilai KBM 50mg/ml. Hal ini
menunjukkan bahwa daya antibakteri pada ekstrak kloroform daun sirih merah
lebih baik daripada fraksi dari ekstrak kloroform daun sirih merah. Hal ini bisa
dikarenakan adanya aktivitas antibakteri yang sinergi dari beberapa senyawa yang
15
Gambar 6. Uji KBM fraksi 2 VLC dari ekstrak kloroform daun sirih merah
Keterangan: 1. Fraksi 2 konsentrasi 250mg/ml ; 2. Fraksi 2 konsentrasi 125mg/ml ; 3. Fraksi 2 konsentrasi 62,5mg/ml ; 4. Fraksi 2 konsentrasi 31,25mg/ml
Metode bioautografi merupakan metode kombinasi KLT dengan deteksi
biologi (Marston, 2011). Metode bioautografi dapat digunakan untuk mendeteksi
komponen senyawa aktif pada suatu sampel (Chomnawang, et al, 2009). Pada
metode bioautografi kontak, adalah dengan memindahkan senyawa antibakteri
melalui proses difusi dari plat KLT ke media agar yang sudah diinokulasikan
bakteri (Hamburger and Cordell, 1987). Fraksi yang akan diuji dengan
bioautografi kontak ditotolkan pada plat KLT (Gambar 7) kemudian ditempelkan
pada permukaan agar yang sudah diinokulasikan bakteri Staphylococcus aureus
resisten ampicillin (Gambar 8a).
(a) UV 254 nm (b) UV 365 nm
Gambar 7. Fraksi pada plat KLT untuk uji bioautografi kontak
Hasil bioautografi menunjukkan adanya aktivitas antibakteri pada fraksi
16
dapat dilihat dari adanya zona jernih yang terbentuk. Pada penelitian yang
dilakukan oleh Sudirman (2005), didapatkan 3 spot zona jernih yang menandakan
adanya aktivitas antibakteri. Tiga spot zona jernih ini dapat dihitung nilai Rf dari
masing-masing spot dan dapat dideteksi kemungkinan senyawa yang berperan
dalam pembentukan zona hambat ini. Hal ini karena adanya pemisahan antara
spot zona jernih yang dihasilkan sehingga dapat dihitung Rf dari spot-spot
tersebut lalu dibandingkan dengan kromatogram yang digunakan untuk
menentukan senyawa yang memiliki aktivitas antibakteri melalui Rf yang
didapatkan. Hasil penelitian ini berbeda dengan yang dilakukan oleh Sudirman
(2005), yaitu belum dapat ditentukan senyawa yang memiliki aktivitas antibakteri
karena zona jernih yang terbentuk tidak berbentuk spot sehingga tidak bisa
dihitung Rf dari senyawa tunggal yang memiliki aktivitas antibakteri. Hal ini
dikarenakan fraksi belum mengalami pemisahan dengan baik sehingga belum bisa
dideteksi senyawa antibakteri teraktif pada fraksi 2 ekstrak kloroform daun sirih
merah. Pada penelitian ini, fraksi yang digunakan untuk uji bioautografi kontak
adalah 10 totol fraksi. Salah satu penyebab pemisahan yang kurang baik ini bisa
dikarenakan totolan fraksi pada plat KLT yang belum kering sempurna. Hal ini
bisa diatasi dengan penggunaan hairdryer untuk pengeringan fraksi pada plat
KLT. Untuk menghindari kerusakan senyawa pada fraksi maka penggunaan
hairdryer diberi jarak sedikit jauh dari plat KLT. Hal-hal lain yang dapat
berpengaruh pada hasil bioautografi kontak adalah loading mass fraksi pada plat
KLT dan juga lamanya kontak plat KLT dengan agar.
(a) Penempelan plat KLT pada agar (b) Hasil uji bioautografi kontak
17
Selanjutnya dilakukan uji kualitatif kandungan senyawa flavonoid pada
fraksi 2 hasil VLC dari ekstrak klorofrom daun sirih merah, dilakukan 2 uji
kualitatif yaitu dengan uji tabung dan uji KLT. Pada penelitian yang dilakukan
oleh Thie (2018), pada ekstrak kloroform daun sirih merah tidak terdeteksi
adanya senyawa flavonoid. Pada penelitian ini tetap dilakukan uji kualitatif
kandungan senyawa flavonoid pada fraksi 2 hasil VLC dari ekstrak kloroform
daun sirih merah untuk melihat apakah pada fraksi tersebut terdeteksi adanya
senyawa flavonoid. Hal ini dikarenakan kandungan senyawa pada fraksi
seharusnya lebih besar daripada yang terdapat pada ekstrak.
(a) Sebelum penambahan reagen (b) sesudah penambahan reagen
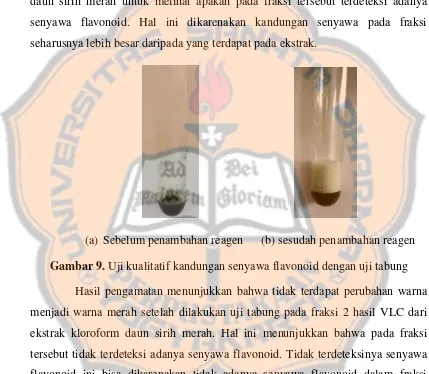
Gambar 9. Uji kualitatif kandungan senyawa flavonoid dengan uji tabung Hasil pengamatan menunjukkan bahwa tidak terdapat perubahan warna
menjadi warna merah setelah dilakukan uji tabung pada fraksi 2 hasil VLC dari
ekstrak kloroform daun sirih merah. Hal ini menunjukkan bahwa pada fraksi
tersebut tidak terdeteksi adanya senyawa flavonoid. Tidak terdeteksinya senyawa
flavonoid ini bisa dikarenakan tidak adanya senyawa flavonoid dalam fraksi
ataupun jumlah / kuantitas senyawa flavonoid yang rendah sehingga tidak dapat
terdeteksi dengan uji tabung.
Selanjutnya dilakukan uji kualitatif kandungan senyawa flavonoid pada
fraksi 2 hasil VLC dari ekstrak kloroform daun sirih merah, dan digunakan
kuersetin sebagai marker. Kuersetin adalah aglikon yang sangat tidak larut dalam
18
(Kelly, 2011). Kloroform merupakan pelarut non polar sehigga kuersetin dipilih
sebagai marker karena dapat larut dalam pelarut non polar. Jarak elusi pada KLT
yang dilakukan adalah 10 cm.
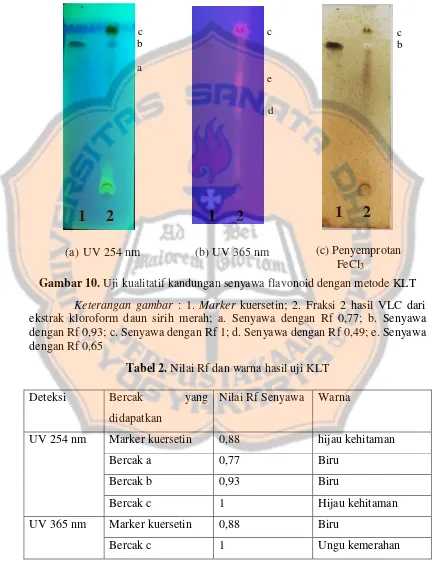
(a) UV 254 nm (b) UV 365 nm
Gambar 10. Uji kualitatif kandungan senyawa flavonoid dengan metode KLT Keterangan gambar : 1. Marker kuersetin; 2. Fraksi 2 hasil VLC dari ekstrak kloroform daun sirih merah; a. Senyawa dengan Rf 0,77; b. Senyawa dengan Rf 0,93; c. Senyawa dengan Rf 1; d. Senyawa dengan Rf 0,49; e. Senyawa dengan Rf 0,65
Tabel 2. Nilai Rf dan warna hasil uji KLT Deteksi Bercak yang
didapatkan
Nilai Rf Senyawa Warna
UV 254 nm Marker kuersetin 0,88 hijau kehitaman
19
Bercak d 0,49 Ungu kemerahan
Bercak e 0,65 Ungu kemerahan
Penyemprotan
FeCl3
Marker kuersetin 0,88 Hitam
Bercak b 0,93 Putih
Bercak c 1 Coklat kehitaman
Fase diam yang digunakan pada KLT ini adalah plat Silica Gel GF254.
Plat ini akan menampakkan bercak pada saat disinari UV 254 nm serta plat dan
bercak akan tampak gelap saat disinari UV 365 nm. Pada uji KLT didapatkan
hasil bahwa fraksi tersebut tidak terdeteksi adanya kuersetin yang merupakan
senyawa golongan flavonoid. Hal ini bisa dilihat dari hasil KLT yang
menunjukkan bahwa sampel menghasilkan warna bercak serta Rf senyawa yang
berbeda dengan marker. Fraksi 2 hasil VLC dari esktrak kloroform daun sirih
merah kemungkinan mengandung flavonoid lain selain kuersetin. Hal ini dapat
dilihat dari adanya fluorosensi pada UV 254 nm pada kromatogram yang
menandakan adanya flavonoid (Wagner and Bladt, 1996) dan berwarna kuning
(Skorek et al., 2016). Selain itu, adanya bercak ungu kemerahan pada
kromatogram dibawah UV 365 nm menunjukkan adanya klorofil ataupun
senyawa lain yang tertutupi oleh klorofil (Wagner and Bladt, 1996). Menurut
Harborne (1987), deteksi senyawa fenol dengan penambahan FeCl3 akan
menghasilkan warna hijau, merah, coklat, ungu, biru, atau hitam yang kuat.
Kromatogram setelah disemprot dengan FeCl3 coklat kehitaman menunjukkan
adanya senyawa fenol pada fraksi.
Aktivitas antibakteri yang dihasilkan oleh fraksi VLC dari ekstrak
kloroform daun sirih merah selain karena aktivitas antibakteri dari flavonoid
diduga juga karena adanya daya antibakteri dari minyak atsiri. Menurut Tiwari
(2011), pelarut kloroform dapat digunakan untuk mengekstraksi senyawa
flavonoid dan terpenoid. Minyak atsiri merupakah salah satu senyawa golongan
20
Berdasarkan analisis statistik (lampiran 4), uji Shapiro-Wilk untuk
melihat mormalitas data dengan nilai signifikansi <0,05 menunjukkan data tidak
terdistribusi secara normal. Uji Levene untuk melihat homogenitas data dengan
nilai signifikansi <0,05 menunjukkan distribusi data tidak homogen, sehingga
dilanjutkan uji Kruskal-Wallis yang menunjukkan adanya perbedaan signifikan
pada data dengan nilai signifikansi <0,05 selanjutnya dilanjutkan uji Post-Hoc
Mann-Whitney. Diameter zona hambat fraksi 2 dan fraksi 3 berbeda bermakna
secara statistik terhadap kontrol negatif dan kontrol positif. Adanya perbedaan
bermakna dengan kontrol positif dikarenakan diameter zona hambat yang
dihasilkan oleh kontrol positif jauh lebih besar daripada zona hambat yang
dihasilkan oleh fraksi 2 dan fraksi 3 yaitu 17,6667±1,4434 mm untuk kontrol
positif, 10,3333±0,7638 untuk fraksi 2, dan 7,8333±0,5774 untuk fraksi 3.
Sedangkan perbedaan bermakna dengan kontrol negatif dikarenakan tidak
dihasilkannya zona hambat oleh kontrol negatif. Hasil pengujian statistik juga
menunjukkan bahwa ada perbedaan bermakna antara zona hambat yang dihasilkan
fraksi 2 dan fraksi 3. Hal ini dikarenakan zona hambat yang dihasilkan oleh kedua
fraksi memiliki selisih yang besar. Dari hasil penelitian didapatkan bahwa fraksi 2
memiliki daya antibakteri yang lebih besar daripada fraksi 3 dengan konsentrasi
fraksi 250 mg/ml.
KESIMPULAN DAN SARAN
Fraksi dari ekstrak kloroform daun sirih merah memiliki daya antibakteri
dengan diameter zona hambat yang dihasilkan oleh fraksi 2 adalah
10,3333±0,7638 mm dan zona hambat yang dihasilkan oleh fraksi 3 adalah
7,8333±0,5774 mm, dengan nilai KBM 125 mg/ml.
Saran, pengujian dengan metode bioautografi kontak sebaiknya
digunakan untuk senyawa yang memiliki daya antibakteri kuat dan juga dilakukan
21
DAFTAR PUSTAKA
Badan Pengawas Obat dan Makanan RI, 2010. Acuan Sediaan Herbal.
Volume 5, Edisi 1, Jakarta: Badan Pengawas Obat dan Makanan, 6-8.
Cahyono, W., 2013. Aktivitas Antibakteri Kombinasi Ekstrak Etanol Daun
Sirih Merah (Piper crocatum Ruiz And Pav) dan Kloramfenikol
terhadap Bakteri Salmonella typhi, Shigella dysenteriae, dan
Staphylococcus aureus beserta Bioautografinya. Skripsi. Surakarta:
Universitas Muhammadiyah Surakarta.
Centers for Disease Control and Prevention, 2013. Antibiotic Resistance
Threats.United States: Department of Health and Human Service.
Chomnawang, M. T., Surassmo, S., Wongsariya, K., and Bunyapraphatsara,
N., 2009. Antibacterial Activity of Thai Medical Plants against
Methicillin-resistant Staphylococcus aureus. Fitoterapia, 80, 102-104.
Clinical and Laboratory Standards Institute, 2017. Performance Standards for
Antimicrobial Susceptibility Testing, 27 th Edition, 62.
Davis, W. W., and Stout, T. R., 1971., Disc Plate Methode of Microbiological
Antibiotic Assay. Journal of Microbiology. 22 (4), 666-670.
Direktorat Jendral Bina Kefarmasian Kefarmasian dan Alat Kesehatan RI,
2011. Farmakope Herbal. Suplemen II. Edisi I, Jakarta: Kementerian
Kesehatan RI, 101-102, 105-111.
Hamburger, O. M., dan Cordell, G. A., 1987. A Direct Bioutographic TLC
Assay for Compounds Possessing Antibacterial Activity. Journal of
Natural Products. 50(1), 19-22.
Harborne, J.B., 1987. Phytochemical Methods: A Guide to Modern Technique
of Plant Analysis, New York: Champman and Hall, 34.
Hartini, Y. S., Wahyuono, S., Widyarini, S., dan Yuswanto, A., 2013. Uji
Aktivitas Fagositosis Makrofag Fraksi-fraksi dari Ekstrak Metanol
Daun Sirih Merah (Piper crocatum Ruiz & Pav.) Secara In Vitro.
22
Hertiani T., Palupi, I. S., Sanliferianti, & Nurwindasari, H. D., 2003. Uji
Potensi Antimikroba terhadap S. aureus, E. coli, Shigella dysentriae,
dan Candida albicans dari Beberapa Tanaman Obat Tradisional untuk
penyakit Infeksi, Jurnal Farmasi Indonesia Pharmacon, 4 (2), 89-95.
Jawetz, Melnick, Adelberg, Brooks, Butel, dan Ornston, 2005. Mikrobiologi
Kedokteran Edisi 20, Jakarta: EGC.
Juliantina R., Farida, dkk., 2009. Manfaat Sirih Merah (Piper crocatum)
Sebagai Agen Antibakterial Terhadap Bakteri Gram Positif dan Gram
Negatif. Jurnal Kedokteran dan Kesehatan Indonesia.
Kelly, G. S., 2011. Quercetin. Alternative Medicine Review. 16 (2), 172-194.
Kementrian Kesehatan RI, 2011. Modul Penggunaan Obat Rasional. Jakarta:
Kementrian Kesesehatan RI.
Kementrian Kesehatan RI., 2011, Pedoman Umum Penggunaan Antibiotik.
Jakarta: Kementrian Kesehatan RI.
Marston, A., 2011. Thin-Layer Chromatography with Biological Detection in
Phytochemistry, Journal of Chromatography A. 1281, 2676-2683.
Pandey, A., and Tripathi, S., 2014. Concept of Standardization, Extraction and
Pre Phytochemical Screening Strategies for Herbal Drug. Journal of
Pharmacognosy and Phytochemistry, 2(5), 115-119.
Parfati, N., dan Windono, T., 2016. Sirih Merah (Piper crocatum Ruiz & Pav.)
Kajian Pustaka Aspek Botani, Kandungan Kimia, dan Aktivitas
Farmakologi. Media Pharmaceutica Indonesiana. 1(2), 106-115.
Reveny, J., 2011, Daya Antimikroba Ekstrak dan Fraksi Daun Sirih Merah
(Piper betle Linn.), Daya Antimikroba, 12 (1), 6-12.
Skorek, M., JurcZYK, k., Sajewicz, M., abd Kowalska, T., 2016. Thin-Layer
Chromatographic Identification of Flavonoids and Phenolic Acids
Contained in Cosmetic Raw Material. Journal of Liquid
Chromatograohy & Related Technologires. 39(5-6), 286-291.
Soleha, T. U., Corolia, N., and Kurniawan, S. W., 2015. The Inhibition Of
Red Betel Leaves (Piper crocatum) Towards Staphylococcus aureus
23
Sudirman, L. L., 2005., Deteksi Senyawa Antimikroba yang Diisolasi dari
Beberapa Lentinus Tropis dengan Metode Bioautografi, Hayati. 12(2),
67-72.
Thie, A. S., 2018. Uji Aktivitas Antibakteri Ekstrak Kloroform Daun Sirih
Merah (Piper crocatum Ruiz & Pav.) terhadap Staphylococcus aureus
Resisten Ampicillin. Skripsi. Yogyakarta: Universitas Sanata Dharma.
Tiwari, P., Kumar, B., Kaur, M., Kaur, G., and Kaur, H., 2011. Phytochemical
screening and Extraction: A Review. Internationale Pharmaceutica
Sciencia. 1(1), 98-106.
Wagner, H., and Bladt, S. 1996. Plant Drug Analysis, A Thin Layer
Chromatography Atlas, 2nd Ed., Berlin: Springer Verlag, 195-197.
Wardani, R, K., Tjahjaningsih, W., & Rahardja, B, S., 2012. Uji Eefektifitas
Ekstrak Daun Sirih Merah (Piper rocatum) terhadap Bakteri
Aeromonas hydrophila Secara In Vitro, Jurnal Ilmiah Perikanan dan
Kelautan, 4 (1), 59-64.
Wendakoon, C., Calderon, P., and Gagnon, D., 2012. Evaluation of Selected
Medicinal Plants Extracted in Different Ethanol Concentrations for
Antibacterial Activity against Human Pathogens, Journal of
Medicinally Active Plants. 1, 60-68.
Yulianingsih, S.N., 2012, Aktivits Antibakteri Ekstrak Etanol Daun Belimbing
Wuluh (Averrhoa bilimbi L.) terhadap Staphylococcus aureus dan
Staphylococcus epidermidis. Skripsi. Surakarta: Universitas
24
Lampiran 1. Surat determinasi tanaman sirih merah
25
26
27 Lampiran 4. Hasil perhitungan statistik
28
Asymp. Sig. .014
Hasil Uji Mann-Whitney kontrol positif dan kontrol negative
Test Statisticsa
Zona Hambat
Mann-Whitney U .000
Wilcoxon W 6.000
Z -2.121
Asymp. Sig. (2-tailed) .034
Exact Sig. [2*(1-tailed Sig.)]
.100b
Hasil Uji Mann-Whitney kontrol positif dan fraksi 2 dari ekstrak kloroform daun sirih merah
Test Statisticsa
Zona Hambat
Mann-Whitney U .000
Wilcoxon W 6.000
Z -1.993
Asymp. Sig. (2-tailed) .046
Exact Sig. [2*(1-tailed Sig.)]
29
Hasil Uji Mann-Whitney kontrol positif dan fraksi 3 dari ekstrak kloroform daun sirih merah
Test Statisticsa
Zona Hambat
Mann-Whitney U .000
Wilcoxon W 6.000
Z -2.023
Asymp. Sig. (2-tailed) .043
Exact Sig. [2*(1-tailed Sig.)]
.100b
Hasil Uji Mann-Whitney kontrol negatif dan fraksi 2 dari ekstrak kloroform daun sirih merah
Test Statisticsa
Zona Hambat
Mann-Whitney U .000
Wilcoxon W 6.000
Z -2.087
Asymp. Sig. (2-tailed) .037
Exact Sig. [2*(1-tailed Sig.)]
30
Hasil Uji Mann-Whitney kontrol negatif dan fraksi 3 dari ekstrak kloroform daun sirih merah
Test Statisticsa
Zona Hambat
Mann-Whitney U .000
Wilcoxon W 6.000
Z -2.121
Asymp. Sig. (2-tailed) .034
Exact Sig. [2*(1-tailed Sig.)]
.100b
Hasil Uji Mann-Whitney fraksi 2 dan fraksi 3 dari ekstrak kloroform daun sirih merah
Test Statisticsa
Zona Hambat
Mann-Whitney U .000
Wilcoxon W 6.000
Z -1.993
Asymp. Sig. (2-tailed) .046
Exact Sig. [2*(1-tailed Sig.)]
31
BIOGRAFI PENULIS
Penulis bernama lengkap Nadia Chandra Prasdiyanti lahir
di Surakarta, 27 Mei 1996. Penulis merupakan anak
pertama dari 3 bersaudara dari pasangan Bapak I Made
Budiarsa dan Ibu Niken Satuti Nur Handayani. Penulis
menempuh pendidikan di SD Percobaan 2 Yogyakarta,
SMP Negeri 1 Depok Yogyakarta, SMA Stella Duce 1
Yogyakarta dan pada tahun 2015 melanjutkan pendidikan
di Program Studi Farmasi Universitas Sanata Dharma Yogyakarta. Penulis aktif
dalam kegiatan kepanitiaan antara lain sebagai anggota divisi Expo kegiatan
INSADHA tahun 2016, kordinator divisi konsumsi kegiatan Desa Mitra 1,
anggota divisi perlengkapan kegiatan Desa Mitra 2 serta menjadi volunteer
kegiatan Faction #2. Penulis pernah menjadi asisten dosen praktikum
Farmakognosi-Fitokimia (2018), Farmakokinetika-Biofarmasetika (2018), serta