BIOAKTIVITAS ANTIMALARIA TURUNAN SANTON TERPRENILASI DARI GARCINIA XANTHOCHYMUS KEPULAUAN BANGKA BELITUNG
Indarti.R1, Ersam2*. T, Santoso. M2, Widyawaruyanti. A3
1Mahasiswa Pascasarjana, Institut Teknologi Sepuluh Nopember, Surabaya 2 Pascasarjana Kimia, Institut Teknologi Sepuluh Nopember, Surabaya
3Fakultas Farmasi, Universitas Airlangga, Surabaya
ABSTRAK
Santon terprenilasi yaitu 1,4,6-trihidroksi-5-metoksi-7-prenilsanton diisolasi dari ekstrak metanol kulit kayu batang Garcinia xanthochymus Hook.f.ex.T.Anderson. Pemisahan dilakukan dengan cara ekstraksi pada suhu kamar dengan metode maserasi menggunakan metanol, selanjutnya fraksinasi komponen dengan cara kromatogarfi vakum cair (KCV) dan kromatografi kolom gravitasi (KKG). Untuk pemurnian dilakukan dengan kristalisasi. Penentuan struktur molekul ditetapkan berdasarkan metode spektroskopi UV,IR, 1H-NMR dan 13C-NMR. Uji bioaktivitas antimalaria secara invitro, dengan nilai IC50 = 0,03 µg/mL. Data fisik
senyawa(1) hasil isolasi berupa kristal kuning dengan titik leleh 182-183◦C.
Kata kunci: Antimalaria Garcinia xanthocymus, santon terprenilasi,
*Corresponding Authors: taslimersam@its.ac.id
1. Pendahuluan
Garcinia xanthochymus Hook.f.ex.T.Anderson adalah tumbuhan yang berasal dari India dan sudah menyebar ke Asia Tenggara termasuk Indonesia. Di daerah Sumatera tumbuhan ini dikenal dengan asam kandis yang sering digunakan buahnya sebagai bumbu masak. Berdasarkan penelitian yang sudah dilaporkan tumbuhan ini mengandung senyawa metabolit sekunder berupa benzofenon, flavonoid, triterpen dan santon (Zhong et al,2009) Senyawa-senyawa tersebut juga sudah dilaporkan memiliki aktivitas sebagai antioksidan (Zhong et al,2009), antitoksik (Han et al,2007) potensi Nerve Growth Factor (Chanmahasanthien et al, 2003). Pada tulisan ini akan di laporkan penemuan santon pada kulit kayu batang G. xanthochymus Hook.f.ex.T.Anderson dan aktivitasnya sebagai antimalaria.
2. Metodologi Penelitian 2.1 Alat dan Bahan
Peralatan yang digunakan terdiri dari gelas kimia, gelas ukur, botol vial, erlenmeyer, kaca arloji,spatula, pipet tetes, pipet kapiler, corong Buchner, bejana pengembang, pinset, neraca analitik, peralatan ekstraksi maserasi, peralatan kromatografi vakum cair (KCV), peralaatan kromatografi kolom gravitasi (KKG), plat pemanas, lampu ultraviolet (UV) dengan λ 254 dan 366nm, peralatan rotary
evaporator BUCHI retavorator R-114, alat ukur titik leleh Fisher Johns, peralatan spektroskopi UV Shimadzu, Spektofotometer IR Shimadzu , dan spektrofotometer NMR Jeol JMN ECA 500MHz. Untuk uji antimalaria digunakan laminar air flow, inkubator, autoklaf, eksikator, mikroskop (Olympus CH 20), penyaring membran pipet 0,22µm, lempeng sumur mikro (24 well) botol scot, alat-alat sentrifuse tertutup.
Bahan yang digunakan terdiri dari serbuk kayu batang Garcinia xanthochymus Hook.f.ex.T.Anderson sebagai bahan sampel, pelarut- pelarut organik n-heksan teknis dan pa, diklorometana teknis, kloroform pa, etil asetat teknis, metanol teknis dan pa, aseton teknis dan pa, akuades, silica gel 60 Merck (0,2-0,5 mm) untuk impregnasi, silica gel 60 merck (0,062-0,2 mm) untuk KKG, serium sulfat 1,5% dalam 2N H2SO4. Aluminium foil, kertas saring whatmann 40,
larutan aseton-d6, untuk spektroskopi NMR. Bahan uji antimalaria digunakan parasit Plasmodium falciparum strain 3D7, RPMI 1640, HEPES buffer, natrium bikarbonat, gentamisin sulfat, serum manusia, eritrosit manusia, minyak imersi dan pewarna giemsa.
2.2 Ekstraksi Sampel
Sampel sebanyak 3 kg diekstraksi menggunakan n-heksan dengan metode maserasi pada suhu kamar selama 2x24 jam, selanjutnya sampel dimaserasi menggunakan metanol selama 3x 24 jam. Maserasi pertama digunakan 7 liter n-heksan selama 2x24 jam, kemudian disaring dan hasilnya dimonitoring di atas plat KLT menggunakan eluen kloroform: metanol (9:1). Noda dideteksi dengan lampu UV kemudian disemprot menggunakan penampak noda yaitu larutan 1,5% serium sulfat dalam 2 N H2SO4 dan dipanaskan di atas oven/pemanas. Hasil
monitoring digunakan untuk mengetahui zat-zat yang bersifat non polar sudah terekstrak semua atau belum. Maserasi kedua digunakan 12 liter metanol selama 3x24 jam. Hasil ekstrak diberi perlakuan yang sama dengan maserasi yang pertama hingga didapatkan semua zat sudah terekstrak dengan sempurna. Ekstrak cair metanol yang dihasilkan kemudian dipekatkan dengan rotary evaporator bertekanan rendah dan diperoleh ekstrak padat. Jumlah total ekstrak metanol yang didapatkan sebanyak 325,24 gram berwarna coklat kehitaman.
2.3 Fraksinasi Ekstrak Metanol
Fraksinasi dilakukan terhadap ekstrak metanol menggunakan kromatografi cair vakum (KCV) yang dengan eluen n-heksana : etil asetat yang ditingkatkan kepolarannya secara bertahap, dimulai dari [(5%), (20%), (50%), (70%)], dilanjutkan dengan etil asetat 100% dan metanol menghasilkan 5 fraksi. Hasil fraksinasi dimonitor diatas plat KLT menggunakan eluen kloroform : metanol ( 9:1). Berdasarkan kromatogram, noda dengan Rf yang relatif sama digabungkan menghasilkan 5 fraksi gabungan, yaitu fraksi gabungan A = 0,068 g (vial 1-10), fraksi gabungan B = 0,557 g (vial 11-22), fraksi gabungan C = 4,680 g (vial 23-35), fraksi gabungan D = 1,700 g ( vial 36-42), fraksi gabungan E = 22,510 g ( vial 43)
2.4 Fraksinasi dari fraksi gabungan B
Fraksi gabungan B (Fr. B) selanjutnya difraksinasi dengan menggunakan kromatografi kolom gravitasi (KKG) dengan eluen n-heksana : etil asetat dengan meningkatkan kepolarannya mulai dari [(5%), (10%), (15%), (20%), (50%)], dan etil asetat 100%, menghasilkan 76 fraksi, kromatogram dengan eluen kloroform : metanol (9:1). Fraksi yang memilki kemiripan Rf dan pola noda digabung sehingga menghasilkan 5 fraksi gabungan yaitu fraksi B1 = 0,0107 g (vial 1-9), fraksi B2 = 0,038 g (vial 11-30), fraksi B3 = 0,046 g (vial 31-51), fraksi B4 = 0,018 g (vial 52-64), fraksi B5 = 0,0742 g (vial 65-67), fraksi B6= 0,198 g (vial 68 – 74).
Fraksi B4 direkristalisasi menggunakan n-heksana : kloroform menghasilkan kristal berwarna kuning yang kemudian diuji kemurniannya dengan uji KLT menggunakan 3 eluen yang berbeda mendapatkan noda tunggal yang mengindikasikan senyawa telah murni dan dilakukan uji tiitk leleh. Pengujian titik leleh menggunakan alat Fisher Johns meleleh pada suhu 182-183◦C. Uji kelarutan senyawa (1) menunjukkan bahwa senyawa ini tidak larut dalam n-heksana dan diklorometan tetapi larut dalam kloroform, aseton, etil asetat dan metanol.
3. Hasil dan Pembahasan
Senyawa (1) berupa kristal berwarna kuning (0,018 g), titik leleh 182-183 C, UV λ maks (MeOH) 233,249 dan 184 nm, IR υ cm-1(KBr) 3425, 2924, 2854, 2368, 2337, 2276, 2106, 1851, 1597, 1481, 1381, 1288, 1234, 1087, dan 1049 . 1H-NMR δH (ppm) 12,20 (1H, s); 7,74 (1H,s); 7,30 (1H,d, J = 9 Hz); 6,62(1H,d, J=9Hz); 5,40 (1H,t, J=7,5Hz); 4,06 (3H,s); 3,44 (2H,d, J =7,5 Hz); 1,77 (3H,s); 1,75 (3H,s). 13C-NMR δC (ppm) 181,3; 154,4; 154,1; 149,1; 144,2 ; 137,1; 134,2; 133,0; 126,6 ; 123,3; 121,5; 121,5; 119,8; 113,5; 108,9; 108,6; 61,0; 29,3; 28,8 dan 17,0 .
Penentuan struktur senyawa (1) dianalisa menggunakan data spektroskopi UV, IR dan NMR ( 1Hdan 13C). Analisa UV terhadap senyawa (1) menghasilkan spektrum UV yang menunjukkan adanya pita serapan λmax pada 233 (0,625), 249
(0,579), 284 nm (0,407) dengan menggunakan pelarut MeOH. Serapan pada pita 221, 253 dan 332 nm merupakan tipe serapan untuk santon terhidroksi (Nkengfack et al, 2002). Serapan pada pita 230 – 248 nm (kuat), 260-264nm (kuat) 312-320 nm (sedang) dan 370-385 nm (lemah) merupakan serapan pita kromofor dari senyawa santon (Rukhaisirikul et al, 2003)
Pita serapan pada λmax 249 nm menunjukkan adanya transisi elektron dari
π ke π* yang merupakan ciri khas untuk sistem ikatan rangkap terkonjugasi dari suatu cincin aromatik. Pita serapan pada λmax 284 nm menunjukkan adanya
transisi elektron dari n ke π* yang memperlihatkan adanya ikatan terkonjugasi dari heteroatom dengan sistem aromatik. Data tersebut menunjukkan bahwa senyawa (1) mengandung sistem aromatik yang tersubstitusi oleh gugus karbonil.
Pada penambahan pereaksi geser NaOH menyebabkan pergeseran batokromik dari 233 ke 240 nm, 249 ke 260 nm dan 284 ke 297 nm mengindikasikan adanya gugus hidroksi yang tersubtitusi pada posisi orto dengan gugus karbonil sehingga penambahan pereaksi geser tersebut menyebabkan terjadinya kesetimbangan keto enol. Fakta ini menunjukkan adanya senyawa fenolat ( Ito et al., 1997).
O
O-H
O
O NaOH
Gambar1.Kesetimbangan Keto – Enol
Pada penambahan AlCl3 senyawa (1) mengalami pergerseran batokromik
dan ketika ditambahkan HCl pergeseran tersebut tidak berbalik. Hal ini menunjukkan bahwa senyawa (1) tidak mempunyai gugus hidroksi pada posisi orto. Dari analisa UV dapat diketahui bahwa senyawa (1) mengandung sistem aromatis yang tersubtitusi gugus karbonil dan gugus hidroksi yang terletak pada posisi orto satu sama lain. Untuk memperjelas dugaan ini, maka analisa dilanjutkan menggunakan data spektrum IR.
Spektrum IR senyawa (1) memperlihatkan serapan-serapan yang khas untuk beberapa gugus fungsi, diantaranya adalah bilangan gelombang ( υmaks cm-1)
: 3425, 2924, 2854, 2368, 2337, 2276, 2106, 1851, 1597, 1481, 1381, 1288, 1234, 1087, dan 1049. Serapan pada bilangan gelombang 3425 cm-1 (melebar) menunjukkan adanya gugus hidroksi, υmaks 1851 cm-1 menunjukkan adanya gugus
karbonil. Serapan dengan υmaks 2924 cm-1 menunjukkan suatu gugus metil (-CH3),
υmaks 2854 cm-1 menunjukkan gugus metilen (-CH2), dan υmaks 1597, 1481, 1381
cm-1 menunjukkan serapan yang khas untuk ikatan rangkap pada cincin aromatis (Tih et al, 2006). Sesuai dengan analisa spektrumUV dan IR maka dapat diketahui bahwa senyawa (1) memiliki gugus hidroksi, gugus karbonil , gugus C-H alifatik, sistem aromatik dan fenol, maka hipotesa sementara senyawa (1) adalah kerangka santon. Untuk menguatkan hipotesa ini dilanjutkan dengan analisa spektrum 1 H-NMR.
Spektrum 1H-NMR memperlihatkan sinyal pada pergeseran kimia (δH ppm) 12,20 (1H, s); 7,74 (1H,s); 7,30 (1H,d, J = 9 Hz); 6,62(1H,d, J=9Hz); 5,40 (1H,t, J=7,5Hz); 4,06 (3H,s); 3,44 (2H,d, J =7,5 Hz); 1,77 (3H,s); 1,75 (3H,s). Dari data spektrum 1H-NMR ini memperlihatkan adanya beberapa kelompok proton yaitu 2 proton singlet pada δH 12,20 dan δH 7,74 berturut-turut merupakan
proton dari gugus hidroksi yang terkelat dengan karbonil dan proton dengan posisi peri dengan gugus karbonil. Kelompok proton doblet dengan δH 7,30 (1H,d, J = 9
Hz); 6,62 (1H,d, J = 9 Hz) adalah proton orto pada cincin aromatik; kelompok proton dari gugus prenil pada 5,40 (1H,t, J=7,5 Hz); 3,44(2H,d, J = 7,5 Hz); 1,77 (3H,s); 1,75 (3H,s) serta kelompok proton metoksi pada δH 4,06 (3H,s)
(Nkengfack et al, 2002).
Untuk memperjelas posisi kelompok-kelompok proton ini dilakukan analisa terhadap data spektrum 13C-NMR. Spektrum 13C-NMR menunjukkan
pergerseran kimia pada (δ ppm) 181,3 ; 154,4; 154,1; 149,1; 144,2 ; 137,1; 134,2 ; 133,0; 126,6 ; 123,3; 121,5; 121,5; 119,8; 113,5; 108,9; 108,6; 61,0; 29,3; 28,8 dan 17,0 . Dari data spektrum 13C-NMR ini menguatkan dugaan bahwa terdapat adanya karbon aromatik yang tersubtitusi yaitu pada δC 154,5 ppm
(C-1); 137,1 (C-4); 154,1 (C-6) dan 126,6 (C-7) (Harrison et al, 1994) karbonil δC 181,3 ppm (C-9); karbon berupa gugus prenil yang terikat pada C-7 pada δC
metoksi yang terikat pada C-5 δC 61,07 ppm, karbon yang mengikat proton orto
aromatik pada 108,6 (C-2); 123,3 (C-3) (Chanmahasanthien et al, 2003). Pergeseran kimia karbon untuk metoksi pada δC 61,0 mengindikasikan bahwa gugus metoksi tersubtitusi pada C-5 cincin aromatik dimana gugus metoksi mempunyai posisi orto terhadap gugus hidroksi. (Nkengfack et al, 2002)
Tabel 1. Perbandingan data 1H-NMR dan 13C-NMR Senyawa / Posisi C Senyawa 1 (Aseton-d6) 1,2,6-trihidroksi-5-metoksi-7-prenil santon (CD3OD) 1,4,6-trihidroksi-5-metoksi-7-prenil santon (CD3OD) δ H ppm δ C ppm δ H ppm δ C ppm δ H ppm δ C ppm 1 154,5 146,4 154,8 2 6,62(1H,d, J=9 Hz) 108,9 139,4 6,51(1H,d,J= 8,8Hz) 109,8 3 7,30(1H,d, J=9 Hz) 123,3 7,17(1H,d, J=9,0Hz) 124,8 7,13(1H,d,J= 8,8Hz) 124,0 4 137,1 6,56(1H,d, J=9,0Hz) 110,6 138,6 4a 144,2 155,6 145,6 4b 149,1 151,6 150,4 5 134,2 136,2 135,4 6 154,1 157,1 156,3 7 126,6 129,1 128,4 8 7,74 (1H,s) 119,8 7,64(1H,s) 121,6 7,58(1H,s) 120,8 8a 113,5 115,1 114,2 9 181,3 183,5 182,6 9a 108,9 110,5 110,6 1’ 3,44(2H,d, J=7,5 Hz) 29,1 3,36(2H,d, J=7,2Hz) 29,9 3,31(2H,d, J=7,2Hz) 29,1 2’ 5,40(1H,t, J=7,5 Hz) 121,5 5,35(1H,t, J=7,2Hz) 123,4 5,32(1H,t, J=7,2Hz) 122,7 3’ 133,0 135,1 134,3 4’ 1,77 (3H,s). 28,8 1,78(3H,s) 26,8 1,75(3H,s) 26,0 5’ 1,76 (3H,s) 17,0 1,74(3H,s) 18,7 1,71(3H,s) 18,0 -OMe 4,06 (3H,s) 61,0 4,07(3H,s) 62,8 4,10(3H,s) 62,0 -OH 12,20(1H,s) 12,21(1H,s)
Sumber : Chanmahasanthien et al, 2003; Harrison et al, 1994
Berdasarkan kajian literatur yang telah dilaporkan, pada spesies G.xanthochymus Hook.f.ex.T Anderson, terdapat 2 senyawa yang memiliki data spektra UV, IR dan 1H-NMR dan 13C-NMR mirip dengan senyawa (1). Senyawa
tersebut memiliki struktur kerangka santon, gugus metoksi, proton orto aromatik, gugus hidroksi yang terkelat dengan karbonil dan gugus prenil. Adapun data selengkapnya dapat dilihat pada tabel 1. Dari data tersebut, dapat dilakukan monitoring bahwa senyawa 1,4,6-trihidroksi-5-metoksi-7 prenilsanton adalah isomer dari 1,2,6-trihidroksi-5-metoksi-7-prenilsanton. Hal ini dapat dibuktikan
bahwa senyawa 1,2,6-trihidroksi-5-metoksi-7-prenilsanton mengalami modifikasi struktur yaitu dengan pergeseran gugus hidroksi dari posisi orto menjadi para, maka akan terbentuk struktur 1,4,6-trihidroksi-5-metoksi-7-prenilsanton, yang mana senyawa ini telah ditemukan pada spesies G.dulcis (Harrison et al, 1994). Berdasarkan pembahasan dan analisis data di atas, maka struktur senyawa (1) adalah merupakan kerangka santon yang tersubtitusi oleh gugus hidroksi, gugus metoksi dan gugus prenil. Struktur yang mungkin disarankan untuk senyawa (1) adalah 1,4,6-trihidroksi-5-metoksi-7-prenilsanton.
4. Uji Bioaktivitas Antimalaria
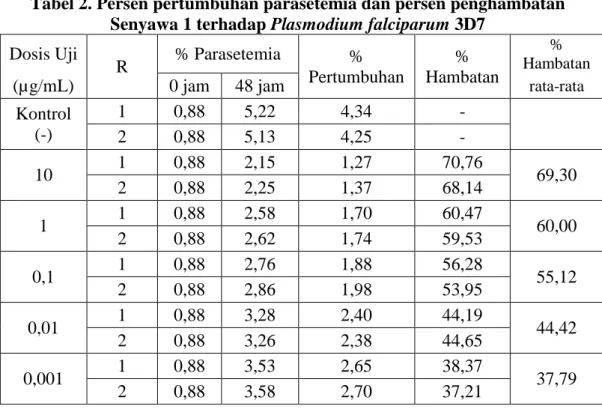
Uji aktivitas sebagai antimalaria dilakukan secara in vitro dengan menggunakan Plasmodium falciparum strain 3D7 (Sensitif Klorokuin) yang dibiakkan secara aseptik dalam platwell 24 dan diinkubasi selama 48 jam. Data hasil uji antimalaria secara in vitro terhadap senyawa (1) mendapatkan data seperti pada tabel 2. Data tersebut dianalisa dengan program analisa probit mendapatkan nilai IC50 = 0,03µg/mL. Efektifitas senyawa (1) terhadap kematian Plasmodium
falciparum menunjukkan bahwa daya hambat 50% adalah pada konsentrasi 0,03µg/mL, tetapi senyawa (1) kurang aktif secara signifikan, hal ini terlihat dari data pada tabel 2 bahwa persentase hambatan rata-rata pada dosis terbesar hanya mampu menghambat sebesar 69,30% dari yang diharapkan 100%, demikian pula pada konsentrasi terendah persentase hambatan rata-ratanya 37,79%.
Keaktifan senyawa santon terhadap Plasmodium falciparum dipengaruhi oleh beberapa hal, diantaranya adalah macam-macam subtituent yang terikat pada kerangka santon dan sedikit banyaknya substituent yang terikat. Beberapa senyawa santon yang telah diuji aktivitas terhadap Plasmodium sp mempunyai hubungan dengan jumlah gugus hidroksi yang terikat pada senyawa tersebut (Fotie et al, 2003). Ada dua hal yang mempengaruhi keaktifan senyawa santon terhadap antimalaria yaitu :
a. Ada posisi gugus hidroksi yaitu santon dengan gugus hidroksi yang terikat pada atom C-4 dan C-5 serta didukung oleh gugus hidroksi pada posisi tetangga yaitu C-3 dan C-6 menunjukkan aktifitas penghambatan pembentukan hemozoin lebih baik dibandingkan jika gugus hidroksi terikat pada posisi peri yaitu posisi pada C-1 atau C-8 (Ignatushchenko et al, 2000)
b. Adanya gugus 1,1-dimetilalil atau cincin piran atau isopentenil meningkatkan aktivitas penghambatan pembentukan hemozoin (Hay et al, 1004) O O O H OH OH OMe (1)
Tabel 2. Persen pertumbuhan parasetemia dan persen penghambatan Senyawa 1 terhadap Plasmodium falciparum 3D7
Dosis Uji R % Parasetemia % Pertumbuhan % Hambatan % Hambatan
(µg/mL) 0 jam 48 jam rata-rata
Kontrol (-) 1 0,88 5,22 4,34 - 2 0,88 5,13 4,25 - 10 1 0,88 2,15 1,27 70,76 69,30 2 0,88 2,25 1,37 68,14 1 1 0,88 2,58 1,70 60,47 60,00 2 0,88 2,62 1,74 59,53 0,1 1 0,88 2,76 1,88 56,28 55,12 2 0,88 2,86 1,98 53,95 0,01 1 0,88 3,28 2,40 44,19 44,42 2 0,88 3,26 2,38 44,65 0,001 1 0,88 3,53 2,65 38,37 37,79 2 0,88 3,58 2,70 37,21
Berdasarkan uraian di atas, jelaslah bahwa keaktifan senyawa (1) sebagai antimalaria tidak signifikan, hal ini disebabkan karena adanya gugus hidroksi pada posisi peri yaitu gugus hidroksi yang terikat pada C-1, meskipun pada C-4 dan C-6 terikat gugus hidroksi, C-5 gugus metoksi dan C-7 gugus prenil. Dengan demikian senyawa (1) dapat dikatakan kurang efektif digunakan sebagai antimalaria, karena aktifitas senyawa (1) tidak signifikan dalam menghambat pembentukan hemozoin dalam darah.
5. Kesimpulan
Berdasarkan penelitian yang telah dilakukan terhadap kulit kayu batang Garcinia xanthochymus Hook.f.ex.T.Anderson dapat diisolasi senyawa 1,4,6-trihidroksi-5-metoksi-7-prenilsanton yang kurang efektif sebagai antimalaria meskipun mempunyai nilai IC50 = 0,03 µg/mL.
6. Ucapan terimakasih
Penulis mengucapkan terimakasih kepada: Departemen Agama RI yang telah memberikan beasiswa, Hibah Pascasarjana DP2M DIKTI, Lab. instrumen UNESA, Lab. instrumen UGM , LIPI SERPONG, Kebun Raya Bogor, Fakultas Farmasi UNAIR dan anggota kelompok penelitian aktivitas kimiawi tumbuhan di jurusan kimia, FMIPA,ITS.
DAFTAR PUSTAKA
Chanmahasathien.W,Li.Y, Satake.M, Oshima.Y, Ruangrungsi.N, Ohizumi.Y, (2003). Prenylated xantones with NGF-potentiating activity from Garcinia xanthochymus. Phytochemistry 64 (981-986)
Chanmahasathien.W,Li.Y, Satake.M, Oshima.Y, Ishibashi.Y,Ruangrungsi.N, Ohizumi.Y, (2003). Prenylated xantones from Garcinia xanthochymus. Chem.Pharm.Bull 51 (1332-1334)
Fidock.DA, Ekland.EH. 2008. In Vitro Evaluation of Antimalarial drugs and Their Relevance to Clinical Outcome. International Journal for Parasitology. 38 (743-747)
Fotie. J. (2008). The Antiprotozoan Potential of Flavonoids. Pharmacognocosy reviews Vol.2 issue 3 (6-19)
Han,QB; Qiao,CF; Song,JZ; Yang,NY; Cao,XW; Peng,Y; Yang,DJ; Chen, SL; Xu,HX.(2007). Cytotixic Prenylated Phenolic Compounds from the Twig Bark of Garcinia xanthochymus. Chemistry & Biodiversity vol 4 (940-946)
Harrison.LJ, Leong. LS, Leong. YW, Sia. GL, Sim. KY, Tan. HTW.(1994). Xanthones and Flavonoid Constituent of Garcinia dulcis (Guttiferae). Natural Product Letters 5 (111-116)
Hay.AE, Helesbeux.JJ, Duval.O, Labaied.M, Grellier.P, Richomme.P. (2004) Antimalarial Xanthones from Calophyllum caledonium and Garcinia vieillardii. Life Sciences 75 (3077-3085)
Ignatushchenko.MV, Winter.RW, Riscoe,M.(2000). Xanthones as antimalarial agents stage specificity. The American Journal of Tropical Medicine and Hygiene 62 (1) 77-81
Ito, C., Itoigawa, M., Miyamoto, Y., Rao, K.S., Takayasu, J., Okuda, Y., Mukainaka, T., Tokuda, H., Nishino, H., Furukawa, H., (1999), “ A New Biflavonoid from Calophyllum panciflorum with Antitumor-Promoting Activity”, J.Nat.Prod., Vol. 62, No. 12, Hal. 1668-1671.
Nuri. (2006). Aktivitas Antimalaria Isolat yang berasal dari Ekstrak Diklorometana Kulit Batang Artocarpus champeden Spreng secara Invitro. Surabaya: UNAIR Thesis
Rukachaisirikul.V, Rittiwigrom.T, Pinsa.A, Sawangchote.P, Taylor.WC. (2003). Xanthones from Stem Bark of Garcinia nigrolineata. Phytochemistry 64 (1149-1156)
Saxena.S, Pant.N, Jain.DC, Bhakuni.RS. (2003). Antimalarial Agents from Plant Sources. Current Science 85 (1314-1329)
Suwandi. JF, Wijayanti.MA, Mustofa.(2008), Aktivitas Penghambatan Polimerisasi Hem Antiplasmodium Ekstrak Daun Sungkai (Peronema canescens) In Vitro. Prosiding Seminar Nasional Sains dan Teknologi. UNILA
Syamsuddin, Tjokrosonto.S, Wahyuono.S, Mustofa.( 2007). Aktivitas Antiplasmodium dari dua fraksi ekstrak n-heksana kulit batang asam kandis (Garcinia parvifolia Miq). Majalah farmasi Indonesia 18 (4) 210-215
Tih, A.E., Ghogomu, R.T., Sondengam, B.L., Caux, C., Bodo, B., (2006), “Minor Biflavonoids from Lophira alata Leaves”, American Chemical Society and American Society of Pharmacognosy
Trager.W and Jensen.J.B.(1976). Human Malaria Parasites in Continous Culture. Science.193 (673-675)
Winter,R.W, Ignatushchenko,M. Ogundahunsi,O.A, Cornell,K.A, Oduola,A.M, Hinrichs,D.J, Riscoe, M.K.(1997). Potentiation of an Antimalarial Oxidant Drug. Antimicrobial and Chemotheraphy 41 (7) 1449-1454 Zhong.FF, Chen Yu, Wang ping, Feng Huijin, Yang.GZ, (2009). Xanthones from
the Bark of Garcinia xanthochymus and Their 1,1-diphenyl-2-picrylhydrazyl (DPPH) Radical-Scavenging Activities. Chinese Journal of Chemistry 27 ( 74-80)