UJI SITOTOKSIK Enterobacter sakazakii ISOLAT ASAL
MAKANAN DAN SUSU BAYI PADA SEL LESTARI VERO
GETRI GRECILIA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Uji Sitotoksik Enterobacter sakazakii Isolat Asal Makanan dan Susu Bayi pada Sel Lestari Vero adalah hasil karya saya dengan arahan pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2008
Getri Grecilia NIM: B04104017
ABSTRAK
GETRI GRECILIA. Uji sitotoksik Enterobacter sakazakii isolat asal makanan dan susu bayi pada sel lestari Vero. Dibimbing oleh Sri Estuningsih.
Enterobacter sakazakii merupakan bakteri yang hidup secara luas. Bakteri ini ditemukan dalam usus manusia sehat sebagai intermittent guest, usus hewan, dan di lingkungan. Lingkungan yang dimaksud meliputi lingkungan berair, industri makanan, rumah tangga, rumah sakit hingga sedimen tanah yang lembab, dan ditemukannya bakteri ini dalam susu formula dan makanan pengganti ASI menyebabkan bakteri ini dikukuhkan sebagai emerging pathogen. Sifat virulen bakteri ini menurut Pagotto (2003) berasal dari suatu senyawa toksin yang menyerupai enterotoksin yang dapat mengakibatkan terjadinya necrotizing enterocolitis (kerusakan berat saluran cerna), meningitis (infeksi selaput otak) dan sepsis (infeksi sistemik) pada bayi, terutama bayi berumur 1 bulan, dengan berat badan lahir rendah atau dengan sistem kekebalan yang rendah. Penelitian ini dilakukan untuk mengetahui apakah isolat E. sakazakii yang diujikan mempunyai kemampuan melisiskan sel sebagai tanda patogenitas isolat tersebut. Sebanyak 12 isolat E. sakazakii asal makanan pengganti ASI (MP-ASI) ditumbuhkan dalam media cair selama 18 jam kemudian dipisahkan dan dikoleksi supernatannya. Diasumsikan supernatan ini mengandung enterotoksin yang dihasilkan oleh bakteri E. sakazakii. Setelah dilakukan filtrasi (dengan filter 0,22 µm) kemudian sebagian filtrat tersebut dididihkan selama 20 menit, filtrat diuji pada sumur-sumur kultur sel lestari Vero yang telah konfluen. Setelah inkubasi semalam kemudian diamati filtrat yang mampu menyebabkan sitolisis sel lestari Vero. Hasil penelitian ini menunjukkan bahwa 6 dari 12 filtrat mampu menyebabkan sitolisis dan 5 dari 6 isolat tersebut masih menunjukkan kemampuan sitolisis setelah filtrat dididihkan. Berdasarkan hasil penelitian, dapat disimpulkan bahwa 6 dari 12 isolat E. sakazakii yang diujikan memiliki faktor virulen berupa enterotoksin yang sebagian besar tahan panas.
Kata kunci : Enterobacter sakazakii, sel lestari Vero, sitotoksik.
ABSTRACT
GETRI GRECILIA. Cytotoxic test of Enterobacter sakazakii enterotoxin isolated from infant food and infant formula on Vero cell line. Under supervisor of Sri Estuningsih.
Enterobacter sakazakii is a broad life bacteria. This bacteria could be found in heald humans visceral as an intermitten guest, animal visceral and in environment such as food industry, wet area, hospital and humid soil sediment. This bacteria also found from food and powder infant formula, that makes them dedicated into emerging pathogen. This bacteria has a virulance factor as toxic substance that similiar with enterotoxin which known causing necrotizing enterocolitis, meningitis, and sepsis in baby especially 1 month old baby, low body weight or low immunity. This research was aimed to know cytolitic ability of E. sakazakii toxin as it’s pathogenicity. Twelve isolates of E. sakazakii from infant were grown in liquid media (Brain Heart Infusion/BHI) about 18 hours than were separated and it’s supernatant were collected. After that, supernatants were filtered with filter 0,22 µm then half of supernatants were boiling for 20 minutes. Filtrates were tested on confluent Vero cell line in culture cell well. The result shown that six of twelve filtrates were causing cytolysis, and five of them still had cytolitic ability after boiled. Based on these result, we conclude that 6 from 12 isolate of E. sakazakii had virulence factor, it is enterotoxin which most of them were heat tolerance.
UJI SITOTOKSIK Enterobacter sakazakii ISOLAT ASAL
MAKANAN DAN SUSU BAYI PADA SEL LESTARI VERO
GETRI GRECILIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Skripsi : Uji sitotoksik Enterobacter sakazakii isolat asal makanan dan susu bayi pada Sel Lestari Vero
Nama : Getri Grecilia
NIM : B04104017 Disetujui Dr.drh. Sri Estuningsih,M.Si Pembimbing Diketahui Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan IPB
KATA PENGANTAR
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT, yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Uji Sitotoksik Enterobacter sakazakii Isolat Asal Makanan Dan Susu Bayi Pada Sel Lestari Vero” sebagai salah satu syarat untuk menyelesaikan studi tingkat Sarjana pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Selama pelaksanan penelitian ini, penulis telah banyak mendapat dukungan, semangat dan bantuan dari berbagai pihak. Pertama-tama penulis ucapkan terimakasih untuk keluarga tercinta atas segala doa, dukungan dan kepercayaan serta cinta yang tidak pernah lekang oleh waktu dan jarak, hingga pada akhirnya penulis dapat tetap bersemangat untuk menyelesaikan skripsi ini. Terimakasih penulis ucapkan kepada Dr. drh. Sri Estuningsih, M.Si selaku dosen pembimbing skripsi yang tidak kenal lelah meluangkan waktu untuk membimbing, mendidik serta mendukung penuh penyusunan skripsi ini hingga selesai. Penulis juga menyampaikan rasa terimakasih kepada Prof. Drh. Arief Boediono, PhD selaku dosen Pembimbing Akademik yang telah banyak memberi sumbangan positif sejak awal penulis di FKH IPB dan kepada Drh. Dewi Ratih Agungpriyono, PhD selaku dosen penilai sekaligus penguji atas saran dan masukan yang telah diberikan untuk kesempurnaan skripsi ini. Terimakasih tidak lupa penulis ucapkan khususnya kepada teman-teman RC (uni, yussy, yue, ana, puput, waQ, dan iya) yang cantik-cantik, nainonk, udin, serta miong atas semangat dan kebersamaan keluarga yang penulis rasakan selama berada di kampus ungu, kepada mas iqie, sugi, mas dho, rian dan dani atas semua dukungan dan bantuannya, teman-teman Asteroidea yang terbaik dan teristimewa serta semua pihak yang tidak dapat penulis sebutkan satu-persatu.
Penulis menyadari bahwa tulisan ini jauh dari kesempurnaan. Semoga skripsi ini dapat bermanfaat bagi kita semua.
Bogor, November 2008 Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Manna, Bengkulu Selatan pada tanggal 1 Januari 1987 sebagai anak ke-3 dari tiga bersaudara, dari pasangan Bapak Ade Badarudin dan Ibu Susilawati.
Penulis memulai pendidikan Sekolah Dasar tahun 1992 di Sekolah Dasar Negeri 10 Manna dan lulus tahun 1998. Pada tahun yang sama melanjutkan pendidikan di Sekolah Menengah Pertama Negeri 1 Manna dan lulus tahun 2001, kemudian melanjutkan di Sekolah Menengah Umum Negeri 2 Manna dan lulus pada tahun 2004.
Pada tahun 2004 penulis diterima di Institut Pertanian Bogor, Fakultas Kedokteran Hewan melalui jalur USMI (Undangan Seleksi Masuk IPB). Selama perkuliahan penulis aktif dalam Himpunan Minat dan Profesi Ruminansia pada periode 2005-2006, dan Himpunan Minat dan Profesi Ornithologi dan Unggas pada periode 2006-2007.
DAFTAR ISI
Halaman
DAFTAR ISI ... iii
DAFTAR TABEL ...iv DAFTAR GAMBAR ...v PENDAHULUAN ... 1 Latar belakang ...1 Tujuan penelitian ...2 Hipotesa ...2 Manfaat ... 2 TINJAUAN PUSTAKA ... 3 Enterobacter sakazakii ...3
Taksonomi dan Klasifikasi ...3
Karakteristik ... 4
Sifat khas E. sakazakii ... 6
Sifat resistensi terhadap Antibiotik 6
Sifat resistensi terhadap perlakuan ... 6
Patogenitas ... 6
Enterotoksin ... 8
Metode penghitungan dan isolasi ... 8
Kejadian infeksius ...10
Makanan pengganti ASI dan susu formula bayi ... 12
Defenisi Susu ... 12
Makanan Pengganti ASI ... 12
Susu Formula Bayi ... 12
Kontaminasi susu formula dan makanan bayi ... 13
Biologi sel ...15
Defenisi Sel ... 15
Kultur jaringan ... 18
Faktor-Faktor yang Mempengaruhi Perkembangan Kultur ... 20
Sel Vero ...22
Defenisi ... 22
Manfaat sel Vero ... 23
METODOLOGI ... 25
Waktu dan tempat ...25
Materi penelitian ...25
Metode penelitian ...25
HASIL DAN PEMBAHASAN ... 30
KESIMPULAN DAN SARAN ... 37
DAFTAR TABEL
Halaman 1 Karakteristik tingkat adaptasi dan perkembangan E. sakazakii... 5 2 Perbedaan bikomia spesies Enterobacter... 5 3 Enterobacter sakazakii dan outbreak penyakit yang berhubungan
dengan susu infan formula yang terjadi dibeberapa Negara ... 11 4 Laporan kejadian adanya E. sakazakii dalam makanan bayi dan
susu bayi... 14 5 Hasil pemberian filtrat enterotoksin E. sakazakii (murni dan
dipanaskan) pada sel monolayer vero setelah inkubasi 24 jam... 33
DAFTAR GAMBAR
Halaman
1 Enterobacter sakazakii ... 3
2 Isolasi dan identifikasi Enterobacter sakazakii... 9
3 Gambaran skematis anatomi sel hewan ... 16
4 Gambaran skematis lapisan membran sel ... 17
5 Gambaran Sel Vero ... 22
6 Gambar format plat pengujian enterotoksin E. sakazakii pada TCP 24 well/sumur ... 28
7 Grafik pertumbuhan sel ... 30
PENDAHULUAN
Latar Belakang
Dalam dunia kedokteran, Enterobakter sakazakii atau yellow pigmented Enterobacter cloacae berkerabat dekat dengan Salmonella di dalam keluarga Enterobacteriaceae. Keberadaan bakteri ini pada susu formula dan MP-ASI di Indonesia telah menimbulkan keresahan yang besar bagi ibu-ibu di Indonesia karena menurut Pagotto (2003), bakteri ini dapat menginfeksi dan bersifat patogen karena menghasilkan suatu toksin yang menyerupai enterotoksin (racun). Berdasarkan laporan dibeberapa negara sejak tahun 2002, E. sakazakii diketahui dapat mengakibatkan enterokolitis nekrotikan et hemorrhagika, meningitis dan sepsis pada bayi, terutama bayi berumur 1 bulan, dengan berat badan lahir rendah atau dengan status kekebalan rendah (FDA/CFSAN 2002a). Infeksi yang ditimbulkan dapat menyebabkan cacat otak hingga kematian. Sumber infeksi diketahui berasal dari susu bubuk formula yang terkontaminasi bakteri tersebut, oleh karena itu bakteri ini dikukuhkan sebagai emerging pathogen (Farber 2004). Pengaruh keberadaan E. sakazakii di Indonesia sampai saat ini belum diketahui. Hasil penelitian Estuningsih, 2006 menunjukkan bahwa E. sakazakii ditemukan sebagai kontaminan sebesar 13,5% dalam makanan bayi dan 6,52% dalam susu bubuk formula (Estuningsih 2004). Hasil penelitian Hibah Bersaing XIV tahun I Estuningsih dkk (2006b) menunjukan bahwa sebanyak 22.73% susu formula dan 46.7% makanan bayi (MP-ASI) yang diteliti tercemar E. sakazakii dengan level MPN (Most Probability Number) kontaminasi terendah 0,36 cfu/100 gram dan tertinggi 15.0 cfu/ 100 gram. Telah diketahui bahwa bakteri E. sakazakii dengan level kontaminasi 3 cfu/100 gram telah mampu menginfeksi bayi. Angka tersebut jauh lebih rendah dari temuan kontaminasi di Indonesia. Hasil penelitian ini menunjukkan bahwa kondisi susu formula dan makanan bayi (MP-ASI) di Indonesia sudah saatnya diperhatikan mengingat resiko yang fatal akibat kemungkinan infeksi oleh E. sakazakii. Mengingat efek yang dapat ditimbulkan cukup serius, maka penelitian lebih lanjut diperlukan.
Penelitian berikut ini akan difokuskan kepada E. sakazakii yang telah berhasil diisolasi dari susu formula dan MP-ASI yang beredar di pasaran
Indonesia untuk melihat kemampuannya menghasilkan enterotoksin. Efek enterotoksin (jika dihasilkan) dilihat dengan melakukan uji sitotoksik terhadap sel lestari Vero. Informasi yang didapat diharapkan bermanfaat untuk digunakan dalam penelitian patogenitas dan patogenesis E. sakazakii. Selain itu diharapkan pula dapat digunakan sebagai landasan kebijakan dalam menegakkan peraturan keamanan pangan umumnya serta susu bayi dan makanan bayi khususnya.
Tujuan penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui kemampuan isolat E. sakazakii yang diisolasi dari susu dan makanan bayi dalam menghasilkan enterotokin.
2. Mempelajari efek sitotoksik toksin E. sakazakii pada sel lestari Vero setelah toksin dipanaskan.
Hipotesis
1. Enterotoksin dapat diproduksi oleh E. sakazakii yang diisolasi dari susu dan makanan bayi.
2. Enterotoksin E. sakazakii dapat menyebabkan sitolisis sel lestari Vero.
Manfaat penelitian
Manfaat penelitian ini adalah mengetahui (menentukan) isolat E. sakazakii yang menghasilkan enterotoksin yang akan digunakan untuk penelitian selanjutnya, serta menambah informasi tentang hasil penelitian E. sakazakii.
TINJAUAN PUSTAKA
I. Enterobacter sakazakii
I. 1. Taksonomi dan Klasifikasi E. sakazakii
Enterobacter sakazakii merupakan anggota Famili Enterobacteriaceae, dikenal sebagai Enterobacter cloacae berpigmen kuning sebelum akhirnya diidentifikasi sebagai spesies baru pada tahun 1980 berdasarkan perbedaan analisis hibridisasi DNA, reaksi biokimia dan uji kepekaan terhadap antibiotika oleh Farmer et al. sebagai penghargaan untuk seorang ahli bakteriologi Jepang (Riichi sakazakii). Hasil penelitian tahun 2007 oleh Iversen et al. kemudian membawa genus baru bagi bakteri ini yaitu Cronobacter, sehingga spesies bagi bakteri ini menjadi Cronobacter sakazakii. Taksonomi dan klasifikasi E. sakazakii adalah sebagai berikut:
kingdom : Bacteria phylum : Proteobacteria
class : Gamma Proteobacteria order : Enterobacteriales
family : Enterobacteriaceae. Hormaeche & Edwards (1960)
genus : Enterobacter
spesies : E. sakazakii. Farmer et al. (1980)
genus : Cronobacter
spesies : Cronobacter sakazakii. Iversen et al. (2007)
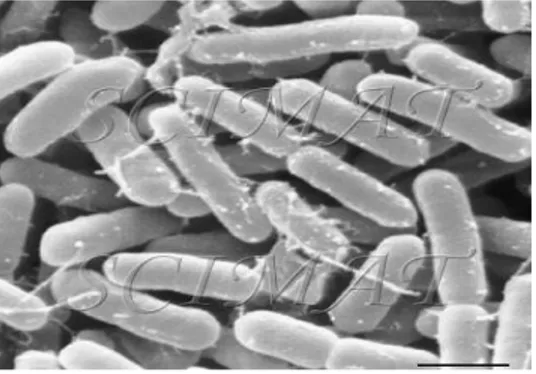
Gambar 1 Enterobacter sakazakii dengan ukuran bar 1 µm (Sumber : Anonim 2004a)
Genus Cronobacter dibuat pada tahun 2007 dan termasuk dalam Famili Enterobacteriaceae dengan karakteristik berupa gram negatif, anaerob fakultatif, berbentuk batang, motil, menurunkan konsentrasi nitrat, menghidrolisis eskulin dan arginin, dan positif terhadap L-ornithine decarboxylation. Bakteri pada genus
ini juga positif memproduksi asetoin (Voges-Proskauer test) dan negatif pada tes methyl red sebagai indikasi 2,3-butanediol karena menghasilkan campuran fermentasi asam. Spesies dari genus Cronobacter diambil berdasarkan kedekatan biologis taksonomi dengan E. sakazakii dan terdiri atas Cronobacter sakazakii, Cronobacter malonaticus, Cronobacter turicensis, Cronobacter muytjensii, dan Cronobacter dublinensis (Iversen et al. 2007).
I. 2. Karakteristik E. sakazakii
Seperti halnya anggota Famili Enterobacteriaceae lainnya, E. sakazakii merupakan bakteri gram negatif bersifat motil (memiliki peritrichous flagella), berbentuk batang dengan ukuran panjang 3 µm dan lebar 1 µm, tidak membentuk spora, dan anaerob fakultatif (Erickson et al. 2005). Bakteri ini memiliki habitat normal yang tidak jelas (Lai 2001), namun hasil publikasi Hassel (2004) mengatakan bahwa bakteri ini dapat ditemukan secara luas misalnya pada usus manusia sehat sebagai intermittent guest, usus hewan, dan lingkungan. Lingkungan yang dimaksud meliputi lingkungan industri makanan (pabrik susu, cokelat, kentang, sereal, dan pasta), lingkungan berair, rumah sakit, rumah tangga, hingga sedimen tanah yang lembab (Lehner & Stephan 2004). Lenati et al. (2008) menambahkan bahwa bakteri ini tidak dapat tumbuh pada lingkungan ASI in vitro pada suhu 10, 23 dan 37oC karena adanya suatu kandungan antimikrobial pada ASI. Pada tahun 1998, bakteri ini berhasil diisolasi dari flora usus lalat buah tanpa ada perbedaan jantan ataupun betina. Hal ini selaras dengan Kuzina et al. (2001) yang menyatakan bahwa E. sakazakii tidak ditemukan dalam koloni lalat lain dalam 30 tahun terakhir kecuali pada lalat buah, namun pada tahun 2003 bakteri ini berhasil diisolasi dari midgut Stomoxys calcitran (lalat penghisap darah) oleh Joanne et al.
Menurut Iversen dan Forsythe (2003) E. sakazakii dapat tumbuh pada kisaran suhu yang lebar (6 – 47oC). Kondisi optimum perkembangan bakteri ini berada pada kisaran suhu 37 – 44oC (Anonim 2005), namun tidak termasuk dalam golongan Heat Resistance karena pada temperatur 60oC dapat terbunuh (Edelson et al. 2004; FDA & CFSAN 2002b). Karakteristik adaptasi dan berkembang bakteri ini menurut Food Safety Athority of Ireland, dapat dilihat pada Tabel 1 (Anonim 2007a).
Tabel 1 Karakter tingkat adaptasi dan perkembangan Enterobacter sakazakii
Parameter Range Optimum
Temperatur untuk pertumbuhan 6 – 45 0C 37 – 43 0C
Waktu generasi º saat suhu 220C 37 – 44 menit -
D-Value ¹ saat suhu 600C (isolat E. sakazakii
berasal dari PIF) 3.52- 3.58 -
Keterangan : º waktu generasi adalah waktu yang dibutuhkan untuk membuat populasi bakteri menjadi duakali lipat. ¹D-Value adalah waktu (menit) dengan pemberian temperatur untuk mendapatkan pengurangan masa hidup sel sebanyak 90%.
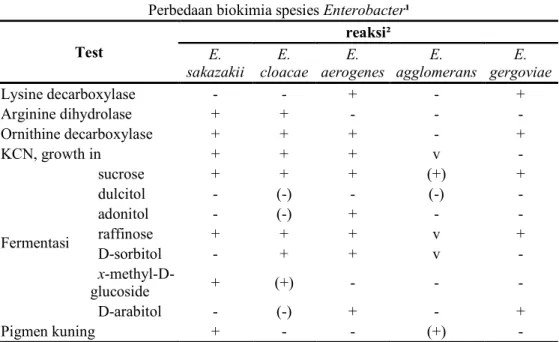
Berdasarkan penelitian lebih lanjut yang dilakukan oleh Iversen et al. (2004b), diperoleh hasil bahwa E. sakazakii mempunyai 97.8% kemiripan dengan Citrobacter koseri dan 97.0% dengan Enterobacter cloacae, sedangkan berdasarkan uji DNA hibridisasi bakteri ini memiliki kesamaan DNA hingga 50% dengan Citrobacter diversus (Farmer et al. 1980). Muytjens et al. (1984) menyatakan bahwa terdapat dua perbedaan besar yang membedakan E. sakazakii dengan spesies Enterobacter lain, yaitu adanya aktivitas glukosida yang tidak ditemukan pada Enterobacter lain dan tidak adanya enzim Phosphoamidase. Iversen dan Forsythe (2003) menambahkan bahwa sebagian besar bakteri ini tidak memfermentasikan sorbitol. Beberapa perbedaan biokimia dari spesies Enterobacter menurut Nazarowec et al. (1997), dapat dilihat pada Tabel 2.
Tabel 2 Perbedaan biokimia spesies Enterobacter
Keterangan: ¹Adaptasi dari Farmer and Kelly (1992), ²Bernilai + jika 90-100% positif; (+) : 75-89% positif; v : 25-74% positif; (-): 10-24% positif; - : 0-9% positif.
Perbedaan biokimia spesies Enterobacter¹ Test reaksi² E. sakazakii E. cloacae E. aerogenes E. agglomerans E. gergoviae Lysine decarboxylase - - + - + Arginine dihydrolase + + - - - Ornithine decarboxylase + + + - + KCN, growth in + + + v - Fermentasi sucrose + + + (+) + dulcitol - (-) - (-) - adonitol - (-) + - - raffinose + + + v + D-sorbitol - + + v - x-methyl-D-glucoside + (+) - - - D-arabitol - (-) + - + Pigmen kuning + - - (+) -
I. 3. Sifat Khas E. sakazakii
I. 3. 1. Sifat resistensi terhadap Antibiotik
Farmer et al. (1980) menemukan bahwa seluruh galur E. sakazakii rentan terhadap Gentamycin, Kanamycin, Chloramphenicol dan Amphicilin, lebih dari 87% bersifat rentan terhadap nalidixic acid, streptomycin, tetracycline, dan carbenicilin; 67% rentan terhadap sulfadiazine dan colistin; dan 13% rentan terhadap antibiotik ganda. Hal ini didukung oleh Weir (2002) yang menyebutkan bahwa E. sakazakii bersifat resisten terhadap Ampisilin dan Gentamisin atau Ampisilin dan Chloramphenicol. Menurut Lai (2001), Carbapenems atau Cephalosporin terbaru yang dikombinasikan dengan agen kedua seperti Aminoglycosida, Trymetrophine, Sulfametoxazole dapat digunakan untuk pengobatan infeksi akibat bakteri ini.
I. 3. 2. Sifat resistensi terhadap perlakuan
Enterobacter sakazakii bersifat lebih resisten terhadap pengeringan dan stres osmotik dibandingkan spesies lain dari Enterobacteriaceae karena suatu kapsul polisakarida dengan aktivitas antifagositik yang dapat mengurangi kemampuan tubuh untuk mengeliminasinya (Iversen et al. 2004a). Keberadaan kapsul ini juga memungkinkan E. sakazakii untuk melakukan perlekatan dan membentuk biofilm (perlekatan yang erat pada permukaan) yang menyebabkan resisten terhadap bahan pembersih dan desinfektan (Hassel 2004; Lehner et al. 2005). Meutia (2008) menambahkan bahwa beberapa isolat E. sakazakii asal susu dan makanan bayi juga memiliki sifat tahan terhadap pemanasan, namun beberapa penelitian menyatakan bahwa bakteri ini tidak lebih tahan panas dibandingkan dengan L. Monocytogenes (Iversen & Forsythe 2003).
I. 3. 3. Patogenitas E. sakazakii
Faktor patogenitas suatu bakteri batang bergram negatif diketahui berasal dari beberapa faktor yaitu endotoksin, enterotoksin, daya invasi, perlekatan ke permukaan sel, hemolisin, dan enzim–enzim yang diproduksi. Kemampuan perlekatan bakteri gram negatif digunakan untuk membentuk koloni pada bagian mukosa dengan menggunakan pili (fimbriae), sedangkan daya invasi yaitu kemampuan bakteri untuk menyerang sel inang dengan menggunakan komponen
permukaan berupa kode pada plasmid ataupun kromosom. Struktur dinding sel umumnya terdiri dari 20% total dinding sel dibentuk oleh lapisan murelin-lipoprotein dan sisanya 80% dibentuk oleh lapisan fosfolipid, protein dan lipopolisakarida. Komponen utama dari dinding sel adalah lapisan lipopolisakarida yang terdiri dari rantai polisakarida yang spesifik sebagai penentu sifat antigenik dan aktivitas endotoksin (Karsinah 1994). Endotoksin adalah bagian dari dinding sel luar bakteria yang jauh kurang toksik dan kurang spesifik dibandingkan dengan eksotoksin karena tidak bertindak sebagai enzim.
Informasi yang menjelaskan tentang sifat virulen dari E. sakazakii masih sangat minim, namun diketahui memiliki kesamaan respon imunologi dengan Eschericia coli dan coliform lain. Pagotto et al. (2003) melaporkan bahwa E. sakazakii mampu menghasilkan suatu senyawa toksin menyerupai enterotoksin dengan efek sitotoksik (melisiskan sel) pada uji in vitro terhadap sel lestari CHO, Vero, dan Y-1 dan menyebabkan kematian pada bayi mencit lewat pemberian peroral serta memiliki efek lethal saat di injeksi dengan konsentrasi 108 cfu pada anak mencit yang berumur 3-4 hari. Miyoshi dan Takai (2005) menyatakan bahwa sifat penyerangan bakteri E. sakazakii secara in vitro memiliki kesamaan denganL. Monocytogenes, yaitu dengan melepaskan Ethylene Glycol Tetraacetic Acid (EGTA) yang merupakan agen selektif untuk ion Ca2+. Habisnya Ca2+ pada kultur sel dapat menyebabkan terbukanya tight junctions yang berperan dalam ikatan antar sel dan barrier molekul antar sel epitel antara lapisan konfluen sel eukariotik.
Hasil penelitian yang dilakukan oleh Mange et al. (2006) dengan 50 stain E. sakazakii yang diujikan pada sel lestari HEp-2 dan Caco-2 (epitel manusia), serta sel lestari HBMEC (mikrovaskuler otak) menyimpulkan bahwa kemampuan adhesi dari E. sakazaki tidak dipengaruhi oleh adanya enzim tripsin, hemaglutinin, dan manosa yang diperantarai oleh suatu struktur fimbrie seperti yang ditemukan pada sebagian besar strain enterobacteriaceae. Kemampuan bakteri ini berasosiasi kuat dengan sel HEp-2 tanpa keterlibatan struktur fimbrial memiliki kesamaan dengan sifat enterotoksigenik E. coli (ETEC) yang diujikan pada sel lestari Caco-2 oleh Darfeuille et al. (1990). Untuk melepaskan toksinnya, bakteri ini berikatan sangat dekat dengan mikrovili tanpa menyebabkan lesio pada mikrovili tersebut.
I. 3. 4. Enterotoksin
Enterotoksin termasuk dalam kelompok eksotoksin yang kebanyakan menyebabkan kasus keracunan pada makanan. Enterotoksin merupakan protein oligomerik yang terdiri dari satu rantai polipeptida A dan lima rantai polipeptida B. Rantai polipeptida A bertugas dalam menghasilkan suatu perlukaan pada sel sehingga dapat mengeluarkan efek toksin ke dalam sel, sedangkan rantai polipeptida B bertugas untuk berikatan dengan permukaan reseptor dari sel inang. Toksin ini diproduksi di dalam pori-pori dan dilepaskan pada fase pertumbuhannya di dalam usus kecil, ukurannya lebih besar dari endotoksin, dengan berat molekul sekitar 50 – 1000 kDa dan berfungsi seperti enzim dengan potensi toksik yang tinggi (konsentrasi 1 µg dapat menyebabkan keracunan). Toksin ini juga bersifat sitotoksik (tidak menyebabkan kerusakan pada membran sel tetapi menyebabkan peningkatan pembentukan messenger intraseluler (cAMP) yang dapat meningkatkan sekresi dan menyebabkan diare), tahan panas (heat stable) sehingga pemanasan terhadap makanan tidak akan merusak toksin, dan dapat membunuh sel dengan mengubah permeabilitas dari epitel sel dinding usus.
Di samping itu, enterotoksin bersifat tahan asam dan tahan terhadap pengaruh enzim proteolitik, seperti tripsin dan pepsin (Clements 1997 diacu dalam Paryati 2006) sehingga proses pemusnahannya menjadi sulit. Enterotoksin juga tidak merangsang terjadinya suatu tanggap perbarahan meskipun kuman yang menghasilkannya bersifat flogistik atau menyebabkan perbarahan dan dihasilkan oleh berbagai bakteri termasuk bakteri penyebab keracunan makanan seperti Escherichia coli, Salmonella, Staphylococcus, Clostridium perfringens, dan Yersinia enterocolitis (Gyles & Thoen 1993).
I. 4. Metode penghitungan dan isolasi E. sakazakii
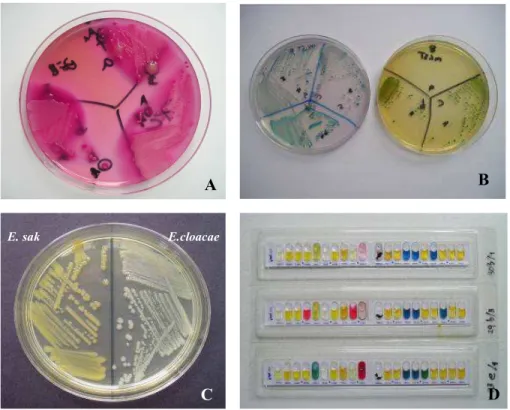
Tahun 1988, Muytjens et al. menemukan metode penghitungan kwantitatif E. sakazakii dalam makanan bubuk formula yang pertama dengan menggunakan media Sheep Blood Agar dan Eosin-Methylene Blue Agar untuk pembiakkan dan memakai sistem API 20E (Gambar 2D) untuk mengidentifikasi strain ini. Tahun 2002, FDA dan CFSAN mengeluarkan protokol tentang cara perhitungan kwantitatif E. sakazakii dalam makanan bubuk formula dengan menggunakan FDA/BAM (FDA’s Bacteriological Analytical Manual). Media yang digunakan
untuk mengisolasi E. sakazakii adalah MacConkey agar, MacConkey-sorbitol Agar, Eosin Methylene Blue (EMB) Agar, Deoxycholate Agar, Tergitol 7 Agar, Xylose-lysine-deoxycholate (XLD) Agar dan Violet Red Bile (VRB) Agar (Gambar 2A). Selain itu, API 20E juga dapat digunakan sebagai sistem konfirmasi akhir untuk strain ini. (FDA & CFSAN 2002b). Beberapa contoh positif dari uji identifikasi isolat E. sakazakii dapat dilihat pada Gambar 2.
Gambar 2 Isolasi dan identifikasi E. sakazakii; A: Media VRBG, B: Media ESIA (hijau) dan DFI (kuning), C: Media Caso Agar, D: Sistem API20E Biomereux’ (Sumber : Estuningsih et al. 2006b)
Berdasarkan data dari Oxoid ltd tahun 2004 (Anonim 2004a), terdapat metode yang lebih cepat dari FDA yaitu Oxoid Chromogenic E. sakazakii Agar (DFI formulation). Media yang digunakan mengandung substrat 5-bromo-4-chloro-3-indolyl-a dan D-glucopirosonide yang akan dipecah oleh enzim α-glukosidase yang dimiliki bakteri ini dan membentuk suatu koloni berwarna hijau kebiruan. DFI agar kemudian dipakai sebagai salah satu media dalam prosedur isolasi dan identifikasi E. sakazakii dengan dasar metode yang diperkenalkan sebagai FDA yang dimodifikasi (Iversen et al. 2004a). Koloni pada DFI dapat dilihat pada Gambar 2B. Menurut Soe dan Brackett (2005), pengujian dengan
E. sak E.cloacae
C
B
D A
real-time PCR juga dapat digunakan untuk mengetahui dengan cepat keberadaan E. sakazakii pada makanan bayi dan dapat digunakan dalam industri makanan dan regulator agensi.
I. 5. Kejadian infeksi akibat Enterobakter sakazakii
Keberadaan E. sakazakii tercatat pada 31 literatur kasus di Inggris (1960-1999) dan terjadi pada kisaran umur penderita 3 hari hingga 4 tahun dengan tingkat infeksi pada bayi umur ≤ 1 minggu mencapai 50%, bayi dengan umur < 1 bulan mencapai 75%, dan bayi dengan berat badan ≤ 2,5 kg juga teridentifikasi sebagai ciri dari 75% pasien yang terinfeksi. Bayi prematur (<28 hari) dan bayi dengan berat badan lahir rendah (<2500 g) adalah grup yang memiliki resiko paling besar mengalami infeksi oleh E. sakazakii daripada bayi normal, anak-anak, ataupun dewasa (Mullane et al. 2007; Himelright et al. 2002). Bowen dan Braden (2006) menelaah 46 kasus pada bayi akibat infeksi E. sakazakii, 12 bayi diketahui menderita bakteriemia, 33 menderita meningitis, dan 1 mengalami infeksi pada traktus urinarius. Pada pasien yang menderita meningitis, 11 (33%) mengalami seizures, 7 (21%) mengalami abses pada otak, dan 14 (42%) meninggal dunia. Berdasarkan informasi hasil identifikasi kejadian wabah yang diakibatkan oleh bakteri ini dari International Risk Assessment (IRA), FAO dan WHO (2006) membagi dua grup beresiko besar terkena wabah E. sakazakii yaitu grup yang mudah terserang yaitu semua bayi dibawah umur 12 bulan dan grup yang paling mudah terserang yaitu semua bayi kurang dari 2 bulan dan bayi yang mengalami gangguan kekebalan tubuh (immunocompromised).
Dari informasi yang tersedia diketahui kejadian infeksi ini telah terjadi pada bayi di beberapa negara, sebagian besar kejadian infeksi tersebut dapat dilacak dan dibuktikan karena bayi yang terkena infeksi dirawat di rumah sakit anak pada instalasi Neonatal Intensive Care Unit (NICU) (FAO & WHO 2006). Pada kasus tersebut diamati dan diteliti penyebabnya yang rata-rata dapat dibuktikan disebabkan oleh infeksi E. sakazakii yang berasal dari susu formula bayi. Kasus pertama akibat infeksi E. sakazaki muncul di Inggris pada tahun 1958 yang menyebabkan kejadian meningitis pada 2 bayi. Sejak itu lebih dari 70 kasus dilaporkan dan diantaranya yaitu ditemukan 2 kasus meningitis lethal pada
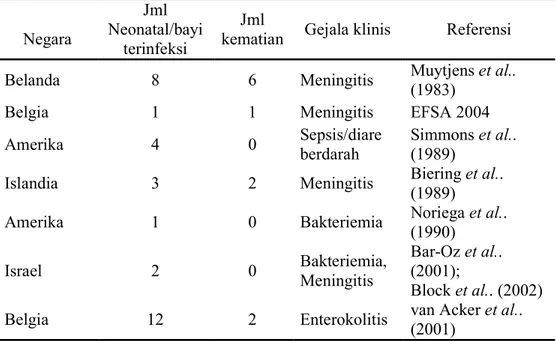
bayi prematur yang keadaannya cepat memburuk mengikuti kelahiran normal pada tahun 1961 (Bar Oz et al. 2001). Di Amerika Serikat angka kejadian infeksi E. sakazakii yang pernah dilaporkan adalah 1 per 100.000 bayi dan terjadi peningkatan angka kejadian menjadi 9.4 per 100.000 pada bayi dengan berat lahir sangat rendah (<1.5 kg) (Anonim 2002b). Beberapa kejadian outbreak meningitis pada neonatal menurut Estuningsih et al. (2006a) dapat dilihat pada Tabel 3. Tabel 3 Enterobacter sakazakii dan outbreak penyakit yang berhubungan dengan
susu formula bayi yang terjadi dibeberapa Negara
Negara
Jml Neonatal/bayi
terinfeksi
Jml
kematian Gejala klinis Referensi
Belanda 8 6 Meningitis Muytjens et al..
(1983)
Belgia 1 1 Meningitis EFSA 2004
Amerika 4 0 Sepsis/diare
berdarah
Simmons et al.. (1989)
Islandia 3 2 Meningitis Biering et al..
(1989)
Amerika 1 0 Bakteriemia Noriega et al..
(1990) Israel 2 0 Bakteriemia, Meningitis Bar-Oz et al.. (2001); Block et al.. (2002)
Belgia 12 2 Enterokolitis van Acker et al..
(2001)
Secara umum, tingkat kefatalan kasus (case-fatality rate) atau resiko untuk dapat mengancam jiwa pada bayi baru lahir dengan diagnosis infeksi berat oleh infeksi bakteri ini berkisar antara 40 - 80% (Anonim 2002a). Gejala yang umum ditimbulkan memiliki kesamaan dengan gram negatif lain seperti menurunnya nafsu makan, iritasi, jaundice, gangguan pernapasan, diare, kembung, muntah, temperatur tubuh yang tidak stabil, sesak hingga kejang (Judarwanto 2008). Pada beberapa kasus dilaporkan terjadi infeksi di saluran kencing (Erickson et al. 2005), bakteriemia dan osteomielitis pada penderita dewasa (Judarwanto 2008). Mullane et al. (2007) menyatakan bahwa meski infeksi oleh E. sakazakii jarang terjadi, namun bakteri ini dapat mengakibatkan penyakit yang sangat berbahaya hingga dapat mengancam jiwa, diantaranya adalah meningitis neonatal (infeksi selaput otak pada bayi), hidrosefalus (kepala besar karena cairan otak berlebihan), sepsis (infeksi berat), dan necrotizing enterocolitis (kerusakan berat saluran
cerna). Menurut laporan Nazarowec dan Farber (1997) dari semua kasus infeksi akibat bakteri ini, penyakit yang paling sering ditemukan adalah seizures, abses otak, hydrocephalus, dan infeksi Sistem Saraf Pusat (SSP) yang akan menyebabkan hambatan dalam perkembangan fisik dan mental (Lai 2001). Infeksi otak yang disebabkan oleh bakteri ini dapat mengakibatkan infark atau abses otak (kerusakan otak) dengan bentuk kista, gangguan saraf berat dan gangguan perkembangan. Gram negatif lain yang diketahui dapat mengakibatkan abses pada otak neonatus, yaitu Citrobacter dan E. coli (Lai 2001).
II. Makanan pengganti ASI dan susu formula bayi II. 1. Definisi Susu
Susu adalah cairan yang dihasilkan oleh kelenjar-kelenjar susu (mammae) baik dari binatang maupun dari manusia (ibu). Air susu yang berasal dari manusia lebih dikenal dengan sebutan Air Susu Ibu (ASI) dan yang berasal dari hewan disebut Pengganti Air Susu Ibu (PASI) (Seodiaoetama 2004).
II. 1. a. Makanan Pengganti ASI
Makanan pengganti ASI (MP-ASI) merupakan suatu bahan makanan dalam perbandingan tertentu dengan kadar gizi yang tinggi (Hermana et al. 1977) dan diberikan sebagai pelengkap ASI. ASI merupakan penyumbang terbesar terhadap zat-zat gizi untuk pertumbuhan dan kesehatan hingga umur 6 bulan. Setelah itu ASI tidak dapat lagi memenuhi kebutuhan karena itu membutuhkan MP-ASI. Menurut SNI 01-7111.4-2005, MP-ASI adalah makanan yang bergizi yang diberikan disamping ASI kepada bayi usia 6 bulan keatas atau berdasarkan indikasi medik, sampai anak berusia 24 bulan untuk mencapai kecukupan gizinya (Badan Standar Nasional Indonesia 2005).
II. 1. b. Susu Formula Bayi
Susu formula merupakan produk yang termasuk dalam makanan pengganti ASI, meliputi makanan dan minuman yang dipasarkan/dinyatakan sebagai makanan bayi dan digunakan sebagai pengganti ASI baik seluruhnya ataupun sebagian. Susu formula adalah susu yang terbuat dari susu sapi atau susu kedelai atau protein hidrolisa, lemak, karbohidrat, vitamin dan mineral. Formula ini
dibuat aman untuk dikonsumsi dan bebas dari mikrobakteri yang patogen serta dipertahankan kestabilannya (Suhardjo 1995)
Muchtadi (2002) mendefenisikan susu formula adalah susu sapi yang diformulasikan sedemikian rupa sehingga komposisinya mendekati ASI. Secara umum susu formula dibagi menjadi 3 golongan :
1. Susu formula adapted yaitu susu formula yang disesuaikan dengan keadaan fisiologis bayi, komposisinya mendekati ASI sehingga cocok digunakan bayi yang baru lahir hingga 4 bulan.
2. Susu formula complete sharing yang memiliki susunan zat gizi lengkap dan dapat diberikan sebagai formula permulaan
3. Susu formula follow sharing yaitu lanjutan yang diperuntukkan bagi bayi umur 36 bulan. Mengandung protein dan mineral yang lebih tinggi dari susu formula. Dapat diberikan kepada anak yang sehat maupun yang mengalami gangguan metabolisme namun menggunakan formula khusus yang disebut formula diit.
Susu mengandung berbagai macam unsur dan sebagian besar terdiri dari zat makanan yang diperlukan bagi pertumbuhan bakteri. Oleh karena itu, pertumbuhan bakteri dalam susu terjadi sangat cepat pada susu yang sesuai. Susu tidak boleh mengandung mikroba patogen dan benda asing yang dapat mencemarinya. Berdasarkan SNI 01-6366.2000, jumlah mikroba maksimal dalam makanan adalah 5x104 cfu/gram makanan dan apabila mengkonsumsi makanan dengan tingkat kontaminasi mikroba melebihi batas yang telah ditentukan, maka dapat menyebabkan gangguan kesehatan (Badan Standar Nasional Indonesia 2000).
II. 2. Kontaminasi susu formula dan makanan bayi
Hasil survey pada tahun 1988 menyebutkan bahwa sebesar 52.2% dari 141 makanan formula bayi dari 35 negara terkontaminasi Enterobacteriaceae dengan 25% terkontaminasi oleh Enterobacter agglomerans, 21% oleh Enterobacter cloacae, dan 14% oleh E. sakazakii. Berdasarkan hasil penelusuran di Kanada, bakteri ini diketahui mengkontaminasi makanan bayi sejumlah 1 cfu/100gr dan spesies Enterobacter yang paling banyak didapatkan adalah Enterobacter
agglomerans, Enterobacter cloacae, E. sakazakii, dan Klebsiella pneumoniae (Muytjens et al. 1988).
Estuningsih et al. (2006a) menemukan 47% (35 sampel) dari 74 sampel makanan formula bayi asal Indonesia dan Malaysia terkontaminasi oleh Enterobacteriaceae, dengan kontaminasi E. sakazakii sebanyak 13,5% (10 sampel) pada sampel dari Indonesia. Hasil penelitian Hibah Bersaing XIV tahun l Estuningsih et al. (2006b) dengan menggunakan 22 sampel susu formula dan 15 sampel makanan bayi menunjukan bahwa sebanyak 22,73% susu formula dan 46,7% makanan bayi (MP-ASI) yang diteliti tercemar E. sakazakii dengan level MPN (Most Probability Number) kontaminasi terendah 0,36 cfu/100 gram dan tertinggi 15,0 cfu/100 gram, namun sampai saat ini pengaruh keberadaan E. sakazakii di Indonesia sendiri belum diketahui. Berdasarkan fakta yang terjadi, beberapa negara menyatakan bahwa susu bubuk formula bayi sebagai sumber infeksi dari wabah yang menyerang neonatus (Taylor 2002) dan pencemaran oleh lingkungan saat pembuatan susu konsumsi mungkin menjadi penyebab pencemaran oleh bakteri ini (Van Acker 2001). Beberapa laporan tentang kejadian kontaminasi oleh E. sakazakii menurut Estuningsih et al. (2006a) dapat dilihat pada Tabel 4.
Tabel 4 Laporan kejadian adanya Enterobacter sakazakii dalam makanan bayi dan susu bayi
Negara Sumber kontaminasi Referensi
Amerika Susu bubuk Farmer et al. (1980)
Belanda Susu bubuk rekonstitusi, susu bubuk
formula Muytjens et al. (1983)
Czesnia susu bubuk formula Postupa and Aldova (1984) 35 negara susu bubuk pengganti ASI Muytjens et al.. (1988) Kanada Susu bubuk rekonstitusi, susu bubuk
formula
Nazarowec-White and Farber (1997)
Amerika susu bubuk formula Simmons et al.. (2001) Israel susu bubuk formula, blender Bar-Oz et al.. (2001) ;
Block et al.. (2002)
Proses kejadian pencemaran pada susu formula dan MP-ASI belum diketahui pasti, namun menurut WHO terdapat tiga jalan bagaimana bakteri ini dapat mengontaminasi susu formula bayi dan makanan khusus bayi yaitu :
1. Kontaminasi terjadi pada bahan mentah yang digunakan untuk memproduksi produk.
2. Kontaminasi terjadi pada produk yang dihasilkan atau pada bahan kering lainnya setelah pasteurisasi.
3. Kontaminasi terjadi pada saat produk disiapkan sebagai makanan yang akan dikonsumsi bayi (WHO 2004)
Oleh karena itu Druddy et al. (2006) menegaskan bahwa makanan pengganti ASI bukanlah suatu produk yang steril. Berdasarkan literatur dari FDA & CFSAN (2002a) menyebutkan bahwa resiko dari pemakaian makanan pengganti ini dapat dikurangi, yaitu dengan :
1. Menyeduh air yang digunakan untuk susu bersuhu minimal 70oC. 2. Menjaga kebersihan botol dan sendok penyeduh (sterilisasi). 3. Good personal hygiene dari penyaji.
4. Harus dikonsumsi segera, tidak boleh disimpan lebih dari 4 jam setelah dicairkan.
5. Jika tidak dikonsumsi, disimpan pada suhu dingin 10oC dengan jarak antara pembuatan dan konsumsi susu harus seminimal mungkin.
Meutia (2008) menyatakan bahwa suhu rekonstruksi 4 dan 40oC tidak memadai sebagai suhu rekonstruksi untuk susu formula dan makanan bayi dalam mengurangi resiko E. sakazakii, sedangkan pemanasan dengan suhu 100oC tidak direkomendasikan karena dapat merusak komponen gizi yang terdapat pada susu formula dan makanan bayi. Selain itu untuk daerah tropis, hang time (jarak antara penyajian hingga dikonsumsi) maksimum selama dua jam, rekonstitusi dengan suhu 70oC dapat menjadi salah satu tindakan manajemen resiko infeksi E. sakazakii dalam lingkungan rumah tangga.
III. Biologi Sel III. 1. Definisi sel
Sel merupakan unit dasar suatu makhluk hidup baik secara struktural maupun fungsional (Sugiri 1992). Ilmu yang mempelajari tentang sel disebut
Biologi sel (juga disebut sitologi, dari bahasa Yunani kytos, "wadah"). Hal yang dipelajari dalam biologi sel mencakup sifat-sifat fisiologis sel seperti struktur dan organel yang terdapat di dalam sel, lingkungan dan interaksi sel, daur hidup sel, pembelahan sel dan fungsi sel (fisiologi), hingga kematian sel. Hal-hal tersebut dipelajari baik pada skala mikroskopik maupun skala molekular, dan sel biologi meneliti baik organisme bersel tunggal seperti bakteri maupun sel-sel terspesialisasi di dalam organ multisel seperti manusia (Anonim 2008a).
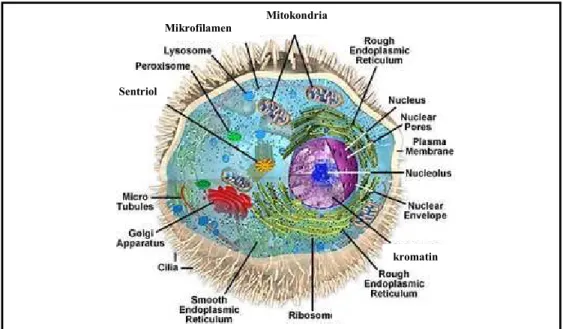
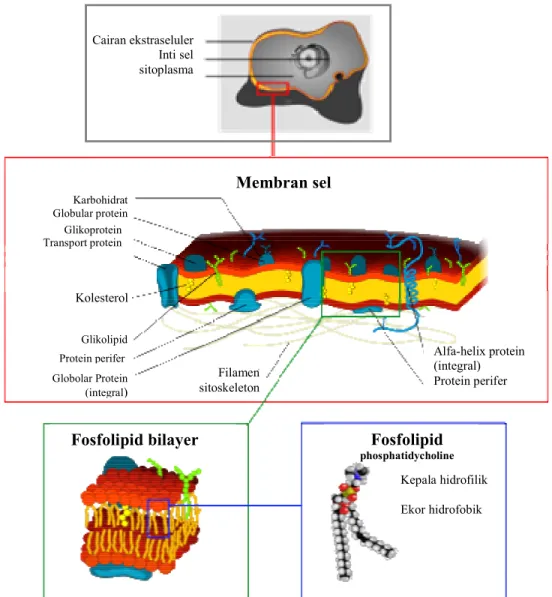
Berdasarkan bentuknya, sel terlihat seperti sebuah kantong yang dipenuhi oleh cairan yang disebut sebagai sitoplasma (sitosol) yang merupa cairan garam dengan berbagai molekul organik di dalamnya (Gambar 3). Sitoplasma dilengkapi dengan membran sel (phospholypid bilayer) yang terdiri dari dua lapis molekul lemak yang saling melekat kuat, bersifat selektif permeabel yang secara fisik memisahkan komponen intraseluler dan lingkungan ekstraseluler. Membran sel ini tersusun atas lapisan tipis amphipathic phospholipids yang terdiri atas bagian hidrofobik (tail) untuk melindungi dari lingkungan sekitar yang berbeda dan bagian hidrofilik (head) yang akan berhubungan dengan permukaan sitosol dan ekstraseluler bilayer (Gambar 4).
Gambar 3 Gambaran skematis anatomi sel hewan (Sumber : Anonim 2008a) Pada membran sel juga ditemukan banyak molekul biologik, protein primer dan lemak (lipid) yang berperan dalam cell signaling (memungkinkan
Anatomi Sel Hewan Mitokondria Mikrofilamen
Sentriol
adanya komunikasi antar sel), pengaturan ion channel, marker yang bertugas mengidentifikasi sel-sel (sebagai sistem pertahanan) dan adhesi sel. Proses adhesi sel dapat terjadi karena adanya suatu molekul sel adhesi (cell adhesion molecules/CAMs) bersifat spesifik yang berinteraksi dengan molekul yang ada pada permukaan sel lain atau pada suatu matriks ekstraseluler (extracellular matrix/ECM) di suatu permukaan (Anonim 2008c).
Gambar 4 Gambaran skematis lapisan membran sel (Sumber : Anonim 2008c)
Matriks ekstraseluler terdiri atas matriks interstitial dan membran basal. Matriks interstitial terletak diantara sel-sel dan berperan sebagai compression buffer melawan stres ligkungan pada ECM sedangkan membran basal terdiri atas
Karbohidrat Globular protein Kolesterol Glikolipid Globolar Protein (integral) Membran sel Filamen sitoskeleton Alfa-helix protein (integral) Protein perifer
Fosfolipid bilayer Fosfolipid
phosphatidycholine Kepala hidrofilik Ekor hidrofobik
Sel
Cairan ekstraseluler Inti sel sitoplasma Glikoprotein Transport protein Protein periferlembaran ECM yang merupakan tempat bagi sel-sel epitel bertengger (Anonim 2008c). Pada membran basal juga terdapat membran berelektron padat yang disebut lamina densa dan pada bagian bawah terdapat kumpulan kolagen fibril retikular (type III). Fungsi utama membran basal adalah sebagai jangkar bagi epithelium agar tidak terlepas dari ikatan pada jaringan dibawahnya (Anonim 2008c).
Pada bagian luar membran sel biasanya dilengkapi sebuah struktur tambahan, contohnya sebagian besar bakteri dan sel tumbuhan memiliki suatu dinding sel sebagai fungsi pertahanan melawan faktor mekanik, kimia ataupun biologis yang merugikan. Sebagian sel juga dilengkapi dengan bentukan rambut silia pada permukaannya (contoh: pada Protista disebut silver slipper), atau sebuah cambuk panjang (contoh: Sel sperma) yang digunakan untuk bergerak. Di dalam setiap sel terdapat suatu material herediter yang disebut DNA yang membawa semua keterangan tentang sifat bawaan suatu sel (kecuali sel darah merah) (Zivkovic 2006).
Sugiri (1992) menerangkan beberapa fase dari pertumbuhan sel yang terjadi jika sel dibiakkan dalam suatu medium nutrien yang menguntungkan pertumbuhan dan multifikasinya, yaitu fase pertumbuhan lambat (lag phase) yang terjadi pada awal daur pertumbuhan dimana sejumlah sel dibiakkan bersama dalam suatu media biakan. Pada fase ini tidak ada peningkatan ataupun penurunan jumlah sel karena perbandingan sel yang ada sama dengan jumlah sel yang ditanam. Pertumbuhan sel lalu memasuki fase pertumbuhan logaritmis (log phase) dimana terjadi proses pembelahan sel secara cepat dan konstan hingga akhirnya sampai pada fase dimana jumlah sel yang hidup sama dengan jumlah sel yang mati akibat semakin menipisnya nutrien dan akumulasi limbah yang diproduksi selama pertumbuhan (static phase). Keadaan tersebut semakin lama akan membuat pertumbuhan sel lambat atau tidak ada sama sekali dan sel mati, fase ini dinamakan fase kematian atau death phase ( Freshney 2005).
III. 2. Kultur jaringan
Kultur jaringan adalah proses pembiakan jaringan secara buatan dalam lingkungan yang terkontrol dengan tujuan untuk mempelajari berbagai sifat
jaringan tubuh dalam kondisi yang lebih sederhana dan terkontrol diluar tubuh. Cara ini juga sering disebut sebagai cara in vitro, karena istilah ini berkaitan dengan tabung test atau tabung gelas ( Latin: Vitro = tabung gelas). Menurut Malole (1990), dilihat dari komposisi selnya kultur jaringan terbagi menjadi tiga yaitu kultur sel, kultur organ, dan kultur eksplan.
• Kultur sel merupakan kultur sel-sel yang berasal dari jaringan atau organ yang telah diuraikan secara mekanis ataupun enzimatis menjadi suspensi sel, suspensi inilah yang akan dibiakkan menjadi satu lapis jaringan (monolayer) diatas permukaan yang keras seperti botol, tabung, cawan ataupun multiwell, atau menjadi suspensi sel dalam media pertumbuhan. Monolayer ini dapat diperbanyak lagi melalui subkultur (passage), sehingga diperoleh sel yang lestari (cell line).
• Kultur organ adalah kultur dari sebagian atau seluruh organ secara in vitro dengan sifat-sifat kultur jaringan dan fungsi organ tersebut masih dapat dipertahankan seperti keadaan in vivo. Kultur ini biasanya digunakan untuk mengetahui pertumbuhan normal dan pengaruh-pengaruh faktor luar terhadap sifat organ.
• Kultur eksplan primer memiliki kesamaan dengan kultur organ, hanya organ yang dikultur lebih kecil dari kultur organ yaitu antara 1-2 mm3. Karena jika yang diambil kurang dari 1 mm3 maka sel yang tumbuh jumlahnya sangat sedikit, sedang jika lebih dari 2 mm3 akan mudah mati karena bagian tengahnya tidak mendapat makanan dari media.
Beberapa sel hidup normal dengan tidak menempel pada suatu permukaan, contohnya sel-sel darah. Sel-sel ini dapat dibiakkan dengan menggunakan suspensi kultur, sedangkan sel yang lain membutuhkan suatu permukaan untuk perlekatan, seperti kebanyakan sel pada jaringan. Sel-sel ini dapat dibiakkan dalam suatu tissue culture plastic yang harus dilapisi dengan komponen matriks ekstraseluler untuk meningkatkan daya adhesi dan dilengkapi dengan komponen lain untuk pertumbuhan hingga membentuk sel monolayer. Sel monolayer ini dapat dilepaskan dari suatu jaringan atau permukaan dengan menggunakan enzim-enzim pencernaan melalui proses enzim-enzimatis, contohnya oleh kolagenase, tripsin, ataupun pronase, yang akan merusak matriks ekstraseluler (Anonim 2008b).
Sel kultur yang dapat tumbuh dan subkultur (passage) secara berkelanjutan dapat menghasilkan continous cell line atau sel lestari. Terbentuknya continous cell line biasanya ditandai dengan perubahan morfologi sel (sel lebih mengecil, kurang erat melekat, lebih bulat, perbandingan inti dan sitoplasmanya lebih besar), lebih cepat tumbuh, waktu yang dibutuhkan untuk tumbuh menjadi dua kali populasi semula menjadi lebih pendek yaitu dari 36-48 jam menjadi 12-36 jam, ketergantungan pada serum berkurang (lebih mampu berploriferasi dalam suspensi sebagai kultur cair atau koloni terpisah dalam agar), dan derajat heteroploid-nya meningkat (peningkatan variasi kromosom diantara sel) (Freshney et al. 2006) .
Menurut Malole (1990) sel yang berasal dari mesoderm (fibroblast, endotel, dan myoblast) lebih mudah dikultur dari pada epitel, neuron, dan jaringan endokrin karena sel-sel mesoderm lebih peka terhadap faktor mitogenik yang ada pada serum dan mampu berdeferensiasi dan bereplikasi di dalam kultur. Faktor sitotoksik dari suatu meterial dapat diketahui dengan menggunakan teknik in vitro pada kultur sel. Dengan metode ini, ada atau tidaknya zat toksin kimia suatu material dapat dilihat dari kemampuannya membunuh sel (sitolisis) dengan segera atau bertahap melalui penghambatan oleh alur metabolik sel. Sitolisis terjadi saat sel pecah karena ketidakseimbangan tekanan osmotik akibat banyaknya air yang masuk kedalam sel yang mengakibatkan volume dalam sel meningkat (hypotonik). Jika volume ini melebihi kemampuan dari membaran sel untuk menahan, maka sel ini akan pecah.
III. 3. Faktor-Faktor yang Mempengaruhi Perkembangan Kultur
Malole (1990) menyatakan, pH, tekanan osmotik, temperatur, gas dan substrat merupakan faktor-faktor yang dapat mempengaruhi perkembangan kultur. Untuk mempertahankan spesifitasnya maka kondisi kultur harus disesuaikan dengan keadaan lingkungan awal di dalam tubuh. Freshney dan Gordana (2006) menerangkan bahwa pertumbuhan sel memerlukan pH 7.4 dan jika dalam proses pembiakan sel pH media lebih rendah dari 7, pertumbuhan sel dapat terhambat. Pengaturan pH dapat dilakukan dengan penambahan 5% CO2 pada ruangan diatas media, sedangkan keseimbangannya dapat dijaga dengan menambahkan NaHCO3.
Tekanan osmotik medium terjadi karena adanya mineral-mineral dan glukosa yang terlarut dalam medium. Temperatur optimal untuk pertumbuhan sel tergantung pada temperatur hewan asalnya. Macam gas yang dibutuhkan oleh setiap sel berbeda-beda tergantung medium kultur dan system buffer yang digunakan serta susbtrat sebagai tempat tumbuhnya biakan sel atau kultur jaringan. Substrat yang baik adalah substrat yang tidak toksik, tidak mengganggu pertumbuhan sel dan tembus pandang agar mempermudah pengamatan perkembangan kultur (Malole 1990). Pada pelaksanaan kultur in vitro, tekanan osmotik, derajat keasaman (pH), ion organik dan gas harus selalu diperhatikan. Secara alami NaCl, ion organik dan glukosa dapat mempengaruhi dan menjaga tekanan osmotik medium kultur, oleh karena itu konsentrasi ketiganya perlu dijaga agar tekanan osmotik berada pada kisaran normal. Ion organik diperlukan dalam menjaga tekanan osmotik dan pH, metabolisme sel dan aktivitas enzimatik, serta perlekatan dan penyebaran sel pada media kultur (Bird & Forrester 1981).
Sel kultur membutuhkan lingkungan yang steril dan suplai nutrisi untuk tumbuh. Pemilihan growth medium merupakan langkah yang penting di dalam teknik kultur sel. Fungsi utama growth medium adalah untuk mempertahankan pH, menyediakan lingkungan yang baik dimana sel dapat bertahan hidup dan juga menyediakan substansi-substansi yang tidak dapat disintesa oleh sel itu sendiri. Pemilihan substansi didasarkan pada jenis sel yang akan ditumbuhkan (Davis 1994). Cairan sel yang terbukti dapat menunjang pertumbuhan sel di luar tubuh adalah serum. Serum berasal dari campuran kompleks berbagai biomolekul yang kecil maupun besar yang memiliki berbagai aktivitas pendorong dan penghambat pertumbuhan yang berada dalam keseimbangan fisiologis. Serum yang biasa digunakan adalah fetal calf serum (FCS) dan fetal bovine serum (FBS) (Freshney & Gordana 2006). Fungsi utama serum yaitu sebagai media suplemen yang biasanya banyak didapatkan dari darah, faktor hormonal yang menstimulasi pertumbuhan dan aktivitas sel (Growth factor), faktor pembantu terjadinya perlekatan sel dan penyebarannya (Fibronectin yaitu protein penyusun serum dan fetuin dalam serum fetus), serta sebagai protein pembawa seperti hormon, mineral, lemak dan lainnya (Malole 1990).
Subkultur (passage) dilakukan untuk membantu mempercepat pertumbuhan sebagian kecil sel menjadi kultur sel baru. Sel dapat dikultur dalam waktu yang lama jika passage dilakukan secara teratur agar terhindar dari kepadatan sel oleh sel-sel lama. Suspensi kultur dapat dengan mudah dipassage dalam jumlah sel sedikit dengan perbandingan jumlah volume media baru yang lebih besar. Untuk perlekatan, sel kultur membutuhkan suatu tempat untuk melekat dan penambahan campuran dari tripsin-EDTA dapat membantu penempelan sel, kemudian sel dapat digunakan sebagai bibit pada kultur yang baru. Penggunaan antibiotik dapat mencegah adanya pertumbuhan mikroorganisme penghambat pertumbuhan sel kultur. Antibiotik berbeda mempunyai spektrum antimikroba yang berbeda pula. Penicillin merupakan antimikroba untuk bakteri gram positif, streptomycin untuk bakteri gram positif dan negatif, sedangkan gentamycin dapat digunakan untuk bakteri gram positif, negatif dan mikoplasma (Freshney & Gordana 2006).
IV. Sel Vero IV. 1. Definisi
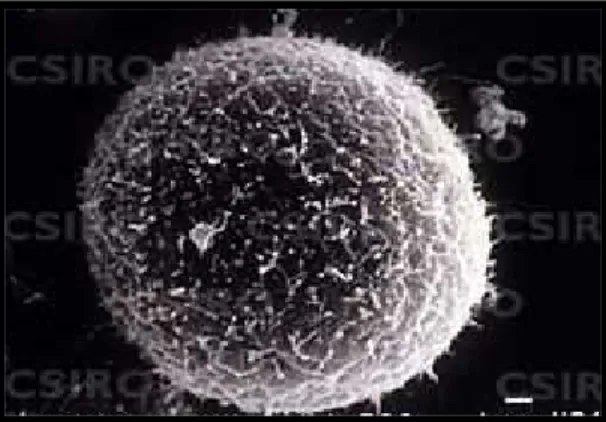
Sel vero merupakan sel yang berasal dari sel epitel ginjal dari Monyet Hijau Afrika (Cercopithecus aethiops). Sel ini pertama kali ditemukan pada tanggal 27 Maret 1962, oleh Yasumura dan Kawakita dari Universitas Chiba di Chiba, Jepang (Anonim 2007b).
Gambar 5 Gambaran Sel Vero dengan ukuran bar 1 ηm (Sumber : Anonim 2007c)
Dalam sebuah artikel tentang penyimpanan dan karakteristik sel vero yang dipublikasikan oleh seorang ilmuwan dari Institut Merieux, tercantum bahwa
ciri-ciri sel vero berdasarkan uji karyologi aneuploid dengan analisis isoenzim, termasuk laktat dehydrogenase, phospho-glukonat dehydrogenase, dan glukos phosphat isomerase, menunjukkan bahwa sel ini berasal dari Cercopithecus dan berbeda dengan sel Hep-2, WI-38, dan MRC-5 (human cell strains or lines). Secara rasional penggunaan sel vero lebih sering dari pada sel primer ginjal kera karena selain dapat disimpan, sel ini memiliki karaktristik yang bagus, dan terhindar dari persoalan variasi lot-by-Iot serta kedatangan agen kontaminan dari kultur primer segar yang baru untuk setiap diproduksi dari ginjal kera yang digunakan. Selain itu dalam segi jumlah, pelestariannya juga menjadi masalah terutama dalam segi etika dan ekonomi (Rebecca 2000).
IV. 2. Manfaat Sel Vero
Sel vero lebih sering digunakan dibandingkan sel diploid karena sel vero bisa lebih diadaptasikan untuk pertumbuhan dalam bioreactors on microcamiers dan penyediaan sel dalam jumlah besar untuk propagasi virus. Sel ini digunakan untuk pembuatan vaksin murni (less contaminating cell debris), vaksin dalam jumlah banyak (i.e., greater vaccine availability), dan berbagai nilai ekonomik lain dalam pembuatan vaksin (Rebecca 2000). Selain itu, sel ini juga sudah digunakan secara luas seperti untuk studi replikasi virus dan juga plaque assays.
Sel vero sangat sensitif terhadap inveksi dari SV-40, SV-5, campak, arboviruses, reoviruses, rubella, simian adenoviruses, virus polio, virus influenza, parainfluenza viruses, respiratory syncytial viruses,vaccinia, dan sebagainya (Rebecca 2000). Sel ini juga dapat digunakan untuk menjelaskan mekanisme rusaknya sel akibat toksin. Sebagai contoh adalah enterotoksin yang di produksi oleh Clostridium perfringen yang dapat menyebabkan kerusakan parah pada membran sitoplasma, dengan menggunakan sel vero maka mekanisme kerjanya dapat dipelajari. Sama halnya seperti Clostridium perfringen, Shigella dysenteriae memiliki shiga toksin yang dapat menghasilkan toksin sebesar 10 pg, dengan LD50 ( dosis yang dibutuhkan untuk membunuh 50% sel) yang dimiliki sel vero sebesar 1 pg ini berarti keberadaan toksin ini akan menyebabkan kematian semua sel vero (Simizu & Toyozo 1987 ).
Pada tahun 1978 ditemukan sebuah toksin yang diproduksi oleh Famili enterobacteriaceae (E. coli 0157:H7) yang memiliki efek fatal bagi sel vero.
Namun hasil ini tidak begitu diperhatikan hingga pada tahun 1982, terjadi beberapa kasus keracunan makanan di Amerika yang disebabkan oleh E.coli (0157:H7) yang menghasilkan Verotoksin. Secara imunologi, verotoksin ternyata memiliki protein identik dan karakteristik yang sama dengan toksin yang di produksi oleh Shigella dysenteriae. Penelitian lebih lanjut dengan menggunakan sel vero menemukan bahwa E. coli (0157:H7) memiliki dua jenis toksin. Toksin pertama diberi nama Shiga-like toksin I dan satunya diberi nama Shiga-like toksin II karena memiliki kesamaan dengan shigela toksin. Kedua toksin ini ditemukan menghambat terjadinya sintesis protein dalam sel eukariotik (Simizu & Toyozo 1987 ).
METODOLOGI
I. Waktu dan tempat penelitian
Penelitian ini dilaksanakan di Laboratorium kultur jaringan, Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian ini berlangsung pada bulan Februari hingga Maret 2007.
II. Materi penelitian
Bahan yang digunakan dalam penelitian ini adalah 12 isolat bakteri E. sakazakii, 1 isolat referensi internasional E. sakazakii American Type Culture Collection (ATCC) nomor 35217 sebagai standar, 1 isolat E. coli non pathogenic (ECNP) yang tidak menghasilkan enterotoksin (kontrol negatif), 1 isolat E. coli enteropathogenic (EPEC) yang menghasilkan enterotoksin (kontrol positif), Brain Heart Infusion (BHI) sebagai media pertumbuhan bakteri, dan sel lestari Vero sebagai media uji enterotoksin. Kedua isolat E. coli adalah koleksi dari Laboratorium Bakteriologi, FKH-IPB. Selain itu juga digunakan alkohol 70%, Newborn Bovine Serum, Feotal calf Serum, sodium azide, ether, 0,05% PTE (PBS-Tripsin 0,05%-EDTA 0,025%) steril, Dubbeccos Modified Eagle Medium (DMEM), NaHCO3, Streptomisin, Penisilin, Gentamisin sulfat, Fungizone®, dan Phospat Buffer Saline (PBS).
Alat–alat yang digunakan pada penelitian ini adalah botol plastik disposible, tissue culture flask/TCF (25 cm2, 75 cm2, 175 cm2), tissue culture plate 24 well/sumur (TPC 24), mikropipet, pipet pengukur steril 2,5 - 10 ml, pipet Pasteur steril, botol media, pipet tip, syringe, erlenmeyer, syringe filter, sentrifuse, tabung sentrifuse 15 dan 50 ml, inkubator dan shaker inkubator, lemari pendingin, tabung gas CO2, oven, waterbath, laminar air flow, inverted mikroskop, dan kamera digital.
III. Metode penelitian
Penelitian ini dilakukan dalam empat tahap yaitu 1. Persiapan isolasi enterotoksin yang akan diujikan aktivitasnya, 2. Pembuatan media kultur untuk sel
Vero, 3. Subkultur (passage) sel kultur asal sel Vero untuk dikembangkan sebagai perangkat pengujian dan 4. Uji sitotoksik enterotoksin E. sakazakii.
III. 1. Persiapan isolasi enterotoksin
Isolat E. sakazakii pada penelitian ini didapatkan dari hasil penelitian Hibah pada tahun 2006 yang dilaksanakan oleh Estuningsih et al. dengan cara mengisolasi E. sakazakii dari susu dan makanan bayi.
Metode yang dilakukan untuk mendapatkan enterotoksin mengikuti penelitian yang dilakukan oleh Pagotto et al. (2003). Isolat E. sakazakii yang digunakan berbentuk liofilisat (bentuk bekuan/bakteri kering), oleh karena itu isolat bakteri tersebut harus ditumbuhkan dahulu (propagasi). Kedalam tabung liofilisat ditambahkan 5 ml media Brain Heart Infusion (sebagai media perkembangan) dan dihomogenkan, kemudian disimpan selama 6 jam dalam inkubator 37 oC. Sebanyak 1 ml suspensi bakteri kemudian ditanamkan kedalam 200 ml media yang sama dan diinkubasi selama 18 - 24 jam dalam suhu 37 oC di dalam shaker inkubator dengan kecepatan 48 goyangan per menit. Keesokan harinya hasil kultur tersebut dipisahkan antara sedimen bakteri dan supernatan dengan cara disentrifuse pada kecepatan 4500 rpm, selama 30 menit pada suhu 4 o
C. Supernatan yang telah dipisahkan diambil dan ditempatkan pada tabung sentrifus 50 ml kemudian difiltrasi menggunakan Filter 0,22 µm untuk mendapatkan supernatan murni. Sebagian dari supernatan tersebut dipanaskan hingga mendidih selama 20 menit lalu dialikuot dalam tabung berukuran 4 ml dan disimpan dalam freezer -20oC hingga akan digunakan, demikian pula dengan filtrat murni E. sakazakii.
III. 2. Pembuatan media kultur sel Vero
Media kultur untuk pertumbuhan sel Vero terdiri atas Growth medium (GM) yang dibuat dengan mencampurkan beberapa komponen yaitu 89 ml DMEM dengan NaHCO3, 7,5 ml Feotal calf Serum (7%), 1 ml Streptomisin (104 µg/ml), 1 ml Penisilin (104 IU/ml), 0,5 ml Gentamisin sulfat (10 mg/ml), dan 1 ml Fungizone® (250 µg/ml), dan Maintenance Medium (MM) yang terdiri atas 94 ml DMEM dengan NaHCO3, 2,5 ml Newborn Bovine Serum (2,5%), 1 ml Streptomisin (104 µg/ml), 1 ml Penisilin (104 IU/ml), 0,5 ml Gentamisin sulfat (10
mg/ml), dan 1 ml Fungizone® (250 µg/ml). GM digunakan untuk propagasi sel Vero hingga konfluen didalam TCF dan didistribusikan pada TCP 24 hingga sel Vero konfluen sedangkan MM digunakan menjelang uji sitotoksik pada TCP 24.
III. 3. Subkultur (passage) sel lestari Vero
Subkultur (passage) sel Vero dilakukan dalam rangka pengujian aktivitas enterotoksin E. sakazakii yang diisolasi dari makanan dan susu bayi. Sub kultur dilakukan untuk memperbanyak sel lestari Vero yang telah konfluen.
Sel Vero didapatkan dari hasil passage ke-55 dari Balai Besar Penelitian Veteriner (Bbalitvet) Bogor. Metode yang dilakukan yaitu, sel Vero ditanam pada GM dalam TCF dan diamati dibawah inverted mikroskop. Pada hari berikutnya jika sel telah konfluen medium yang lama dibuang, kemudian dicuci dengan PBS yang mengandung antibiotik sebanyak 3 kali lalu ditambahkan 1ml tripsin 0,05% pada sel selapis (monolayer) yang disebarkan secara merata, dan disimpan di dalam inkubator 37°C hingga sel monolayer lepas dari permukaan flask (± 5-10 menit). Dengan menggunakan pipet steril 5 ml, ditambahkan GM sebanyak 5 ml pada sel yang telah lepas, kemudian dipindahkan pada tabung sentrifuse. Sentrifugasi dilakukan dengan kecepatan 1000 rpm (300 x g) selama 5 menit, setelah itu supernatan dibuang pada erlenmeyer steril. Pelet yang berada dalam tabung sentrifuse kemudian ditambahkan 5 ml GM, dan dilakukan pipetting secara perlahan-lahan (untuk memecahkan sel menjadi sel tunggal) kemudian sel dihitung dengan mengambil suspensi sel 0,1 ml yang ditambah dengan 0,9 ml Trypan Blue (10 kali pengenceran). Setelah diketahui jumlah sel, maka sel diencerkan menjadi 1x105 sel/ml dengan menambahkan GM, kemudian dimasukkan 10 ml suspensi sel ke dalam TCF 25 cm2 dan diberi nama sel, passage ke-, dan tanggal passage. Setelah itu, TCF tersebut ditutup rapat dan simpan di inkubator 37°C. Pertumbuhan sel di amati setiap hari.
Pada hari ke-3, medium yang lama dibuang dan diganti dengan GM baru. Pengamatan dilakukan hingga 4-6 hari (sel akan monolayer setelah 2-3 hari). Sel monolayer yang telah konfluen, dengan metode yang sama (passage ke-2) dikembangkan dalam TCF dengan luas 75 cm2 dengan tujuan memperbanyak sel yang dipanen. Sel hasil panen kemudian ditanam atau ditumbuhkan sebanyak 1
ml pada setiap well dari Tissue Culture Plate 24 (TCP 24) dengan kepadatan sel 105 sel/ml sebagai sumber sel yang akan di uji sitotoksik.
III. 4. Uji Sitotoksik
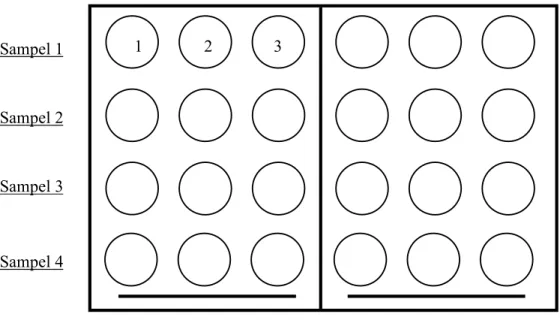
Metode uji sitotoksik yang dilakukan untuk melihat adanya enterotoksin E. sakazakii mengacu pada Pagotto et al. (2003). Sel lestari Vero yang telah ditumbuhkan pada TCP 24 dan sudah dalam keadaan konfluen yang disiapkan selama 4-5 hari. GM dalam TCP 24 lalu dihisap dan diganti dengan MM sebanyak 400 µl/well. Kemudian diberi filtrat enterotoksin yang diujikan sebanyak 100 µl pada tiap sumur dengan format pengujian sebagai berikut:
Gambar 6 Format plat pengujian enterotoksin Enterobacter sakazakii pada TCP 24 sumur. Angka menunjukkan banyaknya ulangan (triplo). Satu buah TCP 24 sumur memuat 4 buah sampel yang diujikan terdiri dari enterotoksin murni dan yang dipanaskan.
Plate 1 diisi dengan sampel nomor 1 sampai 4 yang merupakan filtrat E. sakazakii dengan kode 7a/2, 8c/4, 10a/6, dan 17a/2. Plate 2 diisi dengan sampel nomor 5 – 8 yang berisikan filtrat E. sakazakii dengan kode 19b/2, 23c/4, 24a/3, dan 27a/2. Plate 3 diisi dengan sampel nomor 9 - 12 berisikan filtrat E. sakazakii dengan kode 29a/8, 30c/2, 31b/4, dan 33a/7. Plate 4 diisi dengan sampel nomor 13- 16 yang secara berurutan merupakan ATCC 35217 sebagai kontrol positif, Sampel 3
Sampel 1
Sampel 2
Sampel 4
Enterotoksin murni Enterotoksin dipanaskan 3
Enterophatogenic E. coli/EPEC sebagai kontrol positif, E. coli non phatogenic/ECNP sebagai kontrol negatif dan Brain Heart Infusion/BHI sebagai kontrol negatif media. Semua plate kemudian diinkubasi pada inkubator CO2, suhu 37oC dan CO2 5%. Pengamatan dilakukan 24 jam pasca inkubasi.
Parameter pengamatan yaitu jika sel monolayer tetap utuh setelah diberi enterotoksin baik murni maupun dipanaskan maka diberi nilai negatif (-), dan jika terjadi sitolisis (pelepasan sel) maka diberi nilai positif (+). Setiap nomor sampel dihitung jumlah sumur yang mengalami sitolisis dan dikelompokkan. Reaksi diindikasikan ringan jika sumur yang bernilai (+) hanya 1 dan dinyatakan dengan (1/3) yang artinya hanya 1 dari 3 sumur yang positif mengalami sitolisis. Reaksi sedang dinyatakan dengan (2/3) dan reaksi berat dinyatakan dengan (3/3), sedangkan reaksi negatif dinyatakan dengan 0 yang berarti tidak mengalami sitolisis dan dinyatakan dengan (0/3). Bila terjadi kontaminasi pada sumur maka tidak dilakukan penghitungan terhadap sumur tersebut.