1 BAB I PENDAHULUAN
A. Latar Belakang
Kanker merupakan salah satu penyakit yang menjadi masalah kesehatan dunia, termasuk Indonesia. Data Badan Kesehatan Dunia (WHO) tahun 2010, menunjukkan bahwa kanker merupakan penyebab kematian nomor dua setelah penyakit kardiovaskuler. Pada tahun 2003, jumlah penderita kanker di dunia mencapai 10 juta orang dan pada tahun 2020 diperkirakan naik menjadi 20 juta orang. Berdasarkan Riset Kesehatan Dasar tahun 2007, kanker menempati urutan ke enam penyebab kematian terbesar di Indonesia (Anonim, 2012). Hasil Riskesdas tahun 2007, menunjukkan bahwa prevalensi kanker di Indonesia adalah 4,3 per 1.000 penduduk, dengan angka kejadian lebih tinggi pada perempuan 5,7 per 1.000 penduduk, dibandingkan dengan laki-laki 2,9 per 1.000 penduduk (Anonim, 2009). Jenis kanker yang terjadi di Indonesia didominasi oleh kanker payudara (30%) dan kanker leher rahim atau kanker serviks (24%).
Pengobatan kanker yang ada selama ini banyak dilakukan dengan cara pembedahan (operasi), kemoterapi, dan menggunakan isotop radioaktif yang memiliki efek samping yang kuat terhadap tubuh pasien dan sulit dihindari. Oleh karena itu, dibutuhkan pengobatan yang lebih selektif dan tertarget pada sel kanker.
Mirabilis jalapa L. atau Bunga Pukul Empat merupakan tanaman yang
2
senyawa yang mempunyai aktivitas sebagai antikanker. Mirabilis jalapa L. dilaporkan mengandung protein sejenis Ribosome Inactivating Protein (RIP) yang memiliki kemampuan memotong DNA superkoil untai ganda menjadi bentuk nick
circular dan liniernya (Rumiyati dkk., 2003). Fraksi protein total daun Mirabilis jalapa L. memiliki efek sitotoksik dan dilaporkan dapat menginduksi proses
apoptosis pada sel HeLa (Ikawati dkk., 2003). Ribosome Inactivating Protein (RIP) memiliki aktivitas enzimatik yang dapat menyebabkan kerusakan pada ribosom secara irreversible dan dapat mendepurinasi rRNA sehingga menghambat proses sintesis protein (Stirpe dan Battelli, 2006). Ribosome
Inactivating protein (RIP) yang diisolasi dari tanaman telah diketahui mampu
mengeliminasi sel-sel yang tidak diinginkan secara selektif. Selektivitas ini masih berpotensi untuk ditingkatkan lagi dengan peningkatan sensitivitas uptake RIP secara seluler. Strategi yang banyak dikembangkan adalah dengan penghantaran tertarget.
Biopolimer terbukti berperan penting dalam sistem penghantaran protein
growth factors dan sitokin untuk membantu proses angiogenesis dan rekonstruksi
jaringan. Pemilihan biopolimer yang tepat, termasuk metode pengolahan dan pelepasan matriks yang terkontrol, yang digabungkan dengan protein dan faktor petumbuhan dapat meningkatkan pertumbuhan jaringan yang dapat diproduksi. Penggunaan biopolimer dalam formulasi nanopartikel protein sebagai terapi gen dapat dikembangkan lebih lanjut sebagai cara untuk regenerasi jaringan dengan suatu molekul pentarget (Uchegbu dan Schätzlein, 2006).
3
Pada penelitian ini, akan diformulasikan suatu nanopartikel RIP MJ menggunakan kitosan rantai pendek dan tripolifosfat (TPP). Kitosan akan menjerap RIP MJ yang bersifat asam karena memiliki gugus –NH3+. Selanjutnya,
tripolifosfat berfungsi sebagai penaut silang (crosslinker) yang akan menstabilkan muatan positif yang tersisa dari kitosan.
Untuk mengetahui aktivitasnya, maka perlu dilakukan berbagai macam uji dan karakterisasi nanopartikel. Karakterisasi meliputi entrapment efficiency (%), ukuran partikel, polydispersity index (PI), potensial zeta, dan morfologi partikel dengan Particle Size Analyzer dan Transmission Electron Microscopy.
Pada akhir penelitian, diharapkan akan diperoleh suatu prototype nanopartikel RIP MJ menggunakan tripolifosfat dan kitosan rantai pendek yang telah diketahui karakternya. Prototype ini diharapkan dapat menjadi model baru strategi terapi kanker yang selanjutnya dapat dikonjugasikan dengan suatu molekul pentarget sehingga lebih selektif dan aman bagi pasien.
B. Rumusan Masalah
1. Apakah RIP MJ dapat dikemas dalam sistem nanopartikel kitosan rantai pendek dan penaut silang tripolifosfat?
2. Bagaimana karakter nanopartikel RIP MJ yang dihasilkan menggunakan kitosan rantai pendek dan penaut silang tripolifosfat, meliputi entrapment
efficiency (%), ukuran partikel, polydispersity index (PI), potensial zeta, dan
morfologi partikel?
3. Bagaimana aktivitas nanopartikel RIP MJ yang dihasilkan terhadap pemotongan DNA superkoil?
4
C. Tujuan Penelitian 1. Tujuan Umum
Penelitian ini bertujuan untuk melakukan formulasi dan karakterisasi nanopartikel Ribosome Inactivating Protein Mirabilis jalapa (RIP MJ) dengan polimer kitosan rantai pendek dan penaut silang tripolifosfat.
2. Tujuan Khusus
a. Mendapatkan bentuk RIP MJ yang dapat dikemas dalam nanopartikel kitosan rantai pendek dan penaut silang tripolifosfat.
b. Mengetahui karakter nanopartikel RIP MJ yang dihasilkan, meliputi
entrapment efficiency (%), ukuran partikel, polydispersity index (PI),
potensial zeta, dan morfologi partikel.
c. Mengetahui aktivitas nanopartikel RIP MJ yang dihasilkan terhadap pemotongan DNA superkoil.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai karakteristik nanopartikel RIP MJ menggunakan tripolifosfat penaut silang kitosan rantai pendek yang menjadi prototype sebagai dasar pengembangan strategi terapi kanker yang lebih selektif dan aman bagi pasien.
5
E. Tinjauan Pustaka
1. Kanker
Kanker adalah suatu penyakit yang ditandai dengan hilangnya fungsi kontrol sel terhadap regulasi daur sel maupun fungsi homeostasis sel pada organisme multiseluler yang mengakibatkan sel akan berploriferasi terus-menerus sehingga menimbulkan pertumbuhan jaringan yang abnormal. Sel kanker abnormal ini mempunyai kemampuan untuk menginvasi sel-sel normal di sekitarnya yang disebut angiogenesis. Sel kanker mempunyai kemampuan untuk mengalami siklus proliferasi ulang dan melakukan migrasi ke lokasi yang jauh di dalam tubuh untuk mengkolonisasi berbagai organ. Proses migrasi sel kanker ini disebut dengan metastasis (Lodish dkk., 1999).
Menurut Hanahan dan Weinberg (2000), sel kanker memiliki karakteristik yang berbeda dengan sel normal, antara lain:
a) Sel kanker mampu mengabaikan sinyal anti pertumbuhan karena dapat menghilangkan fungsi sinyal anti pertumbuhan melalui mutasi atau adanya onkogen. Berbagai sinyal antiproliferatif pada sel normal dapat mengatur penghentian proliferasi sel dan homeostasisnya. Sinyal tersebut memaksa sel masuk ke fase istirahat (Go) dan menginduksi sel untuk berhenti berproliferasi.
b) Sel kanker mampu mencukupi kebutuhan sinyal untuk pertumbuhannya sendiri. Sel kanker tidak memerlukan sinyal pertumbuhan mitogenik seperti pada sel normal sebelum berpindah dari fase istirahat (Go) menuju ke fase proliferasi aktif pada siklus sel.
6
c) Sel kanker memiliki potensi yang tak terbatas untuk mengadakan replikasi karena memiliki kemampuan untuk upregulasi telomerase sehingga sel menjadi immortal. Telomerase adalah enzim yang berperan dalam perpanjangan telomer sehingga sel akan tetap mampu mengadakan pembelahan.
d) Sel kanker memiliki sifat resisten terhadap apoptosis karena terjadi mutasi pada jalur proapoptosis atau antiapoptosis. Mutasi pada protein proapoptosis misalnya pada gen tumor p53. Sedangkan, peningkatan aktivitas antiapoptosis misalnya pada upregulasi jalur PI3kinase Akt/PKB.
e) Sel kanker mampu menginduksi angiogenesis untuk mencukupi kebutuhan oksigen dan nutrisi dengan mempengaruhi keseimbangan ekspresi gen penginduksi dan penghambat angiogenesis.
f) Sel kanker dapat menginvasi jaringan di sekitarnya, kemudian bergerak ke tempat lain di dalam tubuh dan membentuk koloni baru yang disebut metastasis. Sel kanker memiliki kemampuan metastasis karena adanya perubahan pada beberapa protein, misalnya pada molekul adhesi antar sel (CAM), cadherin dan integrin, yang menyebabkan interaksi sel kanker menjadi rendah terhadap sel di sekitarnya.
Pengobatan kanker yang banyak digunakan saat ini selain dengan pembedahan adalah menggunakan senyawa kimia, hormon, antibiotika, serta penyinaran dengan isotop radioaktif. Pengobatan kanker tersebut memiliki efek samping yang berat dan sulit dihindari. Dengan demikian, diperlukan
7
alternatif pengobatan yang lebih selektif, aman, dan efisien terhadap sel kanker.
2. Mirabilis jalapa L.
Mirabilis jalapa L. atau disebut Bunga Pukul Empat adalah jenis
spesies yang paling banyak ditemukan diantara spesies lain dalam genus Mirabilis dan banyak terdapat dalam berbagai varietas warna. Berikut adalah klasifikasi dari tanaman Mirabilis jalapa L.
- Divisi : Spermatophyta - Sub Divisi : Angiospermae - Kelas : Dicotyledonae - Bangsa : Caryophyllates - Suku : Nyctaginaceae - Marga : Mirabilis
- Jenis : Mirabilis jalapa L. (Tjitrosoepomo, 1996)
Mirabilis jalapa berasal dari daerah tropis Amerika Selatan yang
kemudian tersebar secara alami ke daerah tropis lain dengan iklim hangat. Tanaman Mirabilis jalapa dapat tumbuh dengan sendirinya melalui penyebaran biji dan pertumbuhannya cukup cepat. Daun dan bunga Mirabilis
jalapa mengandung saponin, flavonoid, dan tanin, bunganya mengandung
polifenol, bijinya mengandung flavonoid dan polifenol. Akarnya mengandung betaxantin, buahnya mengandung zat tepung, lemak (4,3%) dan zat asam lemak (24,2%) (Wijayakusuma, 1996). Ekstrak daun, biji, dan akar
8
tanaman ini mengandung protein-protein sejenis RIP yang disebut Mirabilis Antiviral Protein (MAP) dan MJ30 (Kataoka dkk., 1992; Sudjadi dkk., 2007).
Gambar 1. Tanaman Mirabilis jalapa L. bunga merah
Mirabilis jalapa telah banyak digunakan secara luas oleh berbagai
negara di belahan dunia, terutama sebagai obat dan bahan tambahan makanan, meliputi antijamur, antivirus, antibakteri, diuretik, karminatif, katartik, tonik, dan sebagainya (Anonim 2009).
3. Ribosome Inactivating Protein (RIP)
Ribosome Inactivating Protein (RIP) merupakan sekelompok
sitotoksin yang memiliki aktivitas menghambat sintesis protein pada eukariotik sehingga berpotensi untuk dikembangkan sebagai senyawa antikanker. RIP bersifat merusak ribosom secara irreversible, dengan menghilangkan residu adenin rRNA dan juga mendepurinasi asam nukleat lainnya. Penggunaan RIP sebagai komponen konjugasi dengan antibodi atau sebagai imunotoksin (Stirpe, 2006).
9
RIP terdistribusi luas dalam tanaman tingkat tinggi. Kebanyakan spesies tanaman yang mengandung RIP termasuk subdivisi angiospermae. Akar tanaman Mirabilis jalapa L. diketahui mengandung protein sejenis
Ribosome Inactivating Protein (RIP) yang memiliki aktivitas RNA
N-glikosidase yang dapat menghambat sintesis protein dan dilaporkan bersifat sitotoksik (Ikawati dkk., 2002). Fraksi protein dari daun M. jalapa L. diketahui mempunyai aktivitas untuk memotong DNA superkoil dan aktivitas N-glikosidase. Aktivitas rRNA N-glikosidase ini menyebabkan depurinasi adenin pada posisi 4324 dari 28S rRNA. Protein dari akarnya sitotoksik terhadap sel HeLa, dan fraksi protein totalnya terbukti aktif menginduksi apoptosis sel HeLa (Sudjadi dkk., 2007).
RIP dapat diklasifikasikan menjadi tiga tipe berdasarkan strukturnya, dimana perbedaan struktur ini mempengaruhi proses dan potensi toksisitasnya, namun tidak berbeda dalam mekanismenya menginaktivasi ribosom (Peumans dkk., 2001). RIP tipe 1 yang terdiri dari rantai tunggal polipeptida berukuran sekitar 30kDa dengan aktivitas enzimatik. RIP tipe 2 yang terdiri dari dua rantai peptida, rantai A berukuran 30 kDa dengan aktivitas enzimatik, terikat rantai B berukuran 35 kDa dengan aktivitas lectin sebagai gula yang mengikat struktur galaktosa (Stirpe, 2006). Beberapa RIP tipe 2 berpotensi sangat toksin, yang paling dikenal adalah ricin, sedangkan yang lain memiliki potensi toksin yang rendah. RIP tipe 3 merupakan aktivasi maize b-32 yang menjadi aktif setelah penghapusan bagian peptida pendek
10
dan region N-terminal dari JIP60 dimana rantai aktif terikat dengan bagian yang berukuran sama yang tidak diketahui fungsinya (Stripe, 2006).
Gambar 2. Skematik struktur RIP tipe 1, 2, dan 3 (Peumans dkk., 2001)
Aktivitas enzimatik RIP memberikan suatu potensi yang sangat besar untuk menjadi suatu agen yang bersifat sitotoksik. Beberapa RIP telah diketahui mempunyai kemampuan membunuh sel-sel tumor secara selektif dibandingkan sel normal. RIP juga potensial untuk imunoterapi kanker memakai imunotoksin. Beberapa penelitian melaporkan bahwa RIP maupun imunotoksin yang dibuat dari domain rantai-A, mampu menginduksi kematian sel melalui apoptosis. Fraksi protein total daun Mirabilis jalapa L. diketahui dapat menginduksi apoptosis pada lini sel HeLa (Ikawati dkk., 2003). Domain N-glikosidase Domain Lectin Domain Unknown PAP Maize b-32 Ricin JIP60 A B
RIP Tipe 1 Rantai tunggal RIP Tipe 1 Rantai ganda RIP Tipe 1
RIP Tipe 2
RIP Tipe 3
11
4. Kitosan
Kitosan merupakan suatu polisakarida alami dengan jumlah paling banyak kedua terdapat di alam. Karakteristik dari kitosan antara lain bersifat biokompatible, biodegradable, memiliki aktivitas antimikrobial dan kemampuan untuk mengkhelat (Jansson, 2010). Kitosan merupakan derivat kitin, yaitu material pendukung pada crustaceae, insekta dan fungal mycelia. Kitin banyak diisolasi dari kulit crustaceae, udang dan kepiting (Panos dkk., 2008).
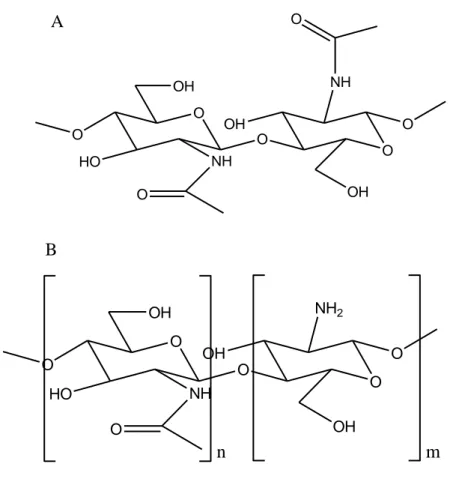
Gambar 3. Struktur kimia kitin (A) dan kitosan (B) (Aranaz dkk., 2009)
Kitin dan kitosan dapat digolongkan sebagai keluarga glukosaminoglikan, yaitu suatu subkategori polisakarida yang memiliki
O O OH NH O O HO O OH NH2 OH O n m O O OH NH O O HO O OH NH O OH O A B
12
aktivitas biologi. Kitosan memiliki karakteristik struktur yang mirip dengan asam hyaluronik yang cocok digunakan untuk menutupi luka atau membuat kulit buatan. Kitin tersusun dari 2-acetamido-2-deoxy-β-D-glucose yang terikat pada rantai β-(1-4). Kitosan dianggap sebagai bentuk N-deasetilasi kitin dan menyisakan gugus amina bebas yang menjadikannya bersifat polikationik sehingga terdiri dari D-glikosamin dan N-acetyl-D-glukosamine (Jansson, 2010). Kitosan terdiri dari acetamido-deoxy-β-D-glucose dan 2-amino-2-deoxy-β-D-glucose. Unit-unit tersebut dihubungkan oleh ikatan glikosidik yang bersifat tidak toksik, biokompatibel dan bermuatan positif (Jansson, 2010).
Berbeda dengan kitosan, kitin mempunyai gugus acetamido pada posisi C-2. Gugus acetamido ini dapat dideasetilasi menjadi gugus amino untuk membentuk kitosan. Kitosan diproduksi melalui proses deasetilasi senyawa kitin, yang merupakan komponen utama pada cangkang binatang
crustaceae (Mardliyati dkk., 2012). Deasetilasi adalah proses penghilangan
gugus asetil (-COCH3) kitin dengan metode kimia maupun enzimatis dengan
enzim chitin deacetylase (CDA). Gugus asetil yang dihilangkan menyisakan gugus amina bebas yang membuat kitosan bersifat polikationik (Aranaz dkk., 2009).
Kitosan yang disintesis dengan metode enzimatis akan menghasilkan kitosan dengan bobot molekul rendah (LMWC) atau kitosan oligosakarida (COS), yang larut dalam air karena memiliki rantai pendek dan terdapat amina bebas pada unit D-glucosamine. Berdasarkan rentang bobot
13
molekulnya kitosan dibagi menjadi tiga, yaitu kitosan bobot molekul rendah (LMWC, 5-20 kDa), kitosan bobot molekul sedang (MMWC, ~100 kDa), dan kitosan bobot molekul tinggi (HMWC, >300 kDa). Kitosan bobot molekul rendah (LMWC) memiliki bioaktivitas, seperti daya antimikroba yang lebih tinggi daripada kitosan bobot molekul sedang dan tinggi (MMWC dan HMWC) (Jannson, 2010).
Kitosan telah banyak diaplikasikan pada industri famasi dan pangan karena sifatnya yang menguntungkan, seperti mukoadhesif, biokompatibel, biodegradable, non-toksik, dan tingkat imunogenisitas yang rendah, maka kitosan merupakan biomaterial yang sesuai sebagai pembawa (carrier) pada sistem penghantaran obat (Mardliyati dkk., 2012).
Pada penghantaran obat, obat dikombinasikan dengan polimer yang mampu melindungi obat hingga obat sampai pada tempat aksinya dan memberikan efek terapinya. Polimer yang digunakan haruslah bersifat biokompatibel, tidak toksik, biodegradable, stabil, dan dapat disterilkan. Kemampuan kitosan dalam menghantarkan obat disebabkan oleh muatan positif yang dapat berinteraksi dengan muatan negatif dari polianion seperti DNA, dan membentuk kompleks polielektrolit (Jannson, 2010).
5. Natrium Tripolifosfat
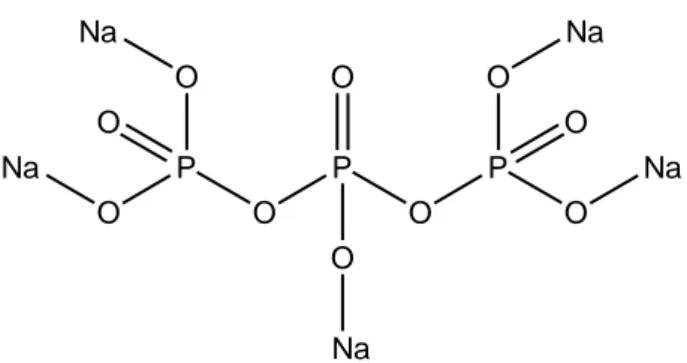
Natrium tripolifosfat (Na5P3O10) merupakan crosslinker polianion
14
Gambar 4. Struktur kimia natrium tripolifosfat
Natrium tripolifosfat (TPP) memiliki bobot molekul sebesar 367,86 dengan komposisi Na 31,25%, O 43,49%, dan P 25,26% (O’Neil dkk., 2006). Natrium triplifosfat diproduksi dengan memanaskan campuran stoikiometrik disodium fosfat (Na2HPO4) dan monosodium fosfat (NaH2PO4) di bawah
kondisi terkontrol. Reaksi kimia yang terjadi:
2 Na2HPO4 + NaH2PO4 Na5P3O10 + 2 H2O (1)
Kelarutan tripolifosfat adalah 20 g/100 mLpada suhu 25 C dan 86,5 g/100 mL pada suhu 100 C. Larutan TPP dengan konsentrasi 1% memiliki pH 9,7-9,8. TPP merupakan senyawa polianion yang mampu berinteraksi dengan kitosan melalui gaya elektrostatik untuk membentuk jalinan silang ionik dan dapat digunakan untuk proses pembuatan butiran dan mikrosfer kitosan karena mampu membentuk gel secara cepat (Mi dkk., 2003).
Natrium tripolifosfat bersifat larut dalam air dan terdisosiasi menjadi ion hidroksil dan fosfat. Ketika pH dari TPP diatur mencapai pH 3, maka hanya ion fosfat saja yang terbentuk. Sedangkan, pada pH 9 baik ion hidroksil (OH-) dan ion fosfat akan terbentuk dan berkompetisi satu sama lain untuk
O P O O O Na P O O O Na Na P O O O Na Na
15
dapat berinteraksi dengan gugus –NH3+ dari kitosan (Bhumkar dan
Pokharkar, 2006).
Interaksi yang terjadi antara kitosan dengan tripolifosfat mengawali terbentuknya penaut silang yang biokompatible dari nanopartikel kitosan, yang efisien diterapkan pada sistem penghantaran protein dan vaksin (Bhumkar dan Pokharkar, 2006).
Triplofosfat (TPP) merupakan crosslinker yang memperbaiki kekuatan mekanik kitosan dengan cara diikat silang. TPP dipilih sebagai polianionik crosslinker karena sifatnya yang non toksik dan kemampuan membentuk gel setelah kontak dengan kitosan (Luo dkk., 2010).
6. Nanopartikel
Nanopartikel merupakan stuktur koloidal yang berdimensi antara 10 - 1000 nm. Karena ukurannya yang sebanding dengan komponen sel manusia, maka nanopartikel sangat cocok untuk diaplikasikan dalam sistem penghantaran obat. Nanopartikel obat secara umum harus terkandung obat dengan jumlah yang cukup di dalam matriks pada tiap butir partikel, sehingga memerlukan ukuran yang relatif lebih besar dibanding nanopartikel non-farmasetik, tetapi masih dalam skala kurang dari 1 mikron.
Material berukuran nanometer memiliki sejumlah sifat kimia dan fisika yang lebih unggul dari material berukuran besar, karena semakin kecil ukuran suatu material, maka luas permukaannya semakin besar sehingga material dalam skala nanometer mempunyai jarak antar atom yang sangat kecil yang akan memudahkan terjadinya reaksi antar atom (Astuti, 2007).
16
Nanopartikel dari bahan polimer alam banyak diaplikasikan pada sistem penghantaran obat karena sifatnya yang istimewa, seperti biokompatibel, biodegradabel, mukoadhesif dan meningkatkan permeasi. Nanopartikel dipandang sebagai carrier yang sangat menjanjikan untuk meningkatkan bioavailabilitas biomolekul karena memiliki kemampuan difusi dan penetrasi yang lebih baik ke dalam lapisan mukus (Mardliyati dkk., 2012).
Terdapat dua macam nanopartikel yang dibentuk dari polimer, yaitu nanokapsul and nanosfer. Nanokapsul terdiri dari polimer yang membentuk dinding melingkupi senyawa obat yang terjerap di dalamnya atau teradsorpsi pada bagian permukaan membran. Nanosfer merupakan sistem matriks dengan obat terdispersi atau teradsorpsi secara merata. Istilah nanopartikel digunakan karena terkadang sulit untuk menentukan apakah partikel dalam bentuk matriks atau membran (Tiyaboonchai, 2003).
Metode pembuatan nanopartikel ada beberapa macam, antara lain metode gelasi ionik (ionotropic gelation), spray drying,
emulsification-solvent evaporation, dan coacervation. Diantara berbagai metode pembuatan
nanopartikel kitosan, metode gelasi ionik (ionotropic gelation) merupakan metode yang banyak digunakan karena prosesnya yang sederhana dan dapat dikontrol dengan mudah.
Prinsip pembentukan nanopartikel berdasar pada interaksi elektrostatik antara gugus amina pada kitosan dan muatan negatif pada gugus polianion dari tripolifosfat. Kitosan dapat dilarutkan dalam asam asetat
17
dengan atau tanpa agen penstabil seperti poloxamer yang dapat ditambahkan pada larutan kitosan sebelum atau setelah dicampurkan dengan polianion. Ketika polianion ditambahkan, maka secara spontan nanopartikel akan terbentuk dengan pengadukan pada suhu ruang. Ukuran dan muatan permukaan dari partikel dapat dimodifikasi dengan variasi ratio kitosan dan stabilizer (Tiyaboonchai, 2003).
Nanopartikel kitosan yang dipreparasi dengan metode gelasi ionik memiliki beberapa kelemahan, diantaranya adalah distribusi ukuran partikel yang sangat lebar (indeks polidispersitas yang tinggi) dan tingkat stabilitas yang rendah. Hal ini sangat tidak diharapkan dalam aplikasi nanopartikel kitosan sebagai sistem penghantaran obat. Oleh karenanya, metode yang efektif dan sederhanana untuk membuat nanopartikel kitosan dengan keseragaman ukuran dan stabilitas yang tinggi masih terus dikaji oleh berbagai peneliti (Mardliyati dkk., 2012).
F. Landasan Teori
Salah satu polimer yang paling banyak digunakan dalam pembuatan nanopartikel adalah kitosan dan TPP menggunakan metode gelasi ionik. RIP merupakan suatu protein yang memiliki gugus karboksilat bermuatan negatif yang dapat membentuk ikatan hidrogen dengan gugus amina kitosan yang bermuatan positif dalam dapar asetat pH 4,0 (Mardliyati dkk., 2012). TPP sebagai crosslinker akan membentuk ikatan hidrogen dengan gugus amina bebas yang bermuatan
18
positif yang dimiliki oleh kitosan dan protein sehingga nanopartikel protein yang terbentuk menjadi lebih kompak (Pertiwi, 2014).
Berdasarkan hasil penelitian yang dilakukan oleh Taurina (2012) dan Farida (2012) diketahui bahwa konsentrasi kitosan 0,02% – 0,06% (b/v) dan
konsentrasi TPP 0,01% – 0,03% (b/v) dapat membentuk nanopartikel yang
memiliki bentuk sferis dengan ukuran berkisar antara 100 – 1000 nm, terdistribusi seragam, potensial zeta bernilai positif, dan entrapment efficiency berkisar antara 75 – 90%.
RIP memiliki aktivitas yang khas untuk dapat memotong DNA superkoil untai ganda menjadi bentuk nick circular dan liniernya. Aktivitas DNAse-like yang dimiliki oleh RIP MJ dapat memotong ikatan fosfodiester pada rantai ganda DNA sehingga DNA superkoil dapat terurai menjadi DNA linier yang berukuran lebih kecil dari DNA nick circular, tetapi lebih besar dari DNA superkoil (Feranisa, 2014).
Obat yang dikemas dalam sistem nanopartikel dapat memberikan efeknya setelah nanopartikel tersebut masuk ke dalam sel dan melepaskan obatnya. Kitosan dan TPP tidak memiliki aktivitas DNAse-like sehingga RIP yang terenkapsulasi dalam nanopartikel tidak dapat memotong DNA superkoil.
Formulasi nanopartikel RIP MJ dengan metode gelasi ionik menggunakan polimer kitosan rantai pendek dan crosslinker tripolifosfat (TPP), diharapkan menjadi suatu model baru strategi terapi kanker yang lebih selektif dan aman bagi pasien.
19
G. Hipotesis
1. Ribosome Inactivating Protein hasil isolasi tanaman Mirabilis jalapa (RIP MJ) dapat dikemas dalam nanopartikel kitosan rantai pendek dan penaut silang TPP dengan metode gelasi ionik.
2. Nanopartikel RIP MJ yang dihasilkan menggunakan kitosan rantai pendek dan penaut silang tripolifosfat memiliki bentuk sferis dengan ukuran berkisar antara 100 – 1000 nm, terdistribusi secara seragam, potensial zeta bernilai positif, dan entrapment efficiency berkisar antara 75% – 90%.
3. Nanopartikel RIP MJ yang dihasilkan tidak mempunyai kemampuan untuk memotong DNA superkoil.