SINTESIS, KARAKTERISASI, DAN UJI KINERJA
BIOHIDROGEL BERBAHAN DASAR EGN-PVA DENGAN
CROSSLINKER GLUTARALDEHIDA
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Menempuh Ujian Sidang Sarjana Sains Program Studi Kimia
Nurul Chotimah 0902305
PROGRAM STUDI KIMIA
JURUSAN PENDIDIKAN KIMIA
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU
PENGETAHUAN ALAM
SINTESIS, KARAKTERISASI, DAN UJI KINERJA
BIOHIDROGEL BERBAHAN DASAR EGN-PVA DENGAN
CROSSLINKER GLUTARALDEHIDA
Oleh Nurul Chotimah
0902305
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana Sains pada Program Studi Kimia Fakultas Pendidikan Matematika dan
Ilmu Pengetahuan Alam
© Nurul Chotimah 2013 Universitas Pendidikan Indonesia
September 2013
Hak Cipta dilindungi Undang-Undang.
NURUL CHOTIMAH
SINTESIS, KARAKTERISASI, DAN UJI KINERJA
BIOHIDROGEL BERBAHAN DASAR EGN-PVA DENGAN
CROSSLINKER GLUTARALDEHIDA
DISETUJUI DAN DISAHKAN OLEH PEMBIMBING :
Pembimbing I,
Dr. Hendrawan, M.Si NIP. 196309111989011001
Pembimbing II,
Fitri Khoerunnisa, Ph.D NIP. 197806282001122001
Mengetahui
Ketua Jurusan Pendidikan Kimia FPMIPA UPI
NIP. 196611211991031002
PERNYATAAN
“Dengan ini saya menyatakan bahwa skripsi dengan judul “SINTESIS, KARAKTERISASI, DAN UJI KINERJA BIOHIDROGEL BERBAHAN DASAR EGN-PVA DENGAN CROSSLINKER GLUTARALDEHIDA
”
inibeserta seluruh isinya adalah benar-benar karya saya sendiri, dan tidak melakukan penjiplakan atau pengutipan dengan cara-cara yang tidak sesuai dengan etika keilmuan yang berlaku dalam masyarakat. Atas pernyataan ini, saya siap menanggung risiko/sanksi yang dijatuhkan kepada saya apabila kemudian ditemukan adanya pelanggaran terhadap etika keilmuan dalam karya saya ini, atau ada klaim dari pihak lain terhadap keaslian karya saya ini.”
Bandung, Oktober 2013 Yang Membuat Pernyataan
ABSTRAK
Telah dilakukan penelitian tentang sintesis, karakterisasi, dan uji kinerja biohidrogel berbahan dasar EGN-PVA dengan crosslinker glutaraldehida. Penelitian ini bertujuan untuk mengetahui preparasi ekstrak GN (EGN), komposisi optimum PVA-EGN-Crosslink GA pada sintesis biohidrogel CRF, dan karakteristik dan kinerja biohidrogel hasil sintesis sebagai CRF. EGN diperoleh dari hasil ekstraksi simplisia GN kering dengan metode maserasi menggunakan pelarut metanol 70 %. Kondisi optimum sintesis biohidrogel diperoleh pada rasio komposisi PVA:EGN:GA = 1:1:1, dimana kemampuan swelling (%SR) dan waktu retensi (%WR) air biohidrogel mencapai 440% dan 25 hari, secara berturut-turut. Hasil karakterisasi menunjukkan bahwa biohidrogel yang disintesis memiliki struktur berpori. Penyisipan nutrien meningkatkan kristalinitas biohidrogel, dimana %SR dan %WR dari biohidrogel meningkat secara linier terhadap kristalinitas. Hal ini menunjukkan bahwa biohidrogel yang disintesis berpotensi sebagai agen control released nutrient (CRF). Biohidrogel bersifat
biodegradable dan juga dapat dijadikan sebagai media tumbuh apabila didukung
oleh penggunaan media lain seperti tanah atau pasir.
ABSTRACT
Has done research on the synthesis, characterization, and performance test of biohydrogel based EGN - PVA with glutaraldehyde as a crosslinker. This study aims to determine extract preparation GN (EGN), optimum composition of PVA-EGN-Crosslink GA on biohydrogel CRF synthesis, characteristics and also performance of biohydrogel synthesized as CRF. EGN is obtained from the extraction of dried GN by maceration method using methanol 70%. The optimum conditions of biohydrogel synthesized, obtained on the composition ratio of PVA:EGN:GA = 1:1:1, where the ability of swelling (%SR) and retention time (%WR) biohydrogel are 440% and 25 days, respectively. The characterization results showed that the synthesized biohydrogel has a porous structure. Insertion of nutrients increases the crystallinity biohidrogel, where SR% and WR% of biohidrogel increased linearly from the crystallinity. This shows that the synthesized biohidrogel is potential to be an agents of control released fertilizer (CRF). Biohydrogel is biodegradable and can also be used as a growing medium if it is supported by the use of other media such as soil or sand.
DAFTAR ISI
LEMBAR PENGESAHAN ... Error! Bookmark not defined.
PERNYATAAN ... Error! Bookmark not defined.
ABSTRAK ... Error! Bookmark not defined.
ABSTRACT...iv
KATA PENGANTAR ... Error! Bookmark not defined.
UCAPAN TERIMA KASIH ... Error! Bookmark not defined.i
DAFTAR ISI ... ii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... iv
BAB I PENDAHULUAN ... Error! Bookmark not defined.
1.1 Latar Belakang ... Error! Bookmark not defined.
1.2 Rumusan Masalah ... Error! Bookmark not defined.
1.3 Tujuan Penelitian ... Error! Bookmark not defined.
1.4 Manfaat Penelitian ... Error! Bookmark not defined.
BAB II TINJAUAN PUSTAKA ... Error! Bookmark not defined.
2.1 Controlled-Release Fertilizer (CRF) ... Error! Bookmark not defined.
2.1.1 Definisi Controlled-Release Fertilizer (CRF) Error! Bookmark not defined.
2.1.2 Kegunaan Agen CRF ... Error! Bookmark not defined.
2.2 Hidrogel ... Error! Bookmark not defined.
2.2.1 Definisi Hidrogel ... Error! Bookmark not defined.
2.2.2 Keuntungan Menggunakan Hidrogel CRF .... Error! Bookmark not defined.
2.3 Bahan Dasar Hidrogel CRF ... Error! Bookmark not defined.
2.3.1 GN ... Error! Bookmark not defined.
2.3.2 Ekstrak GN ... Error! Bookmark not defined.
2.3.3 Gracilaria sp ... Error! Bookmark not defined.
2.3.4 Polivinil Alkohol ... Error! Bookmark not defined.
2.4 Crosslink ... Error! Bookmark not defined.
2.5 Makronutrien dan Mikronutrien ... Error! Bookmark not defined.
BAB III METODE PENELITIAN... Error! Bookmark not defined.
3.1 Lokasi Penelitian dan Waktu Penelitian .. Error! Bookmark not defined.
3.2 Alat dan Bahan ... Error! Bookmark not defined.
3.3 Metode Penelitian ... Error! Bookmark not defined.
3.4 Prosedur Penelitian ... Error! Bookmark not defined.
3.4.1 Tahap Preparasi ... Error! Bookmark not defined.
3.4.2 Tahap Sintesis ... Error! Bookmark not defined.
3.4.3 Tahap Karakterisasi Hidrogel CRF .. Error! Bookmark not defined.
BAB IV HASIL DAN PEMBAHASAN ... Error! Bookmark not defined.
4.1 Tahap Preparasi ... Error! Bookmark not defined.
4.1.1 Preparasi GN ... Error! Bookmark not defined.
4.2 Tahap Karakterisasi ... Error! Bookmark not defined.
4.3.1 Uji Instrumentasi ... Error! Bookmark not defined.
4.3.2 Uji Kinerja ... Error! Bookmark not defined.
BAB V KESIMPULAN DAN SARAN ... Error! Bookmark not defined.
5.1 Kesimpulan ... Error! Bookmark not defined.
5.2 Saran ... Error! Bookmark not defined.
DAFTAR PUSTAKA ... Error! Bookmark not defined.
LAMPIRAN I DATA PERHITUNGAN ... Error! Bookmark not defined.
LAMPIRAN 2 PENGUJIAN KINERJA BIOHIDROGEL SEBAGAI CRF Error! Bookmark not defined.
LAMPIRAN 3 KARAKTERISASI STRUKTUR KIMIA BIOHIDROGEL MELALUI FTIR... Error! Bookmark not defined.
LAMPIRAN 4 KARAKTERISASI KRISTALINITAS BIOHIDROGEL
MENGGUNAKAN XRD ... Error! Bookmark not defined.
DAFTAR TABEL
Tabel 2.1 Komposisi kimia GN ... Error! Bookmark not defined. Tabel 2.2 Sisi aktif agen crosslink dan gugus fungsi yang diserangnya ... Error! Bookmark not defined.
Tabel 2.3 Nutrisi Esensial untuk pertumbuhan tanaman ... Error! Bookmark not defined.
DAFTAR GAMBAR
Gambar 2.1 Struktur Polivinil Alkohol (PVA) ……….14
Gambar 2.2 Struktur Glutaraldehida ……….16
Gambar 2.3 Reaksi Crosslinking antara PVA dan Glutaraldehida ………...17
Gambar 3.1 Bagan Alir Preparasi EGN ………....23
Gambar 3.2 Bagan Alir Penelitian ………....24
Gambar 4.1 Simplisia GN basah dan simplisia GN kering .………...34
Gambar 4.2 (a) EGN 1; (b) EGN 2; (c) EGN 3 ………35
Gambar 4.3 Biohidrogel dari EGN 2 ………36
Gambar 4.4 Spektra FTIR pada GN dan EGN ………..37
Gambar 4.5 Rasio swelling biohidrogel dengan pengeringan suhu ruang (per-menit) ………38
Gambar 4.6 Rasio swelling biohidrogel dengan pengeringan oven 40°C (per-menit) ………38
Gambar 4.7 Rasio swelling biohidrogel dengan pengeringan suhu ruang (per-hari) ………...39
Gambar 4.8 Rasio swelling biohidrogel dengan pengeringan oven 40°C (per-hari) ………...39
Gambar 4.9 Rasio swelling biohidrogel per menit ………41
Gambar 4.10 Retensi air pada biohidrogel dengan pengeringan suhu ruang ……43
Gambar 4.11 Retensi air pada biohidrogel dengan pengeringan oven 40°C …….43
Gambar 4.12 Spektra FTIR pada PVA; PVA:CL(GA); dan PVA:CL(GA) …….45
Gambar 4.13 Spektra FTIR pada EGN:PVA:CL(GA) dan EGN:PVA:CL(GA):Nutrien ……….47
Gambar 4.14 Difraktogram biohidrogel tanpa nutrien dan difraktogram biohidrogel dengan nutrien ………...48
Gambar 4.15 Hasil analisis SEM biohidrogel tanpa nutrien dengan perbesaran (a) 20µm , (b) 599nm, dan (c) 300nm ………49
Gambar 4.16 Hasil analisis SEM biohidrogel dengan nutrien dengan perbesaran (a) 3µm , (b) 600nm, dan (c) 300nm ………50
Gambar 4.17 Rasio swelling biohidrogel tanpa nutrien dan biohidrogel dengan nutrien ……….51
Gambar 4.18 Retensi air pada biohidrogel tanpa nutrien dan biohidrogel dengan nutrien ………..52
BAB I
PENDAHULUAN
1.1Latar Belakang
Indonesia yang dikenal sebagai salah satu negara agraris, memiliki
lahan pertanian yang cukup luas dimana sebagian besar masyarakatnya bekerja di
bidang pertanian. Berdasarkan data BPS tahun 2002, bidang pertanian di
Indonesia menyediakan lapangan kerja bagi sekitar 44,3% penduduk. Namun,
dalam pengolahannya, pertanian Indonesia masih jauh tertinggal oleh negara-negara maju di
belahan Eropa dan Amerika yang hanya memiliki lahan pertanian relatif kecil karena
pengembangan dan pemanfaatan teknologi pertanian yang masih terbatas.
Beberapa permasalahan yang masih ditemukan dalam pengeloaan
pertanian di Indonesia, diantaranya; (1) pencemaran lingkungan yang
disebabkan oleh pemakaian pestisida dan pupuk yang melebihi kebutuhan
tanaman masih sering dijumpai pada banyak lahan pertanian sehingga
konsentrasi nutrien di dalam tanah meningkat dan menyebabkan penurunan
pada kualitas air dan tanah serta kapasitas retensi tumbuhan. Atefah, et al
(2009) menyebutkan bahwa sekitar 40 - 70% dari nitrogen yang dimuat
dalam pupuk tidak diserap oleh akar tanaman tetapi terbuang ke lingkungan
(2) keterbatasan lahan pertanian diakibatkan oleh beralihnya penggunaan
lahan pertanian menjadi lahan industri dan lahan pemukiman seiiring dengan
pertambahan jumlah penduduk yang semakin pesat, (3) pemenuhan
ketersediaan pengairan untuk aktifitas pertanian yang masih terbatas,
terutama di daerah-daerah berlahan kering yang berakibat pada menurunnya
produktifitas pertanian, dan (4) inefisiensi pemupukan yang berakibat pada
meningkatnya ongkos produksi pertanian (Atefah, 2009).
Salah satu alternatif metoda yang dapat digunakan untuk mengatasi
permasalahan di atas ialah dengan penggunaan material yang dapat berfungsi
untuk mengontrol laju dan pola pelepasan nutrisi dalam proses pertumbuhan
menunjukkan banyak keunggulan seperti menurunkan tingkat kehilangan
pupuk dari tanah akibat hujan atau air irigasi, mempertahankan persediaan air
dan mineral untuk waktu yang cukup lama, sehingga meningkatkan efisiensi
pupuk, mengurangi potensi efek negatif dari kelebihan dosis, mengurangi
tingkat toksisitas dan berpotensi sebagai media alternatif tumbuh pada
tanaman (Shaviv, 2005). Mengingat hidrogel memiliki karakteristik yang
unik dimana material ini responsif terhadap perubahan kondisi lingkungan
seperti pH, konduktifitas, konsentrasi ionik dan suhu, maka hidrogel dapat
digunakan sebagai agen CRF.
Hidrogel dapat didefinisikan sebagai jaringan polimer tiga dimensi
yang dapat menyimpan sejumlah besar air diantara strukturnya dan
mengembang tanpa terlarut dalam air. Hidrogel memiliki kapasitas menyerap
air yang besar. Selain itu, pelepasan air dan nutrien juga dapat dikontrol,
sehingga tanaman dapat menyerap nutrien dan air sesuai kebutuhan
(Kaewpirom & Boonsang, 2006). Uji hidrogel untuk aplikasi pertanian telah
menunjukkan hasil yang gemilang seperti telah diamati dapat membantu
mengurangi konsumsi air irigasi, menurunkan kecepatan matinya tanaman
dan memperbaiki ketahanan pupuk dalam tanah (Tomaszewska &
Jarosiewicz, 2002). Selain itu hidrogel mempunyai potensi untuk digunakan
sebagai salah satu teknologi mengatasi usaha budidaya tanaman di lahan
kering dan efisiensi pemakaian air untuk tanaman tertentu, oleh karena itu
hidrogel berpotensi sebagai CRF (Rahardjo, 2007).
Pembuatan hidrogel umumnya masih menggunakan bahan dasar
sintesis dimana bahan sintetis tersebut dapat menghasilkan limbah yang tidak
biodegradable. Selain itu penggunaan bahan sintetis memerlukan biaya yang
cukup tinggi sehingga tidak ekonomis untuk dijadikan sebagai salah satu
solusi dalam mengatasi masalah pertanian. Dalam beberapa tahun terakhir,
pengembangan hidrogel dari bahan polimer alam yang biodegradable dan
biocompatible mulai menjadi pusat perhatian para ilmuwan (Abdel-Mohzen,
et al., 2011). Dalam konteks ini, salah satu peluang yang dapat dimunculkan
memiliki banyak keunggulan dibanding bahan sintetis dimana kebanyakan
bahan alam bersifat biodegradable, ketersediaannya melimpah, bernilai
ekonomis, dan berkontribusi positif pada konservasi alam.
Terdapat beberapa alternatif bahan alam yang merupakan jenis
tumbuhan tingkat rendah dimana kaya akan polimer alam dan dapat
digunakan sebagai salah satu komponen penyusun hidrogel. Bahan alam
berupa agar-agar dengan kode GN akan digunakan sebagai bahan dasar dalam
pembuatan biohidrogel. GN memiliki struktur tiga dimensi, dapat
mengembang, menyusut, dan membentuk gel. Hal ini sesuai dengan syarat
pembentukan hidrogel sehingga GN dapat digunakan sebagai bahan baku
alternatif yang dapat digunakan untuk membuat hidrogel. GN banyak tumbuh
di perairan Indonesia dan sangat cocok dibudidayakan di wilayah tropis
seperti Indonesia.
Budidaya GN telah banyak dikembangkan di berberapa wilayah
perairan Indonesia, namun pemanfaatan GN untuk berbagai aplikasi masih
kurang maksimal. Dengan memperhatikan kelimpahan dan kandungan
selulosa GN yang tinggi, pengolahan GN umtuk berbagai kebutuhan dan
aplikasi dapat meningkatkan nilai tambah material tersebut. Selain itu, GN
bersifat biodegradable sehingga cocok digunakan sebagai salah satu material
pembuatan hidrogel CRF.
Hidrogel dari bahan alam memiliki kekuatan mekanik yang rendah,
sehingga dibutuhkan suatu polimer yang berfungsi untuk memperkuat
struktur mekanik hidrogel dengan teknik ikat silang (crosslinker). Terdapat
banyak senyawa kimia yang digunakan sebagai agen pengikat silang seperti
senyawa epoksi dan aldehida, misalnya epichlorohydrin (ECH) dan
glutaraldehid. Dalam penelitian ini polimer yang digunakan ialah polivinil
alcohol (PVA) dengan pengikat silang (crosslink) glutaraldehid (GA).
1.2 Rumusan Masalah
Berdasarkan uraian yang dikemukakan di atas, maka rumusan masalah
1. Bagaimana komposisi optimum PVA-EGN-Crosslinker GA pada sintesis
biohidrogel
2. Bagaimana karakteristik biohidrogel hasil sintesis
3. Bagaimana kinerja biohidrogel hasil sintesis sebagai CRF
1.3 Tujuan Penelitian
Tujuan dalam penelitian ini ialah sebagai berikut:
1. Mengetahui komposisi optimum PVA-EGN-Crosslinker GA pada
sintesis biohidrogel
2. Mengetahui karakteristik biohidrogel hasil sintesis, serta
3. Mengetahui kinerja biohidrogel hasil sintesis sebagai CRF
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat sebagai:
1. Metode alternatif untuk sintesis biohidrogel CRF berbahan dasar EGN
2. Sumbangan bagi perkembangan teknologi pertanian di Indonesia,
terutama dalam pemanfaatan biohidrogel sebagai material CRF
3. Informasi mengenai potensi pemanfaatan hidrogel berbahan dasar EGN
BAB III
METODE PENELITIAN
3.1 Lokasi Penelitian dan Waktu Penelitian
Tahapan penelitian yaitu preparasi ekstrak GN, sintesis hidrogel CRF, dan
uji kinerja hidrogel CRF dilakukan di Laboratorium Riset Kimia Lingkungan
FPMIPA B UPI yang beralamat di Jl. Dr. Setiabudhi No.229 Bandung. Sedangkan
tahapan karakterisasi hidrogel CRF dengan FTIR dilakukan di Laboratorium
Instrumen FPMIPA UPI dan karakterisasi hidrogel CRF dengan SEM dan XRD
dilakukan di Laboratorium Research Center for Exotic Nanocarbon, Shinshu
University dan Hiroshima University, Jepang. Waktu penelitian dimulai pada
bulan April 2013.
3.2 Alat dan Bahan
Bahan yang digunakan pada penelitian ini adalah GN kering, glutaraldehida
p.a. (Merck), metanol, asam sulfat, asam asetat p.a. (Merck), n-polivinil alkohol
p.a. (Merck), natrium hidrogen pospat (NH4H2PO4), kalium nitrat (KNO3), zink
nitrat (Zn(NO3)2), kacang hijau, tanah, kapas, dan aquadest.
Sedangkan alat yang digunakan adalah Scanning Electron Microscopy
(SEM), Spektrofotometer FTIR, X-ray diffraction (XRD), spektrometer serapan
atom (AAS), magnetic stirer, gelas kimia 600 mL, 400 mL, 250 mL, dan 100 mL,
gelas ukur 50 mL, 25 mL, dan 10 mL, botol semprot, kertas saring, corong
buchner, neraca analitik, kaca arloji, cetakan hidrogel, spatula, oven, penangas
listrik, plastik wraps, batang pengaduk, labu ukur 250 mL dan 100 mL, pipet tetes,
blender, mikropipet ukuran 5 mL dan 10 mL, dan gelas plastik.
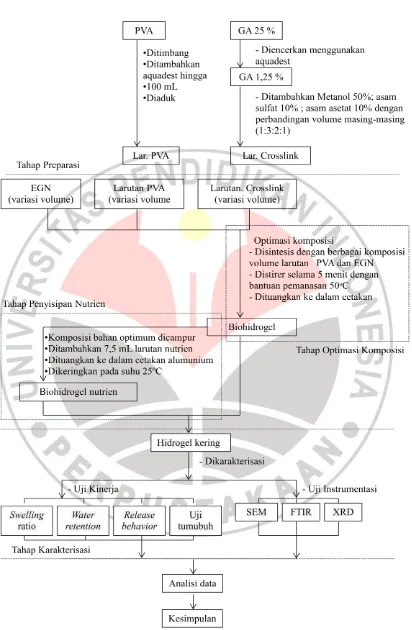
3.3 Metode Penelitian
Penelitian ini dilakukan melalui berbagai tahap yaitu tahap preparasi,
sintesis dan karakterisasi. Tahap preparasi meliputi tahap penyiapan EGN dengan
teknik ekstraksi menggunakan tiga jenis pelarut yaitu metanol, etanol, dan air.
Proses sintesis hidrogel EGN-PVA dilakukan pada berbagai variasi komposisi.
dasar. Biohidrogel hasil sintesis kemudian dikarakterisasi melalui pengujian sifat
mekanik dan kinerjanya sebagai CR (uji swelling dan retensi air) untuk penentuan
kondisi optimum. Biohidrogel disintesis kembali dengan menggunakan komposisi
optimum untuk kemudian disisipkan larutan nutrien. Karakterisasi dan uji kinerja
biohidrogel sebelum dan sesudah penyisipan nutrien dilakukan melalui penentuan
struktur dan morfologi dengan bantuan instrumentasi SEM, FTIR dan XRD, serta
uji kinerja swelling ratio, retensi air, release behavior, dan biodegradasi.
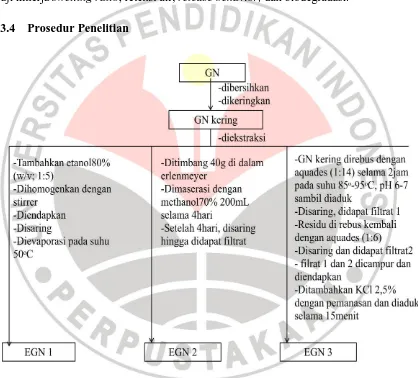
3.4 Prosedur Penelitian
3.4.1Tahap Preparasi
3.4.1.1Tahap Pembuatan Larutan Asam asetat 10%
Diambil asam asetat glasial sebanyak 10,20 mL, kemudian
dilarutkan ke dalam aquades 50 mL, dihomogenkan dan ditambahkan
kembali aquades hingga volume 100 mL.
3.4.1.2Tahap Pembuatan Larutan Methanol 50%
Larutan metanol 96% dipipet sebanyak 52,08 mL, kemudian
dimasukan ke dalam gelas kimia 100 mL, lalu ditambahkan aquades
sampai volume 100 mL dan dihomogenkan.
3.4.1.3Tahap Pembuatan Larutan Glutaraldehida 1,25%
Larutan glutaraldehida 25% dipipet sebanyak 5 mL, kemudian
dimasukan ke dalam gelas kimia 100 mL, lalu ditambahkan aquades
sampai volume 100 mL dan dihomogenkan.
3.4.1.4Tahap Pembuatan Larutan Asam Sulfat 10%
Larutan asam sulfat 98% dipipet sebanyak 10,20 mL,
kemudian dimasukan ke dalam labu ukur 100 mL, lalu ditambahkan
aquades sampai tanda batas dan dihomogenkan.
3.4.1.5Tahap Pembuatan Larutan Crosslink dengan
Perbandingan 3:2:1:1
Larutan metanol 50% ditambahkan larutan asam asetat 10%,
larutan glutaraldehida 1,25%, dan larutan asam sulfat 10% kemudian
diaduk sampai homogen. Campuran ini dibuat dengan perbandingan
3:2:1:1.
3.4.1.6Tahap Pembuatan Larutan PVA 10%
Polivinil alkohol ditimbang sebanyak 10 gram, kemudian
dilarutkan ke dalam aquades 50 mL, dihomogenkan dan ditambahkan
kembali aquades hingga volume 100 mL.
3.4.1.7Tahap Pembuatan Nutrien 0,025mol
Natrium hidrogen pospat (NH4H2PO4) ditimbang sebanyak
2,857 g, kalium nitrat (KNO3) ditimbang sebanyak 2,5275 g, dan zink
dibuat 0,025 mol. Kemudian ketiga zat tersebut dilarutkan ke dalam
aquades 50 mL, dihomogenkan dan ditambahkan kembali aquades
hingga volume 100 mL.
3.4.1.8Tahap Preparasi GN
Simplisia GN diperoleh dari Pulau Pari, Kepulauan Seribu,
DKI Jakarta. GN dicuci dengan air untuk menghilangkan garam,
mikroorganisme dan kotoran-kotoran yang menempel. GN yang telah
bersih dikeringkan di udara terbuka selama beberapa minggu tanpa
terkena cahaya matahari langsung. Simplisia yang telah kering
kemudian dihaluskan menggunakan blender. Setelah itu, simplisia
ditimbang massa keringnya.
3.4.1.9Tahap Pembuatan EGN
Ekstraksi GN dilakukan melalui beberapa cara untuk
mengetahui cara ekstraksi terbaik yang sesuai dengan kebutuhan
ekstrak GN sebagai bahan dasar pembuatan hidrogel. Cara pertama
ekstraksi dilakukan dengan menambahkan etanol 80% dengan
perbandingan 1:5 (w/v), dihomogenkan, diendapkan dan kemudian
disaring. Filtrat dievaporasi dengan menggunakan penguap putar
(rotary evaporator) pada suhu 50 °C sehingga dihasilkan ekstrak GN
pertama. (Jasmanindar, 2009)
Cara kedua simplisia GN ditimbang sebanyak 40 gram dan
dimasukkan ke dalam gelas erlenmeyer. Lalu dilakukan perendaman
(maserasi) dengan larutan metanol 70% sebanyak 200 mL dan
direndam selama 4 hari. Perendaman tersebut berfungsi untuk
menyerap senyawa-senyawa organik yang terkandung dalam simplisia.
Setelah 4 hari, larutan disaring menggunakan kertas saring hingga
didapat larutan ekstrak GN kedua. (Melki, 2012)
Cara ketiga ekstraksi GN dilakukan dalam dua tahap yaitu
direbus dengan air dengan total air perebusan sebanyak 20 kali berat
GN kering. Perebusan pertama dilakukan dengan air seberat 14 kali
diaduk. Hasil perebusan disaring dengan kain dan residunya diekstrak
lagi selama 1 jam dengan air (massa air 6 kali berat GN kering). Hasil
perebusan disaring, residu dibuang, dan filtratnya dicampurkan ke
filtrat hasil penyaringan pertama. Campuran ini lalu diendapkan untuk
memisahkan kotoran halus yang masih ada. Setelah pengendapan,
dilakukan pengentalan dengan menambahkan bahan pengental KCl
2,5% sambil dipanaskan selama 15 menit dan terus diaduk hingga di
dapat ekstrak GN ketiga. Ekstrak GN pertama, kedua, dan ketiga
yang dihasilkan disimpan dalam wadah tertutup yang akan digunakan
untuk penentuan optimasi pelarut.
3.4.2Tahap Sintesis
3.4.2.1Uji Awal EGN
Pada tahap ini dilakukan pembuatan hidrogel EGN–PVA,
ketiga jenis EGN dari hasil ekstraksi dicampurkan dengan PVA dan
crosslinker GA masing-masing di dalam gelas yang berbeda dengan
perbandingan 1:1:1. Setelah itu diaduk selama 5 menit menggunakan
magnetic stirer sampai homogen dengan bantuan pemanasan sebesar
50°C kemudian dituangkan ke cetakan dan dibiarkan sampai hidrogel
kering. Tahap ini bertujuan untuk mengetahui apakah hidrogel dapat
terbentuk atau tidak. Hasil pengujian ini dapat digunakan untuk
memilih pelarut EGN terbaik ketika dicampurkan dengan PVA dan
crosslinker GA pada penelitian hidrogel ditahap berikutnya melalui uji
swelling.
3.4.2.2Optimasi Komposisi EGN dan PVA
Pada tahap ini dilakukan pembuatan hidrogel EGN-PVA
dengan 5 macam variasi komposisi untuk mengetahui komposisi
optimum dalam pembentukan hidrogel dimana variabel tetap dalam
hal ini ialah volume crosslinker, suhu (50 °C), dan waktu pemanasan
Larutan PVA ditambahkan larutan EGN dan larutan
crosslinker dengan perbandingan masing-masing seperti pada tabel di
bawah. Setelah itu diaduk 5 menit menggunakan magnetic stirer
sampai homogen dengan bantuan pemanasan sebesar 50°C kemudian
dituangkan ke dalam cetakan dan dibiarkan sampai hidrogel kering.
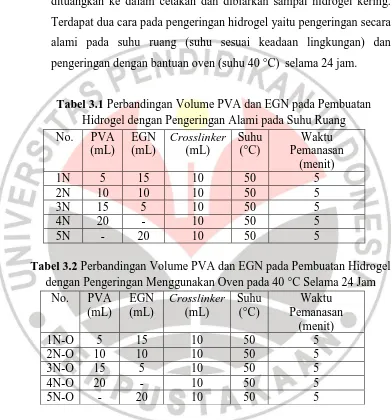
Terdapat dua cara pada pengeringan hidrogel yaitu pengeringan secara
alami pada suhu ruang (suhu sesuai keadaan lingkungan) dan
pengeringan dengan bantuan oven (suhu 40 °C) selama 24 jam.
Tabel 3.1 Perbandingan Volume PVA dan EGN pada Pembuatan Hidrogel dengan Pengeringan Alami pada Suhu Ruang No. PVA
Tabel 3.2 Perbandingan Volume PVA dan EGN pada Pembuatan Hidrogel dengan Pengeringan Menggunakan Oven pada 40 °C Selama 24 Jam
No. PVA
3.4.2.3Tahap Pemasukan Nutrien ke dalam Hidrogel
Hidrogel yang telah terbentuk disisipkan nutrisi yang telah
disiapkan sebelumnya dalam bentuk larutan nutrien. Metode
penyisipan yang dilakukan ada dua yaitu, larutan nutrien dicampurkan
bersamaan dengan bahan hidrogel CRF pada tahap pembuatan
membenamkan hidrogel yang telah terbentuk ke dalam larutan nutrien
sehingga terjadi difusi nutrien ke dalam hidrogel. Nutrien disisipkan
pada hidrogel hasil uji optimasi komposisi dan variasi GA. Nutrien
disisipkan dengan perbandingan PVA: EGN: Crosslinker: Nutrien
yaitu 10:10:10:7,5 sesuai dengan penelitian sebelumnya. Adapun
mikronutrien yang disisipkan yaitu Zink Nitrat 0,025 M sebagai
sumber nutrisi bagi tanaman.
Pada tahap ini dilakukan pembuatan hidrogel EGN-PVA plus
nutrien dengan dua cara penyisipan nutrien untuk mengetahui cara
yang tepat dan selanjutnya hidrogel plus nutrien akan dikarakterisasi
dan diuji kinerjanya.
3.4.3Tahap Karakterisasi Hidrogel CRF
Pada tahap ini, dilakukan karakterisasi terhadap biohidrogel controlled
release fertilizer yang terdiri dari PVA, EGN, dan crosslinker, ddengan dan
tanpa penambahan nutrien. Karakterisasi struktur dan morfologi biohidrogel
dilakukan dengan menggunakan instrumentasi spektrometer FTIR, XRD,
dan SEM. Sedangkan pengujian kinerja meliputi parameter swelling ratio,
water retention, release behavior, uji tumbuh, dan uji degradasi.
3.4.3.1Rasio Swelling
Untuk mempelajari swelling hidrogel, digunakan metode
gravimetri. Rasio swelling diperlukan untuk mengetahui tingkat
elastisitas hidrogel. Hidrogel kering ditimbang (Wd) lalu direndam
dalam 25 mL aquadest dalam gelas kimia 100 mL. Setelah beberapa
saat, hidrogel diangkat dan permukaannya dikeringkan dengan
menggunakan tissue. Kemudian hidrogel tersebut ditimbang kembali
berdasarkan waktu yang telah ditentukan yaitu setiap 10 menit sekali
selama 2 jam pertama dan selanjutnya setiap satu hari sampai dua
Waktu pengangkatan hidrogel dilambangkan dengan Ws. Rasio
swelling pada hidrogel CRF dipelajari dengan menggunakan
persamaan 1
(1)
3.4.3.2Retensi Air
Faktor retensi air dalam hidrogel berfungsi untuk
mempertahankan kelembaban dan kandungan nutrisi dalam tanah
pertanian. Untuk mempelajari retensi air tanah yang mengandung
hidrogel CRF, sampel hidrogel CRF kering dibenamkan di dalam 40g
tanah kering yang ditempatkan dalam cangkir (A). Sejumlah 40g
tanah kering lain tanpa hidrogel CRF ditempatkan dalam cangkir (B),
kemudian setiap cangkir ditimbang (W). Setelah itu, air suling
sebanyak 25mL ditambahkan ke dalam kedua cangkir dan ditimbang
kembali (Wo). Cangkir tersebut disimpan pada kondisi suhu kamar
yang sama dan ditimbang setiap hari (Wt) sampai berat tanah kembali
seperti sebelum ditambahkan air suling. Retensi air (%WR) dari tanah
kemudian dihitung dengan Persamaan 2.
(2)
3.4.3.3Uji Tumbuh pada Kecambah Kacang Hijau
Pengujian ini bertujuan untuk melihat apakah hidrogel dapat
bekerja sebagai media tumbuh tanaman. Pada aplikasi ini tanaman
yang digunakan ialah kacang hijau. Kacang hijau yang akan
digunakan disortasi terlebih dahulu dengan merendam kacang hijau
tersebut di dalam air bersih selama satu malam, kacang hijau yang
terendam dipilih untuk selanjutnya digunakan untuk uji tumbuh pada
hidrogel. Kacang hijau yang telah disortasi diletakkan di atas
permukaan hidrogel plus nutrien dan diletakan di dalam cangkir (A).
Sejumlah kacang hijau lain diletakkan di atas permukaan hidrogel plus
cangkir (B). Kemudian kedua cangkir tersebut ditetesi dengan air
secara berkala dan diamati pertumbuhannya.
3.4.3.4Pengujian Kemampuan Biodegradasi
Hidrogel dipotong dengan ukuran 1x1 cm, setiap spesi yang
telah ditimbang ditempatkan pada tanah pertanian yang ada didalam
sebuah pot. Pot tersebut dibiarkan selama 50 hari dalam kondisi
ambient. Variasi morfologi dan waktu disintregasi dari hidrogel
diamati.
3.4.3.5Release Behavior dengan Instrumentasi AAS
Penentuan konsentrasi adsorbsi dan desorbsi nutrien pada
hidrogel dilakukan dengan menggunakan metode AAS untuk
mengetahui perubahan konsentrasi pada hidrogel sebelum dan setelah
pelepasan nutrisi. Konsentrasi nutrient dapat ditentukan dari kurva
kalibrasi larutan standar. Kurva standar dibuat dengan memplot
absorbansi (sumbu Y) terhadap konsentrasi larutan standar (sumbu X).
Diperoleh garis linear dengan dejarat linearitas mendekati 1.
Kemudian, konsentrasi larutan nutrien diperoleh dengan
membandingkan absorbansi larutan tersebut dengan absorbansi larutan
standar yang telah diketahui konsentrasinya.
Hidrogel kering tanpa nutrien direndam ke dalam larutan
nutrien Zink Nitrat dengan konsentrasi 1, 2, 3, 4, dan 5 ppm.
Penyisipan nutrien ke dalam hidrogel dilakukan selama 18 menit.
Hidrogel kemudian diangkat dan keringkan dengan tissue. Hidrogel
yang telah dikeringkan tersebut bersama hidrogel nutrien coated yang
telah dipotong dengan ukuran 0,5 x0,5 cm2 dibenamkan dalam 25 mL
aquadest selama 18 menit kemudian diangkat dan ditiriskan.
Konsentrasi nutrien yang terdesorbsi dalam aquadest hasil rendaman
tersebut di uji AAS dengan panjang gelombang 766.5 nm, energi
64%, dan interval waktu pengukuran 0,7 detik. Pengukuran
3.4.3.6Karakterisasi menggunakan SEM
Alat yang akan digunakan pada analisis ini yaitu SEM.
Pengujian ini dilakukan bertujuan untuk mengetahui penampang muka
dan penampang melintang hidrogel serta untuk mengetahui ukuran
pori hidrogel. Sebelum diuji, hidrogel terlebih dahulu dikeringkan dan
kemudian dihaluskan. Setelah itu, sampel ditempatkan pada wadah
sampel kemudian dimasukkan ke dalam vacuum chamber dari
instrumen SEM untuk diobservasi struktur morfologinya.
3.4.3.7Karakterisasi menggunakan FTIR spektrometer
Karakterisasi ini dilakukan untuk menentukan gugus fungsi
pada hidrogel dengan bantuan alat spektrofotometer FTIR
(SHIMADZU FTIR-8400). Terdapat 5 sampel yang dikarakterisasi
menggunakan FTIR spektrometer, diantaranya: GN, EGN, PVA-GA,
biohidrogel dengan dan tanpa nutrien. Pada tahap preparasi, sampel
dihaluskan kemudian dipadatkan dan dianalisis dalam bentuk pelet
dengan penambahan KBr. Pelet sampel dimasukkan ke dalam
intrumen untuk diukur serapan FTIR pada sampel tersebut. Spektrum
direkam dalam daerah bilangan gelombang dari 4000 cm-1 sampai 600
cm-1. Kemudian spektrum yang diperoleh dibandingkan satu sama lain
untuk melihat pengaruh nutrien dalam pembentukan gugus fungsi
pada hidrogel.
3.4.3.8Karakterisasi menggunakan XRD
Kristalinitas biohidrogel CRF dikarakterisasi dengan
menggunakan teknik X-ray diffraction (XRD) dengan energi 50kV/
300 mA. Sebelum dilakukan pengukuran, hidrogel terlebih dahulu
dikeringkan dan kemudian dihaluskan. Setelah itu, sampel
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan didapatkan beberapa
kesimpulan sebagai berikut :
a. Ekstrak GN (EGN) didapat dari hasil ekstraksi simplisia GN kering
dengan metode maserasi selama 4 hari menggunakan pelarut optimum
yaitu methanol 70%. EGN tersebut direaksikan dengan PVA dan
CL(GA) untuk membentuk biohidrogel. Adapun waktu yang
dibutuhkan sampai biohidrogel terbentuk ialah tujuh hari setelah hari
sintesis.
b. Berdasarkan hasil optimasi komposisi melalui uji rasio swelling,
retensi air, dan FTIR maka dapat disimpulkan komposisi optimum
dengan perbandingan PVA:EGN:CL(GA) ialah 1:1:1 dengan
kemampuan swelling mencapai 440% dan mampu menjaga
kelembaban tanah (retensi air) sampai hari ke-25.
c. Uji instrumentasi menggunakan XRD menunjukkan bahwa
biohidrogel dengan nutrien memiliki nilai kristalinitas yang lebih
tinggi dibandingkan dengan biohidrogel tanpa nutrien. Uji FTIR
menyatakan bahwa biohidrogel dengan nutrien dan tanpa nutrien
menghasilkan puncak-puncak pada bilangan gelombang yang sama
namun lebar dan ketajaman puncak yang berbeda, hal ini disebabkan
oleh adanya pengaruh lingkungan yang berasal dari air ataupun
nutrien. Sedangkan uji SEM mengkonfirmasi bahwa pada kedua jenis
biohidrogel tersebut terdapat pori, namun ukuran dari pori-pori
tersebut belum bisa dihitung karena keterbatasan alat.
d. Uji kinerja pada biohidrogel terdiri dari rasio swelling, retensi air,
release behavior, uji tumbuh, dan juga uji biodegradable. Pada rasio
swelling dan retensi air, biohidrogel dengan nutrien menunjukkan
dapat dikaitkan dengan harga kristalinitas dimana daya absorpsi dan
desorpsi berbanding lurus dengan kristalinitas. Selanjutnya, release
behavior menunjukkan bahwa biohidrogel berbahan dasar EGN
memiliki ikatan kimia yang kuat dengan nutrien yang disisipkan
sehingga laju pelepasan nutrien belum dapat diukur. Uji tumbuh
menunjukkan bahwa biohidrogel tidak bisa bekerja secara mandiri
sebagai media tumbuh tetapi biohidrogel dapat bekerja dengan adanya
media pendukung. Sedangkan uji biodegradable menyatakan bahwa
biohidrogel berbahan dasar EGN bersifat biodegradable.
5.2 Saran
Untuk penelitian selanjutnya penulis menyarankan:
a. Pada uji SEM sebaiknya biohidrogel di sintesis dengan bentuk setipis
mungkin atau monolayer untuk memudahkan analisis mengenai
porositas dan luas permukaan dari pori biohidrogel yang telah
disintesis sehingga didapatkan hasil yang maksimal.
b. Pada uji kinerja release behavior, perubahan konsentrasi larutan
nutrien diukur berdasarkan fungsi waktu untuk mengetahui
kemampuan pelepasan nutrien oleh biohidrogel.
c. Pada uji tumbuh sebaiknya dilakukan pula pengujian pada blanko agar
dapat membandingkan hasil analisis uji tumbuh pada hidrogel dan
DAFTAR PUSTAKA
Abdel-Mohzen, A.M., et al. (2011). “Eco-Synthesis of PVA/Chitosan Hidrogels for Biomedical Appliccation”. J Polym Environ. 19, 1005-1012.
Anggadiredja, J.T., Zatnika, A., Purwoto, H., dan Istini, S., 2002. Rumput Laut,
Penebar Swadaya, Jakarta Chapman, V.J., and Chapman, C.J., 1980. ”Seaweed and Their Uses”. 3rd
ed., pp. 148 – 193, Chapman and Hall Ltd.,
London
Aslan, L. M. (1998). Budidaya rumput laut. Kanisius. Yogyakarta, 92 hlm.
Atefah, et al. (2009). “Synthesis and Analysis of Swelling and Controlled Release Behaviour of Anionic sIPN Acrylamide based Hydrogels”. World
Academy of Science, Engineering and Technology 56 2009.
[Dirjen] Direktorat Jenderal Perikanan. 2005. Profil rumput laut Indonesia. Jakarta.
Dirjen Perikanan Budidaya DKP. 152 hlm.
Distantina, Sperisa, dkk. (2008). “Pengaruh Konsentrasi dan Jenis Larutan Perendaman terhadap Kecepatan Ekstraksi dan Sifat Gel Agar-agar dari
Rumput Laut Gracilaria verrucosa”. Jurnal Rekayasa Proses, Vol. 2, No.
1
Han X, Chen S, dan Xianguo Hu. (2008). “Controlled-release fertilizer encapsulated by starch/polyvinyl alcohol coating”. Desalination. 240,
21-26.
Hendrajat, A. E. (2010). “Polikultur udang vaname (Litopenaeus vannamei) dan rumput laut (Gracillaria verrucosa)”. Sulawesi: Balai Riset Perikanan
Budidaya Air Payau.
Jamnongkan, T., Kaewpirom, S. (2010). “Controlled-Release Fertilizer Based on Chitosan Hidrogel: Phosphorus Release Kinetic”. Science Journal UBU. 1,
(1), 43-50.
Jasmanindar, Y. (2009). Penggunaan Ekstrak Gracilaria Verrucosa Untuk
Meningkatkan Sistem Ketahanan Udang Vaname Litopenaeus Vanname.
Kaewpirom, S., & Boonsang, S. (2006). “Electrical response characterization of
poly(ethylene glycol) macromer (PEGM) / chitosan hydrogels in NaCl
solution”. European Polymer Journal, 42, 1609–16.
Liang, R., Liu, M., & Wu, L. (2007). “Controlled Release NPK Compound Fertilizer with The Function of Water Retention”. Reactive and Functional Polymers. 67, 769-79.
Luning, K. 1990. Seaweeds - Their Environment, Biogeography, and
Ecophysiology. A WileyInterscience Publication.
Matsuhasi, T., 1977. Acid Pretreatment of Agarophytes Provides Improvement in
Agar Extraction, J. Food Sci., 42, 1396 – 1400.
M.E. Trenkel. 2010. Slow- and Controlled- Release and Stabilized Fertilizers An
Option for Enhancing Nutrient Use Efficiency in Agriculture. Graphics:
Helene Glnet, IFA. ISBN 978-2-9523139-7-1.
Melki, Ayu EP, Wike, dan Kurniati. (2012). “Uji Antibakteri Ekstrak Gracilaria
sp (Rumput Laut) Terhadap Bakteri Escherichia coli dan Staphylococcus
aureus”. FMIPA Universitas Sriwijaya, Indralaya: Tidak Diterbitkan.
Mobarok. (2007). Kristalisasi dan Karakterisasi Senyawa Aktif Bioflokulan DYT
hasil Isolasi Melalui Metode Refluks. Skripsi Sarjana pada FPMIPA
Universitas Pendidikan Indonesia, Bandung : Tidak Diterbitkan.
M. Ray. (1999). Essential Plant Nutrients: their presence in North Carolina soils
and role in plant nutrition. Agronomis Division : NCDA&CS
Nurul-Ulfah, N. (2013). Preparasi dan Uji Swelling Ratio Hidrogel Berbahan
Dasar Polivinil Alkohol Bioflokulan DYT dan Kitosan. Skripsi Sarjana pada
FPMIPA Universitas Pendidikan Indonesia, Bandung : Tidak Diterbitkan.
Omidian, H. and Park, K. (2008). “Swelling agents and devices in oral drug
delivery”. J. DRUG DEL. SCI. TECH. 18(2)83-93 2008.
Purnawijaya, Y. (2013). Preparasi dan Uji Swelling Ratio Hidrogel Berbahan
Dasar Polivinil Alkohol Bioflokulan DYT dan Kitosan. Skripsi Sarjana pada
FPMIPA Universitas Pendidikan Indonesia, Bandung : Tidak Diterbitkan.
Putra, S. E. (2006). Alga laut sebagai biotarget industri. Sekjen Ikatan Mahasiswa
Shaviv, A. and Mikkelsen, R.L. (1993a). “Slow release fertilizers for a safer
environment maintaining high agronomic efficiency”. Fertilizer Research
35, 1-12.
Shaviv A. and Mikkelsen, R.L. (1993b). “Controlled-release fertilizers to increase
efficiency of nutrient use and minimize environmental degradation” – A
review. Fertilizer Research 35, 1-12.
Shaviv, A. (2005): Controlled Release Fertilizers. IFA International Workshop on
Enhanced-Efficiency Fertilizers, Frankfurt. International Fertilizer
Industry Association Paris, France.
Shoji, S. (2005). “Innovative use of controlled availability fertilizers with high
performance for intensive agriculture and environmental conservation”.
Science in China Ser. C. Life Sciences 48, 912-920.
Swantomo, dkk. (2008). “Pembuatan Komposit Polimer Superabsorben dengan Mesin Berkas Elektron”. Seminar Nasional IV Sdm Teknologi
NuklirYogyakarta.
Tachibana, M. (2007 and 2008). Chissoasahi fertilizer co., Ltd: personal report.
Uswatun Hasanah, R. (2007). Pemanfaatan Rumput Laut (Gracilaria sp.) dalam
Meningkatkan Kandungan Serat Pangan Pada Sponge Cake. Skripsi
Sarjana pada FPIK Institut Pertanian Bogor, Bogor : Tidak Diterbitkan. Varshosaz', J. dan Koopaie, N. (2002). ”Cross-linked Poly (vinyl alcohol)
Hydrogel : Study of Swelling and Drug Release Behaviour”. Iranian Polymer Journal .11, (2), 123-131.
Wang, W. Dan Wang, A. (2010). “Preparation, Swelling and Water-retention Properties of Crosslinked Superabsorbent Hydrogels Based on Guar Gum”.
Advanced Materials Research . 96, 177-182.
You, H.C., Jinhae., dan Park, J.H. (2009). “Pulp And Paper Made From Rhodophyta And Manufacturing Method Thereof”. United States Patent.
US 7,662,019 B2.
Zhang, M. (2007). “Effect of coated controlled-release fertilizer on yield increase
Zhang, M., Yang, Y.Ch., Song, F.Pg. and Shi, Y.Xi (2005). “Study and
Industrialized Development of Coated Controlled-Release Fertilizers”.