Iler leaf is one of plant that has many health benefits. Flavonoid, is one of the active compound contained in iler leaf. It has been proven that flavonoid has antioxidant activity. This study was conducted to find out the effect of analgetic iler leaf infusion on female mice using chemical stimulation method.
This research was a pure experimental research of a complete random design of one-way pattern. 35 swiss strain female mice, aged 2-3 months, 20-30 grams and divided randomly in 7 groups. Group I: negative control (aquades 25 g/kgBW), group II: positive control (acetocal 91 mg/kgBW), group III-VII: treatment groups were given iler leaf infusion doses ratings (dose I = 163,75 mg/KgBW; dose II = 327,5 mg/kgBW, dose III = 655 mg/kgBW, dose IV = 1310 mg/kgBW; V= 2620). Control and test materials used were given orally. Fifteen minutes after administration of the test materials and controls, pain inductor (acetic acid 1%) were injected by intraperitonial.The number of mice stretching were observed that appeared every 5 minutes, within 60 minutes. Number of stretching are used to calculate % protection stretching. The results obtained will be analyzed by the Saphirowilk, continued by Kruskalwallis and Mann whitney with 95% confidence level.
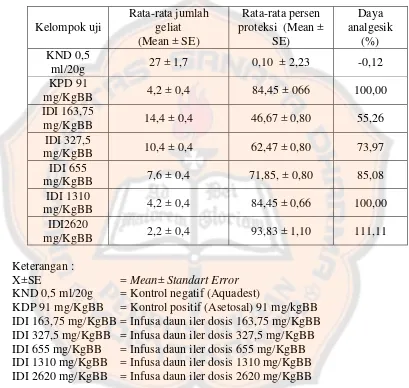
The results of the study suggesting that iler leaf infusion has analgesic effect. Percent protection of iler leaf infusion at dose 163,75 mg/KgBW; dose II = 327,5 mg/kgBW; 655 mg/KgBW; 1310 mg/KgBW and 2620 mg/KgBW were 46,67; 62,47; 71,85; 84,45 dan 93,83% respectively. Effective dose (ED50) of iler leaf infusion is 181,97 mg/KgBW.
Daun iler (Coleus atropurpureus L. Benth) merupakan salah satu tanaman yang banyak memiliki manfaat bagi kesehatan. Flavonoid merupakan salah satu senyawa aktif yang terkandung didaun iler. Telah dibuktikan bahwa flavonoid mempunyai aktivitas sebagai antioksidan. Penelitian ini dilakukan untuk mengetahui adanya efek analgesik dari infusa daun iler terhadap mencit betina dengan menggunakan metode rangsang kimia.
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Tiga puluh lima ekor mencit jenis kelamin betina galur Swiss, umur 2-3 bulan, berat badan 20-30 gram dan dibagi dalam 7 kelompok. Kelompok I adalah kontrol negatif (Aquades 25 g/kgBB), kelompok II adalah kontrol positif (asetosal dosis 91 mg/kgBB), kelompok III-VII adalah kelompok perlakuan infusa daun iler dengan peringkat dosis (163,75; 327,5; 655; 1310 dan 2620 mg/KgBB). Kontrol dan bahan uji diberiakan secara per oral. Lima belas menit setelah diberikan bahan uji dan kontrol, induktor nyeri (asam asetat 1%) diberikan secara intraperitonial. Diamati jumlah geliat mencit yang ditimbulkan setiap 5 menit, selama 60 menit. Jumlah geliat digunakan untuk menghitung % proteksi geliat. Hasil yang didapatkan akan dianalisis dengan uji Saphiro Wilk, dilanjutkan
Kruskal Wallis dan Mann Whitney dengan taraf kepercayaan 95%.
Hasil penelitian menunjukkan bahwa infusa daun iler dapat memberikan efek analgesik Persentase proteksi geliat dari masing-masing infusa daun iler dengan dosis 163,75; 327,5; 655;1310; dan 2620 mg/kg BB mencit berturut-turut sebesar 46,67; 62,47; 71,85; 84,45; 93,83. Dosis efektif (ED50) dari infusa daun iler sebesar 181,97 mg/KgBB.
i
EFEK ANALGESIK INFUSA DAUN ILER
(Coleus atropurpureus L. Benth) DENGAN METODE RANGSANG KIMIA PADA MENCIT BETINA
SKRIPSI
Disusun untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
Endang Milia Tabalubun NIM : 098114125
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iv
HALAMAN PERSEMBAHAN
”NURANI ADALAH SUARA TUHAN”
Ilmu pengetahuan adalah salasatu tujuan hidup manusia, tanpa ’Ilmu
Pengetahuan’ dunia akan gelap dan tidak ada kelangsungan hidup. Sebagai
manusia hendaklah kita menjunjung tinggi ilmu pengetahuan dan menghormati mereka yang berjasa yaitu nabi/resi/guru tercinta.
Saat kita memiliki ilmu pengetahuan yang baik kemudian berusaha mengaplikasikannya dengan kesadaran yang tinggi dan penuh tanggung jawab maka percaya kita akan dibayar mahal entah berupa uang, penghargaan atau sebaliknya tidak sama sekali tetapi yang terpenting dan percayalah bahwa kita akan mulia di depan Tuhan.
Kupersembahkan skripsi ini untuk Bapa Rudy dan Mama Sul, orang tua saya tercinta atas semangat, kasih sayang dan kasih Tuhan
yang mereka berikan kepada saya Semua sahabatku
vii PRAKATA
Puji syukur dan terima kasih kepada Tuhan Yang Maha Esa atas segala rahmat, berkat, penguatan dan kasih yang tak terhingga sehingga penulis dapat menyelesaikan skripsi yang berjudul “Efek Analgesik Infusa Daun Iler (Coleus atropurpureus L.Benth) dengan Metode Rangsang Kimia pada Mencit
Betina” sebagai salah satu syarat untuk mendapatkan gelar sarjana Farmasi (S.Farm).
Dalam proses penelitian dan penyusunan skripsi ini, penulis telah banyak mendapatkan dukungan baik moril maupun materil dari berbagai pihak, berupa bimbingan, pengarahan, semangat, saran dan sarana. Oleh karena itu penulis ingin mengucapkan terima kasih kepada:
1. Dekan Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
2. Ipang Djunarko, M.Sc., Apt., selaku Dosen Pembimbing yang telah banyak memberikan pengarahan, saran, bimbingan, dan dukungan dalam penelitian dan penyusunan skripsi ini.
3. Phebe Hendra, M.Si., Ph.D., Apt., selaku Dosen Penguji yang telah banyak memberikan ide, saran, dan masukan yang membangun bagi penelitian ini.
4. Prof. Dr. C. J. Soegihardjo, Apt., selaku Dosen Penguji yang telah banyak memberikan ide, saran, dan masukan yang membangun bagi penelitian ini.
5. Dra. Maria Margaretha Yetty Tjandrawati, M.Si., selaku Dosen Pembimbing Akademik penulis atas bimbingan, pengarahan dan dukungan selama ini.
viii
7. Almarhum Bapak Tersayang, Mama Tercinta untuk semua perjuangan, didikan, kasih sayang yang tanpa batas buat penulis. I love them and I miss them so much.
8. Keluarga besar Tabalubun dan Lefmanut atas doa, semangat, kasih sayang, dukungan, serta perhatian yang tiada henti kepada penulis.
9. Sahabat-sahabat seperjuangan sejak awal penulis masuk hingga melakukan penelitian ini, Suster Novita Sagala, Devi S Manurung, Febria Sinaga, atas segala pengertian, bantuan, kebersamaan, kerja keras, dan semangat.
10.Leonel Messi, Fabregas Soler, sebagai inspirator, motivator, dan machine laughterpenulis selama masa-masa kuliah hingga pengerjaan skripsi.
11.Teman-teman tercinta Maria Ambuk, Arning Pati, Rosa Delima, serta semua teman-teman FKK-B atas segala bantuan dan semangat kepada penulis selama pengerjaan skripsi.
Penulis telah berupaya dengan semaksimal mungkin dalam penyelesaian skripsi ini, namun penulis menyadari masih banyak kelemahan baik dari segi isi maupun tata bahasa, untuk itu penulis mengharapkan kritik dan saran yang bersifat membangun dari pembaca demi kesempurnaan skripsi ini.Kiranya isi skripsi ini bermanfaat dalam memperkaya perkembangan ilmu pendidikan.
Yogyakarta, Juni 2013
ix
F. Metode uji daya analgesik ………..
1. Golongan analgesik narkotik ………
2. Golongan analgesik non-narkotik ……….
G.Landasan teori ………
H.Hipotesis ……….
BAB III METODE PENELITIAN ………...
x
B. Variabel Penelitian ………..
1. Variabel utama ……….
2. Variabel pengacau ……….
C.Definisi Operasional ………...
D.Subjek dan Bahan Penelitian ………..
1. Subjek penelitian ………...
3. Penentuan dosis infusa daun iler ………...
4. Pembuatan infusa daun iler ………...
5. Pembuatan sediaan ………
a. Asam asetat 1 % ………..
b. Larutan CMC Na 1 % ……….
c. Suspensi asetosal 1 % ……….
6. Penentuan dosis asam asetat ……….
7. Penentuan waktu pemberian rangsangan ………..
8. Penetapan dosis asetosal ………...
9. Pemilihan hewan uji ………..
10.Penetapan criteria geliat ……… 11.Penentuan persean proteksi ……….
xi
12.Perhitungan daya analgesik ……….. 13.Perhitungan Effective Dose50 (ED50) ………..
xii
DAFTAR TABEL
Tabel I Rata-rata jumlah geliat pada berbagai selang waktu pemberian asam asetat 50 mg/kgBB... 36 Tabel II Hasil jumlah kumulatif geliat mencit, % proteksi beserta
perubahan % daya analgesik pada semua kelompok
perlakuan……… 37
Tabel III Hasil uji Mann whitney% proteksi pada uji efek analgesik seluruh kelompok... 39
xiii
DAFTAR GAMBAR
Halaman Gambar 1. Biosintesis Prostaglandin ... Gambar 2 . Struktur kimia asetosal……… Gambar 3. Iler Coleus atropurpureus Bth ... Gambar 4. Skema kerja penelitian ... 16 Gambar 5. Histogram % proteksi uji efek analgesik pada infusa daun iler
untuk semua kelompok perlakuan ... Gambar 6. Persamaan garis ED50 infusa daun iler ... 32 Gambar 7. Daun iler segar. ... 36 Gambar 8. Hasil infusa daun iler ………... Gambar 9. Mencit yang dipuasakan ... 43 Gambar 10. Geliat mencit yang memenuhi criteria ……….... Gambar 11. Geliat mencit yang tidak memenuhi criteria………... Gambar 12. Kotak kaca tempat pengamatan ... 59 Gambar 13. Spuit Injeksi dan peroral ... 59 Gambar 14. Timbangan elektrik ... 60
xiv
DAFTAR LAMPIRAN
Lampiran 8. Hasil analisis uji Mann-Whitney pada jumlah geliat
antara kontrol negatif dan infusa iler dosis II ………... 56 Lampiran 1. Foto daun iler dan infusa daun iler yang digunakan
dalam penelitian ... 49 Lampiran 2. Foto geliat mencit yang masuk dan yang tidak masuk
kriteria ... 50
51
52
53
54 Lampiran 3. Foto spuit injeksi IV , peroral dan timbangan analitik
yang digunakan dalam penelitian... Lampiran 4. Hasil analisis uji Saphiro Wilk pada jumlah geliat
semua kelompok perlakuan …………... Lampiran 5. Hasil analisis uji Kruskal-Wallis pada jumlah geliat
semua kelompok perlakuan... Lampiran 6. Hasi analisis uji Mann-Whitney pada jumlah geliat
antara kontrol negatif dan kontrol positif ……... Lampiran 7. Hasil analisis uji Mann-Whitney pada jumlah geliat
xv
Hasil analisis uji Mann-Whitney pada jumlah geliat antara kontrol positif dan infusa iler dosis I ………. Hasil analisis uji Mann-Whitney pada jumlah geliat antara kontrol positif dan infusa iler dosis II ………. Hasil analisis uji Mann-Whitney pada jumlah geliat antara kontrol positif dan infusa iler dosis III ………. Hasil analisis uji Mann-Whitney pada jumlah geliat antara kontrol positif dan infusa iler dosis IV ………. Hasil analisis uji Mann-Whitney pada jumlah geliat antara kontrol positif dan infusa iler dosis V ………... Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis I dan infusa iler dosis II ……... Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis I dan infusa iler dosis III ……. Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis I dan infusa iler dosis IV ……. Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis I dan infusa iler dosis V …….. Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis II dan infusa iler dosis III …… Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis II dan infusa iler dosis IV ……
xvi
Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis II dan infusa iler dosis V …… Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis III dan infusa iler dosis IV ….. Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis III dan infusa iler dosis V …… Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis II dan infusa iler dosis V …... Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis III dan infusa iler dosis IV ….. Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis III dan infusa iler dosis V …… Hasil analisis uji Mann-Whitney pada jumlah geliat antara infusa iler dosis IVdan infusa iler dosis V …… Hasil determinasi tanaman... Hasil EC penggunaan hewan uji ...
xvii INTISARI
Daun iler (Coleus atropurpureus L. Benth) merupakan salah satu tanaman yang banyak memiliki manfaat bagi kesehatan. Flavonoid merupakan salah satu senyawa aktif yang terkandung didaun iler. Telah dibuktikan bahwa flavonoid mempunyai aktivitas sebagai antioksidan. Penelitian ini dilakukan untuk mengetahui adanya efek analgesik dari infusa daun iler terhadap mencit betina dengan menggunakan metode rangsang kimia.
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Tiga puluh lima ekor mencit jenis kelamin betina galur Swiss, umur 2-3 bulan, berat badan 20-30 gram dan dibagi dalam 7 kelompok. Kelompok I adalah kontrol negatif (Aquades 25 g/kgBB), kelompok II adalah kontrol positif (asetosal dosis 91 mg/kgBB), kelompok III-VII adalah kelompok perlakuan infusa daun iler dengan peringkat dosis (163,75; 327,5; 655; 1310 dan 2620 mg/KgBB). Kontrol dan bahan uji diberiakan secara per oral. Lima belas menit setelah diberikan bahan uji dan kontrol, induktor nyeri (asam asetat 1%) diberikan secara intraperitonial. Diamati jumlah geliat mencit yang ditimbulkan setiap 5 menit, selama 60 menit. Jumlah geliat digunakan untuk menghitung % proteksi geliat. Hasil yang didapatkan akan dianalisis dengan uji
Saphiro Wilk, dilanjutkan Kruskal Wallis dan Mann Whitney dengan taraf kepercayaan 95%.
Hasil penelitian menunjukkan bahwa infusa daun iler dapat memberikan efek analgesik Persentase proteksi geliat dari masing-masing infusa daun iler dengan dosis 163,75; 327,5; 655;1310; dan 2620 mg/kg BB mencit berturut-turut sebesar 46,67; 62,47; 71,85; 84,45; 93,83. Dosis efektif (ED50) dari infusa daun iler sebesar 181,97 mg/KgBB.
xviii ABSTRACT
Iler leaf is one of plant that has many health benefits. Flavonoid, is one of the active compound contained in iler leaf. It has been proven that flavonoid has antioxidant activity. This study was conducted to find out the effect of analgetic iler leaf infusion on female mice using chemical stimulation method.
This research was a pure experimental research of a complete random design of one-way pattern. 35 swiss strain female mice, aged 2-3 months, 20-30 grams and divided randomly in 7 groups. Group I: negative control (aquades 25 g/kgBW), group II: positive control (acetocal 91 mg/kgBW), group III-VII: treatment groups were given iler leaf infusion doses ratings (dose I = 163,75 mg/KgBW; dose II = 327,5 mg/kgBW, dose III = 655 mg/kgBW, dose IV = 1310 mg/kgBW; V= 2620). Control and test materials used were given orally. Fifteen minutes after administration of the test materials and controls, pain inductor (acetic acid 1%) were injected by intraperitonial.The number of mice stretching were observed that appeared every 5 minutes, within 60 minutes. Number of stretching are used to calculate % protection stretching. The results obtained will be analyzed by the Saphirowilk, continued by Kruskalwallis and Mann whitney
with 95% confidence level.
The results of the study suggesting that iler leaf infusion has analgesic effect. Percent protection of iler leaf infusion at dose 163,75 mg/KgBW; dose II = 327,5 mg/kgBW; 655 mg/KgBW; 1310 mg/KgBW and 2620 mg/KgBW were 46,67; 62,47; 71,85; 84,45 dan 93,83% respectively. Effective dose (ED50) of iler leaf infusion is 181,97 mg/KgBW.
1 BAB I PENGANTAR
A. Latar Belakang
Nyeri merupakan perasaan sensoris dan emosional yang tidakn yaman, berkaitan dengan (ancaman) kerusakan jaringan (Tjay dan Rahardja, 2007). Rasa nyeri dalam kebanyakan hal merupakan suatu gejala yang menandakan adanya gangguan pada jaringan. Nyeri adalah suatu pengalaman sensorik dan emosional yang tidak menyenangkan akibat dari kerusakan jaringan secara nyata atau jaringan yang potensial mengalami kerusakan. Nyeri juga merupakan suatu perasaan tidak menyenangkan yang disebabkan stimulus spesifik mekanis, kimia, dan elektrik pada ujung-ujung saraf yang tidak dapat diserahterimakan kepada orang lain (Aprillia,2010).
Karena hal tersebut, maka muncul kecenderungan masyarakat untuk memanfaatkan tanaman sekitar sebagai pengobatan tradisional yang diyakini mempunyai efek samping yang relative lebih kecil daripada menggunakan obat sintetik (Paramono, 2003).
Dalam rangka meningkatkan pelayanan kesehatan secara lebih luas dan merata sekaligus memelihara dan mengembangkan warisan budaya bangsa perlu dilakukan penelitian dan pengembangan obat-obat tradisional hingga penggunaannya dalam masyarakat dapat dipertanggungjawabkan secara ilmiah.
Salah satu kekayaan alam Indonesia yang dapat dimanfaatkan sebagai obat adalah tumbuhan iler. Tanaman iler (Coleus atropurpureus L. Benth) adalah salah satu tumbuhan yang berkhasiat bagi kesehatan masyarakat. Secara tradisional daun tumbuhan iler digunakan untuk membantu menghilangkan rasa nyeri, sembelit, sakit perut, mempercepat pematangan bisul, pembunuh cacing, ambeien, diabetes melitus, wasir, demam dan radang telinga. Sedangkan akarnya dapat mengatasi perut mulas dan mencret(Thomas, 2000).
Menurut penelitian Mpila, Fatimawali, Wiyono (2012), ekstrak etanol daun iler memiliki aktifitas sebagai antibakteri terhadap S.aureus, E. coli dan P. aeruginosa. Hal ini diperkuat juga dalam hasil penelitian Kumala dan Desi (2009), bahwa daun iler memiliki aktifitas sebagai antibakteri terhadap bakteri S. aureus dan E. coli. Namun sampai saat ini belum dilakukan penelitian mengenai efek analgesik dari daun iler.
Menurut penelitian Saragih (2011), Dari uji pendahuluan, yaitu dengan uji skrining fitokimia dengan pereaksi asam sulfat, besi (III) klorida 5%, dan magnesim klorida, natrium hidroksida 10% menunjukkan bahwa ekstrak metanol daun tumbuhan iler mengandung senyawa flavonoida. Manfaat flavonoid bagi kesehatan telah banyak diteliti. Salah satu yang utama adalah kemampuan senyawa flavonoid berperan sebagai antioksidan yang efektif sebagai penangkap radikal bebas. Dengan adanya sifat antioksidan, maka radikal bebas akan ditangkap sehingga proses pembentukan asam arakidonat melalui jalur siklooksigenase akan terhambat dan menyebabkan mediator nyeri dan peradangan tidak terbentuk.
1. Permasalahan
Berdasarkan uraian yang dikemukakan di atas, maka dapat dirumuskan suatu masalah yaitu :
2. Keaslian penelitian
Sepengetahuan penulis, penelitian tentang efek analgesik infusa daun iler pada mencit betina dengan metode rangsang kimia belum pernah dilakukan.
Adapun penelitian terkait tentang tumbuhan iler adalah sebagai berikut: a. Aktivitas Antibakteri Ekstrak Daun Iler (Coleus atropurpureus L. Benth)
Terhadap Beberapa Bakteri Gram (+) dan Bakteri Garm (-) (Kumala dan Desi, 2009).
Dari hasil penelitian penulis, dapat disimpulkan bahwa Coleus atropurpureus
L. Benth memiliki aktivitas antibakteri.
b. Uji Aktivitas Antibakteri Ekstrak Etanol Daun Mayana (Iler) Terhadap
Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa Secara
In-Vitro (Mpila.,dkk, 2012)
Dari hasil penelitian penulis, dapat disimpulkan bahwa ekstrak etanol daun iler memiliki aktivitas sebagai antibakteri terhadap S.aureus, E. coli dan P. aeruginosa.
c. Pengaruh Ekstrak Etanol Daun Iler (Coleus atropurpureus L. Benth)
Terhadap Infeksi Salmonella eteritidis pada Mencit (Musmusculus) (Ariyani, Fazrina dan Darmono, 2007)
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan pengetahuan tentang khasiat daun iler yang memiliki efek analgesik yang bermanfaat dalam pengembangan obat-obat penghilang rasa nyeri.
b. Manfaat praktis
Penelitian ini diharapkan dapat member informasi kepada berbagi pihak tentang efek analgesik dari infusa daun iler, persen proteksi geliat infusa daun iler dan dosis efektif 50% (ED50) dari infusa daun iler.
B. Tujuan Penelitian 1. Tujuan umum
Memberi informasi tentang adanya efek analgesik pada infusa daun iler 2. Tujuan khusus
a. Untuk mengetahui mengetahui seberapa besar efek analgesic dari infusa daun iler dengan menggunakan metode rangsang kimia.
b. Untuk mengetahui seberapa besar persen proteksi geliat dari infusa daun iler pada mencit betina.
6
BAB II
PENELAAHAN PUSTAKA
A. Nyeri 1. Pengertian nyeri
Nyeri adalah sensasi subyektif rasa tidak nyaman yang biasanya berkaitan dengan kerusakan jaringan aktual atau potensial. Nyeri dapat bersifat proktektif, yaitu menyebabkan individu menjauh dari stimulus yang berbahaya (Corwin, 2007). Nyeri bersifat individu dan ambang nyeri pada setiap orang berbeda-beda (Roach, 2004).
Nyeri adalah gejala penyakit yang paling sering terjadi. Walaupun nyeri sering berfungsi untuk mengingatkan dan melindungi dan sering memudahkan diagnosis, pasien merasakannya sebagai hal yang tak mengenakkan, kebanyakan menyiksa dan karena itu berusaha untuk bebas darinya (Mutschler, 1991).
2. Mekanisme nyeri
Menurut DiPiro et al., (2008) proses penghantaran nyeri terdiri atas empat tahap, yaitu stimulasi, transmisi, persepsi nyeri, dan modulasi.
a. Stimulasi
sepanjang serabut saraf afren menuju sumsum tulang belakang (DiPiro et al., 2008)
a. Transmisi
Transmisi rangsang nyeri terjadi di serabut afren Aδ dan C. Serabut saraf afren tersebut merangsang serabut nyeri di berbagai lamina spinal cord’s dorsal
horn melepaskan berbagai neurotransmitter termasuk glutamate, substansi P, dan kalsitonin (DiPiro et al., 2008)
b. Presepsi nyeri
Presepsi nyeri adalah titik utama transmisi impuls nyeri. Otak akan mengartikansinyal nyeri dengan batas tertentu, sedangkan fungsi kognitif dan tingkah laku akan memodifikasi nyeri sehingga tidak menjadi lebih parah (DiPiro
et al., 2008) c. Modulasi
Modulasi nyeri melalui sejumlah proses yang kompleks. Diketahui bahwa sistem opiate endogen terdiri dari berbagai neurotransmitter (seperti µ, δ, dan k)
yang ditemukan dalam system saraf pusat (DiPiro et al., 2008) 3. Jenis nyeri
DiPiro., (2008) menggolongkan nyeri menjadi dua bagian, yaitu : a. Nyeri akut
a. Nyeri kronik
Pada kondisi normal, nyeri akut dapat menghilang dengan cepat karena adanya proses penyembuhan dengan mengurangi produksi rangsangan nyeri. Namun, dalam beberapa kasus, nyeri tetap terjadi selama berbulan-bulan sampai bertahun-tahun, yang mengarah ke keasaan nyeri kronis dengan karakteristik berbeda dengan nyeri akut.
B. Analgetika
Analgetika adalah obat atau senyawa yang dipergunakan untuk mengurangi rasa sakit atau nyeri tanpa menghilangkan kesadaran. Kesadaran akan perasaan sakitterdiri dari dua proses, yakni penerimaan rangsangan sakit di bagian otak besar danreaksi-reaksi emosional dan individu terhadap perangsang ini (Anief, 2000)
Menurut Roach (2004), obat yang digunakan dalam mengatasi nyeri terdiri dari dua kelompok yaitu analgetik non-narkotik dan analgetik narkotik.
1. Analgetik non-narkotik
Obat-obat ini meringankan rasa nyeri tanpa menurunkan kesadaran dan tidak menyebabkan ketergantungan seperti penggunaan analgetik narkotik.Analgetik narkotik terdiri dari senyawa golongan salisilat, non-salisilat (seperti asetaminofen) dan obat antiinflamasi non steroid. Obat ini digunakan untuk mengatasi nyeri ringan hingga sedang (Roach, 2004).
seperti siklooksigenase, sehingga mencegah sensitasi reseptor rasa sakit oleh mediator-mediator rasa sakit, seperti bradikinin, histamin, serotonin, prostasiklin, prostaglandin, ion-ion kalium dan hidrogen, yang dapat merangsang rasa sakit secara mekanik atau kimiawi (Siswandono dan Soekarjdo, 2000). Mekanisme ini dapat dilihat pada gambar 1.
Trauma/luka pada sel
Gangguan pada membran sel
Fofolipid dihambat kortikosteroid
Asam arakhidonat
Dihambat obat AINS Hidroperoksid Endoperoksid
PGG2/PGH
Leukotrien PGE2, PGF2, PGD2 Prostasiklin
Tromboksan A2 (Gambar 1) Biosintesis Prostaglandin (Wilmana, 1995)
Setiap obat menghambat siklo-oksigenase dengan cara yang berbeda. (Wilmana, 1995).
Enzim Fosfolipase
2. Analgetik narkotik
Analgetik narkotik disebut juga opioid, yaitu zat yang bekerja pada reseptor opioid khas di sistem saraf pusat, hingga persepsi nyeri dan respon emosional terhadap nyeri berkurang (Tjay dan Rahardja, 2002).
Tjay dan Rahardja (2002), mengatakan bahwa rasa nyeri dapat dilawan dengan (1) merintangi pembentukan rangsangan dalam reseptor-reseptor nyeri perifer oleh analgetik perifer atau anastetika lokal, (2) merintangi penyaluran rangsangan nyeri dalam saraf-saraf sensoris, misalnya dengan anastetika lokal, (3) blokade dari pusat nyeri dalam sistem saraf sentral dengan analgetik sentral (narkotika) atau dengan anastetika umum.
C. Asetosal
(Gambar 2.) Struktur kimia asetosal (Helmenstine, 2010)
Asetosal stabil pada penyimpanan pH rendah (2-3) dan pada suhu 2-15°C (Dinkes, 2010).
Asetosal bekerja dengan cara menghambat sintesis prostaglandin pada jalur sikloosigenase. Prostaglandin sendiri adalah suatu senyawa dalam tubuh yang merupakan mediator nyeri dan radang/inflamasi.Ia terbentuk dari asam arakidonat pada sel-sel tubuh dengan bantuan enzim cyclooxygenase
(COX).Dengan penghambatan pada enzim COX, maka prostaglandin tidak terbentuk, dan nyeri atau radang pun reda (Tjay dan Rahardja, 2002).
D. Iler (Coleus atropurpureus L. Benth)
1. Keterangan botani
Tanaman iler berdasarkan taksonomi termasuk dalam, Kingdom: Plantae (Tumbuhan)
Subkingdom: Tracheobionta (Tumbuhan berpembuluh) Super Divisi: Spermatophyta (Menghasilkan biji) Divisi: Magnoliophyta (Tumbuhan berbunga) Kelas: Magnoliopsida (berkeping dua / dikoti Sub Kelas: Asteridae
Ordo: Lamiales Famili: Lamiaceae Genus: Coleus
Spesies: Coleus atropurpureus L. Benth
Tumbuhan ini dikenal masyarakat Indonesia dengan nama daerah yaitu: si gresing (Batak), adang-adang (Palembang), plado (Sumba), jawer kotok (Sunda), kentangan (Jawa), ati-ati, saru-saru (Bugis), majana (Madura) (Dalimartha, 2008). 2. Morfologi tanaman
berambut, percabangan banyak, berwarna ungu kemerahan. Permukaan daun agak mengkilap dan berambut halus panjang dengan panjang 7-11 cm, lebar 3-6 cm berwarna ungu kecoklatan sampai ungu kehitaman.Bunga berbentuk untaian bunga bersusun, muncul pada pucuk tangkai batang berwarna putih, merah dan ungu.
Tumbuhan iler memiliki aroma bau yang khas dan rasa yang agak pahit, sifatnya dingin. Jika seluruh bagian diremas akan mengeluarkan bau yang harum. Untuk memperbanyak tanaman ini dilakukan dengan cara setek batang dan biji (Yuniarti, 2008).
3. Ekologi
Tumbuhan iler tumbuh subur di daerah dataran rendah sampai ketinggian 1500 meter diatas permukaan laut dan merupakan tanaman semusim termasuk kategori tumbuhan basah yang batangnya mudah patah.Umumnya tumbuhan ini ditemukan di tempat lembab dan terbuka seperti pematang sawah, tepi jalan pedesaan di kebun-kebun sebagai tanaman liar atau tanaman obat (Yuniarti, 2008).
4. Kandungan kimia
Tumbuhan iler memiliki sifat kimiawi harum, berasa agak pahit, dingin,
memiliki kandungan kimia sebagai berikut : daun dan batang mengandung minyak
atsiri, fenol, tannin, lemak, phytosterol, kalsium oksalat, dan peptik. Komposisi
kandungan kimia yang bermanfaat antara lain juga alkaloid, etil salisilat, metal
eugenol, timol karvakrol, mineral (Dalimartha, 2008).
Dari uji pendahuluan yang dilakukan oleh Saragih (2011) menunjukkan bahwa ekstrak metanol daun tumbuhan iler mengandung senyawa flavonoida. 5. Khasiat dan kegunaan
Tumbuhan iler diduga mempunyai aktifitas antibakteri, sebagai obat hepatitis dan menurunkan demam, batuk dan influenza. Selain itu daun tumbuhan iler ini juga berkhasiat untuk penetralisir racun (antitoksik), menghambat pertumbuhan bakteri (antiseptik), mempercepat pematangan bisul, pembunuh cacing (vermisida), wasir, peluruh haid (emenagog), membuyarkan gumpalan darah, gangguan pencernaan makanan (despepsi), radang paru, gigitan ular berbisa dan serangga (Dalimartha, 2008).
E. Infusa
Infusa adalah hasil proses penyarian yang umumnya digunakan untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Penyarian dengan cara ini menghasilkan sari yang tidak stabil dan mudah tercemar oleh kuman dan kapang. Oleh sebab itu sari yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24 jam (Departemen Kesehatan RI, 1986).
15 menit terhitung mulai suhu mencapai 90o sambil sekali-sekali diaduk.Serkai selagi panas melalui kain flannel, ditambahkan air panas secukupnya melalui ampas hingga diperoleh volume infusa yang dikehendaki (Departemen Kesehatan RI, 1995).
F. Metode Uji Daya Anlgesik
Metode-metode pengujian aktivitas analgesik dilakukan dengan menilai kemampuan zat uji untuk menekan atau menghilangkan rasa nyeri yang diinduksi pada hewan percobaan. Secara umum, daya analgesik pada hewan dinilai dengan menggunakan besarnya peningkatan stimulus nyeri yang harus diberikan sampai ada respon nyeri atau juga persamaan frekuensi respon nyeri (Yayasan Pengembangan Obat Bahan Alam Phyto Medika, 1991).
Penggolongan metode pengujian daya analgesik berdasarkan jenis analgesiknya menurut Turner (1965) adalah:
1. Golongan analgesik narkotika
b. Metode pengukuran tekanan. Alat yang digunakan adalah sebuah alat untuk mengukur tekanan yang diberikan pada tikus secara seragam. Alat tersebut terdiri dari 2 syringe yang dihubungkan ujung dengan ujungnya yang rata-rata bersifat elasatis, fleksibel, dan terdapat pipa plastik yang diisi sebuah cairan. Sisi pipa dihubungkan dengan manometer. Manometer akan membaca ketika tikus memberikan respon. Respon tikus yang pertama adalah meronta-ronta kemudian akan mengeluarkan suara (mencicit) kesakitan.
c. Metode rangsang panas. Alat yang digunakan adalah lempeng panas (hot plate) yang terdiri dari silinder untuk mengendalikan. Hot plate bersuhu sekitar 500 -550C, dilengkapi dengan penangas yang berisi campuran sebanding antara aseton dengan etil format yang mendidih. Tikus yang sudah diberi larutan secara subkutan atau peroral, diletakkan pada hot plate yang sudah disiapkan. Reaksi tikus adalah menjilat-jilat kakinya lalu akan melompat dari silinder. Hewan uji yang dibutuhkan tiap kelompok berjumlah 5 ekor.
d. Metode potensi petidin. Metode ini kurang baik karena dibutuhkan hewan uji dalam jumlah besar untuk melakukan uji ini. Tiap kelompok tikus terdiri dari 20 ekor, setengah dari kelompok dibagi menjadi 3 bagian diberi petidin dengan dosis berturut-turut 2, 4, dan 8 mg/kg. Setengah kelompok yang lain diberi petidin dengan senyawa uji dengan dosis 25% dari LD50. Persen analgetik dihitung dengan bantuan metode rangsang panas.
toksik kemudian segera diikuti pemberian nalorfin (0,5-10,0 mg/kgBB) secara intravena. Sebuah obat yaitu pirinitramid dapat menyebabkan respon seperti hilangnya refleks yang benar pada refleks corneal dan refleks bradipnea. Efek tersebut dapat dilawan dengan pemberian nolorfin 1,25 mg/kg BB yang disuntikkan secara intravena. Teori menyebutkan bahwa nalorfin dapat menggantikan ikatan morfin dengan reseptornya. Peristiwa tersebut menyebabkan ikatan antara morfin dengan reseptornya terlepas, sehingga meniadakan efek morfin.
f. Metode kejang okstitosin. Oksitoksin adalah hormon yang dihasilkan oleh kelenjar pituitary posterior, dapat menyebabkan kontraksi uterin sehingga menimbulkan kejang pada tikus. Respon kejang meliputi kontraksi abdominal, sehingga menarik pinggang dan kaki ke belakang. Penurunan kejang diamati, dan ED50 dapat diperkirakan. Selain morfin senyawa analgesik yang bisa diuji dengan metode ini adalah heroin, metadon, kodein, dan meperidina.
g. Metode pencelupan pada air panas.Tikus disuntik secara intraperitonial dengan senyawa uji, kemudian ekor tikus dicelupkan dalam air panas (suhu 580C). Respon tikus dilihat dari hentakan ekornya yang menghindari air panas. Munculnya reaksi yang khas yaitu sentakan ekor yang keras, dicatat waktunya. Uji ini diulang kembali setiap 30 menit setelah 15 menit penyuntikan. Jika mencit tetap tidak bereaksi dalam waktu 6 detik, mencit diangkat dari penangas.
2. Golongan analgesik non-narkotika
intraperitonial pada hewan uji. Beberapa zat yang sering dipergunakan untuk menimbulkan rasa nyeri dipakai dalam metode ini yaitu asam asetat dan fenil kuionon. Metode ini cukup peka untuk pengujian senyawa-senyawa analgesik yang mempunyai daya analgesik lemah. Metode ini telah sering digunakan oleh banyak peneliti dan bisa direkomendasikan sebagai metode penapisan sederhana (Vogel, 2002). Pemberian analgesik akan mengurangi rasa nyeri atau menghilangkan rasa nyeri sehingga jumlah geliat yang terjadi berkurang sampai tidak terjadi geliat sama sekali. Ini tergantung pada daya analgesik senyawa yang digunakan. Efek analgesik dapat dievaluasi menggunakan persen proteksi geliat.
% Proteksi = 100 – (P/K x 100%) Keterangan :
p : jumlah geliat kumulatif kelompok percobaan tiap individu k : jumlah geliat kumulatif kontrol rata-rata
Perubahan persen proteksi geliat terhadap kontrol positif menggunakan rumus :
Perubahan % proteksi geliat =
X 100%
P = % proteksi geliat pada tiap kelompok perlakuan KP = rata-rata % proteksi geliat pada kontrol positif
b. Metode pedodolorimeter. Metode ini menggunakan aliran listrik untuk mengukur besarnya daya analgesik. Alas kandang tikus terbuat dari kepingan metal yang bisa mengalirkan listrik. Tikus diletakkan pada kandang tersebut kemudian dialiri aliran listrik. Respon ditandai dengan teriakan dari tikus tersebut. Pengukuran ini dilakukan setiap 10 menit selama 1 jam.
c. Metode rektodolorimeter. Tikus diletakkan dalam sebuah kandang yang dibuat khusus dengan alas tembaga yang dihubungkan dengan sebuah penginduksi yang berupa gulungan. Ujing lain dari gulungan tersebut kemudian dihubungkan dengan silinder elektroda tembaga. Sebuah voltmeter yang sensitif untuk mengubah 0,1 volt dihubungkan dengan kondukutor yang berada di gulungan di atas. Tegangan yang sering digunakan untuk menimbulkan teriakan mencit adalah 1 sampai 2 volt.
G. Landasan Teori
Nyeri merupakan sensasi yang tidak menyenangkan, dan berkaitan dengan kerusakan jaringan yang diakibatkan oleh berabagi macam faktor (Tjay, 2007). Rasa nyeri akan timbul bersamaan dengan reaksi peradangan, karena mediator yang memperantarai peradangan (prostaglandin, leukotrien, dll) akan mengaktivasi reseptor nyeri, sehingga rangsangan (mekanis, kimia atau fisis) yang diterima reseptor nyeri akan disalurkan ke pusat nyeri di otak besar, impuls itu kemudian dirasakan sebagai nyeri (Rahardja, 2002).
berbagai macam penyakit salah satunya untuk meredakan nyeri pada saat diare atau meredakan nyeri pada saat datang bulan. Daun iler mengandung beragam senyawa flavonoid (Saragih, 2011). Flavonoid adalah senyawa yang memiliki sifat antioksidan yang efektif sebagai penangkap radikal bebas. Dengan adanya sifat antioksidan, maka radikal bebas akan ditangkap sehingga proses pembentukan asam arakidonat melalui jalur siklooksigenase akan terhambat dan menyebabkan mediator nyeri dan peradangan tidak terbentuk (Tjay dan Raharja (2007). Dengan adanya senyawa flavonoid memungkinkan tanaman iler mempunyai efek analgesik.
H. Hipotesis
21 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni karena dilakukan dengan adanya perlakuan dan tanpa ada penelitian sebelumnya dengan rancangan acak pola searah. Rancangan acak pola searah digunakan karena faktor yang diuji dalam penelitian ini hanya ada satu, yaitu pengaruh dosis pemberian infusa daun iler (Coleus atropurpureus L. Benth) terhadap jumlah proteksi geliat.
B. VariabelPenelitian 1. Variabel utama
a. Variabel bebas: dosis pemberian infusa daun iler
b. Variabel tergantung: jumlah geliat yang dihitung sebagai jumlah % proteksi
2. Variabel pengacau
a. Variabel terkendali : hewan uji adalah mencit galur Swiss, jenis kelamin hewan uji yaitu mencit betina, umur hewan uji yaitu 2-3 bulan, berat badan hewan mencit 20-30 gram, status puasa (mencit dipuasakan selama 24 jam sebelum perlakuan).
C. Definisi Operasional
1. Dosis daun iler merupakan sejumlah daun yang diambil dari tanaman iler, yang berwarna merah, tidak berlubang dan segar.
2. Infusa daun iler adalah sejumlah (gram) bahan yang dipanaskan dengan air dalam panci selama 15 menit terhitung mulai suhu mencapai 90oC sambil sekali-sekali diaduk. Kemudian diserkai selagi panas, tambahkan air panas secukupnya melalui ampas hingga diperoleh volume infus yang dikehendaki (Depkes RI, 1995).
3. Geliat adalah bila mencit menarik kedua kaki belakang ke belakang dengan mengempiskan perutnya sehingga permukaan perut menempel pada alas tempat berpijak mencit tersebut.
4. Persen proteksi geliat terhadap rangsang kimia adalah seratus dikurangi jumlah kumulatif geliat kelompok perlakuan dibagi rata-rata jumlah kumulatif geliat kelompok kontrol dikali 100 persen.
5. Jumlah ∑ geliat adalah banyaknya geliat yang terjadi akibat pemberian rangsang kimia (asam asetat 1 %) selama 1 jam.
analgesik ditunjukkan dengan penurunan jumlah geliat sebesar 50% dari kontrol negatif. Semakin sedikit geliat semakin besar efek analgesiknya.
D. Subjek dan Bahan Penelitian 1. Subjek penelitian
Subjek uji yang digunakan adalah mencit betina galur swiss, dengan berat badan 20-30 g yang diperoleh dari Laboratorium Imono, Fakultas Farmasi, Universitas Sanata Dharma (untuk kelompok kontrol negatif, kontrol positif, infusa daun iler dosis 163,7; 327,5; 655; 1310; 2620 mg/kgBB)
2. Bahan penelitian
a. Daun iler berwarna merah diperoleh dari kebun obat, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang dipanen pada bulan Maret 2013.
b. Asetosal (Merck) sebagai control positif diperoleh dari Laboratorium Farmakologi-Toksikologi Universitas Sanata Dharma.
c. Asam asetat sebagai perangsang nyeri buatan berupa cairan jernih, tidak berwarna, berbau khas, menusuk dan berasa asam (Depkes RI, 1995), diperoleh dari Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi, Universitas Sanata Dharma.
Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi, Universitas Sanata Dharma.
e. Aquades sebagai pelarut dan kontrol negatif diperoleh dari Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi, Universitas Sanata Dharma.
E. Alat atau Instrumen Penelitian 1. Alat infusa (panci infusa)
2. Neraca analitik (merk Mettler-Toledo) 3. Kotak kaca tempat pengamatan geliat 4. Stopwatch (merk Casio)
5. Syringe dan spuit injeksi dan oral
6. Alat-alat gelas berupa labu ukur, beaker glass, pengaduk, Erlemeyer, gelas ukur, pipet tetes
7. Kamera handphone (merk Sony Ericsson Xperia Arc S) 8. Termometer (merk Pirex)
F. Tata Cara Penelitian
1. Determinasi tanaman
Determinasi tanaman Coleus Atropurpureus L. Benth menggunakan
daun secara benar sesuai dengan buku acuan “Flora untuk Sekolah di
Indonesia”. Determinasi tanaman dilakukan di Laboratorium Farmakognosi
2. Pengumpulan bahan
Daun iler diperoleh dari kebun obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang dipanen pada bulan Maret 2013. Daun yang diambil adalah daun segar berwarna merah dan tidak berlubang.
3. Penetapan dosis daun iler
Dosis diambil berdasarkan penggunaan yang dipakai oleh masyarakat pada umumnya, yaitu 5 g, dengan konsentrasi 5,038 g/100 ml. Kemudian dikonversi ke mencit dengan berat 20 g. Sehingga didapatkan:
D = 0,0026 x 5038 mg (untuk manusia 70 kg) D = 13,1 mg/20 g
D = 0,655 mg
D = 655 mg/kgBB (sebagai dosis peringkat II)
Dosis peringkat II (327,5mg/kgBB) didapatkan dengan menurunkan ½ dari dosis peringkat III (655 mg/kgBB). Untuk peringkat dosis I (163,75 mg/kgBB) didapatkan dengan menurunkan ½ dari dosis peringkat II (327,5 mg/kgBB), sedangkan dosis IV (1310 mg/kgBB) didapatkan dengan menaikkan ½ dari dosis peringakat III (655)dan untuk peringkat dosis V (2620) didapatkan dengan menaikkan ½ dari dosis peringakat IV (1310 mg/kgBB).
4. Pembuatan infusa daun iler
pada campuran mencapai suhu 90oC. Selanjutnya, campuran diserkai selagi panas.
5. Pembuatan sediaan
a. Larutan asam asetat 1% sebanyak 25,0 ml
Larutan asam asetat dibuat dengan cara pengenceran dari larutan asam asetat glasial 100% v/v dengan volume pengambilan dihitung dengan menggunakan rumus:
Volume1 x konsentrasi1 = volume2 x konsentrasi2
Sebanyak 0,25 ml asam asetat glasial kemudian ditambah aquades hingga 25,0 mlmenggunakan labuukur 25 ml.
b. Larutan CMC Na 1 %
Larutan CMC Na 1 % dibuat dengan cara melarutkan serbuk CMC Na sebanyak 1,0 g kemudian ditaburkan di atas permukaan air panas sedikit demi sedikit sambil diaduk sehingga mengembang. Larutan yang terbentuk diaduk kemudian dimasukkan kedalam labu ukur 100 ml dan tambahkan aquades hingga tanda batas 100 ml kemudian digojog.
c. Suspensi asetosal 1% 25 ml dalam CMC Na 25 ml
Suspensi asetosal 1% dibuat dengan mensuspensikan 250,0 mg asetosal dengan CMC Na 1% dalam labu ukur 25 ml.
6. Penentuan dosis asam asetat
kelompok mencit dengan dosis berbeda, yaitu 25,50 dan 75 mg/KgBB. Dari ketiga dosis tersebut dicari dosis optimum yang dapat menimbulkan respon nyeri berupa geliat yang dapat diamati sehingga memudahkan pengamatan. 7. Penentuan waktu pemberian rangsang
Selang waktu pemberian asam asetat ditentukan untuk mengetahui waktu dimana senyawa uji telah terabsorbsi dengan optimal sehingga dapat segera menimbulkan efek. Andini (2010) telah melakukan penelitian mengenai penentuan selang waktu dengan menggunakan asetosal 91 mg/KgBB dengan variansi selang waktu adalah 5, 10 dan 15 menit. Dari ketiga selang waktu tersebut dicari selang waktu optimum yang dapat menimbulkan respon nyeri berupa geliat yang dapat diamati sehingga memudahkan pengamatan.
8. Penetapan dosis asetosal
Kontrol positif yang digunakan adalah asetosal sehingga asetosal harus memberikan respon pengurangan geliat. Dosis asetosal yang digunakan dalam penelitian ini adalah dosis lazim, yaitu 0,5 g atau 500 mg yang kemudian dikonversikan pada mencit sehingga dosisnya dapat dihitung sebagai berikut.
diperoleh dosis 91 mg/KgBB. Menurut penelitian terdahulu Handara (2006); Riadiani (2006) danTusthi (2007) penetapan dosis asetosal 91 mg/KgBB. 9. Perlakuan hewan uji
10. Penetapan kriteria geliat
Respon geliat yang terjadi pada pengujian daya analgesik menggunakan rangsang kimia sangat bervariasi. Oleh karena itu, perlu ditetapkan geliat yang kurang lebih sama sehingga pengamatan tidak mengacaukan hasil penelitian. Geliat yang diamati dan dihitung adalah geliat dengan kriteria mencit menarik kedua kaki belakang kearah belakang dan perutnya menempel ke alas pengamatan sehingga tubuh mencit terlihat memanjang.
11. Penentuan % proteksi geliat
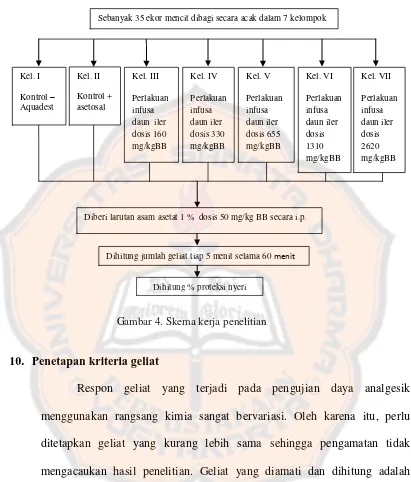
Metode penentuan % proteksi geliat yang digunakan dalam penelitian ini adalah metode rangsang kimia. Besarnya penghambatan jumlah Kel. I Sebanyak 35 ekor mencit dibagi secara acak dalam 7 kelompok
Diberi larutan asam asetat 1 % dosis 50 mg/kg BB secara i.p.
Dihitung jumlah geliat tiap 5 menit selama 60 menit
Dihitung % proteksi nyeri
geliat dihitung dengan menggunakan persamaan Handershot and Forshait
yang telah dimodifikasi, yaitu:
% proteksi geliat = (100-(P/K x 100))% Keterangan:
P = Jumlah kumulatif geliat hewan uji perlakuan
K = Jumlah rata-rata kumulatif geliat hewan uji kontrol negatif Perubahan persen proteksi geliat terhadap kontrol positif menggunakan rumus:
Perubahan % proteksi geliat =
x 100 %
Keterangan:
P = % proteksi geliat pada tiap kelompok perlakuan KP = rata-rata % proteksi geliat pada kontrol positif
12. Perhitungan daya analgetik
Perhitungan daya analgetik dilakukan dengan membandingkan % proteksi geliat dari kelompok perlakuan terhadap kontrol positif (asetosal dosis 91 mg/kgBB).
Daya analgesik =
x 100 %
Keterangan:
P = % proteksi geliat pada tiap kelompok perlakuan KP = rata-rata % proteksi geliat pada kontrol positif
(Putra, 2003).
13. Penentuan dosis efektif 50% (ED50)
Penentuan dosis efektif 50% dilakukan dengan cara memplotkan log dosis dan persen proteksi geliat. Hasil yang didapatkan selanjutnya dimasukkan di dalam persamaan regresi linear dengan menggunakan rumus:
G. Analisis Data
Data jumlah geliat yang diperoleh dikumulatifkan. Kemudian dihitung persen proteksi geliat dari jumlah kumulatif dan kemudian dianalisis dengan
Saphiro Wilk Test untuk melihat distribusi data. Analisis kemudian dilanjutkan dengan analisis Kruskal Wallis Test dengan taraf kepercayaan 95%. Jika hasil yang diperoleh distribusinya tidak normal maka analisis dilanjutkan dengan uji
32
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Bahan yang digunakan dalam penelitian ini adalah daun iler (Coleus atropurpureus L. Benth). Sebelum daun iler ini digunakan dalam pengujian efek analgesik maka diperlukan determinasi tanaman untuk memastikan bahwa tanaman yang digunakan adalah benar-benar tanaman Coleus atropurpureus L.
Benth Bagian tanaman yang digunakan dalam determinasi adalah bagian batang, daun, dan bunga.
Determinasi dilakukan hingga kategori jenis (species) untuk membuktikan bahwa batang, daun, bunga dan biji yang dideterminasi adalah benar Coleus atropurpureus L. Benth.
Berdasarkan hasil determinasi tersebut maka terbukti bahwa tanaman yang diuji ini benar merupakan tanaman iler (Coleus atropurpureus L. Benth) (Lampiran 1).
B. Uji Pendahuluan
Uji pendahuluan merupakan serangkaian uji-uji yang dilakukan sebagai orientasi untuk mempersiapkan hal-hal yang diperlukan dalam pengambilan data penelitian.
.
Hal-hal yang dilakukan dalam uji pendahuluan ini adalah penetapan kriteria geliat hewan uji, penetapan dosis asam asetat dan penetapan selang waktu pemberian rangsang. Kriteria hewan uji yang digunakan dalam uji pendahuluan sama dengan yang digunakan dalam pengambilan data penelitian yaitu mencit betina galur Swiss, umur 2-3 bulan dengan berat badan 20-30 g. Sebelum melakukan pengujian, mencit dipuasakan selama 24 jam.
1. Penentuan kriteria geliat
Penentuan kriteria geliat yang digunakan perlu dilakukan agar pada pengambilan data diperoleh geliat yang relatif sama sehingga pengamatan lebih mudah dan data yang didapatkan lebih spesifik. Pedoman gerakan mencit yang dapat dianggap sebagai geliat adalah apabila mencit menarik kedua kakinya ke belakang dengan mengempiskan perutnya sehingga permukaan perut menempel pada alas tempat berpijak mencit tersebut. Rangsang kimia yang digunakan sebagai penginduksi nyeri agar dapat menimbulkan respon geliat pada mencit yaitu pemberian asam asetat 1%. 2. Penentuan dosis asam asetat
Dalam metode ini, senyawa penginduksi nyeri yang diinjeksikan adalah asam asetat secara intraperitoneal pada mencit putih betina. Dosis asam asetat yang digunakan berdasarkan dari hasil penelitian Sidebang (2011), yang dimana disimpulkan bahwa dosis asam asetat 50 mg/kgBB adalah dosis optimal yang dapat menimbulkan nyeri.
.
geliat yang tidak terlalu sedikit dan tidak terlalu banyak karena dapat menyulitkan pengamatan.
3. Penetapan selang waktu pemberian rangsang
Selang waktu pemberian rangsang merupakanjarak waktu antara pemberian zat uji secara per oral dengan saat pemberian injeksi rangsang nyeri (asam asetat) secara intraperitonial. Penetapan selang waktu pemberian rangsang bertujuan untuk mengetahui waktu dimana zat uji (asetosal sebagai kontrol positif dan dauniler sebagai senyawa uji) terabsorbsi secara tepat sehingga dapat memberikan efek yang optimal.
Dari hasil penelitian Andini (2010) dalam uji pendahuluannya selang waktu yang efektif setelah pemberian asetosal 91 mg/kgBB adalah 15 menit sebelum pemberian asam asetat 1% 50 mg/kgBB.
Dari hasil penelitian Sidebang (2011) mengenai penetapan selang waktu pemberian asam asetat dapat dilihat bahwa selang waktu yang optimum untuk memberi kesempatan zat uji yang diberikan secara peroral untuk terabsorbsi sebelum asam asetat disuntikkan secara intraperitoneal adalah 15 menit hal ini dilihat dari hasil rata-rata jumlah geliat yang timbulkan (Sidebang, 2011)
.
C. Efek Analgesik pada infusa Daun Iler
Setelah dilakukan tahap uji pendahuluan, selanjutnya dilanjutkan aktivitas analgesik untuk masing-masing kelompok.
Penelitian ini bertujuan untuk mengetahui efek analgesik infusa daun iler pada mencit betina.
Uji analgesik dilakukan untuk melihat kemampuan bahan uji dalam menghambat rasa nyeri yang pada penelitian ini disebabkan oleh pemberian asam asetat. Parameter yang digunakan adalah geliat mencit. Geliat mencit diamati selama satu jam untuk menghitung persen proteksi.
Perubahan persen proteksi diperoleh dari persen proteksi tiap kelompok perlakuan yang dibandingkan dengan asetosal sebagai kontrol positif, sehingga melalui perubahan persen proteksi dapat diketahui daya analgesik dari infusa daun ilerpad mencit betina. Asetosal digunakan sebagai kontrol positif karena merupakan obat yang sudah terbukti kasiatnya.
Data-data yang diperoleh dari masing-masing kelompok perlakuan dianalisis secara statistik dan dihitung jumlah kumulatif geliatnya yang kemudian digunakan untuk menghitung persen proteksi dan perubahan persen proteksi. Persen proteksi senyawa uji terhadap nyeri dibandingkan dengan kontrol negatif (aquades), sedangkan perubahan persen proteksi senyawa uji terhadap nyeri dibandingkan dengan kontrol positif (asetosal 91 mg/kgBB).
.
dalam bentuk Mean ± Standard Error yang dapat dilihat pada table II di bawah ini.
Tabel II. Hasil jumlah kumulatif geliat mencit, % proteksi beserta perubahan % daya analgesik pada semua kelompok perlakuan.
Kelompok uji
KND 0,5 ml/20g = Kontrol negatif (Aquadest)
KDP 91 mg/KgBB = Kontrol positif (Asetosal) 91 mg/kgBB IDI 163,75 mg/KgBB = Infusa daun iler dosis 163,75 mg/KgBB IDI 327,5 mg/KgBB = Infusa daun iler dosis 327,5 mg/KgBB IDI 655 mg/KgBB = Infusa daun iler dosis 655 mg/KgBB IDI 1310 mg/KgBB = Infusa daun iler dosis 1310 mg/KgBB IDI 2620 mg/KgBB = Infusa daun iler dosis 2620 mg/KgBB
Dari tabel diatas dapat dilihat semakin kecil jumlah rata-rata geliat mencit maka semakin besar proteksi geliat atau daya analgesiknya. Pada kelompok kontrol negatif dapat dilihat jumlah rata-rata geliat paling besar yaitu 27 ± 1,7.
.
memiliki nilai rata-rata jumlah geliat yang kecil yaitu 2,2 ± 0,4. Hal ini menunjukkan bahwa kontrol positif yaitu asetosal memiliki daya analgesik.
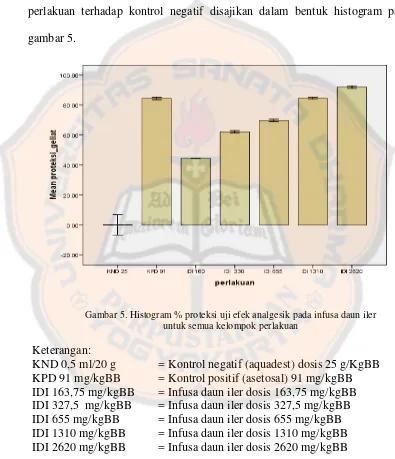
Dari data di atas, hasil persen proteksi nyeri semua kelompok perlakuan terhadap kontrol negatif disajikan dalam bentuk histogram pada gambar 5.
Gambar 5. Histogram % proteksi uji efek analgesik pada infusa daun iler untuk semua kelompok perlakuan
Keterangan:
.
Dari histogram dapat dilihat bahwa aquadest sebagai kontrol negatif memiliki persen (%) proteksi geliat yang paling sedikit dibandingkan asetosal dan infusa daun iler.
Hal ini menunjukkan bahwa aquadest tidak memiliki daya analgesik. Dapat dilihat juga asetosal 91 mg/kg BB sebagai kontrol positif memiliki persen (%) proteksi geliat yang cukup tinggi, ini menunjukkan bahwa asetosal memang memiliki daya sebagai analgesik. Kelima kelompok pemberian dosis infusa daun iler juga menunjukkan persen (%) proteksi geliat yang cukup baik, ada yang sebanding dengan asetosal bahkan lebih tinggi dari asetosal.
Data yang diperoleh berupa % proteksi dari masing-masing kelompok diuji dengan Saphiro Wilk Test untuk melihat distribusi hasil penelitian. Jika distribusi data hasil penelitian tidak normal, dapat dilanjutkan dengan analisis
Kruskal Wallis taraf kepercayaan 95%. Hasil pengolahan statistik menggunakan uji Saphiro Wilk pada distribusi data dari persen proteksi semua kelompok menunjukkan bahwa distribusi data tidak normal.
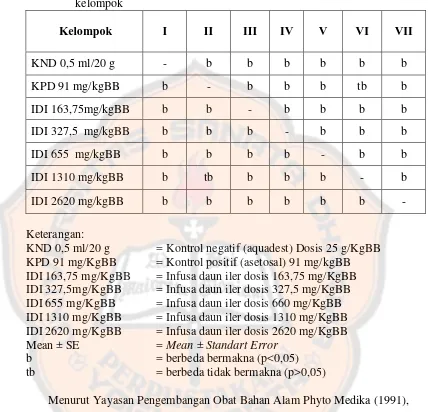
Dari hasil diketahui bahwa antara kelompok terdapat perbedaan yang bermakna (p≤0,05) (lampiran 6). Untuk mengetahui perbedaan persen proteksi
.
Tabel III. Hasil uji Mann whitney % proteksi pada uji efek analgesik seluruh kelompok KPD 91 mg/KgBB = Kontrol positif (asetosal) 91 mg/kgBB IDI 163,75 mg/KgBB = Infusa daun iler dosis 163,75 mg/KgBB IDI 327,5mg/KgBB = Infusa daun iler dosis 327,5 mg/KgBB IDI 655 mg/KgBB = Infusa daun iler dosis 660 mg/KgBB IDI 1310 mg/KgBB = Infusa daun iler dosis 1310 mg/KgBB IDI 2620 mg/KgBB = Infusa daun iler dosis 2620 mg/KgBB Mean ± SE = Mean ± Standart Error
b = berbeda bermakna (p<0,05)
tb = berbeda tidak bermakna (p>0,05)
Menurut Yayasan Pengembangan Obat Bahan Alam Phyto Medika (1991), adanya aktivitas analgesik pada metode rangsang kimia ditunjukkan adanya kemampuan menghambat geliat ≥50% dibandingkan kelompok kontrol negatif.
.
Hasil analisis pada kontrol positif (asetosal dosis 91mg/kg BB) menunjukkan bahwa kelompok perlakuan infusa daun iler dosis 163,75; 327,5; 655; 2620 mg/kg BB memiliki perbedaan yang bermakna. Secara statistik, hal ini menyatakan bahwa kelompok perlakuan infusa daun iler dosis 163,7; 327,5; 655 2620 mg/kgBB mempunyai kemampuan proteksi nyeri yang tidak sebanding dengan asetosal 91 mg/kgBB. Sedangkan terdapat perbedaan yang tidak bermakna pada kelompok perlakuan infusa daun iler dosis 1310 mg/kgBB terhadap kontrol positif (asetosal 91 mg/kgBB), ini menunjukkan bahwa kelompok perlakuan infusa daun iler dosis 1310 mg/kgBB mempunyai kemampuan proteksi nyeri yang sebanding dengan asetosal 91 mg/kgBB. Pada hasil analisis kontrol positif (asetosal 91 mg/kgBB) terhadap kelompok perlakuan infusa daun iler dengan dosis 2620 mg/kgBB IDI menunjukkan bahwa terdapat perbedaan yang bermakna dimana kelompok perlakuan infusa daun iler dosis 2620 mg/kgBB mempunyai kemampuan proteksi nyeri yang lebih tinggi dari asetosal 91 mg/kgBB, dengan rata-rata persen proteksi geliat pada perlakuan infusa daun iler dosis 2620 adalah sebesar 93,83 % sedangkan pada asetosal 91 mg/kgBB adalah 84,45%.
.
daun iler dosis 2620 mg/kgBB terjadi peningkatan persen proteksi sebesar 29,82% dibanding pemberian infusa Daun iler dosis 327,5mg/kgBB dan secara statistik peningkatan persen proteksi kelompok perlakuan yang diberi infusa Daun iler dosis 2620 mg/kgBB berbeda bermakna dengan kelompok perlakuan yang diberi infusa daun iler dosis 327,5mg/kgBB.
Dari penelitian ini dapat dikatakan bahwa persentase proteksi infusa daun iler bergantung dari banyaknya dosis yang diberikan, semakin besar dosis infusa daun iler yang diberikan maka semakin besar persen proteksinya.
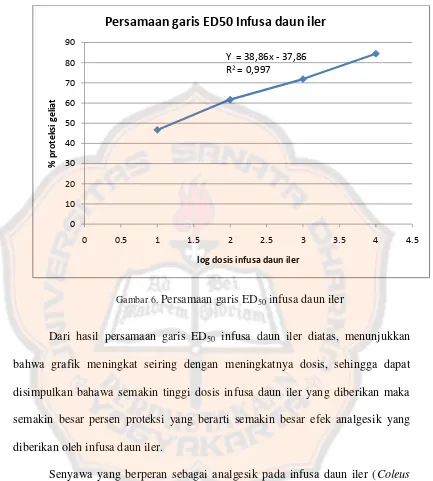
Pada penelitian didapatkan juga Effective Dose50 (ED50) yaitu suatu dosis yang dapat menyebabkan dimana 50% populasi menimbulkan efek analgesik yang dihitung secara ekstrapolasi. Nilai ED bertujuan untuk mengetahui keamanan Perhitungan ED50 diperoleh dengan cara memplotkan log dosis dan persen proteksi geliat. Log dosis yang didapatkan yaitu 2,21; 2,52; 2.82; 3.12 dan 3,42 mg/kgBB dan rata-rata persen proteksi, yaitu 46,67; 62,24; 69,74; 84,56 dan 93,83 Selanjutnya didapatkan persamaan regresi linear
Y = 38,86x – 37,86 5 = 38,86x – 37,86 X = 2,26
X = anti Log 2,26 ED50 = 181,97 mg/KgBB
.
Gambar 6. Persamaan garis ED50 infusa daun iler
Dari hasil persamaan garis ED50 infusa daun iler diatas, menunjukkan bahwa grafik meningkat seiring dengan meningkatnya dosis, sehingga dapat disimpulkan bahawa semakin tinggi dosis infusa daun iler yang diberikan maka semakin besar persen proteksi yang berarti semakin besar efek analgesik yang diberikan oleh infusa daun iler.
Senyawa yang berperan sebagai analgesik pada infusa daun iler (Coleus atropurpureus L. Benth) adalah flavonoid. Hasil penelitian Saragih (2011) mengatakan bahawa isolasi senyawa yang terdapat pada daun iler adalah flavonoid. Flavonoid adalah senyawa alam yang dapat berfungsi sebagai analgesik. Mekanisme flavonoid dalam menghambat proses terjadinya nyeri adalah dengan menghambat metabolisme asam arakidonat. Beberapa senyawa flavonoid dapat menghambat pelepasan asam arakhidonat dan sekresi enzim
0
Persamaan garis ED50 Infusa daun iler
Y = 38,86x - 37,86
.
lisosom dari membran dengan jalan memblok jalur siklooksigenase dan jalur lipoksigenase sehingga menurunkan kadar prostaglandin (mediator nyeri).
Dari hasil penelitian ini dapat dikatakan bahawa infusa daun iler memiliki aktivitas analgesik pada mencit. Dari kelompok IDI dosis I 163,75 mg/kgBB; IDI dosis II 327,5 mg/kgBB; IDI dosis III 655 kgBB; IDI dosis IV 1310 mg/kgBB; IDI dosis V 2620 mg/kgBB dapat memberikan efek analgesik. Kelompok perlakuan infusa daun iler dengan dosis 1310 mg/kgBB yang memiliki kemampuan sebanding dengan asetosal dosis 91mg/kgBB, sedangkan infusa daun iler dengan dosis 2620 mg/kgBB memiliki kemampuan analgesik yang lebih tinggi dari pada asetosal dosis 91 mg/kgBB.
Flavonoid adalah senyawa yang memiliki aktivitas sebagai antioksidan. Perannya sebagai antioksidan penangkal radikal bebas dapat menghambat oksidasi asam arakhidonat sehingga menghambat terbentuknya oksigen reaktif (radikal bebas) dan prostaglandin. Dalam penelitian ini, falvonoid diduga berperan dalam meningkatkan % proteksi pada mencit betina galur Swiss. Selain itu, peningkatan juga dapat terjadi akibat senyawa lain yang terdapat pada iler.
Diperlukan penelitian lanjut tentang uji toksisitas akut terhadap daun ilar. Tujuan uji toksisitas akut adalah menetapkan potensi toksisitas akut (LD50) dari daun iler, menetukan petunjuk tentang dosis yang sebaikanya digunakan sehingga aman digunakan dalam meningkatkan kesehatan masyarakat.
44 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Infusa daun iler memiliki efek analgesik (dosis 327,75; 655; 1310 dan 2620 mg/kgBB) terhadap mencit betina dengan metode rangsang kimia.
2. Kelompok perlakuan infusa daun iler dengan dosis 163,75; 327,5; 655; 1310 dan 2620 mg/kg BB memiliki besar persen proteksi berturut-turut adalah 46,67; 62,47; 71,85; 84,45; 93,83%.
3. Besar ED50 yang didapatkan dari infusa daun iler adalah 181,97 mg/kgBB
A. Saran
45
DAFTAR PUSTAKA
Amitjitraresmu, 1995,UjiEfek Anti Inflamasi Berbagai Ekstrak Daun Iler (Coleus atropurpureus, Benth.) dan Penelusuran Senyawa aktifnya, Skripsi, FMIPA UNPAD, Bandung.
Andini, P. A., 2010, Efek Analgesik Ekstrak Metanol-Air Daun Macaranga tanirus L. pada Mencit Betina Galur Swis, Skripsi, Fakultas Farmasi Pancasila, Jakarta.
Anief,M., 2000, Prinsip Umum dan Dasar Farmakologi, Universitas Gadjah Mada University Press,Yogyakarta.
Aprillia, Y., 2010, Hipnosetri: Rileks, Nyaman, dan Aman Saat Hamil & Melahirkan, Gagas Media, Jakarta, 103.
Archard, G., 2007, Nyeri Punggung, Erlangga, Jakarta, 50, 132.
Corwin, J.E., 2007, Buku Saku Patofisiologi, Edisi III, Buku Kedokteran EGC, Jakarta, 38 -388.
Dalimarta, S., 2000.Atlas Tumbuhan Indonesia, Jilid ke-2, Jakarta: Trubus Agriwidya.
Dalimartha, S., 1996, Ramuan Tradisional untuk Pengobatan, Lembaga Biologi Nasional-LIPI, Jakarta.
Depkes RI, 1986, Sediaan Galenik, Departemen Kesehatan Republik Indonesia, Jakarta, 8-25.
Depkes RI, 1995, Farmakope Indonesia, edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta, 31.
Dinkes, 2010, Informasi tentang Asetosal,
http://dinkes.tasikmalayakota.go.id/index.php/informasi-obat/220-asetosal.html, diakses tanggal 21 April 2013.
DiPiro, J.T., Tabert, R.L., Yee, G.C., Matzke, G.R., Wells, B.G., and Posey, M.,2008, Pharmacotherapy: A Patophysiologic Approach, McGraw- Hill, USA, pp. 1002.
Handara, P. D., 2006, Efek Analgesik Infusa Batang Brotowali pada Mencit Putih Betina, Skripsi, Universitas Sanata Dharma Yogyakarta
Hatch, L., C, 2011, House, Interior, and Tropical Plants Subvolume Coleus, Derived From the Earlier NOS Coleus Gallery, New York.
Kumala, S., 2009, Aktivitas Antibakteri Ekstrak Iler (Coleus atropurpureus L. Benth.) terhadap Beberapa Bakteri Gram (+) dan Bakteri Gram (-) (Antibacterial Sctivity of her leaves (Coleus atropurpureus L. Benth)
Extract Towards Gram (+) and (-) bacteria), Skripsi, Fakultas Farmasi Universitas Pancasila
Lumbessy, M.,Abidjulu J., Paendong, J.E.J., Uji Total Flavonoid Pada Beberapa Tanaman Obat Tradisional Di Desa Waitina Kecamatan Mangoli Timur Kabupaten Kepulauan Sulu Propinsi Maluku Utara, Thesis, FIMP, Jurusan Kimia, Manado.
Mutscler,E., 2000, Dinamika Obat, diterjemahkan oleh Widianto dan Ranti, Edisi V, ITB, Bandung, pp. 177-197.
Mutschler, E., 1991, Dinamika Obat, Penerbit ITB, Bandung, 177-193.
Mahendra, B., 2006, Atasi Stroke Dengan Tanaman Obat, Penerbit Swadaya, Jakarta.
Middelton, E., JR., Kandaswami, C., and Theoharis, C., 2000, The Effects of Plant Flavonoids on Mammalian Cells: Implications for Inflammation, Heart Disease, and Cancer, Chebeague Island Institute of Natural Product Research, Chebeague Island, Maryland (E.M., C.K.); and Department of Pharmacology and Experimental Therapeutics, Tufts University School of Medicine, Boston, Massachusetts (T.C.T.).
Paeamono, S., 2003, Bahan Obat Alami Ditinjau dari Prospek Bisnis, Makalah seminar, 25 Mei 2003, Yogyakarta.
Riyanti, T., Fazrina, & Darmono, 2007, Uji ktifitas Antibakteri Ekstrak Etanol Daun Iler (Coleus atropurpureus L. Benth) Terhadap Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa Secara In-Vitro,
Jurnal Balai Besar Penelitian Veteriner, Fakultas Pancasila, Jakarta
Robinson, T., 1991, Kandungan Organik Tumbuhan Tinggi, Edisi keenam, Terjemahan Kosasih Padmawinata, Penerbit ITB, Bandung.
Saragih, Edward, 2011, Isolasidan Identifikasi Senyawa Aktif Ekstrak Daun Iler (Coleus atropurpureus, Benth), Skripsi, Fakultas Matematika dan Ilmu Pengetahuan Alam UNPAD, Bandung.
Siswandi, Y. dan Baradero M., 2005, Prinsip dan Praktik Keperawatan Perioperatif, Buku Kedokteran EGC, Jakarta, pp. 122.
Sidebang, B.M., 2011, Efek Analgesik Infusa Batang Brotowali (Tinospora crispa (L) Miers.) pada Mencit Putih Betina, Skripsi, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Siswandono dan Soekarjdo, 2000, Prinsip-Prinsip Rancangan Obat, Airlangga University Press, Surabaya, pp. 293-294.
Tjay, T.H.,dan Rahardja, K., 2007, Obat-Obat Penting, Edisi VI, PT.Elex Media Komputindo, Jakarta, 315.
Tjay, T.H dan Rahardja, K., 2002, Obat-Obat Penting, Edisi V, PT.Elex Media Komputindo, Jakarta, 202-302.
Thomas, A., 2000, Tanaman Obat Tradisional 7, Penerbit Kansius, Yogyakarta Tokiman, N.,L, 2011, Pengaruh Praperlakuan Jus Tomat (Solanum lycopersicum
L.) Terhadap Daya Analgesik Paracetamol pada Mencit Putih Betina,
Skripsi, Fakultas Farmasi Universitas Sanata Dharama, Yogyakarta
Turner, R. A., 1965, Screening Methods in Pharmacology, 100-117, Academic Press, New York, London.
Utami, P., 2008, Buku Pintar Tanaman Obat, Argomedia Pustaka, Jakarta
Vogel, H.G., 2002, Drug Discovery and Evaluation : Pharmacological Assay,
edisi 2, Springer, Jerman, pp. 716-717.
Wilmana, P.F., 1995, Analgetik Antipiretik Anti-Inflamasi Non-steroid dan Obat Pirai, dalam Ganiswara, S.G., Setiabudi, R., Sutyana, F.D., Purwantiastuti, Nafrialdy, Farmakologi dan Terapi, Edisi IV, Bagian Farmaklogi Fakultas Kedokteran, Universitas Indonesia, Jakrta, pp. 207-209
Yayasan Pengembangan Obat Bahan Alam Phyto Medika, 1991, Pedoman Pengujian dan Pengembangan Fitofarmaka, Penapisan Farmakologi, Pengujian Fitokimia dan Pengujian Klinik, Jakarta, pp 3, 41, 259.
(Gambar. 8) Daun iler segar (Gambar. 9) Infusa daun iler
( Gambar. 10) Mencit yang dipuasakan ( Gambar . 11) Geliat mencit
(Gambar. 13) Kotak kala tempat
pengamatan (Gambar. 14) Spuit Injeksi dan peroral