INTISARI
Tanaman kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult.) selama ini biasanya digunakan sebagai tanaman hias. Penggunaan kultur jaringan untuk menghasilkan metabolit sekunder dari tanaman bertujuan untuk membuktikan bahwa jaringan dapat menggantikan tanaman asal secara fungsional, termasuk menghasilkan metabolit sekunder. Dalam penelitian ini, metabolit sekunder yang diteliti yaitu glikosida jantung dari kalus daun kamboja jepang.
Penelitian ini bertujuan untuk memperoleh informasi tentang pertumbuhan in vitro kalus daun tanaman kamboja jepang dengan cara mengukur waktu inisiasi kalus dan profil pertumbuhan kalus serta membandingkan kandungan kimia kalus dengan tanaman asal. Eksplan untuk menghasilkan kalus didapat dari jaringan daun kamboja jepang yang ditanam secara in vitro pada media tumbuh MS (Murashige-Skoog) dengan penambahan zat pengatur tumbuh asam 2,4-Diklorofenoksiasetat (analog auksin). Kalus kemudian diekstrak dengan campuran kloroform-metanol (1 : 10 v/v)
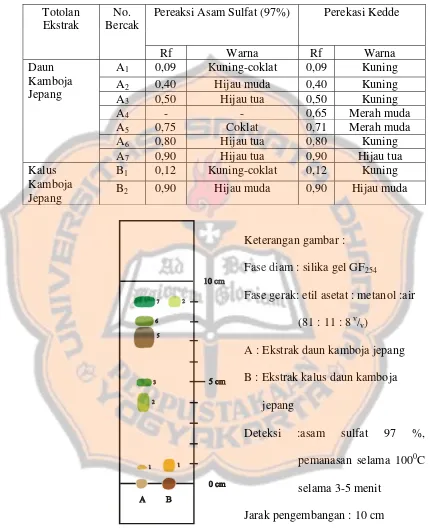
Analisis profil pertumbuhan kalus dilakukan berdasarkan bobot kalus basah dan bobot kalus kering. Uji KLT dilakukan dengan membandingkan harga Rf bercak-bercak hasil pengembangan ekstrak kalus daun kamboja jepang dengan ekstrak daun kamboja jepang dalam fase diam silika gel GF254, fase gerak etil asetat : metanol : aquadest ( 81 :11 : 8 v/v ) dengan jarak pengembangan 10 cm. Deteksi yang digunakan yaitu sinar UV 254 dan 365 nm, serta pereaksi Kedde dan pereaksi asam sulfat berdasarkan acuan (Wagner,1984).
Dari hasil penelitian, diketahui bahwa waktu inisiasi kalus adalah 10,3 hari. Profil pertumbuhan kalus daun kamboja jepang mengikuti pola pertumbuhan sigmoid fase lag, fase eksponensial dan fase stasioner. Hasil KLT yang diperoleh menunjukkan bahwa ekstrak kalus daun kamboja jepang hasil budidaya in vitro tidak mengandung glikosida jantung seperti tanaman asalnya.
Kata kunci : Adenium obesum , kalus, glikosida jantung.
ABSTRACT
Kamboja jepang ( Adenium obesum ( Forssk.) Roem & Schult.) during the time is usually used as decorative plant. Usage of tissue culture to provide secunder metabolit from plant aim to prove that the tissue can act as a complete plant system functionally, including provide secunder metabolit. The experiment’s secunder metabolite is cardiac glycoside from callus of kamboja jepang leaf.
The purpose of this experiment is to get information of growth callus kamboja jepang by in vitro by measuring callus initiation time and profile of callus growth and also compare chemical content of callus with the whole plant leaf. Explan to yield callus got from kamboja jepang leaf planted by in vitro at media growth MS ( Murashige-Skoog) with addition regulator of growth 2,4-Dichlorophenoksiacetate (an auxin analogue). Then, callus be extracted with mixture of chloroform-methanol ( 1 : 10 v / v).
Analysis of growth profile of callus based on wet callus weight and dry callus weight. Test of KLT be done by comparing Rf value of KLT spots of extract callus and the whole plant leaf at silica gel GF254 as stationary phase, ethyl acetate: methanol : aquadest ( 81 : 11 : 8 v / v ) as mobile phase with distance of elution is 10 cm. The detection include UV 254 and 365 light, and Kedde reagent and sulphate acid reagent according to Wagner (1984).
From the result of experiment, it be known that callus initiation time is 10,3 days. Callus growth profile follow sigmoid pattern which consist of lag phase, exponensial phase and stasioner phase. From the result of TLC indicate that extract of callus kamboja jepang leaf which conducting by in vitro do not contain cardiac glycoside like its herbs.
Keywords: Adenium obesum , callus, cardiac glycoside.
KANDUNGAN GLIKOSIDA JANTUNG DAN
PROFIL PERTUMBUHAN KALUS DAUN KAMBOJA JEPANG ( Adenium obesum (Forssk.) Roem. & Schult. )
DALAM MEDIA TUMBUH MURASHIGE - SKOOG
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Melissa Wijaya NIM : 038114112
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
The fear of the LORD is the beginning of knowledge,
But fools despise wisdom and instruction.
( Proverbs 1 : 7 )
Trust
in
the
LORD
with
all
your
heart,
And
lean
not
on
your
own
understanding.
In
all
your
ways
acknowledge
HIM,
And
He
shall
direct
your
paths.
(
Proverbs
3
:
5
‐
6
)
I can do all things through Christ who strengthens me.
( Philippians 4: 13 )
I dedicated this masterpiece to :
My Savior Jesus Christ
My beloved Dad and Mom
My Brother Samuel
My Benny Bear
My Almamater
PRAKATA
Puji syukur kehadirat Allah Bapa di surga, atas limpahan berkat dan kasih-Nya yang tak terhingga, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Kandungan Glikosida Jantung dan Profil Pertumbuhan Kalus Daun Kamboja Jepang ( Adenium obesum (Forssk.) Roem. & Schult. ) Dalam Media Tumbuh Murashige-Skoog”. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar sarjana Farmasi (S.Farm) di Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Skripsi ini dapat terselesaikan karena bantuan, bimbingan, saran, dukungan, cinta dan doa yang tulus dari berbagai pihak. Oleh karena itu, dengan segala kerendahan hati, penulis ingin menyampaikan rasa terima kasih kepada: 1. Kedua orang tua penulis, Kusnadi Widjaja dan Tuti Setiawati, dan kakak
penulis, Samuel Wijaya, terima kasih atas doa, cinta, kasih sayang dan pengorbanannya.
2. Rita Suhadi M, Si., Apt selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
3. Ign.Y. Kristio Budiasmoro, M.Si selaku dosen pembimbing yang telah berkenan membimbing, mengarahkan dan memberikan saran kepada penulis dalam menyelesaikan skripsi ini.
4. Erna Tri Wulandari, M.Si., Apt selaku dosen penguji yang bersedia untuk menguji dan memberi saran dalam skripsi ini.
5. Christine Patramurti, M.Si., Apt selaku dosen penguji yang bersedia untuk menguji dan memberikan saran dalam skripsi ini.
6. Benny Sugientoro, S.Farm., buat cinta, dukungan, doa, perhatian, semangat dan kasih sayangnya.
7. Mas Sigit, Mas Wagiran, Mas Andri dan Pak Mukmin yang banyak membantu penulis selama bekerja di laboratorium.
8. Mbak Christin, Mbak Mina, Mbak Vero, Mas Didit, Donny, Ko Vekeh, Pak Eko dan Ci Vivien, terima kasih atas semua doa, dukungan dan bantuannya. 9. Teman-teman angkatan 2003 teristimewa kelas C, terima kasih buat kasih
persahabatan dan kebersamaannya selama ini.
10.Semua pihak yang tidak dapat disebutkan satu persatu yang telah mendukung dalam penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini masih ada kekurangan yang harus diperbaiki, oleh karena itu saran dan kritik yang bersifat membangun sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi semua pihak
Yogyakarta, Februari 2007
Penulis
DAFTAR ISI
Halaman
HALAMAN JUDUL ... HALAMAN PERSETUJUAN PEMBIMBING ... HALAMAN PENGESAHAN... HALAMAN PERSEMBAHAN... PRAKATA ... PERNYATAAN KEASLIAN KARYA... DAFTAR ISI ... DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIRAN ... INTISARI... ABSTRACT... BAB I PENGANTAR ...
A. Latar Belakang ... 1. Rumusan Permasalahan ... 2. Keaslian Penelitian ... 3. Manfaat Penelitian ... B. Tujuan Penelitian ... BAB II PENELAAHAN PUSTAKA ... A. Uraian Tanaman Kamboja Jepang ...
B. Kultur Jaringan Tanaman ... 1. Eksplan ... 2. Media... 3. Lingkungan... C. Glikosida Jantung ... D. Kromatografi Lapis Tipis ... E. Landasan Teori ... F. Hipotesis... BAB III METODOLOGI PENELITIAN ... A. Jenis dan Rancangan Penelitian ... B. Definisi Operasional ... C. Alat dan Bahan Penelitian ...
1. Alat penelitian ... 2. Bahan Penelitian... D. Tata Cara Penelitian ...
1. Determinasi tanaman ... 2. Pembuatan stok ... 3. Pembuatan media ... 4. Sterilisasi alat dan ruangan ... 5. Sterilisasi dan penanaman eksplan ... 6. Pengamatan waktu inisiasi kalus ... 7. Subkultur... 8. Pemanenan ...
9. Analisis pertumbuhan kalus... 10.Pengeringan dan pembuatan serbuk daun kamboja jepang ... 11.Pembuatan ekstrak kalus daun kamboja jepang ... 12.Pembuatan ekstrak daun kamboja jepang... 13.Uji KLT ekstrak kalus daun kamboja jepang dan ekstrak daun
tanaman asalnya. ... E. Analisis Hasil ...
1. Pembuatan grafik pola pertumbuhan kalus berdasarkan data penimbangan bobot kalus basah dengan umur kalus ... 2. Pembuatan grafik pola pertumbuhan kalus berdasarkan data
biomassanya ... BAB IV HASIL DAN PEMBAHASAN ...
A. Determinasi Tanaman ... B. Pemilihan Eksplan, Sterilisasi, dan Penanaman... C. Deskripsi Kalus dan Waktu Inisiasi Kalus ... D. Subkultur dan Panen... E. Profil Pertumbuhan Kalus ... 1. Pembuatan grafik pola pertumbuhan kalus berdasarkan data
penimbangan bobot kalus basah dengan umur kalus. ... 2. Biomassa kalus selama masa pertumbuhan 42 hari. ... F. Persen Kadar Air Kalus... G. Kromatografi Lapis Tipis ... BAB V KESIMPULAN DAN SARAN ...
A. Kesimpulan ... B. Saran ... DAFTAR PUSTAKA ... LAMPIRAN ... BIOGRAFI PENULIS ...
64 64 65 68 82
DAFTAR TABEL I.
II
Waktu inisiasi kalus rata-rata daun kamboja jepang... Hasil pengamatan KLT dengan fase diam silika gel GF254 dan fase gerak etil asetat : metanol : air ( 81 : 11 : 8 v/v ) ...
51
61
DAFTAR GAMBAR 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17.
Strukur glikosida jantung... Eksplan dalam bentuk irisan melintang daun ... Inisiasi kalus daun kamboja jepang ... Profil pertumbuhan kalus daun kamboja jepang berdasarkan bobot kalus basah... Persen kadar air kalus daun kamboja jepang ... Hasil KLT setelah disemprot dengan pereaksi asam sulfat (97 %) .. Hasil KLT setelah disemprot dengan pereaksi Kedde ... Foto tanaman kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult.) ... Foto daun kamboja jepang ... Foto kalus siap subkultur ... Foto kalus siap panen... Foto kalus basah... Foto kalus kering... Foto serbuk kalus ... Foto hasil KLT secara visual ... Foto hasil KLT dilihat dengan pereaksi asam sulfat ( 97% ) ... Foto hasil KLT dilihat dengan pereaksi Kedde ...
DAFTAR LAMPIRAN
1. Surat Determinasi Tumbuhan ... 2. Foto-foto Hasil Penelitian ... 3. Komposisi media tumbuh Murashige-Skoog ( MS ) ... 4. Data penimbangan bobot kalus basah dan bobot kalus kering dalam
media tumbuh MS ... 5. Profil pertumbuhan kalus daun kamboja jepang berdasarkan bobot
kalus basah ... 6. Profil pertumbuhan kalus daun kamboja jepang berdasarkan bobot
kalus kering ... 7. Data persen kadar air kalus kamboja jepang...
68 69 74
76
77
79 81
INTISARI
Tanaman kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult.) selama ini biasanya digunakan sebagai tanaman hias. Penggunaan kultur jaringan untuk menghasilkan metabolit sekunder dari tanaman bertujuan untuk membuktikan bahwa jaringan dapat menggantikan tanaman asal secara fungsional, termasuk menghasilkan metabolit sekunder. Dalam penelitian ini, metabolit sekunder yang diteliti yaitu glikosida jantung dari kalus daun kamboja jepang.
Penelitian ini bertujuan untuk memperoleh informasi tentang pertumbuhan in vitro kalus daun tanaman kamboja jepang dengan cara mengukur waktu inisiasi kalus dan profil pertumbuhan kalus serta membandingkan kandungan kimia kalus dengan tanaman asal. Eksplan untuk menghasilkan kalus didapat dari jaringan daun kamboja jepang yang ditanam secara in vitro pada media tumbuh MS (Murashige-Skoog) dengan penambahan zat pengatur tumbuh asam 2,4-Diklorofenoksiasetat (analog auksin). Kalus kemudian diekstrak dengan campuran kloroform-metanol (1 : 10 v/v)
Analisis profil pertumbuhan kalus dilakukan berdasarkan bobot kalus basah dan bobot kalus kering. Uji KLT dilakukan dengan membandingkan harga Rf bercak-bercak hasil pengembangan ekstrak kalus daun kamboja jepang dengan ekstrak daun kamboja jepang dalam fase diam silika gel GF254, fase gerak etil asetat : metanol : aquadest ( 81 :11 : 8 v/v ) dengan jarak pengembangan 10 cm. Deteksi yang digunakan yaitu sinar UV 254 dan 365 nm, serta pereaksi Kedde dan pereaksi asam sulfat berdasarkan acuan (Wagner,1984).
Dari hasil penelitian, diketahui bahwa waktu inisiasi kalus adalah 10,3 hari. Profil pertumbuhan kalus daun kamboja jepang mengikuti pola pertumbuhan sigmoid fase lag, fase eksponensial dan fase stasioner. Hasil KLT yang diperoleh menunjukkan bahwa ekstrak kalus daun kamboja jepang hasil budidaya in vitro tidak mengandung glikosida jantung seperti tanaman asalnya.
Kata kunci : Adenium obesum , kalus, glikosida jantung.
ABSTRACT
Kamboja jepang ( Adenium obesum ( Forssk.) Roem & Schult.) during the time is usually used as decorative plant. Usage of tissue culture to provide secunder metabolit from plant aim to prove that the tissue can act as a complete plant system functionally, including provide secunder metabolit. The experiment’s secunder metabolite is cardiac glycoside from callus of kamboja jepang leaf.
The purpose of this experiment is to get information of growth callus kamboja jepang by in vitro by measuring callus initiation time and profile of callus growth and also compare chemical content of callus with the whole plant leaf. Explan to yield callus got from kamboja jepang leaf planted by in vitro at media growth MS ( Murashige-Skoog) with addition regulator of growth 2,4-Dichlorophenoksiacetate (an auxin analogue). Then, callus be extracted with mixture of chloroform-methanol ( 1 : 10 v / v).
Analysis of growth profile of callus based on wet callus weight and dry callus weight. Test of KLT be done by comparing Rf value of KLT spots of extract callus and the whole plant leaf at silica gel GF254 as stationary phase, ethyl acetate: methanol : aquadest ( 81 : 11 : 8 v / v ) as mobile phase with distance of elution is 10 cm. The detection include UV 254 and 365 light, and Kedde reagent and sulphate acid reagent according to Wagner (1984).
From the result of experiment, it be known that callus initiation time is 10,3 days. Callus growth profile follow sigmoid pattern which consist of lag phase, exponensial phase and stasioner phase. From the result of TLC indicate that extract of callus kamboja jepang leaf which conducting by in vitro do not contain cardiac glycoside like its herbs.
Keywords: Adenium obesum , callus, cardiac glycoside.
BAB I PENGANTAR
A. Latar Belakang
Kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult. ) selama ini lebih dikenal sebagai tanaman hias ( Soenanto, 2005). Pada penelitian terdahulu dilaporkan bahwa tanaman kamboja jepang mengandung glikosida jantung dengan kandungan utama berupa oleandrigenin beta-gentiobiosyl-beta-D-thevetoside, neridienone A dan 16,17-dihydroneridienone A ( Yamauchi dan Abe, 1990 ). Ekstrak dari daun tanaman kamboja jepang mengandung glikosida jantung yang memiliki efek sitotoksik yang berpotensi sebagai antikanker ( Nakamura et.al., 2000). Ekstrak akar dan kulit batang dari kamboja jepang juga berpotensi sebagai agen terapeutik untuk pengobatan trypanosomiasis ( Atawodi, et al., 2003; Freiburghaus et al., 1996). Ekstrak kulit batang kamboja jepang juga berpotensi sebagai acaricidal ( Mgbojikwe dan Okoye, 2001).
Di dalam pencarian metode produksi metabolit sekunder dari tumbuhan berkhasiat obat, pendekatan bioteknologi, khususnya kultur jaringan, berpotensi sebagai alternatif di dalam produksi metabolit-metabolit bioaktif tumbuhan untuk skala industri ( Ramachandra dan Ravishankar, 2002).
Kultur jaringan tanaman merupakan teknik perbanyakan tanaman dengan menggunakan potongan kecil jaringan atau sel atau organ, yang dipelihara dalam suatu medium dan dikerjakan seluruhnya dalam kondisi aseptik. Organ, jaringan dan sel tanaman yang ditumbuhkan tersebut disebut eksplan ( Katuuk, 1989 ).
Eksplan yang digunakan dalam penelitian ini adalah daun karena daun lebih mudah didapat daripada bagian tanaman yang lain dan memiliki jaringan parenkim yang akan berdediferensiasi serta mudah untuk disterilisasi.
Eksplan yang telah ditumbuhkan dalam media dapat membentuk kalus yaitu massa amorf yang tersusun atas sel-sel parenkim berdinding sel tipis yang berkembang dari hasil proliferasi sel-sel jaringan induk ( Yuwono, 2006 ). Ide memperbanyak tanaman dengan jalan mengkulturkan bagian kecil organ, jaringan atau sel tersebut dilakukan berdasarkan teori totipotensi sel yaitu : setiap sel tanaman hidup mempunyai informasi genetik dan perangkat fisiologis yang lengkap untuk dapat tumbuh dan berkembang menjadi tanaman yang utuh, jika kondisinya sesuai ( Yusnita, 2003 ). Media yang digunakan dalam penelitian ini adalah media Murashige-Skoog (MS) karena menurut Hendaryono dan Wijayani (1994) media tersebut cocok sebagai media kultur untuk membudidayakan tanaman hias.
Penelitian ini bertujuan untuk mengkulturkan tanaman kamboja jepang dari bagian daun serta mengidentifikasi metabolit sekunder glikosida jantung yang dihasilkan oleh kalus yang dibentuk dari hasil budidaya in vitro. Kultur kalus yang dihasilkan oleh teknik kultur jaringan ini diharapkan memiliki profil pertumbuhan sigmoidal, dimana pada fase stasionernya menghasilkan kandungan glikosida jantung yang optimum.
1. Rumusan Permasalahan
a. Apakah eksplan yang berasal dari daun kamboja jepang dapat menghasilkan kalus jika dikembangkan secara in vitro dalam media Murashige-Skoog ( MS ) ?
b. Bagaimana pola pertumbuhan kalus daun kamboja jepang yang dikulturkan?
c. Apakah kalus daun kamboja jepang hasil budidaya in vitro dapat menghasilkan glikosida jantung seperti tanaman asalnya ?
2. Keaslian Penelitian
Sejauh pengetahuan penulis, penelitian tentang kandungan glikosida jantung dan profil pertumbuhan kalus daun kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult. ) dalam media tumbuh MS belum pernah diteliti. 3. Manfaat Penelitian
Penelitian ini diharapkan memiliki beberapa manfaat antara lain: a. Manfaat Teoritis
Penelitian ini diharapkan dapat bermanfaat dalam mengembangkan bidang ilmu kefarmasian, khususnya dalam mengeksplorasi kandungan glikosida jantung dari tanaman kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult.) yang ditumbuhkan secara in vitro.
b. Manfaat Praktis
B. Tujuan Penelitian Tujuan penelitian ini adalah :
a. Menumbuhkan kalus dari eksplan daun kamboja jepang. b. Mengetahui pola pertumbuhan kalus daun kamboja jepang.
BAB II
PENELAAHAN PUSTAKA
A. Uraian Tanaman Kamboja Jepang
Kamboja jepang dengan nama spesies Adenium obesum (Forssk) Roem & Schult berasal dari famili Apocynaceae dan memiliki nama sinonim yaitu Plumeria rubra L.cv. acutifolia.( Anonim, 2006 ).
Secara morfologis tanaman kamboja jepang ( Adenium obesum (Forssk.) Roem. & Schult. ) memiliki akar yang mampu membesar seperti umbi dan diselimuti oleh rambut-rambut akar yang sangat banyak; berbatang lunak dan tidak berkayu; daunnya berbentuk lanset dengan ujung membulat, tebal dan berserat, berwarna hijau, tampak mengkilap dan licin; bunganya berwarna merah muda sampai merah tua, memiliki 5 helai mahkota bunga yang bagian tengahnya berwarna putih; buahnya tumbuh secara berpasangan, terletak di ujung tunas, berbentuk pipih panjang, berwarna hijau waktu masih muda dan kemudian berangsur-angsur berubah menjadi cokelat; bijinya berada dalam buah, berwarna cokelat. Tanaman ini dapat tumbuh hingga dua meter ( Soenanto, 2005).
Tanaman kamboja jepang mengandung glikosida jantung dengan kandungan utama berupa oleandrigenin beta-gentiobiosyl-beta-D-thevetoside, neridienone A dan 16,17-dihydroneridienone A ( Yamauchi dan Abe, 1990 ).
B. Kultur Jaringan Tanaman
Kultur jaringan dalam bahasa asing disebut sebagai tissue culture, weefsel cultuur atau Gewebe kultur. Kultur artinya budidaya dan jaringan artinya
sekelompok sel yang mempunyai bentuk dan fungsi yang sama. Maka kultur jaringan berarti membudidayakan suatu jaringan tanaman menjadi tanaman kecil yang mempunyai sifat yang sama dengan induknya ( Dixon, 1985).
Kultur jaringan in vitro (mikropopagasi) adalah perbanyakan tanaman dengan menggunakan potongan kecil jaringan atau sel yang dipelihara dalam satu medium dan dikerjakan seluruhnya dalam kondisi aseptik ( Katuuk, 1989).
Ide memperbanyak tanaman dengan jalan mengkulturkan bagian kecil jaringan atau organ muncul dari pendapat bahwa tanaman tinggi terdiri dari sekumpulan sel. Sel-sel yang sama membentuk jaringan yang melakukan tugas tertentu pada setiap organ dalam tubuh tanaman. Sel-sel ini mempunyai kemampuan untuk melakukan seluruh proses hidup. Kemampuan sel ini disebut “totipotency” ( Katuuk, 1989).
Teori totipotensi sel dikemukakan oleh Schwann dan Schleiden pada tahun 1838. Menurut teori ini, setiap sel tanaman hidup mempunyai informasi genetik dan perangkat fisiologis yang lengkap untuk dapat tumbuh dan berkembang menjadi tanaman yang utuh, jika kondisinya sesuai ( Yusnita, 2003 ).
Kultur jaringan dalam skala besar ditemukan sebagai pendekatan alternatif yang menarik terhadap metode penanaman tradisional dimana kultur jaringan dapat menyediakan metabolit-metabolit sekunder yang terkontrol ( Sajc et al., 2000 ).
Keuntungan dari sistem kultur jaringan ini sebagai berikut:
b. Hasil kultur akan terbebas dari mikroba dan serangga.
c. Sel-sel kebanyakan tumbuhan mudah untuk berkembangbiak dalam menghasilkan metabolit-metabolit yang spesifik.
d. Kontrol automatis dari pertumbuhan sel dan proses pengaturan metabolit yang rasional dalam bioreaktor akan mengurangi biaya tenaga kerja dan meningkatkan produktivitas.
e. Substansi organik dapat diekstrak dari kultur kalus. ( Dicosmo dan Misawa, 1995 ).
Faktor-faktor yang menentukan keberhasilan dalam kultur jaringan tanaman antara lain:
1. Eksplan
Eksplan adalah bagian kecil jaringan atau organ yang dikeluarkan atau dipisahkan dari tanaman induk kemudian dikulturkan. Berhasil tidaknya pengkulturan eksplan tergantung pada faktor yang dimiliki oleh eksplan itu sendiri. Faktor-faktor itu meliputi:
a.Ukuran eksplan.
bervariasi, tergantung pada material tanaman yang dipakai serta jenis tanaman ( Katuuk, 1989).
b.Umur eksplan.
Umur eksplan sangat mempengaruhi tipe serta daya morfogenesis. Jaringan yang masih muda serta belum banyak berdiferensiasi terdapat pada bagian meristematik. Dari semua jenis tanaman bagian inilah yang paling banyak berhasil. Sel atau jaringan yang masih muda yang dinamakan juvenile akan tetap muda dalam pengkulturan sehingga daya untuk
beregenerasi tetap ada, sedangkan sel-sel tua, kesanggupan untuk beregenarasi sudah berkurang. Selain dari kandungan jaringan meristematik yang berkurang, jaringan yang sudah tua ada kemungkinan sudah mengandung banyak patogen ( Katuuk, 1989 ).
c.Sumber eksplan.
Tanaman yang dijadikan sumber eksplan hendaknya dari tanaman yang sehat, yang bertumbuh baik / normal. Pengaruh perubahan suhu, cahaya, musim serta kelembaban terhadap tanaman induk sangat mempengaruhi perkembangan eksplan. Tanaman induk dituntut untuk berkecukupan zat hara, lama penyinaran, intensitas cahaya serta hormon tumbuh. Pendek kata pertumbuhannya harus optimum ( Katuuk, 1989 ). d.Genotip eksplan.
pada tanaman monokotil, dikotil dan gymnospermae. Dari ketiga kelompok ini, kemampuan untuk beregenerasi yang paling rendah adalah tanaman gymnospermae, kemudian diikuti oleh tanaman monokotil, dan terakhir oleh tanaman dikotil. Selanjutnya dikatakan bahwa apabila satu jenis tanaman dengan mudah beregenerasi in vivo maka sifat ini berlaku juga pada in vitro (Katuuk, 1989 ).
2. Media
Media kultur merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan. Berbagai komposisi media kultur telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan tanaman yang dikulturkan. Murashige dan Skoog mempublikasikan formulasi media MS (singkatan dari Murashige dan Skoog) yang sampai sekarang terbukti cocok untuk kultur jaringan banyak tanaman dan banyak digunakan di laboratorium kultur jaringan di seluruh dunia ( Yusnita, 2003 ).
Komponen media kultur yang digunakan dalam kultur jaringan adalah sebagai berikut :
a. Air.
disimpan dalam kondisi steril dengan tidak memberi peluang pada bakteri untuk hidup dan berkembang ( Katuuk, 1991 ).
b. Garam anorganik.
Beberapa garam anorganik yang dibutuhkan tanaman dalam jumlah takaran yang banyak dikenal sebagai unsur makro. Unsur makro adalah unsur yang dibutuhkan dalam jumlah yang besar. Jenis-jenis yang termasuk unsur makro adalah nitrogen (N), Fosfor (P), Kalium (K), Sulfur (S), Kalsium (Ca), dan Magnesium (Mg). Unsur NPK adalah unsur yang mutlak dibutuhkan oleh tanaman, yang berarti harus selalu tersedia sedangkan unsur S,Ca, dan Mg boleh ada dan boleh tidak. Namun, karena fungsinya sangat mendukung pertumbuhan jaringan maka akan lebih baik apabila unsur-unsur tersebut juga tersedia ( Hendaryono dan Wijayani, 1994 ).
meningkatkan kandungan fosfat yang berguna untuk pembentukan sejumlah protein ( Hendaryono dan Wijayani, 1994 ).
Selain unsur makro, ada pula unsur mikro, yaitu unsur yang dibutuhkan tanaman dalam jumlah sedikit namun harus tersedia. Unsur-unsur tersebut adalah Besi(Fe), Mangan(Mn), Boron (B), Seng (Zn), Cobalt (Co), Tembaga(Cu), dan Molibdenum (Mo) ( Hendaryono dan Wijayani, 1994 ).
Kegunaan dari unsur mikro tersebut adalah unsur Fe berfungsi dalam pembentukan hijau daun (chlorophyl); unsur Mn berguna untuk pemebentukan membran kloroplas; unsur B memegang peran penting dalam perombakan gula; unsur Zn berperan dalam pembentukan protoplas; unsur Co berguna untuk mengikat N dan untuk pembentukan asam inti; unsur Cu berperan dalam konversi energi; unsur Mo berperan dalam pembentukan klorofil ( Katuuk, 1989 ).
Unsur-unsur makro biasanya diberikan dalam bentuk NH4NO3, KNO3, CaCl2.2H20, MgSO4.7H2O dan KH2PO4. Sedangkan unsur-unsur mikro biasa diberikan dalam bentuk MnSO4.4H2O, ZnSO4.4H2O, H3BO3, KI, NaMo4.2H2O, CuSO4.5H2O dan CoCl2.6H2O ( Hendaryono dan Wijayani, 1994).
c. Sumber karbon dan energi.
pati, dan selulosa. Karbohidrat memiliki 2 fungsi utama yaitu sebagai sumber energi untuk jaringan dan untuk menjaga keseimbangan tekanan osmotik potensial minimum dalam media. Ada banyak jenis karbohidrat yang dipakai dalam kultur jaringan namun yang paling banyak digunakan adalah sukrosa atau D-glukosa ( Katuuk, 1989).
d. Myo-inositol, Vitamin dan asam amino.
Penambahan myo-inositol pada media bertujuan untuk membantu diferensiasi dan pertumbuhan sejumlah jaringan. Bila myo-inositol diberikan bersama dengan auksin, kinetin dan vitamin, maka dapat mendorong pertumbuhan jaringan kalus ( Hendaryono dan Wijayani, 1994).
Asam-asam amino berperanan penting untuk pertumbuhan dan diferensiasi kalus. Kebutuhan asam amino untuk setiap tanaman berbeda-beda. Asparagin dan Glutamin berperan dalam metabolisme asam amino, karena dapat menjadi pembawa dan sumber amonia untuk sintesis asam-asam amino baru dalam jaringan ( Hendaryono dan Wijayani, 1994 ). e. Hormon dan zat pengatur tumbuh.
Keberadaan hormon dan zat pengatur tumbuh dalam kegiatan kultur jaringan adalah mutlak karena budidaya kultur jaringan adalah budidaya terkendali. Proses tumbuh dan berkembangnya eksplan dapat disesuaikan dengan harapan, menjadi kalus saja, organogenesis ataupun embryogenesis. Pengaturan ini dapat dilakukan dengan mengatur macam dan konsentrasi zat pengatur tumbuh sehingga menghasilkan kombinasi yang tepat sesuai dengan harapan. Macam hormon dan zat pengatur tumbuh yang sudah dikenal hingga saat ini adalah sebagai berikut :
1) Auksin
Hormon sintetik atau zat pengatur tumbuh yang digolongkan sebagai auksin yaitu : asam a-naftalenasetat (NAA), asam 2,4-diklorofenoksiasetat (2,4-D), asam 2-metil 4-klorofenoksiasetat (MCPA), asam 2-naftalosiasetat (4-CPA), asam p-klorofenoksiasetat (PCPA), asam 2,4,5-triklorofenoksiasetat (2,4,5-T), asam 3,6-dikloroanisik (dikamba), asam 4-amino 3,5,6-trikloropikolinik (pikloram) ( Santoso dan Nursandi, 2001 ).
Dalam aktivitas kultur jaringan, auksin berperan menginduksi terjadinya kalus, menghambat kerja sitokinin membentuk klorofil dalam kalus, mendorong proses morfogenesis kalus membentuk akar atau tunas, mendorong proses embryogenesis, dan mempengaruhi kestabilan genetis tanaman ( Santoso dan Nursandi, 2001 ).
2) Sitokinin
Sitokinin merupakan nama kelompok hormon tumbuhan yang sangat penting sebagai pemacu pertumbuhan dan morfogenesis dalam kultur jaringan. Seperti auksin, selain sitokinin alami juga terdapat sintesisnya yang tergolong dalam zat pengatur tumbuh. Sitokinin sintetik yang umum digunakan dalam kegiatan kultur jaringan adalah FAP (6-furfurilaminopurin), BAP (Benzylaminopurin), Thidiazuron
(N-phenil-N-1,2,3-thiadiazol-5-penylurea) ( Santoso dan Nursandi, 2001 ).
tunas, menghambat pembentukan akar, mendorong pembentukan klorofil pada kalus ( Santoso dan Nursandi, 2001 ).
3) Gibberilin (GA)
Gibberilin merupakan kelompok lain dari ZPT atau hormon yang dapat mempengaruhi pemanjangan batang atau ruas batang, mendorong pembungaan, induksi buah, dan tumbuhnya mata tunas yang dorman. Secara umum dalam kegiatan kultur jaringan tanaman tanpa penambahan GA, sesungguhnya kegiatan telah dapat berjalan dan proses induksi serta diferensiasi dapat dilakukan, meski demikian tidak menutup kemungkinan bahwa GA endogen dalam eksplan walaupun dalam kadar yang relatif kecil diduga tetap merupakan komponen yang essensial, contoh GA sintetik adalah gibberillic acid (Santoso dan Nursandi, 2001). 5) ABA (Abcisic acid)
ABA merupakan hormon tanaman yang secara alamiah disintesis tanaman bila tanaman berada dalam keadaan stress. ABA tergolong dalam zat penghambat tanaman atau inhibitor karena kerjanya berlawanan dengan hormon pendorong seperti auksin, sitokinin, dan giberelin. Dalam kultur jaringan, ABA dapat menghambat proses inisiasi dan pertumbuhan sel ( Santoso dan Nursandi, 2001 ).
f. Bahan pemadat media
sedangkan media padat adalah media cair tersebut dengan ditambah zat pemadat ( Hendaryono dan Wijayani, 1994 ).
Zat pemadat yang digunakan untuk membuat media padat adalah berupa agar-agar. Agar adalah campuran berbagai polisakarida dari galaktosa yang diekstrak dari ganggang laut, terutama Gellidium amansii dan ganggang lain dari golongan Rhodophyta. Umumnya agar dapat membentuk gel pada suhu 40-45°C dengan titik cair 80-90°C. Kemampuan agar dalam memadatkan media tergantung pada cara pengekstrakannya dari ganggang dan pH larutan media sebelum diautoklaf. Dalam larutan media dengan pH rendah (kurang dari 4,5), gel yang terbentuk oleh agar sangat encer, sedangkan larutan dengan pH tinggi (lebih dari atau sama dengan 5,5) akan berbentuk padat ( Yusnita, 2003 ).
Media kultur jaringan merupakan sumber makanan yang baik untuk bakteri dan fungi, semua prosedur in vitro harus memuat pencegahan terhadap kontaminasi mikroba ( Wetherell, 1982 ). Beberapa teknik sterilisasi yang lazim digunakan dalam kultur jaringan tanaman, yaitu:
a. Sterilisasi panas basah
Cara sterilisasi panas basah adalah dengan menggunakan uap air. Alat yang digunakan untuk sterilisasi ini ialah autoklaf. Hampir semua mikroba mati sesudah diberi uap air dengan suhu 121°C selama 10-15 menit. Cara
waktu 15-20 menit, media 75-500 ml dibutuhkan waktu 20-25 menit, media 500-5000 ml dibutuhkan waktu 25-35 menit, yang semuanya dilakukan pada suhu 121°C; sedangkan untuk mensterilkan peralatan gelas
dibutuhkan waktu 30 menit dengan suhu 130 °C ( Katuuk, 1989 ).
Manfaat dari sterilisasi ini adalah prosesnya cepat, sederhana, dan sanggup membasmi virus tertentu. Namun autoklaf juga mempunyai kekurangan, yaitu:
1) Bila pemanasan terlalu tinggi, gula akan membatu sehingga dapat menjadi racun dalam media.
2) Bila terlalu lama disterilkan, garam akan mengendap sehingga terjadi dipolimerisasi agar.
3) Dapat menurunkan pH sekitar 0,3 - 0,5 unit.
4) Dapat merusak substansi yang mudah menguap, misalnya ethrel dan ethylene ( Katuuk, 1989 ).
b. Sterilisasi panas kering
skalpel tidak dapat disterilkan dengan cara ini sebab dapat merusak ketajaman pisau / alat ( Katuuk, 1989 ).
Lama pemanasan tergantung pada suhu. Biasanya sterilisasi untuk suhu 160°C, memerlukan waktu 45 menit, 170°C-18 menit, 180°C-7,5
menit, dan 190°C selama 1,5 menit. Suhu harus dikontrol, sebab pada suhu
170°C, kertas mulai hancur. Setelah selesai disterilisasi, alat / instrument
dikeluarkan dan dibawa ke ruang transfer, dimana mereka dapat disterilkan lagi dengan menggunakan sinar ultraviolet ( Katuuk, 1989 ). c. Sterilisasi dengan pemijaran
Alat / instrument berupa pisau dan skalpel, dikeluarkan dari bungkusnya, dicelupkan dalam etanol 70% dan dilewatkan pada nyala lampu spiritus. Setiap beberapa saat instrument harus dicelupkan ke dalam etanol kemudian dibakar. Perlakuan ini berjalan terus selama kegiatan inokulasi yang berlangsung di dalam kotak transfer (LAF) ( Katuuk,1989). d. Sterilisasi dengan bahan kimia
Sterilisasi dengan bahan kimia merupakan pembasmian mikroba dengan jalan memakai bahan kimia. Biasanya bahan kimia dipakai untuk mensterilkan permukaan saja, yang meliputi: material tanaman dapat disterilkan dengan menggunakan natrium hipoklorit, perak nitrat atau air brom, sedangkan instrumen, tangan pekerja, serta ruang atau kotak transfer dapat disterilkan dengan menggunakan alkohol 70% ( Katuuk, 1989 ).
material tanaman. Banyak kali terjadi bila terlalu lama dan dengan konsentrasi bahan pencuci yang tinggi, berakibat bukannya mematikan mikroba tetapi bahkan merusak jaringan tanaman yang disterilkan. Di samping itu bahan pencuci hendaknya bersifat lebih mudah larut. Bila tidak demikian, sisa zat pencuci ini akan tetap pada material tanaman, yang dapat mengganggu pertumbuhan eksplan ( Katuuk, 1989 ).
e. Sterilisasi dengan sinar ultraviolet
Ruang dan kotak transfer sukar untuk disterilkan hanya dengan menggosok dengan alkohol atau bahan kimia pada permukaan. Untuk itu digunakan lampu germisidal dengan sinar ultraviolet. Ada laboratorium yang sudah memasangnya di langit-langit atau pada tempat lain dengan maksud agar semua bagian terkena cahaya. Kelemahan menggunakan sinar ultraviolet adalah pada tempat-tempat yang tidak terkena cahaya, proses sterilisasi tidak terjadi. Selain itu, sinar ultraviolet hanya mampu mematikan bentuk fertilisasi bakteri dan jamur, bukan bentuk spora (Katuuk, 1989 ).
Kalus terbentuk melalui 3 tahapan, yaitu : induksi, pembelahan sel dan diferensiasi. Untuk memelihara kalus, maka perlu dilakukan subkultur secara berkala, misalnya setiap 30 hari ( Yuwono, 2006 ).
Subkultur adalah usaha mengganti media tanam kultur jaringan dengan media yang baru, sehingga kebutuhan nutrisi untuk pertumbuhan kalus atau protokormus dapat terpenuhi. Subkultur pada media padat mudah dilakukan dengan cara meletakkan kalus yang sudah terbentuk di atas cawan petri, kemudian membelah-belahnya menjadi bagian-bagian kecil lagi. Setelah menjadi potongan kecil, kalus dimasukkan kembali dalam media yang memiliki komposisi sama dengan media lama. Proses ini juga dilakukan dalam suasana steril ( Hendaryono dan Wijayani, 1994 ).
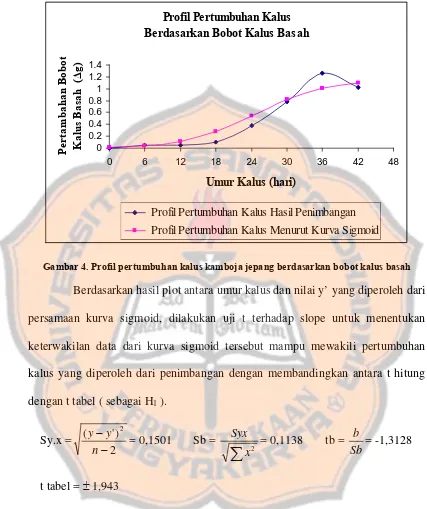
Ada 3 tahapan perkembangan dan pertumbuhan kalus, mulai dari waktu subkultur atau penaburan inokulum, yaitu: induksi pembelahan sel, pembelahan sel aktif dan tahap pembelahan sel lambat atau sel berhenti membelah. Laju pertumbuhan kalus umumnya ditetapkan secara kuantitatif dengan parameter indeks pertumbuhan bobot kalus basah. Pertambahan bobot kalus basah merupakan selisih antara bobot kalus basah pada periode tertentu dikurangi bobot kalus mula-mula atau bobot inokulum. Selanjutnya dari kurva pertumbuhan kalus yang menyatakan hubungan antara pertumbuhan bobot kalus basah dengan umur dapat diketahui fase-fase pertumbuhan kalus antara lain:
merupakan waktu adaptasi kalus dengan media yang baru. Pada fase ini pertambahan bobot kalus hanya sedikit dan terlihat hampir mendatar pada kurva.
b. Fase eksponensial, yaitu fase dimana mulai terjadi pertumbuhan kalus. Pertambahan bobot kalus mulai terlihat nyata dan diikuti fase linier dimana pertumbuhan kalus terus menaik secara eksponensial seperti garis lurus ke atas dan berhenti.
c. Fase stasioner, yaitu fase dimana pertumbuhan kalus sama dengan kematian sel-sel kalus. Kalus tidak dapat bertahan hidup pada fase ini dalam waktu yang lama. Sel-sel mulai mati, media pertumbuhan kelebihan muatan dan nutrien telah habis digunakan, sehingga kematian sel menjadi lebih cepat ( George dan Sherrington, 1984 ).
3. Lingkungan
Faktor lingkungan utama yang harus dipenuhi antara lain : a. Cahaya.
b. Suhu.
Pada umumnya kultur jaringan memerlukan suhu sebesar 25-30°C. Namun untuk pertumbuhan optimum hal ini akan berbeda-beda pada setiap spesies, serta jenis eksperimen ( Katuuk, 1989 ).
c. pH.
Pada umumnya nilai pH yang paling disukai untuk pertumbuhan sel antara 5-6. Walaupun pH media akan berubah selama pengkulturan, pH harus diatur lebih dulu sebelum diautoklaf, yaitu apabila semua komponen media sudah dicampurkan. Manfaat pH dalam media adalah untuk menjaga kestabilan membran sel, mengatur garam-garam agar tetap dalam bentuk terlarut, membantu penyerapan hara dan mengatur sifat gel agar (dalam media padat) ( Katuuk,1989 ).
d. Kelembaban.
Faktor kelembaban relative humidity (RH) tidak banyak dibahas dalam kultur jaringan. Hal ini disebabkan oleh kondisi dalam botol kultur yang selalu lembab karena media. Namun demikian kelembaban di luar botol kultur juga perlu diperhatikan. Kondisi iklim dalam hal ini sangat berpengaruh terhadap kelembaban kultur. Untuk itu disarankan agar RH dalam ruang kultur berkisar 70% ( Katuuk,1989 ).
e. Wadah / botol kultur.
wadah. Besar kecilnya wadah tergantung pada jenis serta ukuran eksplan yang digunakan, dan fase perkembangan eksplan sehingga pemindahan eksplan ke botol yang lebih besar sangat diperlukan. Biasanya untuk eksplan yang berukuran kecil, pada permulaan pengkulturan dapat menggunakan tabung kultur yang berdiameter 1,5 cm, kemudian untuk pertumbuhan akar maka diameter tabung kultur dapat diganti menjadi 2,5 cm. Wadah kultur jaringan tidak hanya tergantung pada botol kultur buatan pabrik. Banyak macam wadah yang boleh dijadikan tempat kultur, antara lain: botol-botol bekas obat-obatan, jam, atau bekas bahan makanan lainnya. Biasanya wadah terbuat dari gelas adalah yang paling baik, karena dapat dengan mudah dicuci untuk digunakan lagi.
C. Glikosida Jantung
Glikosida jantung ditemukan dalam beberapa famili tumbuhan seperti Apocynaceae, Liliaceae, Moraceae, dan Ranunculaceae. Sumber niaga utama
kardenolida ialah genus Digitalis dan Strophantus. Digitalis mempunyai efek langsung pada jantung yaitu memberi kekuatan bila jantung melemah. Glikosida jantung biasanya mempunyai sifat peluruh air seni (diuretik) yang berakibat menurunkan tekanan darah dan mengobati bengkak. Keberadaan senyawa ini dalam tumbuhan mungkin memberi perlindungan kepada tumbuhan tersebut dari gangguan beberapa serangga ( Robinson, 1995 ).
dilakukan. Berdasarkan polaritasnya, glikosida jantung dapat diekstrak dengan menggunakan pelarut yang polar antara lain: etanol, etil asetat, campuran etanol dan air serta campuran etanol dan kloroform ( Samuelsson, 1999 ).
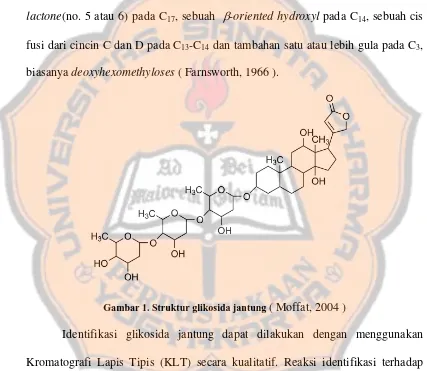
Glikosida jantung diklasifikasikan sebagai steroid (sterol), karena memiliki inti cyclopentanoperhydrophenanthrene, sebuah cincin ∝-β-unsaturated
lactone(no. 5 atau 6) pada C17, sebuah β-oriented hydroxyl pada C14, sebuah cis fusi dari cincin C dan D pada C13-C14 dan tambahan satu atau lebih gula pada C3, biasanya deoxyhexomethyloses ( Farnsworth, 1966 ).
Gambar 1. Struktur glikosida jantung ( Moffat, 2004 )
Identifikasi glikosida jantung dapat dilakukan dengan menggunakan Kromatografi Lapis Tipis (KLT) secara kualitatif. Reaksi identifikasi terhadap glikosida jantung dapat dilakukan menggunakan uji dengan pereaksi Baljet (2,4,6-trinitrophenol), uji dengan pereaksi Kedde (3,5-dinitrobenzoic acid), uji dengan
pereaksi Raymond (m-dinitrobenzene), uji dengan pereaksi Legal (sodium nitroprusside) dimana pereaksi tersebut akan bereaksi dengan grup methylene
memberikan warna oranye, ungu, biru, dan violet, yang menunjukkan adanya glikosida jantung ( Farnsworth, 1966 ).
Di dalam skrining fitokimia untuk glikosida jantung, uji pendahuluan yang positif pada ekstrak tanaman dengan menggunakan salah satu pereaksi yang dikonfirmasikan dengan pereaksi yang spesifik untuk tambahan 2 sisi reaktif (vide supra). Sebagai contoh , sebuah uji pendahuluan yang positif dengan pereaksi
Keller menunjukkan adanya gula deoksi. Ini harus diikuti dengan uji yang ke dua yaitu uji dengan pereaksi Liebermann, hasil positif, menunjukkan adanya inti steroid ( Shoppee, 1964 ).
D. Kromatografi Lapis Tipis
Kromatografi merupakan proses diferensiasi komponen-komponen cuplikan yang ditahan secara selektif oleh fase diam. Pada dasarnya semua kromatografi menggunakan dua fase yaitu fase diam dan fase gerak. Pemisahan-pemisahan tergantung pada gerakan relatif dari dua fase ini. Kromatografi dapat digolongkan berdasarkan sifat-sifat fase diam, yang dapat berupa zat padat atau zat cair. Apabila fase diam berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan, sedangkan untuk fase diam yang berupa cairan dikenal sebagai kromatografi partisi ( Sastrohamidjojo, 2001 ).
Fase diam yang digunakan dalam kromatografi lapis tipis adalah bahan penyerap atau adsorben ( Stahl, 1969 ). Zat penyerap merupakan lapisan tipis serbuk halus yang dilapiskan pada lempeng kaca, plastik atau logam secara merata, umumnya digunakan lempeng kaca. Dua sifat penting yang perlu diperhatikan dalam pemilihan bahan penyerap adalah ukuran partikel dan homogenitas partikel penyerap. Kedua sifat ini sangat berpengaruh pada gaya adhesi. Besar partikel yang biasa digunakan adalah 1-25 mikron. Fase diam yang umum dan paling banyak digunakan adalah silika gel yang dicampur dengan CaSO4 untuk menambah daya lengket partikel silika gel pada pendukung (pelat). Adsorben lain yang juga biasa digunakan adalah alumina, kieselguhr, celite, serbuk selulosa, serbuk poliamida, kanji dan sephadex ( Mulja dan Suharman, 1995 ). Fase diam yang digunakan untuk analisis secara kromatografi lapis tipis untuk glikosida jantung adalah silika gel GF 254 ( Wagner, 1984 ).
Fase gerak adalah medium angkut dan terdiri atas satu atau beberapa pelarut. Fase ini bergerak dalam fase diam karena adanya gaya kapiler. Fase gerak yang digunakan adalah pelarut bertingkat mutu analitik dan bila diperlukan sistem pelarut multi-komponen harus berupa campuran sesederhana mungkin terdiri atas maksimum tiga komponen ( Stahl, 1969 ). Pemilihan fase gerak untuk glikosida jantung ada beberapa macam alternatif, yaitu: etil asetat-metanol-air (100:13,5:10 v
Campuran yang dipisahkan berupa larutan yang ditotolkan berupa bercak. Setelah itu pelat atau lapisan dimasukkan ke dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak). Pemisahan terjadi selama pengembangan. Selanjutnya senyawa yang tidak berwarna harus dideteksi ( Stahl, 1969 ).
Identifikasi dari senyawa yang terpisah (bercak / noda) pada lapisan tipis dapat dilakukan dengan tanpa pereaksi kimia dan disemprot dengan reagen. Identifikasi senyawa glikosida jantung dapat dilakukan dengan tanpa pereaksi kimia yaitu dengan menggunakan sinar ultraviolet 254 dan 365 nm, sedangkan reagen penyemprot yang digunakan untuk identifikasi senyawa glikosida jantung adalah reagen Kedde, Legal, Baljet, Raymond, antimony (III) chloride, chloramine-trichloroacetic acid / CTA, sulphuric acid ( Wagner, 1984 ) dan
vanillin-phosporic acid ( Jork, et al., 1990 ).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan angka Rf atau hRf. Harga Rf didefinisikan sebagai perbandingan jarak antara senyawa dari titik awal dengan jarak tepi muka pelarut dari awal.
Rf =
an pengembang jarak
an pengembang awal
dari bercak jarak
dengan dua desimal. hRf adalah angka Rf dikalikan faktor 100 (h), menghasilkan nilai berkisar antara 0 – 100 ( Stahl, 1969 ).
E. Landasan Teori
Di dalam pencarian metode produksi kandungan obat dari tumbuhan, pendekatan kultur jaringan, potensial sebagai alternatif di dalam produksi metabolit-metabolit bioaktif tumbuhan untuk skala industri. Ide memperbanyak tanaman dengan jalan mengkulturkan bagian kecil jaringan atau organ berdasarkan teori totipotensi.
Pertumbuhan dan perkembangan tanaman dipengaruhi juga oleh zat pengatur tumbuh. Zat pengatur tumbuh yang digunakan dalam penelitian ini adalah 2,4-D (auksin) dengan tujuan untuk merangsang pertumbuhan kalus. Selain itu, 2,4-D juga berfungsi dalam perkembangan sel dengan menaikkan tekanan osmotik dan menurunkan tekanan dinding sel sehingga air dapat masuk ke dalam sel disertai kenaikkan volume sel.
Penelitian ini diharapkan dapat membuktikan bahwa daun kamboja jepang dapat tumbuh secara in vitro untuk menghasilkan kalus yang mengandung glikosida jantung yang sama dengan glikosida jantung pada daun tanaman asalnya.
F. Hipotesis
1. Daun tanaman kamboja jepang dapat membentuk kalus dengan penambahan zat pengatur tumbuh asam 2,4 Diklorofenoksiasetat pada media MS.
2. Kultur kalus yang dihasilkan melalui teknik kultur jaringan ini memiliki profil pertumbuhan sigmoidal, dimana pada fase stasionernya menghasilkan kandungan glikosida jantung yang optimum.
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian non eksperimental dengan
rancangan penelitian deskriptif yaitu tidak ada perlakuan atau manipulasi pada
subyek uji dan penelitian ini hanya bertujuan menunjukkan fakta yang ada.
B. Definisi Operasional
1. Daun yang digunakan sebagai eksplan dalam penelitian ini adalah daun
yang segar dan sehat, terletak pada nomor 3-5 dari ujung batang atau
cabang.
2. Waktu inisiasi adalah waktu yang dibutuhkan oleh eksplan untuk
membentuk kalus dihitung mulai dari saat penanaman eksplan sampai hari
pertama kalus mulai terbentuk berupa bintik putih dari tepi irisan daun
eksplan.
3. Subkultur adalah suatu kegiatan pemeliharaan kalus dengan memindahkan
kalus ke dalam media baru sehingga kalus tidak kekurangan nutrisi.
4. Bobot kalus basah awal adalah hasil pengurangan antara bobot botol +
media + kalus dengan bobot botol + media pada saat subkultur.
5. Bobot kalus basah akhir adalah bobot kalus yang ditimbang pada saat
pemanenan.
6. Bobot kalus kering adalah bobot kalus pada saat pemanenan dan sesudah
mengalami proses pengeringan dengan menggunakan oven pada suhu
40-500C, sampai diperoleh kalus dengan bobot konstan yaitu antara
penimbangan yang pertama dan berikutnya selama 1 jam tidak berbeda 0,5
mg.
7. Laju pertumbuhan kalus adalah laju pertumbuhan kalus yang ditandai
adanya pertambahan berat kalus dari waktu ke waktu dengan memanen
setiap 6 hari sekali sebanyak 6 botol selama 42 hari.
8. Profil pertumbuhan kalus adalah rasio antara pertumbuhan kalus ( bobot
kalus basah akhir- bobot kalus basah awal) dengan waktu pemanenan serta
rasio antara bobot kalus kering dengan waktu pemanenan.
9. Persen kadar air adalah rerata bobot kalus basah dikurangi dengan rerata
bobot kalus kering lalu dibagi dengan rerata bobot kalus basah dikali dengan
100%.
10. Konsentrasi zat pengatur tumbuh yaitu asam 2,4-Diklorofenoksiasetat yang
digunakan adalah 4 ppm 2,4-D yang terkandung dalam satu liter media.
C. Alat dan Bahan Penelitian 1. Alat penelitian
a. Alat yang digunakan dalam kultur jaringan tanaman:
1) Alat-alat gelas, Pyrex
2) Autoklaf, YX 400Z Shanghai Sanshen, Medical Inst, Co, LTD.
4) Pemanas listrik, Ika Combimag, RCT, German.
5) Timbangan analitik, Scaltec.
6) Glassfirn.
7) Magnetic stirrer.
8) Pinset.
9) Skapel.
10)Kertas pH indikator.
11)Kertas saring.
12)Laminar air flow.
13)Lampu UV.
14)Inkubator, Heraeus Tamson, Holland.
15)Botol kultur.
16)Aluminium foil,Heavy-Duty, Diamond-Wrap.
17)Referigerator, Sharp.
18)Sprayer.
19)Mortir & stamper.
b. Alat untuk penyarian : alat gelas (pyrex), kertas saring, dan waterbath
c. Alat untuk Kromatografi Lapis Tipis:
1) Bejana gelas.
2) Lempeng kaca.
3) Lemari asam.
4) Pipa kapiler.
6) Lampu TL Day Light” 20 watt.
7) Lampu UV 254 dan 365 nm.
2. Bahan Penelitian
a. Bahan eksplan : daun yang segar dan sehat terletak no. 3-5 dari ujung
batang atau cabang tanaman kamboja jepang diambil dari Fakultas
Farmasi Universitas Sanata Dharma, Dusun Paingan, Desa
Maguwohardjo, Kecamatan Depok, Kabupaten Sleman, Yogyakarta.
b. Bahan kimia
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah :
1) Agar, Mkr Chemicals.
2) Garam anorganik (makronutrien) yang terdiri dari :
a) Kalium nitrat, Merck, Germany.
b) Ammonium nitrat, GPR, BDH.
c) Kalsium dikloro dihidrat, Merck, Germany
d) Magnesium sulfat heptahidrat, Merck, Germany
e) Kalium dihigrogen fosfat, Merck, Germany.
3) Garam anorganik mikronutrien yang terdiri dari :
a) Mangan sulfat tetrahidrat, BDH limited Poole, England.
b) Seng sulfat heptahidrat, Merck, Germany.
c) Asam borat, GPR, BDH, Merch, Germany
d) Kalium iodide netral, Merck, Germany
e) Tembaga (II) sulfat pentahidrat, Bratako chemika, Bandung.
g) Kobalt (II) klorida heksahidrat, GPR, BDH.
h) Besi (II) sulfat heptahidrat, Merck, Germany
i) Natrium etilen diamin tetra asetat dihidrat, GPR,BDH, Merck,
Germany.
4) Vitamin dan asam amino yang terdiri dari:
a) Myo inositol, Biochemical, BDH, Merck, Germany.
b) Tiamin hidroklorida, Biochemical, BDH, Merck, Germany.
c) Asam nikotinat, BDH, Merck, Germany.
d) Piridoksin hidroklorida, Biochemical, BDH, Merck, Germany.
e) Glisin, Biochemical, BDH, Merck, Germany.
5) Sumber karbon : sukrosa, BDH, Merck, Germany.
6) Zat pengatur tumbuh : Asam 2,4-Diklorofenoksiasetat, GPR, BDH.
7) Desinfektan
a) Natrium hipoklorida, Bayclin, Johnson.
b) Alkohol 70% derajat kemurnian teknis.
c) Tween 80, Merck-Sohuchardt.
8) Akuades
c. Bahan untuk penyarian: Metanol (J.T. Baker, Germany) dan Kloroform
(J.T. Baker, Germany)
d. Kromatografi Lapis Tipis :
a) Metanol, J.T. Baker, Germany
b) Etil asetat, J.T. Baker, Germany.
d) Asam sulfat, Merck, Germany.
e) Silica-Gel GF 254, Merck, Germany.
D. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman kamboja jepang dilakukan di laboratorium Biologi
Fakultas Farmasi Universitas Sanata Dharma berdasarkan pustaka acuan
(Anonim, 2006).
2. Pembuatan stok
a. Pembuatan larutan stok hara mikro
Disiapkan gelas piala dengan volume 500 ml yang telah diisi akuades
300 ml. Mangan (II) sulfat tetrahidrat sebanyak 2,23 g, seng sulfat
heptahidrat sebanyak 0,86 g, asam borat sebanyak 0,62 g, kalium iodida
sebanyak 0,083 g, natrium molibdat dihidrat sebanyak 0,025 g, tembaga
(II) sulfat pentahidrat 0,0025 g, kobalt (II) klorida heksahidrat sebanyak
0,0025 g dimasukkan satu per satu ke dalam gelas piala tersebut, sambil
diaduk dengan menggunakan magnetic stirer hingga jernih. Kemudian
ditambahkan aquades hingga volume 500 ml. Perlu diperhatikan bahwa
tiap 1 liter media membutuhkan 5 ml stok hara mikro.
b. Pembuatan larutan stok besi
Stok untuk bahan ini terpisah dari unsur hara mikro lainnya, karena
komponen natrium etilen diamin tetra asetat dan besi (II) sulfat heptahidrat
kemudian dipanaskan. Disiapkan gelas piala dengan volume 500 ml yang
telah diisi akuades 300 ml. Besi (II) sulfat heptahidrat sebanyak 0,278 g
dan natrium etilen diamin tetra asetat dihidrat sebanyak 0,373 g
dimasukkan ke dalam gelas piala tersebut, lalu ditambahkan beberapa tetes
HCl sambil diaduk dengan menggunakan magnetis stirer hingga larut dan
agar cepat larut dibantu dengan pemanasan. Kemudian ditambahkan
akuades hingga volume 500 ml. Perlu diperhatikan bahwa satu liter media
dibutuhkan 5 ml larutan stok besi.
c. Pembuatan larutan stok vitamin dan asam amino
Dua ratus milliliter aquades dimasukkan ke dalam gelas piala dengan
volume 500 ml, kemudian asam nikotinat sebanyak 0,05 g, piridoksin
hidroklorida sebanyak 0,05 g, tiamin hidroklorida sebanyak 0,01 g dan
glisin sebanyak 0,2 g dimasukkan satu per satu ke dalam gelas piala
tersebut, sambil diaduk dengan menggunakan magnetic stirer hingga
jernih. Kemudian ditambahkan aquades hingga volume 500 ml. Perlu
diperhatikan bahwa satu liter media dibutuhkan 5 ml larutan stok vitamin
dan asam amino.
d. Pembuatan larutan stok myoinositol
Untuk membuat larutan myoinositol, diperlukan 10 g myoinositol yang
dilarutkan dalam 500 ml aquades dalam gelas piala sampai larut kemudian
akuades ditambahkan sampai volume 1 liter. Dalam membuat satu liter
e. Pembuatan larutan stok ZPT
ZPT yang digunakan adalah asam 2,4 Diklorofenoksiasetat. Untuk
membuat larutan stok 2,4-D (4 ppm), larutkan 2,4-D sebanyak 100 mg ke
dalam 2-5 ml etanol, panaskan sebentar lalu tambahkan 100 ml akuades.
Dalam membuat satu liter media dengan konsentrasi 2,4D sebesar 4 ppm
dibutuhkan larutan stok sebanyak 4 ml.
3. Pembuatan media
Media yang digunakan adalah media Murashige-Skoog. Pembuatannya
adalah sebagai berikut : mula-mula 500 ml akuades dipanaskan di dalam gelas
piala 1000 ml. Sambil terus diaduk, dimasukkan bahan-bahan anorganik
makro sesuai dengan komposisi yang ada (daftar terlampir). Setelah semua
hara makro larut, dimasukkan berturut-turut 5 ml larutan stok hara mikro, 5 ml
larutan stok besi-EDTA, 5 ml stok vitamin dan asam amino dan 10 ml stok
myoinositol. Sedikit demi sedikit dimasukkan campuran sukrosa 30 g dan agar
11 g sambil diaduk hingga larut. Sementara itu, ditambahkan juga akuades
sedikit demi sedikit untuk membantu kelarutan hingga volume mencapai 1000
ml. Campuran tersebut dipanaskan hingga mendidih dan berwarna jernih.
Setelah jernih, suhu pemanas diturunkan dan stok zat pengatur tumbuh
dimasukkan sesuai konsentrasi yang diinginkan. Setelah itu, dilakukan
pengaturan pH media 5,2 – 5,6. jika terlalu basa ditambahkan HCl encer dan
jika terlalu asam ditambahkan larutan KOH encer. Penyusutan air karena
pemanasan diatasi dengan penambahan akuades hingga 1000 ml kemudian
Botol yang berisi media kemudian ditutup menggunakan alumunium foil dan
disterilisasi dengan autoklaf pada suhu 1210 C selama 15 menit. Media yang
aman digunakan adalah media yang telah disimpan dalam inkubator selama
kurang lebih 1 minggu dan tidak tampak adanya pertumbuhan
mikroorganisme kontaminan seperti : jamur, dan bakteri.
4. Sterilisasi alat dan ruangan
a. Sterilisasi alat
Erlenmeyer yang berisi akuades dan gelas piala kosong ditutup dengan
alumuniumfoil. Cawan petri diisi kertas saring, skalpel, pinset yang
dibungkus dengan kertas payung semuanya dimasukkan dalam autoklaf
dan disterilkan pada temperatur 120 °C selama 20 menit.
b. Sterilisasi ruangan
Dinding- dinding ruangan penanaman eksplan dan Laminar Air Flow
(LAF) disterilkan dengan menggunakan alkohol 70 % atau spiritus.
Selanjutnya lampu UV baik yang ada di ruangan maupun di LAF
dinyalakan selama ± 2 jam.
5. Sterilisasi dan penanaman eksplan
a. Sterilisasi eksplan
Sebelum dimasukkan ke dalam LAF, eksplan berupa daun yang
diambil dari tanaman induk dicuci di bawah air keran yang mengalir
dengan diberi sedikit detergen untuk membersihkan kotoran yang melekat
di permukaan terluar eksplan Eksplan direndam-dikocok dalam larutan
akuades. Di dalam LAF eksplan juga disterilkan dengan direndam-dikocok
dalam larutan hipoklorit-Tween-80 selama 5 menit. Eksplan dibilas 3 kali
dengan air steril (air yang sudah disterilisasi dengan autoklaf). Eksplan
yang sudah dibilas dengan air steril ini sudah siap untuk ditanam.
b. Penanaman eksplan
Potongan eksplan yang akan ditanam yang sudah disterilkan
sebelumnya dimasukkan ke dalam media dengan sedikit ditekan untuk
memperbesar sudut kontak eksplan dengan permukaan media klutur.
Media yang telah ditanami, diinkubasikan dalam ruang inkubator dengan
suhu ruangan 18 °C serta disinari dengan lampu TL ”Day Light” 20 watt
dengan ketinggian 40 cm.
6. Pengamatan waktu inisiasi kalus
Waktu inisiasi kalus dihitung dari saat kalus mulai terbentuk. Karena
pertambahan bobot pertumbuhan kalus tidak dapat diamati, penentuan waktu
inisiasi kalus dilakukan secara visual yaitu mulai terlihatnya bintik putih pada
bagian pelukaan eksplan.
7. Subkultur
Subkultur dilakukan 36 hari setelah penanaman dimana tanaman telah
menampakkan gejala kurang nutrisi (berwarna kecoklatan) atau bobotnya
tidak bertambah. Pada proses subkultur, kalus dipecah menjadi bagian yang
lebih kecil kemudian ditanam lagi ke dalam media baru. Proses subkultur ini
dilakukan sebagai berikut, semua perlengkapan yang digunakan yaitu pinset,
berisi media yang telah diketahui beratnya dimasukkan kedalam laminar air
flow dan disterilkan selama ± 2 jam dengan lampu UV.
Media yang berisi kalus kemudian disemprot dengan alkohol 70%
kemudian dimasukkan ke dalam laminar air flow. Ketika botol akan dibuka
dan ditutup, maka dilakukan proses flambir. Kemudian ambil kalus dengan
pinset dan letakkan di atas cawan petri. Bersihkan kalus dari sisa-sisa eksplan
hingga bersih kemudian belah bagian kalus tersebut dan potong-potong
dengan menggunakan pertolongan skapel dan pinset dengan ukuran kalus
awal, yaitu 3 – 5 mm lalu ditanam dalam media yang baru secara aseptis.
Kalus yang telah ditanam tadi kemudian diinkubasikan di dalam ruang
inkubator dengan suhu ruangan 180C serta disinari dengan lampu TL “Day
Light” 20 watt dengan ketinggian 40 cm. Sub-kultur ini dibuat sebanyak 42
botol. Untuk mengetahui bobot kalus maka dilakukan penimbangan pada
media baru yang berisi kalus, selanjutnya bobot yang diperoleh dikurangkan
dengan bobot media awal sebelum ditanami kalus.
8. Pemanenan
Setelah dilakukan subkultur, tiap 6 (enam) hari sekali dilakukan
pemanenan sebanyak 6 (enam) buah botol yang berisi kalus lalu dibersihkan
dari sisa-sisa agar yang masih melekat. Setelah kalus bersih kemudian
dilakukan penimbangan dan akan mendapatkan bobot kalus basah. Kalus yang
telah dipanen kemudian dikeringkan pada suhu 40-500C hingga didapatkan
perbedaan bobot sebesar 0,5 mg bobot zat dari 2 penimbangan berurutan
yang konstan. Catat bobot kering kalus hasil setiap pemanenan. Kalus kering
yang diperoleh kemudian digerus dengan menggunakan mortir dan stamper .
Selanjutnya serbuk kalus yang diperoleh, disimpan di dalam flakon dan
dikumpulkan sebanyak ± 2 gram untuk dibuat ekstrak sehingga dapat
diketahui metabolit sekunder dalam kalus.
9. Analisis pertumbuhan kalus
Analisis pertumbuhan kalus dalam penelitian ini menggunakan dua cara,
yaitu :
a. Pembuatan grafik pola pertumbuhan kalus berdasarkan data penimbangan
bobot kalus basah dengan umur kalus.
Perhitungan bobot kalus basah tiap-tiap waktu tertentu yakni setiap 6
(enam) hari sekali. Pertambahan bobot kalus basah pada tiap-tiap waktu
pemanenan didapatkan dari penjumlahan dari tiap-tiap botol yang dipanen
pada hari yang sama. Analisis pertumbuhan kalus dilakukan dengan
menggunakan kurva sigmoid yang menyatakan hubungan antara umur
kalus dengan pertambahan bobot kalus basah ( pertumbuhan kalus )
sehingga diperoleh gambaran fase-fase pertumbuhan kalus. Rumus regresi
linier menurut Budiasmoro (2003) adalah sebagai berikut :
r = Δp/(Δh.p)
( )
( )
( )(
)
(
)
( )
2( )
22 p p n p.r p p r a Σ − Σ Σ Σ − Σ Σ =
( ) ( )( )
(
)
( )
2( )
2Persamaan kurva sigmoid menurut Budiasmoro (2003) adalah sebagai berikut :
b
e
b
N
a
a
Y
t xa N
−
+
=
− + ) ( . 1)
/
(
'
Y' = pertumbuhan sebagai fungsi umur kalus pada persamaan sigmoid
a = nilai intercept dari rumus regresi linier
b = nilai slope dari rumus regresi linier
N = data bukan nol yang terukur pertama kali
X = umur kalus
Untuk membuktikan bahwa kurva sigmoid yang dihasilkan dapat
mewakili profil pertumbuhan kalus dilakukan uji t terhadap nilai b dan
nilai pertumbuhan yang diperoleh dari persamaan kurva sigmoid.
Sy.x = 2 ) ' ( 2 − − n y y Sb =
∑
2 x Syx tb = Sb bSyx = simpangan relatif data penimbangan dengan hasil perhitungan kurva
sigmoid
Y = nilai pertumbuhan yang didapat dari selisih bobot akhir dan bobot
awal kalus
n = jumlah data
x = simpangan Y terhadap rerata Y
Sb = simpangan b
b = nilai slope persamaan sigmoid yang didapat dari hasil regresi linier
tb = nilai t hitung dari b yang akan dibandingkan dengan t tabel.
b. Pembuatan grafik pola pertumbuhan kalus berdasarkan data biomassanya
Kalus basah yang diperoleh dari setiap pemanenan kemudian
dikeringkan hingga bobotnya konstan dan ditimbang. Pertumbuhan kalus
dihitung berdasarkan persentase pertambahan bobot biomassa kalus.
Kemudian dibuatkan grafik pola pertumbuhan kalus, dengan
menghubungkan antara pertambahan bobot kalus kering dan umur kalus.
10.Pengeringan dan pembuatan serbuk daun kamboja jepang
Daun kamboja jepang dikeringkan di dalam oven pada suhu 40-500C.
Kemudian daun yang telah dikeringkan tersebut, digerus dengan
menggunakan mortir dan stamper. Serbuk daun yang diperoleh, disimpan di
dalam flakon.
11.Pembuatan ekstrak kalus daun kamboja jepang
Satu gram serbuk kalus daun kamboja jepang direfluks menggunakan 10
ml campuran kloroform-metanol (1:10 v/v), selama 10 menit. Larutan
didinginkan dan disaring, filtratnya diuapkan sampai kering. Residu yang
diperoleh dilarutkan dalam 2 ml kloroform-metanol (1:1 v/v) ( Dwiatmaka dan
Wulandari, 2005). Ekstrak yang ditotolkan pada plat KLT 30-50μl ( Wagner,
12. Pembuatan ekstrak daun kamboja jepang
Satu gram serbuk daun kamboja jepang direfluks menggunakan 10 ml
campuran kloroform-metanol (1:10 v/v), selama 10 menit. Larutan didinginkan
dan disaring, filtratnya diuapkan sampai kering. Residu yang diperoleh
dilarutkan dalam 2 ml kloroform-metanol (1:1 v/v) ( Dwiatmaka dan
Wulandari, 2005) . Ekstrak yang ditotolkan pada plat KLT 30-50μl ( Wagner,
et al., 1984 ).
13. Uji KLT ekstrak kalus daun kamboja jepang dan ekstrak daun tanaman asalnya.
Ekstrak kalus daun kamboja jepang dan ekstrak daun tanaman asalnya
ditotolkan pada lempeng KLT dengan menggunakan fase diam silica gel GF254
dan fase gerak berupa etil asetat – metanol - air (81 : 11 : 8 v/v) dengan jarak
pengembangan 10 cm. Deteksinya menggunakan sinar UV 254 dan 365 nm,
serta disemprot dengan dua macam pereaksi yaitu Kedde ( bercak diamati di
bawah sinar tampak) dan asam sulfat 97% ( lempeng dipanaskan pada suhu
1000C selama 3-5 menit, amati bercak di bawah sinar tampak) ( Wagner, et
al., 1984 ).
E. Analisis Hasil
Analisis waktu inisiasi kalus dilakukan secara visual sebagai munculnya
titik-titik tumbuh kalus yang berwarna putih kekuningan untuk yang pertama
kalinya pada eksplan dengan menggunakan rata-rata waktu inisiasi kalus.
Analisis pertumbuhan kalus di dalam penelitian ini menggunakan dua
1. Pembuatan grafik profil pertumbuhan kalus berdasarkan data penimbangan bobot kalus basah dengan umur kalus.
Pertumbuhan kalus diperoleh berdasarkan pertambahan bobot kalus basah
yakni dengan cara mengurangkan bobot kalus basah akhir dengan bobot kalus
basah awal. Kemudian data yang diperoleh dimasukkan ke dalam rumus
regresi linier untuk memperoleh nilai a ( intercept ) dan b ( slope ). Setelah itu,
nilai a dan b yang diperoleh, dimasukkan ke dalam persamaan kurva sigmoid
dan dibuat grafik pertumbuhan kalus dengan memplotkan umur kalus dengan
pertumbuhan kalus. Untuk mengamati apakah data dapat digambarkan dengan
kurva sigmoid dilakukan uji t dengan membandingkan nilai t hitung dengan t
tabel ( Budiasmoro, 2003 ).
2. Pembuatan grafik profil pertumbuhan kalus berdasarkan data biomassanya.
Data penimbangan bobot kalus basah yang diperoleh dari setiap
pemanenan kemudian dikeringkan hingga bobotnya konstan dan ditimbang.
Pertumbuhan kalus dihitung berdasarkan persentase pertambahan bobot
biomassa kalus. Kemudian dibuatkan grafik profil pertumbuhan kalus, dengan
menghubungkan antara pertambahan bobot kalus kering dan umur kalus. Data
profil pertumbuhan kalus berdasarkan biomassa kalus tersebut digunakan
sebagai data pendukung bagi profil pertumbuhan kalus berdasarkan
pertambahan bobot kalus basah.
Untuk mengetahui apakah dengan adanya penambahan zat pengatur
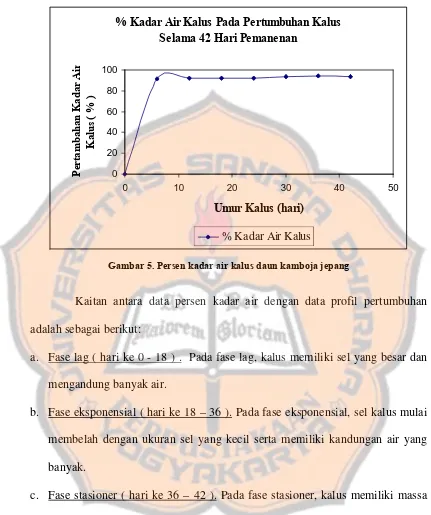
terkandung di dalam kalus maka diperlukan perhitungan persen kadar air. Persen
kadar air kalus dihitung dengan mengurangkan rerata bobot kalus basah akhir
dengan rerata bobot kalus kering dibagi dengan rerata bobot basah akhir dikali
100%.
Analisis kandungan kimia kalus, dalam hal ini glikosida jantung
dilakukan uji KLT dengan membandingkan bercak kalus kamboja jepang dengan
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi tanaman kamboja jepang dilakukan dengan mencocokkan tanaman kamboja jepang yang digunakan dalam penelitian dengan ciri-ciri morfologi tanaman kamboja jepang berdasarkan pustaka acuan ( Anonim, 2006 ). Berdasarkan hasil determinasi, diperoleh keterangan bahwa tanaman yang digunakan dalam penelitian ini adalah tanaman kamboja jepang ( Adenium obesum ( Forssk.) Roem & Schult) . Kamboja jepang yang dipergunakan dalam
penelitian ini termasuk dalam familia Apocynaceae ( Anonim, 2006 ).
B. Pemilihan Eksplan, Sterilisasi, dan Penanaman
Eksplan yang digunakan dalam penelitian ini adalah daun tanaman kamboja jepang. Bagian tanaman yang digunakan dalam penelitian ini adalah daun karena daun lebih mudah didapat daripada bagian tanaman yang lain dan daun memiliki jaringan parenkim yang akan berdediferensiasi yaitu proses perkembangan terbalik dari bagian tanaman atau organ tanaman menjadi sekelompok sel yang terus-menerus membelah berupa kalus dalam media tanam yang digunakan. Selain itu, di dalam proses pengkulturan mudah untuk disterilisasi.
Daun yang digunakan dalam penelitian ini adalah daun yang segar dan sehat, terletak nomor 3-5 dari ujung batang atau cabang karena pada bagian
tersebut masih banyak dijumpai jaringan meristem dan parenkim muda yang mempunyai sifat totipotensi sehingga dapat tumbuh dan berkembang menjadi kalus. Pada bagian ujung batang atau cabang, sel-sel daun masih terlalu muda dan tidak tahan terhadap sterilisasi secara kimiawi dengan menggunakan larutan hipoklorit-Tween 80. Campuran senyawa kimia tersebut menyebabkan kerusakan banyak jaringan daun sehingga gagal terbentuk kalus bahkan eksplan dapat mati. Sedangkan pada bagian pangkal batang atau cabang, sel-sel daun sudah tidak aktif membelah karena pada daun hanya memiliki sedikit jaringan meristem sehingga pembentukan kalus akan butuh waktu yang sangat lama.
Bagian tanaman yang digunakan dalam penelitian ini adalah daun karena pada penelitian terdahulu dilaporkan bahwa ekstrak dari daun tanaman Adenium obesum mengandung glikosida jantung yang memiliki efek sitotoksik yang berpotensi sebagai antikanker ( Nakamura et.al., 2000 ). Oleh karena itu, pada penelitian ini diharapkan kalus daun kamboja jepang juga mempunyai kandungan glikosida jantung yang sama dengan tanaman asalnya.
Media tanam dalam kultur jaringan adalah tempat untuk tumbuh eksplan. Media yang digunakan adalah Murashige-Skoog. Media tersebut mengandung berba