i
PEMROGRAMAN MATLAB
SKRIPSI
WAHAB ABDULLAH NIM 013224021
PROGRAM STUDI FISIKA
FAKULTAS MATEMATIKA dan ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA
ii
PEMROGRAMAN MATLAB
SKRIPSI
Telah diuji
pada tanggal : 20 juni 2006
PENGUJI TANDA TANGAN
1. Drs. Hainur Rasyid A, M.Si ……… NIP: 131 460 080
2. Drs. Madlazim, M.Si ………
NIP: 132 002 340
3. Drs. Supardiyono, M.Si ………
NIP: 132 002 340
Mengetahui Dekan FMIPA
Universitas Negeri Surabaya
iii
PEMROGRAMAN MATLAB
Telah layak untuk diuji / diseminarkan sebagai persyaratan mendapat Gelar Sarjana
WAHAB ABDULLAH 013224021
PEMBIMBING TANDA TANGAN
Untuk
Ayah dan ibu (yang tidak perlu membaca skripsi ini)
Adik-adikku (yang mungkin nanti perlu membacanya)
iv
MENGGUNAKAN BAHASA PEMROGRAMAN MATLAB
Wahab Abdullah ABSTRAK
Atom hidrogen merupakan atom yang paling sederhana. Hasil pemecahan persamaan Schrodinger untuk elektron atom hidrogen menghasilkan fungsi gelombang (orbital) yang bergantung pada jarak dari inti dan angular. Fungsi tersebut mengandung polinomial Legendre dan polinomial Laguerre. Dalam bahasa pemrograman Matlab tersedia fungsi khusus dari polinomial tersebut sehingga dapat digunakan untuk visualisasi orbital atom hidrogen. Hasil visualisasi menunjukkan bahwa ketergantungan orbital pada jarak dari inti ditentukan oleh bilangan kuantum utama n dan bilangan kuantum orbital l. Ketergantungan pada angular ditentukan oleh bilangan kuantum orbital l dan bilangan kuantum magnetik m. Untuk keadaan eksitasi pertama, bila ada gangguan medan listrik luar maka terjadi degenerasi nilai eigen energi yang dikenal dengan efek Stark orde pertama yang menyebabkan terjadinya polarisasi pada orbital.
v
secara tepat dan serentak, yang tidak terpengaruh oleh prinsip ketidakpastian
Heisenberg. Sholawat dan salam bagi Rasul-Nya (Muhammad SAW) yang diutus
untuk seluruh manusia, jin dan malaikat.
Skripsi ini ditulis untuk memenuhi sebagian syarat memperoleh gelar
sarjana sains bidang studi Fisika Fakultas Matematika dan Ilmu Pengetahuan
Alam Universitas Negeri Surabaya. Skripsi ini membahas sebagian dari sifat-sifat
orbital atom hidrogen dan visualisasinya menggunakan bahasa pemrograman
MATLAB.
Ucapan terima kasih sebesar-besarnya penulis tujukan kepada:
1. Orang tua dan saudara penulis atas segala dukungannya.
2. Drs. Supardiyono, M.Si selaku dosen pembimbing skripsi yang telah
membimbing penulis sehingga dapat menyelesaikan skripsi ini.
3. Drs. Hainur Rasyid Achmadi, M.S (selaku ketua jurusan Fisika) dan Drs.
Madlazim, M.Si selaku dosen penguji skripsi.
4. Dr. Budi Jatmiko, M.Pd selaku dekan FIMPA Universitas Negeri
Surabaya.
5. Bapak dan ibu dosen yang telah mentransfer pengetahuannya kepada
vi
7. Teman-teman jurusan fisika angkatan 2001 (Anyim, Eni, Ria, Tria, Feve,
Putri, Echi, Uut, Ummy, Widya, Mamiek, Nana, Fida, Anang, Seagate,
Ropeq, Jenny, Imam, Onie, Sitorus, Hendro, Supri dan teman-teman yang
pindah ke hati (jurusan) yang lain) atas segala obrolannya, ide-idenya dan
bantuannya.
Semoga skripsi ini dapat bermanfaat bagi penulis, pembaca dan semua
pihak pada umumnya.
Surabaya, Juni 2006
vii Nomor
Gambar Judul Gambar Halaman
2.1
Pola dari pemisahan Stark dari atom hidrogen pada eksitasi pertama n = 2. Empat garis tebal degenerasi terpisah sebagian oleh efek Stark.
13
3.1 Flowchart untuk program menampilkan grafik fungsi
radial dan probabilitasnya. 15
3.2 Flowchart untuk program harmonik bola. 16 3.3 Flowchart untuk program harmonik bola (lanjutan). 17 3.4 Flowchart untuk program ketergantungan harmonik
bola pada angular. 18
3.5 Flowchart untuk program orbital. 19
3.6 Flowchart untuk program efek Stark. 20 3.7 Beberapa sketsa distribusi |Ylm|
2 di bidang z-x dalam
diagram polar . 22
3.8 Representasi polar untuk nilai-nilai absolut dari fungsi
gelombang angular untuk orbital p dan s. 23 3.9 Fungsi gelombang radial dan distribusi probailitas atom
hydrogen. 23
3.10 Orbital pz dan px dalam 2D. 24
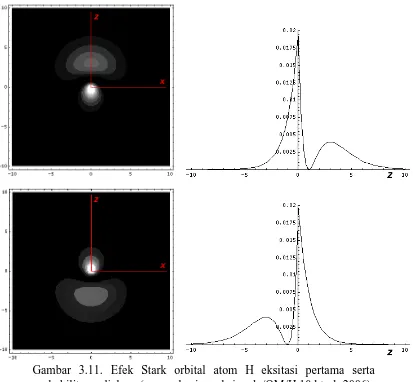
3.11 Efek Stark orbital atom H eksitasi pertama serta
probabilitas radialnya. 24
4.1 Tampilan menu program AtomHidrogen. 27 4.2 Tampilan menu program HarmonikBola. 27 4.3 Tampilan menu program FungsiAngular. 28 4.4 Tampilan menu program FungsiRadial. 29
4.5 Tampilan menu program orbital. 30
4.6 Tampilan menu program EfekStark. 30
4.7 Plot fungsi radial untuk N = 1, L = 0. 32 4.8 Plot fungsi radial untuk N = 2, L = 0. 33 4.9 Plot fungsi radial untuk N = 3, L = 0. 33 4.10 Fungsi gelombang radial atom hidrogen Rnl(r) untuk n
=1, 2 dan 3 dan l = 0 dan 1. 34
4.11 Plot kerapatan probabilitas radial untuk N =1, L=0. 35 4.12 Plot kerapatan probabilitas radial untuk N=2, L=0. 35 4.13 Plot kerapatan probabilitas radial untuk N=3, L=0. 36 4.14 Fungsi distribusi electron 4r
2[R
nl(r)]2 untuk atom
hidrogen 37
viii
4.22 Gambar pembanding untuk kuadrat amplitudoY(3, 1). 42 4.23 Plot kuadrat amplitudoY(3, 2) dalam diagram polar. 42 4.24 Gambar pembanding untuk kuadrat amplitudoY(3, 2). 42 4.25 Plot kuadrat amplitudoY(3, 3) dalam diagram polar. 43 4.26 Ketergantungan Y(0, 0) pada angular ( dan ) untuk
orbital s. 44
4.27 Gambar pembanding untuk orbital s. 44 4.28 Ketergantungan Y(1, 0) pada angular ( dan ). 44 4.29 Gambar pembanding untuk Orbital pz. 45
4.30 Orbital p (px). 47
4.31 Orbital 2d, terlihat seperti penggabungan dua orbital p. 48 4.32 Orbital atom hidrogen untuk N=1, L=0 dan M=0. 49 4.33
Orbital atom hidrogen untuk N=2, L=0 dan M=0. Terlihat bahwa jarak dari inti lebih lebar dari gambar 4.25.
49 4.34 Orbital atom hidrogen untuk N=1, L=1 dan M=1. 50 4.35 Gambar pembanding untuk orbital N = 1, L = 1 dan
M= 1. 50
4.36 Akibat adanya medan listrik terjadi polarisasi orbital
atom H. 51
4.37 Gambar pembanding untuk gambar 4.36. 51 4.38 Plot probabilitas radial untuk gambar 4.29. 52 4.39 Gambar pembanding untuk gambar 4.38. 52 4.40
Polarisasi orbital atom H akibat medan listrik. Energi orbital ini lebih rendah daripada orbital pada gambar 4.29.
ix Nomor
Lampiran Judul Lampiran Halaman
1 Harmonik bola untuk cos() dalam (0,1) ketika = 0 59
2 Listing program 60
3 Pemecahan persamaan Schrodinger untuk elektron
x
1. Halaman Pengesahan ……… ii
2. Halaman Persetujuan ……… iii
3. Abstrak ……… iv
4. Kata Pengantar ……… v
5. Daftar Gambar ……… vii
6. Daftar Lampiran ……… ix
7. Daftar Isi : ……… x
BAB I PENDAHULUHAN ……… 1
A. Latar Belakang Masalah ……… 1
B. Rumusan Masalah ……… 3
C. Tujuan Penelitian ……… 3
D. Manfaat Penelitian ……… 4
E. Batasan Masalah ……… 4
BAB II KAJIAN PUSTAKA ……… 5
A. Persamaan Scrhodinger Untuk Elektron Dalam Atom Hidrogen ……… 5
B. Solusi Persamaan Scrhodinger Untuk Elektron Dalam Atom Hidrogen ……… 7
C. Bilangan Kuantum ……… 8
xi
B. Pengujian Program ……… 21
C. Penerapan Program ……… 25
BAB IV HASIL dan PEMBAHASAN ……… 26
A. Program Komputer dan Pembahasan ……… 26
B. Pembahasan Secara Fisis ……… 31
C. Keunggulan dan Keterbatasan Program ……… 54
BAB V SIMPULAN dan SARAN ……… 56
8. Daftar Pustaka ……… 57
9. Lampiran Lampiran 1 ……… 59
Lampiran 2 ……… 60
PENDAHULUAN
A. Latar Belakang Masalah
Hidrogen, dengan hanya satu elektron, adalah sistem atom yang paling sederhana yang mungkin. Masalah dari struktur atom hidrogen adalah masalah yang paling penting dari struktur atom dan molekul, tidak hanya karena perlakuan teoritik dari atom ini lebih sederhana daripada atom-atom dan molekul-molekul yang lain, tetapi juga sebagai dasar bagi diskusi untuk banyak sistem atomik yang lebih kompleks (Pauling, 1935: 112). Sehingga masalah atom hidrogen umumnya menjadi materi wajib dalam buku teks maupun perkuliahan fisika modern dan fisika kuantum.
Walaupun fungsi gelombang untuk elektron atom hidrogen hasil pemecahan persamaan Schrodinger tidak mempunyai tafsiran fisis, tetapi kuadrat besaran mutlaknya yang dicari pada suatu tempat tertentu berbanding lurus dengan peluang (probabilitas) untuk mendapatkan elektron di tempat tersebut. Fungsi gelombang tersebut ada yang bergantung pada pada jarak dari inti yang disebut fungsi gelombang radial dan ada yang bergantung pada sudut angular yang disebut fungsi harmonik bola. Solusi lengkapnya adalah perkalian dari fungsi-fungsi tersebut. Tetapi bila fungsi besaran kuadrat dari fungsi-fungsi tersebut kita plot maka akan diperoleh hasil berupa visualisasi orbital atom dari atom hidrogen. Fungsi gelombang elektron atom hidrogen tersebut dikenal sebagai orbital.
pada atom hidrogen (efek Stark) sehingga fungsi gelombang ikut berubah. Pada keadaan dasar tidak terjadi degenerasi, tetapi pada keadaan eksitasi pertama terjadi degenerasi yang dikenal sebagai efek Stark orde pertama (linier di dalam medan
listrik ). Pada penelitian ini yang divisualisasikan hanya efek Stark pada atom
hidrogen pada keadaan eksitasi pertama.
Salah satu kesulitan dalam visualisasi orbital atom hidrogen adalah fungsinya mengandung polinom Legendre dan polinom Laguerre. Kesulitan ini dapat diatasi dengan komputasi menggunakan program Matlab yang menyediakan fungsi khusus Legendre dan Laguerre. Telah ada yang membuat program komputer untuk memvisualisasikan orbital atom hidrogen antara lain buatan Kevin Chu dengan bahasa pemrograman Matlab yang menampilkan plot 3D dari pemecahan persamaan Schrodinger yang telah diketahui untuk orbital 1s, 2s, 2p_z, 3d_z2 dan 3d_xy dan plot
fungsi dan probabilitas radialnya (Chu, 2005). Program dalam matlab yang lain adalah buatan L. Kocbach yang menampilkan fungsi radial dan fungsi probabilitas radial serta plot masing-masing (Kocbach, 2005). Ada juga dalam bahasa Maple buatan Takeuchi yang mendemonstrasikan gambaran 3D dari berbagai variasi orbital atom hidrogen atau probabilitas dari densitas kemungkinan keberadaan elektron (Takeuchi, 2005).
radial serta plot 3D beberapa orbital (Lindblad, 2005). Yang menarik dari program ini adalah control window dan menunya dan banyaknya gejala fisis yang ditampilkan.
B. Rumusan Masalah
Dari latar belakang di atas, maka dirumuskan masalah:
1. Bagaimana membuat program komputer yang dapat memplot orbital atom hidrogen (baik fungsi radial, probabilitas radial maupun fungsi harmonik bola dan ketergantungannya terhadap sudut angular) dan orbital atom hidrogen pada keadaan eksitasi pertama akibat efek Stark dengan bahasa pemrograman Matlab. 2. Bagaimana hasil plot program komputer tersebut di atas.
C. Tujuan Penelitian
1. Membuat program komputer (hasil modifikasi program buatan Goran Lindbald) yang dapat memplot orbital atom hidrogen (baik fungsi radial, probabilitas radial maupun fungsi harmonik bola dan ketergantungannya terhadap sudut angular) dan orbital atom hidrogen pada keadaan eksitasi pertama akibat efek Stark dengan bahasa pemrograman Matlab.
1. Mengetahui plot orbital atom hidrogen (baik fungsi radial, probabilitas radial maupun fungsi harmonik bola dan ketergantungannya terhadap sudut angular) dan orbital atom hidrogen pada keadaan eksitasi pertama akibat efek Stark.
2. Menambah pengetahuan tentang atom hidrogen, karena dengan adanya visualisasi ini maka akan menambah tafsiran fisisnya.
3. Dapat digunakan untuk membuat media pembelajaran dalam perkuliahan fisika modern dan fisika kuantum.
E. Batasan Masalah
1. Yang divisualisasikan adalah orbital atom hidrogen (baik fungsi radial, probabilitas radial maupun fungsi harmonik bola dan ketergantungannya terhadap sudut angular) dan orbital atom hidrogen pada keadaan eksitasi pertama akibat efek Stark dengan bahasa pemrograman Matlab.
BAB II
KAJIAN PUSTAKA
A. Persamaan Scrhodinger Untuk Elektron Dalam Atom Hidrogen
Sebuah atom hidrogen terdiri dari sebuah proton (partikel bermuatan +e) dan sebuah elektron (partikel bermuatan –e) yang 1836 kali lebih ringan dari proton. Dalam pembahasan di sini proton dianggap diam di pusat koordinat dan elektron bergerak mengelilinginya dibawah pengaruh medan atau gaya Coulumb. Pendekatan lebih baik dilakukan dengan memandang kedua partikel berotasi di sekitar pusat massa bersama yang berada (sedikit) di dekat proton, tetapi efek ini diabaikan (Purwanto, 1997:115). Persamaan Scrhodinger untuk elektron dalam tiga dimensi yang harus dipakai untuk persoalan atom hidrogen adalah (Beiser, 1992: 204)
0dengan me adalah massa elektron. Energi potensial V ialah energi potensial listrik
dari suatu muatan –e pada jarak r dari muatan +e
Mengingat sistem mempunyai simetri bola, analisis menjadi lebih sederhana bila persamaan Schrodinger dinyatakan dalam koordinat bola sehingga pers. (1) menjadi (setelah mensubstitusikan pers.(2))
0
Persamaan (3) dapat dipisahkan menjadi tiga persamaan yang bebas, masing-masing hanya mengandung satu koordinat saja. Fungsi gelombang (r,,) mengambil bentuk perkalian tiga fungsi yang berbeda
r, , R r (4)
Fungsi R(r) memerikan bagaimana fungsi gelombang elektron berubah sepanjang vektor jari-jari dari inti, dengan dan konstan. Fungsi ()
memerikan bagaimana fungsi gelombang elektron berubah terhadap sudut zenit sepanjang meridian pada bola yang berpusat pada inti, dengan r dan konstan. Fungsi () memerikan bagaimana fungsi gelombang elektron berubah terhadap sudut azimut sepanjang garis pada bola yang berpusat pada inti, dengan r dan konstan (Beiser,1992: 207).
Hasil pemisahan variabel dari persamaan (3) adalah:
B. Solusi Persamaan Scrhodinger Untuk Elektron Dalam Atom Hidrogen Solusi dari persamaan (5) adalah
2 im im
m Ae Ae (8)
dengan A adalah konstanta normalisasi yang besarnya 1/ 2 . Solusi dari persamaan (6) adalah
lm
NlmPlm
cos
(9)
m l
P ditentukan dengan rumus Rodrigues untuk polinom Legendre
l(Boass, 1982:505)
Nlm adalah konstanta normalisasi yang besarnya
(Yariv, 1982:66) Fungsi yang berhubungan angular total adalah harmonik bola yaitu
m m l
Y , 1 (12)
dengan Ylm
1m
Ylm* (Gate, 1989:17). Solusi dari persamaan (7) adalah
/2 21
Nnl adalah konstanta normalisasi yang besarnya
Besar adalah
L adalah polinom Laguerre terasosiasi yang dapat ditentukan dengan rumus
L
xLp(x) ditentukan dengan rumus
p x(Boass, 1982:533)
Jadi solusi lengkap persamaan fungsi gelombang elektron atom hidrogen adalah
nlm r, , Rnl r Ylm , (17)
Jika elektron dijelaskan oleh salah satu fungsi gelombang ini, dikatakan bahwa elektron itu menempati orbital tersebut. Jadi, elektron yang digambarkan oleh fungsi gelombang 100 disebut menempati orbital dengan n=1, l=0, dan m=0.
C. Bilangan Kuantum
sudut elektron terhadap inti L l
l1 , dan bilangan m menentukan arah momentum sudut Lz m.Biasanya keadaan momentum sudut orbital diberi nama dengan huruf s untuk
l = 0, p untuk l = 1, d untuk l = 2, f untuk l = 3, g untuk l = 4 dan seterusnya.
D. Peluang Mendapatkan Elektron
Peluang mendapatkan elektron pada titik r, , berbanding lurus dengan 2
dengan 2 R222. Peluang untuk mendapatkan elektron atom hidrogen
E. Efek Stark Dalam Atom Hidrogen
Sebelum membahas efek Stark, perlu diketahui dulu tentang teori gangguan (perturbation theory). Alasan adanya teori gangguan adalah bahwa pada level terendah dari (solusi) aproksimasi, dapat diketahui bagaimana pergeseran energi dan bagaimana fungsi eigen berubah akibat perubahan potensial.
Nilai eigen dan set lengkapdari fungsi eigen ternormalisasi untuk Hamiltonian (tanpa gangguan) Ho
Adanya gangguan mengakibatkan
Ho H1
n Enn (20)(Gasiorowicz, 2003: 174) Solusinya memberikan (untuk pergeseran orde pertama)
Jika H1 hanya tergantung pada r, maka
r r r (Gasiorowicz, 2003: 175) Lebih jauh, persamaan pergeseran orde pertama
(Gasiorowicz, 2003: 175)
Aplikasi teori gangguan pada masalah yang nyata adalah efek Stark pada atom hidrogen. Efek Stark merupakan peristiwa pergeseran tingkat energi atom hidrogen sebagai akibat gangguan medan listrik yang lemah dan serba sama pada atom tersebut (Tjia, 1999:93). Hamiltonian tidak terganggu
yang fungsi eigennya nlm
r . Potensial pengganggu ze e
H
1 r (25)
(Gasiorowicz, 2003: 180)
di mana adalah medan listrik. Pergeseran energi dari keadaan dasar yang mana tidak terdegenerasi diberikan oleh
e z e
d r
r zE1001 100 100 3 100 2 (26) (Gasiorowicz, 2003: 180)
Integral ini lenyap karena kuadrat dari fungsi gelombang selalu berupa fungsi genap sedang potensial pengganggu adalah fungsi ganjil. Jadi (26) menunjukkan tidak adanya pergeseran energi untuk keadaan dasar yang linier di dalam medan listrik.
Sebagai contoh untuk mengilustrasikan teori gangguan degenerasi adalah efek Stark pada keadaan eksitasi pertama (n = 2). Untuk sistem yang tak terganggu ada empat keadaan n = 2 yang energinya sama yaitu 200, 211, 210 dan2,1,1. Fungsi dengan l=0 mempunyai paritas genap dan l=1 mempunyai paritas ganjil. Kita ingin memecahkan persamaan mirip pers. (23). Karena potensial pengganggu dalam z maka ini hanya berhubungan dengan nilai-m yang sama, adanya paritas membuat potensial pengganggu berhubungan dengan suku l=1 hingga l=0, yaitu
0
1 , 1 , 2 1 , 1 ,
2
z (27)
Elemen-elemen diagonal adalah nol, karena paritas, dan elemen-elemen diagonal yang lain sebanding, karena mereka adalah konjugat kompleks satu sama lain, dan masing-masing boleh dipilih menjadi real. Kita punya
(Gasiorowicz, 2003: 182) dan kemudian pers. (28) menjadi
(Gasiorowicz, 2003: 183) Nilai eigen darinya adalah
o
a e
E1 3 (31)
dan keadaan eigen yang berkorespondensi ketika dinormalisasi adalah
(Gasiorowicz, 2003: 183)
m = 0
m = +1
m = 0
200 210
2 1
200 210
2 1
1 , 1 ,
2
4 degenerasi keadaan n = 2
BAB III
METODE PENELITIAN
Secara garis besar metode penelitian ini ada tiga tahap, yaitu modifikasi program komputer buatan Goran Lindblad, pengujian program tersebut dan penerapan program.
A. Modifikasi Program
Modifikasi-modifikasi program antara lain sebagai berikut:
1. Tampilan menu yang berbahasa Indonesia untuk memudahkan pengguna. 2. Keterangan – keterangan pada m-file berbahasa Indonesia untuk memudahkan
pengembangan lebih lanjut dan penerapan pada program yang lain (karena tampilan menunya yang menarik).
3. Untuk program fungsi radial dan distribusi probabilitasnya, masukannya bilangan kuantum utama N dan orbital M, tidak lagi N saja.
4. Untuk program plot 3D atau ketergantungan harmonik bola pada angular, masukannya tidak lagi L, tetapi L dan M (bilangan kuantum magnetik).
5. Membuat program untuk efek Stark pada atom hidrogen pada keadaan eksitasi pertama (program ini tidak ada pada program buatan Goran Lindblad). Untuk polt orbitalnya, dibuat berdasarkan program buatan Goran Lindblad sedangkan plot probabilitas radialnya berdasarkan program buatan Kevin Chu.
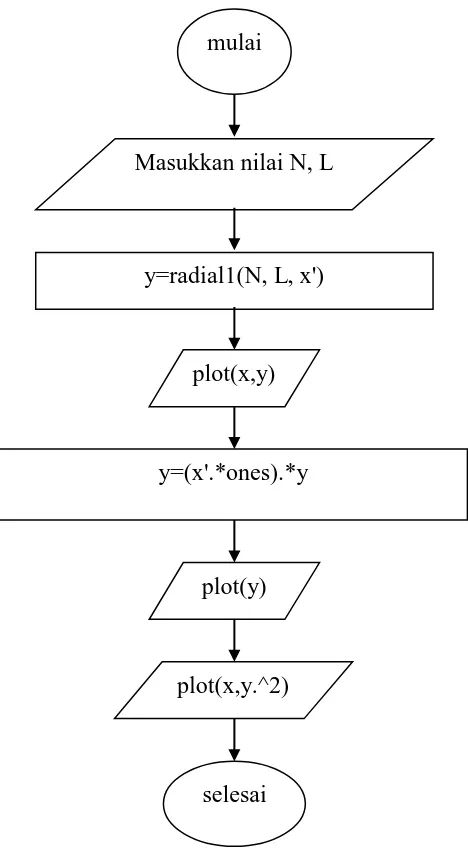
mulai
Masukkan nilai N, L
y=radial1(N, L, x')
plot(x,y)
selesai y=(x'.*ones).*y
plot(y)
plot(x,y.^2)
Gambar 3.1. Flowchart untuk program menampilkan grafik fungsi radial dan probabilitasnya.
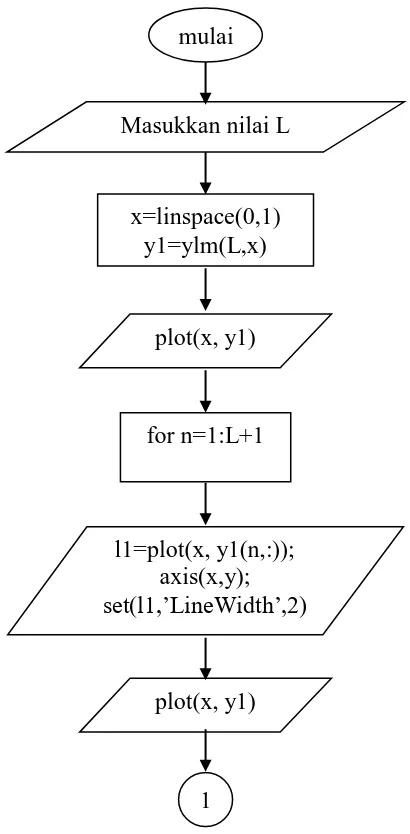
mulai
Masukkan nilai L
x=linspace(0,1) y1=ylm(L,x)
plot(x, y1)
for n=1:L+1
l1=plot(x, y1(n,:)); axis(x,y);
set(l1,’LineWidth’,2)
plot(x, y1)
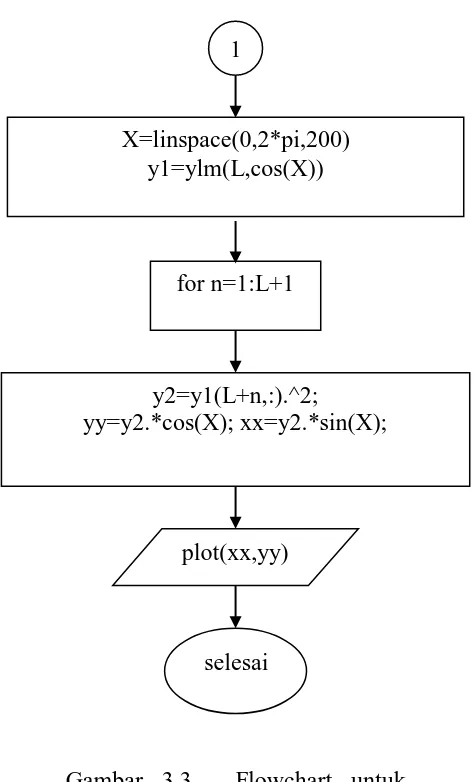
1
X=linspace(0,2*pi,200) y1=ylm(L,cos(X))
for n=1:L+1
selesai y2=y1(L+n,:).^2;
yy=y2.*cos(X); xx=y2.*sin(X);
plot(xx,yy)
Gambar 3.3. Flowchart untuk program harmonik bola (lanjutan).
mulai
Masukkan nilai L, M
theta=pi*linspace(0,1,60); phi=2*pi*linspace(0,1,90); sph=ylm(L,cos(theta));
sph=sph(L+M+1,:); dd=abs(sph' * cos(M*phi));
norm=max(max(dd)); dd=dd/norm;
X=dd.*(sin(theta)'*cos(phi)); Y=dd.*(sin(theta)'*sin(phi)); Z=dd.*(cos(theta)'*ones(size(phi)));
selesai mesh(X,Y,Z)
mulai
Masukkan nilai N, L, M
w=hydrogen(N,L,M,x,y); mm=max(max(abs(w)));
w=30*w./mm;
selesai surf(x,y,w)
mulai
Masukkan nilai N1, L1, M1, N2, L2, M2
w1=hydrogen(N1,L1,M1,x,y); w2=hydrogen(N2,L2,M2,x,y); mm1=max(max(abs(w1))); mm2=max(max(abs(w2))); w1=30*w1./mm1;
w2=30*w2./mm2;
w=((1/sqrt(2))*(asinh(w1)-asinh(w2))).^2;
selesai surf(x,y,w)
Gambar 3.6. Flowchart untuk program efek Stark. a0=1;
r=1/a0 * [-10:0.01:0];
psi_20=((1/(2*a0))^1.5) * (2+r).*exp(r/2); psi_21=(1/sqrt(3))*((1/(2*a0))^1.5)*r.*exp(r/2); psi_1=(1/sqrt(2))*(psi_20 - psi_21);
r1=1/a0 * [0:0.01:10];
psi_20=((1/(2*a0))^1.5) * (2-r1).*exp(-r1/2); psi_21=(1/sqrt(3))*((1/(2*a0))^1.5)*r1.*exp(-r1/2); psi_2=(1/sqrt(2))*(psi_20 - psi_21);
B. Pengujian Program
Untuk mengetahui benar atau tidaknya program yang dihasilkan dalam penelitian ini perlu diadakan pengujian. Pengujian untuk program hasil modifikasi dilakukan dengan membandingkan gambar hasil program dengan gambar hasil program aslinya, selain itu juga dibandingkan dengan gambar-gambar yang relevan yang ada pada buku-buku teks. Di dalam buku teks hanya ada beberapa gambar plot orbital untuk state-state tertentu, sehingga gambar hasil program yang diuji juga untuk gambar-gambar tertentu. Meskipun demikian, bila terjadi kecocokan antara gambar hasil program dan gambar pada buku teks maka dianggap program ini benar dan bisa diterapkan.
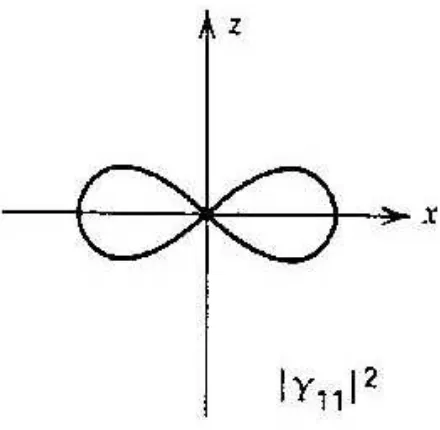
Gambar 3.7. Beberapa sketsa distribusi |Ylm|2 di bidang z-x dalam diagram polar (Gasiorowicz, 2003: 141).
Gambar 3.8. Representasi polar untuk nilai-nilai absolut dari fungsi gelombang angular untuk orbital p dan s (Pauling, 1935:150).
C. Penerapan Program
26 BAB IV
HASIL DAN PEMBAHASAN
Secara garis besar hasil penelitian ini ada dua macam, yaitu program komputer dalam bahasa MATLAB dan hasil terapan program komputer tersebut. Pembahasan juga ada dua macam, yaitu pembahasan program komputer dan pembahasan hasil terapan program secara fisis. Dibahas juga keunggulan dan keterbatasan program hasil penelitian.
A. Program Komputer dan Pembahasan
Pada penelitian ini dihasilkan 19 file-file program yang dapat dilihat pada lampiran 2. File-file tersebut merupakan modifikasi dari file-file buatan Goran Lindblad dan satu file tambahan untuk menampilkan orbital atom hidrogen pada eksitasi pertama di dalam medan listrik (efek Stark). Berikut akan dibahas beberapa file.
1. File AtomHidrogen.m
File ini adalah menu untuk program-program beberapa eigenstate (keadaan eigen) atom hidrogen. Dengan file ini kita dapat memanggil file-file:
HarmonilBola.m (tombol “Harmonik Bola”), FungsiAngular.m (tombol “Orbital
Atom 3D”), FungsiRadial.m (tombol “Fungsi Gelombang Radial”), orbital.m
(tombol “Orbital Atom 2D”) dan file EfekStark.m (tombol “EfekStark”). File
AtomHidrogen.m ini juga dilengkapi dengan tombol ”BERHENTI” untuk keluar
Gambar 4.1. Tampilan menu program AtomHidrogen.m.
Gambar 4.2. Tampilan menu program HarmonikBola.m. 2. File HarmonikBola.m
Gambar 4.3. Tampilan menu program FungsiAngular.m. 3. File FungsiAngular.m
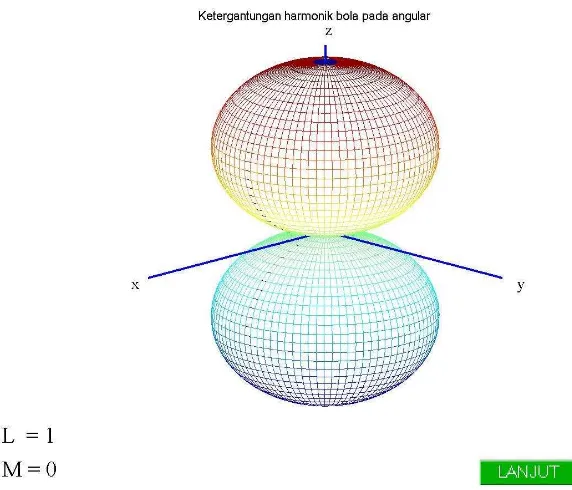
File ini menampilkan ketergantungan harmonik bola pada angular dengan masukan bilangan kuantum angular (orbital) L dan bilangan kuantum magnetik M. Besaran yang ditampilkan adalah nilai absolut dari bagian real dari fungsi
Ylm(,). File ini menggunakan fungsi file ylm.m. Dalam file aslinya (buatan Goran Lindblad), masukanya berupa L saja, jadi file tersebut menampilkan nilai absolut Ylm(,) secara beruntun dan otomatis untuk nilai M = 0 hingga M = L sehingga lebih sulit dalam penyimpanan gambar serta harus menunggu untuk memperoleh gambar yang kita inginkan.
4. File FungsiRadial.m
Gambar 4.4. Tampilan menu program FungsiRadial.m.
menggunakan algoritma dalam fungsi file radial1.m dan laguerre.m. Masukan file ini adalah bilangan kuantum utama N dan bilangan kuantum orbital L. Berbeda dengan file aslinya yang menampilkan seluruh fungsi gelombang radial untuk N dengan L = 0 hingga L = N - 1 dalam satu grafik sehungga sulit untuk mengidentifikasi mana plot fungsi gelombang radial untuk N = 4 dan L = 2 misalnya, karena ada 4 plot (yaitu untuk M = 4 dan L = 0, 1, 2 dan 3).
5. File orbital.m
Gambar 4.5. Tampilan menu program orbital.m.
Gambar 4.6. Tampilan menu program EfekStark.m. 6. File EfekStark.m
B. Pembahasan Secara Fisis
Berikut akan dibahas tentang keadaan normal atom hidrogen, fungsi gelombang radial atom hidrogen, ketergantungan fungsi gelombang pada pada sudut dan , orbital s, p dan d serta efek Stark untuk n = 2.
1. Keadaan normal dari atom hidrogen
Sifat-sifat dari atom hidrogen pada keadaan normalnya (n = 1, l = 0, m = 0) diterangkan oleh fungsi gelombang (gambar 4.7)
o
Orbital pada keadaan ini disebut juga orbital 1s. Interpretasi fisis mempostulatkan untuk fungsi gelombang membutuhkan
o
sebagai fungsi distribusi probabilitas untuk elektron relatif terhadap inti. Karena ekspresi ini bebas dari dan , atom hidrogen normal adalah simetri bola. Simetri bola ini merupakan sifat yang tidak diajukan oleh atom Bohr normal, untuk orbit Bohr dibatasi ke sebuah bidang tunggal (single plane) (Pauling, 1935: 139).
Dengan menggunakan
r dr r R dr 2 2P
diperoleh fungsi distribusi radial
r aoProbabibilitas yang mana elektron tetap di sekitar o
1A dari inti adalah besar,
Gambar 4.7. Plot fungsi radial untuk N = 1, L = 0.
Bohr. Jarak yang paling mungkin dari elektron terhadap inti, yaitu nilai r pada
P(r) saat nilai maksimum adalah tepat jari-jari orbit Bohr normal ao untuk hidrogen (Pauling, 1935: 140).
Fungsi 2 100
mempunyai nilai maksimum pada r = 0, menunjukkan bahwa
posisi paling mungkin untuk elektron adalah dekat inti, maka dari itu kesempatan elektron tinggal di dalam volume kecil sangat dekat inti adalah lebih besar daripada kesempatan elektron tersebut tinggal di elemen volume dengan ukuran yang sama pada jarak yang lebih besar dari inti (Pauling, 1935: 141).
2. Fungsi gelombang radial atom hidrogen
Gambar 4.8. Plot fungsi radial untuk N = 2, L = 0.
Gambar 4.10. Fungsi gelombang radial atom hidrogen Rnl(r) untuk n =1, 2 dan 3 dan l = 0 dan 1 (Pauling, 1935: 142).
Pada plot fungsi radial di atas sumbu horisontal merepresentasikan nilai r, oleh karena itu skala horisontal harus ditingkatkan dengan faktor n dengan tujuan untuk menunjukkan R(r) sebagai fungsi jarak elektron-inti r.
Gambar 4.10 berikut merupakan gambar pembanding dari gambar 4.7 hingga gambar 4.9 di atas. Terlihat bahwa antara gambar hasil program dengan gambar yang ada di buku teks terdapat kecocokan. Dengan demikian program file FungsiRadial.m untuk plot fungsi radial benar dan dapat dipakai.
Fungsi distribusi radial
2 2nl
P r r Rnl r
yang direpresentasikan dari fungsi
Gambar 4.13. Plot kerapatan probabilitas radial untuk N=3, L=0.
Dari gambar 4.11 hingga gambar 4.13 dengan melihat puncak-puncak gelombang dari plot di atas (denga l = 0 untuk n = 1 ada satu puncak, untuk n = 2 ada dua puncak dan untuk n = 3 ada tiga puncak) kita boleh mengatakan bahwa selama waktu satu periode elektron mungkin dipertimbangkan, pada keadaan normal (n = 1, l = 0) membentuk sebuah bola sekitar inti, pada keadaan 2s (n = 2,
l = 0) membentuk sebuah bola dan sebuah lapisan yang lebih luar, pada keadaan 3s (n = 3, l = 0) membentuk sebuah bola dan dua lapisan yang terpusat demikian seterusnya (Pauling, 1935: 143).
Gambar 4.14. Fungsi distribusi electron 4r2[Rnl(r)]2 untuk atom hidrogen (Pauling, 1935: 143).
program file FungsiAngular.m untuk plot probabilitas radial benar dan dapat dipakai.
3. Ketergantungan fungsi gelombang pada sudut dan
Fungsi gelombang dengan nilai l yang sama dan nilai m yang berbeda merepresentasikan keadaan-keadaan dengan momentum angular yang sama tetapi dengan orientasi-orientasi yang berbeda dalam ruang.
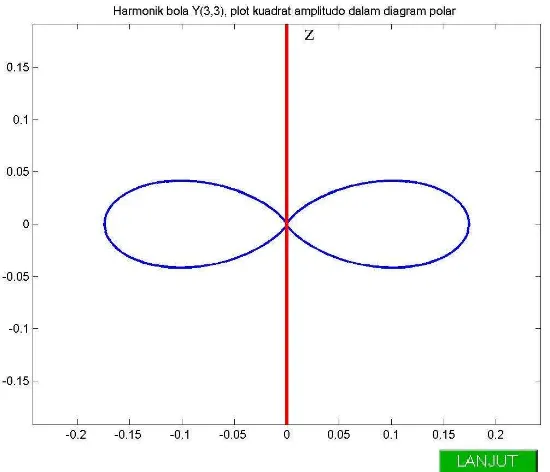
Gambar 4.19. Plot kuadrat amplitudoY(3, 3) dalam diagram polar.
Dari gambar-gambar harmonik bola di atas terlihat bahwa l meningkatkan fungsi distribusi probabilitas menjadi lebih terkonsentrasi sekitar bidang xy
(Pauling, 1923: 147). Hal tersebut ditunjukkan oleh sumbu horisontalnya yang semakin melebar. Hal ini karena besar momentum sudut yang dimiliki elektron semakin besar ketika l makin besar. Terlihat pula bahwa untuk selain l = 0, probabilitas dekat inti adalah kecil, ini alibat efek sentrifugal (adanya momentum sudut) yang menjauhkan elektron dari inti.
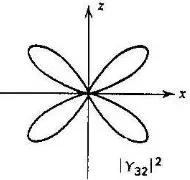
Gambar 4.23. Plot kuadrat amplitudoY(3, 2) dalam diagram polar. Gambar 4.22. Gambar pembanding untuk kuadrat amplitudoY(3, 1). .
Gambar 4.25. Plot kuadrat amplitudoY(3, 3) dalam diagram polar.
Terlihat dari plot-plot kuadrat harmonik bola di atas, bahwa m menentukan arah dari momentum sudut elektron, untuk l yang sama, semakin besar m fungsi distribusi semakin menjauh dari sumbu z.
Dengan melihat gambar hasil program file HarmonikBola.m dengan gambar yang ada pada buku teks, terlihat adanya kecocokan sehingga program file tersebut dapat benar dan dapat diterapkan atau digunakan.
Gambar 4.28. Ketergantungan Y(1, 0) pada angular ( dan ). Gambar 4.26. Ketergantungan Y(0, 0) pada angular ( dan ) untuk orbital s.
Gambar 4.29. Gambar pembanding untuk Orbital pz.
Yang diamati dari gambar 4.26 dan gambar 4.28 hanyalah “tumpahan”
distribusi elektron, dengan distribusi ruang yang diberikan oleh probabilitas 2, kita tidak mungkin mengamati secara langsung gerak elektron di dalam atom hidrogen (Krane,1992: 280).
Dari perbandingan gambar hasil program FungsiAngular.m dengan gambar dari buku teks terlihat adanya kecocokan sehingga program tersebut benar dan dapat digunakan.
4. Orbital s
Kurva rapat elektron untuk orbital 2s mengungkapkan dua daerah dengan rapat elektron tinggi yang terpisah oleh titik nol (gambar 4.12). Titik nol ini disebut simpul, dan menyatakan daerah dalam ruang yang kebolehjadian menemukan sebuah elektron sangat kecil. Semua orbital kecuali orbital 1s
5. Orbital p
Sebuah elektron p mempunyai momentum sudut (dengan besaran 2), dan momentum ini mempunyai efek yang besar pada bentuk fungsi gelombang di dekat inti: orbital p mempunyai amplitudo nol pada r = 0. Hal ini dapat dipahami secara klasik, berkenaan dengan efek sentrifugal momentum sudut, yang menjauhkan elektron itu dari intinya. Hal ini juga merupakan sesuatu yang kita duga dari bentuk energi potensial efektif, yang naik sampai tak terhingga ketika r
menuju nol dan mengeluarkan fungsi gelombang dari inti.
Efek sentrifugal yang sama, tampak pada semua orbital dengan l > 0, konsekuensinya amplitudo nol pada inti sehingga peluang menemukan elektron pada inti adalah nol (Atkins, 1994: 387). Setiap orbital p mempunyai dua cuping yang terpisah oleh simpul (bidang simpul dalam hal ini) pada inti. Orbital p, dapat diandaikan mempunyai berbagai orientasi sekeliling inti. Ketiga orbital 2p
terdapat pada sudut yang saling tegak lurus. Orbital p yang saling tegak lurus kadang-kadang ditandai sebagai px, py, pz. Huruf subskrip x, y, z yang dapat digambarkan lewat gambar dari orbital p ini (Fessenden, 1997: 3).
Orbital 2p dibedakan karena tiga nilai m yang berbeda. Karena bilangan kuantum m menyatakan momentum sudut disekitar sumbu maka perbedaan nilai
Gambar 4.30. Orbital p (px).
sepanjang sumbu-z (untuk = 0 dan 180o). Karena alasan ini, orbital ini disebut
pz (gambar 4.28). Orbital dengan m = 1 (yang sebanding dengan i
e
sin )
mempunyai sudut disekitar sumbu-z. Orbital dengan faktor i
e berkaitan dengan rotasi satu arah dan orbital dengan faktor i
e , berkaitan dengan gerakan dengan arah yang berlawanan. Orbital itu mempunyai amplitudo nol bila = 0 dan 180o (sepanjang sumbu-z) dan amplitudonya maksimum pada saat = 90o, yang
berada pada bidang xy. Untuk menggambarkan fungsi itu, biasa diambil kombinasi linier real
Gambar 4.31. Orbital 2d, terlihat seperti penggabungan dua orbital p. 6. Orbital d
Jika n = 3, l dapat bernilai 0, 1, atau 2. Hasilnya adalah satu orbital 3s, tiga orbital 3p, dan lima orbital 3d. Kelima orbital d mempunyai m = 2, 1, 0, -1, -2 dan berkaitan dengan lima momentum sudut yang berbeda disekitar sumbu-z (tetapi besarannya sama, karena pada setiap kasus l = 2). Berbeda dengan orbital p, orbital d dengan nilai m yang berlawanan (sehingga arah gerakannya disekitar sumbu-z juga berlawanan) dapat digabungkan secara berpasangan seperti pada gambar 4.31 (Atkins, 1994: 387).
Gambar 4.32. Orbital atom hidrogen untuk N=1, L=0 dan M=0.
Gambar 4.33. Orbital atom hidrogen untuk N=2, L=0 dan M=0. Terlihat bahwa jarak dari inti lebih lebar dari gambar 4.25
Gambar 4.34. Orbital atom hidrogen untuk N=1, L=1 dan M=1.
Gambar 4.35. Gambar pembanding untuk orbital N = 1, L = 1 dan M = 1.
Gambar 4.36. Akibat adanya medan listrik terjadi polarisasi orbital atom H. 7. Efek Stark
Berikut adalah gambar-gambar dari orbital atom hidrogen yang terdegenerasi dalam medan medan listrik untuk keadaan eksitasi pertama.
Gambar 4.38. Plot probabilitas radial untuk gambar 4.29.
Gambar 4.39. Gambar pembanding untuk gambar 4.38.
Dari gambar 4.36 hingga gambar 4.41 terlihat bahwa fungsi distribusi terkonsentrasi pada sumbu z dan terpolarisasi. Dari plot fungsi distribusi radial, terlihat bahwa probabilitas tertinggi adalah dekat inti.
Untuk mendapatkan beberapa dugaan intuisi dari apa yang terjadi, kembali ke teori klasik tentang gerak partikel di bawah pengaruh gaya kuadrat terbalik, orbit-orbit adalah berbentuk elips yang mempunyai pusat tarik-menarik pada salah satu fokus. Karena partikel bergerak lebih lambat ketika benda lebih jauh dari pusat, partikel tersebut menghabiskan waktu lebih lama pada salah satu sisi dari pusat daripada sisi yang lain, jadi sebuah atom bila digambarkan dengan cara ini adalah secara efektif terpolarisasi. Kombinasi-kombinasi linier ψ1 dan ψ2 adalah fungsi gelombang yang sekurang-kurangnya secara kasar berkorespondensi dengan orbit-orbit Keplerian klasik. Orbit-orbit-orbit itu dikenal sebagai orbit-orbit berpolarisasi stasioner, yang muncul hanya untuk sebuah gaya kuadrat terbalik dan beberapa kasus yang lain. Pada mekanika kuantum, degenerasi di antara state-state dari l yang berlainan yang mana membuat segala sesuatu mungkin lenyap sesegera setelah gaya tarik-menarik tidak lagi kuadrat terbalik. Jadi, gaya kuadrat terbalik bertanggung jawab terhadap keberadaan dari momen listrik permanen menurut kedua teori (Park, 1992: 229-230).
C. Keunggulan dan Keterbatasan Program 1. Keunggulan
memperoleh informasi (gambar-gambar) yang lebih banyak dari yang ada pada buku-buku teks.
b. Sama dengan poin satu di atas untuk plot fungsi radial dan probabilitasnya dengan masukan n dan l.
c. Sama dengan poin satu di atas untuk plot harmonik bola dalam diagram polar dengan masukan l.
d. Sama dengan poin satu di atas untuk plot orbital 2D dengan masukan n,l
dan m.
2. Keterbatasan
a. Tidak dapat menampilkan untuk masukan m yang negatif.
56 A. Simpulan
1. Penelitian ini menghasilkan program komputer dalam bahasa pemrograman
Matlab yang dapat memvisualisasikan orbital atom hidrogen tanpa gangguan
(fungsi radial dan distribusi probabilitasnya serta ketergantungan harmonik
bola pada angular) dan dengan gangguan medan listrik untuk keadaan eksitasi
pertama (efek Stark).
2. Hasil visualisasi menunjukkan:
a. Bentuk orbital atom hidrogen bergantung pada jarak dari inti r dan juga
pada angular (θ, ). Ketergantungan pada r ditentukan oleh state dari
elektron dengan bilangan kuantum utama n dan bilangan kuantum orbital l.
Ketergantungan pada angular ditentukan bilangan kuantum orbital l dan
bilangan kuantum magnetik m.
b.Adanya gangguan medan listrik menyebabkan terjadinya degenerasi nilai
eigen energi untuk keadaan eksitasi pertama (efek Stark orde pertama).
Adanya medan ini menyebabkan terpolarisasinya orbital atom hidrogen.
B. Saran
Program hasil penelitian ini tidak menampilkan bentuk matematis dari
persamaan elektron untuk atom hidrogen (orbital). Perlu dilakukan penelitian
lebih lanjut untuk menampilkan persamaan tersebut serta efek Stark untuk
57
Atkins, P.W. 1994. Kimia Fisika (Terjemahan). Jakarta: Erlangga.
Beiser, Arthur. 1992. Konsep Fisika Modern (Terjemahan). Jakarta: Erlangga.
Boass, Mary. 1982. Mathematical Methods in the Physical Sciences. New York: John Willey & Sons. Inc.
Chu, Kevin. http: // www.princenton.edu/ ~ktchu/ misc/ archives/ quantum_plots/ H_atoms/. Tanggal 12 Desember 2005.
Fessenden, Ralp. 1997. Kimia Organik (Terjemahan). Jakarta: Erlangga.
Gasiorowicz, Sthepen. 2003. Quantum Physics. Third edition. New York: John Wiley & Sons Inc.
http://www.physics.csbsju.edu/QM/H.10.html. Tanggal 12 Desember 2005.
Kocbach. http://www.fi.uib.no/AMOS/hydro/. Tanggal 12 Desember 2005.
Krane, Kenneth. 1992. Fisika Modern (Terjemahan). Jakarta: UI-Press.
Lindblad,Goran. http://www.theophys.kth.se/mathphys/schrodinger.html. Tanggal 12 Desember 2005.
Lindblad,Goran. http://mathphys.physics.kth.se/mathphys/schrod7.ps.gz. Tanggal 12 Desember 2005.
Park, D. 1992. Introduction to the Quantum Theory. Third Edition. New York: McGraw Hill.
Pauling, Linus. 1935. Introduction to Quantum Mechanics with Applications to Chemistry. Tokyo: Kogakusha Company, Ltd.
Purwanto, Agus. 1997. Pengantar Fisika Kuantum. Surabaya: Citra Media.
Takeuchi. http://www.alfredstate.edu/takeuchi/home.html. Tanggal 12 Desember 2005.
Maple. Yogyakarta: Penerbit Andi.
Woodgate, G.K. 1989. Elementary Atomic Structure. London: Oxford University Press.
59 57
Gambar L.1. Harmonik bola dari derajat L = 3 untuk cos() dalam (0,1) ketika = 0.
LAMPIRAN 2
LISTING PROGRAM
1. File AtomHidrogen.m
%> File <AtomHidrogen.m> merupakan menu untuk program-program %> beberapa sifat dari eigenstate atom H.
%> File ini modifikasi dari <hatom.m> buatan %> © Goran Lindblad - gli@theophys.kth.se
close, clear, disp('> Selamat Datang Di <AtomHidrogen>!'); q1=1;
axis('off');axis([0 1 0 1]), t1=title('Program Atom Hidrogen'); set(t1,'FontSize',18);
ww = {''
' Program ini menampilkan beberapa sifat atom hidrogen ' ' untuk state-state yang terbatas, menampilkan grafik' ' ketergantungan pada radial dan angular ' ' dan juga Efek Stark untuk eksitasi pertama.'};
text0([.15 .45 .75 .4], ww);
rbutt([.15 .36 .35 .06],'Harmonik Bola','close,q=1;') rbutt([.15 .29 .35 .06],'Orbital Atom 3D','close,q=2;')
rbutt([.15 .22 .35 .06],'Fungsi Gelombang Radial','close,q=3;') rbutt([.55 .36 .35 .06],'Orbital Atom 2D','close,q=4;')
rbutt([.55 .29 .35 .06],'Efek Stark n=2','close,q=5;') bbutt([.55 .22 .35 .06],'BERHENTI','close,q=6;'), uiwait
if q==6 return; elseif q==2
FungsiAngular;return; elseif q==4
orbital; return; elseif q==5 EfekStark;return; elseif q==1
HarmonikBola;return; elseif q==3
FungsiRadial;return; end
end
if q1==1 start;return elseif q1==2
AtomHidrogen; return end
disp('> Ketik AtomHidrogen untuk mengulangi!');
2. File bbutt.m
function h = bbutt(xy,ww,action) %> Ini adalah tombol biru standar %> Panggil: bbutt(xy,ww,action)
%> Input: xy = position 4-vector [x1 y1 x2-x1 y2-y1] %> ww = text string,
%> action = callback sebagai 'close' atau 'uiresume' uicontrol('Style','pushbutton','Units','normalized',... 'Position',xy,'String',ww,...
'BackGroundColor',[.0 .0 .9],'ForeGroundColor','w',... 'Fontsize',12,'Callback',action)
3.File edit1.m
function f=edit1(xy,string);
%> file <edit1> mengijinkan kita untuk mengedit "string" %> Panggil q = edit1(xy, string) dimana
%> xy = 4-vector memberikan posisi dan ukuran dari "window" %> string = string yang diedit.
%> Bila kamu ingin sebuah "number", q=eval(q)
t0 = uicontrol('Style','edit','Units','normalized', ... 'BackgroundColor',[.9 .9 .9], ...
'Position',xy, 'String',string, ... 'Callback','uiresume'); uiwait;
f=get(t0,'String');delete(t0);
4. File FungsiAngular.m
%> <FungsiAngular.m> menampilkan ketergantungan harmonik bola terhadap angular %> dengan masukan bilangan kuantum momemtum angular L (= bilangan bulat tidak negatif). %> Besaran yang ditampilkan adalah
%> nilai absolut dari bagian real dari fungsi. %> Menggunakan fungsi file <ylm.m> %> File ini modifikasi dari <angl.m> buatan %> © Goran Lindblad - gli@theophys.kth.se disp('> Selamat datang di <FungsiAngular>!'); clear; close;q=0;
q=1; str='[1,0]';
txt={' KETERGANTUNGAN HARMONIK BOLA PADA ANGULAR' ' '
' Menampilkan ketergantungan harmonik bola pada angular.' ' '
' Besaran yang ditampilkan adalah nilai absolut dari ' ' bagian real fungsi YLM(theta, phi).'
' ' ' '
tt1=text0([.15 .45 .75 .4],txt); ee = str;
gbutt([.75 .01 .15 .05], 'LANJUT', 'uiresume'), ee=edit1([.7 .5 .2 .05],ee);
Q=eval(ee); delete(tt1); while q==1 L=Q(1);M=Q(2);
%%% Pengeplotan
zz=0.8*[-1 1 -1 1 -1 1]; % mendefinisikan sumbu aksis grafik i %% Memilih kisi-kisi untuk grafik
theta=pi*linspace(0,1,60); phi=2*pi*linspace(0,1,90); sph=ylm(L,cos(theta));
sph=sph(L+M+1,:); dd=abs(sph' * cos(M*phi)); norm=max(max(dd)); dd=dd/norm;
X=dd.*(sin(theta)'*cos(phi)); Y=dd.*(sin(theta)'*sin(phi)); Z=dd.*(cos(theta)'*ones(size(phi)));
mesh(X,Y,Z),axis('off'),axis(zz),hold on,
l1=line([0,1.1],[0,0],[0,0]);set(l1,'LineWidth',2); l1=line([0,0],[0,1.1],[0,0]);set(l1,'LineWidth',2); l1=line([0,0],[0,0],[0,1.1]);set(l1,'LineWidth',2);
l1=text(2,0,-0.7,sprintf('L = %g',L));
set(l1,'FontName','palatino'); set(l1,'FontSize',18),
l1=text(2,0,-0.9,sprintf('M = %g',M));
set(l1,'FontName','palatino');set(l1,'FontSize',18),
l1=text(1.2,0,0,'x');
set(l1,'FontName','palatino');set(l1,'FontSize',12),
l1=text(0,1.2,0,'y');
set(l1,'FontName','palatino');set(l1,'FontSize',12),
l1=text(0,0,1.2,'z');
set(l1,'FontName','palatino');set(l1,'FontSize',12),
hold off, view([1,1 0.5]),
title('Ketergantungan harmonik bola pada angular'), Lbutt(.75,.01);
rbutt([.45 .01 .15 .05],'L,M BARU ','uiresume; q=1;'), bbutt([.6 .01 .15 .05],'MENU','close; q=2;'),
bbutt([.75 .01 .15 .05],'BERHENTI','close;q=0;'), uiwait;
if q==1
clear; AtomHidrogen; return; end
end
disp('> Ketik <FungsiAngular> untuk mengulangi!');
5. File FungsiRadial.m
disp('> Selamat datang di <FungsiRadial>'); clear; close;
str='[1,0]';
txt={' FUNGSI GELOMBANG RADIAL' ' '
' Fungsi gelombang radial didefinisikan dalam bentuk polinomial ' ' Laguerre dan dihitung dengan menggunakan algoritma dalam ' ' <radial1.m> dan <laguerre.m>. '
' ' ' '
' Masukkan n dan l di kotak'};
tt1=text0([.15 .45 .75 .4],txt); q=1;
ee = str;
gbutt([.75 .01 .15 .05], 'LANJUT', 'uiresume'), ee=edit1([.7 .5 .2 .05],ee); P=sprintf(strrep(P,'Q(1)','%g'),Q(1));
P=sprintf(strrep(P,'Q(2)','%g'),Q(2));
xmax=2+2*N*(N+1); x=linspace(0,xmax,300); y=radial1(N,L,x'); plot(x,y);axis('tight'),
title(P);xlabel('Satuan dalam jari-jari Bohr');
Lbutt(.75,.01);
P='Plot fungsi radial dikalikan r untuk N = Q(1), L = Q(2)'; P=sprintf(strrep(P,'Q(1)','%g'),Q(1));
P=sprintf(strrep(P,'Q(2)','%g'),Q(2)); y=(x'.*ones).*y;
plot(y), axis('tight'),
title(P);xlabel('Satuan dalam jari-jari Bohr');
Lbutt(.75,.01);
P='Kerapatan probabilitas radial untuk N = Q(1), L = Q(2)'; P=sprintf(strrep(P,'Q(1)','%g'),Q(1));
P=sprintf(strrep(P,'Q(2)','%g'),Q(2)); plot(x,y.^2), axis('tight'),
title(P);xlabel('Satuan dalam jari-jari Bohr')
Lbutt(.75,.01);
bbutt([.6 .01 .15 .05],'MENU','close; q=2;'); bbutt([.75 .01 .15 .05],'BERHENTI','close,q=0;'); uiwait;
if q==1
FungsiRadial; elseif q==2
clear; AtomHidrogen; return; end
end
disp('> Ketik <FungsiRadial> untuk mengulangi!');
6. File orbital.m
%> File <orbital.m> menampilkan orbital hidrogen dengan %> bilangan kuantum [N,L,M].
%> File ini menghitung nilai (real), dengan tanda, dari
%> orbital H dengan bilangan kuantum N,L,M (0 <= M <= L <= N-1) %> untuk phi = 0 dan amplitudo digambar dalam color map.
clear; close; disp('> Selamat datang di <orbital>'); str='[1,0,0]';
txt={' ORBITAL HIDROGEN ' ' '
' File ini menampilkan bentuk geometri atom hidrogen.'
' Penggambaranya dalam color map dari amplitudo, dengan skala ' ' yang tidak linier untuk amplitudo yang bertujuan untuk memperoleh ' ' kontras yang lebih baik untuk orbital yang berbeda.'
' Fungsi gelombang dengan bilangan kuantum standar' ' [N,L,M], N > L >= M .'
'' '' ''
' Tulis [N,L,M] pada kotak >> ' };
tt1=text0([.15 .45 .75 .4],txt); % title(' Orbital Hidrogen'), q=1;
ee = str;
gbutt([.75 .01 .15 .05], 'LANJUT', 'uiresume'), ee=edit1([.7 .5 .2 .05],ee);
Q=eval(ee); delete(tt1);
if isempty(Q) Q=[1,0,0];
end
while q == 1
Q(3)=abs(Q(3));
P='Amplitudo kuadran pertama untuk N = Q(1), L = Q(2), M = Q(3), satuan dalam jari-jari Bohr'; P=sprintf(strrep(P,'Q(1)','%g'),Q(1));
P=sprintf(strrep(P,'Q(2)','%g'),Q(2)); P=sprintf(strrep(P,'Q(3)','%g'),Q(3)); % disp(P);
figure(gcf);
N=Q(1);L=Q(2);M=abs(Q(3));
scale =1.1*(2*N*(N+1) - 0.5*L*(L+1) + 0.2*M*(M+1) + 4); x=linspace(-scale,scale,100);
y=x;
w=hydrogen(N,L,M,x,y); mm=max(max(abs(w)));
w=30*w./mm; %pengskalaan dapat dirubah untuk penyesuaian.
w=asinh(w); % membuat skala untuk logaritma amplitudo, dengan tanda! surf(x,y,w); axis('tight'); axis('equal');
colormap(jet);
view(2);% view([1,-1,3]);
shading interp;%colorbar; % xlabel(P);
% title('Amplitudo orbital hidrogen, skala panjang dalam satuan jari-jari Bohr'); title(P), xlabel('Koordinat Radial'), ylabel('Koordinat Z');
gbutt([.75 .01 .15 .05], 'LALUI', 'uiresume; q=2'), tt2=text0([.3 .85 .6 .05],'Pilih nilai baru [N,L,M] >> '); ee=edit1([.7 .85 .2 .05],ee);
Q=eval(ee);delete(tt2);
end
Lbutt(.75,.01);
rbutt([.45 .01 .15 .05],'ULANG ','uiresume; q=1;'); bbutt([.6 .01 .15 .05],'MENU','close; q=2;'); bbutt([.75 .01 .15 .05],'BERHENTI','close;q=0;'); uiwait;
if q==1 orbital; elseif q==2
clear; AtomHidrogen; return;
end
disp('> Ketik <orbital> untuk orbital yang lain!');
7. File gbutt.m
%> Input: xy = position 4-vector [x1 y1 x2-x1 y2-y1] %> ww = text string,
%> action = callback sebagai 'close' atau 'uiresume'
uicontrol('Style','pushbutton','Units','normalized',... 'Position',xy,'String',ww,...
'BackGroundColor',[.0 .7 .0],'ForeGroundColor','w',... 'Fontsize',12,'Callback',action)
8. File HarmonikBola.m
disp('> Selamat datang di <HarmonikBola>!'); clear; close;q=0;
q=1;
txt={' HARMONIK BOLA' ''
' Harmonik bola didefinisikan dalam bentuk ' ' fungsi Legendre terasosiasi.'
''
' Algoritma menghitung fungsi Legendre adalah ' ' komponen standar dari MATLAB.'
''
' Masukkan bilangan bulat positif L di kotak'}; tt1=text0([.15 .45 .75 .35], txt);
str='3';
gbutt([.75 .01 .15 .05], 'LANJUT','uiresume'), ee=edit1([.75 .45 .15 .05],str);
L =eval(ee);delete(tt1); while q==1
%%%%%%% Masukan
x=linspace(0,1); y1=ylm(L,x); plot(x,y1); xy=axis;
title(sprintf('Harmonik bola dari derajat L = %g',L)); xlabel('cos(theta) dalam (0,1), ketika phi = 0!'); str='Harmonik bola Y(L,M)';
str1=sprintf(strrep(str,'L','%g'),L); Lbutt(.75,.01);
for n=1:L+1
l1=plot(x,y1(n,:)); axis(xy);
set(l1,'LineWidth',2);
str2=sprintf(strrep(str1,'M','%g'),n-1); title(str2);
xlabel('cos(theta) dalam (0,1), ketika phi = 0!');
Lbutt(.75,.01);
plot(x,y1);
title(sprintf('Harmonik bola dalam derajat L = %g',L)); xlabel('cos(theta) dalam (0,1), ketika phi = 0!'); Lbutt(.75,.01);
drawnow;
X=linspace(0,2*pi,200); y1=ylm(L,cos(X));
str='Harmonik bola Y(L,M), plot kuadrat amplitudo dalam diagram polar '; str1=sprintf(strrep(str,'L','%g'),L);
for n=1:L+1
y2=y1(L+n,:).^2;
yy=y2.*cos(X); xx=y2.*sin(X);
l1= plot(xx,yy);axis('off');set(l1,'LineWidth',2); axis('equal');xy=axis;
xmax=max(xy);
l1=line([0,0],1.1*[-xmax,xmax]); set(l1,'LineWidth',3);
set(l1,'Color','r');
str2=sprintf(strrep(str1,'M','%g'),n-1); title(str2);
l1=text(0.1*xmax, 1.05*xmax, 'z');
set(l1,'FontName','palatino'); set(l1,'FontSize',18);%set(l1,'Color','Black'); drawnow;
Lbutt(.75,.01);
end % dari iterasi dalam n
rbutt([0.45 .01 .15 0.05],'ULANG','uiresume; q=1;'); bbutt([0.6 .01 .15 0.05],'MENU','close, q=2;'); bbutt([0.75 .01 .15 0.05],'BERHENTI','close, q=0'); uiwait;
if q==1
HarmonikBola; elseif q==2
clear; AtomHidrogen; return; end
end
disp('> Ketik <HarmonikBola> untuk mengulangi!');
9. File Hydrogen.m
function f=hydrogen(N,L,M,x,y);
%> Panggil: hydrogen(N,L,M,x,y)
%> Input: N,L,M integers, 0 ¾ M ¾ L ¾ N-1 %> x,y = vector-vector baris, Bohr radius units,
%> Output: sebuah matrix dari amplitudo real dalam bidang \phi = 0, %> [x,y] = r[cos(\theta) , sin(\theta)]
%>
unix=ones(size(x)); uniy=ones(size(y));
rr=(x.^2)'*uniy + unix'*y.^2 + eps; rr=sqrt(rr);
cos=(x'*uniy)./rr; rr=2*rr./N;
k=2*L+1; p=N-L-1;
norm=2*sqrt(fact(N-L-1)/fact(N+L))/N^2; mm=exp(-0.5*rr);
mm=mm.*(rr.^L);%
% mm=mm.*sqrt(rr.*(unix'*y)+eps);ini adalah normalisasi extra mm=norm*mm.*laguerre(k,p,rr);
mm=mm.*yl(L,M,cos);
f=mm;
10. File laguerre.m
function f=laguerre(k,n,x);
%> file <laguerre.m> menghitung niali-nilai dari %> polinomial Laguerre.
%> Panggil: laguerre(k,n,x),
%> Input: k = real, n = non-negative integer, x = matrix dari nilai-nilai. %> Output: sebuah matrix dari dimensi sama seperti x.
%> Referensi: HMF Ch 22. x1=ones(size(x));
if n==0 w3=x1;
elseif n==1
w3=k+1-x;
else
w1=x1; w2=k+1-x;
for r=2:n
w3=2*w2-w1+((k-1-x).*w2 - (k-1)*w1)/r;
w1=w2; w2=w3;
end
f=w3;
11. File Lbutt.m
function h = Lbutt(x,y)
%> Ini adalah tombol standar "LANJUT" dengan %> panjang = .15 dan tinggi = .05.
%> Panggil: Lbutt(x,y)
%> Input: x, y = posisi sudut kiri lebih rendah %> callback adalah 'uiresume'.
uicontrol('Style','pushbutton','Units','normalized',... 'Position',[x,y,.15, .05],'String','LANJUT',...
'BackGroundColor',[.0 .7 .0],'ForeGroundColor','w',... 'Fontsize',10,'Callback','uiresume'); uiwait;
11. File obutt.m
function h = obutt;
%> file <obutt.m> memberikan sebuah tombol abu-abu tanpa fungsi %> pada sebuah posisi yang belum terdefinisi pada tombol dari figure. %> Panggil: obutt
uicontrol('Style','pushbutton','Units','normalized',...
'Position',[.15 .01 .75 .05],'BackGroundColor',[.8 .8 .8])
12. File radial1.m
function f=radial1(N,L,x);
%> File ini menghitung fungsi radial untuk atom hidrogen %> dalam satuan atomik, untuk range dari angular momenta. %> Panggil: radial(n,x),
%> Input: n = positive integer, x = column vector.
%> Output: sebuah matrix dari n baris berhubungan dengan L = 0,...,n-1, %> kolom dari size x.
y=2*x./N; z=exp(-0.5*y);
w=[];
k=2*L+1; p=N-L-1;
norm=2*sqrt(prod(1:N-L-1)/prod(1:N+L))/N^2; w=[w,norm*(y.^L).*z.*laguerre(k,p,y)];
f=w;
13. File rbutt.m
function h = rbutt(xy,ww,action) %> Ini adalah tombol merah standar %> Panggil: rbutt(xy,ww,action)
%> Input: xy = posisi 4-vector [x1 y1 x2-x1 y2-y1] %> ww = text string,
uicontrol('Style','pushbutton','Units','normalized',... 'Position',xy,'String',ww,...
'BackGroundColor',[.85 .0 .0],'ForeGroundColor','w',... 'Fontsize',12,'Callback',action)
14. File text0.m
function f = text0(xy,ww) %> Panggil f=text0(xy,'string');
%> dimana x adalah 4 - vector [x0 y0 dx dy]; %> ww adalah 'string' dalam 'cell array' .
f=uicontrol('Style','text','Units','normalized','FontSize',12,... 'String',ww, 'HorizontalAlignment','left','Position',xy,... 'BackgroundColor',[.93 .93 .93]);
15. File yl.m
function f=yl(L,M,x); %> Panggil f=yl(L,M,x)
%> Input: 0 <= M <= L integers, x = matrix, values in [-1,1]; %> Output: yl(L,M,x) = matrix size(x).
%> Menghitung harmonik bola YLM(cos theta) = yl(L,M,x) %> kecuali faktor bergantung-phi (phi = 0).
%> Ylm = yl(L,M,x).*exp(i*M*phi)); %>
norm=((-1).^M).*sqrt((2*L+1).*fact(L-M)./(fact(L+M)*4*pi)); f=norm*legf(L,M,x);
16. File legf.m
function f=legf(L,M,x);
%> file <legf.m> menghitung legendre(L,M,x),
%> fungsi legendre terasosiasi sebagaimana yang didefinisikan dalam HMF atau Messiah. %> Panggil: legf(L,M,x),
%> Input: L,M = integers, 0 <= M <= L,
%> x = matrix dari dimensi yang berubah-ubah, nilai-nilai dalam (-1,1). %> Output: sebuah matrix yang berdimensi sama dengan x.
%>
p0=[1]; p1=[1,0];
if L==0;
f=ones(size(x)); return
elseif L==1;
return else f=x; return end
end
for n=1:L-1
p=((2*n+1)/(n+1))*[p1,0]-(n/(n+1))*[0,0,p0]; p0=p1;p1=p;
end
nn=[0:L-M]; pp=p(1:L-M+1);
nn=fact(L-nn)./fact(L-M-nn); pp=pp.*nn;
w=polyval(pp,x);
w=((1-x.^2).^(0.5*M)).*w;
f=w;
17. File fact.m
function f=fact(x);
%> file <fact.m> menghitung faktorial-faktorial fact(x) dari
%> sebuah matrix dengan masukan integer, men-set tak hingga untuk nilai-nilai negatif. %> Panggil: fact(X)
%> Input: X = vector dari matrix, nilai-nilai integer
%> Output: sebuah vector atau matrix dari ukuran yang sama. %> Bandingkan fungsi gamma standar matlab dari MATLAB. %> Kita ingin menjauhi semua keluaran NaN!!!
%>
maxx=max(max(x)); y=zeros(size(x));
% iterasi the faculty untuk elemen-elemen dari nilai 1,2,...,maxx.
for n=0:maxx-1
z=~(x - maxx + n); y=y+z; y=(maxx-n)*y;
end
z=~x; % sekarang berurusan dengan argumen-argumen nol, jawabannya 1.
y=y+z;
% argumen-argumen adalah negatif, jawabannya harus tak hingga- % set setiap elemen matrix terpisah
w=~y; [w1,w2]=find(w); nn=length(w1);
for m=1:nn
y(w1(m),w2(m))=inf;
end f=y;
18. File EfekStark.m
%> File <EfekStark.m> menampilkan orbital hidrogen %> dalam medan listrik untuk eksitasi pertama.
disp('> Selamat datang di <starkeffect>'); clear; close;q=0;
q=1;
txt={' EFEK STARK ' ' '
' File ini menampilkan bentuk geometri atom hidrogen ' ' dalam medan listrik (efek Stark) untuk eksitasi pertama.' ' Penggambaranya dalam color map dari kuadrat amplitudo.' ' Juga ditampilkan plot probabilitas radial.' };
tt1=text0([.15 .45 .75 .4],txt);
Lbutt(.75,.01); delete(tt1);
figure(gcf);
N1=2;L1=0;M1=0; N2=2;L2=1;M2=0;
scale =1.1*(2*N1*(N1+1) - 0.5*L1*(L1+1) + 0.2*M1*(M1+1) + 4); x=linspace(-scale,scale,100);
y=x;
w1=hydrogen(N1,L1,M1,x,y); w2=hydrogen(N2,L2,M2,x,y); mm1=max(max(abs(w1))); mm2=max(max(abs(w2))); w1=30*w1./mm1;
w2=30*w2./mm2;
w=(1/sqrt(2))*(asinh(w1)-asinh(w2)); surf(x,y,w); axis('tight'); axis('equal'); colormap(jet);
view(2);% view([1,-1,3]); shading interp;%colorbar;
xlabel('Koordinat Radial'), ylabel('Koordinat Z');
title('Plot Kuadrat Amplitudo (( \Psi200 - \Psi210 )/2^1^/^2)^2 ');
a0=1;
r=1/a0 * [-10:0.01:0];
psi_20=((1/(2*a0))^1.5) * (2+r).*exp(r/2); psi_21=(1/sqrt(3))*((1/(2*a0))^1.5)*r.*exp(r/2); psi_1=(1/sqrt(2))*(psi_20 - psi_21);
r1=1/a0 * [0:0.01:10];
psi_20=((1/(2*a0))^1.5) * (2-r1).*exp(-r1/2); psi_21=(1/sqrt(3))*((1/(2*a0))^1.5)*r1.*exp(-r1/2); psi_2=(1/sqrt(2))*(psi_20 - psi_21);
plot(r, psi_1.^2, r1, psi_2.^2); grid on;
xlabel('Koordinat Z (dalam jari-jari Bohr)'); title('Probabilitas Radial ( \Psi200 - \Psi210 )^2 ');
Lbutt(.75,.01);
w=(1/sqrt(2))*(asinh(w1)+asinh(w2)); surf(x,y,w); axis('tight'); axis('equal'); colormap(jet);
view(2);% view([1,-1,3]); shading interp;%colorbar;
xlabel('Koordinat Radial'), ylabel('Koordinat Z');
title('Plot Kuadrat Amplitudo (( \Psi200 + \Psi210 )/2^1^/^2)^2 ');
Lbutt(.75,.01); %plot radial r=1/a0 * [-10:0.01:0];
psi_20=((1/(2*a0))^1.5) * (2+r).*exp(r/2); psi_21=(1/sqrt(3))*((1/(2*a0))^1.5)*r.*exp(r/2); psi_1=(1/sqrt(2))*(psi_20 + psi_21);
r1=1/a0 * [0:0.01:10];
psi_20=((1/(2*a0))^1.5) * (2-r1).*exp(-r1/2); psi_21=(1/sqrt(3))*((1/(2*a0))^1.5)*r1.*exp(-r1/2); psi_2=(1/sqrt(2))*(psi_20 + psi_21);
plot(r, psi_1.^2, r1, psi_2.^2); grid on;
xlabel('Koordinat Z (dalam jari-jari Bohr)'); title('Probabilitas Radial ( \Psi200 + \Psi210 )^2 ');
Lbutt(.75,.01);
rbutt([.45 .01 .15 .05],'ULANG ','uiresume; q=1;'); bbutt([.6 .01 .15 .05],'MENU','close; q=2;'); bbutt([.75 .01 .15 .05],'BERHENTI','close;q=0;'); uiwait;
if q==1
EfekStark;
elseif q==2
end
disp('> Ketik <EfekStark> untuk mengulangi');
19. File ylm.m
function f=ylm(L,x); %> Panggil f= ylm(L,x)
%> Input: L = non-negative integer %> x = row vector with values in [-1,1].
%> Output: ylm(L,x) = matrix of dimension (2*L+1) x length(x). %> Menghitung harmonik bola untuk
%> m = -L,..,L, kecuali faktor bergantung-phi. %> Ylm = ylm.*exp(i*m*phi); m=[-L:L]'. %>
mm=[0:L]';
y=sqrt((2*L+1).*fact(L-mm)./fact(L+mm)/4/pi); y=legendre(L,x).*(y*ones(size(x)));
%size(y) y1=y(2:L+1,:);
y1=(cos([1:L]'*pi)*ones(size(x))).*y1; y=flipud(y);
y=[y;y1];
LAMPIRAN 3
PEMECAHAN PERSAMAAN SCHRODINGER UNTUK ELEKTRON DALAM ATOM HIDROGEN
A. Persamaan Schrodinger untuk Elektron dalam Atom Hidrogen Persamaan Schrodinger untuk elektron atom hidrogen adalah
Bila ditulis lengkap persamaan (1)* menjadi
0Dalam koordinat bola (setelah memasukkan nilai V) persamaan (1)* menjadi
0
Untuk memecahkan persamaan (3)* digunakan teknik pemisahan variabel
r, , Rr (4)*
Substitusi pers. (4)* ke pers. (3)* diperoleh
kemudian dibagi dengan R diperoleh
kemudian dikalikan dengan 2 2 sin dengan sedikit aljabar diperoleh
1 0B. Solusi persamaan (6.a)*
0
persamaan karakteristiknya
0
Karena tidak ada gelombang pantul maka suku yang ada konsanta B bernilai nol.
Dari gambar terlihat bahwa dan 2 keduanya mengidentifikasi bidang
Karena fungsi gelombang harus bernilai tunggal maka untuk memenuhi pers (9)*,
m harus berupa bilangan bulat.
C. Solusi persamaan (7)*
Persamaan (11)* identik dengan persamaan Legendre
0yang solusinya
P
x (fungsi Legendre terasosiasi)
ldengan konstanta normalisasi
D. Solusi persamaan (8)*
1 0Diasumsikan inti diam dan karenanya energi kinetiknya nol, sehingga dengan memilih referensi energi nol, keadaan batas dari sistem memiliki energi negatif:
E = -|E| Dan didefinisikan
2 sebuah fungsi eigen, karena meningkat tanpa batas ketika . Diasumsikan
Untuk persaman (21)*, supaya menjaga validnya persamaan maka
s1 l l1 0s sehingga s = l atau s = - l(l+ 1), karena l0 maka s = -l(l+ 1) tidak dapat diterima karena perlakuan pada pers (19)* di mana s adalah bilangan positif. Dengan menggunakan s = l maka pers (21)* menjadi
substitusi pers (20)* ke (22)* dan dengan pengaturan koefisien dari diperoleh :
Untuk koefisien 0
1 1
0Untuk koefisien 1
12
1
0Jadi secara umum
v divergen. Untuk menjamin pembatasan ekspansi deret (20)*setelah (katakanlah) suku v+1, dibutuhkan (menurut (23)*) pemenuhan
bilanganbulat positif
nl
v
1
(24)*