Prosiding Seminar Nasional Hasil Penelitian yang Dibiayai oleh Hibah Kompetitif Bogor, 1-2 Agustus 2007
179 TINJAUAN ULANG PENGEMBANGAN
TEKNOLOGI HAPLOID CABAI DAN PROSPEKNYA
UNTUK PERCEPATAN PENELITIAN GENETIKA DAN PEMULIAAN TANAMAN Ence Darmo Jaya Supena
Departemen Biologi, FMIPA-IPB dan
Pusat Penelitian Suberdaya Hayati dan Bioteknologi (PPSHB), LPPM-IPB ABSTRAK
Cabai (Capsicum annuum L. dan C. frutescense L.) merupakan tanaman sayuran terpenting di Indonesia, baik dilihat dari kegunaan maupun luas pertanamannya sehingga mempunyai nilai ekonomis tinggi. Namun ternyata rataan produktivitasnya masih rendah. Upaya penelitian genetika dan pemuliaan cabai yang dilakukan di Indonesia, diantaranya terkendala oleh tidak tersedianya galur-galur murni dan masih menggunakan metode konvensional. Berawal untuk mengatasi masalah ini, upaya pengembangan teknologi haploid pada cabai untuk memproduksi galur murni secara cepat melalui kultur antera pada media padat telah dilakukan pada tahun 1996-1999 dengan pendanaan Hibah Bersaing V, DP3M Ditjen DIKTI. Dalam program ini hanya mampu menghasilkan tingkat kalus yang dapat dibuktikan dari jumlah kromosomnya adalah haploid. Upaya pengembangan teknologi haploid pada cabai ini dilanjutkan melalui proyek Biotechnology Research Indonesia-Netherlands (BIORIN) pada tahun 2000-2004 di Wageningen, Belanda dengan pendanaan dari KNAW Belanda. Dalam proyek ini berhasil dikembangkan metode yang efisien untuk memproduksi tanaman haploid ganda (HG) cabai lokal Indonesia melalui teknik kultur sebar mikrospora antera (KSM) pada media dua-lapis, media cair di atas media padat. Prosedur KSM ini lebih efisien dalam memproduksi tanaman HG dari metode-metode yang telah dilaporkan sebelumnya. Untuk menerapkan prosedur KSM pada kondisi lokal di Bogor, diperlukan adaptasi pada kondisi lokal yang masalah utamanya adalah kontaminasi kultur yang tinggi dan keterbatasan kelengkapan peralatan untuk kondisi perlakuan dan inkubasi. Dengan adanya pendanaan Program Insentif Riset Terapan dari Menristek mulai tahun anggaran 2007, rencana penerapan teknik ini dapat terfasilitasi dengan diterimanya proposal yang berjudul: “Implementasi Teknologi Haploid untuk Percepatan Pengembangan Varietas Hibrida Cabai Berbasis Kultivar Lokal”.
Kata kunci : Cabai, teknologi, haploid, genetika, pemuliaan, hibrida
PENDAHULUAN
Cabai (Capsicum annuum L. dan C. frutescense L.) merupakan komoditas sayuran terpenting di Indonesia bila dilihat dari nilai ekonomis dan luas areal pertanamannya. Cabai secara luas digunakan sebagai bagian dari berbagai menu masakan di banyak daerah di Indonesia, baik digunakan langsung dalam bentuk buah segar ataupun sudah berupa produk olahan. Luas areal pertanaman cabai (termasuk di dalamnya cabai besar dan keriting serta cabai rawit) di Indonesia pada tahun 2002-2005 berkisar dari 150 000 sampai hampir 200 000 ha/tahun dan merupakan pertanaman terluas untuk kategori sayuran (Deptan, 2007). Namun ternyata produktivitas cabai di Indonesia masih rendah (rata-rata 5.6 ton/ha pada tahun 2005) dengan kisaran produktivitas antar daerah yang sangat lebar mulai dari 1.74 ton/ha di Sulawesi Tenggara sampai 12.45 ton/ha di Jawa Barat (Deptan, 2007). Produktivitas ini masih jauh lebih rendah bila dibandingkan dengan negara tetangga, seperti Thailand dengan rata-rata 14 ton/ha (FAO, 2006). Faktor penyebab rendahnya produktivitas cabai ini, selain karena teknik budidaya yang dilaksanakan belum intensif, juga karena serangan hama dan penyakit pada pertanaman serta kualitas benih yang digunakan masih rendah.
Tanaman cabai telah dijadikan salah satu dari 10 komoditas tanaman hortikultura (tiga diantaranya adalah tanaman sayuran) yang mendapat prioritas untuk dikembangkan di Indonesia sejak tahun 2002 (sumber informasi: Direktorat Jendral Tanaman Hortikultura, Departemen Pertanian). Namun penelitian genetika dan program pemuliaan tanaman cabai di Indonesia pada umumnya masih menggunakan metoda konvensional, yang pada dasarnya tidak efisien untuk perbaikan sifat-sifat tanaman yang dikendalikan secara poligenik, seperti ketahanan terhadap penyakit, dan untuk perakitan benih berkualitas. Oleh karenanya, introduksi dan pengembangan teknologi baru seperti teknologi haploid („haploid technology‟) sangat diperlukan untuk
percepatan program penelitian genetika dan pemuliaan cabai di Indonesia.
Makalah ini memaparkan secara singkat program dan hasil-hasil penelitian genetika dan pemuliaan cabai di Departemen Biologi FMIPA-IPB dan PPSHB-IPB serta permasalahannya, dan selanjutnya difokuskan pada upaya mengembangkan prosedur yang efisien untuk memproduksi tanaman haploid ganda (HG) kultivar cabai lokal Indonesia. Program selanjutnya yang sedang dan akan dilaksanakan bertujuan untuk mengadaptasi dan menerapkan teknologi
haploid pada kondisi lokal di Indonesia untuk mempercepat penelitian genetika dan pemulian cabai, khususnya pengembangan varietas hibrida cabai berbasis kultivar lokal Indonesia.
LATAR BELAKANG PENELITIAN GENETIKA DAN PEMULIAAN CABAI YANG DILAKUKAN
Penelitian cabai di Departemen Biologi FMIPA-IPB dimulai pada tahun 1989 dengan mengoleksi beberapa kultivar lokal cabai serta mendapatkan beberapa nomor koleksi dari Balitsa, Lembang untuk diidentifikasi sifat morfologis dan agronomisnya (Budiono, 1990). Penelitian dilanjutkan pada tahun 1990 dengan tujuan utama untuk mempelajari hubungan genetik antar spesies cabai (cabai besar dan cabai rawit) dan daya gabung antar ras cabai (cabai besar dan cabai keriting) dengan pendanaan dari Hibah Kompetitif DP3M Ditjen DIKTI (Loan No.2944-IND) (Guhardja et al., 1991). Dari hasil penelitian ini diperoleh bahwa ternyata kultivar-kultivar lokal yang diujikan mempunyai potensi daya gabung umum untuk beberapa sifat agronomis yang berhubungan dengan produktivitas, seperti jumlah buah, bobot buah dan jumlah biji. Oleh karenanya, kultivar-kultivar lokal ini berpotensi sebagai material untuk pengembangan varietas hibrida berbasis kultivar lokal. Hasil lain menunjukkan bahwa sumberdaya genetik dari cabai rawit (C. frutescense) memungkinkan juga untuk dimanfaatkan dalam perbaikan genetik tanaman cabai besar (C. annuum) melalui persilangan (Muto‟ah, 1992). Studi kariotipe kromosom,
menunjukkan bahwa kedua spesies mempunyai jumlah kromosom yang sama, yaitu 2n=2x=24. Antara cabe besar dan cabe keriting sama-sama terdiri dari 2 pasang submetasentrik dan 10 pasang metasentrik, sedangkan pada cabai rawit ada perbedaan yaitu terdiri dari 1 pasang submetasentrik dan 11 pasang metasentrik (Hidayah, 1991). Namun, hasil studi genetika lebih lanjut dari hasil persilangan antar ras cabai dengan membandingkan populasi tetua dan populasi F2 menunjukkan bahwa tetua-tetua yang digunakan untuk persilangan tidak cukup murni. Hal ini terbukti dari besarnya ragam pada populasi tetua, dan bahkan untuk sifat tertentu, misalnya jumlah dan bobot buah, menunjukkan bahwa ragam populasi tetua tertentu lebih besar dari populasi F2-nya (Trimarmono, 1993).
Besarnya ragam pada populasi tetua disebabkan karena kultivar lokal yang dijadikan tetua pada dasarnya adalah hasil penyerbukan terbuka (open pollinated variety) sehingga kemurnian genetiknya sangatlah tidak terjamin. Meskipun cabai merupakan tanaman menyerbuk sendiri, tetapi karena penyerbukan terjadi setelah bunga mekar, maka penyerbukan silang secara alami sangat tinggi. Oleh karenanya untuk melakukan penelitian genetik dan pemulian cabai yang lebih terkontrol haruslah tersedia terlebih dahulu benih-benih yang terjamin mutu genetiknya, yaitu berupa galur murni-galur murni untuk dijadikan bahan penelitian dan untuk dijadikan tetua dalam persilangan-persilangan. Galur murni pada cabai dapat saja diperoleh secara konvensional melalui penyerbukan sendiri terkendali yang membutuhkan sampai tujuh generasi, atau dapat menggunakan alternatif teknologi haploid melalui pembentukan tanaman haploid dan haploid ganda yang dapat dilakukan dalam satu generasi saja. Pemanfaatan teknologi haploid ini sangat berpotensi untuk percepatan penelitian genetik dan pemulian tanaman.
TEKNOLOGI HAPLOID DAN PEMANFAATANNYA
Teknologi haploid mencakup regenerasi embrio dari sel gamet yang dilanjutkan dengan pembentukan tanaman haploid dan haploid ganda („doubled haploid‟, HG) dari embrio tersebut.
Proses pembentukan embrio dan tanaman haploid dapat terjadi secara spontan di alam, namun frekuensinya sangat rendah dan sangat tergantung pada genotipe tertentu saja. Oleh karenanya, pemanfaatan atau eksploitasi teknik ini sangat sulit dilakukan dan tidak efisien bila hanya mengandalkan dari proses spontan di alam. Baru pada tahun 1964, Guha and Maheshwari melaporkan penemuan barunya bahwa mereka mengamati cukup banyak embrio dari kultur antera Datura innoxia Mill. Selanjutnya, dapat dikonfirmasi bahwa embrio dan tanaman tersebut berasal dari mikrospora (polen belum dewasa) atau polen sehingga mempunyai jumlah kromosom haploid atau sama dengan jumlah kromosom sel gamet (Guha dan Maheshwari, 1966). Tanaman HG dapat diperoleh secara spontan melalui proses fusi dan endomitosis, ataupun melalui induksi penggandaan jumlah kromosom, misalnya dengan penggunaan senyawa kimia kolkisin pada berbagai fase haploid (Jansen, 1974). Pembentukan embrio dari mikrospora ini merupakan metode yang paling efisien dan tercepat untuk menghasilkan tanaman HG karena dapat dalam satu generasi (Ferrie et al. 1994). Sedangkan dengan menggunakan teknik konvensional melalui penyerbukan sendiri yang terkontrol membutuhkan waktu sekitar tujuh generasi.
Prosiding Seminar Nasional Hasil Penelitian yang Dibiayai oleh Hibah Kompetitif Bogor, 1-2 Agustus 2007
181 Tanaman HG memiliki beberapa keunggulan dan sangat berguna untuk memfasilitasi program pemuliaan maupun penelitian genetika dan dasar untuk menunjang perbaikan tanaman (Ferrie et al., 1994; Palmer and Keller, 1999). Tanaman HG umumnya digunakan sebagai tetua dalam pengembangan varietas hibrida. Tanaman HG juga dimanfaatkan untuk membantu proses seleksi, khususnya untuk sifat yang dikendalikan poligenik, dan untuk mempelajari sifat-sifat resesif. Akhir-akhir ini, populasi tanaman HG juga banyak dimanfaatkan untuk keperluan pemetaan molekular dan seleksi dengan bantuan marka molekular, seperti untuk tanaman cabai (Caranta et al., 1996; Djian-Caporalino et al., 2001; Lefebvre et al., 2003), Brassica (Somer et al., 1998; Farnham et al., 2002; Mahmood et al., 2003). Sebagai tambahan, tanaman haploid yang mempunyai jumlah kromosom sama dengan sel gamet, menjadi sarana yang sangat penting untuk mempelajari induksi mutasi dan seleksinya (Palmer and Keller, 1999).
STATUS TEKNOLOGI HAPLOID PADA TANAMAN CABAI
Tanaman haploid cabai dapat diperoleh melalui partenogenesis spontan dalam bentuk embrio kembar (Christensen dan Bamford, 1943), tetapi frekuensinya sangat rendah dan sangat tergantung dari genotipe (Pochard dan Dumas de Vaulx, 1979). Kultur antera cabai pada media padat yang menghasilkan tanaman haploid dalam frekuensi yang masih sangat rendah dan melalui fase kalus baru dilaporkan pada tahun 1970-an (Wang et al. 1973; George dan Narayanaswamy 1973). Metoda kultur antera cabai yang relatif lebih efisien berhasil dikembangkan oleh Sibi et al. (1979) yang selanjutnya diperbaiki oleh Dumas de Vaulx et al. (1981). Metoda Dumas de Vaulx et al. (1981) inilah yang selanjutnya banyak digunakan oleh berbagai kelompok peneliti dengan sedikit modifikasi untuk genotipe yang dikulturkan (Morrison
et al. 1986; Munyon et al. 1989; Qin and Rotino 1993; Mityko et al. 1995; Gémesné et al. 1998; Gyulai et al. 2000). Namun pada umumnya hasil yang diperoleh tidak memuaskan dan banyak genotipe yang tidak respon sama sekali dengan teknik ini. Selain itu, metoda ini umumnya dikembangkan untuk tanaman cabai paprika. Oleh karenanya untuk memanfaatkan teknologi haploid dalam penelitian genetik dan pemulian cabai di Indonesia perlu adanya upaya khusus pengembangan teknologi ini untuk kultivar cabai lokal Indonesia.
PENGEMBANGAN TEKNOLOGI HAPLOID UNTUK KULTIVAR CABAI LOKAL INDONESIA
Penelitian dengan tujuan untuk mengembangkan metoda untuk mendapatkan galur murni cabai melalui pembentukan tanaman haploid dengan pendekatan induksi ginogenesis dan androgenesis secara in vitro dan yang dilajutkan dengan penggandaan kromosom untuk mendapatkan tanaman HG telah dilaksanakan di Departemen Biologi FMIPA-IPB dan PPSHB-IPB pada tahun 1996-1999 (selama tiga tahun) dengan sumber pendanaan Program Hibah Bersaing V, DP3M Ditjen DIKTI (Supena, 1999). Dalam penelitian ini, percobaan induksi androgenesis melalui kultur antera pada media padat hanya mampu sampai menginduksi terbentuknya kalus yang secara sitogenetik terbukti berasal dari mikrospora atau polen karena jumlah kromosomnya adalah 12 atau sama dengan jumlah kromosom sel gamet. Pendekatan ginogenesis melalui penyelamatan embrio in vitro hasil penyerbukan dengan polen yang telah diradiasi dengan sinar gamma terlebih dahulu hanya mampu sampai tahapan kecambah dan tidak berhasil menjadi tanaman (Suharsono dan Supena, 1998). Hasil tambahan dalam program penelitian ini adalah berhasil mengembangkan metode penggandaan kromosom tanaman cabai in vivo dengan menggunakan senyawa kolkisin. Masalah utama dalam upaya menghasilkan tanaman cabai haploid maupun HG dalam penelitian ini, akhir menjadi dasar untuk melaksanakan kerjasama penelitian dengan Belanda melalui proyek Biotechnology Research Indonesia-Netherlands (BIORIN) dengan pendanaan dari KNAW Belanda.
Pada tahun 1996/1997 juga dilakukan penelitian sehubungan dengan upaya persiapan ke arah pengembangan varietas hibrida, yaitu percobaan induksi steril jantan pada tanaman cabai dengan radiasi sinar gamma (Supena dan Widyastuti, 1997). Penelitian ini dibiayai oleh Proyek Operasi dan Perawatan Fasilitas (OPF) – IPB. Penggunaan radiasi sinar gamma 150 Gy pada biji cabai dapat menurunkan secara nyata viabilitas serbuk sari dari 91% pada kontrol menjadi hanya 36%. Oleh karenanya terdapat indikasi peluang untuk mendapatkan tanaman steril jantan melalui perlakuan radiasi sinar gamma. Tanaman steril jantan ini akan sangat bermanfaat dalam proses hibridisasi masal untuk memproduksi varietas hibrida.
Upaya mengembangkan metoda yang efisien dalam memproduksi tanaman HG cabai lokal Indonesia melalui proyek BIORIN dilakukan di Plant Research International (PRI)
Wageningen, Belanda. Langkah awal yang dilakukan adalah dengan cara menguji dan membandingkan empat sistem berbeda kultur antera dan kultur mikrospora tanaman cabai dan tembakau (Dumas de Vaulx et al., 1981; Johansson et al., 1982; Dolcet-Sanjuan et al., 1997; Custers et al., 1999; Touraev and Heberle-Bors, 1999). Akhirnya, prosedur kultur sebarmikrospora („shed-microspore culture‟ yang selanjutnya disingkat „KSM‟) dipilih dan dikembangkan dalam penelitian ini (Gambar 1). Faktor utama dari prosedur ini meliputi: seleksi kuncup bunga yang mengandung ≥50% mikrospora pada fase satu-sel tahap akhir („late unicellular stage‟), praperlakuan kuncup bunga pada suhu 4°C selama satu hari, dilanjutkan dengan mengkultur antera pada sistem media dua-lapis (media cair di atas media padat) selama satu minggu pada suhu 9°C, selanjutnya pada suhu 28°C, dan semuanya dalam kondisi gelap. Media yang digunakan mengandung unsur-unsur dari Nitsch-media (Nitsch dan Nitsch 1969) dengan 2% maltosa, dan khusus untuk media padat ditambah 0.5% karbon aktif (Supena et al., 2006a).
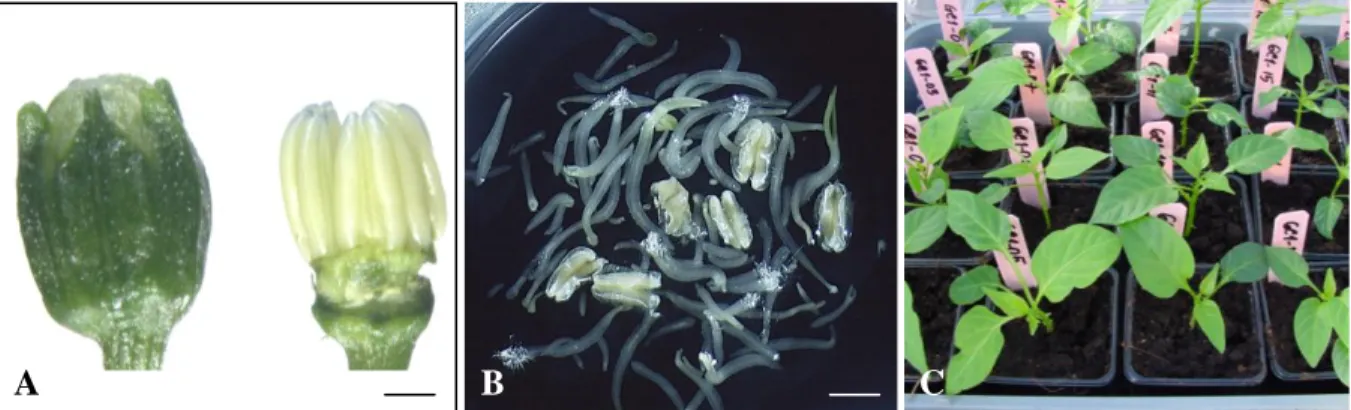
Gambar 1. Produksi tanaman haploid dan haploid ganda dengan teknik kultur sebar mikrospora cabai (Capsicum annuum L.). A: Stadia kuncup bunga dan fase antera yang tepat untuk diisolasi dan dikulturkan. B: Embrio-embrio yang terbentuk pada umur kultur 7 minggu, yang sebelumnya didahului dengan terbukanya dinding antera yang diikuti tersebarnya mikrospora dan proembrio pada medium setelah 3 minggu dari kultur. C: Tanaman haploid dan haploid ganda pada media kompos, yang sebelumnya melalui tahapan pengecambahan embrio pada media padat agar dan vermikulit aseptik dengan hara ½ MS10 (Murashige dan Skoog, 1962). Garis untuk A = 1 mm, dan untuk B = 4 mm.
Dari efisiensinya dalam memproduksi tanaman HG, prosedur KSM ini melampaui semua prosedur yang telah dilaporkan sebelumnya untuk cabai. Kultivar Tombak dan Galaxy mampu menghasilkan masing-masing 6 dan 11 embrio normal per kuncup bunga, yang 70% diantaranya mampu berkecambah normal sampai menjadi tanaman dewasa, sehingga produktivitasnya adalah 72-125 tanaman per 100 antera (Supena et al., 2006a). Seluruh dari 10 genotipe cabai lokal Indonesia yang diuji memberikan respon positif dengan prosedur KSM ini.
Prosedur KSM yang telah dikembangkan di Wageningen sangat layak untuk segera diterapkan untuk memproduksi tanaman HG cabai kutivar lokal pada kondisi lokal guna mempercepat perbaikan genetik dan pemuliaan cabai berbasis kultivar lokal. Sayangnya masih ada beberapa kendala yang menghambat penerapan teknologi ini pada kondisi lokal. Tiga faktor penting telah diidentifikasi dan sedang diusahakan pemecahannya, yaitu (i) masalah kontaminasi dari sumber eksplan, (ii) tidak efisiennya penggandaan kromosom secara in vivo pada tanaman, dan (iii) metoda yang aplikabel untuk analisis ploidi pada kondisi laboratorium lokal (Supena et al., 2006b).
Masalah kontaminasi yang diakibatkan bakteri dari sumber eksplan menjadi diperparah dengan sulitnya menyediakan tanaman sumber eksplan yang sehat pada kondisi lokal yang beriklim tropik. Langkah pertama yang sedang ditempuh adalah mengusahakan untuk mendapatkan tanaman sumber eksplan yang lebih sehat dan penggunaan beberapa jenis antibiotik dan kombinasinya untuk menangani masalah kontaminasi ini. Penggunaan antibiotik pada kultur
in vitro harus mengusahakan untuk mengurangi atau bahkan menghilangkan pengaruh negatif antibiotik pada kutur, sehingga diharapkan diperoleh kultur yang tidak terkontaminasi dan tetap mampu menghasilkan embrio. Hasil awal dari pelaksanaan penelitian dengan dana Program Insentif Riset Terapan yang dimulai tahun 2007 telah memperlihatkan hasil yang positif, sehingga produksi tanaman HG untuk kultivar cabai lokal Indonesia siap dilaksanakan (Gambar 2).
Prosiding Seminar Nasional Hasil Penelitian yang Dibiayai oleh Hibah Kompetitif Bogor, 1-2 Agustus 2007
183 Untuk masalah kedua dan ketiga telah dapat dipecahkan dengan melakukan percobaan-percobaan di Wageningen. Perlakuan kolkisin (100 μM) seminggu pertama kultur sangat efektif dalam meningkatkan frekuensi tanaman DH yang diperoleh, yaitu mampu meningkatkan dari sekiar 30% menjadi 60%. Untuk analisis ploidi, penghitungan jumlah kloroplas pada stomata daun merupakan metoda yang layak, cepat dan mudah digunakan untuk menentukan jumlah ploidi tanaman cabai pada kondisi laboratorium di Indonesia (Supena et al., 2006b).
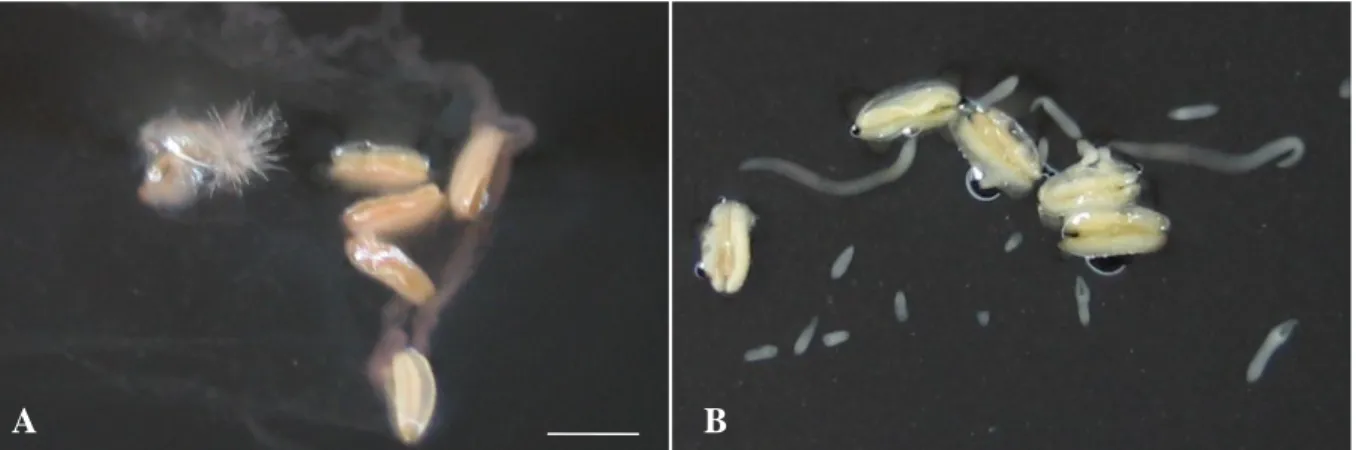
Gambar 2. Kultur sebar mikrospora cabai besar kultivar Tanjung setelah enam minggu dari awal kultur pada kondisi lokal di Bogor mulai dari persiapan sumber eksplan, proses kultur dan inkubasinya. A: Kultur umumnya terkontaminasi bakteri, dan B: Kultur tidak terkontaminasi dan dapat menghasilkan embrio setelah diberi perlakuan Rifampicin 10 mg/l + Timentin 400 mg/l pada media cairnya dari awal kultur. Garis untuk A dan B = 4 mm.
PROSPEK PERCEPATAN PENGEMBANGAN VARIETAS HIBRIDA CABAI BERBASIS KULTIVAR LOKAL
Penggunaan varietas hibrida dalam budidaya tanaman pada prinsipnya adalah upaya mengoptimalkan dan memanfaatkan efek heterosis yang ada pada tanaman tertentu. Efek heterosis dapat nampak pada keunggulan sifat agronomis seperti umur genjah, produksi dan kualitas buah meningkat serta peningkatan ketahanan terhadap hama dan penyakit (Lippert, 1975; Daskalov dan Milkova, 1991). Penggunaan varietas hibrida ini telah terbukti dapat meningkatkan produktivitas hasil tanaman secara signifikan untuk tanaman gandum, jagung, padi dan beberapa tanaman palawija. Prospek bisnis benih hibrida untuk cabai masih sangat terbuka lebar. Informasi dari Perusahaan Benih Ewindo Purwakarta, dari sekitar 28.5 ton keperluan benih cabai per tahun yang dibutuhkan pada tahun 2006, baru sekitar 7.5 ton diantaranya adalah benih hibrida, sedangkan sisanya 21 ton adalah berupa benih OP (original population) yaitu benih dengan sistem perbanyakan benih melalui penyerbukan terbuka di dalam populasi.
Faktor utama untuk dapat mengembangkan varietas hibrida adalah ketersediaan keragaman genetik yang cukup yang direpresentasikan dalam galur-galur murni sebagai calon tetua. Dengan telah diadaptasikan dan dapat diterapkannya prosedur KSM antera cabai pada kondisi lokal di Bogor untuk memproduksi secara cepat tanaman HG dari cabai kultivar lokal. Tahapan berikutnya yang akan dilakukan adalah identifikasi dan karakterisasi tanaman cabai HG yang dihasilkan, baik untuk sifat morfologis maupun agronomis. Tanaman cabai HG yang memiliki sifat morfologis dan atau agronomis berbeda, baik untuk cabai besar maupun cabai keriting, akan dijadikan bahan untuk pelaksanaan persilangan dialel untuk selanjutnya menguji dan mengetahui daya gabung umum dan atau daya gabung khusus diantara tanaman HG dalam rangka mendapatkan calon tetua potensial dan calon varietas hibrida harapan. Tanaman-tanaman F1 (hibrida) dari kombinasi persilangan tanaman HG yang memperlihatkan vigor sifat agronomis potensial akan diuji daya hasilnya pada luasan petak percobaan tertentu. Tahapan terakhir dari rangkaian penelitian adalah menguji multi lokasi beberapa hibrida potensial terpilih sebagai calon varietas hibrida cabai di beberapa sentra pertanaman cabai. Dengan demikian, diharapkan dari rangkaian kegiatan penelitian dapat membuktikan bahwa penerapan teknologi haploid dapat mempercepat proses pemulian tanaman cabai dengan diperolehnya beberapa kandidat varietas hibrida cabai unggul yang dapat beradaptasi baik pada sejumlah daerah sentra produksi cabai di Indonesia karena berbasis kultivar lokal setempat.
UCAPAN TERIMA KASIH
Hasil-hasil penelitian yang diungkapkan dalam makalah ini didanai oleh Program Hibah Kompetitif DP3M Ditjen DIKTI baik melalui Program Hibah Bersaing Perguruan Tinggi maupun program hibah kompetitif sebelumnya, dana OPF-IPB dan proyek Biotechnology Research Indonesia-Netherlands (BIORIN) yang didanai oleh the Royal Netherlands Academy of Arts and Sciences (KNAW) Belanda, serta Program Insentif Riset Terapan dari Menristek yang dimulai tahun 2007. Penulis menyampaikan terima kasih khusus kepada Dr. Jan B.M. Custers dari Plant Research International (PRI) Wageningen sebagai ketua proyek dan sekaligus patner dari Belanda atas segala bantuan, bimbingan dan dukungannya. Penulis juga menyampaikan penghargaan dan terima kasih kepada Prof. Dr. Ir. Jajah Koswara yang dalam periode kepemimpinannya di DP3M Ditjen DIKTI Depdiknas telah menumbuhkembangkan gairah penelitian, khususnya dikalangan dosen perguruan tinggi.
DAFTAR PUSTAKA
Budiono, R. 1990. Analisis penampilan morfologi koleksi cabai (Capsicum spp.). Skripsi, Biologi FMIPA-IPB, Bogor.
Caranta, C., A. Palloix, K. Gebre-Selassie, V. Lefebvre, B. Moury, and A. M. Daubèze. 1996. A complementation of two genes originating from susceptible Capsicum annuum lines confers a new and complete resistance to pepper veinal mottle virus. Phytopathol 86:739-743.
Christensen, H. M. and R. Bamford. 1943. Haploids in twin seedlings of pepper, Capsicum annuum L. J. Heredity 34:99-104.
Custers, J. B. M., S. C. H. J. Snepvangers, H. J. Jansen, L. Zhang, and M. M. van Lookeren Campagne. 1999. The 35s-CaMV promoter is silent during early embryogenesis but activated during nonembryogenic sporophytic development in microspore culture. Protoplasma 208: 257-264.
Daskalov, S. and L. Milkova. 1991. Induced mutations used in heterosis breeding of pepper (Capsicum annuum L.), p. 499-504. Proceeding of an International Symposium: Plant Mutation Breeding for Crop Improvement, vol.1. Vienna, 18-22 June 1990.
Deptan (Departemen Pertanian). 2007. Sistem Informasi Eksekutif: Subsektor Hortikultura. http://www.deptan.go.id/infoeksekutif/horti/2007.
Djian-Caporalino, C., L. Pijarowski, A. Fazari, M. Samson, L. Gaveau, C. O‟Byrne, V. Lefebvre, C. Caranta, A. Palloix, and P. Abad. 2001. High-resolution genetic mapping of the pepper (Capsicum annuum L.) resistance loci Me3 and Me4 conferring heat-stable resistance to root-knot nematodes (Meloidogyne spp.). Theor. Appl. Genet. 103:593-600.
Dolcet-Sanjuan, R., E. Claveria, andA. Huerta. 1997. Androgenesis in Capsicum annuum L.-Effects of carbohydrate and carbon dioxide enrichment. J. Amer. Soc. Hort. Sci. 122:468-475.
Dumas de Vaulx, R., D. Chambonnet, and E. Pochard. 1981. Culture in vitro d‟anthères du
piment (Capsicum annuum L.): amélioration des taux d‟obtention de plantes chez différents
génotypes par des traitements à +35°C. Agronomie 1:859-864.
Farnham, M. W., M. Wang, and C. E. Thomas. 2002. A single dominant gene for downy mildew resistance in broccoli. Euphytica 128:405-407.
FAO (Food and Agriculture Organization of the United Nation). 2006. Agriculture statistics. http://faostat.fao.org
Ferrie, A. M., C. E. Palmer, and W. A. Keller. 1994. Biotechnological application of haploids, p. 77-110. In: Shargool PD & Ngo TT (Eds.). Biotechnological Applications of Plant Cultures. CRC, Baca Raton.
George, L. and S. Narayanaswamy. 1973. Haploid Capsicum through experimental androgenesis. Protoplasma 78:467-470.
Gémesné, J. A., Z. S. Sági, P. Salamon, N. Somogyi, L. Zatykó, and G. Venzcel. 1998. Experiences and results of in vitro haploid methods application in pepper breeding programme, pp 201-205. Proceedings of the Xth Meeting on Genetics and Breeding of Capsicum and Eggplant, Avignon, France, Sept. 7-11, 1988.
Guha, S and S. C. Maheshwari. 1964. In vitro production of embryos from anthers of Datura. Nature 204:496.
Prosiding Seminar Nasional Hasil Penelitian yang Dibiayai oleh Hibah Kompetitif Bogor, 1-2 Agustus 2007
185 __________________________. 1966. Cell division and differentiation of embryos in the pollen
grains of Datura in vitro. Nature 212:97-98.
Gyulai, G., J. A. Gémesné, Z. S. Sági, G. Venczel, P. Pintér, Z. Kristóf, O. Törjék, L. Heszky, S. Bottka, J. Kriss, and L. Zatykó. 2000. Doubled haploid development and PCR-analysis of F1 hybrid derived DH-R2 paprika (Capsicum annuum L.) lines. Plant Physiol. 156:168-174. Guhardja, E., I. Widodo, and E. D. J. Supena. 1991. Pemuliaan tanaman serta studi hubungan
genetic antar spesies atau ras cabe (Capsicum annuum dan Capsicum frutescense). Laporan Penelitian DP3M-DIKTI, FMIPA-IPB. Bogor.
Hidayah, T. L. 1991. Analisis kariotipe kromosom beberapa koleksi cabe (Capsicum spp.). Skripsi, Biologi FMIPA-IPB. Bogor.
Jansen, C. J. 1974. Chromosome doubling techniques in haploids, p. 153-190. In: Kasha KJ (Ed.). Haploids in Higher Plants, Advances and Potential. Proceeding of the First International Symposium, Guelph, Ontario, June 10-14, 1974.
Johansson, L., B. Andersson, and T. Eriksson. 1982. Improvement of anther culture technique: activated charcoal bound in agar medium in combination with liquid medium and elevated CO2 concentration. Physiol. Plant. 54:24-30.
Lefebvre, V., A. M. Daubèze, J. Rouppe van der Voort, J. Peleman, M. Bardin, and A. Palloix. 2003. QTLs for resistance to powdery mildew in pepper under natural and artificial infection. Theor. Appl. Genet. 107:661-666.
Lippert, L. F. 1975. Heterosis and combining ability in chili peppers by diallel analysis. Crop Sci 15:323-325.
Mahmood, T., U. Ekuere, F. Yeh, A. G. Good, and G. R. Stringam. 2003. RFLP linkage analysis and mapping genes controlling the fatty acid profile of Brassica juncea using reciprocal DH populations. Theor. Appl. Genet. 107:283-290.
Morrison, R. A., R. E. Koning, and D. A. Evans. 1986. Anther culture of an interspecific hybrid of Capsicum. Plant Physiol. 126:1-9.
Munyon, I. P., J. F. Hubstenberger, and G. C. Phillips. 1989. Origin of plantlets and callus obtained from chile anther cultures. In Vitro Cell Dev. Biol. 25:293-296.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bio-assays with tobacco tissue culture. Physiol. Plant. 15:473-497.
Muto‟ah. 1992. Studi morfologi dan ketahanan terhadap Pseudomonas solanasearum E.F. Smith pada F2 persilangan antara Capsicum frutescense L. (CR 04) x Capsicum annuum L. (CB 12A). Skripsi. Biologi FMIPA-IPB, Bogor.
Mityko, J., A. Andrasfalvy, G. Csillery, and M. Fari. 1995. Anther culture response in different genotypes and F1 hybrids of pepper (Capsicum annuum L.). Plant Breed. 114:78-80.
Nitsch, J. P. and C. Nitsch. 1969. Haploid plants from pollen grains. Science 163:85-85.
Palmer, C. E. and W. A. Keller. 1999. Haploidy, p. 247-286. In: Gómez-Campo C (Ed.). Biology of Brassica Coenospecies. Elsevier, Amsterdam.
Pochard, E. and R. Dumas de Vaulx. 1979. Haploid parthenogenesis in Capsicum annuum L, p. 455-472. In: J. G. Hawkes, R. N. Lester, and A. D. Skelding (Eds.). The Biology and Taxonomy of the Solanaceae, Academic Press, London.
Qin, X and G. L. Rotino. 1993. Anther culture of several sweet and hot pepper genotypes. Capsicum and Eggplant Nwsl. 12:59-62.
Sibi, M., R. Dumas de Vaulx, and D. Chambonnet. 1979. Obtention de plantes haplöides par androgenèse in vitro chez le piment (Capsicum annuum L.). Ann. Amélior Plantes 29:583-606.
Somers, D. J., K. R. D. Friesen, and G. Rakow. 1998. Identification of molecular markers assosiated with linolenic acid desaturation in Brassica napus. Theor. Appl. Genet. 96:897-903.
Suharsono dan E. D. J. Supena. 1998. Induction of gynogenesis and androgenesis in hot pepper (Capsicum annuum L.) using gamma irradiation. Symposium and Meeting for Further Development of Horticulture in East Asia. Tokyo University of Agriculture and Technology, Japan, April 2-4, 1998.
Supena, E. D. J. dan Widyastuti. 1997. Induksi steril jantan pada tanaman cabai (Capsicum annuum L.) dengan radiasi sinar gamma (Cs137). Laporan Penelitian IPB, Bogor.
Supena, E. D. J. 1999. Pembentukan galur murni cabai (Capsicum annuum L.) menggunakan teknik in vitro dan mutagenesis. Laporan Penelitian Hibah Bersaing V – IPB, Bogor.
Supena, E. D. J., S. Suharsono, E. Jacobsen, and J. B. M. Custers. 2006a. Successful development of shed-microspore culture protocol for doubled haploid production in Indonesian hot peppers (Capsicum annuum L.). Plant Cell. Rep. 25 (1):1-10.
Supena, E. D. J., W. Muswita, S. Suharsono, and J. B. M. Custers. 2006b. Evaluation of crucial factors for implementing shed-microspore culture of Indonesian hot pepper (Capsicum annuum L.) cultivars. Scientia Horticulturae 107 (3):226-232.
Touraev, A and E. Heberle-Bors. 1999. Microspore embryogenesis and in vitro pollen maturation in tobacco, pp 281-291. In: Hall RD (ed.) Methods in Molecular Biology, Vol.111: Plant Cell Culture Protocols. Humana, Totowa, NJ.
Trimarmono, A. 1993. Studi sebaran sifat-sifat tanaman F2 hasil persilangan antar galur cabe (Capsicum spp.). Skripsi, Biologi FMIPA-IPB, Bogor.
Wang, Y. Y., C. S. Sun, C. C. Wang, and N. F. Chien. 1973. The induction of pollen plantlets of triticale and Capsicum annuum from anther culture. Scientia Sinica 16:147-151.
Widodo, I. 1991. Hubungan genetik antar spesies/ras cabe. Tesis. Program Pascasarjana-IPB, Bogor.