Bakteri yang terdapat pada suspensi lumpur dikultivasi selama 3 hari pada
kondisi anaerob dan aerob. Kultivasi pada kondisi anaerob menggunakan tabung
ulir berisi media cair, 400 mg/L zat warna tekstil dan 2 g/L glukosa. Kultivasi pada
kondisi aerob menggunakan erlenmeyer berisi media cair 150 mg/L zat warna
tekstil dan 2 g/L glukosa. Perubahan yang terjadi pada kultivasi secara anaerob
adalah warna menjadi pudar dan agak keruh sedangkan pada kondisi aerob
warna hampir tidak berubah dan keruh. Hasil pengamatan ini menunjukkan
bahwa bakteri yang terdapat pada lumpur limbah tekstil memiliki tingkat
ketahanan yang tinggi terhadap zat warna azo. Ketahanan yang tinggi dari
bakteri terhadap zat warna tekstil disebabkan karena bakteri tersebut sudah lama
beradaptasi dengan lingkungan limbah tekstil. Perombakan zat warna azo
menggunakan bakteri berlangsung lebih efisien pada kondisi anaerob
dibandingkan dengan kondisi aerob.
Pada kondisi anaerob, bakteri dari lumpur limbah tekstil Mama & Leon lebih
mampu merombak zat warna reaktif azo dibandingkan dengan bakteri dari
lumpur Sungai Badung. Sedangkan pada kondisi aerob, kemampuan adaptasi
dan pertumbuhan bakteri dari lumpur Sungai Badung lebih baik dibandingkan
dengan bakteri dari lumpur limbah tekstil Mama & Leon. Perombakan zat warna
remazol yellow, remazol red, remazol black, remazol blue
dan
remazol
campuran
oleh bakteri yang hidup pada lumpur limbah tekstil Mama & Leon pada kondisi
anaerob (tabung ulir) dan bakteri dari lumpur Sungai Badung pada kondisi aerob
(erlenmeyer) selama 3 hari inkubasi disajikan pada Gambar 22.
Gambar 22 Perombakan zat warna remazol pada kultivasi suspensi lumpur pada
kondisi anaerob (tabung ulir) dan aerob (erlenmeyer) selama 3 hari
A B C D E A B C D E A=Remazol yellow B=Remazol red C=Remazol black D=Remazol blue E=Remazol campuranGambar 22 memperlihatkan bahwa zat warna reaktif azo mudah
mengalami perombakan pada kondisi anaerob dan sebaliknya cukup stabil pada
kondisi aerob. Sulitnya zat warna azo mengalami oksidasi disebabkan oleh
kromofor (N=N) pada zat warna azo lebih mudah menerima elektron
dibandingkan dengan melepaskan elektron. Stabilnya zat warna azo,
menyebabkan bakteri pada umumnya kurang mampu menggunakan zat warna
azo secara langsung sebagai sumber karbon dan energi melainkan diperlukan
kosubstrat berupa karbon organik yang berfungsi sebagai pendonor elektron
untuk proses perombakan. Glukosa yang digunakan sebagai sumber karbon
mengalami proses glikolisis menghasilkan koenzim NADH yang berfungsi
sebagai pendonor elektron yang berperan penting dalam pemutusan ikatan azo
pada kondisi anaerob. Namun, pada kondisi aerob (ada oksigen), proses reaksi
redoks antara zat warna azo dengan NADH mengalami hambatan karena zat
warna azo dan oksigen berkompetisi sebagai penerima elektron dari NADH. Ion
hidrogen pada NADH lebih mudah ditransfer ke oksigen dibandingkan dengan ke
zat warna azo. Akibatnya, transfer elektron cendrung terjadi dari molekul NADH
ke oksigen melalui rantai pernapasan. Dengan demikian, proses perombakan zat
warna azo menggunakan bakteri lebih mudah berlangsung pada kondisi anaerob
dibandingkan dengan kondisi aerob. Hasil pengamatan ini sejalan dengan
beberapa kajian yang telah dilakukan oleh Ganes
et al
. (1994) dan Van der Zee
(2002), yang menyatakan bahwa perombakan zat warna azo berlangsung lebih
efektif dan efisien pada kondisi anaerob dibandingkan dengan kondisi aerob.
Efisiensi perombakan dapat ditingkatkan dengan menambahkan glukosa sebagai
kosubstrat.
Hasil isolasi bakteri dari lumpur limbah tekstil diperoleh sebanyak 27
bakteri, sedangkan dari lumpur Sungai Badung diperoleh 5 bakteri. Bakteri yang
terseleksi dari lumpur limbah tekstil Mama & Leon, terdiri dari 6 isolat (1-6) hasil
kultivasi pada media cair yang mengandung zat warna
remazol yellow
, 5 isolat
(7-11) yang mengandung zat warna
remazol red
, 6 isolat (12-17) yang
mengandung zat warna
remazol black
, 4 isolat (18-21) yang mengandung zat
warna
remazol blue
, dan sebanyak 6 isolat (22-27) yang dikultivasi pada media
cair yang mengandung campuran dari keempat zat warna remazol tersebut.
Sebanyak 5 bakteri yang terseleksi dari lumpur Sungai Badung masing-masing
hasil kultivasi pada media cair yang mengandung zat warna
remazol yellow,
remazol red,
remazol black,
remazol blue
dan campuran keempat zat warna
remazol
tersebut. Semua bakteri yang terseleksi diidentifikasi morfologi dan
aktivitas biokimianya untuk mengetahui genus bakteri yang paling dominan hidup
dalam limbah tekstil.
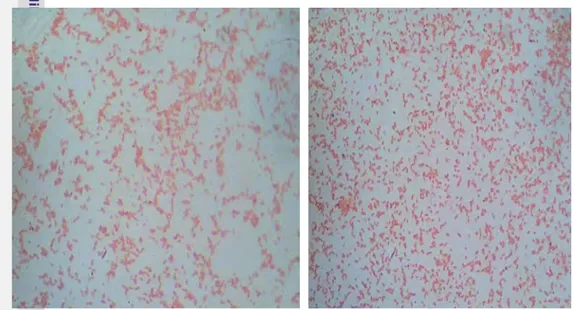
Tahapan identifikasi dimulai dari uji morfologi menggunakan pewarnaan
Gram. Hasil pewarnaan Gram terhadap 32 isolat hasil isolasi dari lumpur limbah
tekstil dan Sungai Badung, setelah diamati dengan mikroskop pada pembesaran
1000x menunjukkan sel berwarna merah dan berbentuk batang. Hasil uji
morfologi dengan pewarnaan Gram bakteri tersebut disajikan pada Gambar 23.
Hasil pengamatan ini memberikan gambaran bahwa semua bakteri yang
terseleksi dari lumpur limbah tekstil Mama & Leon dan lumpur Sungai Badung
dikatagorikan sebagai bakteri Gram negatif.
Gambar 23 Pewarnaan Gram bakteri di bawah pengamatan mikroskop
pembesaran 1000X
Kajian-kajian terhadap isolasi dan identifikasi bakteri dari lumpur limbah
industri memberikan gambaran bahwa kebanyakan bakteri yang hidup di lumpur
pengolahan limbah merupakan bakteri Gram negatif. Kajian yang dilakukan
Yazdi
et al.
(2001), melaporkan bahwa sebanyak 20 isolat yang berhasil diisolasi
dari lumpur aktif yang digunakan untuk pengolahan limbah cair, diperoleh 18
isolat merupakan bakteri Gram negatif termasuk ke dalam
Achromobacter
sp.
,
Alcaligenes
sp.
, Flavobacterium
sp.
dan Pseudomonas
sp. dan hanya 2 isolat
teridentifikasi bakteri Gram positif yaitu
Bacillus
sp. dan
Micrococcus
sp.
Dominansi bakteri Gram negatif yang terseleksi pada kultivasi lumpur limbah
tekstil disebabkan penambahan zat warna ke dalam media seleksi. Pada
umumnya, bakteri Gram positif lebih peka terhadap pengaruh zat warna
dibandingkan dengan bakteri Gram negatif. Hal ini disebabkan dinding sel bakteri
Gram positif lebih mudah rusak akibat pengaruh zat warna. Menurut
Dwidjoseputro (2005), penambahan zat warna seperti zat warna hijau malaksit ke
dalam media tumbuh merupakan cara untuk mencegah pertumbuhan bakteri
Gram positif.
Identifikasi terhadap bakteri perombak zat warna tekstil dilakukan dengan
cara mencocokkan hasil uji morfologi dan uji aktivitas biokimia dari setiap bakteri
tersebut dengan uji morfologi dan uji aktivitas biokimia yang terdapat pada
Bergey’s Manual of Determinative Bacteriology
. Aktivitas biokimia setiap jenis
bakteri adalah berbeda-beda karena setiap bakteri mempunyai aktivitas
enzimatik yang berbeda. Hasil identifikasi terhadap 27 bakteri yang berhasil
diisolasi dari lumpur limbah tekstil CV. Mama & Leon diduga sebanyak 10
bakteri termasuk
Aeromonas
sp., 6 bakteri
Pseudomonas
sp., 5 bakteri termasuk
Flavobacterium
sp., 3 bakteri termasuk
Plesiomonas
sp. dan 3 bakteri
Vibrio
sp.
Sedangkan 5 bakteri yang terseleksi dari lumpur Sungai Badung diduga 3 bakteri
termasuk
Vibrio
sp dan 2 bakteri
Plesiomonas
sp. Hasil uji morfologi dan
karakteristik fisiologi bakteri-bakteri tersebut disajikan pada Tabel 6.
Uji motilitas menunjukkan sebanyak 26 bakteri tersebut adalah motil dan 6
bakteri bersifat nonmotil. Motilitas atau pergerakan bakteri disebabkan karena sel
bakteri memiliki flagella. Bakteri berbentuk spiral dan batang kebanyakan
mempunyai flagella dan motil sedangkan hanya sedikit bakteri yang berbentuk
kokus (bola) bersifat motil (Dwidjoseputro, 2005). Uji oksidase dihubungkan
dengan adanya sitokrom dalam kadar yang tinggi yang dipakai untuk mengenal
bakteri yang termasuk ke dalam genus
Pseudomonas
dan
Neisseria.
Uji oksidasi
positif ditandai adanya warna merah tua sampai hitam akibat aktivitas sitokrom
terhadap paraaminodimetilanilin. Uji oksidase terhadap bakteri menunjukkan
semua bakteri yang diisolasi memberikan uji positif (Tabel 6). Uji katalase untuk
menentukan adanya enzim katalase yang dipakai untuk mengkatalisis
penguraian hidrogen peroksida menjadi air dan oksigen. Hidrogen peroksida
bersifat toksik terhadap sel karena molekul ini menginaktivasikan enzim dalam
sel. Hasil uji katalase menunjukkan semua bakteri yang diisolasi memberikan uji
positif (Tabel 6).
Tes pembentukan indol bertujuan untuk memeriksa kemampuan bakteri
untuk mendegradasi asam amino esensial triptopan. Enzim yang berperan dalam
proses ini adalah triptopanase. Produk metabolit triptopan adalah indol, asam
piruvat dan amonia. Terbentuknya Indol dapat dideteksi dengan pereaksi
Kovac’s
menghasilkan warna merah yang merupakan kompleks antara indol dengan
paradimetilaminobenzaldehid. Dua puluh satu bakteri hasil isolasi menunjukkan
tes positif terhadap pembentukan indol. Uji sitrat bertujuan untuk mengetahui
kemampuan bakteri untuk memecah sitrat yang dibantu adanya enzim sitrat
permease. Beberapa bakteri dapat menggunakan sitrat sebagai sumber energi.
Enzim sitrat permease berperan dalam membawa sitrat dari luar sel ke dalam
sel. Sitrat yang telah berada dalam sel akan masuk ke dalam siklus Krebs. Pada
siklus Krebs, sitrat diubah menjadi asam oksaloasetat dan asam asetat dengan
bantuan enzim sitrase. Selanjutnya asam oksaloasetat dan asam asetat dirubah
menjadi asam piruvat dan karbon dioksida. Uji penggunaan sitrat positif ditandai
dengan terjadinya perubahan warna dari hijau menjadi biru dari indikator
bromothymol blue
. Sifat basa pada media terjadi karena terbentuknya natrium
bikarbonat hasil yang merupakan hasil reaksi antara karbon dioksida dengan
simmons citrate.
Hasil tes penggunaan sitrat menunjukkan bahwa 22 isolat
bakteri memiliki ensim sitrat permease atau tes positif (Tabel 6). Uji
dekarboksilasi bakteri terhadap suatu asam amino merupakan reaksi pemecahan
gugus karboksil oleh enzim dekarboksilase, sehingga dihasilkan amina dan
karbon dioksida. Uji dekarboksilasi asam amino menggunakan 2 substrat yaitu
asam amino arginin dan ornithin. Uji positif ditandai terbentuknya warna ungu.
Hasil uji dekrboksilasi menggunakan asam amino arginin diperoleh sebanyak 14
bakteri memberikan uji yang positif dan 11 memberikan hasil negatif. Sedangkan
menggunakan ornithin, sebanyak 4 bakteri memberikan hasil positif dan 21
memberikan hasil uji negatif (Tabel 6).
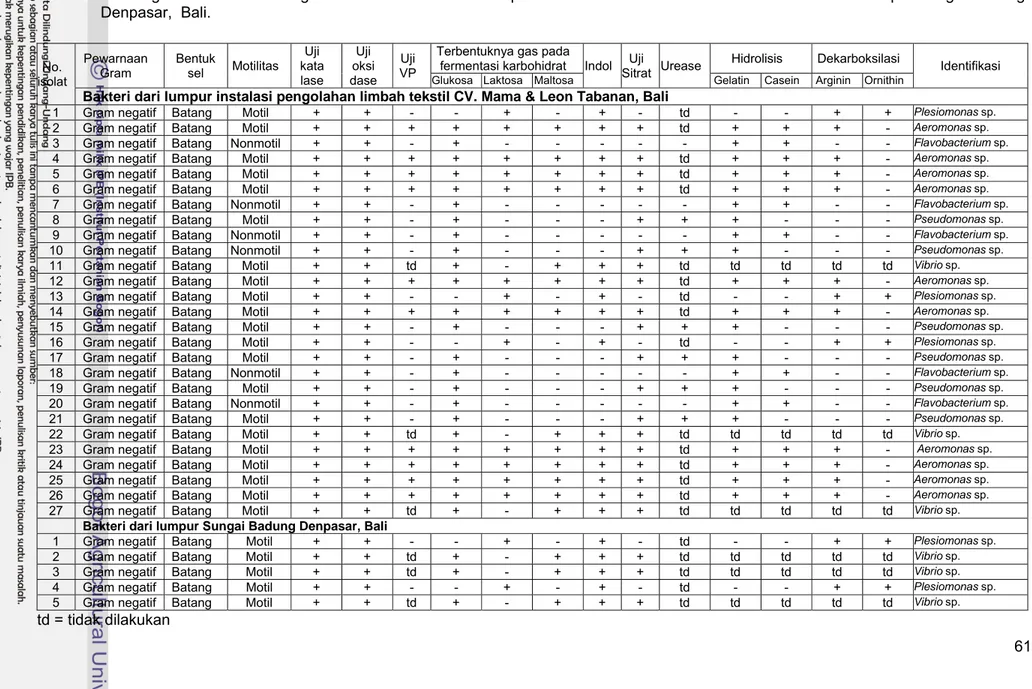
Tabel 6 Morfologi dan karakter fisiologi bakteri hasil isolasi dari lumpur limbah tekstil CV. Mama & Leon Tabanan dan lumpur Sungai Badung
Denpasar, Bali.
No. isolat Pewarnaan Gram Bentuk sel Motilitas Uji kata lase Uji oksi dase Uji VPTerbentuknya gas pada
fermentasi karbohidrat Indol Sitrat Uji Urease Hidrolisis Dekarboksilasi Identifikasi
Glukosa Laktosa Maltosa Gelatin Casein Arginin Ornithin
Bakteri dari lumpur instalasi pengolahan limbah tekstil CV. Mama & Leon Tabanan, Bali
1 Gram negatif Batang Motil + + - - + - + - td - - + + Plesiomonas sp.
2 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
3 Gram negatif Batang Nonmotil + + - + - - - - - + + - - Flavobacterium sp.
4 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
5 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
6 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
7 Gram negatif Batang Nonmotil + + - + - - - - - + + - - Flavobacterium sp.
8 Gram negatif Batang Motil + + - + - - - + + + - - - Pseudomonas sp.
9 Gram negatif Batang Nonmotil + + - + - - - - - + + - - Flavobacterium sp.
10 Gram negatif Batang Nonmotil + + - + - - - + + + - - - Pseudomonas sp.
11 Gram negatif Batang Motil + + td + - + + + td td td td td Vibrio sp.
12 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
13 Gram negatif Batang Motil + + - - + - + - td - - + + Plesiomonas sp.
14 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
15 Gram negatif Batang Motil + + - + - - - + + + - - - Pseudomonas sp.
16 Gram negatif Batang Motil + + - - + - + - td - - + + Plesiomonas sp.
17 Gram negatif Batang Motil + + - + - - - + + + - - - Pseudomonas sp.
18 Gram negatif Batang Nonmotil + + - + - - - - - + + - - Flavobacterium sp.
19 Gram negatif Batang Motil + + - + - - - + + + - - - Pseudomonas sp.
20 Gram negatif Batang Nonmotil + + - + - - - - - + + - - Flavobacterium sp.
21 Gram negatif Batang Motil + + - + - - - + + + - - - Pseudomonas sp.
22 Gram negatif Batang Motil + + td + - + + + td td td td td Vibrio sp.
23 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
24 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
25 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
26 Gram negatif Batang Motil + + + + + + + + td + + + - Aeromonas sp.
27 Gram negatif Batang Motil + + td + - + + + td td td td td Vibrio sp.
Bakteri dari lumpur Sungai Badung Denpasar, Bali
1 Gram negatif Batang Motil + + - - + - + - td - - + + Plesiomonas sp.
2 Gram negatif Batang Motil + + td + - + + + td td td td td Vibrio sp.
3 Gram negatif Batang Motil + + td + - + + + td td td td td Vibrio sp.
4 Gram negatif Batang Motil + + - - + - + - td - - + + Plesiomonas sp.
5 Gram negatif Batang Motil + + td + - + + + td td td td td Vibrio sp.
td = tidak dilakukan
4.2 Efisiensi Perombakan Zat Warna Pada Variasi Kondisi Lingkungan
Pertumbuhan dan aktivitas bakteri sangat dipengaruhi oleh kondisi
lingkungan. Bakteri dalam merombak bahan organik untuk memenuhi kebutuhan
nutrisi dan energinya memerlukan bantuan enzim. Aktivitas enzim dalam
peranannya sebagai katalis dipengaruhi oleh faktor lingkungan, di mana enzim
mempunyai aktivitas tinggi pada kondisi tertentu dan bersifat nonaktif pada
kondisi yang tidak menguntungkan. Faktor lingkungan mempengaruhi efisiensi
perombakan yang dianalisis di antaranya adalah pH, konsentrasi glukosa,
konsentrasi zat warna dan lama waktu inkubasi.
4.2.1 Efisiensi Perombakan Pada Variasi pH
Data efisiensi perombakan 200 mg/L zat warna reaktif azo jenis
remazol
selama 5 hari inkubasi pada kondisi pH yang berbeda-beda (pH 5-9) disajikan
pada Lampiran 2. Berdasarkan data kemampuan dari masing-masing bakteri
untuk melakukan perombakan dipilih 5 bakteri yang mempunyai efisiensi
perombakan tertinggi dari masing-masing zat warna. Kelima bakteri tersebut
terdiri dari 3 bakteri termasuk
Aeromonas
sp. (
Aeromonas
sp.ML6,
Aeromonas
sp.ML14 dan
Aeromonas
sp.ML24)
,
Pseudomonas
sp.ML8, dan bakteri
Flavobacterium
sp.ML 20
.
Hasil perombakan 200 mg/L zat warna reaktif azo
oleh kelima bakteri tersebut selama 5 hari inkubasi pada kondisi pH yang
berbeda-beda disajikan pada Gambar 24.
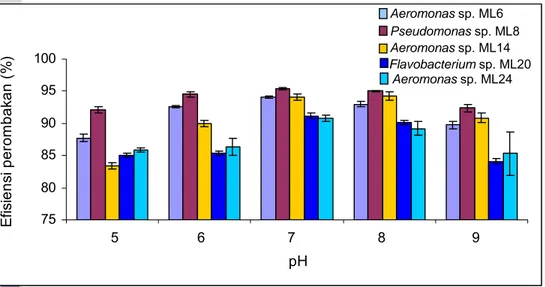
Gambar 24 Efisiensi perombakan zat warna pada kondisi anaerob selama 5 hari
inkubasi diberbagai kondisi pH.
75 80 85 90 95 100 1 2 3 4 5 pH E fis iens i per om bak an ( % ) Aeromonas sp. ML6 Pseudomonas sp. ML8 Aeromonas sp. ML14 Flavobacterium sp. ML20 Aeromonas sp. ML24 5 6 7 8 9
Gambar 24 menunjukkan bahwa efisiensi perombakan masing-masing zat
warna dipengaruhi pH lingkungan. Efisiensi perombakan zat warna oleh bakteri
meningkat dengan naiknya kondisi pH lingkungan dari 5 sampai 7 kemudian
cendrung stabil pada pH 7-8 dan menurun pada pH 9. Analisis faktor pH
terhadap efisiensi perombakan zat warna menggunakan
one-way
Anova selang
kepercayaan 95% menunjukkan bahwa perlakuan perombakan zat warna azo
pada kondisi pH yang berbeda menghasilkan efisiensi perombakan yang
berbeda pula (Lampiran 3). Kondisi pH optimum untuk berlangsungnya proses
perombakan 200 mg/L zat warna azo selama 5 hari inkubasi pada kisaran pH 7-8
dengan efisiensi perombakan berkisar 89,19 sampai 94,38%. Hasil penelitian ini
memperkuat simpulan HeFang
et al.
(2004) dan Moosvi
et al
. ( 2005), yang
menyatakan bahwa perombakan zat warna azo menggunakan bakteri sangat
dipengaruhi oleh kondisi pH lingkungan. Hasil kajian HeFang
et al.
(2004)
tentang perombakan zat warna azo
direct fast scarlet
4BS menggunakan
konsorsium yang terdiri dari
white-rot fungus
dan
Pseudomonas
1-10 yang
diisolasi dari air limbah tekstil selama 4 hari inkubasi menunjukkan efisiensi
perombakan warna pada pH 3 adalah 73%, pH 4 adalah 83%, pH 7 adalah 95%
sedangkan pada pH 8 dan 10 masing-masing 90% dan 76%.
Pseudomonas
1-10
menstimulasi produksi enzim ekstraseluler lignolitik peroksidase dari
white-rot
fungus
8-4 yang berperan dalam perombakan zat warna azo tersebut. Hasil
kajian Moosvi
et al
. (2005) tentang perombakan zat warna azo
reactive violet
5
menggunakan konsorsium bakteri RVM 11.1 yang diisolasi dari tanah yang
terkontaminasi limbah tekstil selang waktu 37 jam melaporkan bahwa efisiensi
perombakan warna pada pH dibawah 5,5 sangat rendah sedangkan efisiensinya
90% diperoleh pada kisaran pH 6,5 sampai 8,5.
Perbedaan efisiensi perombakan zat warna pada variasi kondisi pH
disebabkan oleh perubahan aktivitas pertumbuhan bakteri. Beberapa bakteri
dapat tumbuh dan beraktivitas baik pada lingkungan asam dan beberapa bakteri
juga tumbuh baik pada lingkungan basa. Namun, kebanyakan bakteri hidup dan
beraktivitas baik pada kondisi pH netral (Cutright 2001). Pada kondisi lingkungan
tidak menguntungkan, pertumbuhan bakteri menjadi terganggu bahkan mati.
Terganggunya pertumbuhan bakteri menyebabkan efisiensi perombakan zat
warna menjadi rendah. Disamping pertumbuhan bakteri, aktivitas enzim yang
terlibat pada proses perombakan juga sangat dipengaruhi oleh pH. Enzim pada
sistem biologi sebagian besar merupakan protein yang mempunyai gugus aktif
yang bermuatan positif (+) dan negatif (-). Aktivitas enzim akan optimum jika
terjadi keseimbangan antar kedua muatannya. Bila proses perombakan
berlangsung pada pH tidak optimum, maka aktivitas enzim akan menurun akibat
terjadinya perubahan ionisasi gugus-gugus pada sisi aktif enzim. Pada kondisi
asam (pH rendah), enzim lebih bermuatan positif sedangkan pada kondisi basa
(pH tinggi), maka enzim lebih bermuatan negatif.
4.2.2 Efisiensi Perombakan pada Variasi Konsentrasi Glukosa
Penambahan glukosa pada proses perombakan zat warna reaktif azo
menggunakan bakteri ditujukan untuk mempercepat laju perombakan. Hal ini
disebabkan karena zat warna reaktif azo sulit digunakan secara langsung
sebagai sumber karbon dan energi untuk pertumbuhannya. Data perombakan
200 mg/L zat warna
remazol
menggunakan bakteri
Aeromonas
sp.ML6,
Aeromonas
sp.ML14,
Aeromonas
sp.ML24
, Pseudomonas
sp.ML8
dan
Flavobacterium
sp.ML20 pada kondisi anaerob selama 5 hari inkubasi pada
variasi penambahan konsentrasi glukosa (0-4 g/L) disajikan pada Gambar 25.
Data selengkapnya disajikan pada Lampiran 4.
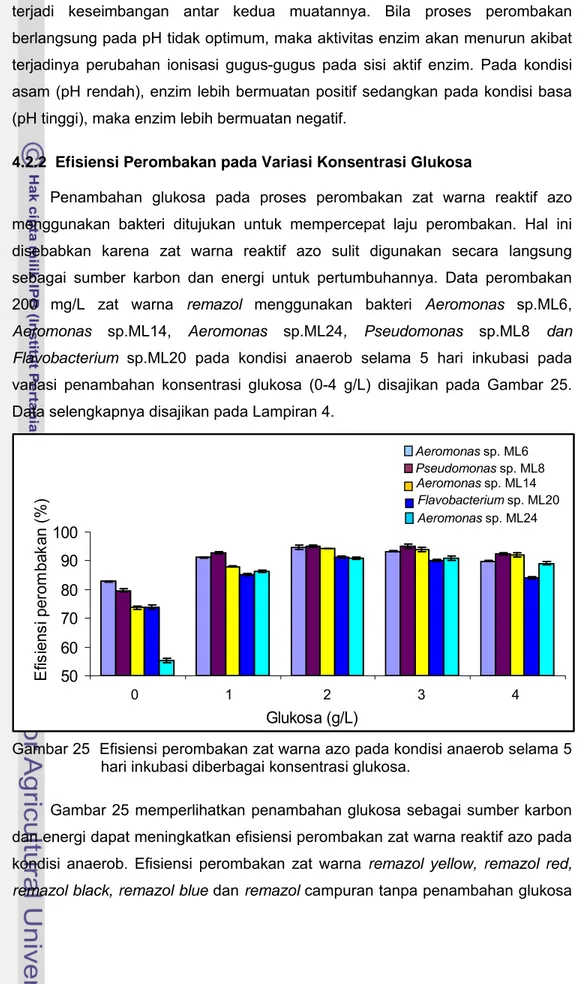
Gambar 25 Efisiensi perombakan zat warna azo pada kondisi anaerob selama 5
hari inkubasi diberbagai konsentrasi glukosa.
Gambar 25 memperlihatkan penambahan glukosa sebagai sumber karbon
dan energi dapat meningkatkan efisiensi perombakan zat warna reaktif azo pada
kondisi anaerob. Efisiensi perombakan zat warna
remazol yellow, remazol red,
remazol black, remazol blue
dan
remazol
campuran tanpa penambahan glukosa
50
60
70
80
90
100
1 2 3 4 5Glukosa (g/L)
E
fis
iens
i per
om
ba
kan (
%
)
Aeromonas sp. ML6 Pseudomonas sp. ML8 Aeromonas sp. ML14 Flavobacterium sp. ML20 Aeromonas sp. ML24 0 1 2 3 4selama 5 hari inkubasi secara berturut-turut adalah 82,78%, 79,71%, 73,72%,
73,86% dan 55,40%. Efisiensi perombakan zat warna tersebut pada
penambahan 2 g/L glukosa meningkat menjadi 94,70%, 95,17%, 94,33%,
91,16% dan 90,90%. Akan tetapi, dengan penambahan 4 g/L glukosa efisiensi
perombakan menurun menjadi 89,90%, 92,38%, 91,93%, 84,11% dan 89,16%.
Kebutuhan glukosa optimum untuk merombak 200 mg/L zat warna azo adalah
berkisar 2-3 gram per liter limbah.
Hasil penelitian ini memperkuat kajian Chinwetkitvanich
et al.
(2000),
Padmavathy
et al.
(2003), Mendez
et al.
(2004) dan Shin
et al.
(2002) yang
melaporkan bahwa perombakan zat warna azo pada kondisi anaerob
menggunakan mikrob memerlukan kosubstrat berupa senyawa karbon organik
yang berfungsi sebagai sebagai elektron donor. Mendez
et al.
(2004) dalam
kajiannya melaporkan untuk merombak 0,06 mM zat warna azo
acid orange
7
pada kondisi anaerob tanpa penambahan glukosa diperlukan waktu selama 19
hari sedangkan dengan penambahan 1,8 g/L glukosa diprlukan waktu selama 5
hari. Dalam kajian Shin
et al
. (2002) juga dilaporkan perombakan 100 mg/L zat
warna amaranth menggunakan biofilm
Trametes versicolor
pada
polyethylene
teraphthalate fiber
membutuhkan waktu 16-20 jam dengan laju perombakan
3-3,8 mg/L per jam. Disamping glukosa, beberapa senyawa organik yang dapat
digunakan sebagai elektron donor pada proses perombakan zat warna azo di
antaranya asetat, sukrosa, laktosa, dan tapioka. Namun, glukosa dilaporkan
paling efektif digunakan sebagai sumber elektron donor karena glukosa lebih
mudah dan cepat mengalami glikolisis dibandingkan dengan sukrosa, laktosa
dan tapioka.
Menurut Yoo (2000), perombakan zat warna reaktif azo menggunakan
bakteri pada dasarnya merupakan reaksi reduksi-oksidasi (redoks) yang
dikatalisis oleh enzim. Bakteri memerlukan kosubstrat berupa senyawa karbon
organik seperti glukosa untuk mempercepat proses perombakan zat warna azo.
Glukosa dalam sistem biologi mengalami proses glikolisis dengan bantuan enzim
dehidrogenase
menghasilkan koenzim nikotinamida adenin dinukleotida (NADH).
Glikolisis mengubah molekul glukosa menjadi dua molekul piruvat yang
kemudian diubah menjadi asetil koenzim A yang siap memasuki siklus asam
sitrat. Pada proses glikolisis 1 molekul glukosa dihasilkan 2 molekul NADH
sedangkan pada siklus asam sitrat dihasilkan tiga molekul NADH dan satu
molekul FADH
2. NADH dan flavin adenin dinukleotida (FADH) merupakan
koenzim yang bertindak sebagai pembawa elektron. Koenzim-koenzim ini
berperan penting dalam proses perombakan zat warna azo. Peranan NADH dan
FADH
2pada perombakan zat warna azo dijelaskan melalui 2 hipotesis
mekanisme perombakan azo secara biologi yaitu perombakan dengan
melibatkan enzim secara langsung (
direct enzymatic
) dan perombakan dengan
melibatkan enzim secara tidak langsung (
indirect enzymatic
) yang dilaporkan
oleh Wuhrmann (1980) dan Van der Zee (2002).
Mekanisme perombakan zat warna azo menurut hipotesis
direct enzymatic
,
koenzim NADH yang dihasilkan dari proses glikolisis glukosa mentransfer
elektron ke zat warna azo yang dikatalisis oleh enzim
azoreductase
. Koenzim
NADH mengalami reaksi oksidasi sedangkan zat warna azo mengalami reduksi
menghasilkan senyawa amina aromatik (Gambar 26). Putusnya ikatan azo
menyebabkan warna menjadi hilang.
R-N=N-R
’R-NH
2
+ R
’-NH
2Glukosa Asetil CoA
Gambar 26 Mekanisme perombakan zat warna azo
secara
direct enzymatic
Mekanisme perombakan zat warna azo menurut hipotesis
indirect
enzymatic,
flavin adenin dinukleotida dalam keadaan tereduksi (FADH
2) berperan
sebagai mediator redoks pada proses perombakan zat warna azo. NADH
mereduksi flavin adenin dinukleotida dalam keadaan teroksidasi (FAD
2+)
dikatalisis oleh enzim
azoreductase
menghasilkan FADH
2. Hal ini terjadi karena
NADH memiliki nilai potensial reduksi lebih negatif dibandingkan dengan FADH
2(NAD
+/NADH+H
+E
o
= -320 mV dan FAD/FADH
2E
o=-220 mV). FADH
2hasil
reduksi tersebut selanjutnya mentransfer elektron secara langsung ke senyawa
azo tanpa bantuan enzim
azoreductase
.
Gambar 27 Perombakan zat warna azo menggunakan mediator redoks
2[NAD(P)H + H+ ] 2NAD(P)
Dehidrogenase
FAD FADH
2Enzim + 2 NADH + 2 H
+Enzim + 2 NAD
+FAD FADH
2FADH
2FAD
Enzim + R
1N=N R
2Enzim + R
1NH
2+ R
2NH
2FADH
2FAD
Jumlah glukosa yang digunakan menjadi kontrol terhadap proses
berlangsungnya perombakan. Jumlah glukosa yang sedikit akan menghasilkan
reducing equivalents
yang sedikit sehingga efisiensi perombakan rendah,
sedangkan bila jumlah glukosa berlebih mengakibatkan efisiensi perombakan
menjadi menurun. Penurunan efisiensi perombakan zat warna pada
penambahan glukosa berlebih disebabkan glukosa terurai menghasilkan
asam-asam yang menyebabkan terjadinya penurunan pH pada lingkungan. Penurunan
pH menyebabkan aktivitas enzim menjadi tidak maksimum (Chen
et al.
2003).
Analisis pengaruh faktor konsentrasi glukosa terhadap efisiensi
perombakan zat warna azo menggunakan
one-way
Anova pada selang
kepercayaan 95% (Lampiran 5) menunjukkan bahwa penambahan glukosa
secara signifikan mempengaruhi efisiensi perombakan. Efisiensi perombakan
maksimum pada perombakan 200 mg/L zat warna reaktif azo selama 5 hari
inkubasi diperoleh sebesar 91,02 sampai 95,20% dengan penambahan 2 sampai
3 gram glukosa pada setiap satu liter limbah.
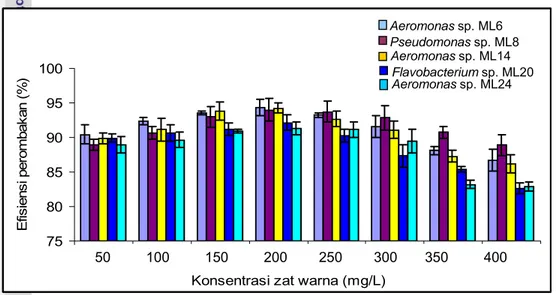
4.2.3 Efisiensi Perombakan pada Variasi Konsentrasi Zat Warna
Menurut Cutright (2001), aktivitas bakteri dalam merombak substrat
dipengaruhi oleh faktor besarnya konsentrasi substrat yang akan dirombak.
Untuk substrat pada rentang konsentrasi rendah, aktivitas perombakan umumnya
berlangsung cepat dengan meningkatnya konsentrasi substrat. Berdasarkan data
hasil perombakan zat warna pada konsentrasi yang berbeda-beda (Lampiran 6)
diperoleh pola efisiensi perombakan zat warna meningkat dengan naiknya
konsentrasi zat warna dari 50 sampai 200 mg/L kemudian menurun pada
konsentrasi dari 200 sampai 400 mg/L (Gambar 28). Efisiensi perombakan 50
mg/L zat warna azo salama 5 hari inkubasi berkisar antara 88,94 sampai 90,43%
sedangkan untuk 200 mg/L meningkat menjadi 91,28-94,36% dan pada
konsentrasi 400 mg/L turun menjadi 82,90-88,92%. Perbedaan efisiensi
perombakan di berbagai konsentrasi zat warna azo berhubungan dengan faktor
toksisitas zat warna dan kinetika reaksi perombakan (Pandey
et al.
2007).
Toksisitas zat warna azo berhubungan dengan struktur dan jenis gugus
yang terikat pada zat warna tersebut. Zat warna azo dengan katagori toksisitas
moderat atau sangat toksik lebih sulit dirombak dan memerlukan waktu yang
lebih lama dibandingkan dengan zat warna azo yang memiliki toksisitas rendah
atau tidak toksik. Disamping itu, produk hasil peruraian zat warna azo pada
kondisi anaerob berupa senyawa amina aromatik umumnya bersifat lebih toksik
dibandingkan dengan zat warna azo sendiri. Amina aromatik tersebut
meningkatkan toksisitas sehingga menghambat pertumbuhan bahkan sampai
membunuh bakteri. Efek toksik zat warna azo semakin meningkat dengan
meningkatnya konsentrasi zat warna, hal ini menyebabkan efisiensi perombakan
cendrung menurun. Di lain pihak, efisiensi perombakan zat warna azo yang tidak
toksik atau toksik rendah cendrung meningkat sampai pada konsentrasi tertentu
dan selanjutnya menurun sejalan dengan meningkatnya toksisitas dan jenuhnya
gugus aktif dari enzim.
Gambar 28 Efisiensi perombakan zat warna pada kondisi anaerob selama 5 hari
inkubasi diberbagai konsentrasi zat warna.
Perombakan zat warna azo oleh bakteri merupakan reaksi enzimatik. Pada
umumnya reaksi enzimatik dengan konsentrasi substrat rendah, jika konsentrasi
substrat dinaikkan dua kali, maka kecepatan reaksi perombakan zat warna
meningkat dua kali lipat. Ini berarti pada konsentrasi substrat rendah kecepatan
reaksi enzimatik berorde satu. Hasil analisis terhadap kinetika perombakan zat
warna pada penelitian ini menunjukkan kinetika reaksi orde 1 (Lampiran 7). Hasil
temuan ini, memperkuat simpulan Wuhrmann
et al.
(1980) dan Mendez
et al
.
(2003), yang melaporkan bahwa pada umumnya reaksi perombakan zat warna
azo secara biologi mengikuti reaksi orde 1. Temuan ini juga sejalan dengan
kajian Sani
et al
. (1999) yang melaporkan bahwa perombakan zat warna azo
pada konsentrasi 1-10
μ
M berlangsung cepat sedangkan pada konsentrasi 30
μ
M berlangsung lambat.
75 80 85 90 95 100 1 2 3 4 5 6 7 8Konsentrasi zat warna (mg/L)
E fis ien si per om bak an (% ) Aeromonas sp. ML6 Pseudomonas sp. ML8 Aeromonas sp. ML14 Flavobacterium sp. ML20 Aeromonas sp. ML24 50 100 150 200 250 300 350 400
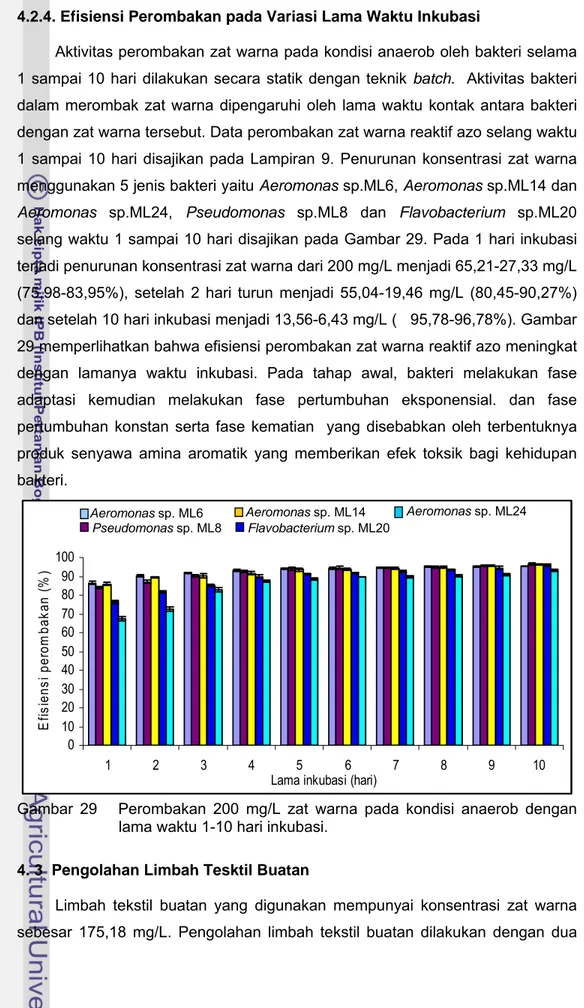
4.2.4. Efisiensi Perombakan pada Variasi Lama Waktu Inkubasi
Aktivitas perombakan zat warna pada kondisi anaerob oleh bakteri selama
1 sampai 10 hari dilakukan secara statik dengan teknik
batch.
Aktivitas bakteri
dalam merombak zat warna dipengaruhi oleh lama waktu kontak antara bakteri
dengan zat warna tersebut. Data perombakan zat warna reaktif azo selang waktu
1 sampai 10 hari disajikan pada Lampiran 9. Penurunan konsentrasi zat warna
menggunakan 5 jenis bakteri yaitu
Aeromonas
sp.ML6,
Aeromonas
sp.ML14 dan
Aeromonas
sp.ML24,
Pseudomonas
sp.ML8 dan
Flavobacterium
sp.ML20
selang waktu 1 sampai 10 hari disajikan pada Gambar 29. Pada 1 hari inkubasi
terjadi penurunan konsentrasi zat warna dari 200 mg/L menjadi 65,21-27,33 mg/L
(75,98-83,95%), setelah 2 hari turun menjadi 55,04-19,46 mg/L (80,45-90,27%)
dan setelah 10 hari inkubasi menjadi 13,56-6,43 mg/L ( 95,78-96,78%). Gambar
29 memperlihatkan bahwa efisiensi perombakan zat warna reaktif azo meningkat
dengan lamanya waktu inkubasi. Pada tahap awal, bakteri melakukan fase
adaptasi kemudian melakukan fase pertumbuhan eksponensial. dan fase
pertumbuhan konstan serta fase kematian yang disebabkan oleh terbentuknya
produk senyawa amina aromatik yang memberikan efek toksik bagi kehidupan
bakteri.
Gambar 29 Perombakan 200 mg/L zat warna pada kondisi anaerob dengan
lama waktu 1-10 hari inkubasi.
4. 3 Pengolahan Limbah Tesktil Buatan
Limbah tekstil buatan yang digunakan mempunyai konsentrasi zat warna
sebesar 175,18 mg/L. Pengolahan limbah tekstil buatan dilakukan dengan dua
0 10 20 30 40 50 60 70 80 90 100 1 2 3 4 5 6 7 8 9 10
Lama inkubasi (hari)
E fis ie ns i p er om ba ka n (% ) Aeromonas sp. ML6 Pseudomonas sp. ML8 Aeromonas sp. ML14 Flavobacterium sp. ML20 Aeromonas sp. ML24
tahap, yaitu tahap pengolahan anaerob dan tahap pengolahan aerob.
Masing-masing tahap menggunakan proses tersuspensi dan pertumbuhan terlekat.
Tahap Pengolahan Anaerob
Bakteri yang digunakan untuk mengolah limbah pada tahap anaerob adalah
bakteri kultur tunggal dan konsorsium. Bakteri kultur tunggal masing-masing
adalah
Aeromonas
sp.ML6,
Aeromonas
sp.ML14,
Aeromonas
sp.ML24
,
Pseudomonas
sp.ML8,
Flavobacterium
sp.ML20, sedangkan konsorsium bakteri
yang digunakan terdiri dari
Aeromonas
sp.ML6,
Aeromonas
sp.ML14,
Aeromonas
sp.ML24
, Pseudomonas
sp.ML8 dan
Flavobacterium
sp.ML20.
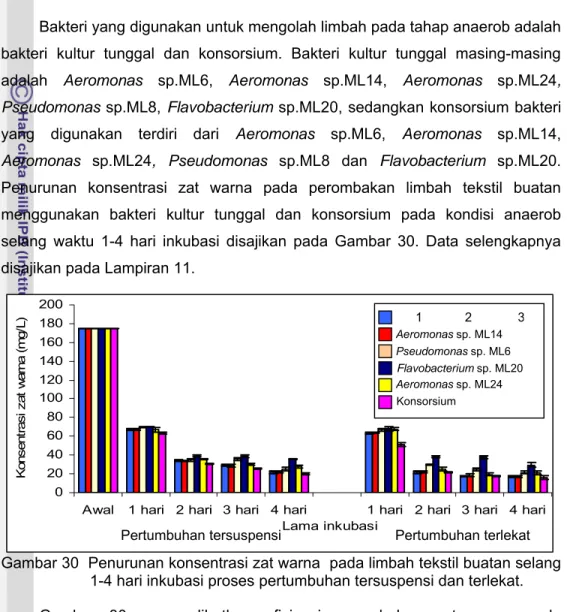
Penurunan konsentrasi zat warna pada perombakan limbah tekstil buatan
menggunakan bakteri kultur tunggal dan konsorsium pada kondisi anaerob
selang waktu 1-4 hari inkubasi disajikan pada Gambar 30. Data selengkapnya
disajikan pada Lampiran 11.
Gambar 30 Penurunan konsentrasi zat warna pada limbah tekstil buatan selang
1-4 hari inkubasi proses pertumbuhan tersuspensi dan terlekat.
Gambar 30 memperlihatkan efisiensi perombakan zat warna pada
pengolahan limbah tekstil buatan selang waktu 1; 2; 3 dan 4 hari menggunakan
proses pertumbuhan tersuspensi secara berturut-turut adalah 59,85-63,91%;
77,63-82,52%; 77,75-85,41% dan 79,69-88,49% sedangkan menggunakan
pertumbuhan terlekat adalah 61,27-63,91%; 78,11-87,65%; 78,32-90,24% dan
83,08-90,90%. Efisiensi perombakan menggunakan pertumbuhan terlekat lebih
tinggi dibandingkan dengan pertumbuhan tersuspensi, sedangkan untuk
pertumbuhan terlekat, efisiensi perombakan dengan konsorsium bakteri lebih
tinggi dibandingkan dengan menggunakan kultur tunggal. Dalam keadaan
0 20 40 60 80 100 120 140 160 180 200
Awal 1 hari 2 hari 3 hari 4 hari 1 hari 2 hari 3 hari 4 hari Lama inkubasi K ons ent ras i z at w ar na (m g/ L)
Pertumbuhan tersuspensi Pertumbuhan terlekat
1 2 3 Aeromonas sp. ML14 Pseudomonas sp. ML6 Flavobacterium sp. ML20 Aeromonas sp. ML24 Konsorsium
substrat mencukupi, hubungan antar bakteri pada sistem konsorsium dalam
melakukan aktivitas perombakan tidak saling mengganggu, bahkan
masing-masing bakteri beraktivitas membentuk suatu urutan yang saling
menguntungkan. Fenomena hubungan sinergisme antar bakteri ini menjadi
keunggulan dalam pemanfaatannya untuk pengolahan limbah. Hal ini disebabkan
karena konsorsium bakteri dapat hidup saling bersinergi sehingga menghasilkan
efisiensi perombakan yang lebih tinggi dibandingkan dengan pertumbuhan
tersuspensi. Perombakan zat warna azo pada kondisi anaerob, menghasilkan
amina aromatik yang lebih toksik dari sebelumnya. Produk
intermediate
hasil
perombakan anaerob tersebut akan mengganggu pertumbuhan bakteri.
Pengaruh toksisitas dari amina aromatik lebih tinggi pada sistem pertumbuhan
tersuspensi dibandingkan sistem pertumbuhan terlekat karena pada sistem
pertumbuhan terlekat, bakteri membentuk lapisan tipis yang berfungsi untuk
melindungi diri dari pengaruh lingkungan yang kurang menguntungkan.
Pembentukan biofilm pada batu vulkanik sebagai strategi mempertahankan diri
dari pengaruh kondisi lingkungan ekstrim (Prakash
et al
. 2003).
Gambar 31 memperlihatkan penampakan batu vulkanik dengan banyak
rongga-rongga sehingga mempermudah pelekatan bakteri, memperkokoh biofilm
dan melindungi mikrob dari abrasi akibat aliran limbah. Barus (2007), yang
melaporkan bahwa batu vulkanik sangat baik digunakan untuk mengamobil
bakteri pada pengolahan limbah mengandung merkuri.
Gambar 31
Scanning electron micrograph
penampakan batu vulkanik dengan
pembesaran 10.000 X. Tanda panah menunjukkan rongga batu
vulkanik.
Perlakuan dengan kontrol negatif (batu vulkanik tanpa penambahan
bakteri) terhadap adsorpsi zat warna menunjukkan bahwa batu vulkanik
disamping sebagai bahan pengamobil juga mempunyai kemampuan untuk
mengadsorpsi zat warna tekstil sebesar 5,67%. Kemampuan batu vulkanik
mengadsorpsi zat warna disebabkan oleh adanya interaksi fisika antara pori
dengan zat warna. Batu vulkanik setelah diamobilisasi menggunakan bakteri
terlihat penampakan struktur permukaannya menjadi semakin tertutup. Hal ini
menunjukkan bahwa biofilm bakteri sudah terbentuk pada permukaan batu
vulkanik. Pembentukan biofilm konsorsium bakteri selama 3 hari pada batu
vulkanik secara visual diamati menggunakan
scanning electron microscope
dan
hasilnya disajikan pada Gambar 32.
Gambar 32
Scanning electron micrograph
biofilm konsorsium bakteri pada batu
vulkanik pada kondisi anaerob dengan pembesaran 10.000 X.
Tanda panah menunjukkan biofilm pada permukaan batu vulkanik.
Proses pembentukan biofilm bakteri pada permukaan batu vulkanik
kemungkinan melalui adsorpsi. Bakteri pertama-tama mendekat pada permukaan
batu vulkanik selanjutnya terjadi proses adsorpsi sel ke dalam pori. Bakteri pada
permukaan batu vulkanik mengalami kolonisasi dengan mengeluarkan senyawa
polimer ekstraseluler. Menurut Prakash
et al
. (2003), biofilm terutama terdiri dari
sel mikrob dan matriks polimer ekstraseluler. Polimer eksopolisakarida (EPS)
sekitar 50-90% merupakan senyawa karbon organik. Adanya EPS
memperkokoh pelekatan bakteri pada batu vulkanik sehingga dapat menjaga
stabilitas populasi dalam reaktor. Hasil pemeriksaan jumlah populasi bakteri yang
terlekat pada batu vulkanik dalam reaktor anaerob menggunakan metode
total
plate count
diperoleh sebesar 4,68 x 10
9– 20,5 x10
9cfu/g (Tabel 7). Jumlah air
limbah tekstil yang diolah dalam reaktor adalah 900 mL sedangkan jumlah batu
vulkanik yang digunakan adalah 757 gram. Jadi perkiraan jumlah total bakteri
yang terdapat dalam reaktor anarobik untuk mengolah 900 mL limbah tekstil
berkisar 3,54 x 10
12-- 15,52 x 10
12cfu. Jumlah bakteri dalam bioreaktor sudah
memadai digunakan untuk pengolahan limbah tekstil. Menurut Cutright, (2001)
jumlah populasi bakteri minimum yang dianggap memadai untuk digunakan
dalam pengolahan limbah adalah 10
8cfu/L limbah.
Tabel 7 Jumlah koloni bakteri teramobil pada batu vulkanik
No Isolat
Berat batu vulkanik
(g)
Jumlah koloni terhitung Jumlah koloni (cfu/gram) Petri 1 Petri 2 Petri 3 Petri 4
1 Kontrol 25 - - - - - 2 Aeromonas ML6 25 120x109 72x109 34x1010 12x1010 6,52x109 3 Aeromonas ML14 25 148x109 276x109 24x1010 40x1010 10,64x109 4 Pseudomonas ML8 25 108x109 93x109 15x1010 24x1010 5,91x109 5 Flavobacterium ML20 25 102x109 86x109 11x1010 17x1010 4,68x109 6 Aeromonas ML24 25 105x109 129x109 40x1010 28x1010 9,14x109 7 Konsorsium 25 260x109 240x109 85x1010 70x1010 20,50x109
Dari ke-enam bakteri yang dicobakan, diperoleh tiga bakteri yang
menghasilkan efisiensi perombakan zat warna tinggi. Ketiga bakteri tersebut
adalah
Aeromonas
sp.ML6,
Aeromonas
sp.ML14 dan konsorsium. Efisiensi
perombakan zat warna pada reaktor anaerob dengan waktu tinggal limbah 3 hari
dalam reaktor menggunakan bakteri
Aeromonas
sp.ML6,
Aeromonas
sp.ML14
dan konsorsium menggunakan proses pertumbuhan terlekat adalah 90,00%;
89,41% dan 90,24%. Hasil perombakan limbah tekstil buatan secara anaerob
menggunakan ketiga bakteri tersebut, diukur parameter pH, bau, TDS, TSS,
nitrat, nitrit, BOD
5, COD dan warna. Hasil pengukuran parameter kualitas limbah
tersebut disajikan pada Lampiran 12. Nilai BOD
5, COD, warna, TDS dan TSS
dari limbah tekstil buatan sebelum diolah masing-masing sebesar 945 mg/L,
4.000 mg/L, 2.130 CU, 4.380 mg/L dan 1.220 mg/L. Setelah diolah menggunakan
konsorsium bakteri sistem pertumbuhan terlekat dengan waktu tinggal limbah
selama 3 hari, nilai BOD
5dan COD turun menjadi 454 mg/L dan 2.117 mg/L atau
efisiensi penurunan sebesar 51,96% dan 47,08%. Warna turun menjadi 192 CU
atau efisiensinya sebesar 90.99%. TDS dan TSS masing-masing turun menjadi
2.152 mg/L dan 719 mg/L.
Analisis terhadap sistem pengolahan pada reaktor anaerob menunjukkan
bahwa pada reaktor anaerob terjadi perombakan warna yang tinggi, akan tetapi
nilai COD dan BOD masih tinggi jika dibandingkan dengan baku mutu nilai COD
dan BOD yang dipersyaratkan pada KepMen LH No. 51/MENLH/10/1995.
Tingginya nilai COD dan BOD pada pengolahan anaerob menunjukkan
perombakan zat warna tekstil tidak berlangsung sempurna. Hal ini berarti, pada
kondisi anaerob bakteri hanya mampu merombak molekul zat warna yang
berukuran besar menjadi molekul-molekul yang lebih sederhana. Konsentrasi
BOD
5dan COD pada limbah tekstil buatan secara empirik digunakan sebagai
pendekatan untuk mengetahui ketersediaan sumber hara bagi kehidupan mikrob
(Brault, 1991). Hal tersebut dilakukan dengan menghitung nisbah COD terhadap
BOD
5,. Nisah COD terhadap BOD
5semakin mendekati nilai 1,46 berarti
penguraian limbah dikatagorikan semakin sempurna. Lebih lanjut, Utami (1992)
menyatakan bahwa bila nisbah COD terhadap BOD
5lebih kecil dari 1,7
digolongkan sebagai limbah yang mudah terurai, bila berkisar antara 1,7 sampai
10 merupakan limbah yang tidak terurai secara sempurna dan bila lebih besar
dari 10, maka limbah masuk ke dalam katagori limbah yang sangat sulit terurai.
Nisbah COD terhadap BOD
5pada limbah tekstil buatan setelah dilakukan
pengolahan baik menggunakan proses tersuspensi maupun proses terlekat
berkisar antara 4,69 sampai 6,40. Hasil temuan ini menunjukkan bahwa limbah
tekstil tersebut masuk ke dalam katagori limbah yang tidak terurai secara
sempurna. Kandungan bahan organik tinggi hasil pengolahan anaerob
mengisyaratkan bahwa pengolahan limbah tekstil berlangsung tidak efektif dan
efisien dengan sistem pengolahan satu tahap. Terbentuknya amina aromatik dari
peruraian zat warna azo pada kondisi anaerob yang bersifat lebih toksik
dibandingkan zat warna azo sendiri juga menjadi indikator pentingnya dilakukan
pengolahan lanjutan pada kondisi aerob.
Pengolahan Tahap Aerob
Pengolahan lanjutan secara aerob ditujukan untuk menurunkan nilai COD
dan BOD yang masih tinggi, perombakan amina aromatik, menghilangkan bau
tak sedap serta bahan-bahan pencemar lain yang belum sempurna dirombak
pada proses anaerob. Haug
et al
. (1991), melaporkan mekanisme perombakan
amina aromatik pada kondisi aerob dimulai dari oksidasi amina aromatik yang
dikatalisis oleh enzim oksigenase sehingga terjadi pemecahan struktur benzena.
Cincin aromatik mengalami hidroksilasi dan selanjutnya terjadi pembukaan cincin
(
cleavage
) melalui pengikatan 2 atom oksigen yang pada akhirnya menghasilkan
fumarat dan piruvat (Gambar 33).
Gambar 33 mekanisme perombakan amina aromatik pada kondisi aerob
Perlakuan pengolahan limbah pada tahap aerob sama seperti pada tahap
pengolahan anaerob, yaitu menggunakan proses pertumbuhan tersuspensi dan
terlekat. Limbah yang diolah adalah hasil pengolahan anaerob menggunakan
konsorsium bakteri proses pertumbuhan terlekat. Karakteristik limbah tekstil
untuk sampel pengolahan tahap aerob disajikan pada Lampiran 13. Bakteri yang
digunakan pada tahap ini adalah bakteri hasil isolasi dari lumpur Sungai Badung
yang teridentifikasi
Plesiomonas
sp.SB1,
Plesiomonas
sp.SB2,
Vibrio
sp.SB1,
Vibrio
sp. SB2 dan
Vibrio
sp.SB3. Data penurunan COD dan warna hasil
pengolahan limbah tahap aerob selang waktu 1 sampai 3 hari menggunakan
proses pertumbuhan tersuspensi disajikan pada Gambar 34, sedangkan data
selengkapnya disajikan pada Lampiran 14.
Gambar 34 Penurunan COD dan warna pada perombakan lanjutan limbah tekstil
buatan mengunakan proses pertumbuhan tersuspensi pada kondisi
aerob selang waktu 1-3 hari inkubasi.
Gambar 34 memperlihatkan bahwa pengolahan lanjutan dengan proses
pertumbuhan tersuspensi selang waktu 1; 2 dan 3 hari, nilai COD secara
berturut-turut mengalami penurunan dari 2.118 mg/L menjadi 616-545 mg/L
(efisiensi 70,92-74,27%), 260-231 mg/L (efisiensi 87,72-89,09%) dan 140-102
mg/L (efisiensi 93,39-95,20%). Warna turun dari 195 CU menjadi 128-117 CU
(efisiensi 34,36-40,00%), 118-105 CU (efisiensi 39,49-46,15%) dan 103-92 CU
COOH OH NH2 NH2 HOOC COOH O O COOH HOOC OH
O2 H2O H2O Fumarat + Firuvat
0 200 400 600 800 1000 1200 1400 1600 1800 2000 2200 Awal 1 2 3
Lama inkubasi (Hari)
COD ( m g/ L) 0 20 40 60 80 100 120 140 160 180 200 Awal 1 2 3
Lama inkubasi (Hari)
W arn a (C U ) Plesiomonassp. SB1 Plesiomonassp. SB2 Vibriosp. SB1 Vibriosp. SB2 Vibriosp. SB3 Konsorsium Plesiomonas sp. SB1 Plesiomonas sp. SB2 Vibrio sp. SB1 Vibrio sp. SB2 Vibrio sp. SB3 Konsorsium piruvat
(47,18-52,82%). Dari 6 jenis bakteri yang dicobakan untuk pengolahan limbah
pada tahap aerob, diperoleh sebanyak 3 bakteri yang mampu menurunkan nilai
COD dan warna yang tinggi. Ketiga bakteri tersebut adalah
Vibrio
sp.SB1,
Vibrio
sp.SB3 dan konsorsium bakteri (gabungan dari kelima bakteri tersebut).
Bakteri-bakteri potensial ini diamobilkan pada batu vulkanik dan selanjutnya digunakan
untuk mengolah limbah pada kondisi aerob. Data penurunan COD dan warna
hasil pengolahan limbah tahap aerob selang waktu tinggal limbah dalam reaktor
1; 2 dan 3 hari menggunakan proses pertumbuhan terlekat disajikan pada
Gambar 35, sedangkan data selengkapnya disajikan pada Lampiran 15.
Gambar 35 Penurunan COD dan warna pada perombakan lanjutan limbah tekstil
buatan mengunakan proses pertumbuhan terlekat pada kondisi
aerob selang waktu 3 hari inkubasi .
Gambar 35 memperlihatkan pengolahan aerob dengan lama waktu tinggal
limbah 1; 2 dan 3 hari dalam reaktor secara berturut-turut nilai COD turun dari
2.118 mg/L menjadi 471-447 mg/L (efisiensi 77,76%), 251-211 mg/L (efisiensi
88,15%- 90,03%) dan 99-93 mg/L (efisiensi 95,34 -95,61%). Warna dari 195 CU
turun menjadi 118-113 CU (efisiensi 39,49-42,05%), 116-108 CU (efisiensi
40,51-44,62%) dan 76-65 CU (efisiensi 61,03-66,67%). Efisiensi penurunan COD pada
waktu tinggal limbah 3 hari dalam reaktor menggunakan proses pertumbuhan
terlekat lebih besar dibandingkan dengan pengolahan menggunakan proses
pertumbuhan tersuspensi. Pengolahan lanjutan tahap aerob menggunakan
proses pertumbuhan terlekat mampu menurunkan COD sebesar 95,34-95,61%
sedangkan menggunakan proses tersuspensi sebesar 93,39-95,20%. Secara
umum, tingginya efisiensi perombakan COD pada tahap pengolahan aerob
disebabkan bahan organik hasil perombakan tahap anaerob mudah dirombak
lebih lanjut oleh bakteri pada tahap aerob.
0 200 400 600 800 1000 1200 1400 1600 1800 2000 2200 Awal 1 2 3
Lama inkubasi (Hari)
COD ( m g/ L) 0 50 100 150 200 250
Awal 1 hari 2 hari 3 hari Lama inkubasi (Hari)
W ar na ( CU) Vibrio sp. SB1 Vibrio sp. SB3 Konsorsium Vibrio sp. SB1 Vibrio sp. SB3 Konsorsium 1 2 3
Pengolahan lanjutan pada tahap aerob dengan waktu tinggal limbah 3 hari
dalam reaktor menggunakan proses pertumbuhan terlekat menghasilkan efisiensi
penurunan warna lebih tinggi dibandingkan menggunakan proses pertumbuhan
tersuspensi. Pada proses pertumbuhan terlekat, efisiensi penurunan warna
sebesar 60,00-66,67% sedangkan dengan pertumbuhan tersuspensi sebesar
50,77-52,82%. Hal ini disebabkan bakteri yang melekat pada batu vulkanik
tersebut membentuk lapisan dengan ketebalan tertentu dan mendegradasi zat
warna yang teradsorpsi pada batu vulkanik tersebut sampai pada tahap
mineralisasi. Disamping penurunan warna, pengolahan lanjutan tahap aerob
menggunakan proses pertumbuhan terlekat juga menghasilkan efisiensi
penurunan BOD, TDS dan TSS yang lebih tinggi dibandingkan dengan
pengolahan dengan proses pertumbuhan tersuspensi. Keunggulan sistem
pengolahan dengan proses pertumbuhan terlekat adalah terjadinya
wash out
bakteri ke lingkungan cukup kecil sehingga populasi bakteri pada bioreaktor tetap
terjaga dan reaktor dapat digunakan berulang-ulang untuk mengolah limbah
(Stolz 2001). Bakteri terlekat pada batu vullkanik dapat diamati secara visual
menggunakan
scanning electron microscope
(Gambar 36). Konsorsium bakteri
terlekat pada batu vulkanik tahap pengolahan aerob terdiri dari
Vibrio
sp. SB1,
Vibrio
sp. SB2,
Vibrio
sp. SB3,
Plesiomonas
sp. SB1 dan
Plesiomonas
sp. SB2.
Gambar 36
Scanning electron micrograph
biofilm konsorsium bakteri pada batu
vulkanik pada kondisi aerob dengan pembesaran 10.000 X. Tanda
panah menunjukkan biofilm pada permukaan batu vulkanik.
Jumlah populasi bakteri dalam reaktor berperan penting dalam
meningkatkan efisiensi pengolahan limbah. Pada umumnya, semakin banyak
jumlah bakteri, maka proses pengolahan berlangsung cepat. Hasil perhitungan
jumlah bakteri yang terlekat pada batu vulkanik yang digunakan merombak
limbah pada kondisi aerob adalah sekitar 1,70 x 10
10cfu/g. Jumlah bakteri dalam
bioreaktor sudah memadai digunakan untuk pengolahan limbah tekstil.
Pengolahan limbah tekstil yang paling optimal diperoleh dari penelitian ini
adalah sistem kombinasi anaerob-aerob menggunakan konsorsium bakteri yang
diamobilkan pada batu vulkanik. Hubungan penurunan konsentrasi zat warna
pada tahap pengolahan anaerob dan penurunan COD, BOD dan TSS pada
tahap aerob terhadap waktu pengolahan disajikan pada Gambar 37.
Gambar 37 Perombakan zat warna dalam reaktor anaerob dan COD, BOD dan
TSS dalam reaktor aerob pada pengolahan limbah tekstil buatan
sistem kombinasi anaerob-aerob pertumbuhan terlekat
Kurva penurunan COD terhadap lama pengolahan limbah diperoleh persamaan
garis Y= 1.686,6e
-1,03Xdengan nilai koefisien determinasi (R
2) sebesar 0,97. Nilai
BOD diperoleh persamaan garis Y= 377,07e
-0,71X(R
2= 0,950) dan TSS dengan
persamaan garis Y= 757,4e
-0,21X(R
2=0,96). Persamaan garis dari masing-masing
bahan pencemar pada kurva tersebut, dapat digunakan untuk menduga efisiensi
waktu yang diperlukan untuk mengolah limbah pada sistem tersebut sampai
pada tingkat pemenuhan baku mutu yang dipersyaratkan dalam KepMen LH
No.51/MENLH/10/1995. Limbah tekstil buatan mempunyai konsentrasi warna
sebesar 175,18 mg/L, apabila penurunan warna dikehendaki mencapai efisiensi
90% (17,52 mg/L), maka waktu yang diperlukan untuk mengolah limbah tahap
anaerob adalah 3 hari. Hasil pengolahan tahap anaerob selama 3 hari, mampu
menurunkan COD dari 4.000 mg/L menjadi 2.118 mg/L, BOD dari 945 menjadi
0 500 1000 1500 2000 2500 0 1 2 3 4
Lama pengolahan (hari)
Li m ba h t ida k t er om bak ( m g/ L) y = 122,56e-0,6047x R2 = 0,8651 0 50 100 150 200 0 2 4 6
Lama pengolahan (hari)
Ko ns ent ra si z at w arn a s is a ( m g/ L) COD TSS BOD
461 mg/L, TDS dari 4.380 mg/L 2.150 mg/L dan TSS dari 1.220 mg/L menjadi
725 mg/L. Pengolahan pada tahap aerob yang diperlukan untuk menurunkan
COD dari 2.118 mg/L menjadi 300 mg/L sesuai dengan baku mutu adalah 40
jam, menurunkan BOD dari 461 mg/L menjadi 150 mg/L diperlukan waktu
pengolahan 31 jam, sedangkan TSS dari 725 menjadi 400 mg/L diperlukan waktu
64 jam. Penurunan TSS pada sistem ini tampaknya kurang efisien, yaitu
diperlukan waktu yang lebih lama dibandingkan dengan menurunkan nilai COD
dan BOD. Untuk menghasilkan kualitas limbah dengan parameter yang diukur
berada di bawah baku mutu, maka pengolahan limbah dengan sistem kombinasi
anaerob-aerob menggunakan konsorsium bakteri teramobil pada batu vulkanik
ditetapkan waktu tinggal limbah dalam reaktor aerob selama 3 hari.
4.4. Pengolahan Air Limbah Tekstil Sistem Kombinasi Anaerob-Aerob
Menggunakan Proses Pertumbuhan Terlekat
Air limbah pencelupan tekstil diambil dari industri tekstil CV. Mama & Leon
Tabanan-Bali. Air limbah tekstil tersebut diolah menggunakan sistem kombinasi
anaerob-aerob yang masing-masing berisi konsorsium bakteri yang diamobilkan
pada batu vulkanik. Sebelum diolah, air limbah diequalisasi pHnya hingga
mencapai 7 dengan menambahkan larutan HCl. Pengolahan limbah dilakukan
dengan waktu tinggal 3 hari pada tahap anaerob dan 3 hari pada tahap aerob.
Karakteristik limbah tekstil sebelum dan setelah diolah disajikan pada Tabel 8.
Tabel 8 Karakteristik air limbah tekstil sebelum dan sesudah pengolahan
menggunakan kombinasi anaerob-aerob pertumbuhan terlekat.
Parameter Satuan Karakteristik limbah awal
Karakteristik limbah sesudah diolah selang waktu 6 hari Ulangan Rerata I II III Warna CU 1.587 65,36 68,24 70,08 67,89±2,4 pH - 10,50 6,15 6,00 6,25 6,18±0,1 Bau - - - - TDS mg/L 6.205 1.170 1.200 1.190 1.187±15,27 TSS mg/L 2.688 330 342 335 336±6,03 Nitrat mg/L 8,38 4,51 4,57 4,62 4,57±0,1 Nitrit mg/L 1,22 0,32 0,31 0,28 0,30±0,0 BOD mg/L 907 54,86 60,25 50,76 55,29±4,8 COD mg/L 6.000 95,67 105,26 90,46 97,13±7,5 Klorida mg/L 499 145 140 148 144,33±4,0
Hasil penentuan karakteriatik limbah tekstil sebelum diolah menunjukkan
bahwa semua parameter kualitas limbah yang diukur berada diatas baku mutu
yang dipersyaratkan dalam KepMen LH No.51/MENLH/10/1995. Jika limbah
tekstil tersebut dibuang secara langsung ke badan air dapat mencemari air dan
menimbulkan gangguan ekosistem perairan.
Pengolahan limbah tekstil dengan sistem kombinasi anaerob-aerob
menggunakan konsorsium bakteri proses pertumbuhan terlekat menghasilkan
penurunan warna limbah yang tinggi (Gambar 38). Warna lebih dominan
disebabkan oleh zat-zat warna tekstil yang terbuang sebagai air limbah.
Hilangnya warna jelas sekali terlihat setelah mengalami pengolahan tahap
anaerob sedangkan dari pengolahan tahap anaerob ke tahap aerob terjadi
perubahan warna yang relatif kecil. Hal ini menunjukkan bahwa zat warna tekstil
sebagian besar mengalami perombakan pada tahap anaerob.
Gambar 38 Perubahan warna limbah tekstil sebelum dan sesudah pengolahan
pada reaktor anaerob-aerob selama 6 hari inkubasi.
Air limbah tekstil yang digunakan mempunyai konsentrasi warna sebesar
1.587 CU, setelah selang waktu 6 hari pengolahan warna mengalami penurunan
dari 1.587 CU menjadi 67,89 CU atau efisiensi penurunan warna sebesar
95,72%. Warna tidak tercantum sebagai salah satu syarat baku mutu ditinjau dari
KepMen LH No. 51/MENLH/10/1995. Secara langsung, warna tidak berbahaya
bagi kesehatan manusia, akan tetapi secara tidak langsung berdampak negatif
terhadap ekosistem air maupun kesehatan manusia. Air yang berwarna secara
estetika memberikan kesan yang negatif. Air berwarna menghambat penetrasi
sinar matahari ke dalam air sehingga mengganggu aktivitas fotosintesis.
Kurangnya jumlah oksigen dalam air dapat memicu aktivitas mikroorganisme
anoksik-anaerob yang menghasilkan bau tak sedap. Dengan alasan ini, limbah
zat warna yang dihasilkan dari kegiatan industri tekstil harus diolah sebelum
dibuang ke lingkungan.
Air limbah tekstil yang dihasilkan dari proses pencelupan tekstil di Industri
CV. Mama & Leon Tabanan Bali memiliki keasaman (pH) sangat basa yaitu
10,50 dan pengamatan secara organoleptik tidak berbau. Tingginya pH limbah
disebabkan oleh pemakaian NaOH, Na
2CO
3atau detergen dalam proses
pencelupan tekstil
.
Air limbah ini, sebelum diolah dikondisikan pada pH 7 untuk
mengoptimalkan aktivitas bakteri dalam melakukan perombakan. Setelah
dilakukan pengolahan dengan sistem kombinasi anaero-aerob menggunakan
bakteri konsorsium yang terlekat pada batu vulkanik selang waktu 6 hari, pH air
limbah menurun sedikit dari pH 7 menjadi 6,18. Hasil pengolahan pada tahap
anaerob menghasilkan bau sangat menyengat akan tetapi bau menjadi hilang
setelah mengalami perombakan aerob. Kondisi pH air limbah hasil pengolahan
jika ditinjau berdasarkan KepMen LH No.51/MENLH/10/1995, sudah memenuhi
persyaratan baku mutu limbah industi untuk dibuang ke lingkungan.
Padatan tersuspensi total atau
total suspended solid
(TSS) dan
total
dissolved solid
(TDS) dari air limbah tekstil sebesar 2.688 mg/L dan 6.205 mg/L.
TSS dan TDS yang tinggi berdampak negatif terhadap perairan karena
mengurangi penetrasi sinar matahari yang masuk ke badan air, kekeruhan air
meningkat yang menyebabkan gangguan pertumbuhan bagi organisme
produser. Setelah diolah selang waktu 6 hari dalam reaktor anaerob-aerob
mampu menurunkan nilai TSS menjadi 336 mg/L atau efisiensi penurunan TSS
sebesar 87,50% sedangkan nilai TDS turun menjadi 1.187 mg/L atau efisiensi
penurunan TDS sebesar 80,87%. Nilai TSS dan TDS jika ditinjau dari KepMen
LH No. 51/MENLH/10/1995 telah memenuhi syarat, karena ambang batas TSS
dan TDS yang dipersyaratkan dalam KepMen LH No. 51/MENLH/10/1995
sebesar 400 mg/L dan 4.000 mg/L.
Air limbah tekstil yang digunakan mempunyai nilai BOD
5dan COD
masing-masing sebesar 907 mg/L dan 6000 mg/L. Nilai BOD
5dan COD menggambarkan
kandungan bahan organik pada air limbah. Penyusun utama bahan organik
biasanya berupa polisakarida (karbohidrat), polipeptida (protein) dan lemak.
Selain jenis bahan organik tersebut, limbah organik juga mengandung bahan
organik sintetik seperti pestisida dan surfaktan. Tingginya bahan organik pada air
limbah tekstil disebabkan oleh penggunan enzim, detergen, pestisida dan zat
warna sintetik pada proses produksi tekstil. Setelah dilakukan pengolahan
dengan kombinasi anaerob-aerob selang waktu 6 hari, nilai BOD
5turun menjadi
55,29 mg/L atau efisiensi penurunan BOD
5sebesar 93,90%. Nilai COD turun
menjadi 97,13 mg/L atau efisiensi penurunan COD sebesar 98,38%. Hal ini
menunjukkan bahwa penguraian bahan-bahan organik yang terdapat pada
limbah tekstil menggunakan sistem kombinasi anaerob-aerob berlangsung
efisien. Nilai BOD
5dan COD hasil pengolahan ini sudah berada dibawah baku
mutu air yang dipersyaratkan dalam KepMen LH No. 51/MENLH/10/1995.
Nitrat, nitrit dan klorida yang terkandung pada limbah tekstil masing-masing
sebesar 8,38 mg/L; 1,22 mg/L dan 499 mg/L. Persenyawaan nitrogen terutama
nitrit bersifat toksik yaitu menyebabkan keracunan bagi tubuh. Nitrit
mengoksidasi ion besi (II) menjadi besi (III) di dalam haemoglobin (Hb) dan
mengubah Hb menjadi methaemoglobin (MetHb). Pada keadaan normal, darah
manusia memiliki kadar haemoglobin berkisar 10-14 mg/dL. Apabila perubahan
Hb menjadi MetHb mencapai 20-30% dari Hb normal, maka akan terjadi hypoxia
yaitu menurunnya kadar oksigen pada darah. Diperairan tergenang, keberadaan
nitrat dan nitrit bersama dengan posfat sering menyebabkan terjadinya
eutrofikasi pada perairan. Eutrofikasi mendorong terjadinya perubahan
keanekaragaman dan dominansi organisme akuatik, kekeruhan meningkat dan
menyebabkan terjadinya kondisi anoksik di perairan. Untuk itu, nitrat dan nitrit
pada air limbah sangat perlu diminimalkan sebelum dibuang ke lingkungan.
Nitrogen pada limbah tekstil berasal pemakaian enzim pada proses produksi
tekstil. Air limbah tekstil setelah diolah selang waktu 6 hari konsentrasi nitrat dan
nitrit turun menjadi 4,71 mg/L dan 0,33 mg/L atau efisiensi sebesar 43,80% dan
72,95%. Konsentrasi nitrat dan nitrit dalam limbah jika ditinjau KepMen LH No.
51/MENLH/10/1995 berada di bawah baku mutu air limbah industri. Baku mutu
nitrat dan nitrit menurut KepMen LH No. 51/MENLH/10/1995, adalah sebesar 30
mg/L dan 3,0 mg/L.
Klorida diperlukan oleh mahluk hidup untuk pengaturan tekanan osmotik
sel. Perairan yang diperuntukkan bagi keperluan domestik, termasuk air minum,
pertanian dan industri sebaiknya memiliki kadar klorida lebih kecil dari 100 mg/L.
Kadar klorida yang tinggi pada perairan dapat meningkatkan sifat korosivitas air
sehingga mudah mengakibatkan terjadinya perkaratan peralatan yang terbuat
dari logam. Sistem pengolahan limbah kombinasi anaerob-aerob proses
pertumbuhan terlekat ini mampu menurunkan kandungan klorida dalam air
limbah dari 499 mg/L menjadi 144,33 mg/L atau efisiensi penurunannya 71,14%.
4.5 Toksisitas Limbah Hasil Pengolahan
Evaluasi efek toksik limbah tekstil sebelum dan setelah pengolahan
menggunakan hewan uji
Daphnia
magna (ISO 66431). Penilaian toksisitas
limbah menggunakan EC
50yaitu efek konsentrasi yang menyebabkan kematian
sebesar 50% terhadap hewan uji pada waktu paparan 48 jam. Kurva hubungan
dosis respon log persentase konsentrasi limbah terhadap persentase mortalitas
Daphnia magna
selama paparan 48 jam untuk limbah sebelum dan sesudah
pengolahan disajikan pada Gambar 39 dan 40. Data selengkapnya disajikan
pada Lampiran 15.
Gambar 39. Hubungan dosis respon log konsentrasi limbah (%) terhadap
mortalitas
Daphnia magna
selama paparan 48 jam untuk limbah
sebelum pengolahan
Pengolahan tahap anaerob
Pengolahan tahap aerob
Gambar 40 Hubungan dosis respon log konsentrasi limbah (%) terhadap
mortalitas
Daphnia magna
selama paparan 48 jam untuk limbah
setelah pengolahan.
Gambar 39 memperlihatkan kurva hubungan antara persentase
pengenceran limbah dengan persentase mortalitas
Daphnia magna.
Regresi
y = 43,185x - 24,37 R2 = 0,9826 0 10 20 30 40 50 60 70 0,7 1,1 1,5 1,9 2,3 Log konsentrasi efluen (%)
M or tal itas D aphn ia m agna ( % ) y = 23,254x - 8,5071 R2 = 0,9423 0 5 10 15 20 25 30 35 40 45 0 1 2 3
Log konsentrasi efluen (%)
M or ta lit as D aph ni a m ag na ( % ) y = 39,863x - 33,726 R2 = 0,973 0 10 20 30 40 50 60 0,5 1,0 1,5 2,0 2,5
Log % konsentrasi limbah
M ort al itas D aphni a m agna (% )

![Gambar 27 Perombakan zat warna azo menggunakan mediator redoks 2[NAD(P)H + H+ ] 2NAD(P)](https://thumb-ap.123doks.com/thumbv2/123dok/2488294.2220829/11.918.207.749.854.1017/gambar-perombakan-warna-menggunakan-mediator-redoks-nad-nad.webp)