284
PENGARUH BAP DAN IAA PADA PERBANYAKAN TUNAS KRISAN (Chrysanthemum morifolium R.) SECARA IN VITRO
SUMARNY TRIDELPINA PURBA JURUSAN PENDIDIKAN BIOLOGI,
FAKUKTAS KEGURUAN DAN ILMU PENDIDIKAN (FKIP) UNIVERSITAS SIMALUNGUN
ABSTRACT
The study on crisan’s bud through tissue culture was aimed to study the effect of BAP (6-Benzilaminopurine) and IAA (Indole Asetat Acid) on multiplication of leaves, shoots and roots of crisan plants in vitro. The Study was carried out in the Tissue Culture Laboratory YAHDI, Medan on September to November 2010.
This study used faktorial experiment arranged in Completely Randomized Design (CDR). The treatment consisted of 2 factors. The first factor was the BAP concentration, consisted of three levels; BAP: 0 ppm, BAP: 0,5 ppm, dan BAP: 1 ppm. The second factor was IAA concentration, consist of two level; IAA: 0 ppm, IAA: 0,1 ppm. Each treatment was replicated three times. Observations were carried out for 6 weeks after planting.
Based on the result of analysis, it showed that the combination of BAP 1 ppm and IAA 0,1 ppm gave the best result, where the number of leaves was highest (3,3 sheets), and the combination of BAP 1 ppm and IAA 0,1 ppm also gave the highest number of bud (2,0 buds). The treatment of BAP concentration did not affect the multiplication of roots. Similarly, to the IAA concentration did not affect the multiplication of roots as well.
Key Words : Crisan, bud, BAP and IAA.
PENDAHULUAN
Bunga Krisan (Chrysantenmum morifolium R.), termasuk bunga potong yang cukup tinggi nilai ekonomisnya sebab memiliki warna, bentuk dan ukuran yang beragam serta daya simpan yang lama. Permintaan terhadap bunga krisan meningkat 25% per tahun. Permintaan pasar yang tinggi tersebut menjadikan tanaman krisan mempunyai prospek yang cerah untuk dikembangkan baik pada saat ini maupun yang akan datang (balai Penelitian Tanaman Hias, 2000). Tanaman krisan umumnya diperbanyak dengan setek pucuk yang berasal dari tanaman induk. Namun, perbanyakan krisan melalui setek pucuk mempunyai kelemahan yaitu penyediaan bibit yang terbatas dan tejadinya penurunan kualitas bibit. Hal ini ditandai dengan menurunnya bobot segar dan diameter batang yang mengecil (de Reuter, 1993). Pemakaian bibit yang bermutu tinggi dan tersedia dalam jumlah banyak merupakan langkah yang tepat untuk memenuhi permintaan konsumen. Oleh sebab itu salah satu cara yang harus ditempuh adalah penggunaan metode kultur jaringan.
Perbanyakan krisan secara kultur jaringan dapat menghemat waktu dan dapat diperoleh jumlah bibit krisan dalam jumlah yanga banyak. Menurut Nugroho dan Sugito (2000) tanaman krisan dapat dikembangkan dengan kultur jaringan melalui meristem culture yaitu teknik kultur jaringan dengan menggunakan bagian tanaman jaringan muda atau meristem. Selain itu, kelebihan kultur meristem yang mampu menghasilkan bibit tanaman identik dengan induknya. Rice et al. (1992) mengatakan bahwa kultur meristem mampu meningkatkan laju induksi dan penggandaan tunas, mampu memperbaiki mutu bibit yang dihasilkan, serta mampu mempertahankan sifat-sifat morfologi yang positif.
Perbanyakan bibit melalui kultur jaringan bertujuan untuk mendapatkan bibit dalam jumlah besar dan seragam, bebas hama penyakit, waktu yang relatif singkat dan tidak tergantung musim (Sriyanti dan Wijayani, 1984). Perbanyakan cepat melalui kultur jaringan dapat ditempuh antara lain melalui inisiasi tunas adventif. Pada perbanyakan melalui tunas adventif, tunas dapat dihasilkan dari jaringan yang secara normal tidak dapat menghasilkan
285
langsung (induksi kalus). Pada morfogenesis langsung akan terbentuk tunas secara langsung dari eksplan, sehingga tahap inisiasi dan multiplikasi tunas dapat terjadi pada media yang sama. Morfogensis tidak langsung terjadi melalui pembentukan kalus terlebih dahulu. Perbanyakan melalui kalus dapat menghasilkan bibit dalam jumlah besar tetapi membutuhkan waktu yang lebih lama. Hal ini disebabkan karena eksplan dikulturkan terlebih dahulu pada media untuk induksi kalus dan kemudian dipindahkan ke media untuk merangsang pertunasan. Perbanyakan melalui kalus dapat menimbulkan ketidakstabilan genetik. Salah satu faktor yang menentukan keberhasilan kultur jaringan adalah zat pengatur tumbuh. Ada dua golongan zat pengatur tumbuh yang sangat penting pada kultur in vitro, yaitu auksin dan sitokinin.
Auksin merupakan faktor yang penting pada pembelahan sel, menginduksi pembentukan kalus serta merangsang pertumbuhan akar. Auksin yang sering digunakan dalam kultur jaringan adalah IAA(Indole acetic Acid), NAA (1-napthalene acetic acid), IBA (3-indole butyric acid) dan 2,4-D (dichlorophenoxy acetic acid) (wetherell, 1982).
Golongan Sitokinin mempengaruhi proses metabolism dan fisiologi dalam jaringan tanaman. Untuk pertumbuhan eksplan, zat ini dibutuhkan terutama dalam pembelahan sel. Sitokinin yang biasa digunakan dalam kultur in vitro adalah kinetin, BAP (benzyl amino purine) dan 2-ip (isopentenylamino purine). Kisaran konsentrasi yang biasa digunakan ialah 0,01-10 mg l-1 (Hartmann, Kester dan Davis, 1990).
Berbagai media dasar digunakan dalam kultur jaringan seperti media Murasgige dan Skoog (MS), Nitsch, White, Heller, B5 dan beberapa media lainnya (Winata, 1987). Media dasar yang umum digunakan untuk perbanyakan tanaman krisan adalah media MS (Earle dan Langhans, 1974). Media MS dengan BA 2 mg l-1 dapat menghasilkan tunas dari eksplan tunas lateral Chrysanthemum coronarium yang dikulturkan pada media MS dengan penambahan BAP 0,56 mg l-1 dan NAA 0,47 mg l-1 dapat menghasilkan tunas-tunas (Lee, Huang dan Pua, 1997). Tunas-tunas adventif adapt diregenerasi secara langsung dari eksplan daun dan batang krisan. Media optimum yang digunakan untuk inisiasi tunas adventif dari kedua jenis eksplan adalah media dasar MS + NAA 0,93 mg l-1 + BAP 1,13 mg l-1 (Kaul, Miller, Hutchinson dan Richard, 1990).
Amiputri (1993) melakukan penelitian pada tanaman krisan. Penggunaan BAP 2-6 ppm pada media tepung ubi jalar menekan pertumbuhan, tetapi menghasilkan tunas yang lebih banyak dibanding penggunaan media tepung tapioca. Di laboratorium Kultur Jaringan Budidaya Pertanian IPB, krisan diperbanyak dengan setek buku dengan menggunakan media dasar MS dengan penambahan BAP 0,5 ppm dan IAA 0,1 ppm dan casein hidrolisat 0,1 g l-1 (Avivi, 1994).
Berdasarkan uraian tersebut maka dilakukan suatu penelitian mengenai perbanyakan krisan dengan menggunakan media dasar MS dan zat pengatur tumbuh BAP dan IAA.
BAHAN DAN METODE
Studi ini dilaksanakan di Laboratorium Kultur Jaringan YAHDI. Kegiatan studi dimulai pada bulan September sampai bulan Nopember 2010.
Bahan
Bahan yang digunakan dalam percobaan ini adalah tanaman krisan yang sudah dikulturkan (plantlet krisan), bahan kimia yang digunakan dalam pembuatan media Murashige dan Skoog, zat pengatur tumbuh BAP dan IAA. Semua alat yang digunakan disterilisasi dalam autoclave pada tekanan 17 - 20 psi dan dipertahankan selama 1 jam. Laminar Air Flow Cabinet sebelum digunakan disterilkan terlebih dahulu dengan alkohol 70 % pada dinding dan alasnya kemudian dilap dengan tissue dan didiamkan selama kurang lebih 30 menit. Ruang penanaman dan ruang diatur suhunya dengan suhu rata-rata 25oC. Lampu fluorescent biasa digunakan sebagai sumber cahaya dalam ruang kultur.
286 Penanaman Eksplan
Planlet yang digunakan adalah planlet krisan yang tersedia di Laboratorium Kultur Jaringan YAHDI. Penanaman dilakukan di laminar air-flow cabinet dan ditanam pada botol yang berisi media MS yang sudah ditambahkan zat pengatur tumbuh sesuai dengan konsentrasi perlakuan. Kemudian diletakkan pada rak kultur dengan suhu 25 ± 1 0C dengan memakai lampu TL. Penyinaran dilakukan selama 24 jam
Rancangan Percobaan dan Pengambilan Data
Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) faktorial. Perlakuan terdiri dari 2 faktor. Faktor pertama adalah konsentrasi BAP yang terdiri dari 3 level meliputi BAP: 0 ppm, BAP: 0,5 ppm, dan BAP: 1 ppm. Faktor kedua adalah konsentrasi IAA yang terdiri dari 2 level meliputi konsentrasi IAA: 0 ppm, dan IAA: 0,1 ppm. Setiap perlakuan diulang tiga kali. Pengamatan dilakukan selama 8 minggu setelah tanam. Komponen yang diamati adalah jumlah daun, jumlah tunas dan jumlah akar. Data yang diperoleh dianalisis dengan uji F pada jenjang 5% dan apabila menunjukkan beda nyata, maka dilanjutkan dengan uji jarak berganda Duncan pada jenjang 5%.
HASIL DAN PEMBAHASAN
Kombinasi konsentrasi BAP dan IAA berpengaruh nyata terhadap penggandaan tunas melalui kultur jaringan yang dapat dilihat pada parameter jumlah daun, jumlah akar dan jumlah tunas. Rerata jumlah daun, jumlah akar dan jumlah tunas pada berbagai BAP dan IAA melalui kultur jaringan disajikan pada tabel 1.
Tabel.1. Rerata Jumlah Daun, Jumlah Akar, Tunas Krisan Melalui Kultur Jaringan Umur 8 Minggu
Perlakuan Jumlah Daun Jumlah Akar Jumlah Tunas BAP 0 ppm + IAA 0,1 ppm 3,0 a 2,6 a 1,3 a BAP 0,5 ppm + IAA 0,1 ppm 3,1 a 0,0 b 1,3 a BAP 1,0 ppm + IAA 0,1 ppm 3,3 b 0,0 b 2,0 a
Ket : Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak beda nyata dengan uji jarak berganda Duncan pada jenjang 5 %.
Jumlah Tunas
Waktu inisiasi tunas tercepat dapat dilihat pada pemberian BAP 1 ppm dengan IAA 0,1 ppm (1MST), sedangkan pemberian BAP 0,5 ppm dan IAA 0,1 ppm menunjukkan waktu inisiasi lambat, tunas terbentuk setelah 2 minggu setelah tanam (2 MST). Diduga pembentukan tunas yang lebih cepat karena adanya sitokinin dengan konsentrasi yang tepat untuk memacu tumbuhnya tunas.
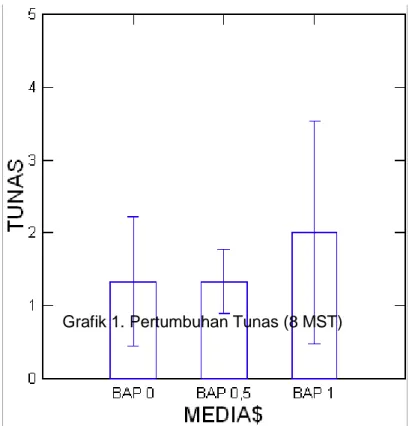
Namun hasil analisis data menunjukkan bahwa tidak ada perbedaan yang nyata antara perlakuan BAP 0,5 ppm + IAA 0,1 ppm (kontrol) dengan perlakuan BAP 0,5 ppm + IAA 0,1 ppm dan BAP 1 ppm + IAA 0,1 ppm terhadap jumlah tunas. Grafik pertumbuhan tunas pada konsentrasi BAP dan IAA dapat dilihat pada Grafik 1.
Pertumbuhan dan perkembangan tunas-tunas adventif ditentukan oleh keseimbangan antara auksin dan sitokinin. Sitokinin menstimulasi pembelahan sel dan merangsang pertumbuhan tunas adventif, sedangkan auksin merangsang pembelahan dan pembesaran sel (Wetherell, 1982). Keseimbangan antara auksin dan sitokinin yang sesuai menyebabkan pembelahan dan pembesaran sel berlangsung cepat sehingga tunas juga
287
sitokinin terhadap auksin yang tinggi memacu pembentukan tunas, dan dengan adanya auksin eksogen dapat memacu pembentukan organ. Jumlah sitokinin yang diperlukan untuk pembentukan tunas beragam tergantung spesies atau kultivar (Tripepi, 1997).
Grafik 1. Pertumbuhan Tunas (8 MST) \
Umumnya semua perlakuan konsentrasi sitokinin terhadap auksin lebih tinggi memacu pembentukan tunas adventif. Pada eksplan daun Aegle marmelos regenerasi tunas terbanyak adalah 38,4 tunas yang diperoleh dari media MS + IAA 0,5 mg l-1 + BAP 1,5 mg l -1 (Islam, Hossain, Joarda dan Karim, 1993).
Pada studi ini tampak bahwa pemberian BAP 1 ppm merupakan konsentrasi terbaik, sedangkan pada pemberian BAP 0,5 ppm pembentukan tunas lambat.
Jumlah Daun
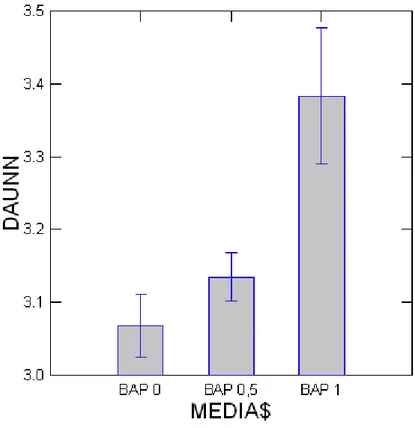
Pada tabel 1. Tampak bahwa jumlah daun terbanyak diperoleh pada perlakuan BAP 1 ppm + IAA 0,1 ppm (3,3 helai), diikuti oleh perlakuan BAP 0,5 ppm + IAA 0,1 ppm (3,1 helai). Daun terlihat berwarna hijau dengan penampilan tanaman yang tegar. Perlakuan dengan jumlah tunas banyak menghasilkan pula jumlah daun yang banyak. Penambahan sitokinin (BAP) dalam konsentrasi tinggi dan IAA dalam konsentrasi rendah akan memberikan daun yang banyak (Winata, 1997). Grafik pertumbuhan daun pada konsentrasi BAP dan IAA dapat dilihat pada Grafik 2.
288
Grafik 2. Pertumbuhan Daun (8 MST)
Jumlah Akar
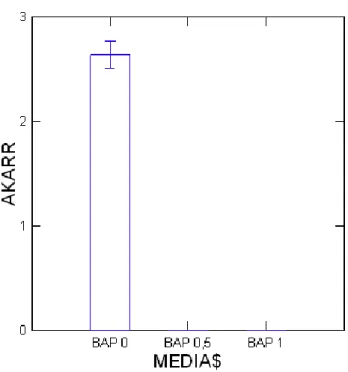
Perlakuan tanpa zat pengatur tumbuh dan tanpa BAP membentuk akar. Hal ini dapat kita lihat pada tabel 1. Bahwa perlakuan BAP 0 ppm + IAA 0,1 ppm menghasilkan jumlah
akar yang paling banyak (2,6 akar), sedangkan kombinasi perlakuan dengan BAP 0,5 ppm + IAA 0,1 ppm dan BAP 1 ppm + IAA 0,1 ppm tidak menghasilkan akar.
Dengan demikian, dapat disimpulkan bahwa tidak ada pengaruh pemberian BAP dan IAA terhadap pertumbuh akar. Semua perlakuan yang menggunakan BAP tidak membentuk akar, tetapi membentuk sedikit kalus. Pada perlakuan dengan BAP terjadi pembentukan kalus. Diduga adanya nisbah sitokinin-auksin yang tinggi akan mendorong pembentukan tunas dan bila nisbah tersebut seimbang maka akan terbentuk kalus. Grafik pertumbuhan akar dapat dilihat pada grafik 3.
Terhambatnya pembentukan akar juga disebabkan oleh tingginya konsentrasi BAP dalam media. Menurut Fossard dalam Nisa (2005), medium tanpa sitokinin lebih baik dari pada medium yang mengandung sitokinin untuk pembentukan akar. Wattimena et al (1991) dalam Yunus (2007) menambahkan bahwa untuk pertumbuhan akar hanya diperlukan auksin, tanpa sitokinin atau sitokinin dalam konsentrasi yang rendah, pada konsentrasi yang tinggi, sitokinin mampu mendorong proliferasi tunas, sebaliknya menghambat pembentukan akar.
289
Grafik 3. Pertumbuhan Akar (8 MST)
Selain itu, konsentrasi auksin yang digunakan dalam percobaan ini juga relatif rendah yakni 0,1 ppm, sedangkan untuk perakaran tambahan dibutuhkan tambahan auksin 1 - 5 mg.l-1 (Syahid dan Mariska, 1991 dalam Nisa, 2005). Hal ini sesuai dengan pendapat Skoog dan Miller (1975) bahwa untuk perakaran secara in vitro biasanya digunakan auksin dalam konsentrasi tinggi.
Ada beberapa media yang terkontaminasi pada beberapa perlakuan, yaitu pada perlakuan kombinasi BAP 0 ppm dan IAA 0,1 ppm pada ulangan ke- 3, dan pada perlakuan kombinasi BAP 1 ppm dan IAA 0,1 ppm pada ulangan pertama. Kontaminasi ditandai oleh adanya benang-benang hifa oleh jamur pada sekeliling permukaan media dimana plantlet ditanam. Pengamatan adanya kontaminasi media dan plantlet dilihat setelah 4 minggu setelah tanam (4 MST).
290
(a) (b) (c)
(d) (e) (f)
Gambar 1. Tanaman Krisan yang telah memiliki akar, daun dan tunas (8 MST)
Ket :
(a), (b) dan (c) merupakan tanaman krisan hasil perlakuan kombinasi BAP 1 ppm + IAA 0,1 ppm. Jumlah tunas dan daun banyak, namun jumlah akar tidak ada; (d), (e), dan (f) merupakan tanaman krisan hasil perlakuan dari kombinasi BAP 0 ppm + IAA 0,1ppm (kontrol). Jumlah daun sedikit, tunas tidak ada, tetapi jumlah akar sangat banyak.
KESIMPULAN
Berdasarkan analisis sidik ragam ternyata kombinasi konsentrasi BAP dan IAA menunjukkan beda nyata terhadap penggandaan tunas krisan yang tercermin pada parameter jumlah daun, jumlah akar dan jumlah tunas. Kombinasi BAP 1 ppm dan IAA 0,1 ppm memberikan penggandaan tunas krisan terbaik. Hal ini berarti kombinsi BAP 1 ppm dan IAA 0,1 ppm merupakan keseimbangan yang tepat untuk menginduksi tunas krisan. Keadaan ini sesuai dengan pendapat George dan Sherrington (1984) yang menyatakan bahwa perimbangan konsentrasi sitokinin dan auksin yang tepat mampu memperbaiki penggandaan tunas. Demikian halnya dengan jumlah daun, dari hasil analisis diperoleh bahwa jumlah daun meningkat pada perlakuan kombinasi BAP 1 ppm dan IAA 0,1 ppm. Penambahan sitokinin (BAP) dalam konsentrasi tinggi dan IAA dalam konsentrasi rendah akan memberikan daun yang banyak (Winata, 1997).
291
BAP (0 ppm) ternyata memberikan jumlah akar banyak dan kecenderungan jumlah akar menurun dengan meningkatnya konsentrasi BAP. Keadaan ini membuktikan bahwa BAP mampu menekan pertumbuhan akar. Kemampuan menghambat petumbuhan akar ini sangat penting dalam penggandaan tunas (multiplikasi).
Keseimbangan antara BAP dan IAA sangat penting dalam menginduksi tunas karena masing-masing zat pengatur tumbuh tersebut mempunyai peranan dalam menginduksi tunas. Menurut Kusumo (1984) zat pengatur tumbuh sitokinin berperan dalam pembelahan sel dan morfogenesis, sedang auksin berperan dalam mengatur pertumbuhan dan pemanjangan sel. Pemanjangan sel, pembelahan sel, morfogenesis dan pengaturan pertumbuhan merupakan proses yang sangat penting dalam pembentukan kalus dan selanjutnya diikuti pembentukan tunas. Hal ini menunjukkan bahwa sitokinin (termasuk BAP) dan auksin (termasuk IAA) berperan saling melengkapi dalam menginduksi tunas. Keadaan ini juga dibuktikan oleh kombinasi BAP 1 ppm dan IAA 0,1 ppm memberikan penggandaan tunas krisan terbanyak.
DAFTAR PUSTAKA
Amiputri, R.B. 1993. Studi Beberapa Jenis Substitusi Agar dan Pengaruhnya terhadap Empat Jenis Tanaman Penguji dalam Kultur Jaringan. Tesis SPS-IPB. Bogor.
Avivi, S. 1994. Pengaruh Beberapa Jenis Substitusi Agar-agar dan Zat Pengatur Tumbuh terhadap Kultur Jaringan Krisan. Laporan Praktikum Kultur Jaringan SPS-IPB. Bogor Earle, E.D. dan R.W. Langhans. 1974. Propagation of Chrysanthemum In Vitro: II.
Production, Growth and Flowering of Plantlet from Tissue Culture. J. Amer. Soc. Hort.Sci 14 (3):67-72.
Farid, M. 2003. Perbanyakan Tebu (Saccharum officinarum L. ) secara In Vitro Pada Berbagai Konsentrasi IBA dan BAP. J. Sains & Teknologi VOL.3 NO.3:103-109. Hartmann, H.T., D.E. Kester dan F.T. Davies. 1990. Plant Propagation Principles and
Practices. Prentice Hall Inc. New Jersey.
Islam, R., M. Hossain, O.I.Joarda dan M.R. Karim. 1993. Adventitious Shoot Formation on Excised Leaf Explant of in vitro Grown Seedlings of Aegle marmelos Corr. J. Hort.Sci.68(4):495-498
Kaul, V., R.M. Miller, J.F. Hutchinson dan D. Rhichard. 1990. Shoot Regeneration from Stem and Leaf Explants of Dendranthema grandiflora Tzvelev (syn. Chrysanthemum
morifolium Ramat). Plant Cell, Tissue and Organ Cukture 21:21-30
Lee, T.M., E.E. Huang dan E.C.Pua. 1997. High Frequency Shoot Regeneration from Leaf Disc Explants of Garland Chrysanthemum (Chrysanthemum coronarium) In Vitro. Plant Sci. 126(2):219-226.
Nisa, C. dan Rodinah. 2005. Kultur Jaringan Beberapa Kultivar Buah Pisang (Musa paradisiaca L.) dengan Beberapa Campuran NAA dan Kinetin. Bioscientiae 2(2): 23-36.
Wetherell, R.J. 1982. Pengantar Propagasi Tanaman Secara In vitro (terjemahan Koensoemarijah). Avery Publishing Group Inc. New York.
Winata, L.G. 1987. Teknik Kultur Jaringan Tumbuhan. PAU Bioteknologi. IPB. Bogor.
Yunus, A. 2007. Pengaruh IAA dan Kinetin terhadap Pertumbuhan Eksplan Bawang Merah (Allium ascalonucum L.) Secara In Vitro. Jurnal Akta Agrosia Edisi 1: 53-58.