TEKNIK KULTUR
LARVA UDANG VANAME,
DI PT.
TAKALAR SULAWESI SELATAN
JURUSAN BUDIDAYA PERIKANAN
POLITEKNIK PERTANIAN NEGERITEKNIK KULTUR Thalassiosira sp UNTUK PAKAN ALAMI
LARVA UDANG VANAME, Litopenaeus vanname
DI PT. CENTRALPERTIWI BAHARI
TAKALAR SULAWESI SELATAN
TUGAS AKHIR
RIDAWATI
1222054
JURUSAN BUDIDAYA PERIKANAN
POLITEKNIK PERTANIAN NEGERI PANGKAJENE DAN KEPULAUA
PANGKEP
2015
PAKAN ALAMI
vannamei (Bonne)
PERTIWI BAHARI
JURUSAN BUDIDAYA PERIKANAN
TEKNIK KULTUR Thalassiosira sp UNTUK PAKAN ALAMI
LARVA UDANG VANAME, Litopenaeus vannamei (Bonne)
DI PT. CENTRALPERTIWI BAHARI
TAKALAR SULAWESI SELATAN
TUGAS AKHIR
RIDAWATI
1222054
Sebagai Salah Satu Syarat untuk Menyelesaikan Studi pada Politeknik Pertanian Negeri Pangkajene dan Kepulauan
Telah Diperiksa dan Disetujui oleh Pembimbing
Ratnawati Rifai, S.Pi., M.Si Dr. Ir. Hj. Hartinah Tayibu, M.S
Ketua Anggota
Diketahui oleh:
Ir. Andi Asdar Jaya, M.Si. Ir. Rimal Hamal, M.P.
Direktur Ketua Jurusan
RINGKASAN
RIDAWATI, 12 22 054. Teknik Kultur Thalassiosira sp Sebagai Pakan Alami Larva Udang Vaname, Litopenaeus vannamei (Bonne) di PT. Centralpertiwi Bahari Takalar, Sulawesi Selatan dibimbing oleh Ratnawati Rifai dan Hartinah Tayibu.
Masalah teknis terbesar yang dihadapi oleh petani dalam menghasilkan benih yang berkualitas adalah ketidaksesuaian pakan alami yang digunakan dalam pemeliharaan larva. Oleh karena itu pengetahuan tentang teknik kultur pakan alami perlu dipelajari agar dapat diketahui teknik-teknik dalam mengkultur pakan alami.
Tugas akhir ini disusun dengan tujuan untuk memperkuat penguasaan teknik kultur Thalassiosira sp sebagai pakan alami untuk larva udang vaname (Litopenaeus vannamei), sehingga mampu melakukan pembenihan serta menyelesaikan masalah yang dihadapi dalam manajemen pakan alami.
Tugas akhir ini disusun berdasarkan kegiatan Pengalaman Kerja Praktik Mahasiswa (PKPM) yang dilaksanakan pada bulan Februari sampai Mei 2015 di PT. Centralpertiwi Bahari (PT. CPB) Takalar, Sulawesi Selatan
Teknik kultur Thalassiosira sp. terbagi atas tiga bagian yaitu kultur murni, kultur intermediate dan kultur massal. Kepadatan alga pada puncak populasi untuk kultur skala laboratorium pada wadah 100 ml yaitu 3.326.000 sel/ml, wadah 1 liter (B1) yaitu 2.883.000 sel/ml, wadah 1 liter (B2) yaitu 2.162.000 sel/ml, wadah 19 liter yaitu 1.275.000 sel/ml, untuk kultur skala intermediate pada wadah 12 ton kepadatannya yaitu 60.000 sel/ml, dan skala massal pada wadah 50 ton yaitu 77.000 sel/ml. Perbedaan wadah budidaya Thalassiosira sp tidak menyebabkan perbedaan pola pertumbuhan. Kisaran kualitas air untuk kultur
skala indor yaitu salinitas 28 ppt, suhu 23oC – 24,5oC, pH 7,2 – 8,1 dan untuk
kultur skala outdor, kisaran salinitas 30 – 32 ppt, suhu yaitu 29oC – 32oC, dan pH
yaitu 9 – 9,8. Kisaran kualitas air yang diperoleh berdasarkan perbandingan dengan teori yang diampuh, masih berada pada kisaran yang optimal.
iv
KATA PENGANTAR
Puji Syukur senantiasa kami panjatkan kehadirat Tuhan Yang Maha Esa, karena atas berkat, rahmat dan penyertaan-Nyalah sehingga penulis dapat menyelesaikan tugas akhir ini tepat pada waktunya. Tugas akhir ini disusun sebagai salah satu persyaratan yang harus dipenuhi untuk meraih gelar sarjana ahli madya perikanan (A.Md.Pi) Jurusan Budidaya Perikanan Politeknik Pertanian Negeri Pangkep.
Dengan selesainya Laporan Tugas Akhir ini, penulis menghaturkan doa, rasa hormat, serta terima kasih yang sebesar-besarnya sebagai penghargaan atas segala bimbingan dan bantuan yang penulis peroleh dalam penyusunan Laporan Tugas Akhir ini kepada:
1. Ratnawati Rifai, S.Pi., M.Si selaku pembimbing I dan Dr.Ir. Hartinah Tayibu,
MS selaku pembimbing II, yang telah banyak memberikan bimbingan, arahan dan petunjuk dalam menyelesaikan laporan tugas akhir ini.
2. Bapak Ir. Rimal Hamal, M.P, selaku Ketua Jurusan Budidaya Perikanan.
3. Bapak Ir. Andi Asdar Jaya, M.Si, selaku Direktur Politeknik Pertanian Negeri
Pangkep.
4. Bapak dan Ibu tercinta yang telah membesarkan saya serta saudara-saudara
saya yang selalu memberikan bimbingan serta dukungan baik secara spiritual maupun secara material serta doa hingga penyelesaian studi ini.
5. PT. Centralpertiwi Bahari Takalar yang telah memberikan kesempatan untuk
v
6. Bapak Fachruddin Nz selaku pembimbing lapangan yang telah banyak
memberikan ilmu dan motivasi dalam melaksanakan pengalaman Kerja Praktek Mahasiswa.
7. Bapak dan ibu dosen serta teknisi budidaya perikanan yang telah memberikan
ilmunya kepada penulis.
8. Teman-teman juga adik-adik mahasiswa yang selalu memberikan suport dan
masukan.
Penulis menyadari bahwa penyusunan tugas akhir ini masih jauh dari kesempurnaan dan masih banyak terdapat kekurangan, untuk itu saran dan kritik yang sifatnya membangun sangat diharapkan penulis demi perbaikan dimasa mendatang. Semoga tugas akhir ini bermanfaat bagi penulis dan berguna bagi yang membacanya Amin.
Pangkep, 03 September 2015
vi
DAFTAR ISI
Halaman RINGKASAN ... iii KATA PENGANTAR ... iv DAFTAR ISI ... viDAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan dan Manfaat ... 2
II TINJAUAN PUSTAKA 2.1 Pengertian Plankton ... 3
2.2 Klasifikasi dan Morfologi Thalassiosira sp ... 4
2.2.1 Biologi Thalassiosira sp ... 4
2.2.2 Habitat Thalassiosira sp ... 5
2.2.3 Budidaya Thalassiosira sp ... 6
2.2.4 Kandungan Gizi Thalassiosira sp ... 7
2.2.5 Fase Pertumbuhan ... 7
III METODE 3.1 Waktu dan Tempat ... 10
3.2 Bahan dan Alat ... 10
3.3 Metode Pengumpulan Data ... 12
3.4 Metode Pelaksanaan 3.4.1 Persiapan Wadah Kultur ... 13
3.4.2 Persiapan Air ... 14
vii
3.4.4 Pemeliharaan ... 16
3.4.5 Pengukuran Kualitas Air ... 19
3.4.6 Pemanenan ... 20
3.5 Parameter yang Diamati dan Analisa Data ... 20
IV HASIL DAN PEMBAHASAN 4.1 Jumlah Populasi Thalassiosira sp pada Kultur Skala Indor ... 21
4.2 Jumlah Populasi Thalassiosira sp pada Kultur Skala outdor ... 23
4.3 Kualitas Air untuk Kultur Thalassiosira sp ... 25
4.4 Pemanenan ... 27
V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 28
5.2 Saran ... 28
DAFTAR PUSTAKA ... 29
LAMPIRAN ... 30 RIWAYAT HIDUP
viii
DAFTAR TABEL
Halaman
1 Bahan yang digunakan untuk kultur Thalassiosira sp ... 10
2 Alat yang digunakan untuk kultur Thalassiosira sp ... 11
3 Dosis pupuk untuk kultur Thalassiosira sp pada skala laboratorium ... 15
4 Dosis pupuk untuk kultur Thalassiosira sp pada skala outdor ... 16
5 Parameter kualitas air yang dipantau ... 19
ix
DAFTAR GAMBAR
Halaman
1 Morfologi Thalassiosira sp ... ... 5
2 Grafik pertumbuhan plankton .... ... 8
3 Grafik pertambahan populasi Thalassiosira sp pada wadah l liter
(B1) ... 21
4 Grafik pertambahan jumlah populasi Thalassiosira sp pada wadah l
liter ... 22
5 Grafik pertambahan jumlah populasi Thalassiosira sp pada wadah
l5 liter ... 22
6 Grafik pertambahan populasi Thalassiosira sp pada wadah beton
x
DAFTAR LAMPIRAN
Halaman
1 Kultur Thalassiosira sp pada Wadah Erlenmeyer ... 31
2 Kultur Thalassiosira sp pada Wadah Botol ... 31
3 Kultur Thalassiosira sp pada Wadah Galon ... 31
4 Kultur Thalassiosira sp pada Bak Fiber (Skala Intermediate) ... 31
5 Kultur Thalassiosira sp pada Bak Beton 12 Ton (Skala Intermediate) ... 32
6 Kultur Thalassiosira sp pada Bak Beton 50 Ton (Skala Massal) ... 32
7 Pertambahan populasi Thalassiosira sp pada Skala Indor ... 33
1
I PENDAHULUAN
1.1 Latar Belakang
Pakan alami merupakan salah satu faktor utama dalam menunjang keberhasilan suatu usaha pembenihan, baik pembenihan ikan maupun udang. Pakan alami merupakan pakan terbaik terutama pada stadia larva karena pakan alami memiliki kandungan gizi yang cukup lengkap, mudah dicerna oleh larva yang belum memiliki alat pencernaan yang lengkap dan ukurannya sesuai dengan bukaan mulut larva. Dalam kegiatan budidaya, pakan alami yang biasa digunakan ada dua jenis yaitu budidaya fitoplankton (nabati) dan budidaya zooplankton (hewani). Kedua jenis pakan alami tersebut sangat memegang peran penting sebagai dasar pemenuhan gizi pada saat awal kehidupan larva udang, ikan, kerang-kerangan dan berbagai jenis komoditi perikanan lainnya. Fitoplankton merupakan sumber produsen pertama pada jaringan rantai makanan, dari sinilah awal mula sumber energi utama yang terus digali dan dikembangkan dari berbagai macam jenis pakan alami.
Salah satu jenis fitoplankton yang digunakan sebagai pakan alami larva udang vaname yaitu jenis diatom. Diatom adalah mikroalga uniseluler fotosintetik yang memiliki dinding khas terbuat dari silika. Pola, ukuran, dan ornamentasi dinding sel yang khas menjadi ciri taksonomi jenis-jenis diatom. Ada beberapa zooplankton jenis diatom yang memiliki flagella seperti
Thalassiosira sp dan Chaetoceros sp, organisme ini biasa digunakan sebagai
2 PT. Centralpertiwi Bahari merupakan salah satu hatchery yang berada dibawah manajemen CP. Prima yaitu perusahaan yang telah lama bergelut dibidang pembenihan dan pembesaran udang windu maupun udang vaname. Oleh karena itu kegiatan praktek yang berkaitan dengan teknik kultur pakan alami dilakukan di hatchery PT. Centralpertiwi Bahari, Takalar Sulawesi Selatan.
Jenis pakan alami yang difokuskan dalam kegiatan ini adalah Thalassiosira sp. dalam pemeliharaan larva udang vaname. Data-data yang diperoleh selama praktik dianalisa dan ditulis dalam laporan tugas akhir.
1.2 Tujuan dan Manfaat
Tujuan penulisan tugas akhir ini adalah memperkuat penguasaan teknik kultur Thalassiosira sp sebagai pakan alami untuk larva udang vaname (Litopenaeus vannamee) di PT. Centralpertiwi Bahari Takalar Sulawesi Selatan.
Manfaat penulisan tugas akhir ini adalah memperluas wawasan kompetensi keahlian mahasiswa dalam berkarya di masyarakat kelak khususnya mengenai teknik kultur pakan alami Thalassiosira sp untuk penyediaan pakan bagi larva udang vaname.
3
II TINJAUAN PUSTAKA
2.1 Pengertian Plankton
Plankton merupakan sekelompok biota akuatik baik berupa tumbuhan maupun hewan yang hidup melayang maupun terapung secara pasif di permukaan perairan, dan pergerakan serta penyebarannya dipengaruhi oleh gerakan arus walaupun sangat lemah (Piranti, 2012)
Pakan alami umumnya diberikan kepada organisme budidaya yang masih stadia larva karena ukurannya cocok dengan bukaan mulut larva. Pakan alami memiliki beberapa kelebihan dibanding dengan pakan buatan yaitu nilai gizinya sangat lengkap, tidak menyebabkan penurunan kualitas air pada wadah budidaya, meningkatkan daya tahan tubuh benih terhadap penyakit dan perubahan kualitas air, mudah ditangkap oleh larva karena pergerakannya tidak begitu aktif dan berukuran kecil sesuai dengan bukaan mulut larva (Furgoninspired, 2012).
Ada beberapa jenis plankton yang sering digunakan dalam kegiatan pembenihan udang vaname, salah satunya yaitu fitoplankton jenis diatom. Diatom (Chrysophyta) adalah kelompok alga yang memiliki dinding sel yang terbentuk dari silikon dioksida. Memiliki kloroplas dan DNA dalam nukleus, mengandung chlorophyl a dan c serta beberapa carotenoid seperti seperti fucoxanthin. Ada beberapa fitoplankton yang memiliki flagella. Organisme ini biasa digunakan sebagai pakan dalam budidaya seperti Thalassiosira sp,
Chaetoceros sp, dan Skeletonema sp. Variabel kimia lingkungan perairan
memainkan peran penting didalam mendeterminasi tingkat pertumbuhan dan kualitas sel alga. Alga dapat menyerap nutrient dari seluruh lapisan perairan,
4 karena bisa mengabsorpsi langsung melalui membran sel. Salah satu tujuan kultur alga adalah untuk mendapatkan kelimpahan sel yang tertinggi dalam periode waktu yang singkat. Apabila pemanfaatan air dengan zat penyubur yang terbatas akan menghasilkan kelimpahan sel yang kurang baik. Kondisi perairan alami, konsentrasi trace metal biasanya cukup terpenuhi, tetapi kandungan makro nutrien seperti Fosfor terbatas keberadaannya diperairan tawar dan Nitrat terbatas diperairan laut (Faricha, 2009).
2.2 Klasifikasi dan Morfologi 2.2.1 Biologi Thalassiosira sp
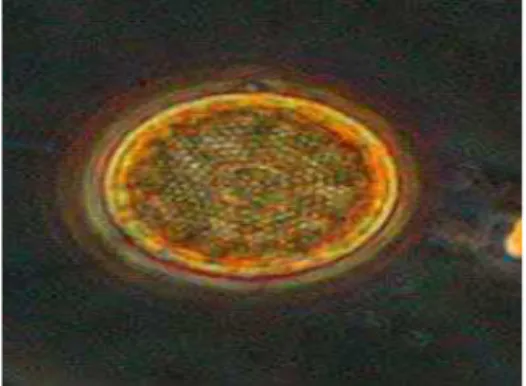
Thalassiosira sp adalah salah satu spesies diatom. Thalassiosira sp seperti halnya diatom lain merupakan alga yang bersifat uniseluler, eukaryotik, dan fotosintetis yang ditemukan diseluruh perairan laut dan tawar di dunia dan bertanggung jawab terhadap 20% produktivitas primer global. Mereka merupakan dasar pembentuk yang mendukung perikanan pantai skala besar. Fotosintesis oleh diatom laut seperti halnya Thalassiosira sp menghasilkan 40% dari 45 – 50 milyar metrik ton karbon organik yang diproduksi didalam laut setiap tahunnya. Morfologi diatom digambarkan mempunyai bentuk ornamen seperti silika pada dinding selnya. Kalium dan silika merupakan nutrien yang banyak dimanfaatkan oleh diatom sebagai salah satu sumber elemen untuk membentuk komposisi frustala pada lapisan selnya pada proses asimilasi. Thalasiosira sp memiliki bagian tubuh yang bernama fultoportulae yang dapat mensekresikan β-kitin yang berguna agar Thalassiosira tidak tenggelam dan selnya selalu mengapung di perairan. Ciri-ciri dari Thalassiosira sp adalah permukaan katup datar, terdapat fultoportulae di dekat pusat katup, memiliki dua katup yang
5 dibatasi oleh duri-duri dan pada bagian tepi dilapisi oleh mantel (Anonim 2003, dalam Pratama, 2012).
Berikut adalah klasifikasi dari Thalassiosira sp yang diklasifikasikan oleh International Taxonomi Standar Report (2008) dalam Panjaitan (2012) :
Divisi : Eukaryota
Phylum : Bacillariopita
Kelas : Bacillariophyceae
Sub kelas : Coscinodiscophyceae
Ordo : Thalassiosirales
Subordo : Thalassiosiraceae
Genus : Thalassiosira
Species : Thalassiosira weissflogii.
Adapun morfologi Thalassiosira sp dapat dilihat pada Gambar 1.
Gambar 1 Morfologi Thalassiosira sp (Sunarto, 2008)
2.2.2 Habitat
Menurut Smayda (1958) dalam Pratama (2012), Thalassiosira sp dapat ditemukan di banyak tempat yaitu perairan laut mulai dari belahan bumi utara Antartika sampai belahan bumi selatan Cape Town, oleh karena itu banyak sekali
6 spesies Thalassiosira yang sudah dikenal hingga saat ini, spesies-spesies tersebut antara lain adalah T. pseudonana, T. weissflogii, T. antarctica Comber, dan T.
hyalina. Rentang suhu hidup Thalassiosira dari 8,4oC – 17,2oC. Spesies lain dari
Thalassiosira sp ditemukan mampu hidup pada suhu yang lebih rendah, yaitu
1,77oC– 3,49oC. Rentan salinitas untuk Thalassiosira adalah 32,61 – 34,64 ppt.
Salah satu spesies dari Thalassiosira, yaitu T.hyalina merupakan spesies yang di sebagian besar arus kutub dan distribusinya sejajar dengan arah aliran arus tersebut. Hal ini seperti yang terjadi pada arus Greenland Timur, yang berhubungan dan menyambung dengan laut Labrador. Pada beberapa daerah pantai di iklim dingin, sebagai contoh Skeletonema costatum tumbuh pada akhir musim dingin atau bahkan awal musim semi, tumbuhnya S. costatum ini menggantikan atau disuksesi oleh Thalassiosira spp dan pada gilirannya nanti akan digantikan oleh Chaetocheros spp. dan begitu seterusnya.
2.2.3 Budidaya Thalassiosira
Menurut Clark (2002) dalam Pratama (2012) budidaya Thalassiosira sp dilakukan dalam tiga tahap, yaitu laboratorium, semi massal, dan lapangan. Tahap laboratorium dikenal dengan skala kecil dan tahap lapangan (outdor) dikenal dengan skala massal. Pada skala laboratorium dilakukan kultur murni fitoplankton yang bertujuan untuk menjaga kemurnian dan kelestarian alga. Budidaya skala laboratorium ini pada umumnya dilakukan dalam ruangan tertutup dan kondisi lingkungan terkontrol pada setiap wadah budidayanya. Thalassiosira sp dapat dikultur dalam skala laboratorium yaitu dengan menggunakan media air laut yang mengandung makronutrium didalamnya yang meliputi 100 µM nitrat, 383 µM silikat dan 36 µM fosfat. Metode kultur selanjutnya yaitu kultur skala
7 intermediate dan kultur skala massal. Kultur skala intermdiate dan kultur skala massal dilakukan di ruangan yang terbuka dan diberi atap yang tembus dengan cahaya matahari sehingga proses fotosintesis berjalan.
2.2.4 Kandungan Gizi
Menurut Gisella et.al (2012) Thalassiosira sp mempunyai kandungan protein sekitar 44,5%, kandungan karbohidrat 26,1% dan kandungan lemak sekitar 11,8% dari berat keringnya. Jenis fitoplankton ini adalah salah satu jenis pakan alami yangdirekomendasikan untuk diberikan sebagai pakan alami karena mempunyai beberapa keunggulan antara lain adalah nilai nutrisi yang dikandungnya memenuhi syarat bagi pertumbuhan larva udang vaname dan jenis crustacea lainnya.
2.2.5 Fase Pertumbuhan
Thalassiosira sp sebagai salah satu jenis plankton memiliki fase
pertumbuhan. Fase pertumbuhan ini pada saat budidaya secara visual ditandai dengan adanya perubahan warnah air dari awalnya bening menjadi berwarnah coklat mudah dan kemudian menjadi coklat dan seterusnya, perubahan ini disertai dengan menurunnya transparansi. Kejadian tersebut merupakan indikasi dari meningkatnya ukuran sel dan bertambah banyaknya jumlah sel yang secara langsung akan berpengaruh terhadap keadatan plankton. Menurut Kawaroe (2010) pola pertumbuhan mikroalga pada sistem kultivan terbagi menjadi 5 tahap dan dapat dilihat pada Gambar 2.
8 Gambar 2 Grafik pertumbuhan plankton
Fase-fase pertumbuhannya adalah sebagai berikut :
a. Fase lag
Pada fase lag belum mengalami perubahan. Pada fase ini pertumbuhan fitoplankton dikaitkan dengan adaptasi fisiologis metabolisme sel pertumbuhan fitoplankton, seperti peningkatan kadar enzim dan metabolit yang terlibat dalam pembelahan sel dan fiksasi karbon.
b. Fase logaritmik atau eksponensial
Pada fase eksponensial sel fitoplankton telah mengalami pembelahan sel dengan laju pertumbuhannya tetap. Pertumbuhan fitoplankton dapat maksimal tergantung pada spesies alga, intensitas cahaya dan temperatur.
c. Fase transisional atau fase berkurangnya pertumbuhan relatif
Pertumbuhan sel mulai melambat ketika nutrien, cahaya, pH, CO2 atau
9
d. Fase Stasioner
Pada fase keempat faktor pembatas dan tingkat pertumbuhan seimbang. Laju kematian fitoplankton relatif sama dengan laju pertumbuhannya sehingga kepadatan fitoplankton pada fase ini relatif konstan.
e. Fase Kematian
Pada fase kematian, kualitas air memburuk dan nutrient habis hingga ke level tidak sanggup menyokong kehidupan fitoplankton. Kepadatan sel menurun dengan cepat karena laju kematian fitoplankton lebih tinggi dari pada laju pertumbuhannya hingga kultur berakhir.
10
III METODE
3.1 Waktu dan Tempat
Tugas akhir ini disusun berdasarkan kegiatan Pengalaman Kerja Praktik Mahasiswa (PKPM) yang dilaksanakan pada tanggal 09 Februari – 09 Mei 2015 di PT. Centralpertiwi Bahari (PT. CPB) Takalar, Sulawesi Selatan.
3.2 Bahan dan Alat
Bahan dan alat yang digunakan dalam kegiatan ini dapat dilihat pada Tabel 1 dan Tabel 2 berikut ini.
Tabel 1 Bahan yang digunakan untuk kultur Thalassiosira sp
No Bahan Spesifikasi Kegunaan
1 Air laut - Media kultur
2 Aquades Cair Untuk sterilisasi
3 Kaporit 15 kg Untuk treatment air
4 Alkohol 96% Untuk sterilisasi
5 Quillard Cair Pupuk kultur pada wadah erlenmeyer
6 Air tawar Salinitas 0 ppt Untuk menambahkan air laut yang
salinitasnya > 28 ppt dan untuk membilas peralatan
7 Bibit alga Thalassiosira Bibit untuk kultur
8 AGP 1 liter Pupuk untuk kultur skala indor dan
outdor
9 EDTA 1 kg Pupuk untuk kultur skala 1 L dan 15 L
10 Silikat 2,5 L Pupuk untuk skala indor dan outdor
11 NaNO3 25 kg Pupuk untuk kultur skala outdor
12 DSP 25 kg Pupuk untuk kultur skala outdor
13 Urea 50 kg Pupuk untuk kultur skala outdor
14 Natrium thiosulfat 25 kg Untuk menetralkan kaporit
15 Wipol 800 ml Bahan untuk sterilisasi ruangan
16 Porstex Cair Bahan untuk pencucian peralata
laboratorium
17 Deterjen Bubuk Mencuci peralatan dan wadah kultur
11 Tabel 2 Alat yang digunakan untuk kultur Thalassiosira sp
No Alat Spesifikasi Kegunaan
1 Botol 1 liter Wadah kultur skala laboratorium
2 Erlenmeyer 100 ml Wadah kultur skala laboratorium
3 Rak kultur Kayu Tempat meletakkan wadah
kultur
4 Bak fiber 500 liter Wadah kultur skala intermedit
5 Bak beton 12 ton Wadah kultur skala intermedit
6 Bak beton 50 ton Wadah kultur skala massal
7 Pipa 2” dan 4 “ Wadah penyaluran air dan pakan
alami
8 Bulb Karet Alat penghisap
9 Perangkat aerasi Plastik Suplay oksigen
10 Timbangan electrik 500 gr Untuk menimbang pupuk
11 Pompa celup 8 HP Penyedot pakan alami yang akan
ditransfer
12 Termometer 50oC Mengukur suhu
13 Filter bag 5 µm Menyaring air
14 Galon 19 L Wadah kultur laboratorium
15 Corong 18, 20 dan 25 cm Alat bantu untuk kultur
16 Gelas ukur 1000 ml Wadah untuk melarutkan pupuk
17 Pipet skala 10 ml Memipet larutan pupuk
18 Pipet tetes 5 ml Memipet sampel thalassiosira
yang akan dicek kepadatannya
19 Test tube 20 ml Wadah kultur dan tempat sampel
20 Rak testube Plastik Tempat meletakkan test tube
21 Laminary air flow Kayu Tempat kerja saat mengkultur
22 Bunsen - Untuk sterilisasi
23 Labu semprot 250 ml Wadah untuk aquades
24 Spray 500 ml Wadah untuk alkohol
25 Lampu 50 watt Untuk menyuplai cahaya
26 Scoring pad - Untuk menggosok bak
27 Aluminium foil 8 m × 30 cm Penutup erlenmeyer dan botol
kultur
28 AC Model AH-Al2kcy Menurunkan dan menstabilkan
suhu laboratorium kultur
29 Haemocytometer Kaca Untuk menghitung alga
30 Microskop CH-B145-2 Untuk mengamati alga
31 Cover glass Kaca Untuk menutup haemocytometer
32 Autoclave Model yx-280D Untuk sterilisasi
33 Boks Plastik Tempat penyimpanan alat
34 Ember 20 liter Tempat membuat media botol
35 Pitcher Vol 700 ml Menimba dan mengukur media
botol
36 Pompa air laut 10 HP Untuk memompa air laut
12 Lanjutan Tabel 2 Alat yang digunakan untuk kultur Thalassiosira sp
No Alat Spesifikasi Kegunaan
38 Bak kerucut 500 L Wadah penampungan air
3 Bak filter - Untuk menyaring air laut
40 Sikat galon - Untuk menyikat galon
41 Scoring pad - Untuk menggosok bak
42 Sikat tabung reaksi - Untuk menyikat test tube
43 Hand refraktometer - Mengukur salinitas
44 pH terst - Mengukur Ph
45 Termometer 100oC Mengukur suhu
Sumber : Data PKPM PT.Centralpertiwi Bahari Takalar 2015
3.3 Metode Pengumpulan Data
Metode pengumpulan data yang digunakan dalam tugas akhir ini yaitu observasi dan partisipasi aktif untuk mengumpulkan data primer dan data sekunder.
3.3.1 Data Primer
Data Primer adalah data yang dikumpulkan sesuai hasil praktik yang dikerjakan secara langsung.
3.3.2 Data Sekunder
Data sekunder adalah data yang dikumpulkan dari berbagai sumber seperti data yang diperoleh dari laporan tahunan, buku-buku penunjang dan hasil wawancara dengan pembimbing lapangan yang tidak bisa dilakukan secara langsung di lapangan.
3.4 Metode Pelaksanaan
Adapun metode pelaksanaan kegiatan kultur Thalassiosira sp di PT. Centralpertiwi Bahari, Takalar adalah sebagai berikut.
13 3.4.1 Persiapan Wadah
Persiapan wadah dan peralatan meliputi pencucian peralatan, pengeringan, dan sterilisasi menggunakan autoclave. Wadah kultur dan peralatan skala laboratorium seperti test tube, erlenmeyer, botol dan galon direndam dengan air tawar dan diberi larutan porsteks terlebih dahulu selama ± 7 jam selanjutnya wadah digosok/disikat kemudian dibilas dengan air tawar yang mengalir sampai bersih lalu dikeringkan. Glasware (erlenmeyer, gelas ukur, tes tube, petridisk) dan selang aerasi yang sudah kering dibungkus dengan plastik yang tahan panas dan dilakban kemudian dimasukkan ke dalam autoclave untuk disterilkan pada
suhu 121oC selama 15 menit.
Persiapan wadah kultur skala intermediate dan skala massal dilakukan dengan cara bak disemprot dengan air laut untuk membersihkan kotoran yang menempel pada dinding dan lantai dasar bak. Bak yang telah disemprot dengan air laut kemudian digosok dengan scoring pad yang telah dicelupkan ke dalam larutan deterjen hingga kotoran yang menempel pada dinding dan lantai dasar bak hilang. Selain itu, selang aerasi dan batu aerasi yang digunakan juga digosok. Selanjutnya bak tersebut dibilas dengan menyemprotkan kembali air laut ke dalam bak hingga sisa-sisa deterjen hilang. Setelah proses tersebut selesai, maka bak dikeringkan selama 1 malam untuk dipakai keesokan harinya. Dalam jangka waktu 2 minggu sekali, bak-bak tersebut diberi clorin secukupnya untuk mencegah pertumbuhan bakteri dan menghilangkan sisa kotoran yang sulit dibersihkan. Bak yang telah diberi klorin harus dibilas terlebih dahulu pada keesokan harinya sebelum digunakan untuk kultur.
14 3.4.2 Persiapan Air
Air yang digunakan untuk kultur Thalassiosira sp berasal dari laut. Air laut dipompa dengan menggunakan pompa Sumersibel yang berdiameter 4 inch dengan power 24 PK. Air tersebut kemudian dialirkan dengan gaya grafitasi dan di saring pada bak sand filter, selanjutnya air dialirkan ke dalam bak treatment yang berkapasitas 40 ton. Air laut di treatment pada bak treatment dengan menggunakan kaporit sebanyak 10 ppm dan diaeras selama 5 jam kemudian disterilkan dengan Natrium Tiosulfat sebanyak 5 ppm dan diaerasi selama 2 jam sebelum digunakan. Air dari bak treatment tersebut dialirkan melalui pipa paralon ke bak penampungan air untuk kultur laboratorium. Air laut yang akan digunakan di laboratorium terlebih dahulu salinitasnya dicek dengan menggunakan hand
refraktometer. Air yang digunakan untuk kultur laboratorium salinitasnya harus
28 ppt. Apabila salinitas air laut pada pengukuran refraktometer melebihi 28 ppt maka harus dilakukan perlakuan yaitu dengan menambahkan air tawar. Sebelum digunakan air dilewatkan di cadritge filter lalu dimasukkan ke dalam laboratorium.
Sedangkan air yang digunakan untuk skala intermediate dan skala massal berasal dari bak treatment yang dialirkan melalui pipa dan langsung dimasukkan ke dalam bak kultur tanpa harus dilewatkan di catridge filter. Salinitas yang digunakan untuk kultur skala intermediate dan skala massal yaitu salinitas 30 ppt
– 32ppt. Bak-bak yang terisi dengan air diaerasi selama satu malam dan pada
15 3.4.3 Persiapan Pupuk
Adapun langka yang dilakukan dalam persiapan pupuk skala indor yaitu pupuk EDTA sebanyak 20 gram dan Silikat sebanyak 135 gram ditimbang kemudian masing-masing pupuk dilarutkan dengan aquades di dalam gelas ukur yang berbeda. Selanjutnya pupuk diaduk sampai pupuk larut lalu dimasukkan ke dalam botol yang berbeda kemudian ditutup dengan menggunakan aluminium
foil. Larutan pupuk disterilkan di dalam autoclave pada suhu 121oC selama 15
menit. Setelah itu, larutan pupuk didinginkan lalu disimpan pada tempat yang steril dan pupuk siap digunakan. Jenis dan dosis pupuk yang digunakan untuk kultur skala indor dapat dilihat pada Tabel 3.
Tabel 3 Dosis pupuk untuk kultur Thalassiosira sp pada skala laboratorium
Jenis pupuk Dosis pupuk setiap wadah (ml)
1liter 15 liter
EDTA 0.25 3.75
AGP 0.5 7.5
SILIKAT 0.5 7.5
Sumber : Data PKPM PT.Centralpertiwi Bahari Takalar 2015
Untuk kultur outdor, persiapan pupuk dilakukan dengan cara pupuk
NaNO3, DSP, Urea, dan Silikat ditimbang sesuai dengan dosis yang telah
ditentukan lalu dimasukkan ke dalam ember dan ditambahkan dengan air kemudian diaduk sampai semua pupuk larut. Sedangkan AGP dipipet menggunakan pipet skala lalu dimasukkan ke dalam ember. Adapun jenis dan dosis pupuk yang digunakan untuk kultur skala indor disajikan pada Tabel 4.
16 Tabel 4 Dosis pupuk untuk kultur Thalassiosira sp. pada skala outdor
Jenis Pupuk
Dosis Pupuk Pada Setiap
Wadah (gram) Fungsih
1 ton 12 Ton 50 Ton
NaNO3 60 720 3000 Sebagai nutrisi bagi alga
DSP 5 60 250 Meningkatkan posfhor
UREA 10 120 500 Mempercepat pertumbuhan sel
SILIKAT 11 132 550 Menguatkan sel alga
AGP 5 60 250 Mempercepat pertumbuhan sel
Sumber : Data PKPM PT.Centralpertiwi Bahari Takalar 2015
3.4.4 Pemeliharaan
Kultur Skala Laboratorium
Pada kultur Thalassiosira di PT. Centralpertiwi Bahari Takalar untuk kultur skala laboratorium menggunakan wadah dengan volume bertingkat.
a. Kultur Skala 100 ml (Erlenmeyer)
Kultur skala 100 ml dikerjakan di dalam laminari air flow. Sebelum melakukan kultur, laminari air flow dan tangan terlebih dahulu disemprot dengan alkohol 96 % kemudian bunsen dinyalakan. Erlenmeyer yang telah diautoclave diisi dengan air media quillard yang telah disterilkan sebanyak 80 ml. Selanjutnya bibit dituang ke dalam erlenmeyer sebanyak 20 ml (2 tabung reaksi yang bervolume 10 ml). Erlenmeyer ditutup dengan aluminium foil lalu mulut erlenmeyer dipanaskan di bunsen kemudian media erlenmeyer disimpan di rek
kultur. Alga dipelihara selama 5 – 8 hari pada suhu 18 – 24oC dan dilakukan
pengkocokan setiap 3 kali/hari yaitu pagi, siang dan sore hari. Kultur skala 100 ml menggunakan media botol dapat dilihat pada Lampiran 1.
17 b. Kultur Skala 1 Liter (Botol)
Air yang digunakan untuk kultur pada wadah botol terlebih dahulu disterilkan. Air dialirkan dari bak penampungan lalu dimasukkan ke dalam ember sebanyak 20 liter. Air diberi pupuk EDTA 5 ml, AGP 10 ml, dan Silikat 10 ml lalu diaerasi selama 10-15 menit sampai homogen. Selanjutnya air dimasukkan ke dalam botol volume 1 liter sebanyak 700 ml. Kemudian botol ditutup dengan menggunakan aluminium foil dan dimasukkan ke dalam mesin autoclave dan
diautoclave pada suhu 121oC selama 15 menit.
Kultur skala 1 liter dilakukan dengan cara mensterilkan tempat kerja dengan alkohol 96% lalu bunsen dinyalakan. Mulut botol dan erlenmeyer dipanaskan di bunsen, penutup botol dan erlenmeyer dibuka lalu bibit yang ada di dalam erlenmeyer dituang ke dalam botol sebanyak 200 ml (2 buah erlenmeyer yang berisi bibit dituang ke dalam 1 botol kultur). Selanjutnya botol ditutup dengan aluminium foil kemudian mulut botol dipanaskan di bunsen lalu media botol diberi label dengan menggunakan kertas marker kemudian diaerasi dan diberi sinar lampu neon 40 watt. Bibit dipelihara selama 3 hari pada suhu 18 –
25oC. Kultur skala 1 liter menggunakan botol dapat dilihat pada Lampiran 2.
c. Kultur Skala 15 Liter (Galon)
Kultur skala 15 liter menggunakan wadah galon dan dikultur setelah bibit selesai dikultur di botol. Kultur skala 15 liter dilakukan dengan cara mensterilkan tempat kerja dengan alkohol 96% lalu mengisi galon dengan air laut yang dialirkan dari bak penampungan sebanyak 13 liter. Bibit dimasukkan ke dalam galon yang telah diisi dengan air laut sebanyak 2 botol bibit dari kultur skala 1 liter. Bibit kemudian diberi pupuk dengan cara memipet EDTA sebanyak 3,75
18 ml, AGP sebanyak 5,7 ml, dan silikat sebanyak 5,7 ml ke dalam galon. Galon ditutup kemudian diletakkan di rak kultur . Pada rak kultur dipasangi lampu sebanyak 2 susun dan pipa aerasi. Media galon diberi aerasi dan pelihara selama
3 hari pada suhu ruangan 23 – 24,5oC. Kultur skala 15 liter menggunakan galon
dapat dilihat pada Lampiran 3.
Kultur Skala Intermediate
Kultur skala intermediate dilakukan di luar ruangan pada bak fiber dan bak beton.
a. Kultur Skala Intermediate Volume 500 Liter (Bak Fiber)
Bak fiber yang akan digunakan untuk kultur diisi dengan air laut sebanyak
470 liter. Setelah itu, dilakukan pemberian pupuk NaNO3 30 gram, DSP 2,5
gram, Urea 5 gram, Silikat 5,5 gram dan AGP 2,5 ml lalu diberi aerasi. Selanjutnya bibit dari galon dimasukkan ke dalam bak sebanyak 30 liter dan dipelihara selama 24 jam. Setelah itu, bibit dikultur kembali menggunakan 2 bak dengan volume 500 liter dengan cara bibit dibagi kedalam 2 bak lalu air laut dimasukkan ke dalam bak sampai volumenya 500 liter kemudian bibit diberi pupuk dengan dosis yang sama pada saat kultur awal dan bibit dipelihara selama 24 jam sebelum dikultur pada bak skala 12 ton (bak beton). Kultur skala intermediate menggunakan bak fiber dapat dilihat pada Lampiran 4.
b. Kultur Skala Intermediate Volume 12 Ton (Bak Beton)
Kultur skala intermedit pada bak beton dilakukan dengan cara mengisi bak beton dengan air yang dialirkan dari bak treatment sebanyak 11 ton lalu diaerasi selama 1 malam. Keesokan harinya, bibit ditransfer dari bak fiber dengan
19 menggunakan pompa celup dan selang yang disambungkan pada pipa transfer.
Selanjutnya, bibit diberi pupuk NaNO3 sebanyak 720 gram, DSP 60 gram, urea
120 gram, silikat 132 gram, dan AGP 60 ml dan dipelihara selama 24 jam sebelum dikultur pada bak massal. Kultur skala intermediate menggunakan bak beton dapat dilihat pada Lampiran 5.
Kultur Skala Massal Volume 50 Ton
Kultur skala massal dilakukan dengan cara mengisi bak beton dengan air yang dialirkan langsung dari bak treatment sebanyak 38 ton dan diaerasi selama 1 malam. Selanjutnya bibit ditransfer dari bak intermedit ke bak massal sebanyak
12 ton. Bibit diberi pupuk NaNO3 3000 gram, DSP 250 gram, Urea 500 gram,
silikat 550 gram dan AGP 250 ml dan dipelihara selama 3 hari sebelum diberikan pada larva. Kultur skala massal dapat dilihat pada Lampiran 6.
3.4.5 Pengukuran Kualitas Air
Parameter kualitas air yang dipantau pada kultur Thalassiosira sp. dapat dilihat pada Tabel 5.
Tabel 5 Parameter kualitas air yang dipantau
No Parameter Alat dan spesifikasi Cara pengukuran
Fisika
1 Suhu Termometer 100oC Insitu
2 Salinitas Hand refraktometer Exitu
Kimia
1 pH pH testr Exitu
Keterangan : Insitu artinya diukur langsung di wadah kultur
20 3.4.6 Pemanenan Thalassiosira sp
Pemanenan dilakukan setelah alga mencapai puncak populasi yaitu pada hari ke 3 dan cara menyambung pipa transfer dengan selang dan pompa lalu membuka kran pada ujung pipa dan pompa dinyalakan.
3.5. Parameter yang Diamati dan Analisa Data 3.5.1 Parameter yang Diamati
Parameter yang diamati yaitu pertambahan populasi dan Kualitas air
Thalassiosira sp. pada kultur skala indor dan kultur skala outdor.
3.5.2 Analisa Data
Kepadatan Thalassiosira sp
Menurut Isnansetyo dan Kurniastuti (1995) rumus yang digunakan untuk menghitung kepadatan alga yaitu:
Kepadatan Thalassiosira sp. = jumlah sel × 10.000 sel/ml
Berdasarkan Standar Operasional Prosedur (SOP) PT. Centralpertiwi Bahari Takalar, rumus yang digunakan untuk menghitung kepadatan alga yaitu sebagai berikut:
Kepadatan Thalassiosira sp. =
! ! × 10.000 sel/ml
Data yang diperoleh disajikan dalam bentuk tabel dan grafik selanjutnya dianalisa secara deskriptif.
21
IV HASIL DAN PEMBAHASAN
4.1 Jumlah Populasi Thalassiosira sp. pada Kultur Skala Indor
Pengamatan jumlah populasi dilakukan untuk mengetahui kondisi fitoplankton dan mengetahui jumlah kepadatan fitoplankton yang tumbuh dengan menggunakan haemocytometer. Isnansetyo dan Kurniastuti (1995) menyatakan bahwa metode pemantauan fitoplankton perlu dilakukan, selain pemantauan pertumbuhan, juga pemantauan terhadap kemungkinan adanya kontaminasi oleh protozoa. Beberapa kasus kontaminasi tersebut terjadi karena kesalahan dalam melakukan sterilisasi alat dan media, unit aerasi serta ketelitian pada saat inokulasi. Adapun hasil pemantauan jumlah populasi Thalassiosira sp. pada kultur skala labratorium disajikan pada Lampiran 7 dan Gambar 3, 4, dan 5.
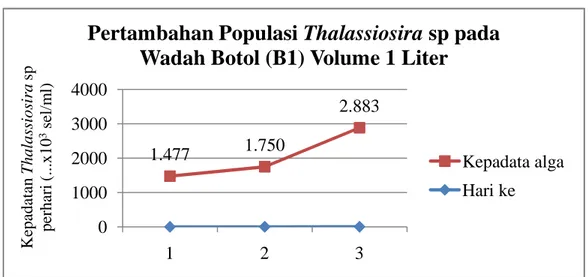
Gambar 3 Grafik pertambahan populasi Thalassiosira sp. pada wadah botol (B1)
1.477 1.750 2.883 0 1000 2000 3000 4000 1 2 3 K epa da ta n T hal as si os ir a sp pe rha ri ( ...x10 3se l/ m l)
Pertambahan Populasi Thalassiosira sp pada
Wadah Botol (B1) Volume 1 Liter
Kepadata alga Hari ke
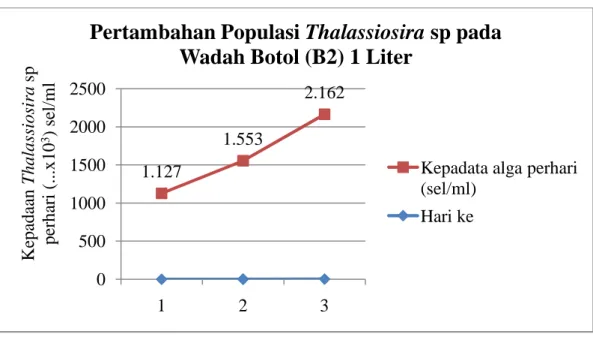
22 Gambar 4 Grafik pertambahan populasi Thalassiosra sp pada wadah botol (B2)
Gambar 5 Grafik pertmbahan populasi Thalassiosira sp pada wadah galon 15 liter Pertambahan jumlah populasi Thalassiosira sp skala indor baik pada wadah erlenmeyer dengan waktu pemeliharaan 5 hari maupun wadah botol dan galon pada hari ketiga cenderung meningkat dengan bertambahnya waktu pemeliharaan. Diduga jumlah populasi masih terus meningkat, namun dengan kepadatan 3.326.000 sel/ml pada wadah erlenmeyer, dan 2.883.000 sel/ml pada
1.127 1.553 2.162 0 500 1000 1500 2000 2500 1 2 3 K epa da an T hal as si os ir a sp pe rha ri ( ...x 10 3 ) se l/ m l
Pertambahan Populasi Thalassiosira sp pada
Wadah Botol (B2) 1 Liter
Kepadata alga perhari (sel/ml) Hari ke 1 2 3 327 536 1.275 0 200 400 600 800 1000 1200 1400 1 2 3 K epa da ta n T hal as si os ir a sp pe rha ri (...x10 3) se l/ m l
Pertambahan Populasi Thalassiosira sp pada
Wadah Galon 15 Liter
Kepadata alga perhari (sel/ml)
23 wadah botol (B1), untuk botol (B2) 2.162.000 sel/ml serta pada media galon sebanyak 1.275.000 sel/ml sudah dianggap cukup untuk bibit pada tahap selanjutnya sehingga dipanen sebelum puncak populasi. Pertambahan populasi yang meningkat terus hingga hari ketiga menunjukkan bahwa ketersediaan nutrien (pupuk) untuk pertumbuhan Thalassiosira sp masih mencukupi kebutuhan. Menurut Ismansetyo dan Kurniastuti (1995) bahwa jumlah populasi akan menurun apabila kebutuhan nutrisi tidak sesuai dengan kebutuhan algae untuk tumbuh. Berdasarkan pada pertumbuhan Thalassiosira sp yang diperoleh masih berada pada fase eksponensial dimana pertambahan populasi berbanding lurus dengan bertambahnya waktu.
4.2 Jumlah Populasi Thalassiosira sp. pada Kultur Skala Outdor
Kultur skala outdor adalah kelanjutan dari kultur skala indor yang dilakukan pada lokasi yang terbuka, tidak terdapat atap sama sekali sehingga sinar matahari dapat dengan langsung masuk ke dalam bak. Kultur skala outdor terdiri atas kultur intermediate dan kultur massal. Kultur skala intermeditate menggunakan wadah dengan volume bertingkat yaitu volume 500 liter, 1 ton dan 12 ton. Yang membedakan kultur intermediate dan kulur massal di PT. Centralpertiwi Bahari yaitu ukuran wadah. Adapun hasil pemantauan jumlah populasi Thalassiosira sp pada kultur indor dapat dilihat pada Lampiran 8 dan Gambar 6.
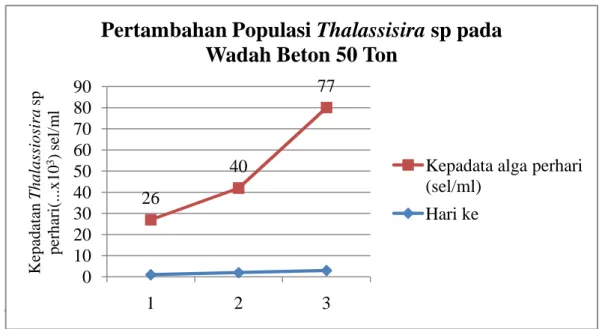
24 Gambar 6 Pertambahan populasi Thalassiosira sp pada bak beton 50 ton
Gambar 6 Grafik pertambahan populasi Thalassiosira sp pada wadah beton 50 ton
Dari Gambar 6 di atas menunjukkan bahwa pertambahan jumlah populasi
Thalassiosira sp pada kultur skala outdor meningkat seiring bertambahnya waktu
pemeliharaan hingga hari ketiga. Jumlah populasi masih akan meningkat namun dengan kepadatan 72.000 sel/ml untuk kultur pada bak fiber dan 60.000 sel/ml untuk kultur pada bak beton 12 ton sudah dianggap cukup sebagai starter untuk kultur selanjutnya. Pemanenan dilakukan pada hari ketiga dimana pada hari ketiga berada pada fase eksponensial. Pada fase eksponensial diawali dengan pembelahan sel dengan laju pertumbuhan yang terus menerus, pertumbuhan pada fase ini mencapai maksimal. Menurut pembimbing lapangan PKPM, untuk mendapatkan tingkat kepadatan alga yang tinggi pada kultur skala outdor maka proses penebaran bibit sebaiknya dilakukan pada pagi hari sebelum matahari terbit. Hal ini bertujuan agar alga yang dikultur bisa langsung memperoleh sinar matahari sehingga proses fotosintesis cepat terjadi.
Berdasarkan pemantauan jumlah populasi Thalassiosira sp pada skala dan wadah yang berbeda mempelihatkan bahwa pola pertambahan populasi sama.
26 40 77 0 10 20 30 40 50 60 70 80 90 1 2 3 K epa da ta n T hal as si os ir a sp pe rha ri (...x1 0 3) se l/ m l
Pertambahan Populasi Thalassisira sp pada
Wadah Beton 50 Ton
Kepadata alga perhari (sel/ml)
25 Namun puncak pertambahan populasi setiap wadah dan skala yang berbeda. Hal ini disebabkan karena kepadatan awal Thalassiosira sp berbeda dan beberapa faktor lingkungan juga berbeda seperti suhu ruangan dan salinitas air media. Indikasi meningkatnya jumlah populasi Thalassiosira sp yang masih berada pada fase eksonensial (Gambar 3, 4, 5 dan 6) menunjukkan bahwa ketersediaan pupuk untuk menunjang pertumbuhannya masih cukup. Selain itu, ditunjang dengan kualitas air yang masih optimum (Tabel 6).
4.3 Kualitas Air untuk Kultur Thalassiosira sp
Berdasarkan hasil pemantauan kualitas air pada kultur Thalassiosira sp skala indor dan skala outdor dapat dilihat pada Tabel 6. Tabel 6 Hasil pengukuran kualitas air pada kultur Thalassiosira sp
No Parameter Nilai pengukuran
*
Nilai optimum**
Indor Outdor Indor Outdor
1 Suhu 23 – 24,5oC 29 – 32 18 – 25 27 – 35
2 Salinitas 28 ppt 30 – 32 26 – 28 25 – 42
3 pH 7,2 – 8,1 9 – 9,8 7 – 9 7 – 10,2
Sumber : *Data primer PKPM PT.Centralpertiwi Bahari Takalar 2015
**
Pembimbing lapangan PKPM
Dari Tabel 8 di atas menunjukkan bahwa hasil pengukuran kualitas air pada kultur Thalassiosira sp antara kultur skala indor dan outdor terdapat perbedaan kisaran kualitas air. Adanya perbedaan ini diduga disebabkan oleh tempat yang berbeda dimana pada kultur skala indor dilakukan di dalam ruang yang tertutup sedangkan untuk skala outdor dilakukan di tempat yang terbuka. Kondisi media kultur, cahaya, pH, aerasi, dan suhu sangat mendukung terjadinya pembelahan sel Thalassiosira sp. Untuk kultur Thalassiosira sp skala indor di PT. CPB menggunakan media air dengan salinitas 28 ppt sedangkan untuk kultur
26 skala outdor menggunakan salinitas 30 – 32 ppt. Pada umumnya alga mampu tumbuh optimal pada salinitas yang lebih rendah dari lingkungan aslinya (Kurniawan, 2001). Kultur Thalassiosira sp skala laboratorium dilengkapi dengan pencahayaan menggunakan lampu neon 40 watt sedangkan untuk kultur skala indor menggunakan cahaya matahari yang selain berfungsi sebagai sumber cahaya untuk fotosintetis juga berfungsi untuk mempertahankan suhu dan oksigen (Fachruddin 2015). Hal ini sesuai dengan pendapat Kurniawan (2009) bahwa fungsi cahaya untuk kultur algae yaitu untuk proses fotosintesis. Kebutuhan cahaya tergantung pada kedalaman dan kepadatan kultur. Adapun kekuatan lampu yang digunakan untuk kultur Thalasiosira sp skala indor yaitu 220 Volt. Semakin tinggi kepadatan dan kedalaman kultur, intensitas cahaya yang dibutuhkan akan semakin tinggi. Kisaran pH saat kultur Thalassiosira sp skala indor yaitu 7,2 – 8,1 dan untuk skala outdor yaitu 9 – 9,8. Untuk mempertahankan pH maka pada wadah kultur diberi aerasi. Adapun fungsi dari pemberian aerasi yaitu mengaduk alga agar tidak terjadi pengendapan sehingga dipastikan seluruh alga mendapatkan cahaya dan nutrien, mengurangi terjadinya stratifikasi suhu, serta menambah pertukaran gas antara media dan udara. Suhu
ruangan yang digunakan saat kultur alga skala indor yaitu 23oC – 24,4oC
sedangkan suhu yang digunakan untuk kultur skala outdor yaitu 29oC – 32oC.
Suhu yang rendah pada kultur skala indor bertujuan untuk menghasilkan bibit alga yang memiliki umur yang panjang dibandingkan dengan suhu yang tinggi.
Kisaran suhu dibawah 16oC akan menghambat pertumbuhan alga sedangkan
kisaran suhu diatas 35oC mampu mematikan beberapa spesies algae. Untuk