i
TEKNIK PEMELIHARAAN LARVA UDANG VANAME
(Litopenaeus vannamei Boone)
DI PT. CENTRALPERTIWI BAHARI, KAB. TAKALAR
SULAWESI SELATAN
TUGAS AKHIR
Oleh:
SRIMULIANA INDAH WATI
1622010544
JURUSAN BUDIDAYA PERIKANAN
POLITEKNIK PERTANIAN NEGERI PANGKAJENE KEPULAUAN
PANGKEP
iv
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam tugas akhir ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Pangkep, 16 Juli 2019 Yang menyatakan,
v
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan tugas akhir ini tepat pada waktunya sebagai salah satu syarat menyelesaikan studi di Politeknik Pertanian Negeri Pangkep.
Upaya maksimal yang dilakukan oleh penulis tidak akan terwujud dengan baik tanpa diiringi dengan doa yang dikabulkan oleh Allah SWT. Untuk itu patutlah kiranya jika penulis memanjatkan puji dan syukur serta terima kasih yang tidak terhingga kepada-Nya dan kepada orang-orang yang turut mendukung penyelesaian laporan tugas akhir ini antara lain :
1. Kepada Ibu Sri Wahidah, S.Pi., M.Si selaku pembimbing pertama dan Ibu Ir. Fauziah Nurdin, M.P selaku pembimbing anggota yang telah memberikan motivasi, arahan dan bimbingan mulai dari penyusunan proposal tugas akhir hingga penyelesaian laporan tugas akhir ini.
2. Ucapan terima kasih kepada Bapak Maulana manajer di PT Centralpertiwi Bahari, Kabupaten Takalar.
3. Kepada Ketua Jurusan Budidaya Perikanan Bapak Dr. Ardiansyah, S.Pi., M.Biotech. St
4. Kepada Bapak Dr. Ir. Darmawan, M.P selaku Direktur Politeknik Pertanian Negeri Pangkep.
Akhirnya dengan tulus penulis menghaturkan terima kasih kepada Ayahanda tercinta Abd. Rahim B dan Ibunda tercinta Madyana yang senantiasa memberikan dukungan baik berupa moril maupun materil serta beliau senantiasa mengiringi doa hingga penyelesaian studi ini. Terima kasih kepada semua saudara
vi
saya, karena keberadaanmu, pengorbanan, keikhlasan dan doamu menjadi motivasi ampuh bagi saya dalam meraih cita-cita ini, terima kasih kepada para sahabat yang senantiasa memberikan semangat dalam penyusunan tugas akhir ini. Kepada rekan-rekan seangkatan di Jurusan Budidaya Perikanan, semua staf PT Centralpertiwi Bahari Kabupaten Takalar, staf laboratorium Politeknik Pertanian Negeri Pangkep yang tidak sempat disebut namanya, atas partisipasi dan bantuannya dalam penyelesaian studi ini penulis mengucapkan banyak terima kasih.
Semoga tugas akhir ini bermanfaat bagi penulis dan berguna kepada yang memerlukannya amin.
Pangkep, 16 Juli 2019
vii
DAFTAR ISI
Halaman HALAMAN JUDUL
HALAMAN PENGESAHAN... ii
HALAMAN PERSETUJUAN ... iii
PERNYATAAN ... iv
KATA PENGANTAR ... v
DAFTAR ISI ... vii
DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi ABSTRAK ... xii BAB I. PENDAHULUAN 1.1. Latar Belakang ... 1.2. Tujuan dan Manfaat ...
1 2 BAB II. TINJAUAN PUSTAKA
2.1. Deskripsi Udang Vaname (Litopenaeus vannamei) ... 2.2. Taksonomi Udang Vaname ... 2.3. Morfologi Udang Vaname ... 2.4. Persyaratan Lokasi Pemeliharaan Larva ... 2.5. Habitat dan Siklus Hidup Udang Vaname ... 2.6. Tingkah Laku Udang Vannamei ... 2.7. Makan dan Kebiasaan Makan Udang Vaname ... 2.8. Perkembangan Larva Udang Vaname ... 2.9. Pertumbuhan ... 2.10. Pemeliharaan Larva Udang Vannamei ...
4 5 5 8 9 10 11 12 16 16
viii BAB III. METODOLOGI
3.1. Waktu dan Tempat ... 23 3.2. Bahan dan Alat ... 23
3.2.1 Alat ... 3.2.2 Bahan ...
23 24 3.3. Metode Pengumpulan Data ... 25 3.4. Metode Pelaksanaan ... 25
3.4.1. Penyediaan Air Pemeliharaan ... 3.4.2. Persiapan Pemeliharaan Larva ... 3.4.3. Penebaran Nauplii ... 3.4.4. Penyediaan dan Pemberian Pakan alami ... 3.4.5. Pemberian Pakan Buatan ... 3.4.6. Pengelolaan Kualitas Air ...
26 27 28 28 30 31 3.5. Parameter yang Diamati ... 32 3.6. Analisis Data ... 33 BAB IV. HASIL DAN PEMBAHASAN
1.1. Pertumbuhan Panjang Post Larva Udang Vaname ... 1.2. Tingkat Kelangsungan Hidup Larva atau Survival Rate 1.3. Manajemen Pemberian Pakan ... 1.4. Parameter Kualitas Air ...
34 36 38 42 BAB V. PENUTUP 5.1. Kesimpulan ... 5.2. Saran ... 45 45 DAFTAR PUSTAKA LAMPIRAN RIWAYAT HIDUP
ix
DAFTAR TABEL
Halaman
Tabel 2.1. Kualitas Air pada Pemeliharaan Larva ... 18
Tabel 3.1. Alat yang Digunakan pada Pemeliharaan Larva ... 23
Tabel 3.2. Bahan yang Digunakan pada Pemeliharaan Larva ... 24
Tabel 4.1. Hasil Pengukuran Pertumbuhan Post Larva ... 34
Tabel 4.2. Manajemen Pakan pada Pemeliharaan Stadia Zoea1-PL12 ... 39
x
DAFTAR GAMBAR
Halaman
Gambar 2.1. Morfologi Udang Vaname ... 7
Gambar 2.2. Siklus Hidup Udang Vaname ... 10
Gambar 2.3. Fase Perkembangan Stadia Nauplius ... 13
Gambar 2.4. Fase Perkembangan Zoea ... 14
Gambar 2.5. Fase Perkembangan Mysis ... 15
Gambar 3.1. Penebaran Kaporit dan Thiosulfat ... 26
Gambar 3.2. Pencucian dan Pengeringan Bak Larva ... 27
Gambar 3.3. Transfer Algae ke Bak Pemeliharaan ... 29
Gambar 3.4. Penimbangan Pakan Buatan ... 30
xi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Peta Lokasi PT. Centralpertiwi Bahari, Takalar ... 51
Lampiran 2. Kemasan Pakan Buatan ... 52
Lampiran 3. Gambar Pakan Buatan ... 52
Lampiran 4. Kegiatan Menimbang Pakan Buatan ... 52
Lampiran 5. Kegiatan di Unit Pemeliharaan Larva ... 53
Lampiran 6. Kandungan Nutrisi Pakan ... 54
Lampiran 7. Pengamatan Parameter Kualitas Air di PT.Centralpertiwi Bahari Takalar ... 55 Lampiran 8. Kegiatan Water Treatment ... 58
Lampiran 9. Kegiatan di Unit Algae dan Artemia ... 60
Lampiran 10. Kegiatan di Unit Quality Control ... 61
Lampiran 11. Perhitungan ... 62
Lampiran 12. Pengamatan Harian Kultur Algae ... 66
Lampiran 13. Perkembangan Larva Udang Vaname ... 67
Lampiran 14. Jumlah Populasi dan Tingkat Kelangsungan Hidup Larva.. 68
xii
ABSTRAK
SRIMULIANA INDAH WATI. 1622010544. Teknik Pemeliharaan Larva Udang Vaname (Litopenaeus Vannamei Bonne) Di PT. Centralpertiwi Bahari Kabupaten Takalar Sulawesi Selatan. Dibimbing oleh ibu Sri Wahidah dan ibu Fauziah Nurdin.
Udang vaname merupakan salah satu komoditas ekspor unggulan dibidang perikanan, masuk ke Indonesia pada tahun 2001. Beberapa keunggulan udang vaname, diantaranya dapat tumbuh dengan cepat, tingkat komsumsi pakan rendah, mampu beradaptasi terhadap kisaran salinitas yang luas serta dapat dipelihara dengan padat tebar yang tinggi. Pemeliharaan larva merupakan salah satu kegiatan penting dalam pembenihan udang, dimulai dari stadia naupli, zoea, mysis hingga post larva.
Tujuan penulisan tugas akhir adalah untuk memperkuat penguasaan teknik pemeliharaan larva udang vaname (Litopenaeus vannamei Boone). Sehingga sangat bermanfaat untuk memperluas wawasan, kompetensi keahlian mahasiswa dalam berkarya dimasyarakat kelak. Penulisan tugas akhir ini disusun berdasarkan hasil kegiatan PKPM yang dilakukan pada tanggal 16 Januari sampai 16 April 2019 di PT. Centralpertiwi Bahari, Kabupaten Takalar. Metode pelaksanaan yaitu dengan berpartisipasi aktif pada semua kegiatan yang berkaitan dengan teknik pemeliharaan larva udang vaname.
Hasil yang diperoleh menunjukkan bahwa nilai SR pada bak A1= 88,69%, bak A2= 70,85% dan bak A3= 57,98%. Perbedaan nilai SR tersebut disebabkan oleh beberapa faktor yaitu, biasanya terdapat aerasi yang terlepas, waktu dan cara pemberian pakan yang kurang tepat, waktu penyiponan dan pergantian air yang terlalu lama serta tingkat mortalitas yang tinggi. Teknik pemeliharaan larva dimulai dari persiapan, penebaran naupli, Penyediaan dan pemberian pakan alami dan buatan, pengelolaan kualitas air, manajemen kesehatan, dan Panen.
BAB I. PENDAHULUAN
1.1. Latar Belakang
Udang vaname (Litopenaeus vannamei Boone) merupakan salah satu komoditas ekspor unggulan dibidang perikanan. Menurut data FAO (2012), Indonesia merupakan negara produsen udang yang menempati urutan keempat dunia setelah negara Cina, Thailand dan Vietnam. Kementerian Kelautan dan Perikanan (KKP), pada tahun 2009 menetapkan target produksi udang vaname meningkat sampai 209% menjadi sebesar 511 ribu ton untuk tahun 2014 (Ditjen Perikanan Budidaya 2010).
Udang vaname masuk ke Indonesia pada tahun 2001 dan pada bulan Mei 2002 pemerintah Indonesia memberikan izin kepada perusahaan swasta untuk mengimpor induk udang vaname sebanyak 2.000 ekor. Induk dan benur tersebut kemudian dikembangkan oleh hatchery pemula. Dengan adanya pembenihan udang vaname baik dalam bentuk skala kecil atau hatchery akan membantu pemerintah dalam penyediaan benur bermutu bagi pembudidaya udang vaname sehingga target pemerintah meningkatkan produksi udang dalam negeri dapat tercapai (Lestari, 2009).
Prospek pengembangan budidaya udang vaname di Sulawesi Selatan sangat baik karena luas wilayah pertambakannya mencapai 90.540 ha yang pernah digunakan untuk kegiatan budidaya udang windu dengan mengaplikasikan mulai dari teknik budidaya tradisional hingga intensif. Budidaya udang vaname belum meluas di masyarakat, diharapkan dalam pengembangannya dapat meningkatkan kembali produksi udang di Sulawesi Selatan. (Anonim, 2001; 2005).
2
Beberapa keunggulan yang dimiliki udang vaname, diantaranya dapat tumbuh dengan cepat, tingkat komsumsi pakan atau food comsumtion rate (FCR) rendah, mampu beradaptasi terhadap kisaran salinitas yang luas serta dapat dipelihara dengan padat tebar yang tinggi (Panjaitan, 2012). Kegiatan pembenihan udang vaname tidak terlepas dari ketersediaan benur yang berkualitas (Hendrajat dkk., 2007).
Oleh karenanya diperlukan ketersediaan benur secara terus menerus dan berkualitas, sehingga ketersediaan benur tersebut diharapkan mampu meningkatkan produktifitas udang vaname (Haliman dan Adijaya, 2005). Ketersediaan benih yang berkualitas (genetik dan morfologi) merupakan salah satu faktor penentu keberhasilan budidaya udang. Karakter morfologi diantaranya dicirikan dengan perkembangan larva yang baik, serta karakter morfologi yang tinggi (Wahidah dkk.,2015).
Pemeliharaan larva merupakan salah satu kegiatan penting dalam pembenihan udang. Proses pemeliharaan larva dimulai dari stadia naupli, zoea, mysis hingga post larva. Berdasarkan uraian tersebut, maka diperlukan informasi tentang teknik pemeliharaan larva udang vaname, sebagaimana yang dilakukan pada PT. Centralpertiwi Bahari, Kabupaten Takalar.
1.2. Tujuan dan Manfaat
Tujuan penulisan Tugas Akhir adalah untuk memperkuat penguasaan teknik pemeliharaan larva udang vaname (Litopenaeus vannamei Boone) di PT. Centralpertiwi Bahari, Kabupaten Takalar.
Manfaat penulisan Tugas Akhir ini adalah untuk memperluas wawasan, kompetensi keahlian mahasiswa dalam berkarya di masyarakat kelak khususnya
3
mengenai teknik pemeliharaan larva udang vaname (Litopenaeus vannamei Boone) di PT. Centralpertiwi Bahari, Kabupaten Takalar dalam bidang pembenihan.
BAB II. TINJAUAN PUSTAKA
2.1. Deskripsi Udang Vaname (Litopenaeus vannamei)
Udang vaname merupakan salah satu jenis udang yang memiliki pertumbuhan cepat dan nafsu makan tinggi, namun ukuran yang dicapai pada saat dewasa lebih kecil dibandingkan udang windu (Penaeus monodon). Habitat aslinya adalah di perairan Amerika, tetapi spesies ini hidup dan tumbuh dengan baik di Indonesia. Dipilihnya udang vaname ini disebabkan oleh beberapa faktor yaitu (1) sangat diminati dipasar Amerika, (2) lebih tahan terhadap penyakit dibanding udang putih lainnya, (3) pertumbuhan lebih cepat dalam budidaya, (4) mempunyai toleransi yang lebar terhadap kondisi lingkungan (Ditjenkan, 2006).
Udang vaname (Litopenaeus vannamei) disebut juga dengan udang putih dan merupakan spesies introduksi yang dibudidayakan di Indonesia. Udang vaname berasal dari perairan Amerika Tengah. Udang vaname masuk ke Indonesia pada tahun 2001 dan merupakan salah satu pilihan jenis udang yang dapat dibudidayakan di Indonesia. Dengan adanya pembenihan udang vaname, baik dalam bentuk skala kecil atau hatchery akan membantu pemerintah dalam penyediaan benur bermutu bagi pembudidaya udang vaname. Sehingga target pemerintah meningkatkan produksi udang dalam negeri dapat tercapai (Lestari, 2009).
Udang vaname termasuk genus paneus, namun yang membedakan dengan genus paneus lain adalah mempunyai sub genus Litopenaeus yang dicirikan oleh bentuk thelicum terbuka tetapi tidak ada tempat untuk penyimpanan sperma (Ditjenkan, 2006). Ada dua spesies yang termasuk sub genus Litopenaeus yakni Litopenaeus vannamei dan Litopenaeus stylirostris (Wyban dan Sweeney, 1991).
5 2.2. Taksonomi Udang Vaname
Holtius (1980) dalam Boone (1931), klasifikasi udang vaname yaitu : Kingdom : Animalia Filum : Arthropoda Subfilum : Crustacea Kelas : Malacostraca Subkelas : Eumalacostraca Superordo : Eucarida Ordo : Decapoda Subordo : Dendrobrachiata Famili : Penaeidae Genus : Litopenaeus
Spesies : Litopenaeus vannamei (Boone, 1931) 2.3. Morfologi Udang Vaname
Udang vaname masuk kedalam bangsa decapoda karena sama halnya seperti lobster, kepiting dan berbagai jenis udang lain, yaitu mempunyai karapaks yang berkembang sehingga menutup kepala dan dada menjadi satu atau disebut dengan chepalothorax, sedangkan tergolong anggota suku penaidae dikarenakan mempunyai karakter menetaskan telurnya di luar tubuh. Selanjutnya dinyatakan bahwa genus penaeus bercirikan terdapat gigi pada bagian atas dan bawah rostrum, rostrum memanjang dan memiliki 2-4 gigi pada tepi rostrum bagian ventral dan 8-9 gigi pada rostrum bagian dorsal (FAO 2011 dalam Wahyudewantoro 2011).
6 Tubuh udang vaname dibagi menjadi dua bagian besar, yakni bagian chepalothorax yang terdiri atas kepala dan badan yang dilindungi karapaks serta bagian abdomen yang terdiri atas perut dan ekor yang terdiri dari segmen atau ruas-ruas (Suharyadi 2011). Menurut Martosudarmo dkk, (1983), tubuh udang vaname terdiri dari tiga bagian yaitu :
2.3.1. Kepala
Kepala terdiri dari enam ruas, pada ruas kepala pertama terdapat mata majemuk yang bertangkai, beberapa ahli berpendapat bahwa mata bertangkai ini bukan suatu anggota badan seperti pada ruas-ruas yang lain, sehingga ruas kepala dianggap berjumlah lima buah. Pada ruas kedua terdapat antena I atau antennules yang mempunyai dua buah flagella pendek yang berfungsi sebagai alat peraba dan pencium. Ruas ketiga yaitu antena II atau antennae mempunyai dua buah cabang yaitu cabang pertama (exopodite) yang berbentuk pipih dan tidak beruas dinamakan prosertama. Sedangkan yang lain (endopodite) berupa cambuk yang panjang yang berfungsi sebagai alat perasa dan peraba. Tiga ruas terakhir dari bagian kepala mempunyai anggota badan yang berfungsi sebagai pembantu yaitu sepasang mandibula yang bertugas menghancurkan makanan yang keras dan dua pasang maxilla yang berfungsi sebagai pembawa makanan ke mandibula. Ketiga pasang anggota badan ini letaknya berdekatan satu dengan lainnya sehingga terjadi kerjasama yang harmonis antara ketiganya.
2.3.2. Dada
Bagian dada terdiri dari delapan ruas yang masing-masing ruas mempunyai sepasang anggota badan yang disebut thoracopoda. Thoracopoda pertama sampai dengan ketiga dinamakan maxilliped yang berfungsi sebagai
7 pelengkap bagian mulut dalam memegang makanan. Thoracopoda lainnya (kelima-kedelapan) berfungsi sebagai kaki jalan yang disebut pereipoda. Kaki jalan pertama sampai dengan ketiga memiliki capit kecil yang merupakan ciri khas dari jenis udang vaname.
2.3.3. Perut
Bagian perut atau abdomen terdiri dari enam ruas. Ruas yang pertama sampai dengan ruas kelima masing-masing memiliki sepasang anggota badan yang dinamakan pleopoda. Pleopoda berfungsi sebagai alat untuk berenang oleh karena itu bentuknya pendek dan kedua ujungnya pipih dan berbulu (setae) pada ruas yang keenam kaki renang berubah bentuk menjadi pipih dan melebar yang dinamakan uropoda, yang bersama-sama dengan telson berfungsi sebagai kemudi. Warna dari udang vaname ini putih transparan dengan warna biru yang terdapat dekat dengan bagian telson dan uropoda (Lightner et al, 1996).
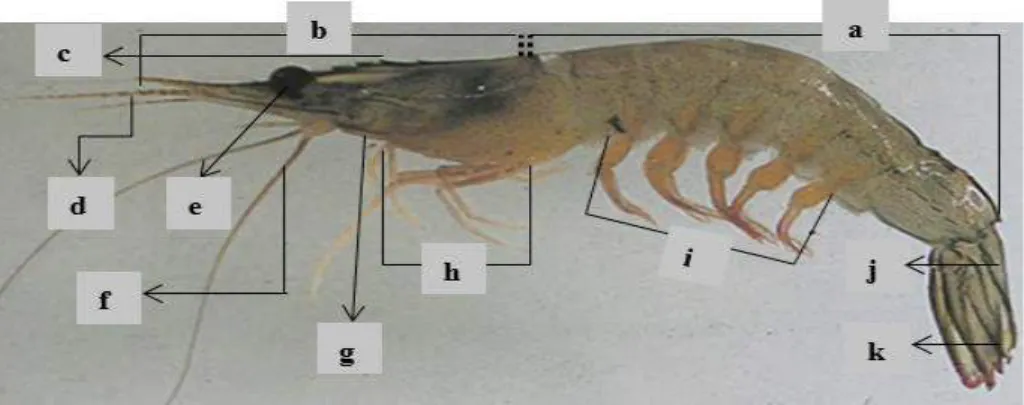
Alat kelamin udang jantan disebut petasma, yang terletak pada pangkal kaki renang pertama. Sedangkan alat kelamin udang betina disebut juga dengan thelicum terbuka yang terletak diantara pangkal kaki jalan keempat dan kelima (Tricahyo 1995, Wyban dan Sweeney, 1991). Adapun morfologi udang vaname dapat dilihat pada Gambar 2.1
8 Keterangan:
a. Perut (abdomen)
b. Chepalothorax (bagian kepala) c. Rostrum (cucuk kepala)
d. Antennula (sungut kecil) e. Mata
f. Antenna (sungut besar)
g. Maxilliped (alat bantu rahang) h. Pereipoda (kaki jalan)
i. Pleopoda (kaki renang) j. Telson (ujung ekor) k. Uropoda (ekor kipas)
2.4. Persyaratan Lokasi Pemeliharaan Larva
Harjono (2012), syarat lokasi untuk pembenihan dan pemeliharaan larva udang penaeid adalah sebagai berikut :
a. Lokasi dekat dengan laut.
b. Lokasi dekat dengan tambak pembesaran. c. Lokasi datar dengan elevasi kurang dari 3-4 m.
d. Kualitas air baik dengan fluktuasi yang tidak terlalu tinggi serta lokasi jauh dari sumber limbah.
e. Tersedia sumber air tawar untuk sterilisasi bak dan penurunan salinitas. f. Lokasi dekat dengan pasar.
g. Kemudahan mendapatkan sarana produksi seperti pakan dan obat-obatan, serta kemudahan dalam mendapatkan tenaga kerja.
9 2.5. Habitat dan Siklus Hidup Udang Vaname
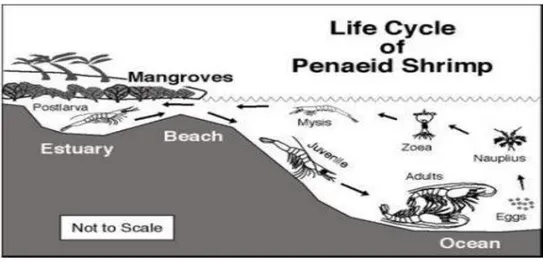
Habitat udang berbeda-beda tergantung dari jenis dan persyaratan hidup dari tingkatan-tingkatan dalam daur hidupnya. Pada umumnya udang bersifat bentik dan hidup pada permukaan dasar laut. Adapun habitat yang disukai oleh udang adalah dasar laut yang lumer (soft) yang biasanya campuran lumpur dan pasir. Lebih lanjut dijelaskan, bahwa induk udang vaname ditemukan di perairan lepas pantai dengan kedalaman berkisar antara 70-72 m (235 kaki) menyukai daerah yang dasar perairannya berlumpur. Sifat hidup dari udang vaname adalah katadromous atau dua lingkungan, dimana udang dewasa akan memijah di laut terbuka. Setelah menetas, larva dan yuwana udang vaname akan bermigrasi ke daerah pesisir pantai yang biasa disebut daerah estuaria tempat nurseri ground, dan setelah dewasa akan bermigrasi kembali ke laut untuk melakukan kegiatan pemijahan seperti pematangan gonad, maturasi dan perkawinan (Wyban dan Sweeney, 1991). Hal ini sama seperti pola hidup udang vaname lainnya dimana mangrove merupakan tempat berlindung dan mencari makanan setelah dewasa akan kembali ke laut (Elovaara, 2001).
Briggs et al (2004), udang vaname hidup di habitat laut tropis dimana suhu air biasanya lebih dari 20°C sepanjang tahun. Udang vaname dewasa dan bertelur di laut terbuka, sedangkan pada stadia post larva udang vaname akan bermigrasi ke pantai sampai pada stadia juvenil. Udang vaname merupakan bagian dari organisme laut. Beberapa udang laut menghabiskan siklus hidupnya di muara air payau. Adapun siklus hidup udang vaname dapat dilihat pada Gambar 2.2
10
Gambar 2.2 Siklus Hidup Udang Vaname (Stewart, 2005) 2.6. Tingkah Laku Udang Vaname
Dalam usaha pembenihan udang, perlu adanya pengetahuan tentang tingkah laku udang. Menurut Haliman dan Adijaya (2005), beberapa tingkah laku udang yang perlu kita ketahui antara lain :
a. Sifat nokturnal yaitu sifat binatang yang aktif mencari makan pada waktu malam hari dan pada waktu siang hari mereka lebih suka beristirahat, baik membenamkan diri pada lumpur maupun menempel pada suatu benda yang terbenam.
b. Sifat kanibalisme yaitu sifat suka memangsa sejenisnya. Sifat ini sering timbul pada udang yang kondisinya sehat, yang tidak sedang ganti kulit. Sasaranya adalah udang-udang yang kebetulan ganti kulit.
c. Ganti kulit (moulting) yaitu suatu proses pergantian kutikula lama digantikan dengan kutikula yang baru. Kutikula adalah kerangka luar udang yang keras (tidak elastis). Oleh karena itu untuk tumbuh menjadi besar mereka perlu melepas kulit lama dan menggantikan dengan kulit baru.
11 d. Daya tahan udang sangat besar pada waktu berupa benih sangat tahan pada
perubahan kadar garam (salinitas). Sifat demikian dinamakan sifat euryhaline. Sifat lain yang menguntungkan adalah ketahanan terhadap perubahan suhu dan sifat ini dikenal sebagai eurytherma.
e. Menyukai hidup di dasar atau bentik.
f. Tipe pemakan lambat tetapi terus menerus (continous feeder).
2.7. Makan dan Kebiasaan Makan Udang Vaname
Makanan udang vaname terdiri dari crustacea dan molusca yang terdapat 85% di dalam pencernaan makanan dan 15% terdiri dari invertebrata benthic kecil, mikroorganisme penyusun detritus, udang vaname demikian juga di alam merupakan omnivora dan scavenger (pemakan bangkai). Makanannya biasanya berupa crustacea kecil, amphipoda dan polychaetes atau cacing laut (Wyban dan Sweeney, 1991). Lebih lanjut dikatakan dalam pemeliharaan induk udang vaname, pemberian pakan udang vaname 16% dari berat total adalah cumi, 9% cacing dengan pemberian pakan empat kali per hari.
Udang mempunyai pergerakan yang hanya terbatas dalam mencari makanan dan mempunyai sifat dapat menyesuaikan diri terhadap makanan yang tersedia lingkungannya. Di alam larva udang biasanya memakan zooplankton yang terdiri dari trochophore, balanos, veliger, copepoda, dan larva polychaeta (Tricahyo 1995). Udang vaname termasuk golongan udang penaeid. Maka sifatnya antara lain bersifat nokturnal artinya aktif mencari makan pada malam hari atau apabila intensitas cahaya berkurang. Sedangkan pada siang hari yang cerah lebih banyak pasif, diam pada rumpon yang terdapat dalam air tambak atau membenamkan diri dalam lumpur.
12 Djarijah (1995), pakan adalah makanan yang khusus dibuat atau diproduksi agar mudah dan tersedia untuk dimakan dan dicerna dalam proses pencernaan ikan atau udang sehingga menghasilkan energi yang dapat dipergunakan untuk aktifitas hidup. Sedangkan kelebihan energi yang dihasilkan ini akan disimpan dalam bentuk daging, yaitu untuk pertumbuhan. Pakan dibedakan atas dua yaitu pakan alami dan pakan buatan. Pakan alami merupakan makanan yang tumbuh di alam tanpa campur tangan manusia secara langsung, sedangkan pakan buatan merupakan makanan ikan yang dibuat dari campuran bahan-bahan alami dan atau bahan olahan yang selanjutnya dilakukan proses pengolahan serta dibuat dalam bentuk tertentu sehingga tercipta daya tarik (merangsang) udang untuk memakanya dengan mudah.
Jenis pakan yang diberikan pada larva udang vaname selama proses pemeliharaan ada dua jenis yaitu pakan alami serta pakan buatan. Pemberian pakan alami berupa Thalassiosira sp dan Artemia salina. Selain pakan alami, juga diberikan pakan buatan, pakan buatan yang biasa diberikan untuk larva udang vaname adalah pakan dalam bentuk bubuk dan flake (lempeng tipis) dengan ukuran partikel sesuai dengan stadianya, kandungan protein 40% dan lemak 10% SNI 7311 (2009). Manajemen pakan harus dilakukan sebaik mungkin dengan memperhatikan ukuran pakan, dosis pakan, cara pemberian, dan waktu pemberian pakan.
2.8. Perkembangan Larva Udang Vaname
Lim, et al. (1989) dalam Lestari (2009), perkembangan larva udang vaname terdiri dari beberapa stadia yaitu :
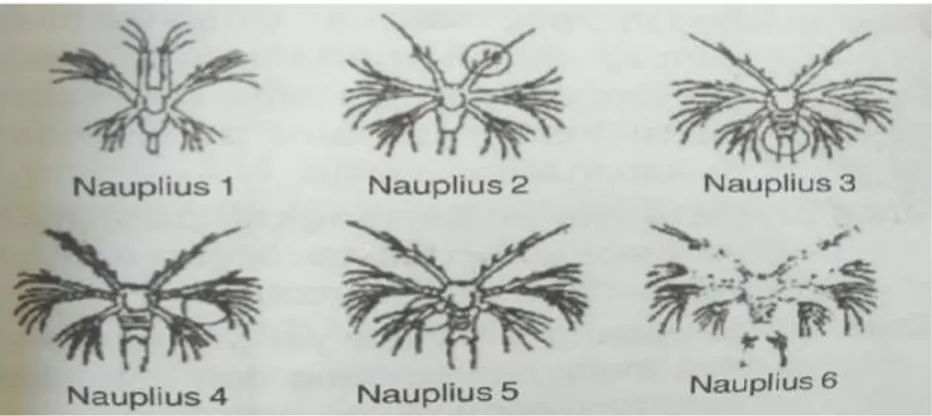
13 2.8.1. Nauplius
Nauplius bersifat planktonik dan fototaksis positif, pada stadia ini masih memiliki kuning telur sehingga belum memerlukan makanan. Perkembangan stadia nauplius terdiri dari enam sub stadium. Nauplius memiliki tiga pasang organ tubuh yaitu antena pertama, antena kedua dan mandibula. Antena pertama uniramous, sedangkan dua alat lainnya biramous.
Pada stadia ini, nauplius berukuran 0,32-0,58 mm. Sistem pencernaannya belum sempurna dan masih memiliki cadangan makanan yaitu kuning telur sehingga pada stadia ini benih udang vaname belum membutuhkan makanan dari luar. Perkembangan nauplius dapat dilihat pada Gambar 2.3.
Gambar 2.3. Fase Perkembangan Stadia Nauplius (Wyban and Swiney, 1991) Pada fase nauplius ini larva mengalami enam kali pergantian bentuk dengan tanda-tanda sebagai berikut :
Nauplius I: Bentuk badan bulat telur dan mempunyai anggota badan tiga pasang.
Nauplius II: Pada ujung antena pertama terdapat setae (rambut), yang satu panjang dan dua lainnya pendek.
14 (spine), tunas maxilla dan maxilliped mulai tampak.
Nauplius IV: Pada masing-masing furcal terdapat empat buah duri, Exopoda pada antena kedua beruas-ruas.
Nauplius V: Organ pada bagian depan sudah tampak jelas disertai dengan tumbuhnya benjolan pada pangkal maxilla.
Nauplius VI: Perkembangan bulu-bulu semakin sempurna dari duri pada furcal tumbuh makin panjang.
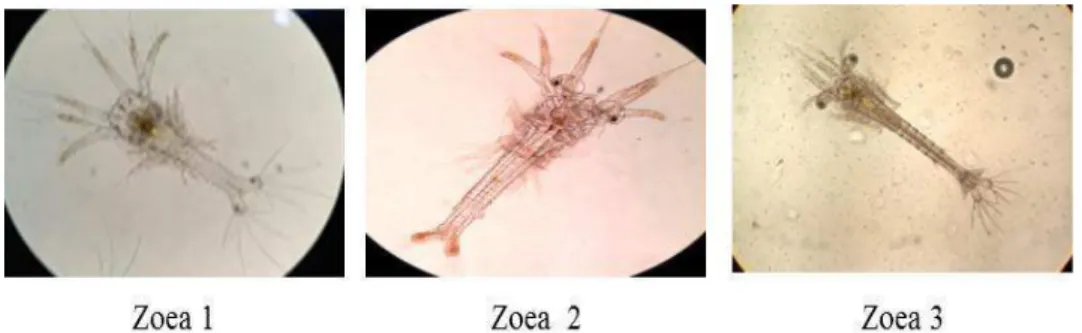
2.8.2. Zoea
Perubahan bentuk dari nauplius menjadi zoea memerlukan waktu kira-kira 40 jam setelah penetasan. Pada stadia ini larva dengan cepat bertambah besar. Tambahan makanan yang diberikan sangat berperan dan mereka aktif memakan fitoplankton. Stadia akhir zoea juga memakan zooplankton. Zoea sangat sensitif terhadap cahaya yang kuat dan ada juga yang lemah diantara tingkat stadia zoea tersebut. Zoea terdiri dari tiga substadia secara kasar tubuhnya dibagi kedalam tiga bagian, yaitu karapaks, thorax dan abdomen. Tiga substadia tersebut dapat dibedakan berdasarkan segmentasi abdomen dan perkembangan dari lateral dan dorsal pada setiap segmen. Fase perkembangan zoea dapat dilihat pada gambar 2.4.
15 Fase zoea terdiri dari tingkatan-tingkatan yang mempunyai tanda-tanda yang berbeda sesuai dengan perkembangan dari tingkatannya, seperti diuraikan berikut ini :
Zoea I: Bentuk badan pipih, karapaks dan badan mulai nampak, maxilla pertama dan kedua serta maxilliped pertama dan kedua mulai berfungsi. Proses mulai sempurna dan alat pencernaan makanan nampak jelas.
Zoea II: Mata bertangkai, pada karapaks sudah terlihat rostrum dan duri supraorbital yang bercabang.
Zoea III: Furcal dua buah mulai jelas masing-masing dengan tiga duri (spine), tunas maxilla dan maxilliped mulai tampak.
2.8.3. Mysis
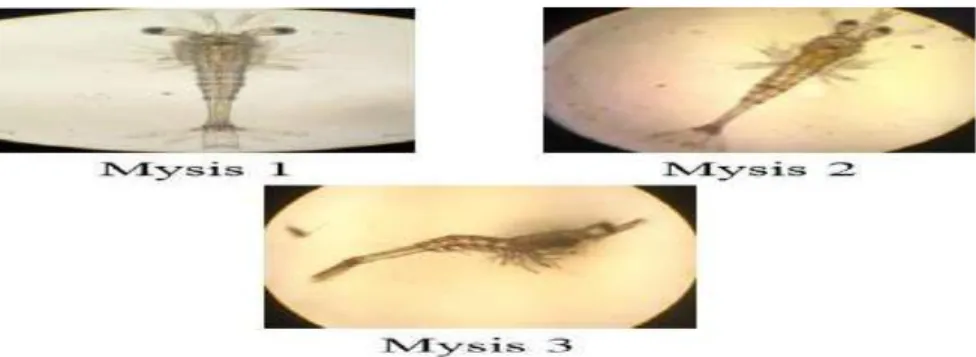
Larva mencapai stadia mysis pada hari kelima setelah penetasan. Larva pada stadia ini kelihatan lebih dewasa dari dua stadia sebelumnya. Stadia mysis lebih kuat dari stadia zoea dan dapat bertahan dalam penanganan. Stadia mysis memakan fitoplankton dan zooplankton, akan tetapi lebih menyukai zooplankton menjelang stadia mysis akhir. Mysis memiliki tiga sub stadia dimana satu dengan lainnya dapat dibedakan dari perkembangan bagian dada dan kaki renang. Adapun fase perkembangan mysis dapat dilihat pada Gambar 2.5
16 Fase ini mengalami tiga perubahan dengan tanda-tanda sebagai berikut :
Mysis I: Bentuk badan sudah seperti udang dewasa, tetapi kaki renang (Pleopoda) masih belum nampak.
Mysis II: Tunas kaki renang mulai nampak nyata, belum beruas-ruas.
Mysis III: Kaki renang bertambah panjang dan beruas-ruas. 2.8.4 Post Larva
Perubahan bentuk dari mysis menjadi post larva terjadi pada hari kesembilan. Stadia post larva mirip dengan udang dewasa, dimana lebih kuat dan lebih dapat bertahan dalam penanganan. Kaki renang pada stadia post larva bertambah menjadi tiga segmen yang lebih lengkung. Post larva bersifat planktonik, dimana mulai mencari jasad hidup sebagai makanan.
2.9. Pertumbuhan
Pertumbuhan adalah suatu proses pertambahan ukuran, baik volume, bobot, dan jumlah sel yang bersifat irreversible (tidak dapat kembali ke asal). Pengamatan pertumbuhan larva udang dilakukan bertujuan untuk mengontrol pertumbuhan larva. Apabila pertumbuhan larva lambat dараt dipacu dеngаn pemberian pakan уаng berkualitas.
Sikong (1982), faktor-faktor yang mempengaruhi pertumbuhan suatu organisme antara lain keturunan (genetik), umur dan lingkungan. Faktor lingkungan yang mempengaruhi terdiri dari abiotik (suhu, salinitas, pH) dan biotik (pakan, kepadatan organisme, parasit dan penyakit). Pengamatan pertumbuhan dilakukan dengan menggunakan loop dan mistar untuk mengukur panjang larva yang dipelihara.
17 2.10. Pemeliharaan Larva Udang Vaname
2.10.1. Penebaran Naupli
Subaidah dkk (2008), penebaran naupli sebaiknya dilakukan pada pagi hari atau sore hari, hal ini bertujuan untuk menghindari perubahan suhu yang terlalu tinggi. Aklimatisasi dilakukan sebelum penebaran yaitu 30 menit atau sampai suhu di dalam wadah dengan suhu di luar wadah sama. Naupli yang ditebar adalah naupli muda (N3-N4). Padat penebaran naupli adalah maksimum 100 ekor/liter. Nauplius yang ditebar berwarna cokelat oranye, gerakan berenang aktif, periode bergerak lebih lama dari periode diam, kondisi tubuh lengkap, ukuran dan bentuk tubuh normal serta bebas patogen, respon terhadap rangsangan dan bersifat fototaksis positif. Nauplius yang ditebar adalah naupli muda (N3-N4), hal ini bertujuan agar menekan gangguan proses metamorfosis sekecil mungkin dari stadia protozoea pertama, karena pada proses pemeliharaan larva udang vaname sering dikenal dengan istilah zoea syndrome atau zoea lemah (SNI, 7311:2009).
2.10.2 Manajemen Pakan
Djarijah (1995), pakan adalah makanan yang khusus dibuat atau diproduksi agar mudah dan tersedia untuk dimakan dan dicerna dalam proses pencernaan ikan atau udang sehingga menghasilkan energi yang dapat dipergunakan untuk aktifitas hidup. Sedangkan kelebihan energi yang dihasilkan ini akan disimpan dalam bentuk daging, yaitu untuk pertumbuhan. Pakan dibedakan atas dua yaitu pakan alami dan pakan buatan. Pakan alami merupakan makanan yang tumbuh di alam tanpa campur tangan manusia secara langsung, sedangkan pakan buatan merupakan makanan ikan yang dibuat dari campuran
18 bahan-bahan alami dan atau bahan olahan yang selanjutnya dilakukan proses pengolahan serta dibuat dalam bentuk tertentu sehingga tercipta daya tarik (merangsang) ikan atau udang untuk memakanya dengan mudah. Jenis pakan yang diberikan pada larva udang vaname selama proses pemeliharaan ada dua jenis yaitu pakan alami (fitoplankton dan zooplankton) serta pakan komersil (buatan). Pemberian pakan alami berupa Thalassiosira dan Artemia salina. Selain pakan alami, juga diberikan pakan buatan, adapun pakan buatan yang biasa diberikan untuk larva udang vaname adalah pakan dalam bentuk bubuk, cair dan flake (lempeng tipis) dengan ukuran partikel sesuai dengan stadianya, kandungan protein 40% dan lemak 10% (SNI 7311 (2009)).
2.10.3. Pengelolaan Kualitas Air
Air merupakan media hidup bagi larva udang dan organisme lainnya yang penting untuk diperhatikan. Kualitas air yang baik akan mendukung pertumbuhan dan perkembangan larva udang vaname secara optimal. Pengelolaan kualitas air pada masa pemeliharaan larva udang vaname dilakukan dengan beberapa cara, yaitu monitoring, pengecekan kualitas air, water exchange, dan penyiponan. Syarat kualitas air untuk larva dan waktu pengukuran menurut (SNI, 7311:2009), dapat dilihat pada Tabel 2.1.
Tabel 2.1. Kualitas Air pada Pemeliharaan Larva
No. Kriteria Satuan Ukuran Waktu pengukuran
1. Suhu oC 29-32 2 kali sehari 2. Salinitas ppt 29-34 Setiap hari 3. pH - 7,5-8,5 Setiap hari
4. Oksigen terlarut, min mg/l 5 Maksimum 3 kali sehari 5. Nirit, maks. mg/l 0,1 Setiap hari
6. Bakteri pathogen (Vibrio, sp.),
maks Cfu/ml 10
3 Maksimum 3 hari sekali Sumber: (SNI, 7311:2009).
19 Selain pengukuran parameter kualitas air, juga dilakukan pergantian dan penambahan air secara sirkulasi dengan cara melihat air secara visual, bila di permukaan air telah banyak gelembung busa yang telah menumpuk dan gelembung tersebut tidak dapat pecah kembali, ini diasumsikan air pada kondisi jenuh dan telah terjadi banyak perombakan gas di dalam air (Subaidah dan Pramudjo, 2008).
Udang vaname memiliki toleransi lebih luas terhadap perubahan lingkungan seperti salinitas dan temperatur. Udang vaname dapat hidup pada salinitas 0,1-60 ppt dan suhu 12-37oC, tumbuh dengan baik pada suhu 24-34oC dan ideal pada suhu 28-31oC (Kordi, 2008). Sedangkan menurut (Sutaman, 1992) Pengelolaan kualitas air merupakan salah satu faktor penting dalam operasional pemeliharaan larva. Kualitas air pada bak pemeliharaan larva harus dipertahankan sebaik mungkin. Beberapa variabel kunci didalam menentukan mutu air media pemeliharaan larva adalah suhu dan kekeruhan yang merupakan variabel fisik, sedangkan variabel kimia yang terpenting adalah salinitas atau kadar garam, pH, oksigen terlarut (DO), amoniak dan hasil-hasil buangan dari proses metabolisme lainnya seperti H2S.
a. Suhu
Suhu optimal pertumbuhan udang antara 29-32°C (SNI, 7311:2009). Jika suhu lebih dari angka optimum maka metabolisme dalam tubuh udang akan berlangsung cepat. Imbasnya kebutuhan oksigen terlarut meningkat. Suhu mempengaruhi aktivitas metabolisme organisme. Maka dari itu penyebaran organisme baik di lautan maupun di perairan tawar dibatasi oleh suhu perairan tersebut. Suhu sangat berpengaruh terhadap kehidupan dan pertumbuhan biota air.
20 Hal ini agar proses metabolisme dan proses moulting pada masa pemeliharaan berjalan dengan lancar (Haliman dan Adijaya, 2005). Sedangkan menurut Effendi (2003) dalam Suastika (2013) menyatakan suhu sangat mempengaruhi kondisi salinitas perairan, semakin tinggi suhu akan berdampak pada tingginya salinitas. Proses evaporasi akibat suhu yang meningkat akan meningkatkan salinitas. Proses evaporasi (penguapan) dalam siklus hidrologi air tawar dan air laut sekitar 30%.
Suhu air mempunyai peranan yang sangat penting dalam menentukan pertumbuhan dan kehidupan larva yang dipelihara baik secara langsung maupun tidak langsung. Secara umum, dalam batas-batas tertentu kecepatan pertumbuhan larva meningkat sejalan dengan kenaikan suhu air, namun kelangsungan hidupnya akan menurun pada suhu tinggi. Suhu air yang terbaik bagi pertumbuhan larva udang berkisar antara 28oC sampai 32oC (Sutaman, 1993).
b. Salinitas
Salinitas dapat didefinisikan sebagai total konsentrasi ion-ion terlarut dalam air yang dinyatakan dalam satuan permil (o/oo) atau ppt (part per thousand) atau gr/l. Kandungan salinitas terdiri dari garam-garam mineral yang bermanfaat, salah satunya adalah kalsium yang berfungsi mempercepat proses pengerasan tulang. Kisaran salinitas yang baik untuk budidaya udang vaname antara 15-30 ppt (Haliman dan Adijaya, 2008).
Selanjutnya pada kondisi tertentu, salinitas sumber air dapat menjadi sangat tinggi. Hal ini dapat menyebabkan proses osmoregulasi terganggu yang akhirnya menghambat pertumbuhan udang. Salinitas yang terlalu tinggi juga dapat menyebabkan kesulitan bagi udang berganti kulit karena kulit cenderung keras,
21 meningkatnya kebutuhan energi untuk beradaptasi terhadap perubahan lingkungan, lumutan pada karapaks dan udang mudah terserang white spot pada musim kemarau.
c. pH (Derajat Keasaman)
pH merupakan parameter kualitas air untuk mengetahui derajat keasaman. pH air untuk pemeliharaan udang yang ideal antara 7,5-8,5. Perubahan pH air dapat dipengaruhi oleh sifat tanah dasar perairan. Umumnya, pH air pada sore hari lebih tinggi daripada pagi hari akibat adanya kegiatan fotosintesis oleh pakan alami yang menyerap CO2 (Haliman dan Adijaya, 2008). Selanjutnya, untuk keperluan pemeliharaan sebaiknya pH air selalu diukur pada titik kritis yaitu pukul 04.00-05.00 atau pagi hari dan pukul 14.00-15.00 atau siang hari. Sejalan dengan bertambahnya umur pemeliharaan larva, maka penumpukan bahan organik akan bertambah banyak yang berakibat semakin rendahnya pH air terutama pada bagian dasar perairan.
Menurut Sutaman (1993) pH air yang rendah dapat secara langsung berpengaruh terhadap pertumbuhan dan kelangsungan hidup larva udang yang dipelihara. pH air serendah 6,4 dapat menurunkan laju pertumbuhan sebesar 60%. Pada pH yang tinggi, persentase amonia yang tidak terionisasi akan lebih besar sebaliknya, persentase hidrogen sulfida (H2S) yang tidak terionisasi justru lebih kecil.
d. Oksigen Terlarut
Oksigen terlarut (Dissolved Oksigen) yang sering disingkat DO merupakan parameter kimia dan dianggap sangat penting karena merupakan kebutuhan primer bagi larva dalam proses metabolisme. Oleh karena itu ketersediaan oksigen
22 bagi udang menentukan lingkaran aktivitasnya, konversi pakan yang akhirnya akan mempengaruhi juga pada pertumbuhan larva, periode moulting, dan sistem kekebalan tubuh (Kordi, 2008).
Selain untuk respirasi, oksigen juga berguna untuk menetralisir gas-gas beracun dan mencegah pertumbuhan bakteri yang merugikan. Semakin tinggi suhu dan salinitas, semakin kecil pula kelarutan oksigen di dalamnya. Air dengan oksigen terlarut hingga 200% jenuh dapat menyebabkan timbulnya gas bubble disease. Adapun tingkat ini ditentukan oleh suhu dan salinitas air. Semakin tinggi suhu air maka kapasitas jenuh oksigen akan semakin besar, sebaliknya semakin tinggi salinitas kapasitas jenuh oksigen di air menurun. Kandungan oksigen pada air pemeliharaan larva diperoleh dari difusi udara, aerasi, pergantian air dan proses fotosintesa pada fitoplankton (Kordi, 2008).
23
BAB III. METODOLOGI
3.1. Waktu dan Tempat
Penulisan tugas akhir ini disusun berdasarkan hasil kegiatan Pengalaman Kerja Praktik Mahasiswa (PKPM) yang dilakukan selama tiga bulan pada tanggal 16 Januari sampai 16 April 2019 di PT. Centralpertiwi Bahari, Dusun Kawari, Desa Mappakalompo, Kecamatan Galesong, Kabupaten Takalar, Provinsi Sulawesi Selatan.
3.2. Bahan dan Alat 3.2.1. Alat
Alat yang digunakan pada kegiatan pemeliharaan larva udang vaname di PT. Centralpertiwi Bahari Takalar dapat dilihat pada Table 3.1.
Tabel 3.1. Alat yang Digunakan pada Pemeliharaan Larva.
No. Alat Spesifikasi Fungsi
1. Bak pemeliharaan larva
Beton,
persegi,volume 40 ton
Wadah pemeliharaan larva
2. Bak reservoar
Beton, persegi panjang, volume 40 dan 60 ton
Wadah persediaan air untuk pemeliharaan larva
3. Ember Bahan plastik, ukuran 30 liter
Wadah untuk menampung dan membawa benur 4. Selang aerasi Green marine, Ø ¼
inch
Sistem pengaerasian atau suplai oksigen
5. Batu aerasi Berpori, bulat kasar, dilengkapi pemberat
Sistem pengaerasian atau suplai oksigen
6. Filter bag - Penyaring air
7. Pipa 3 inci Pemasukan dan pengeluaran
air
8. Gayung 2 L Menebar pakan dan probiotik
9. Scouring pad - Penggosok dinding bak
10. Seser 200μ Sarungan benur dan saringan
pakan
11. Mangkok Bahan plastik Wadah untuk pakan buatan 12. Beacker glass Pyrex, 500-100 ml Wadah pengambilan sampel 13. Timbangan pakan
Mettler Toledo PB 802, dengan kapasitas 1 kg
24
Tabel 3.1. Alat yang Digunakan pada Pemeliharaan Larva. 14. pH meter Waterproof pH scan
pen, ketelitian 0,01 Mengukur pH air 15. Hand refractometer Atago, ketelitian 1
ppt Mengukur salinitas air 16. Thermometer suhu Air raksa, ketelitian
1oC
Mengukur suhu air pemeliharaan 17. DO meter YSI, ketelitian 0,1
ppm Mengukur kandungan O2
18. Blower Root blower Sumber oksigen
19. Pompa 230 W, 220 V, Ø 2
inch Distribusi air laut 20. Genset 32 Kva, 220 V, 1
phase Sumber listrik cadangan
21. Ember 20 liter Melarutkan kaporit dan
thiosulfat
22. Heather - Menaikkan suhu
Sumber : Data Primer PT. Centralpertiwi Bahari, 2019
3.2.2. Bahan
Bahan yang digunakan pada saat pemeliharan larva udang vaname dapat dilihat pada Table 3.2.
Tabel 3.2. Bahan yang Digunakan Untuk Pemeliharaan Larva.
No. Nama Alat Dosis Fungsi
1. Kaporit 10 ppm Membunuh bakteri dalam air 2. Thiosulfat 5 ppm Menetralkan kaporit
3. EDTA 10-20 ppm Mengikat logam berat 4. Deterjen 2-5 ppm Sebagai desinfektan 5. Air laut 20-27 ton Media pemeliharaan
6. Air tawar Melarutkan probiotik dan Mensterilkan alat
7. Vitamin C 2 ppm Menambah daya tahan tubuh larva 8. Nauplius Nauplii4-5 Larva yang akan dipelihara
9. Vanna pro 8 ppm Probiotik untuk larva 10. Super NB 3-5 ppm Probiotik untuk larva 11. Molase 3-5 ppm Probiotik untuk larva
12. Artemia sp. Pakan alami larva
14. Thallasiosina sp. 30.000-50.000 sel/ml
Pakan alami larva 15. SIS 00 1 mg/l Pakan buatan larva Z1-Z3
16. SIS 01 1 mg/l Pakan buatan larva M1-M3
17. SIS 02 1 mg/l Pakan buatan larva PL1-PL5
18. SIS 03 1 mg/l Pakan Buatan PL6-PL10
19. Spirulina 1 mg/l Pakan buatan larva Z-M 20. Flake 1 mg/l Pakan buatan larva PL1-PL12
21. Iodium 1 ppm Sebagai desinfektan 22. Zeigler 1 dan 2 1 mg/l Pakan buatan larva Z1-M3
25
3.3. Metode Pengumpulan Data
Pengumpulan data dilakukan dengan empat metode, yaitu :
1. Metode observasi, yaitu melakukan pengamatan terhadap berbagai kegiatan operasiaonal dalam usaha pemeliharaan larva udang vaname. 2. Metode partisifasi aktif, berperan serta dalam kegiatan operasional
pemeliharaan larva udang vaname bersama seluruh staf dan karyawan unit pemeliharaan larva tersebut.
3. Metode wawancara, yaitu mendapatkan tambahan pengetahuan teoritis dan berbagai informasi yang terkait dengan kegiatan di lapangan melalui wawancara dengan staf atau teknisi.
4. Metode studi pustaka, yaitu penulusuran pustaka melalui literatur yang berhubungan dengan pemeliharaan larva udang vaname.
Metode pengumpulan data digunakan untuk mengumpulkan data primer dan data sekunder. Data primer adalah data yang dikumpulkan sesuai hasil praktik yang dikerjakan secara langsung pada saat kegiatan. Data sekunder adalah data yang dikumpulkan dari berbagai sumber yang digunakan untuk membantu menyelesaikan tugas akhir pada kegiatan praktikum yang tidak bisa dilakukan secara langsung di lapangan.
3.4. Metode Pelaksanaan
Metode pelaksanaan yaitu dengan berpartisipasi aktif pada semua kegiatan yang berkaitan dengan teknik pemeliharaan larva udang vaname yang dilakukan di PT. Centralpertiwi Bahari. Adapun metode pelaksanaan yang dilakukan antara lain:
26
3.4.1. Penyediaan Air Pemeliharaan
Air yang digunakan untuk kebutuhan pemeliharaan induk dan larva berasal dari laut yang berjarak 500 m dari lokasi pembenihan PT. Centralpertiwi Bahari dengan panjang pipa hisap dari rumah pompa ke arah laut mencapai 100 m. Langkah–langkah penyediaan air bersih sebagai berikut :
a. Memompa air laut menuju bak tandon yang sebelumnya telah melalui proses filtrasi pada bak sandfilter.
b. Menampung ke dalam bak penampungan atau bak reservoar.
c. Memberi perlakuan atau treatment air menggunakan kaporit 10 ppm yang disaring dengan saringan dari bahan waring.
d. Menyebar secara merata larutan kaporit ke dalam bak reservoar. Selanjutnya memeriksa kandungan klorin setelah dibiarkan selama 5 jam setelah pemberian kaporit dan dinetralkan dengan thiosulfat.
e. Mendistribusikan air yang telah di treatment menuju departemen-departemen yang membutuhkan yaitu pada bagian pemeliharaan induk, pemeliharaan larva maupun bagian produksi pakan alami. Adapun gambar penebaran kaporit dan thiosulfat dapat dilihat pada Gambar 3.1
Gambar 3.1. Penebaran Kaporit dan Thiosulfat a. Penebaran Kaporit pada Bak
reservoar
b. Pemberian Larutan Thiosulfat reservoar
27
3.4.2. Persiapan Pemeliharaan Larva
a. Menyiapkan bak pemeliharaan (berbentuk persegi panjang dengan dimensi 7x5x2 m).
b. Mencuci dinding bak dan peralatan aerasi dengan menggunakan detergen yang dilarutkan pada air tawar dalam ember plastik. Pencucian bak dan pengeringan dapat dilihat pada Gambar 3.2.
Gambar 3.2. Pencucian dan Pengeringan Bak Larva c. Melakukan Pengeringan bak pemeliharaan selama 3-5 hari.
d. Memasang instalasi aerasi, instalasi alga dan saluran pembuangan sekaligus saluran panen, serta terpal sebagai penutup agar suhu tetap stabil selama pemeliharaan.
e. Mengisi bak pemeliharaan dengan air laut yang sebelumnya telah disterilkan pada bak tandon sebanyak 50% (20 m3) dari volume bak dengan memasang filter bag pada ujung pipa transfer air.
f. Memberikan EDTA 200 g (10 mg/l) ke dalam media pemeliharaan larva yang berfungsi untuk mengikat logam berat dan penambahan vitamin C sebanyak 2 ppm.
28
3.4.3. Penebaran Naupli
Tahapan-tahapan penebaran naupli adalah sebagai berikut : 1. Menyiapkan alat dan bahan yang akan digunakan. 2. Mengeluarkan box naupli dari kendaraan.
3. Menyiapkan larutan pencucian kantong plastik dengan sterofoam berisi 100 ppm larutan iodine (5 ml dalam 50 liter air).
4. Mengeluarkan kantong naupli dari box, mencuci kantong naupli dan memasukkan ke dalam bak pemeliharaan.
5. Melakukan aklimatisasi dengan cara membiarkan kantong naupli berada di bak pemeliharaan sampai suhu kantong sama dengan suhu di bak pemeliharaan.
6. Setelah 30 menit, membuka kantong plastik dan memasukkan naupli secara perlahan ke dalam bak pemeliharaan.
7. Pada sore hari, menghidupkan heater dan melakukan pengaturan suhu 31oC.
3.3.4 Penyediaan dan Pemberian Pakan Alami
Jenis pakan yang diberikan pada larva udang vaname selama proses pemeliharaan yaitu pakan alami (Thalassiosira, sp dan Artemia salina) dan pakan komersil (pakan buatan). Masing-masing pakan tersebut diberikan dengan jumlah dan frekuensi yang disesuaikan dengan stadia larva. Tahapan-tahapan yang dilakukan pada pemberian pakan adalah sebagai berikut :
a. Penyediaan dan pemberian Thalassiosira, sp
1. Mengkultur Thalassiosira, sp hasil kultur skala laboratorium ke skala intermediate dan skala massal.
29
2. Menambahkan pupuk (NaNO3 50 ppm, Urea 10 ppm, DSP 5 ppm, silikat 15 ppm, AGP 5 ppm, EDTA 5 ppm, KNO3 20 ppm untuk nutrisi pertumbuhan Thalassiosira, sp).
3. Memanen hasil kultur Thalassiosira dengan menggunakan pompa celup. Pemberian Thalassiosira pada larva zoea sampai dengan mysis3. Thalassiosira, sp dialirkan melalui pipa transfer alga ke bak pemeliharaan larva. Berikut Gambar 3.3 Transfer algae.
Gambar 3.3 Transfer Algae ke Bak Pemeliharaan b. Penyediaan dan Pemberian Artemia salina
Pemberian Artemia salina dilakukan pada stadia PL1 sampai PL12 dengan frekuensi pemberian tiga kali sehari. Metode kultur Artemia salina yang digunakan adalah dengan terlebih dahulu melalui proses pengikisan lapisan cangkang kista Artemia salina (dekapsulasi) pada wadah ember plastik volume 100 liter. Langkah kerja dekapsulasi kista Artemia salina sebagai berikut :
1. Mencampur kista Artemia salina dengan kaporit 1,5 ml/g kista dan diaduk dengan aerasi yang kuat. Penambahan soda api sebanyak 2000 mg/l untuk menaikkan pH karena proses pengikisan cangkang akan lebih cepat pada pH tinggi.
30
2. Menuang artemia yang telah didekapsulasi pada saringan khusus, diaduk sampai berwarna oranye atau merah bata kemudian dibilas dengan air tawar, dilakukan hingga bersih dan bau klorin hilang.
3. Mengkultur dilakukan pada bak kerucut selama 22-23 jam atau sampai menetas.
4. Memanen dilakukan dengan membuka keran pembuangan pada bagian bawah bak kultur menggunakan saringan khusus Artemia salina.
5. Menebar nauplii Artemia salina ke dalam bak pemeliharaan larva secara merata dengan gayung pakan.
3.3.5 Pemberian Pakan Buatan
Pakan buatan yang diberikan di PT. Centralpertiwi Bahari pada larva adalah pakan komersil. Pakan buatan berperan penting dalam menjaga atau mencegah agar tidak terjadi under feeding selama masa pemeliharaan larva. Langkah-langkah yang dilakukan untuk pemberian pakan buatan adalah sebagai berikut :
a. Sebelum melakukan pemberian pakan, perlu melakukan pemeriksaan rutin terhadap ketersediaan pakan.
b. Menimbang pakan dengan timbangan digital ketelitian 0.1 g kemudian dimasukan ke dalam wadah pakan berupa mangkuk plastik ukuran 500 g. Berikut. Penimbangan pakan dapat dilihat pada Gambar 3.4.
31
c. Memberikan pakan dengan frekuensi pemberian pakan buatan yaitu delapan kali/hari pada pukul 07.00, 11.00, 13.00, 16.00, 19.00, 23.00, 01.00, dan 04.00).
d. Menebar pakan secara langsung ke dalam bak pemeliharaan yang dilakukan sekali tebar. Pakan diberikan disaring untuk stadia Z-M dan untuk PL tanpa diencerkan terlebih dahulu.
e. Setelah selesai, semua peralatan yang digunakan dicuci hingga bersih dan dikembalikan ke tempat semula. Penimbangan dan pemberian pakan disesuaikan dengan jumlah yang tertera pada form pakan harian.
3.3.6 Pengelolaan Kualitas Air
Pengelolaan kualitas air dilakukan dengan beberapa cara yaitu :
a. Monitoring kondisi air secara langsung pada bak pemeliharaan larva yang dilakukan secara rutin setiap hari,
b. Mengecek kualitas air di Laboratorium Quality Control,
c. Mengganti dan menambahkan air serta memberikan probiotik vannapro sebanyak 200 g/bak untuk membantu mempertahankan kualitas air pada bak pemeliharaan larva.
d. Pada stadia Z3, dilakukan penambahan air sebanyak 50% dari volume air sebelumnya. Untuk pergantian air dilakukan pada pagi dan sore hari, mulai stadia M3 sampai PL5 dan dari PL5 sampai dengan PL panen, sebanyak 15% dari volume wadah pemeliharaan yang terisi. Hal ini bertujuan untuk mengurangi kandungan bahan organik dan anorganik dalam air selain itu untuk memperbaiki kualitas air dengan penambahan air yang baru.
32
3.5. Parameter yang Diamati
Adapun parameter yang diamati pada kegiatan pemeliharaan larva udang vaname antara lain :
a. Pertumbuhan bobot mutlak
Pertumbuhan bobot mutlak udang uji dapat dihitung dengan menggunakan rumus menurut Effendi (1979) yaitu :
... (3.1) Keterangan :
Wm : Pertumbuhan bobot mutlak (g)
Wt : Bobot rata-rata udang pada akhir penelitian (g) Wo : Bobot rata-rata udang pada awal penelitian (g)
b. Laju pertumbuhan spesifik (%) dapat dihitung dengan menggunakan dengan rumus Metaxa et al (2006) yaitu :
...(3.2) Keterangan :
α : Laju pertumbuhan spesifik (%) t : Lama pemeliharaan (hari)
Wo : Bobot rata-rata udang pada awal penelitian (g) Wt : Bobot rata-rata udang padaakhir penelitian (g)
c. Pertumbuhan panjang mutlak dihitung dengan menggunakan rumus Effendie (1979), yaitu:
...(3.3) Keterangan :
Lm : Pertumbuhan panjang mutlak (cm) Wm = Wt – Wo
α : 𝐋𝐧𝐖𝐭−𝐋𝐧𝐖𝐨
𝐭 x 100%
33
Lt : Panjang rata-rata pada waktu akhir (cm) Lo : Panjang rata-rata pada waktu awal (cm)
d. Tingkat Kelangsungan Hidup Larva atau Survival Rate (SR)
Tingkat kelangsungan hidup atau survival rate (SR) merupakan perbandingan jumlah larva yang hidup pada akhir pemeliharaan dengan total larva udang yang ditebar pada awal pemeliharaan. Kelulushidupan larva udang vaname dapat dihitung dengan menggunakan rumus menuru Effendie (1979) yaitu:
...(3.4)
Keterangan :
SR : Tingkat kelangsungan hidup (%)
Nt : Jumlah udang pada akhir pemeliharaan (ekor). N0 : Jumlah udang pada awal pemeliharaan (ekor). e. Manajemen Pemberian Pakan
f. Parameter Kualitas Air
Kualitas air adalah suatu kondisi air dilihat dari karakteristik fisik, kimiawi, dan biologis. Parameter kualitas air yang diukur meliputi oksigen terlarut, suhu, salinitas dan pH.
3.6. Analisa Data
Data yang diperoleh disajikan dalam bentuk tabel dan grafik selanjutnya dianalisa secara deskriptif.
SR : 𝐍𝐭