3
II. TINJAUAN PUSTAKA
3.1 CURD DAN TAHU
Curd adalah hasil penggumpalan protein melalui penambahan bahan penggumpal (koagulan). Proses pembentukan curd dibutuhkan dalam proses pembuatan beberapa produk pangan seperti dalam proses pembuatan tahu. Proses pembuatan tahu dimulai dengan pengekstrakkan protein dari kacang kedelai sehingga didapatkan sari kedelai (susu kedelai). Kemudian protein kedelai digumpalkan dengan penambahan koagulan. Pembentukan curd kedelai ini terjadi melalui pemanfaatan sifat fungsional yang terdapat pada protein, yaitu gelasi protein. Menurut Zayas (1997), gel dari protein kedelai ini memiliki kapasitas untuk bertindak sebagai matriks dan menahan air, lemak, polisakarida, flavor dan komponen lainnya. Kemampuan protein dalam membentuk gel serta proses pembentukan curd adalah proses penting untuk menghasilkan produk berbasis protein.
3.1.1 Gelasi Protein
Menurut Zayas (1997), kapasitas pembentukan gel protein pangan adalah atribut fungsional penting dalam pembuatan pangan. Kapasitas pembentukan gel merupakan standar yang umum digunakan untuk mengevaluasi protein bahan pangan. Karakteristik mutu dari banyak pangan, khususnya sifat tekstur dan juiciness ditentukan melalui kapasitas pembentukan gel protein. Gel dapat bervariasi nyata dalam sifat reologinya seperti kekohesivitasan, kekerasan, kelengketan, dan daya adesif. Gel protein memiliki sifat yang unik yaitu bersifat seperti bahan padat, tapi pada saat yang sama memiliki banyak karakteristik dari cairan. Untuk menghasilkan sifat tekstur tertentu, protein— melalui fenomena gelasi protein—sering digunakan.
Menurut Schmidt (1981) yang dikutip oleh Zayas (1997), gelasi adalah fenomena agregasi protein di mana interaksi polimer-polimer dan polimer-solven sangat seimbang sehingga jaringan atau matriks tersier terbentuk. Gel terbentuk ketika sebagian protein unfolded membentuk segmen polipeptida yang berinteraksi pada titik tertentuk untuk membentuk jaringan cross-linked tiga dimensi. Gel dengan stabilitas dan kekuatan yang tinggi dapat terbentuk sebagai hasil dari cross-linking yang memberikan fluiditas, elastisitas dan sifat mengalir dari gel. Pengurangan jumlah cross-links akan menurunkan kekerasan gel. Pembentukan gel merupakan hasil dari ikatan hidrogen, interaksi ion dan hidrofobik, gaya Van der Walls, dan ikatan kovalen disulfida. Penurunan jumlah dari cross-link akan mengurangi kekerasan gel (Zayas, 1997). Wang dan Damodaran (1990) yang dikutip oleh Zayas (1997) melaporkan bahwa ukuran dan bentuk polipteptida dalam matriks gel juga akan mempengaruhi kekuatan dari gel.
Menurut Kinsella (1979) yang dikutip oleh Zayas (1997), gelasi adalah sifat hidrasi, struktural, tekstural dan reologi dari protein. Foegeding (1989) yang dikutip oleh Zayas (1997) menggambarkan gel sebagai sesuatu yang mengandung struktur unit terhubung dengan fase liquid di seluruh matriks tiga dimensinya. Kemampuan pembentukan gel dari protein mempengaruhi funsional lainnya seperti daya ikat air dan pengikatan lemak (Zayas, 1997). Sifat protein untuk membentuk gel dan menahan sejumlah gula, flavor, dan bahan pangan lainnya secara signifikan dalam matriks tiga dimensi telah digunakan secara luas dalam proses pangan dan dalam pengembangan produk pangan baru (Kinsella, 1997 dikutip oleh Zayas, 1997).
4 Protein berberat molekul tinggi dan persentase amino yang tinggi dengan gugus hidrofobik cenderung membangun jaringan yang kuat dalam sistem gel. Keberadaan asam amino hidrofobik juga mempengaruhi perubahan protein selama pemanasan. Peningkatan jumlah gugus -SH dan -SS- selama denaturasi dapat memperkuat jaringan intermolekul. Berat molekul minimum kristis bagi pembentukan gel adalah 23000 (Zayas, 1997).
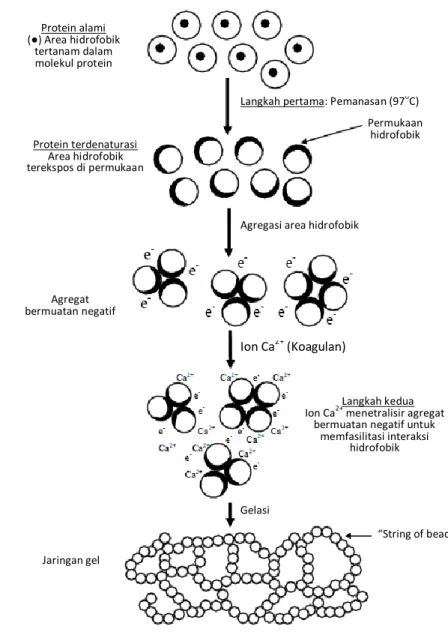
Gambar 1. Mekanisme gelasi dari tahu yang terkoagulasi oleh CaSO4. (O) merupakan molekul
protein. (●) merupakan area hidrofobik. Diadaptasi dari Kohyama et al. (1995).
Dalam pembentukan gel, transisi dari bentuk asli menjadi bagian yang terdenaturasi merupakan precursor penting terhadap interaksi-interaksi protein. Derajat denaturasi protein yang penting dalam pembentukan gel masih merupakan perdebatan. Jaringan gel dapat terbentuk setelah denaturasi protein parsial dan molekul protein di-fixed-kan dalam bagian terdenaturasi parsial (Zayas, 1997).
Felix (1988) menyatakan bahwa gelasi protein menyediakan integritas mekanis ke banyak matriks pangan dengan membentuk jaringan molekular yang memberikan sifat-sifat seperti padatan. Gelasi ini dapat mempengaruhi sifat kinestetik, struktural, tekstural, dan reologi. Pada konsentrasi tinggi (20%), sebagian besar dispersi protein menunjukkan fenomena ini; juga konsentrasi rendah,
Protein alami (●) Area hidrofobik
tertanam dalam molekul protein
Langkah pertama: Pemanasan (97oC) Permukaan
hidrofobik Protein terdenaturasi
Area hidrofobik terekspos di permukaan
Agregasi area hidrofobik
Agregat bermuatan negatif
Ion Ca2+ (Koagulan)
Langkah kedua Ion Ca2+ menetralisir agregat
bermuatan negatif untuk memfasilitasi interaksi
hidrofobik
Gelasi
Jaringan gel
5 atau molekul protein yang merupakan dimensi molekular kecil dengan sedikit kecenderungan untuk interaksi intermolekular, akan mengurangi sifat seperti bahan padat tersebut. Protein kedelai mempunyai banyak sifat fungsional yang sudah dipelajari secara luas. Sifat-sifat fungsional protein tersebut antara lain kemampuan untuk larut, kemudahan terdenaturasi oleh panas, pengemulsian, kemampuan menghasilkan busa, kemampuan membentuk gel, kemampuan menahan air (Water Holding Capacity), sifat reologi, kemampuan membentuk tekstur, dan kemampuan mempengaruhi karakteristik tekstur (Liu et al., 2008).
Contoh mekanisme pembentukan gel oleh protein dapat dilihat pada Gambar 1, pembentukan gel kedelai ini juga dibantu oleh adanya koagulan. Awalnya protein yang memiliki area hidrofobik yang tertanam di dalam molekul protein dipanaskan hingga 97oC. Hal ini menyebabkan protein terdenaturasi sehingga protein terbuka, dan area hidrofobik terekspos di permukaan. Protein-protein terdenaturasi tersebut kemudian saling beragregasi diakibatkan area hidrofobik dari protein-protein tersebut saling mendekat dan bergabung. Sebagai akibatnya agregat protein menjadi bermuatan negatif. Koagulan kemudian ditambahkan, dalam hal ini koagulan CaSO4, sehingga ion Ca2+ dari
koagulan akan menetralisir muatan negatif dari agregat protein dan memfasilitasi terjadinya interaksi hidrofobik. Akhirnya terjadilah gelasi yang ditunjukan dengan terbentuknya jaringan gel yang tersusun dari string of beads.
Gambar 2. Pembentukan struktur jaringan protein dengan adanya perubahan konsentrasi, pH, atau kekuatan ion protein. Diadaptasi dari Hegg (1982) dan Oakenfull et al. (1997).
Menurut Yasir (2005), pembentukan gel protein sangat dipengaruhi oleh kondisi dari pembentukan itu sendiri. Gel dapat menjadi lebih kasar jika pH mendekati titik isoelektrik protein dan juga ketika kekuatan ion protein ditingkatkan. Dalam kasus protein globular, perubahan konsentrasi, pH, dan kekuatan ion protein, akan menyebabkan struktur jaringan berubah dan secara tidak langsung akan berkontribusi terhadap kekuatan gel, seperti yang ditunjukkan oleh Gambar 2.
Banyak penelitian yang menghubungkan antara sifat gelasi protein dengan keberadaan 7S (β-conglycinin) dan 11S (glycinin)—yang merupakan kandungan mayoritas dari protein globulin kedelai. Kandungan protein 11S dan rasio protein 11S/7S telah dilaporkan memiliki korelasi positif dengan kekerasan gel tahu pada basis sistem protein terpurifikasi (Kang et al., 1991; Murphy et al., 1997; Saio et al., 1969 yang dikutip oleh Mujoo, 2003). Utsumi dan Kinsella (1985) yang dikutip oleh Mujoo (2003) menemukan bahwa protein 7S membentuk gel yang jauh lebih keras dibandingkan dengan protein 11S. Selain itu terdapat sedikit korelasi antara rasio protein 11S/7S dengan mutu tahu
Konsentrasi protein Kekuatan ion Tinggi Dekat pI Tinggi Rendah Jauh dari pI Rendah
Larutan Larutan Gel transparan Gel opak Gel turbid (keruh)
Rendah Kekuatan gel
(Tinggi)
6 (Skurray et al., 1980; Taira, 1990 yang dikutip oleh Mujoo, 2003). Berbeda dengan pendapat Utsumi dan Kinsella (1985) sebelumnya, Corredig (2006) justru menemukan bahwa gel yang dihasilkan oleh protein 11S (glycinin) yang sudah terisolasi jauh lebih keras dibandingkan dengan gel yang dihasilkan oleh protein 7S (β-conglycinin), dan struktur jaringan yang terbentuk berbeda, tergantung dengan komposisi proteinnya. Hal yang senada juga dinyatakan oleh Blazek (2008) yang menyatakan bahwa glycinin berkontribusi besar terhadap peningkatan kekerasan, sementara itu β-conglycinin justru memiliki pengaruh yang kuat terhadap keelastisitasan gel protein kedelai.
3.1.2 Tahu
Menurut Liu (2008), tahu merupakan produk berbasis kedelai yang airnya terekstrak dan garam atau asamnya terendap dalam bentuk curd, menyerupai keju putih halus atau yogurt yang sangat keras. Sederhananya, tahu merupakan protein kedelai yang digumpalkan melalui penambahan suatu bahan penggumpal. Tahu merupakan pangan yang serbaguna dan bergizi yang terbuat dari curd kedelai (Obatolu, 2007). Dibandingkan dengan daging atau keju, tahu memiliki kalori yang lebih rendah karena rasio protein/lemaknya yang lebih tinggi. Tahu juga bebas kolesterol, bebas laktosa, dan jumlah lemak jenuhnya lebih sedikit (Liu, 2008).
Pemanfaatan protein kedelai yang pertama kali adalah di Asia Timur, Protein tersebut dimanfaatkan sebagai makanan dalam bentuk tahu gel. Gel dari kedelai atau yang biasa disebut dengan tahu memiliki kapasitas untuk bertindak sebagai matriks dan menahan air, lemak, polisakarida, flavor dan bahan komponen lainnya. Sifat karaktersitik dari gel protein kedelai ini adalah kemampuan menahan proteinnya atau Water Holding Capacity (WHC) yang tinggi dibandingkan dengan gel dari susu atau gel lainnya (Zayas, 1997).
Tahu merupakan pangan yang diproduksi melalui pemanfaatan sifat gelasi protein kedelai. Kedelai yang akan dioleh diekstrak proteinnya menjadi susu kedelai lalu digumpalkan menggunakan koagulan. Oboh (2006) menyatakan bahwa tahu dihasilkan dengan cara mengkoagulasikan susu kedelai panas baik dengan garam (CaCl2 atau CaSO4) atau asam (glukono-δ-lakton). Pengkoagulasian
ini akan menghasilkan gel protein yang dapat menjerat air, lemak, dan komponen lainnya dalam matriks curd yang terbentuk. Curd yang terbentuk kemudian ditekan hingga membentuk kubus padat (Cao dan Chan, 1997; Cao dan Chang, 1999 yang dikutip oleh Oboh, 2006).
Hasil dan mutu dari tahu dipengaruhi oleh varietas kedelai, kualitas kedelai (tergantung dengan pertumbuhan dan kondisis penyimpanan), dan kondisi proses. Proses koagulasi merupakan tahap yang paling penting dalam pembuatan tahu dan paling sulit dikontrol karena ketergantungannya terhadap kompleks hubungan intern dari variabel-variabel berikut: kimiawi kedelai; suhu pemasakan susu kedelai; volume, kandungan padatan dan pH; tipe, jumlah, konsentrasi dan metode penambahan dan pencampuran koagulan; serta suhu dan waktu koagulasi (Cai dan Chang, 1998).
Untuk tahu tradisional yang biasanya dijual di Indonesia, proses pembuatannya pada dasarnya terdiri atas dua bagian, yaitu pembuatan susu kedelai dan penggumpalan proteinnya. Sebagai zat penggumpal secara tradisional biasanya digunakan biang, yaitu cairan yang keluar pada waktu pengepresan dan sudah diasamkan semalam. Sebagai pengganti, dapat digunakan air jeruk, cuka, larutan asam laktat, larutan CaCl2 atau CaSO4. Pada pembuatan tahu cina biasanya digunakan sioko
yang mengandung CaSO4 dan garam. Selain protein, zat-zat lain yang terdapat dalam kedelai juga
terbawa ke dalam endapan. Terdapat beberapa faktor yang mempengaruhi rendemen protein dan mutu tahu, yaitu cara penggilingan, pemilihan bahan baku, bahan penggumpal, dan keadaan sanitasi proses pengolahan. Hasil penelitian menunjukkan bahwa ekstraksi secara panas menghasilkan rendemen lebih banyak (Purwaningsih, 2007).
7 Proses pembuatan tahu pada dapat dimulai dengan memilih kedelai yang berkualitas baik lalu di bersihkan kotorannya. Setelah itu kedelai direndam dalam air bersih selama 8-12 jam (lebih baik jika menggunakan air mengalir). Perendaman dimaksudkan untuk melunakkan struktrur selularnya sehingga mudah digiling dan memberikan disperse dan suspense bahan padat kedelai yang lebih baik pada waktu ekstraksi (penggilingan). Proses perendaman juga akan mengurangi oligosakarida penyebab flatulensi menjadi sekitar 30%. Perendaman dapat mempermudah pengupasan kulit kedelai, tetapi perendamannya yang terlalu lama dapat mengurangi total padatan (Purwaningsih, 2007). Menurut Subardjo et al. (1987) perendaman yang terlalu lama akan menyebabkan terjadinya pembentukan busa pada permukaan air rendaman akibat fermentasi kedelai, sedangkan perendaman yang terlalu singkat akan membuat biji kedelai sulit pecah saat penggilingan.
Kedelai yang sudah direndam kemudian dikupas dan dilakukan penggilingan dengan penambahan air antara 8-10 kali berat kedelai. Penggunaan air panas 80-100oC dapat menonaktifkan enzim lipoksigenase penyebab bau langu serta memperbanyak rendemen. Bubur kedelai selanjutnya disaring dan filtratnya dimasak. Pemasakan ini bertujuan untuk mengurangi bau langu, menonaktifkan tripsin inhibitor (antitripsin), meningkatkan daya cerna, mempermudah ekstraksi, penggumpalan protein, serta menambah keawetan produk (Purwaningsih, 2007). Menurut Liu et al. (2004), pemanasan optimal dalam pembuatan susu kedelai dilakukan selama 3-10 menit setelah mendidih yang tujuannya untuk mengekstrak protein kedelai dan mendenaturasi protein serta memudahkan proses koagulasi. Penggumpalan selanjutnya dilakukan dengan penambahan batu tahu atau biang. Dalam hal ini harus diperhatikan kecepatan penambahannya. Gumpalan (curd) protein kedelai selanjutnya dicetak, diperas (dipres) dan dipotong (Purwaningsih, 2007).
Penambahan koagulan ke dalam filtrat dilakukan pada suhu yang tepat, sesuai dengan jenis koagulan yang digunakan. Setelah curd terbentuk, curd dikumpulkan dan dimasukkan ke dalam wadah cetakan, kemudian ditekan perlahan untuk membuang kelebihan air dan terbentuk padatan tahu. Menurut Shurtleff dan Aoyagi (2001), untuk mendapatkan hasil dengan jumlah yang tinggi (misal untuk menghasilkan tahu soft) kebanyakan produsen melakukan penekanan ringan awal sekitar 2-4 gm/cm2 (0.026-0.052 psi) untuk kira-kira 5 menit, kemudian penekanan dan tutup dihilangkan dan tarik kain ke seluruh sisi untuk meningkatkan pengurasan air, dan pada akhirnya dilakukan penekanan kuat sekitar 20-100 gm/cm2 (0.26-1.32 psi) untuk kira-kira 20 hingga 30 menit.
Menurut Obatolu (2007), hasil dan kualitas tahu dipengaruhi oleh beberapa faktor, yaitu mutu dan varietas kedelai, jumlah pengadukan, koagulan yang digunakan, dan besar dan lama penekanan curd. Selain itu, koagulasi susu kedelai sangat mengandalkan hubungan intern antara tipe kedelai, suhu pemasakannya, volume, kandungan padatan, pH, tipe dan jumlah koagulan, serta waktu koagulasi. Semua faktor itu akan mempengaruhi profil tekstur curd yang dihasilkan pada produk akhir seperti kekerasan. Kekerasan tahu dapat bervariasi dari lunak ke keras dengan kandungan air sekitar 70-90% dan kandungan protein sekitar 5-16%, dan hal itu tergantung dari jenis dan jumlah koagulan, pengadukan selama koagulasi serta penekanan yang diaplikasikan terhadap curd (DeMan et al, 1986 yang dikutip Blazek, 2008).
Obatolu (2007) menyatakan bahwa tahu lunak digolongkan melalui rasa yang lunak dan tekstur yang halus dengan kadar air berkisar antara 84-90%. Kekerasan kemungkinan dikarenakan oleh kepadatan dan kerapatan struktur dari tahu. Tahu yang keras memiliki struktur yang lebih padat karena molekul proteinnya sangat dekat akibat hilangnya kandungan air selama tahap koagulasi. Sehingga dapat diasosiasikan bahwa rendahnya kemampuan menahan air (Water Holding Capacity) akan menyebabkan tahu memiliki kekerasan yang tinggi, sehingga tahu memiliki tekstur yang padat dan penampakan yang kasar. Sebaliknya, tingginya kemampuan struktur tahu dalam menahan air akan
8 menyebabkan tahu memiliki kekerasan yang rendah, sehingga tahu memiliki tekstur yang lembut dan penampakan yang halus.
3.2 KOAGULASI DAN KOAGULAN
Tahap koagulasi protein (pengendapan protein) merupakan salah satu tahapan penting dalam pembuatan produk pangan berbasis curd. Koagulasi adalah proses perubahan bentuk dari susu cair menjadi padatan berbentuk gel. Menurut Meng et al. (2002), koagulasi adalah interaksi acak molekul-molekul protein yang mengakibatkan terbentuknya agregat protein baik yang memiliki sifat larut maupun yang tidak larut. Koagulasi protein dilakukan biasanya dilakukan dengan bantuan koagulan sebagai penggumpal protein. Secara tidak langsung proses koagulasi protein yang mempengaruhi struktur curd yang dihasilkan, dapat menentukan mutu tekstur produk akhir. Terdapat tiga jenis koagulan yang biasa digunakan untuk menghasilkan curd, yaitu garam, asam, dan enzim.
Dalam pembuatan tahu, proses penggumpalan merupakan tahapan proses paling menentukan bagi sifat-sifat fisik dan organoleptik tahu. Menurut Blazek (2008), proses koagulasi merupakan tahap yang tersulit karena ketergantungannya terhadap hubungan intern yang rumit dari berbagai variabel. Peningkatan suhu koagulasi akan meningkatkan kekerasan seiring dengan peningkatan tingkat pengadukan langsung setelah penambahan koagulan (Saio, 1979 yang dikutip oleh Blazek, 2008). Selain itu, menurut Johnson dan Wilson (1984), jumlah koagulan yang dibutuhkan dalam pengkoagulasian tahu tergantung pada kadar padatan yang terdapat dalam susu kedelai yang dihasilkan.
Poysa dan Woodrow (2004) melaporkan bahwa penggunaan koagulan yang berbeda akan menghasilkan tahu dengan sifat tekstur dan flavor yang berbeda. Lebih jauh lagi, Beddows dan Wong (1987) menyatakan bahwa kalsium sulfat yang merupakan koagulan yang biasanya dipakai dalam pembuatan tahu, akan membantu memudahkan protein dalam susu kedelai untuk beragregasi. Kalsium sulfat yang bereaksi dengan protein akan menciptakan ikatan silang antar polimer protein. Kombinasi antara panas dengan mekanisme kerja kalsium tersebut akan membentuk struktur tahu. Mutu produk akhir tahu dipengaruhi oleh pH, konsentrasi koagulan, dan kecepatan pengadukan selama proses.
Koagulasi protein susu kedelai terjadi pada pH 4.1-4.6, dan dari koagulasi tersebut akan dihasilkan curd yang mengandung protein yang sebagian besar terdiri atas globulin (Karsono, 2010). Menurut Shurtleff dan Aoyogi (1984), penambahan koagulan sebaiknya diaplikasikan saat susu kedelai telah mencapai suhu antara 70-90oC, tapi hal ini tergantung dari jenis koagulan yang dipakai. Koagulasi ini akan menghasilkan hasil samping yang umumnya mengandung albumin, protease, pepton, nitrogen yang bukan dari protein, gula, antitrypsin, urease, lipoksidase, serta enzim-enzim lain dan bahan lain yang ikut terlarut dalam air (Smith, 1958).
Shurtleff dan Aoyogi (2001) menyatakan bahwa di dunia terdapat empat tipe koagulan atau penggumpal dasar yang digunakan untuk membuat tahu, yaitu: 1) koagulan tipe garam klorida atau nigari; 2) koagulan tipe sulfat; 3) Glukono delta lakton (GDL atau lakton); dan 4) koagulan tipe asam. Tipe koagulan atau bahan penggumpal untuk pembuatan tahu yang umum digunakan dapat dilihat pada Tabel 1. Untuk penggumpal tahu tipe garam, kation metal (yang bermuatan positif) dalam garam (seperti Mg2+ atau Ca2+) bereaksi dengan bermacam protein dalam susu kedelai dan mengendap dengan minyak membentuk curd. Pemakaian koagulan tipe garam dapat menyebabkan terjadinya koagulasi protein pada pH di atas titik isoelektrik protein globulin kedelai (Wolf dan Cowan, 1971). Contoh-contoh koagulan yang biasa dipakai beserta tipe tahu dan suhu koagulasinya dapat dilihat pada Tabel2.
9 Tabel 1. Beberapa golongan bahan penggumpal tahu yang umum digunakan
Golongan Jenis yang umum digunakan
Garam klorida (nigari)
Garam sulfat Lakton Asam
nigari alami, MgCl2.6H2O, air laut, CaCl2,
CaCl2.2H2O
CaSO4.2H2O dan MgSO4.7H2O
C6H10O6 (glukono-δ-lakton)/GDL
Asam laktat, sari buah jeruk, asam asetat, cuka (larutan asam asetat 4%)
Sumber : Shurtleff dan Aoyogi (1984)
Tabel 2. Jenis koagulan yang biasa dipakai untuk beberapa tipe tahu beserta suhu koagulasinya
Tipe Tahu Koagulan Suhu Koagulasi
Regular atau Firm Tipe Nigari1 Kalsium sulfat Lakton (GDL) Sari lemon Vinegar 70-85oC 70-75oC 90oC 80-90oC 80-90oC
Tahu Silken Tipe Nigari
Kalsium sulfat
65-68oC 70oC Tahu silken dalam bungkus Lakton
Kalsium sulfat
85oC2 90oC2
Keterangan : (1) Termasuk nigari alami, magnesium klorida dan kalsium klorida. (2) Koagulan ditambahkan pada susu kedelai dingin kemudian dipanaskan hingga 85oC atau 90oC.
Sumber :Shurtleff dan Aoyogi (2001)
Nigari alami atau juga dikenal dengan ―bittern‖, diekstrak dari air laut dengan menghilangkan hampir atau semua garam meja (NaCl) dan air. Campuran mineral laut alami mengandung utamanya magnesium klorida dan semua garam lain dan sisa-sisa mineral dalam air laut. Koagulan tipe nigari mampu menghasilkan tahu yang paling enak, mengingat aroma dan flavor manisnya yang sangat halus. Nigari dibandingkan dengan kalsium sulfat dan lakton memiliki kekurangan, yaitu nigari harus ditambahkan perlahan, beberapa kali ke dalam susu kedelai. Penggumpalan menggunakan nigari membutuhkan waktu yang lama. Selain itu dibutuhkan kemampuan dan pengetahuan dalam menggunakan koagulan ini. Kekurangan lainnya adalah tahu yang dihasilkan tidaklah terlalu lembut dan halus (Shurtleff dan Aoyogi, 2001).
Koagulan tipe sulfat merupakan koagulan yang sudah digunakan secara luas di dunia. Jenis yang paling umum adalah kalsium sulfat (garam gypsum) dan magnesium sulfat (garam Epsom). Koagulan-koagulan ini sangat tepat bagi metode produksi masal modern walaupun koagulan ini terdispersi dengan lambat dalam air untuk membentuk larutan koloid yang memiliki waktu reaksi koagulasi yang lambat. Namun penggunaan koagulan ini cukup mudah, bahkan bagi orang yang tidak terlatih (Shurtleff dan Aoyogi, 2001). Selain itu menurut Obatolu (2007) semakin lambat aksi pengkoagulasian oleh koagulan, semakin baik rendemen tahu yang dihasilkan dibandingkan dengan koagulan yang cepat aksi pengkoagulasiannya.
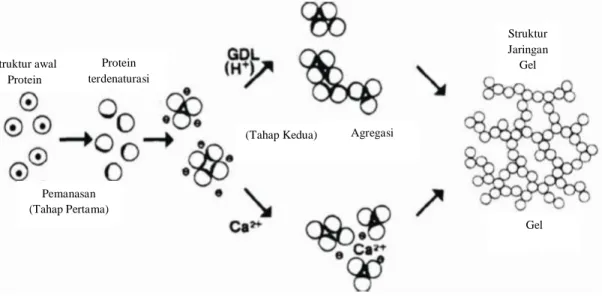
10 Koagulan tipe lakton atau GDL, merupakan koagulan nomor dua yang digunakan secara luas sebagai koagulan tahu di Jepang. Hasil dari pengkoagulasian protein menggunakan koagulan ini adalah tahu sutra (silken tofu). Ketika lakton dicampurkan dengan susu kedelai dan dipanaskan, lakton akan memproduksi asam glukonat yang mengkoagulasi protein susu kedelai untuk membentuk tahu sutra, dan proses ini hampir mirip dengan proses yang terjadi pada asam, yang diproduksi oleh mikroba starter, yang digunakan pada saat pembuatan yogurt (Shurtleff dan Aoyogi, 2001). Mekanisme gelasi protein oleh koagulan CaSO4 dan GDL dapat dilihat pada Gambar 3.
Gambar 3. Mekanisme gelasi protein oleh koagulan CaSO4 dan GDL. (Kohyama et al., 1995)
Koagulan tipe asam yang sering digunakan dalam pengendapan protein kedelai adalah asam laktat (seperti yang dihasilkan secara alami oleh Lactobacillus). Asam laktat memberikan flavor yang jauh lebih baik dibandingkan dengan lakton dan menghasilkan struktur molekul yang lebih kecil juga. Asam asetat bahkan memberikan performa yang lebih baik dibandingkan dengan asam laktat, karena dapat mengkoagulasikan protein sebanyak 67.8% dari total protein, ketika pH diturunkan menjadi 4.5, di mana asam laktat hanya mampu mengkoagulasikan 55% dari total protein kedelai. Asam lainnya yang aman untuk pangan seperti asam sulfurat, hidroklorat, fosforat, sitrat, malat atau tartarat dapat juga digunakan secara komersial dalam pengendapan curd konsentrat protein kedelai (Shurtleff dan Aoyogi, 2001).
Berbagai sari buah jeruk (khususnya sari lemon) dapat bekerja sama baiknya dengan koagulan alami, dan koagulan ini mungkin merupakan yang terbaik bagi Negara tropis di mana harganya tidak terlalu mahal dan tersedia secara local, walaupun dibandingkan dengan nigari dan kalsium sulfat rendemen tahunya lebih rendah, tekstur sedikit rapuh, dan flavornya sedikit asam. Di Indonesia whey tahu yang telah dibiarkan terfermentasi selama semalam (diinokulasikan dengan sedikit whey terfermentasi dari hari sebelumnya) hingga menjadi asam juga dapat digunakan sebagai koagulan yang gratis dan mudah dibuat lagi dan juga mampu menghasilkan tahu dengan mutu yang bagus. Di Thailand dan Burma, sari buah beri yang pahit dari pohon tertentu dikatakan dapat digunakan juga sebagai koagulan (Shurtleff dan Aoyogi, 2001).
Struktur awal Protein Protein terdenaturasi Pemanasan (Tahap Pertama)
(Tahap Kedua) Agregasi
Struktur Jaringan Gel
11
3.3 TEKNIK ELEKTROFORESIS DALAM ANALISIS PROTEIN
Elektroforesis merupakan suatu cara untuk memisahkan fraksi-fraksi suatu zat melalui migrasi partikel bermuatan atau ion-ion makromolekul di bawah pengaruh medan listrik. Menurut Nielsen (2010) elektroforesis adalah migrasi molekul bermuatan dalam suatu larutan melalui suatu medan listrik. Migrasi partikel ini tergantung dengan viskositas larutan, ukuran dan muatan partikel, dan yang paling penting adalah voltase yang digunakan (Pomeranz dan Meloan, 1994). Selain itu Rybicky dan Purves (1996) juga menyatakan bahwa tingkat migrasi partikel bermuatan tergantung dari kekuatan medan, muatan total, ukuran, bentuk dan kekuatan ion partikel, viskositas, dan suhu medium di mana molekul bergerak.
Menurut Copeland (1994), metode elektroforesis telah digunakan secara luas dalam penganalisisan protein untuk mencari tingkat kemurnian, berat molekul, dan terkadang titik isoelektrik. Teknik elektroforesis juga sering digunakan untuk mengetahui komposisi produk pangan. Sebagai contoh, perbedaan dalam komposisi protein dari konsentrat protein kedelai dan konsentrat protein whey yang dihasilkan melalui teknik separasi yang berbeda, dapat dideteksi (Nielsen, 2010).
Banyak molekul biologis, seperti asam amino, peptida, protein, nukleotida dan asam nukleat, yang memiliki grup yang dapat berionisasi pada pH berapapun yang digunakan, yang terdapat dalam larutan baik sebagai kation (+) maupun anion (-). Di bawah pengaruh medan listrik, partikel bermuatan ini akan bermigrasi baik ke katoda maupun ke anoda, tergantung dengan muatan alaminya (Wilson dan Walker, 2000). Menurut Nielsen (2010), besarnya muatan dan voltase yang digunakan akan menentukan berapa jauh sebuah protein akan bermigrasi dalam suatu medan listrik. Namun terdapat juga gaya gesek yang menghambat pergerakan dari molekul bermuatan ini. Gaya gesek ini ditimbulkan oleh ukuran hidrodinamik dari molekul, bentuk molekul, ukuran pori-pori medium di mana elektroforesis dilakukan, dan viskositas dari buffer (Wilson dan Walker, 2000).
Tipe elektroforesis yang paling umum dilakukan untuk protein adalah elektroforesis zonal, di mana protein dipisahkan dari campuran yang kompleks menjadi pita-pita melalui migrasi dalam buffer encer dalam matriks polimer padat yang disebut gel. Gel poliakrilamid adalah matriks yang paling umum digunakan untuk elektroforesis protein, walaupun matriks-matriks lainnya seperti pati dan agarosa mungkin digunakan. Matriks gel dibentuk sebagai slab diantara dua papan gelas (Nielsen, 2010).
Matriks gel poliakrilamid dibentuk melalui polimerisasi akrilamid dan sejumlah kecil (biasanya 5% atau kurang) dari cross-linking reagent, N, N‘-metilenbisakrilamid, dengan kehadiran katalis, tetrametiletilendiamin (TEMED), dan sebuah sumber radikal bebas, amonium persulfat (Nielsen, 2010). Mekanisme pembentukan gel adalah polimerisasi adisi vinil dan dikatalis oleh sistem radikal bebas yang terbentuk dari ammonium persulfat (inisiator) dan TEMED (katalis). TEMED menyebabkan pembentukkan radikal bebas dari persulfat dan berturut-turut mengkatalisis polimerisasi. Oksigen, pengikat radikal,dapat mengganggu polimerisasi, sehingga penghilangan gas yang tepat untuk menghilangkan oksigen terlarut dari larutan akrilamid sangatlah penting bagi pembentukan gel. Setelah akrilamid aktif terbentuk, akrilamid aktif akan bereaksi dengan akrilamid lain untuk membentuk rantai polimer panjang. Gel kemudian terbentuk sebagai hasil dari polimerisasi ini dengan struktur berbentuk jala. Jumlah akrilamid dan ikatan silang dari akrilamid yang digunakan akan menentukan ukuran pori serta ukuran jala dari gel (Garfin, 1990).
Pemisahan protein dapat dilakukan dengan cara elektroforesis native, yaitu protein dipisahkan menurut bentuk alaminya berdasarkan muatan, ukuran, dan bentuk molekul. Namun pemisahan protein yang biasanya digunakan adalah melalui elektroforesis denaturasi. Teknik ini dilakukan dengan menggunakan media poliakrilamid dan protein yang akan dipisahkan terlebih dahulu
12 didenaturasikan. Polyacrylamide gel electrophoresis (PAGE) dengan detergen anionik, sodium dodecyl sulfate (SDS), digunakan untuk memisahkan subunit protein menurut ukurannya. Protein disolubilisasi dan dipisahkan menjadi subunit-subunit dalam suatu buffer yang mengandung SDS dan reducing agent. Reducing agent, seperti mercaptoethanol atau ditiotreitol, digunakan untuk mengurangi ikatan disulfida yang terdapat pada suatu subunit protein atau di antara subunit-subunit protein. Protein akan mengikat SDS, yang akan membuatnya menjadi bermuatan negatif, dan kemudian dipisahkan berdasarkan ukurannya sendiri (Nielsen, 2010).
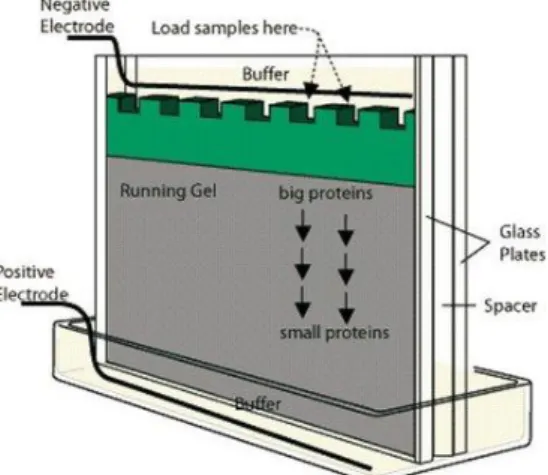
SDS akan melapisi protein yang telah terdenaturasi. Pada bentuk terdenaturasi, kebanyakan protein mengikat SDS dalam rasio berat yang konstan, sehingga protein berakhir dengan memiliki densitas bermuatan yang sama. Di bawah kondisi seperti ini, tingkat migrasi protein dalam medan listrik tidak lagi tergantung pada muatan yang melekat pada molekul, tetap lebih ditentukan semata-mata oleh ukuran molekul (sebagai contoh, protein yang lebih besar akan lebih sangat terhambat dalam migrasi dalam gel polimer dibandingkan dengan protein yang lebih kecil). Skema dari alat SDS-PAGE dapat dilihat pada Gambar 4. Sampel protein akan diinjeksikan melalui sumur pada ujung atas gel yang kontak, melalui kolam buffer, dengan katoda. Bagian bawah gel juga terhubung dengan anoda. Ketika arus listrik diaplikasikan, protein yang terlapis oleh SDS akan bermigrasi ke bagian bawah gel, di bawah pengaruh medan listrik yang diberikan (Copeland, 1994). Kompleks SDS-protein yang lebih besar akan memiliki mobilitas yang lebih kecil dibandingkan dengan kompleks SDS-protein yang lebih kecil.
Gambar 4. Skema alat SDS-PAGE (Jage, 2008)
Menurut Boyer (1993), gel yang dibentuk dari polimerisasi akrilamid memiliki beberapa kelebihan positif dalam elektroforesis: 1) memiliki kemampuan pemisahan yang tinggi bagi protein dan asam nukleat yang berukuran kecil hingga sedang (kira-kira hingga 1 × 106 dalton); 2) dapat menerima ukuran sampel yang relative besar; 3) memiliki interaksi yang minimal antara molekul yang bermigrasi dengan matriks; 4) memiliki matriks yang fisiknya stabil. Elektroforesis melalui gel poliakrilamid dapat meningkatkan resolusi komponen sampel disebabkan oleh separasinya yang berdasarkan penyaringan molekul dan mobilitas elektroforesis.
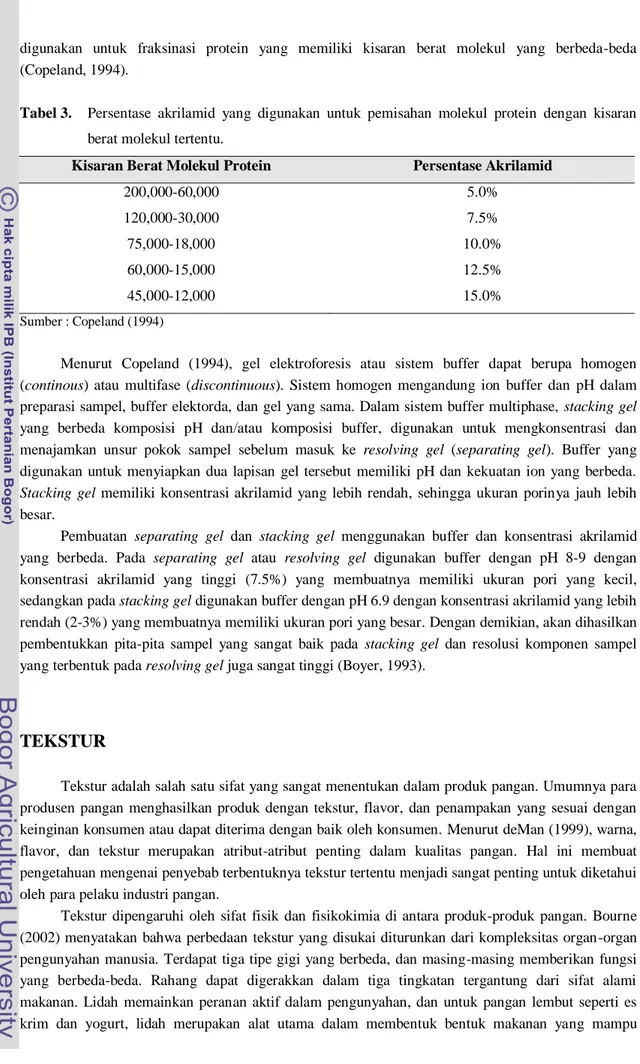
Resolusi berat molekul yang dicapai melalui SDS-PAGE sebagian tergantung pada ukuran pori dari gel polimer. Dengan demikian persentase akrilamid yang digunakan dalam preparasi gel perlu untuk diperhatikan. Persentase akrilamid yang digunakan akan tergantung pada kisaran berat molekul sesuai dengan sampel yang akan dipisahkan. Tabel 3 menunjukkan persentase akrilamid yang dapat
13 digunakan untuk fraksinasi protein yang memiliki kisaran berat molekul yang berbeda-beda (Copeland, 1994).
Tabel 3. Persentase akrilamid yang digunakan untuk pemisahan molekul protein dengan kisaran berat molekul tertentu.
Kisaran Berat Molekul Protein Persentase Akrilamid 200,000-60,000 120,000-30,000 75,000-18,000 60,000-15,000 45,000-12,000 5.0% 7.5% 10.0% 12.5% 15.0% Sumber : Copeland (1994)
Menurut Copeland (1994), gel elektroforesis atau sistem buffer dapat berupa homogen (continous) atau multifase (discontinuous). Sistem homogen mengandung ion buffer dan pH dalam preparasi sampel, buffer elektorda, dan gel yang sama. Dalam sistem buffer multiphase, stacking gel yang berbeda komposisi pH dan/atau komposisi buffer, digunakan untuk mengkonsentrasi dan menajamkan unsur pokok sampel sebelum masuk ke resolving gel (separating gel). Buffer yang digunakan untuk menyiapkan dua lapisan gel tersebut memiliki pH dan kekuatan ion yang berbeda. Stacking gel memiliki konsentrasi akrilamid yang lebih rendah, sehingga ukuran porinya jauh lebih besar.
Pembuatan separating gel dan stacking gel menggunakan buffer dan konsentrasi akrilamid yang berbeda. Pada separating gel atau resolving gel digunakan buffer dengan pH 8-9 dengan konsentrasi akrilamid yang tinggi (7.5%) yang membuatnya memiliki ukuran pori yang kecil, sedangkan pada stacking gel digunakan buffer dengan pH 6.9 dengan konsentrasi akrilamid yang lebih rendah (2-3%) yang membuatnya memiliki ukuran pori yang besar. Dengan demikian, akan dihasilkan pembentukkan pita-pita sampel yang sangat baik pada stacking gel dan resolusi komponen sampel yang terbentuk pada resolving gel juga sangat tinggi (Boyer, 1993).
3.4 TEKSTUR
Tekstur adalah salah satu sifat yang sangat menentukan dalam produk pangan. Umumnya para produsen pangan menghasilkan produk dengan tekstur, flavor, dan penampakan yang sesuai dengan keinginan konsumen atau dapat diterima dengan baik oleh konsumen. Menurut deMan (1999), warna, flavor, dan tekstur merupakan atribut-atribut penting dalam kualitas pangan. Hal ini membuat pengetahuan mengenai penyebab terbentuknya tekstur tertentu menjadi sangat penting untuk diketahui oleh para pelaku industri pangan.
Tekstur dipengaruhi oleh sifat fisik dan fisikokimia di antara produk-produk pangan. Bourne (2002) menyatakan bahwa perbedaan tekstur yang disukai diturunkan dari kompleksitas organ-organ pengunyahan manusia. Terdapat tiga tipe gigi yang berbeda, dan masing-masing memberikan fungsi yang berbeda-beda. Rahang dapat digerakkan dalam tiga tingkatan tergantung dari sifat alami makanan. Lidah memainkan peranan aktif dalam pengunyahan, dan untuk pangan lembut seperti es krim dan yogurt, lidah merupakan alat utama dalam membentuk bentuk makanan yang mampu
14 ditelan, di mana lidah hanya melakukan kerja yang sedikit. Saliva memainkan peranan utama dalam penyiapan makanan sebelum penelanan.
Menurut deMan (1999), tekstur dapat didefinisikan sebagai cara di mana unsur pokok dan elemen-elemen struktur yang bermacam-macam disusun dan digabung ke dalam mikro- dan makrostruktur, dan manifestasi eksternal struktur ini berkenaan dengan aliran dan deformasi. Tekstur juga didefinisikan sebagai manifestasi sensori dari struktur pangan dan cara di mana struktur ini bereaksi untuk menerima gaya, indera spesifik termasuk penglihatan, kinestetik, dan pendengaran (Szczesniak, 1990 yang dikutip oleh Bourne, 2002). Berdasarkan ISO tahun 1992 yang dikutip oleh Bourne (2002), tekstur adalah semua atribut mekanis (permukaan dan geometris) dari produk pangan yang dapat dijelaskan melalui alat mekanis, sentuhan, reseptor visual dan pendengaran.
Szczesniak (1963) yang dikutip oleh Rosenthal (1999), karakteristik tekstur dapat dibagi ke dalam tiga kelas utama, yaitu: 1) karaktersitik mekanis, yaitu yang berhubungan dengan reaksi pangan terhadap tekanan, yang meliputi parameter primer (kekerasan, kohesivitas, viskositas, elastisitas, daya adesif) dan parameter sekunder (daya kunyah, gumminess); 2) karakteristik geometris, yaitu yang berhubungan dengan ukuran, bentuk dan orientasi partikel dalam pangan—seperti, powdery, gritty, lumpy, flaky, fibrous, cellular, aerated, dan crystalline; 3) karakteristik lainnya—yaitu yang berhubungan dengan persepsi atas kadar air dan lemak dalam pangan seperti, kering, basah, dan berminyak.
Menurut Scott-Blair (1958) yang dikutip oleh Rosenthal (1999), teknik instrumental untuk mengukur tekstur pangan dapat digolongkan menjadi tiga golongan, yaitu: 1) pengukuran empiris, yaitu metode untuk mengukur atribut mekanis produk dengan menggabungkan beberapa prinsip percobaan seperti penetrasi, pemotongan, penekanan, dan lain-lain; 2) pengukuran imitative, yaitu metode yang sengaja didesain dengan meniru proses pengunyahan dalam mulut manusia seperti Texture Profile Analysis (TPA); 3) pengukuran fundamental, yaitu metode untuk mengukur atribut reologi atau fisik.
Pengukuran imitatif dilakukan untuk meniru pengunyahan yang biasa terjadi dalam mulut manusia. Alat ini dibuat khusus untuk mengukur stress dan/atau strain selama rangkaian pengujian. Dulu pengujian seperti ini banyak sekali dilakukan, beberapa di antaranya menggunakan gigi-gigi manusia palsu yang saling bergerak, untuk meniru pergerakan dari rahang manusia. Sementara itu ada beberapa indra yang dibuat dengan alat yang memiliki geometri yang mirip dengan mulut manusia, untuk mendapatkan data yang sangat tergantung pada faktor-faktor seperti tipe dan posisi sensori serta gerakan rahang. Akan tetapi beberapa modifikasi kecil pada alat, seperti penggantian gigi-gigi palsu dengan plunger pada area cross-section, sehingga stress yang tepat dapat diaplikasikan, dan hal ini akan membuat alat menghasilkan data yang sangat berguna bagi aplikasi komparatif seperti quality assurance (Rosenthal, 1999).
Pengukuran imitatif yang dapat mewakili semua imajinasi dari banyak ahli teknologi pangan karena pengukurannya yang dapat menyediakan nilai tekstur pangan yang terstandarisasi adalah Texture Profile Analysis (TPA), yang dalam General Foods di pertengahan tahun 1960. Dalam sebuah paper, Szczesniak (1963) dan koleganya menegaskan bermacam-macam istilah yang berhubungan dengan tekstur, yang dapat dilihat pada Tabel 4. Berdasarkan standar-standar sensori yang telah dibuat oleh Szczesniak dan koleganya, alat dengan gaya deformasi yang kompresif dikembangkan. Berdasarkan pada alat yang mendeformasi pangan melalui gerakan yang menyerupai rahang manusia, General Foods Texturometer menggunakan alat semacam plunger yang berujung pipih yang akan kontak langsung dengan sampel makanan guna mengukur tekstur pangan tersebut (Friedman, Whitney, dan Szczesniak, 1963 yang dikutip oleh Rosenthal, 1999).
15 Siklus dua gigitan digunakan, dan stress yang terdapat pada sampel makanan diukur ketika sampel ditekan. Setelah ―gigitan pertama‖ beban dihilangkan dari sampel dan dibiarkan untuk istirahat sebentar. Ketika plunger ditarik menjauh dari permukaan sampel, setiap ketenggangan yang diakibatkan oleh stickiness (kelengketan) akan diobservasi. Alat kemudian menekan sampel untuk kedua kalinya (Gigitan kedua) yang diikuti dengan pengistirahatan yang kedua. Ketahanan pangan selama deformasi dimonitor melalui siklus dua gigitan ini (Rosenthal, 1999). Kurva TPA stress-strain yang ideal ditunjukkan pada Gambar 5.
Dalam usaha untuk menghubungkan definisi tekstur sensorial telah dijelaskan pada Tabel 4, sebuah fungsi matematika diatribusikan ke setiap hal dalam basis data kurva stress-strain yang didapatkan dari teksturometer. Hal ini dicapai melalui ―eksperimen dan pertimbangan yang teliti atas variabel dependen penting‖ (Friedman et al., 1963, p.393). Ilustrasi mengenai bagaimana pengukuran instrumental ini ditentukan telah ditampilkan dalam Tabel 4. Sebagai contoh, kekohesivitasan didefinisikan sebagai rasio dari tenaga yang dibutuhkan untuk menekan sampel pada gigitan kedua dengan tenaga yang dibutuhkan untuk menekan sampel pada gigitan pertama.
Lebih jelasnya, kekohesivitasan ditentukan dengan cara menghitung rasio dari area di bawah dua puncak kurva yang sama dengan dua kali gigitan dalam mulut manusia. Bukti bahwa alat yang digunakan sesuai dengan panel sensori, dicapai dengan mengkorelasikan penilaian sensori yang telah dilakukan dengan output dari teksturometer. Garis atau kurva yang paling tepat kemudian dicocokkan dengan data (Szczesniak et al., 1963 yang dikutip oleh Rosenthal, 1999).
Sudah jelas bahwa pengembangan dari TPA telah memberikan kontribusi yang sangat berharga bagi pengukuran nilai tekstur pangan. Bagaimanapun, kehati-hatian tetap harus dilakukan dalam menerima hasil bagi tujuan-tujuan lain selain evaluasi komparatif. Tekniknya jelas sekali merupakan tiruan dari apa yang terjadi di dalam mulut. Tapi harus dicatat bahwa cukup selain perbedaan-perbedaan, yang teridentifikasi lebih awal, antara pengujian dengan alat dan oleh manusia (seperti kontrol suhu, saliva), hubungan antara beberapa karakteristik sensori yang dimaksudkan untuk diukur melalui TPA tidaklah linier (Rosenthal, 1999). Sebagai contoh, menurut Szczesniak et al (1963) yang dikutip Rosenthal (1999), saat tingkat kekerasan sensori berada pada 1 dan 2 terdapat sekitar 10 unit teksturometer, sedangkan saat tingkat kekerasan sensori berada pada 8 dan 9 terdapat sekitar 70 unit teksturometer.
Gambar 5. Aspek-aspek kurva texture profile analysis (Rosenthal, 1999)
Gigitan pertama Gigitan kedua
16 Kelebihan lain dari TPA sebagaimana diukur dengan teksturometer adalah bahwa alat tersebut memiliki aksi berayun hasil dari konstruksi pivotal (analog dengan sendi temporomandibular). Wilayah kontak antara bidang horizontal sampel dan plunger berujung pipih akan bervariasi, awalnya menjadi kecil dulu dan kemudian dengan cepat meningkat hingga semuanya kontak dengan sampel makanan.
Meskipun terdapat kekurangan-kekurangan seperti ini, besarnya ketersediaan mesin pengujian kompresif gaya deformasi lainnya di pasar telah mendorong penggunaan metode TPA untuk pengujian komparatif dibandingkan dengan menggunakan alat lainnya. Sebagai contoh, Bourne (1996) mengganti mesin pengujian Instron Universal dan menggunakan TPA untuk membandingkan tingkat kematangan buah pear yang berbeda-beda (Rosenthal, 1999).
Selama TPA terbatas pada pengujian komparatif, beberapa dari kekurangan ini tidaklah menjadi masalah, tapi jika pekerja mengabaikan poin seperti ini dan memperlakukan analog instrumental atas istilah-istilah sensori ini sebagai nilai absolut, maka basisnya dapat beresiko. Szczesniak dan Hall (1975) mengenali potensi ini sebagai penyalahgunaan dan menyatakan bahwa ―penggunaan teksturometer yang tepat masih lebih seperti seni karena operatornya harus menggunakan pemikiran yang tidak mampu dilakukan oleh alat tersebut‖ (Rosenthal, 1999).
Szczesniak (1975) menggunakan TPA untuk menguji gel gelatin dan gel karagenan. Sehingga beberapa hal yang biasa terdapat di antara gel-gel percobaan, dapat dimasukkan ke dalam tingkat kekuatan gel yang sama seperti yang telah diukur dengan menggunakan Bloom Gelometer. Ketika kekuatan Bloom sama, perbedaan kekerasan dan daya adesif dalam TPA menjadi jelas. Aspek menarik dari studi mereka adalah bahwa pengukuran TPA dilakukan pada kisaran suhu tertentu. Hasil dari penganekaragam suhu pengujian dari 10oC hingga 20oC yaitu penurunan yang dramatis pada kekerasan gel gelatin, agaknya disebabkan oleh pelelehan. Sebaliknya gel karagenan, yang tidak meleleh, hanya menunjukkan pengurangan yang sedikit pada kekerasannya. Tingkat kekohesivan dari gel karagenan dan gel gelatin tampak hampir tak dapat dibedakan satu sama lain dan susah berubah di sepanjang gradien suhu (Rosenthal, 1999).
Henry, Katz, Pilgrim, dan May (1971) yang dikutip Rosenthal (1999) melakukan TPA pada makanan berjenis semisolid (seperti gel gelatin). Di samping karakteristik yang diidentifikasikan di Tabel 4, mereka menentukan lima variabel lagi, yang berhubungan dengan sifat material selama upstroke ketika plunger ditarik menjauh dari sampel. Di samping pengujian instrumental, mereka juga melakukan evaluasi sensori pada makanan.
Penggunaan analisis korelasi di setiap atribut memperkenankan identifikasi terhadap empat faktor yang bertanggungjawab atas 95% perbedaan sensori. Masing-masing faktor berkolerasi baik dengan atribut-atribut spesifik. Sebagai contoh, 33% dari perbedaan sensori dijelaskan oleh faktor yang didasarkan pada ―stringy dan sticky‖. Regresi berlipat kemudian diimplementasikan kepada keempat faktor sensori dan setiap pengukuran instrumental. Telah ditemukan bahwa faktor-faktor sensori dapat dijelaskan hanya dengan menggunakan delapan pengukuran instrumental, dan menurut mereka, dalam kasus pangan semisolid, banyak data yang didapat dari TPA yang justru berlebih (Rosenthal, 1999).
17 Tabel 4. Parameter-parameter yang diukur oleh analisis profil tekstur
Parameter Definisi Sensorial Definisi Instrumetal Kekerasan Gaya yang dibutuhkan untuk
menekan produk pangan di antara geraham
Elastisitas Besaran di mana sebuah produk pangan kembali ke ukuran aslinya ketika beban dihilangkan
Siklus= Kontak kedua – Kontak pertama Elastisitas = Siklus untuk material inelastik
- Siklus untuk pangan Daya adesif Energi yang dibutuhkan untuk
menarik pangan menjauh dari permukaan
Daya kohesif Kekuatan ikatan internal yang membangun pangan
Kerapuhan Gaya yang membuat material remuk
Daya kunyah Energi yang dibutuhkan untuk mengunyah pangan padat hingga siap untuk ditelan
= Kekerasan x Daya Kohesif x Elastisitas
Kelengketan Energi yang dibutuhkan untuk menghancurkan pangan semi padat sehingga mudah untuk ditelan
= Kekerasan x Daya Kohesif
Sumber : Rosenthal (1999)
Daya Kohesif = B/A
Kerapuhan Kekerasan