LAPORAN PRAKTIKUM KIMIA FISIKA
PENENTUAN
BERAT MOLEKUL BERDASARKAN
PENGUKURAN MASSA JENIS GAS
OLEH:
IRMA MULYANI 1313031073
KOMANG AYU WIDIA ANTARI 1313031078
ADI RAHMAN 1413031022
JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENDIDIKAN ALAM UNIVERSITAS PENDIDIKAN GANESHA
I. JUDUL
II. TUJUAN
: Penentuan Berat Molekul Berdasarkan Pengukuran Massa Jenis Gas
1. Menentukan berat molekul senyawa CHCl3 dan zat unknown X
berdasarkan pengukuran massa jenis gas secara eksperimen 2. Menentukan zat unknown X berdasarkan berat molekul hasil
eksperimen III. DASAR TEORI
Gas mempunyai sifat bahwa molekul-molekulnya sangat berjauhan satu sama lain sehingga hampir tidak ada gaya tarik menarik atau tolak menolak diantara molekul-molekulnya sehingga gas akan mengembang dan mengisi seluruh ruang yang ditempatinya, bagaimana pun besar dan bentuknya. Untuk memudahkan mempelajari sifat-sifat gas ini maka diasumsikan sifat gas ini sesuai dengan sifat-sifat gas ideal yaitu:
a. Tidak ada gaya tarik menarik di antara molekul-molekulnya. b. Volume dari molekul-molekul gas sendiri diabaikan.
c. Tidak ada perubahan energi dalam (internal energy = E).
Semua gas yang dikenal sehari-hari termasuk gas nyata, sedangkan gas ideal pada kenyataannya tidak pernah ada, namun sifat-sifatnya didekati oleh gas sejati pada tekanan yang sangat rendah. Jadi pada tekanan mendekati nol semua gas memenuhi sifat gas ideal, sehingga persamaan PV = nRT
Densiti dari gas dipergunakan untuk menghitung berat molekul suatu gas, dengan cara membendungkan suatu volume gas yang akan dihitung berat molekulnya dengan berat gas yang telah diketahui berat molekulnya (sebagai standar) pada temperatur atau suhu dan tekanan yang sama. Densiti gas didefinisikan sebagai berat gas dalam gram per liter. Untuk menentukan berat molekul ini maka ditimbang sejumlah gas tertentu kemudian diukur PV dan T-nya.
molekul maka n dapat diubah dalam bentuk massa perberat molekul, sehingga persamaan gas ideal menjadi :
(1)
Persamaan 1 dapat diubah menjadi: P(BM) = ( m
V x RT ) (2)
atau (3)
Dimana:
BM = Berat molekul P = Tekanan gas (atm) n = Jumlah mol
V = Volume gas (Liter) T = Suhu (K)
R = Konstanta gas (0,08206 liter atm mol-1K-1)
ρ = Densitas gas (gram/Liter)
Bila suatu zat cair yang bersifat volatil dengan titik didih lebih kecil dari 100oC ditempatkan dalam labu erlenmeyer bertutup yang mempunyai lubang kecil
pada bagian tutupnya, dan kemudian labu erlenmeyer tersebut dipanaskan sampai suhu 100oC, maka cairan tersebut akan menguap. Uap yang dihasilkan akan
mendorong udara yang terdapat pada labu erlenmeyer dan keluar melalui lubang-lubang kecil. Setelah semua udara yang keluar, pada akhirnya uap ini berhenti keluar. Hal ini terjadi apabila keadaan kesetimbangan dicapai, yaitu tekanan uap cairan dalam labu erlenmeyer sama dengan tekanan udara luar. Pada keadaan kesetimbangan ini, labu erlenmeyer hanya berisi uap cairan dengan tekanan sama dengan tekanan atmosfer, volume sama dengan volume labu erlenmeyer, dan suhu sama dengan titik didih air dalam penangas air (kira-kira 100oC). Labu erlenmeyer ini kemudian diambil
dari penangas air, didinginkan dan ditimbang sehingga massa gas yang terdapat di dalamnya dapat diketahui.
Faktor koreksi digunakan untuk menentukan tingkat kesalahan. Nilai berat molekul (BM) hasil perhitungan akan mendekati nilai sebenarnya, tetapi juga terkadang terdapat kesalahan-kesalahan. Ketika labu erlenmeyer kosong ditimbang, labu ini penuh dengan udara. Setelah pemanasan dan pendinginan dalam desikator, tidak semua uap cairan ke bentuk cairannya, sehingga akan mengurangi jumlah udara yang masuk kembali ke dalam labu erlenmeyer. Jadi massa labu erlenmeyer dalam
PV=nRT atau P V = m
BM x RT
keadaan ini lebih kecil daripada massa labu erlenmeyer dalam keadaan semua uap cairan kembali ke bentuk cairnya. Oleh karena itu, massa cairan yang sebenarnya harus ditambahkan dengan massa udara yang tidak dapat masuk kembali ke dalam labu erlenmeyer karena adanya uap cairan yang tidak mengembun. Massa udara tersebut di atas dapat dihitung dengan mengasumsikan bahwa tekanan parsial udara yang tidak dapat masuk sama dengan tekanan uap cairan pada suhu kamar, dengan faktor koreksi:
Yangmana, P adalah tekanan uap (mmHg) dan t adalah suhu kamar (oC). Jadi dengan
menggunakan rumus di atas, tekanan uap pada berbagai suhu dapat diketahui.
Dengan menggunakan nilai tekanan uap pada suhu kamar, bersama-sama dengan data mengenai volume labu erlenmeyer dan berat molekul udara (28,8 gram/mol) dapat dihitung faktor koreksi yang harus ditambahkan pada massa cairan. Dengan menggunakan faktor koreksi akan dapat diperoleh nilai berat molekul (BM) yang lebih tepat.
Berikut disajikan tabel beberapa senyawa volatil dan berat molekul (BM) beberapa senyawa.
No Nama Berat Molekul
1 Ether 74
2 Dichloromethane 72
3 Chlorobenzene 113
4 Chloroform 119.5
5 Dibutyl ether 130
(Vogel, 1989) Kloroform
Kloroform adalah nama umum untuk triklorometana (CHCl3). Kloroform
dikenal karena sering digunakan sebagai bahan pembius, meskipun kebanyakan digunakan sebagai pelarut nonpolar di laboratorium atau industri. Wujudnya pada suhu ruang berupa cairan, namun mudah menguap. (Wikipedia, 2013)
Pada suhu normal dan tekanan, kloroform adalah cairan yang sangat mudah menguap, jernih, tidak berwarna, berat, sangat bias, dan tidak mudah terbakar. Massa molar secara teoritis sebesar 119,5 g/mol. Densitas senyawa ini sebesar 1,48 g/cm3
dengan titik lebur sebesar -63,5 °C dan titik didih sebesar 61,2 °C. Kelarutan dalam
air 0,8 g/100 ml pada 20°C dengan bentuk molekul tetrahedral (Anonim, 2013).
log
P
=
6,90328
−
1163
,
03
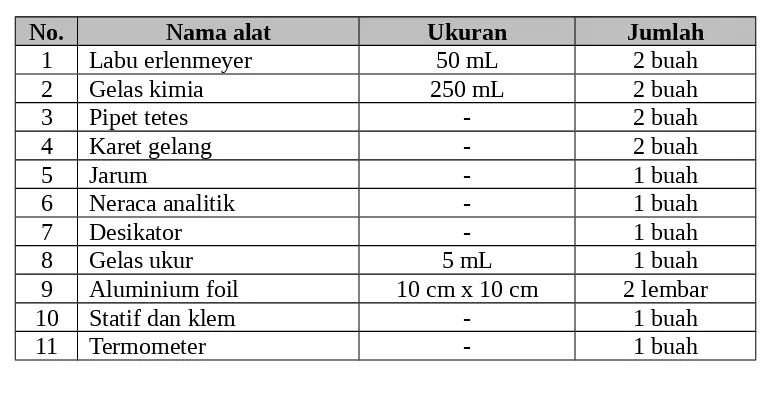
IV. ALAT DAN BAHAN Tabel alat
No. Nama alat Ukuran Jumlah
1 Labu erlenmeyer 50 mL 2 buah
2 Gelas kimia 250 mL 2 buah
3 Pipet tetes - 2 buah
4 Karet gelang - 2 buah
5 Jarum - 1 buah
6 Neraca analitik - 1 buah
7 Desikator - 1 buah
8 Gelas ukur 5 mL 1 buah
9 Aluminium foil 10 cm x 10 cm 2 lembar
10 Statif dan klem - 1 buah
11 Termometer - 1 buah
Tabel bahan
No. Nama bahan Konsentrasi Jumlah
1 Cairan volatil yaitu kloroform (CHCl3)
- 5 mL
V. PROSEDUR KERJA DAN HASIL PENGAMATAN No
.
PROSEDUR KERJA HASIL PENGAMATAN
Senyawa Kloroform
1 Sebuah labu erlenmeyer berleher kecil yang bersih dan kering ditutup dengan aluminium foil, kemudian tutup dikencangkan menggunakan karet gelang.
Gambar1. Labu erlenmeyer kosong yang ditutup dengan alumunium foil+karet gelang
2. Labu erlenmeyer kosong ditimbang dengan menggunakan neraca analitik
Berat labu erlenmeyer kosong sebesar 68,7187 gram
3 Labu erlenmeyer beserta aluminium foil dan karet gelang ditimbang dengan menggunakan neraca analitik.
Berat labu erlenmeyer di tutup dengan aluminium foil dan karet gelang sebesar 69,2789 gram
4 5 mL zat cair volatil (CHCl3) dimasukkan
ke dalam labu erlenmeyer, selanjutnya
Berat labu erlenmeyer yang sudah berisi larutan CHCl3 kemudian ditutup aluminium
Erlenmeyer
ditutup kembali dengan kertas aluminium foil dan dikencangkkan dengan karet gelang erat-erat sehingga tutup ini bersifat kedap udara. Kemudian aluminium foil dilubangi dengan menggunakan jarum, agar uap dapat keluar.
foil dan karet sebesar 76,27 gram
Labu telah dilubangi dengan jarum. 5 Labu erlenmeyer direndam dalam
penangas air bersuhu ± 100oC sedemikian
rupa sehingga air ± 1 cm di bawah aluminium foil. Labu erlenmeyer dibiarkan dalam penangas air sampai semua larutan volatil (CHCl3) menguap. Kemudian Suhu
penangas air dicatat.
Labu direndam dalam penangas air dan semua larutan CHCl3 menguap pada suhu
95oC → 368 K
6 Setelah semua larutan kloroform (CHCl3)
dalam labu erlenmeyer menguap, labu erlenmeyer kemudian diangkat dan dikeringkan bagian luar labu erlenmeyer dengan lap. Selanjutnya labu didinginkan dalam desikator. Udara akan masuk kembali ke labu Erlenmeyer melalui lubang kecil tadi dan uap cairan volatil yang terdapat dalam labu Erlenmeyer akan kembali mengembun menjadi cairan.
Terlihat embun pada dinding labu erlenmeyer pada saat didinginkan dalam desikator. Setelah lama, sudah tidak terdapat embun
7 Labu erlenmeyer yang telah dingin ditimbang dengan neraca analitik (tutup aluminium foil beserta karet gelang tidak dilepaskan sebelum labu tersebut ditimbang).
Labu erlenmeyer yang sudah didinginkan yang berisi larutan kloroform kemudian ditimbang = 69,89 gram
8
Volume labu erlenmeyer ditentukan dengan cara mengisi labu erlenmeyer dengan air sampai penuh dan massa air
yang terdapat dalam labu Erlenmeyer diukur. Selanjutnya suhu air dalam labu erlenmeyer diukur, dimana volume air dapat diketahui bila massa jenis air pada suhu air dalam labu erlenmeyer diketahui
dengan menggunakan rumus: ρ= m
V
9 Tekanan atmosfer diukur dengan menggunakan barometer.
765 mmHg
765/760 = 1,006 atm
Zat Unknown X
1 Sebuah labu erlenmeyer berleher kecil yang bersih dan kering ditutup dengan aluminium foil, kemudian tutup dikencangkan menggunakan karet gelang.
Labu erlenmeyer kosong yang ditutup dengan alumunium foil+karet gelang
2 Labu erlenmeyer kosong ditimbang dengan menggunakan neraca analitik
Berat labu erlenmeyer kosong sebesar 65,4272
3 Labu erlenmeyer beserta aluminium foil dan karet gelang ditimbang dengan menggunakan neraca analitik.
4 5 mL zat cair volatil sampel unknown dimasukkan ke dalam labu erlenmeyer, selanjutnya ditutup kembali dengan kertas aluminium foil dan dikencangkkan dengan karet gelang erat-erat sehingga tutup ini bersifat kedap udara. Kemudian aluminium foil dilubangi dengan menggunakan jarum, agar uap dapat keluar.
Berat labu erlenmeyer yang berisi larutan sampel unknown ditutup aluminium foil dan karet sebesar 73,26 gram
Labu erlenmeyer dilubangi dengan jarum. 5 Labu erlenmeyer direndam dalam
penangas air bersuhu ± 100oC sedemikian
rupa sehingga air ± 1 cm di bawah aluminium foil. Labu erlenmeyer dibiarkan dalam penangas air sampai semua larutan sampel unknown menguap. Kemudian Suhu penangas air dicatat.
Labu direndam dalam penangas air dan sampel semua menguap pada suhu 93oC
→ 366 K
6 Setelah semua larutan sampel unknown dalam labu erlenmeyer menguap, labu erlenmeyer kemudian diangkat dan dikeringkan bagian luar labu erlenmeyer dengan lap. Selanjutnya labu didinginkan dalam desikator. Udara akan masuk kembali ke labu Erlenmeyer melalui
Terlihat emnun pada dinding erlenmeyer pada saat didinginkan dalam desikator.
lubang kecil tadi dan uap cairan volatil yang terdapat dalam labu Erlenmeyer akan kembali mengembun menjadi cairan. 7 Labu erlenmeyer yang telah dingin
ditimbang dengan neraca analitik (tutup aluminium foil beserta karet gelang tidak dilepaskan sebelum labu tersebut ditimbang).
Labu erlenmeyer yang berisi sampel unknown yang telah didinginkan sebesar 66,583 gram
8
Volume labu erlenmeyer ditentukan dengan cara mengisi labu erlenmeyer dengan air sampai penuh dan massa air yang terdapat dalam labu Erlenmeyer diukur. Selanjutnya suhu air dalam labu erlenmeyer diukur, dimana volume air dapat diketahui bila massa jenis air pada suhu air dalam labu erlenmeyer diketahui
dengan menggunakan rumus: ρ= m
V
Massa air = 147,07 Volume air = 0,1477 L
8 Tekanan atmosfer diukur dengan menggunakan barometer.
Tekanannya 765 mmHg 765/760 = 1,006 atm
Hasil Pengamatan Senyawa CHCl3
No Pengamatan Hasil
1 Berat Erlenmeyer kosong 68,7188 gram
2 Berat Erlenmeyer + aluminium foil + karet 69,2789 gram 3 Berat Erlenmeyer + aluminium foil + karet + CHCl3 76,27 gram
4 Suhu penangas air 93 0C
6 Berat setelah dingin 69,89 gram
7 Massa labu + air 216 gram
8 Suhu air 30 0C
Hasil pengamatan zat unknown X
No Pengamatan Hasil
1 Berat Erlenmeyer kosong 65,4272 gram
2 Berat Erlenmeyer + aluminium foil + karet 66,0350 gram
3 Berat Erlenmeyer + aluminium foil + karet + zat
unknown X 73,26 gram
4 Suhu penangas air 92 0C
5 Suhu saat zat unknown X habis menguap 93 0C
6 Berat setelah dingin 66,583 gram
7 Massa labu + air 212,5 gram
8 Suhu air 30oC
VI. PEMBAHASAN
Percobaan ini berjudul Penentuan Berat Molekul Berdasarkan Pengukuran Massa Jenis Gas. Adapun tujuan dari percobaan ini adalah 1) Menentukan berat molekul senyawa CHCl3 dan zat unknown X berdasarkan
pengukuran massa jenis gas secara eksperimen 2) Menerapkan persamaan gas ideal dalam menentukan berat molekul senyawa CHCl3 dan zat unknown X secara
eksperimen 3) Menentukan zat unknown X berdasarkan berat molekul hasil eksperimen.
Penentuan berat molekul senyawa CHCl3 dan zat unknown X dapat
ditentukan dengan mengkombinasikan persamaan gas ideal dengan massa jenis sehingga didapat suatu persamaan yang digunakan untuk menentukan berat molekul dari senyawa CHCl3 dan zat unknown X. Berat molekul dari zat
unknown X yang telah diketahui kemudian dapat ditentukan senyawanya. Dalam penentuan berat molekul senyawa CHCl3 dan zat unknown X terdapat faktor
koreksi yang harus diperhatikan agar nilai dari berat molekul yang didapatkan lebih akurat.
Akibatnya, massa labu erlenmeyer kosong lebih kecil dari massa labu erlenmeyer dalam keadaan semua uap kembali ke bentuk cair. Oleh karena itu, massa sebenarnya dari cairan volatil harus ditambahkan dengan massa udara yang tidak bisa kembali ke dalam labu erlenmeyer karena uap cairan terkondensasi. Massa udara dapat dihitung dengan mengasumsikan bahwa tekanan parsial udara yang tidak bisa masuk sama dengan tekanan uap cairan volatil pada suhu kamar menggunakan rumus factor koreksi berikut:
logP=6,90328−1163,03 227,4+T
Senyawa volatil yang akan ditentukan berat molekulnya dalam percobaan ini adalah CHCl3 dan zat unknown X. Berdasarkan hasil penelitian yang telah
dilakukan, berat molekul yang diperoleh dari masing-masing senyawa ini dapat dilihat dari perhitungan berikut:
1. Penentuan berat molekul senyawa CHCl3 Tanpa Faktor Koreksi Diketahui:
Massa Erlenmeyer + aluminium foil + karet gelang = 69,2789 gram
Massa Erlenmeyer + aluminium foil + karet gelang + CHCl3 = 76,27gram
Massa jenis air (ρ) adalah 0,9957 gram/cm3 ( pada temperatur 30°C)
Massa labu erlenmeyer + air = 216 gram
Massa labu erlenmeyer kosong = 68,7188 gram
Suhu penangas air = 930C
Suhu cairan habis menguap = 950C = 3680K
Massa CHCl3 setelah didinginkan = 69,89 gram
Tekanan udara = 765 mmHg
R adalah 0,08206 liter atm mol-1 K-1
Berat molekul (BM) CHCl3 yang sebenarnya adalah 119,5 gram/mol
Dihitung:
Berat molekul CHCl3 = .... ?
Perhitungannya adalah sebagai berikut:
Massa zat CHCl3 = (massa labu erlenmeyer + aluminium foil + karet
gelang + CHCl3 setelah didinginkan) - (massa labu erlenmeyer +
= 0,6111 gram
Tekanan udara di ruangan setelah diukur dengan barometer adalah 765
mmHg
Tekanan udara = 765760mmHgmmHgx1atm
= 1,0065 atm
Volume air dihitung dengan menggunakan massa jenis air
Massa air = (massa labu erlenmeyer + air) – (massa labu Erlenmeyer kosong)
= 216 gram – 68,7188 gram = 147,28 gram
Massa jenis air pada suhu 30°C = 0,9957 gram/cm3
¿ massa air
volume air
volume air=massa air
❑
volume air= 147,28gram 0,9957gram/cm3
= 147,91cm3
= 0,14791L
Volume air = volume erlenmeyer = 0,14791L
Menghitung massa jenis gas
¿ massa senyawa CHCl3
volume labu erlenmeyer
¿0,6111gram 0,14791L
¿4,131gram L
Berat molekul (BM) CHCl3
PV=nRT
PV=( m
BM)RT
P BM=(m
V)RT P BM=RT
BM=RT
BM=
4,131gram
L ×0,08206L atmmol
−1
K−1
×368K
1,0065atm
BM=123.94 gram mol
KR
= |
BM hasil percobaan
−
BM
sec
ara teoritis
BM
sec
ara teoritis
| ×
100
= |
123
,
94
−
119
,
5
119
,
5
| ×
100
=
3,71
2. Penentuan berat molekul senyawa CHCl3 Dengan Faktor Koreksi Diketahui:
BMudara adalah 28,8 gram/mol
Suhu air adalah 30ºC = 303 K
Suhu penangas air adalah 95ºC = 3680 K
Dihitung:
Berat molekul CHCl3 = .... ?
Perhitungannya adalah sebagai berikut: logP=6,90328− 1163,03
(227,4+T)
logP=6,90328− 1163,03 (227,4+300C
)
logP=6,90328−1163,03 257,4 P=¿6,90328−4,51
log¿
P=¿2,39328 log¿ P = 247,33
P=247,33mmHg
760mmHg x1atm
¿0,325atm
Menghitung massa udara yang tidak masuk
massaudara=PV BMudara
massaudara=0,325atm ×0,14791L ×28,8gram/mol 0,08206L atm mol−1
K−1
×303K
massaudara=0,05567gram
Menghitung berat jenis udara
❑udara=massa volatil+massa udara
Volume labu
¿(0,6111+0,05567)gram 0,14791L
¿4,5079gram/L
Menghitung berat molekul
BM=RT
P
BM=4,5079gram/L×0,08206Latm mol −1
K−1
×368K 1,0065atm
BM=135,25gram/mol
KR
= |
BM hasil percobaan
−
BM
sec
ara teoritis
BM
sec
ara teoritis
| ×
100
= |
135,25
−
119
,
5
119
,
5
| ×
100
=
13
,
17
Dengan menggunakan faktor koreksi justru kesalahan relatifnya semakin besar, hal ini mungkin dikarenakan pemanasan yang dilakukan saat menguapkan kloroform dan juga pendinginan yang kurang lama, sehingga mengakibatkan banyak udara yang tidak dapat masuk kembali ke erlenmeyer dan menyebabkan faktor koreksi semakin besar
3. Penentuan berat molekul senyawa Unknown Tanpa Faktor Koreksi Diketahui:
Massa Erlenmeyer kosong = 65,4272 gram
Massa Erlenmeyer + aluminium foil + karet gelang = 66,0350 gram
Massa Erlenmeyer + aluminium foil + karet gelang + zat unknown x = 73,26 gram
Massa jenis air (ρ) adalah 0,9957 gram/cm3 ( pada temperatur 30°C)
Suhu penangas air = 920C
Suhu cairan habis menguap = 930C = 3660K
R adalah 0,08206 liter atm mol-1 K-1
Dihitung:
Berat molekul senyawa volatile unknown = .... ?
Perhitungannya adalah sebagai berikut:
Massa zat volatil unknown = (massa labu erlenmeyer + aluminium foil + karet gelang + zat volatil setelah didinginkan) - (massa labu erlenmeyer + aluminium foil+ karet gelang)
= 66,583 gram – 66,0350 gram = 0,548 gram
Tekanan udara di ruangan setelah diukur dengan barometer adalah 765 mmHg
Tekanan udara = 765mmHg
760mmHgx1atm = 1,0065 atm
Volume labu erlenmeyer dihitung dengan menggunakan massa jenis air
Massa air = (massa labu erlenmeyer + air) – (massa labu Erlenmeyer kosong)
= 212,5 gram – 65,4272 gram = 147,07 gram
¿ massa air
volume air
volume air=massa air
❑
volume air= 147,07gram 0,9957gram/cm3
= 147,70cm3
= 0,14770L
Menghitung massa jenis gas volume labu=volume air
= 0,14770L
¿massa senyawa unknown
¿0,548gram 0,14770L
¿3,71gram L
Berat molekul (BM) senyawa unknown PV=nRT
PV=( m
BM)RT
P BM=(m
V)RT P BM=RT
BM=RT
P
BM=
3,71gram
L ×0,08206Latm mol
−1
K−1
×366K
1,0065atm
BM=110,7gram mol
Berdasarkan berat molekul yang diperoleh maka dapat diduga senyawa unknown tersebut merupakan klorofofm. Sehingga perhitungan kesalahan relative dapat dibandingkan dengan berat molekul kloroform secara teoritis yaitu 119,5 gram. Perhitungannya sebagai berikut:
KR
= |
BM hasil percobaan
−
BM
sec
ara teoritis
BM
sec
ara teoritis
| ×
100
= |
110
,
7
−
119
,
5
119
,
5
| ×
100
=
7,3
4. Penentuan berat molekul senyawa Unknown Dengan Faktor Koreksi Diketahui:
BMudara adalah 28,8 gram/mol
Suhu air adalah 30ºC = 303 K
Suhu cairan habis menguap adalah 93ºC = 3660 K
Dihitung:
Perhitungannya adalah sebagai berikut: logP=6,90328− 1163,03
(227,4+T)
logP=6,90328− 1163,03 (227,4+300C)
logP=6,90328−1163,03 257,4 P=¿6,90328−4,51
log¿
P=¿2,39328 log¿ P = 247,33
P=247,33mmHg
760mmHg x1atm
¿0,325atm
Menghitung massa udara yang tidak masuk
massaudara=
PV BMudara RT
massaudara=0,325atm ×0,14770L ×28,8gram/mol 0,08206Latm mol−1
K−1
×303K
massaudara=0,055gram
Menghitung berat jenis udara
❑udara=massa volatil+massaudara volumelabu
¿(0,548+0,055)gram 0,14770L
¿4,082gram/L
Menghitung berat molekul
BM=RT
P
BM=4,082gram/L ×0,08206Latm mol
−1K−1×366K
1,0065atm
KR
= |
BM hasil percobaan
−
BM
sec
ara teoritis
BM
sec
ara teoritis
| ×
100
= |
121,80
−
119
,
5
119
,
5
| ×
100
=
1,9
Walaupun perhitungan yang dilakukan telah menggunakan faktor koreksi namun, masih terdapat penyimpangan nilai berat molekul CHCl3 dan
sampel unknown X yang tidak tepat 119,5gram/mol. Adanya perbedaan berat molekul CHCl3 dan sampel unknown ini disebabkan oleh beberapa faktor
kesalahan yaitu:
a. Uap senyawa volatil tidak berkondensasi secara sempurna ketika labu erlenmeyer didinginkan dalam desikator
b. Penguapan senyawa volatil yang dilakukan kurang sempurna, masih ada beberapa senyawa volatil yang belum teruapkan.
c. Penguapan senyawa volatil yang terlalu lama mengakibatkan senyawa volatil keluar dari dalam labu erlenmeyer
VII. KESIMPULAN
Massa jenis gas kloroform yang di dapat yaitu sebesar ¿4,131gram L dan
massa jenis gas zat unknown x yang di dapat yaitu sebesar ¿3,71gram
L dengan
menerapkan hukum gas ideal dengan persamaan BM=RT
P sehingga didapat
berat molekul dari senyawa kloroform adalah 123.94grammol sedangkan berat
molekul dari senyawa unknown x adalah 110,7gram
DAFTAR PUSTAKA
Retug, Sastrawidana. 2003. Penuntun Praktikum Kimia Fisika. Singaraja: Jurusan Pendidikan Kimia, Fakultas Pendidikan MIPA, IKIP Negeri Singaraja.
JAWABAN PERTANYAAN