OLIMPIADE SAINS NASIONAL 2011
Manado
11-16 September 2011
Ujian Praktikum
Bidang Kimia
13 September 2011
Waktu 270 menit
Kementerian Pendidikan Nasional Direktorat Jenderal
Managemen Pendidikan Dasar dan Menengah Direktorat Pembinaan Sekolah Menengah Atas
Petunjuk :
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban). Tulis dengan huruf cetak dan jangan disingkat !
2. Soal Praktikum ini terdiri dari 2 bagian. TOTAL Poin = 140
Percobaan dilakukan dalam 2 babak praktikum dan 2 kelompok praktikum. Dalam setiap babak masing masing kelompok hanya melakukan 1 percobaan, soal 1 atau 2.
3. Anda diberikan waktu selama 15 menit untuk membaca setiap soal. 4. Total waktu yang disediakan: 270 menit.
Percobaan 1 = 120 menit dan Percobaan 2 = 150 menit.
Terdapat jeda 30 menit antara kelompok 1 dan 2. Siswa tidak diperkenankan meninggalkan ruangan laboratorium.
5. Semua jawaban harus ditulis di lembar jawaban yang tersedia 6. Diperkenankan menggunakan kalkulator.
7. Tabel Periodik Unsur sudah disediakan.
8. Anda dapat mulai bekerja bila sudah ada tanda mulai dari pengawas. 9. Anda harus segera berhenti bekerja bila ada tanda berhenti dari Pengawas. 10. Letakkan jawaban Anda di meja sebelah kanan dan segera meninggalkan ruangan. 11. Setelah praktikum selesai, Anda dapat membawa pulang soal ujian !!
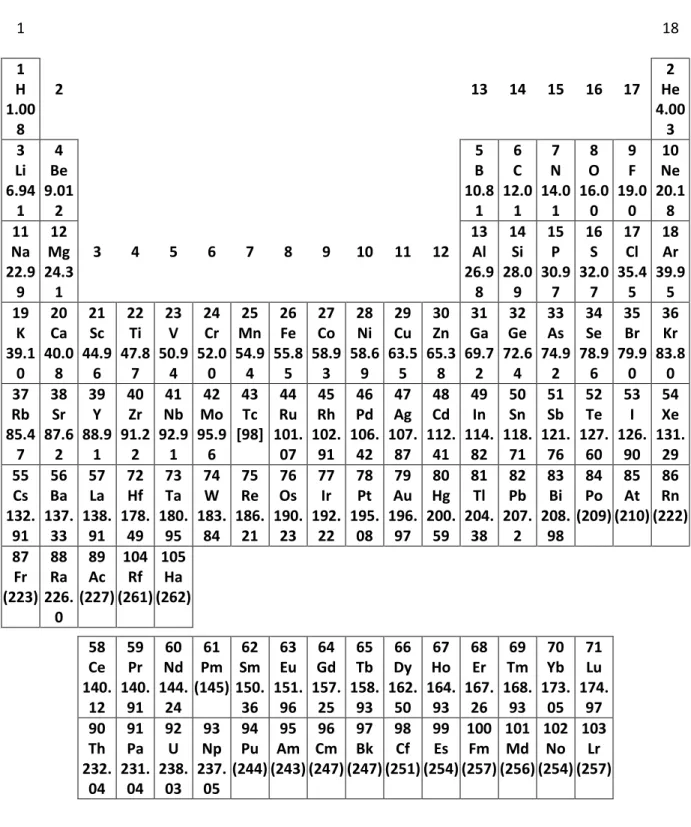
Tabel Periodik Unsur dengan Massa Atom Relatif 1 18 1 H 1.00 8 2 13 14 15 16 17 He2 4.00 3 3 Li 6.94 1 4 Be 9.01 2 5 B 10.8 1 6 C 12.0 1 7 N 14.0 1 8 O 16.0 0 9 F 19.0 0 10 Ne 20.1 8 11 Na 22.9 9 12 Mg 24.3 1 3 4 5 6 7 8 9 10 11 12 13Al 26.9 8 14 Si 28.0 9 15 P 30.9 7 16 S 32.0 7 17 Cl 35.4 5 18 Ar 39.9 5 19 K 39.1 0 20 Ca 40.0 8 21 Sc 44.9 6 22 Ti 47.8 7 23 V 50.9 4 24 Cr 52.0 0 25 Mn 54.9 4 26 Fe 55.8 5 27 Co 58.9 3 28 Ni 58.6 9 29 Cu 63.5 5 30 Zn 65.3 8 31 Ga 69.7 2 32 Ge 72.6 4 33 As 74.9 2 34 Se 78.9 6 35 Br 79.9 0 36 Kr 83.8 0 37 Rb 85.4 7 38 Sr 87.6 2 39 Y 88.9 1 40 Zr 91.2 2 41 Nb 92.9 1 42 Mo 95.9 6 43 Tc [98] 44 Ru 101. 07 45 Rh 102. 91 46 Pd 106. 42 47 Ag 107. 87 48 Cd 112. 41 49 In 114. 82 50 Sn 118. 71 51 Sb 121. 76 52 Te 127. 60 53 I 126. 90 54 Xe 131. 29 55 Cs 132. 91 56 Ba 137. 33 57 La 138. 91 72 Hf 178. 49 73 Ta 180. 95 74 W 183. 84 75 Re 186. 21 76 Os 190. 23 77 Ir 192. 22 78 Pt 195. 08 79 Au 196. 97 80 Hg 200. 59 81 Tl 204. 38 82 Pb 207. 2 83 Bi 208. 98 84 Po (209) 85 At (210) 86 Rn (222) 87 Fr (223) 88 Ra 226. 0 89 Ac (227) 104 Rf (261) 105 Ha (262) 58 Ce 140. 12 59 Pr 140. 91 60 Nd 144. 24 61 Pm (145) 62 Sm 150. 36 63 Eu 151. 96 64 Gd 157. 25 65 Tb 158. 93 66 Dy 162. 50 67 Ho 164. 93 68 Er 167. 26 69 Tm 168. 93 70 Yb 173. 05 71 Lu 174. 97 90 Th 232. 04 91 Pa 231. 04 92 U 238. 03 93 Np 237. 05 94 Pu (244) 95 Am (243) 96 Cm (247) 97 Bk (247) 98 Cf (251) 99 Es (254) 100 Fm (257) 101 Md (256) 102 No (254) 103 Lr (257)
1. Sintesis Gas Hidrogen
(64 Poin)
Hidrogen pertama kali ditemukan sebagai gas pada tahun 1766 oleh Henry Cavendish, ahli kimia dan fisika dari Inggris. Kelimpahan hidrogen di kerak bumi adalah 1,520 parts per million (bagian perjuta), dan kelimpahan ini adalah terbesar ketiga sesudah oksigen dan silikon. Kelimpahan hidrogen di jagad raya adalah 74 % (berat) dan dari jumlah atom adalah 90 %, sehingga hidrogen merupakan konstituen utama di jagad raya. Pada keadaan normal, gas hidrogen merupakan molekul diatomik (H2 ). Gas ini dapat bereaksi dengan oksigen membentuk air (H2O) yang merupakan komponen
utama di bumi. Dalam tekanan 1 atm dan suhu ruang (STP), hidrogen tidak berwarna, tak berbau, tidak mempunyai rasa dan hanya sedikit larut dalam air. Hidrogen dikenal sebagai gas dengan densitas paling rendah yaitu 0,08988 gram per liter pada STP, dan ini hanya 1/14 densitas udara. Hidrogen mempunyai titik leleh -259,14 oC dan mendidih pada -252,87 oC. Gas hidrogen dapat
disintesis dengan berbagai cara antara lain: a. Reaksi logam aktif dengan air.
b. Reaksi logam kurang aktif dengan asam kuat. c. Reaksi logam amfoter dengan basa kuat. d. Reaksi hidrida logam dengan air.
e. Dekomposisi air melalui elektrolisis.
Pada praktikum ini, setiap siswa harus melakukan sintesis gas hidrogen yang dihasilkan dari reaksi antara logam aluminium dengan larutan NaOH. Gas hidrogen yang terbentuk ditampung dalam balon dan balon yang berisi gas hidrogen tersebut harus mampu terbang naik ke atas. Lakukan praktikum ini untuk 3 buah balon yang massanya berbeda.
Peralatan dan Zat
1. Botol : 1 Buah
2. Tutup botol yang tersambung dengan selang : 1 buah
3. Half Mask Respirator : 1 buah
4. Sarung tangan tahan panas : 1 pasang
5. Gunting : 1 buah 6. Logam Aluminium 7. Larutan NaOH 2 M 8. Benang 9. Label stiker Percobaan. Prosedur:
1. Timbang dan catat massa salah satu balon lalu sambungkan dan ikat dengan kuat pada ujung selang menggunakan benang.
6. Biarkan beberapa saat sampai reaksi berlangsung sempurna yang ditandai dengan habisnya buih di dalam botol dan balon telah mengembang sempurna.
7. Ikat balon yang telah terisi gas hidrogen dengan benang yg telah disediakan.
8. Beri label nama anda pada balon, lalu ukur dan catat diameter balon dengan bantuan petugas.
9. Tempelkan ujung tali balon di meja masing-masing dengan mengunakan solatif.
10. Buang limbah cairan yang ada di dalam botol ke dalam botol limbah yang telah disediakan. 11. Bilas botol mengunakan air lalu keringkan dengan cara menyimpan botol dalam posisi
terbalik.
12. Catat semua data di lembar data dan pengamatan pada lembar jawaban. 13. Ulangi prosedur yang sama untuk semua balon yang telah disediakan.
14. Sebelumnya pastikan tidak ada uap air tersisa baik di dalam botol maupun selang. Catatan:
(i) Periksalah balon yang disediakan, jangan sampai bocor!
(ii) Tidak diperkenankan meminta tambahan bahan kimia atau balon. Formula: Volume bola: ܸ =ସଷߨݎଷ Hukum Graham: ௨భ ௨మ= √ ெమ ெభ
Tugas dan Pertanyaan
1. Catat semua data pengamatan pada lembar jawaban! (Total: 27 poin) 2. Tuliskan persamaan reaksi pembuatan gas hidrogen tersebut! (3 poin) 3. Secara teoritis, berapa gram massa gas hidrogen yang terbentuk? (3 poin) 4. Anggap balon sebagai bola, hitung volume dan densitas hidrogen yang anda diperoleh
(18 poin) 5. Jika balon tidak dapat terbang, jelaskan alasannya! (3 poin)
6. Dengan memperhitungkan massa molar gas H2, Kr dan O2, maka:
a. Pada 25oC, hitunglah laju diffusi gas Kr dan O
2terhadap difusi gas H2! (6 poin)
b. Pada 25oC, Manakah gas yang bergerak paling cepat?
2. Pemisahan Campuran Zat Pewarna Makanan dengan Metode Kromatografi
(76 Poin)
Kromatografi adalah suatu metode yang digunakan ilmuwan untuk memisahkan senyawa organik dan anorganik sehingga senyawa tersebut dapat dianalisis dan dipelajari. Dengan menganalisis senyawa, seorang ilmuwan dapat mengetahui apa yang membangun senyawa tersebut. Kromatografi adalah suatu metode fisik yang cocok untuk menyelidiki suatu campuran dan pelarutnya. Kata kromatografi berarti “tulisan berwarna”, artinya suatu cara uji campuran zat warna berwujud cair. Seorang botanis Rusia bernama M.S. Tswett menemukan kromatografi ketika mempelajari material zat warna dari tumbuhan pada tahun 1903.
Kromatografi digunakan oleh berbagai orang dan pada berbagai bidang disiplin ilmu. Sebagian orang menggunakan kromatografi untuk mengetahui komponen apa saja yang terdapat dalam suatu zat padat atau zat cair. Metode ini digunakan juga untuk mengetahui zat-zat yang tak dikenal dalam suatu sampel. Polisi, FBI, dan agen detektif lainnya menggunakan kromatografi ketika mengusut suatu kasus kriminal. Metode ini digunakan pula untuk menguji keberadaan kokain dalam urin, alkohol dalam darah, PCB (polychlorinated benzene) dalam ikan, dan kandungan timbal dalam sistem perairan.
Metode kromatografi adalah cara pemisahan dua atau lebih senyawa atau ion berdasarkan pada perbedaan migrasi dan distribusi senyawa atau ion-ion tersebut di dalam dua fasa yang berbeda. Dua fasa ini bisa berwujud padat-cair, cair-cair, atau gas-cair. Zat terlarut di dalam suatu fasa gerak mengalir pada suatu fasa diam. Zat terlarut yang memiliki afinitas terhadap fasa gerak yang lebih besar akan tertahan lebih lama pada fasa gerak, sedangkan zat terlarut yang afinitasnya terhadap fasa gerak lebih kecil akan tertahan lebih lama pada fasa diam. Dengan demikian senyawa-senyawa dapat dipisahkan komponen demi komponen akibat perbedaan migrasi di dalam fasa gerak dan fasa diam.
Dalam semua metode kromatografi terdapat fasa gerak dan fasa diam. Fasa diam adalah fasa yang tidak bergerak, sedangkan fasa gerak adalah fasa yang bergerak melalui fasa diam dan membawa komponen-komponen senyawa yang akan dipisahkan. Pada posisi yang berbeda-beda, senyawa-senyawa yang berbeda akan tertahan dan terabsorbsi pada fasa diam, dan kemudian satu demi satu senyawa-senyawa ini akan terbawa kembali oleh fasa gerak yang melaluinya. Dalam kromatografi kertas dan kromattografi lapis tipis, fasa gerak adalah pelarut. Fasa diam pada kromatografi kertas adalah kertas yang menyerap pelarut polar, sedangkan fasa diam pada kromatografi lapis tipis adalah pelat yang dilapisi adsorben tertentu. Kedua jenis kromatografi ini menggunakan aksi kapilaritas untuk menggerakkan pelarut melalui fasa diam.
Peralatan dan Zat
1. Alat Suntik plastik (10 cc) : 2 buah
2. Gelas kimia 250 mL : 1 buah
3. Pipet tetes : 2 buah
4. Aluminium foil 10 x 10 cm : 3 lembar
13. Sampel permen hijau dan ungu
14. Larutan Butanol:Etanol:Ammonia 2% (3:1:2)
15. Botol semprot 250 mL berisi Aquadest : 1 buah
16. Botol vial kecil : 12 buah
17. Larutan Etanol-Air (2:4) 18. Satu plastik kliplock berisi:
Plat KLT 7 x 5 cm : 3 lembar
Pipa kapiler untuk penotol : 10 buah Label stiker
Kertas saring untuk kolom
Percobaan
I. Kromatografi Lapis Tipis
1. Larutkan 2 buah sampel permen berwarna ungu dan hijau, masing- masing dengan 2,5 mL air di dalam vial yang berbeda.
2. Biarkan sampai zat warnanya larut sempurna dengan cara mengoyang-goyangkan vial kurang lebih 5-10 menit.
3. Ke dalam gelas kimia 250 mL tuangkan 5 mL larutan pengembang, yaitu larutan Butanol:Etanol:Ammonia 2% (3:1:2), lalu tutup gelas kimia tersebut menggunakan aluminium foil dan biarkan beberapa saat supaya suasana di dalam gelas kimia menjadi jenuh.
4. Siapkan 1 buah plat KLT, totolkan semua zat pewarna dan larutan sampel permen pada plat KLT dengan menggunakan pipa kapiler yang berbeda untuk masing-masing spot/noda (lihat Gambar I). Totolkan masing-masing sampel beberapa kali sehingga spot/noda cukup tebal namun tidak melebar.
5. Biarkan sejenak supaya semua spot/noda meresap dan mengering.
6. Masukkan plat KLT tersebut ke dalam gelas kimia berisi larutan pengembang.
7. Lakukan kromatografi sampai larutan pengembang mencapai kurang lebih 1 cm dari ujung bagian atas plat KLT (kira-kira 20 menit).
8. Setelah selesai, angkat dan keluarkan plat KLT dari dalam gelas kimia, segera beri tanda ujung larutan pengembang dan biarkan mengering di udara.
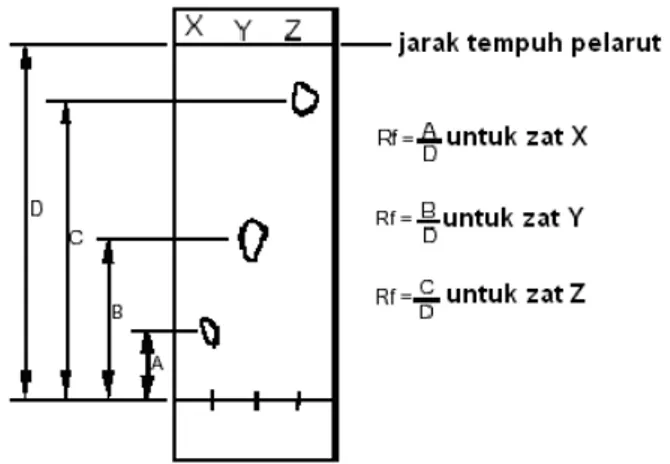
9. Beri tanda dengan pensil noda-noda yang muncul, tentukan nilai Rf-nya. Nilai Rf adalah
“retardation factor” atau nilai “ratio-to-front” yang diekspresikan sebagai fraksi desimal (lihat Gambar 1).
10. Tempelkan hasil KLT Anda di lembar data dan pengamatan pada lembar jawaban.
f
Jarak yang ditempuhsampel Jaraknodadaribatasbawah
R = =
Gambar 1. Cara penentuan nilai Rf
II. Kromatografi Kolom
1. Buatlah 2 buah kolom kromatografi menggunakan alat suntik plastik (masing masing kolom untuk larutan pewarna baku dan sampel permen).
2. Sumbatlah setiap ujung alat suntik dengan sedikit kapas, tekan menggunakan pensil Anda hingga kapas tidak longgar.
3. Masukkan kertas saring berdiameter sesuai alat suntik (sudah disediakan) ke dalam alat suntik tepat di atas permukaan kapas. Gunakan pengaduk kaca untuk membantu meletakkan dan mendorong kapas dan kertas saring.
4. Masukkan 2 gram silika gel yang telah tersedia ke dalam alat suntik tersebut, lalu simpan alat suntik pada rak penyangga kolom.
5. Letakkan botol vial kosong bersih di bawah alat suntik untuk menampung eluat yang keluar dari ujung alat suntik.
6. Tambahkan larutan alkohol-air hingga sekitar 0,1 cm di atas permukaan silika dalam alat suntik.
7. Padatkan silika di dalam alat suntik dengan menggunakan daya dorong dari pendorong alat suntik.
8. Pada kolom kromatografi pertama, teteskan 3 tetes larutan campuran pewarna baku di atas permukaan silika hingga semuanya terserap pada permukaan silika, dan diamkan beberapa saat hingga tidak ada lagi larutan pengembang yang menetes dari ujung alat suntik.
9. Tambahkan larutan alkohol-air perlahan dengan pipet tetes ke dalam alat suntik hingga terjadi proses pergerakan sampel pada kolom tersebut yang membentuk pemisahan warna tertentu. (Perhatian: pastikan kolom harus selalu terisi oleh larutan fasa gerak, jangan
sampai kering!)
10. Ketika warna pertama mulai akan keluar dari ujung alat suntik, segera tampung eluat yang keluar dengan vial kosong.
14. Setelah eluat sampel permen hijau keluar semua, lakukan pencucian kol meneteskan larutan pengembang etanol
berwarna jernih).
15. Kemudian lakukan prosedur yang sama
tetes sampel permen warna ungu) menggunakan kolom yan pemisahan sampel permen warna hijau.
16. Setelah proses pemisahan masing masing dan catat warna setiap eluat di lembar 17. Lakukan kromatografi lapis tipis terhadap
dengan posisi spot seperti terlihat pada Gambar 2 (Catatan: Lakukan prosedur
plat KLT untuk satu jenis sampel permen
diperoleh dari sampel permen beserta larutan pewarna
Gambar 2
18. Bandingkan hasil kromatogramnya dengan kromatogram larutan sampel sebelum pemisahan.
19. Bandingkan pula kromatogramnya dengan kromatogram baku.
20. Catat semua nilai Rfyang diperoleh.
21. Dari hasil percobaan, identifikasi zat warna apa saja yang terkandung dalam sampel permen warna hijau dan ungu yang Anda peroleh.
22. Catat semua data pengamatan
Tugas dan Pertanyaan
1. Catat semua data percobaan pada
2. Diketahui struktur beberapa zat warna yang terdapat dalam larutan zat pewarna baku maupun sampel permen adalah sebagai be
Setelah eluat sampel permen hijau keluar semua, lakukan pencucian kol
meneteskan larutan pengembang etanol-air sampai bersih (warna tetesan cairan yang keluar Kemudian lakukan prosedur yang sama terhadap sampel permen warna ungu (gunakan 5 tetes sampel permen warna ungu) menggunakan kolom yang sebelumnya digunakan untuk pemisahan sampel permen warna hijau.
Setelah proses pemisahan masing masing sampel yang mengandung pe dan catat warna setiap eluat di lembar jawaban.
Lakukan kromatografi lapis tipis terhadap semua eluat sampel permen hijau dan ungu dengan posisi spot seperti terlihat pada Gambar 2.
Lakukan prosedur KLT sebagaimana yang sudah Anda lakukan sebelumnya
KLT untuk satu jenis sampel permen; totolkan pada pelat KLT semua eluat yang
ri sampel permen beserta larutan pewarna baku sebagai pembanding
2. Posisi spot untuk hasil eluat sampel permen
Bandingkan hasil kromatogramnya dengan kromatogram larutan sampel sebelum matogramnya dengan kromatogram-kromatogram larutan zat pewarna yang diperoleh.
Dari hasil percobaan, identifikasi zat warna apa saja yang terkandung dalam sampel permen warna hijau dan ungu yang Anda peroleh.
pengamatan dan jawaban Anda di lembar jawaban.
Catat semua data percobaan pada lembar jawaban! (Total: 46 poin)
Diketahui struktur beberapa zat warna yang terdapat dalam larutan zat pewarna baku maupun adalah sebagai berikut:
Setelah eluat sampel permen hijau keluar semua, lakukan pencucian kolom dengan cara air sampai bersih (warna tetesan cairan yang keluar terhadap sampel permen warna ungu (gunakan 5 g sebelumnya digunakan untuk sampel yang mengandung pewarna selesai, amati mpel permen hijau dan ungu
nda lakukan sebelumnya, satu totolkan pada pelat KLT semua eluat yang
sebagai pembanding).
Bandingkan hasil kromatogramnya dengan kromatogram larutan sampel sebelum atogram larutan zat pewarna
Dari hasil percobaan, identifikasi zat warna apa saja yang terkandung dalam sampel permen
a. Urutkan nilai Rf keempat zat warna tersebut mulai dari nilai Rf yang paling kecil pada
kromatografi lapis tipis dengan eluen butanol:etanol:ammonia 2% (3:1:2)! (2 poin)
b. Jelaskan mengapa urutan nilai Rf-untuk keempat zat warna tersebut adalah seperti yang Anda
tuliskan pada jawaban soal a)! (5 poin)
c. Zat warna manakah yang akan mempunyai rentang bilangan gelombang (3500-3300) cm-1dan
(1690-1720) cm-1pada spektrum Infra Merah? Jelaskan! (5 poin)
3. Berdasarkan hasil kromatografi Lapis tipis (KLT) yang sudah Anda lakukan menggunakan eluen eluen butanol:etanol:ammonia 2% (3:1:2), perkirakan komponen zat warna apa saja (dengan struktur zat warna A-D di atas) yang terdapat pada masing-masing larutan zat warna baku maupun warna pada masing-masing sampel permen! Jelaskan! (Nilai: perkiraan: 2 poin; penjelasan: 5 poin)
4. Berdasarkan hasil kromatografi lapis tipis dan kromatografi kolom yang sudah Anda lakukan terhadap sampel permen Anda, perkirakan komponen zat warna apa saja (dengan struktur zat warna A-D di atas) yang terdapat pada masing-masing sampel permen! Jelaskan! (Nilai: perkiraan: 2 poin; penjelasan: 5 poin)
5. Fasa gerak yang digunakan untuk kromatografi lapis tipis adalah Butanol:Etanol:Ammonia 2% dengan perbandingan 3:1:2, kemungkinan apakah yang terjadi jika pada fasa gerak tersebut komposisi butanol diubah menjadi lebih banyak atau lebih sedikit? Jelaskan! (4 poin)
Referensi