UJI AKTIVITAS ANTIMIKROBA GETAH JARAK TINTIR (Jatropha multifidaLinn.) TERHADAPStaphylococcus aureusATCC 25923,
Escherichia coliATCC 25922,danCandida albicansATCC 10231
Skripsi
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Puspita Sari NIM : 108114153
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIMIKROBA GETAH JARAK TINTIR (Jatropha multifida Linn.) TERHADAP Staphylococcus aureus ATCC 25923,
Escherichia coli ATCC 25922, dan Candida albicans ATCC 10231
Skripsi
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Puspita Sari NIM : 108114153
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
Hiduplah sedemikian rupa seolah-olah
akan mati esok. Belajarlah seolah-olah kau
hidup selamanya.
Mahatma Gandhi
Kupersembahkan karya sederhanaku ini untuk :
Tuhan Yesus Kristus penolongku yang hebat.
Bapak Partijo dan Ibu Lasmi Puji Asih,kedua orang tuaku yang hebat.
Kakak – kakakku terkasih Darmiasih, Jati Nugroho, dan Sugianto.
v PRAKATA
Puji syukur kepada Tuhan Yang Maha Baik, karena atas penyertaan dan pertolonganNya penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antimikroba Getah Jarak Tintir (Jatropha multifida Linn.) Terhadap
Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan
Candida albicans ATCC 10231”.
Skripsi ini disusun sebagai syarat memperoleh gelar Sarjana Farmasi (S. Farm.) di Fakultas Farmasi Universitas Sanata Dharma. Penyusunan skripsi ini dapat terselesaikan karena bantuan dan kerja sama dari banyak pihak. Oleh karena itu, penulis ingin mengucapkan teima kasih yang mendalam kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Prof. Dr. C. J. Soegihardjo, Apt. selaku Dosen Pembimbing dan penguji yang telah rela meluangkan waktu untuk memberikan bimbingan, saran, dan dukungan hingga skripsi ini terselesaikan.
3. Damiana Sapta Candrasari, M.Sc. dan Dr. Erna Tri Wulandari M.Si., Apt. selaku Dosen Penguji yang telah meluangkan waktu untuk menguji selama ujian tertutup dan terbuka serta untuk kritik dan sarannya yang membangun. 4. Ibu C.M. Ratna Rini Nastiti, M. Pharm., Apt., selaku Ketua Program Studi
dan Dosen Pembimbing Akademik atas bantuan yang telah diberikan selama perkuliahan dan penyusunan skripsi.
5. Ibu Maria Dwi Jumpowati, S.Si., yang telah bersedia meluangkan waktu
vi
6. Seluruh staf Dosen Fakultas Farmasi Universitas Sanata Dharma karena telah membagikan ilmu kepada penulis.
7. Bapak Mukminin, Bapak Wagiran, Mas Andri, Mas Sigit, seluruh laboran dan karyawan Universitas Sanata Dharma.
8. Orang tuaku, dua orang luar biasa dalam hidupku, terima kasih atas cinta, semangat, dukungan, dan kepercayaannya sehingga semua terasa lebih indah. 9. Ketiga kakakku terkasih (Darmiasih, Jati Nugroho, dan Sugianto) atas segala
dukungan, doa, dan penghiburan yang kalian berikan.
10. Sahabatku Trifonia Rosa, Ranny Oktaviani, Gilda Todingbua, Yohanes Ivan,
dan Yeni Natalia atas kebersamaan, dan kebaikan kalian selama ini.
11. Teman – teman Kos Agatha : Liana Risha yang selalu mengingatkan tentang skripsi, Rosa Kurniasih, Rosalia Suryaningtyas, Gabriella Septiana, Maria Karina, Gracia Jenny, Maria Magdalena, terima kasih atas dukungan dan kebersamaannya selama ini.
12. Teman – teman FKK B 2010 atas kebersamaannya selama ini.
13. Semua pihak yang telah banyak membantu penyelesaian skripsi ini yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu, kritik dan saran yang membangun akan sangat membantu penulis dalam menyempurnakan skripsi ini. Penulis berharap semoga skripsi ini berguna dikemudian hari.
ix
PERNYATAAN KEASLIAN KARYA ... vii
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... viii
DAFTAR ISI ... ix
B. Tujuan Penelitian ... 4
x
A. Jarak tintir (Jatropha multifida Linn.) ... 5
B. Kandungan Metabolit Sekunder Batang Jarak Tintir ... 6
1. Saponin ... 7
2. Tanin ... 8
3. Flavonoid ... 8
4. Alkaloid ... 9
C. Getah Jarak Tintir ... 10
D. Bakteri Gram Positif dan Gram Negatif ... 11
E. Staphylococcus aureus ... 12
F. Escherichia coli ... 14
G. Candida albicans ... 15
H. Antijamur ... 17
I. Antibakteri ... 18
J. Pengukuran aktivitas antimikroba ... 20
K. Landasan Teori ... 20
L. Hipotesis ... 22
BAB III. METODOLOGI PENELITIAN ... 23
A. Jenis Rancangan Penelitian ... 23
B. Variabel Penelitian dan Definisi Operasional ... 23
1. Variabel penelitian ... 22
2. Definisi operasional ... 24
C. Bahan Penelitian ... 25
xi
E. Tata Cara Penelitian ... 26
1. Determinasi tanaman ... 26
2. Pengumpulan bahan ... 26
3. Skrining Fitokimia Getah Jarak Tintir ... 26
a. Uji pendahuluan ... 26
4. Uji aktivitas antimikroba ... 29
a. Persiapan konsentrasi getah jarak tintir ... 29
b. Pembuatan kultur mikroba uji ... 29
c. Pengukuran zona hambat ... 29
d. Penentuan KHM (Konsentrasi Hambat Minimum) ... 30
F. Tata cara Analisis Hasil ... 30
BAB IV. HASIL DAN PEMBAHASAN ... 32
A. Determinasi tanaman ... 32
B. Pengumpulan Getah Jarak Tintir ... 33
C. Skrining Fitokimia Getah Jarak Tintir ... 33
1. Uji pendahuluan ... 34
2. Uji tanin ... 34
xii
4. Uji flavonoid ... 38
5. Uji alkaloida ... 38
6. Uji antrakinon ... 39
D. Uji Potensi Antimikroba Getah Jarak Tintir Secara Difusi Sumuran 41 1. Uji potensi antibakteri getah jarak tintir terhadap Staphylococcus aureus ATCC 25923 ... 45
2. Uji potensi antibakteri getah jarak tintir terhadap Escherichia coli ATCC 25922 ... 47
3. Uji potensi antibakteri getah jarak tintir terhadap Candida albicans ATCC 10231 ... 50
E. Penentuan Konsentrasi Hambat Miniman (KHM) Getah Jarak Tintir terhadap Staphylococcus aureus ATCC 25923, dan Escherichia coli ATCC 25922 secara Dilusi Cair ... 51
1. Penentuan KHM getah jarak tintir terhadap Staphylococcus aureus ATCC 25923 ... 52
2. Penentuan KHM getah jarak tintir terhadap Escherichia coli ATCC 25922 ... 53
F. Mekanisme Antimikroba Golongan Senyawa yang Terkandung Dalam Getah Jarak Tintir ... 55
BAB V. KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
LAMPIRAN ... 62
xiii
DAFTAR TABEL
Halaman Tabel I. Hasil uji tabung pada skrining fitokimia getah jarak tintir ... 40 Tabel II. Diameter zona hambat getah jarak tintir terhadap bakteri
Staphylococcus aureus ATCC 25923 ... 46 Tabel III. Diameter zona hambat getah jarak tintir terhadap Escherichia
coli ATCC 25922 ... 48 Tabel IV. Diameter zona hambat getah jarak tintir terhadap bakteri
Candida albicans ATCC 10231 ... 50 Tabel V. Kekeruhan media pada dilusi cair bakteri Staphylococcus
aureus ATCC 25923 ATCC 25923 ... 52
Tabel VI. Kekeruhan media pada dilusi cair bakteri Escherichia coli
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman jarak tintir ... 6
Gambar 2. Dinding sel bakteri Gram Positif dan Gram Negatif ... 11
Gambar 3. Bakteri Staphylococcus aureus ... 13
Gambar 4. Bakteri Escherichia coli ... 14
Gambar 5. Jamur Candida albicans ... 16
Gambar 6. Tanaman jarak tintir ... 32
Gambar 7. Ikatan antara tanin dengan protein ... 35
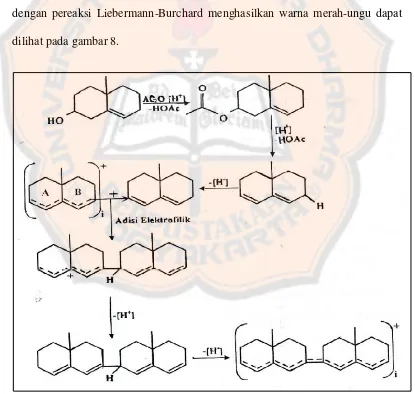
Gambar 8. Reaksi terpenoid dengan pereaksi Liebermann-Burchard ... 37
Gambar 9. Mekanisme reaksi antara flavonoid dengan magnesium ... 38
Gambar 10. Mekanisme reaksi alkaloid dengan pereaksi Mayar ... 36
Gambar 11. Mekanisme reaksi alkaloid dengan pereaksi Dragendorff ... 36
xv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat Determinasi Tanaman Jarak Tintir (Jatropha multifida
Linn.) ... 63
Lampiran 2. Sertifikat Hasil Uji Staphylococcus aureus ATCC 25923 ... 64
Lampiran 3. Sertifikat Hasil Uji Escherichia coli ATCC 25922 ... 65
Lampiran 4. Sertifikat Hasil Uji Candida albicans ATCC 10231 ... 66
Lampiran 5. Data diameter zona hambat (mm) getah jarak tintir terhadap Escherichia coli ATCC 25922... 67
Lampiran 6. Hasil uji statistik diameter zona hambat (mm) getah jarak tintir terhadap Escherichia coli ... 67
Lampiran 7. Hasil uji Mann-Whitney kelompok konsentrasi pada bakteri Escherichia coli ATCC 25922 ... 80
Lampiran 8. Data diameter zona hambat (mm) getah jarak tintir terhadap Staphylococcus aureus ATCC 25923 ... 80
Lampiran 9 Hasil uji statistik diameter zona hambat getah jarak tintir terhadap Staphylococcus aureus ATCC 25923 ... 81
Lampiran 10. Hasil uji Mann-Whitney kelompok konsentrasi pada bakteri Staphylococcus aureus ATCC 25923 ... 93
Lampiran 11. Data diameter zona hambat (mm) getah jarak tintir terhadap Candida albicans ATCC 10231 ... 94
Lampiran 12. Hasil uji statistik diameter zona hambat (mm) getah jarak tintir terhadap Candida albicans ATCC 10231 ... 94
Lampiran 13. Hasil uji Mann-Whitney kelompok konsentrasi pada Candida albicans ATCC 10231 ... 107
xvi
Escherichia coli ATCC 25922 ... Lampiran 16. Foto Tanaman Jarak Tintir (Jatropha multifida Linn.) dan
Getah Jarak Tintir ... 110 Lampiran 17. Foto Hasil Skrining Fitokimia Getah Jarak Tintir (Jatropha
multifida Linn.) ... 111 Lampiran 18. Foto seri konsentrasi getah jarak tintir, kontrol positif, dan
kontrol negatif ... 113 Lampiran 19. Foto hasil uji aktivitas antibakteri getah jarak tintir terhadap
Staphylococcus aureus secara difusi sumuran ... 114
Lampiran 20. Foto hasil uji aktivitas antibakteri getah jarak tintir terhadap
Escherichia coli secara difusi sumuran ... 115 Lampiran 21. Foto hasil uji aktivitas antifungi getah jarak tintir terhadap
Candida albicans secara difusi sumuran ... 116 Lampiran 22. Foto pengujian aktivitas antibakteri getah jarak jarak tintir
secara dilusi cair terhadap Staphylococcus aureus dan
Escherichia coli untuk mendapatkan KHM (Konsentrasi
xvii INTISARI
Getah jarak tintir (Jatropha multifida Linn.) digunakan masyarakat sebagai penyembuh luka. Hasil penelitian yang dilakukan di Filipina oleh Ongtengco (1992) dan di Nigeria oleh Adelosa (2007) menyatakan bahwa getah jarak tintir memiliki aktivitas antimikroba terhadap Candida albicans, Proteus
spp., Staphylococcus aureus, Citrobacter spp., Morganella morgani, Klebsiella,
Serratia, Aeromonas, Acitobacter, Pseudomonas aeruginosa, dan Eschericia coli.
Staphylococcus aureus, Escherichia coli, dan Candida albicans merupakan
mikroba yang sering menimbulkan penyakit pada manusia. Penelitian ini bertujuan untuk mengetahui aktivitas antimikroba dari getah jarak tintir yang tumbuh di Indonesia terhadap Staphylococcus aureus, Escherichia coli, dan
Candida albicans serta mengetahui senyawa golongan apa saja yang terkandung
didalamnya.
Uji aktivitas antimikroba ini dilakukan dengan metode difusi sumuran untuk mengetahui diameter zona hambat getah jarak tintir. Selanjutnya untuk menentukan KHM (Konsentrasi Hambat Minimal) digunakan metode dilusi cair dan dibaca kekeruhannya menggunakan Nephelometer. Data diameter zona hambat diolah menggunakan uji Shapiro-Wilk untuk mengetahui normalitas data dan diuji menggunakan Kruskal-Wallis dan dilanjutkan dengan analisis
Mann-Whitney. KHM ditentukan berdasarkan konsentrasi terendah yang menunjukkan
adanya penurunan kekeruhan media pada dilusi cair. Uji tabung digunakan untuk menentukan senyawa golongan apa saja yang terkandung dalam getah jarak tintir. Penentuan hasil positif dengan pengamatan perubahan warna dan adanya pengendapan.
Hasil penelitian diketahui bahwa getah jarak tintir memiliki aktivitas antibakteri terhadap Staphylococcus aureus dan Escherichia coli dengan nilai KHM berturut – turut, yaitu 4% dan 7%, serta memiliki aktivitas antijamur terhadap Candida albicans dengan zona hambat iradikal. Senyawa yang diduga terkandung dalam getah jarak tintir, yaitu saponin triterpen, tanin, alkaloid, dan flavonoid.
Kata kunci : getah jarak tintir, Jatropha multifida Linn., Staphylococcus aureus,
xviii
ABSTRACT
Latex of jarak tintir (Jatropha multifida Linn.) has been used as a wound healer. The result of research that has been done by Ongtengco (1992) in Philippines and Adelosa (2007) in Negeria is that jarak tintir‟s latex have antimicrobiac activity against Candida albicans, Proteus spp., Staphylococcus
aureus, Citrobacter spp., Morganella morgani, Klebsiella, Serratia, Aeromonas,
Acitobacter, Pseudomonas aeruginosa, and Eschericia coli. Staphylococcus
aureus, Escherichia coli, and Candida albicans are microbe that often cause
disease to human. This study aims to determine the antimicrobial activity of jarak tintir;‟s latex against Staphylococcus aureus, Escherichia coli, and Candida
albicans, and as well to knowing what compounds contain in it.
This antimicrobial activity test was carried out by the method of well diffusion to determine the inhibition zone diameter of jarak tintir‟s latex. Furthermore, to determine the MIC (Minimum Inhibitory Concentration) used broth dilution method and the turbidity was read by Nephelometer. Data of inhibition zone diameter were processed using Shapiro-Wilk to determine the normality of the data and tested using Kruskal-Wallis followed by Mann-Whitney. MIC os determined based on the lowest concentration that show decreases in turbidity on broth media. Phytochemical screening is used to determine what compounds were contained in jarak tintir‟s latext. Determination of positive results with observations of color change and precipitation.
The result show thet jarak tintir‟s latex have antimicrobial activity against Staphylococcus aureus and Escherichia coli with MIC values 4% and 7%, and have antifungal activity against Candida albicans with iradikal zone inhibition. Compouns that contoined int the jarak tintir‟s latex are saponins (triterpene), tannins, alkaloids, and flavonoids.
Keyword : latex of jarak tintir, Jatropha multifida Linn., Staphylococcus aureus,
1 BAB I PENGANTAR A. Latar Belakang
Dewasa ini, penyakit akibat infeksi bakteri maupun jamur telah banyak terjadi. Bakteri maupun jamur merugikan yang seringkali ditemukan tersebut antara lain Staphylococcus aureus, Escherichia coli, dan Candida albicans. Berbagai penelitian terkait senyawa antimikroba tersebut terus dilakukan karena sering terjadi resistensi terhadap senyawa yang telah digunakan sebelumnya. Menurut Priyanto (2010) resistensi antimikroba merupakan keadaan dimana mikroba tidak lagi dapat dihambat pertumbuhannya maupun dibunuh dengan antimikroba yang biasa digunakan.
Indonesia memiliki banyak tanaman yang dapat dimanfaatkan sebagai antimikroba. Penelitian terhadap tanaman-tanaman tersebut telah banyak dilakukan. Jatropha multifida (jarak tintir) atau lebih dikenal sebagai pohon yodium telah banyak diteliti aktivitas antimikrobanya. Hasil penelitian terdahulu menyatakan bahwa jarak tintir memiliki aktivitas antimikroba yang diduga berasal dari kandungan senyawa saponin, alkaloid, flavonoid, dan tanin pada batangnya.
Ekstrak metanol dari campuran daun, batang, biji, dan kulit jarak tintir mampu menghambat pertumbuhan Candida albicans, Staphylococcus aureus,
dan Escherichia coli (Sari, 2011), sedangkan ekstrak metanol dari kulit batang
memiliki aktivitas antimikroba terhadap Candida albicans, Staphylococcus
Pseudomonas aeruginosa dengan nilai Konsentrasi Hambat Minimal (KHM) berturut-turut, yaitu 0,005%, 0,00125%, 0,0000625%, 0,01%, 0,000156%, 0,00125% (Aiyelaagbe, 2008).
Getah jarak tintir sendiri telah dikenal sebagai penyembuh luka. Pengujian aktivitas antimikroba dari getah jarak tintir terhadap Staphylococcus
aureus, Pseudomonas aeruginosa, dan Escherichia coli telah dilakukan di
Filipina oleh Ongtengco (1992). Nilai KHM getah jarak tintir pada pengujian tersebut terhadap Staphylococcus aureus, Pseudomonas aeruginosa, dan
Escherichia coli berturut – turut, yaitu 0,098%, 0,78%, dan 1,56%. Berdasarkan
penelitian Adelosa (2007), getah Jarak tintir sendiri yang diujikan sebagai pengobatan lesi/luka pada mulut anak di Nigeria akibat infeksi Candida albicans memiliki efek pengeringan luka lebih cepat dari obat Nystatin.
Faktor edafik atau faktor tanah tempat tumbuh yang berbeda dapat mempengaruhi kandungan senyawa suatu tanaman meskipun spesiesnya sama. Hal ini terbukti dari hasil penelitian Widyastuti (2003) yang menyatakan bahwa jenis tanah mempengaruhi kadar minyak atsiri pada tanaman ketumbar
(Coriandrum sativum L.). Oleh karena itu, peneliti tertarik menguji aktivitas
antimikroba getah jarak tintir terhadap Staphylococcus aureus, Escherichia coli,
dan Candida albicans meskipun penelitian terhadap bakteri dan jamur yang
1. Perumusan masalah
a. Berapakah diameter zona hambat dan KHM getah jarak tintir terhadap
Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan
Candida albicans ATCC 10231?
b. Senyawa golongan apa sajakah yang terkandung dalam getah jarak tintir? 2. Keaslian penelitian
Sejauh pengetahuan penulis, uji aktivitas antimikroba getah jarak tintir terhadap Staphylococcus aureus, Escherichia coli, dan Candida
albicans berbeda dari penelitian yang dilakukan oleh Delia C. Ongtengco di
Manila, Filipina pada tahun 1992 yang berjudul „The In Vitro Antibacterial
Activity of Jatropha multifida Linn. Latex Against Common Bacterial
Wound Isolates‟. Perbedaan penelitian ini terdapat pada metode pengujian,
mikroba uji yang digunakan dan tempat pengambilan bahan tanaman. Penelitian yang dilakukan Ongtengco menggunakan metode pengujian
Kirby-Bauer Agar-Disk Diffusion, sedangkan pada penelitian aktivitas
antimikroba yang peneliti lakukan menggunakan metode difusi sumuran. Mikroba uji pada penelitian Ongtengco, yaitu bakteri yang didapat dari isolat luka, sedangkan penelitian ini menggunakan strain bakteri yang didapat dari Balai Laboratorium Kesehatan Yogyakarta. Getah jarak tintir yang digunakan oleh Ongtengco berasal dari Filipina, sedangkan pada penelitian ini berasal dari Yogyakarta, Indonesia.
Penelitian ini juga berbeda dari pengujian „Daya Hambat Getah
In Vitro‟ yang dilakukan oleh Darmawi (2013). Perbedaan tersebut terletak
pada metode yang digunakan, yaitu Kirby-Bauer Agar-Disc Diffusion sedangan pada penelitian ini menggunakan metode difusi sumuran.
3. Manfaat penelitian
a. Manfaat teoritis : penelitian ini dapat menambah informasi tentang
aktivitas antimikroba dari getah jarak tintir yang tumbuh di Yogyakarta, Indonesia terhadap Staphylococcus aureus ATCC 25923, Escherichia
coli ATCC 25922, dan Candida albicans ATCC 10231.
b. Manfaat praktis : penelitian ini dapat digunakan sebagai acuan dalam penggunaan getah jarak tintir sebagai antimikroba terhadap
Staphylococcus aureus, Escherichia coli, dan Candida albicans.
B. Tujuan 1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui aktivitas antimikroba getah jarak tintir terhadap Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan Candida albicans ATCC 10231.
2. Tujuan khusus
a. Mengetahui diameter zona hambat dan KHM getah jarak tintir terhadap
Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922,
dan Candida albicans ATCC 10231.
5 BAB II
PENELAAHAN PUSTAKA
A. Jarak tintir (Jatropha multifida Linn.) Klasifikasi jarak tintir, yaitu :
Kerajaan : Plantae Subkerajaan : Tracheobionta Super Divisi : Spermatophyta Divisi : Magnoliophyta
Gambar 1. Tanaman jarak tintir
Jarak tintir disebut juga jarak cina, pohon yodium, jarak gurita dan balacai batai. Tumbuhan ini memiliki senyawa kimia berupa α-amirin, kampesterol, 7α-diol, stigmaterol, β-sitosterol, dan HCN. Jarak tintir telah
digunakan sebagai pengobatan untuk luka berdarah, penurun panas, dan anti-inflamasi (Hariana, 2004).
Hasil penelitian melaporkan bahwa ekstrak metanol dari kulit batang jarak tintir memiliki aktivitas antimikroba terhadap mikroba penyebab penyakit kelamin seperti Candida albicans, Staphylococcus aureus, Gardnerella
vaginalis, Neisseria gonorrhoeae, Proteus mirabilis, dan Pseudomonas
aeruginosa dengan nilai Konsentrasi Hambat Minimal (KHM) berturut-turut,
yaitu 0,005%, 0,00125%, 0,0000625%, 0,01%, 0,000156%, 0,00125% (Aiyelaagbe, 2008).
B. Kandungan Metabolit Sekunder Batang Jarak Tintir
antimikroba sehingga diharapkan getah jarak tintir juga mengandung saponin, tanin, flavonoid, dan alkaloid.
1. Saponin
Saponin adalah glikosida dengan berat molekul besar yang terikat dengan aglikon triterpen atau steroid. Kebanyakan saponin bersifat sabun, bersifat hemolitik, memiliki rasa pahit dan toksik terhadap ikan (piscicidal). Berdasarkan jenis sapogeninnya (aglikon) saponin dibagi menjadi tiga kelas, yaitu triterpen, steroid, dan steroid alkaloid. Semua saponin mengikat satu atau lebih gula pada aglikonnya (Hostetmann, 2005). Mekanisme saponin sebagai antibakteri adalah dengan menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas atau kebocoran sel dan mengakibatkan keluarnya senyawa intraseluler (Robinson (cit., Nuria, 2009)).
2. Tanin
Tanin adalah senyawa fenolik dengan berat molekul 500-3000 Da dan memiliki kemampuan mengendapkan protein dari suatu larutan. Tanin larut dalam air, alkohol, gliserol, dan aseton (Evans, 2009). Tanin dikategorikan dalam tiga grup yaitu tanin terkondensasi, tanin terhidrolisis, dan tanin kompleks. Tanin terkondensasi disebut juga proanthocyanidin dan merupakan flavonoid polimerik atau oligomerik yang terdiri dari unit flavan-3-ol (catechin). Tanin kompleks adalah tanin yang unit catechinnya terikat pada unit gallotannin ataupun ellagitannin (Vermerris, 2008).
Menurut Robinson (cit., Nuria, 2009) Sebagai antimikroba, tanin dapat menghambat enzim reverse transkriptase dan DNA topoisomerase sehingga sel bakteri tidak dapat terbentuk. Gilman (cit., Sari, 2011) menyebutkan bahwa tanin dan flavonoid merupakan senyawa fenol yang bekerja sebagai antibakteri dengan menyebabkan kerusakan pada dinding sel. Ion H+ dari senyawa fenol akan menyerang gugus polar (gugus fosfat) sehingga molekul fosfolipid akan terurai menjadi gliserol, asam karboksilat, dan asam fosfat. Hal ini mengakibatkan fosfolipid tidak mampu mempertahankan bentuk membran sel mengakibatkan membran sel bocor dan bakteri terhambat pertumbuhannya dan bahkah kematian.
3. Flavonoid
polifenol. Flavonoid dapat dikelompokkan berdasarkan keragaman pada rantai C3 menjadi flavonol, flavon, isoflavon, flavanon, flavanonol, katekin, leukoantosianidin, antosianin, khalkon, dan auron. Mekanisme kerja flavonoid sebagai antibakteri adalah dengan membentuk senyawa kompleks dengan protein ekstraseluler sehingga merusak membran sel bakteri yang diikuti dengan keluarnya senyawa intraseluler. (Robinson, 1995).
4. Alkaloid
Alkaloid merupakan senyawa organik yang terdapat dalam tanaman, bersifat basa, dan struktur kimianya memiliki sistem lingkar heterosiklik dengan nitrogen sebagai hetero atomnya. Alkaloid tersusun atas karbon, hidrogen, nitrogen, dan oksigen, tetapi tidak semua alkaloid mengandung keempat unsur tersebut. Ada pula alkaloid lain yang mengandung unsur selain yang telah disebutkan (Sumardjo, 2009).
Alkaloid bekerja sebagai antibakteri dengan cara menghambat sintesis protein bakteri, mengakibatkan terdenaturasinya protein dan asam nukleat sehingga sel bakteri rusak dan berujung pada kematian sel (Oktaviani, 2013).
C. Getah Jarak Tintir
Getah jarak tintir didapat dengan mematahkan maupun menyayat tangkai daun dan melukai kulit batang. Getah jarak tintir berwarna kuning sampai kuning kemerahan. Getah jarak tintir dikenal dapat membantu penyembuhan luka sayat dan beberapa penelitian telah dilakukan untuk membuktikannya secara ilmiah (Juniarti, 2012).
Getah jarak tintir mengandung tioglikosida yang menghasilkan minyak bersifat iritan dan memiliki efek abortifacient Oleh karena itu, penggunaannya secara oral harus dihindari (Begg, 1994). Labaditin merupakan senyawa yang diisolasi dari getah jarak tintir dan memiliki efek antibakteri terhadap bakteri Gram positif tetapi tidak pada bakteri Gram negatif (Barbosa, 2010). Getah Jarak tintir sendiri telah diujikan sebagai pengobatan lesi/luka pada mulut anak di Nigeria akibat infeksi Candida albicans dan efeknya lebih cepat dari obat Nystatin (Adesola, 2007).
Pengujian aktivitas antimikroba dari getah jarak tintir terhadap bakteri yang diisolasi dari luka telah dilakukan di Filipina tahun 1992 oleh Ongtengco. Hasilnya, getah jarak tintir memiliki daya hambat sedang terhadap Proteus spp.,
Staphylococcus aureus, dan Citrobacter spp. dan memiliki daya hambat lemah
terhadap Morganella morgani, Klebsiella, Serratia, Aeromonas, Acitobacter,
menentukan kekuatan daya hambat pada penelitian Ongtengco ini, yaitu daya hambat kuat jika diameter zona hambat ≥ 18 mm, sedang jika 12-16 mm, dan lemah jika 7-11 mm dengan diameter paper disk 6,35.
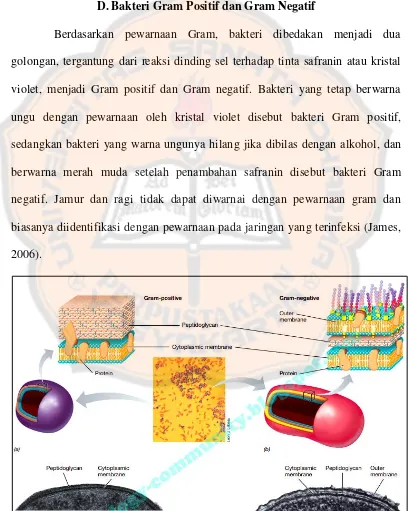
D. Bakteri Gram Positif dan Gram Negatif
Berdasarkan pewarnaan Gram, bakteri dibedakan menjadi dua golongan, tergantung dari reaksi dinding sel terhadap tinta safranin atau kristal violet, menjadi Gram positif dan Gram negatif. Bakteri yang tetap berwarna ungu dengan pewarnaan oleh kristal violet disebut bakteri Gram positif, sedangkan bakteri yang warna ungunya hilang jika dibilas dengan alkohol, dan berwarna merah muda setelah penambahan safranin disebut bakteri Gram negatif. Jamur dan ragi tidak dapat diwarnai dengan pewarnaan gram dan biasanya diidentifikasi dengan pewarnaan pada jaringan yang terinfeksi (James, 2006).
Bakteri Gram positif sebagian besar dinding selnya mengandung peptidoglikan yang menjerat warna violet. Bakteri Gram negatif memiliki lebih sedikit peptidoglikan yang terletak antara membran plasma dan suatu membran bagian luar. Zat warna violet yang digunakan dalam pewarnaan Gram dapat terbilas dari bakteri Gram negatif (Campbell, 2003). Contoh bakteri Gram positif, yaitu Staphylococcus aureus dan Clostridium perfringens, sedangkan contoh bakteri Gram negatif, yaitu Escherichia coli, dan Psuedomonas
aeruginosa (James, 2006).
E. Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram positif dan diantara
spesies Staphylococcus lain merupakan patogen utama bagi manusia.
Staphylococcus aureus merupakan bentuk koagulase-positif dan hal ini yang
Gambar 3. Bakteri Staphylococcus aureus(Extension, 2010)
Kemampuan patogenik strain Staphylococcus aureus merupakan gabungan dari faktor-faktor ekstraseluler, toksin – toksin yang dihasilkan, dan sifat invasif dari bakteri itu sendiri. Staphylococcus aureus menghasilkan koagulase yaitu suatu protein mirip enzim yang dapat menggumpalkan plasma yang telah diberi oksalat atau sitrat dengan bantuan suatu faktor yang terdapat dalam banyak serum. Koagulase ini terdapat pada permukaan dinding sel dan terikat secara nonenzimatik dengan fibrinogen sehingga bakteri dapat beragregasi. Selain itu, koagulasi dapat mengendapkan fibrin pada permukaan dinding sel sehingga mungkin mengubah pola fogositosis oleh sel – sel fagosit. Bakteri yang membentuk koagulase dianggap mempunyai potensi menjadi invasif (Jawetz, 1996).
Staphylococcus aureus juga memiliki beberapa toksin seperti
sindroma lepuh kulit stafilokukus. TSST-1 menyebabkan demam, syok, dan ruam kulit deskuamatif. Enterotoksin bertanggung jawab pada keracunan makanan. Enterotoksin dihasilkan ketika Staphylococcus aureus tumbuh pada makanan yang mengandung karbohidrat dan protein. Efek muntah yang dihasilkan mungkin akibat perangsangan sistem saraf pusat (pusat muntah) setelah toksin bekerja pada reseptor – reseptor saraf dalam usus (Jawetz, 1996).
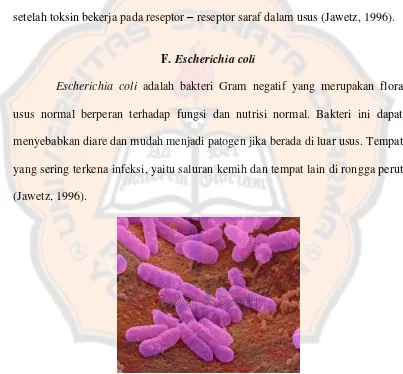
F. Escherichia coli
Escherichia coli adalah bakteri Gram negatif yang merupakan flora
usus normal berperan terhadap fungsi dan nutrisi normal. Bakteri ini dapat menyebabkan diare dan mudah menjadi patogen jika berada di luar usus. Tempat yang sering terkena infeksi, yaitu saluran kemih dan tempat lain di rongga perut (Jawetz, 1996).
Gambar 4. Bakteri Escherichia coli (Psmicrographs, 2010)
Escherichia coli digolongkan menjadi EPEC, ETEC, EHEC, EIEC, dan EAEC berdasarkan ciri khas sifat – sifat virulensinya dan setiap grup menimbulkan penyakit melalui mekanisme yang berbeda- beda. Berikut ini adalah penggolongan Escherichia coli menurut Jawetz (1996):
a) EPEC (E. coli Enteropatogenik) adalah penyebab diare pada anak. EPEC melekat pada sel mukosa usus kecil dan infeksi tersebut mengakibatkan diare cair yang dapat sembuh sendiri tetapi dapat juga menjadi kronik. b) ETEC (E. coli Enterotoksigenik) adalah penyebab tersering dari traveler's
diarrhea dan diare pada bayi di negara berkembang
c) EHEC (E. coli Enterohemoragik) menghasilkan verotoksin karena memiliki efek sitotoksik pada sel Vero, yaitu suatu sel ginjal dari monyet hijau Afrika. EHEC berhubungan dengan kolitis hemoragik, suatu diare yang berat, anemia hemolitik mikroangiopatik, dan trombositopenia. Pencegahan dapat dilakukan dengan memasak daging sapi sampai matang.
d) EIEC (E. coli Enteroinvasif) menyebabkan penyakit yang mirip dengan shigelosis.
e) EAEC (E. coli Enteroagregatif) menyebabkan diare akut dan kronik pada negara berkembang.
G. Candida albicans
Kelompok jamur yang menyebabkan penyakit pada manusia, yaitu : 1. Mould (jamur filamentosa) tumbuh sebagai filamen panjang yang berjalin
keratin dan menyebabkan beberapa penyakit seperti infeksi kuku, kulit, dan rambut.
2. Ragi sejati, merupakan jamur bulat atau oval uniseluler. Contohnya, yaitu
Cryptococcus neoformans yang menyebabkan infeksi paru pada pasien
immunocompromised.
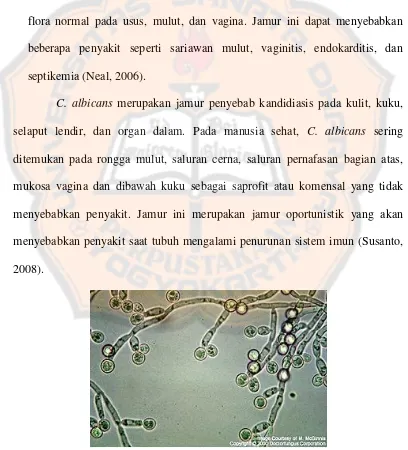
3. Jamur menyerupai ragi. Contohnya adalah Candida albicans yang merupakan flora normal pada usus, mulut, dan vagina. Jamur ini dapat menyebabkan beberapa penyakit seperti sariawan mulut, vaginitis, endokarditis, dan septikemia (Neal, 2006).
C. albicans merupakan jamur penyebab kandidiasis pada kulit, kuku,
selaput lendir, dan organ dalam. Pada manusia sehat, C. albicans sering ditemukan pada rongga mulut, saluran cerna, saluran pernafasan bagian atas, mukosa vagina dan dibawah kuku sebagai saprofit atau komensal yang tidak menyebabkan penyakit. Jamur ini merupakan jamur oportunistik yang akan menyebabkan penyakit saat tubuh mengalami penurunan sistem imun (Susanto, 2008).
Patogenesis Candida albicans terjadi dalam dua tahap, yaitu adhesi dan invasi. Tahap pertama infeksi Candida albicans pada tubuh manusia yaitu pelekatan (adhesi). Adhesi dilakukan dengan melekatkan dinding sel dengan sel inang yang selanjutnya mengaktivasi mitogen activated protein kinase (Map-kinase). Map-kinase diperlukan untuk pertumbuhna hifa invasif dan perkembangan biofilm pada tahap selanjutnya (Kusumaningtyas, 2005).
Setelah adhesi selanjutnya tahap invasi. Hifa Candida albicans melakukan penetrasi ke dalam permukaan epitelium melewati cell junction. Invasi yang ditandai dengan kolonisasi tersebut dipercepat dengan keberadan serum atau saliva. Candida albicans lalu mensekresi proteinse aspartat (SAPs) yang bertanggung jawab terhadap perusakan pada kulit (Kusumaningtyas, 2005).
C. albicans pada media SDA (Sabouraud Dextrose Agar) dan inkubasi
suhu kamar akan berbentuk koloni lunak berwarna coklat dan berbau seperti ragi. C. albicans meragikan glukosa dan maltosa menghasilkan asam dan gas serta tidak bereaksi dengan laktosa (Jawetz, 1996).
H. Antijamur
Antijamur berdasarkan struktur kimianya dapat digolongkan menjadi golongan azol, golongan polien, dan golongan lain. Contoh antijamur golongan azol yaitu imidazol dan triazol, golongan polien yaitu amfoterisin B dan nystatin, dan golongan lain contohnya, yaitu flusitosin, griseofulfin dan terbinafin (Priyanto, 2010).
Nystatin merupakan antijamur golongan polien yang digunakan sebagai
dipakai sebagai antijamur oral karena bersifat toksik. Pemakaian Nystatin untuk infeksi Candida albicans di usus tidak berbahaya karena Nystatin tidak dapat diabsorbsi di usus (Neal, 2006).
Nystatin bekerja dengan mengikat ergosterol atau asam lemak penyusun
membran sel pada dinding sel jamur. Terikatnya ergosterol menyebabkan sel jamur rusak dan lisis. Antijamur golongan ini hanya bersifat toksisitas selektif pada jamur saja karena manusia tidak memiliki ergosterol melainkan kolesterol (Priyanto, 2010).
I. Antibakteri
Spektrum antibakteri dibagi menjadi dua, yaitu berspektrum sempit
(narrow spectrum) dan berspektrum luas (broad spectrum). Antibakberi
berspektrum sempit jika hanya efektif melawan bakteri dalam jumlah terbatas atau satu golongan saja misalnya hanya Gram positif. Jika antibakteri efektif melawan beberapa jenis atau golongan bakteri, misalnya Gram positif dan negatif maka antibakteri tersebut berspektrum luas (Priyanto, 2010).
Intensitas antibakteri dibedakan menjadi bakterisidal dan bakteriostatik. Bakterisidal jika antibakteri dapat membunuh bakteri, sedangkan bakteriostarik jika hanya bisa menghambat atau menghentikan pertumbuhan bakteri. Jika antibakteri yang diberikan bersifat bakteriostatik maka antibodi tubuh yang berperan membunuh bakteri (Priyanto, 2010).
Dinding sel bakteri berfungsi melindungi membran sitoplasma, memelihara bentuk sel, dan mencegah lisis katrena tekanan osmosis. Jika dinding sel rusak atau tidak terbentuk sempurna maka sel dapat lisis atau tidak dapat membelah. Sel lisis terjadi karena cairan disekitar yang hipoosmosis berdifusi ke dalam sel menyebabkan pembengkakan dan diikuti lisis. Contoh antibakteri yang bekerja menghambat sintesis dinding bakteri, yaitu golongan penisilin, sefalosporin, dan polipeptida.
B. Penghambat sintesis protein
Proses sintesis protein bakteri terjadi di ribosom. Antibakteri penghambat sintesis protein biasanya bersifat toksisitas selektif karena ribosom bakteri dan manusia berbeda. Bakteri memiliki ribosom 30 S dan 50 S sedangkan manusia 40 S dan 60 S. Antibakteri ini akan mengikat ribosom 30 S atau 50 S atau keduanya sehingga sintesis protein bakteri terganggu. Contoh antibakteri yang sudah digunakan, yaitu golongan aminoglikosida, tetrasiklin, kloramfenikol, klindamisin, dan makrolida.
C. Antagonis asam folat
Asam folat digunakan bakteri untuk sintesis DNA atau RNA. Tidak seperti manusia, bakteri tidak dapat mengabsorpsi asam folat dari makanannya. Untuk mencukupi kebutuhannya asam folat disintesis sendiri menggunakan
paraamino benzoic acid (PABA). Antibakteri antagonis asam folat memiliki
untuk membentuk asam folat. Contoh antibakteri yang sudah digunakan, yaitu golongan sulfonamid (Priyanto, 2010).
Salah satu antibakteri yang berasal dari tanaman yaitu timol. Timol merupakan salah satu komponen minyak atsiri golongan fenol yang berkerja sebagai antibakteri dengan cara mendenaturasi protein sel bakteri, sehingga terjadi perubahan struktur sel dan dapat menyebabkan kebocoran membran sel. Akibatnya, komponen penting dalam sel akan keluar dan pertumbuhan sel terhambat bahkan sampai terjadi kematian sel (Nio, 2004).
J. Pengukuran Aktivitas Antimikroba
Pengukuran aktivitas antimikroba dapat dilakukan dengan dua cara, yaitu metode difusi dan dilusi. Metode difusi menggunakan kertas cakram atau sumuran. Senyawa yang akan diuji aktivitas antimikrobanya diteteskan ke kertas cakram atau ke dalam sumuran, kemudian dihitung luas zona hambat disekitar kertas cakram atau sumuran. Metode dilusi dilakukan dengan cara mencampur media pertumbuhan cair atau padat dengan mikroba dan senyawa antimikroba yang ingin diuji, lalu diamati tingkat kekeruhannya (Edber, 1986).
K. Landasan Teori
Staphylococcus aureus, Escherichia coli, dan Candida albicans
menyebabkan candidiasis yang bisa berkembang menjadi berbahaya. Penemuan antimikroba terhadap senyawa tersebut terus dilakukan karena adanya resistensi antimikroba.
Jarak tintir merupakan tumbuhan yang getahnya digunakan masyarakat sebagai pengobatan luka bakar maupun iris. Batang jarak tintir mengandung senyawa saponin, alkaloid, flavonoid, dan tanin yang dapat berperan sebagai senyawa antimikroba. Penelitian terkait aktivitas antibakteri getah jarak tintir terhadap bakteri yang ditemukan pada luka telah dilakukan di Filipina oleh Ongtengco pada tahun 1992. Hasil penelitian menyatakan bahwa getah jarak tintir memiliki aktifitas antimikroba terhadap Staphylococcus aureus,
Pseudomonas aeruginosa, dan Escherichia coli dengan nilai KHM
berturut-turut, yaitu 0,098%, 0,78%, dan 1,56%. Penelitian Adelosa (2007) di Nigeria menyatakan bahwa getah jarak tintir lebih cepat efeknya dalam mengobati lesi pada mulut anak akibat infeksi Candida albicans dibandingkan obat Nystatin.
Berdasarkan penelitian yang telah dilakukan sebelumnya getah jarak tintir terbukti merupakan zat yang potensial sebagai antimikroba. Faktor tempat tumbuh tanaman dapat mempengaruhi kadar kandungan senyawa suatu tanaman sehingga aktivitas antimikroba jarak tintir yang tumbuh di Indonesia mungkin saja berbeda dengan yang tumbuh di Nigeria dan Filipina. Hal ini terbukti dari hasil penelitian Widyastuti (2003) yang menyatakan bahwa jenis tanah mempengaruhi kadar minyak atsiri pada tanaman ketumbar (Coriandrum
Pengujian aktivitas antimikroba dapat dilakukan dengan metode dilusi dan difusi. Metode difusi untuk mengetahui diameter zona hambat sedangkan metode dilusi untuk mengetahui KHM suatu senyawa antimikroba.
L. Hipotesis
Getah jarak tintir memiliki aktifitas antimikroba terhadap
Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan
Candida albicans ATCC 10231 serta dapat ditentukan diameter zona hambat
23 BAB III
METODOLOGI PENELITIAN
A. Jenis Rancangan Penelitian
Penelitian tentang Uji Aktivitas Antimikroba getah jarak tintir terhadap
Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan
Candida albicans ATCC 10231 merupakan jenis penelitian eksperimental murni
dengan menggunakan rancangan acak lengkap pola searah.
B. Variabel Penelitian dan Definisi Operasional 1) Variabel penelitian
a. Variabel utama
1) Variabel bebas : getah jarak tintir konsentrasi 12,5 % v/v, 25 % v/v,
50 % v/v, dan 100 % v/v. Seri konsentrasi pada penentuan KHM. 2) Variabel tergantung : diameter zona hambat getah jarak tintir
terhadap pertumbuhan Staphylococcus aureus, Escherichia coli, dan
Candida albicans serta kekeruhan media pada dilusi cair.
b. Variabel pengacau
1) Variabel pengacau terkendali : waktu inkubasi 24 jam, suhu inkubasi 350C, volume media dan suspensi mikroba, serta kekeruhan suspensi mikroba (setara dengan Standard Mac Farland II).
2) Definisi operasional
a. Getah jarak tintir adalah getah yang didapat pada pagi hari dengan melukai tangkai daun sampai getah tidak menetes pada tanaman jarak tintir yang tumbuh di Universitas Sanata Dharma.
b. Diameter zona hambat adalah zona radikal (jernih) dan iradikal (masi ada
pertumbuhan bakteri tetapi lebih sedikit dibandingkan pertumbuhan disekitarnya) disekitar lubang sumuran yang berisi getah jarak tintir dengan berbagai konsentrasi.
c. Difusi sumuran adalah metode yang digunakan untuk mengetahui diameter zona hambat getah jarak tintir dengan cara melubangi media dengan pelubang sumuran diameter lima milimeter dan mengisinya dengan senyawa uji lalu diinkubasi selama 24 jam pada suhu 350C.
d. Dilusi merupakan metode yang digunakan untuk menentukan KHM dengan cara memasukkan masing – masing satu mililiter senyawa uji dan bakteri pada media cair lalu diinkubasi selama 24 dan 48 jam pada suhu 350C lalu dibaca kekeruhannya menggunakan Nephelometer.
e. KHM adalah konsentrasi terkecil getah jarak tintir yang masih bisa menghambat pertumbuhan mikroba uji.
f. Media adalah tempat tumbuh mikroba dan untuk bakteri Staphylococcus
aureus, dan Escherichia coli menggunakan media Mueller-Hinton Agar
(MHA) dan Mueller-Hinton Broth (MHB), sedangkan untuk jamur
Candida albicans menggunakan media Potato Dextrose Agar (PDA) dan
g. Kontrol positif adalah senyawa yang telah teruji memiliki efek
antimikroba terhadap Staphylococcus aureus, Escherichia coli, dan
Candida albicans. Timol 0,2 % digunakan sebagai kontrol positif untuk
Staphylococcus aureus dan Escherichia coli, sedangkan Nystatin 100.000
IU sebagai kontrol positif untuk Candida albicans.
h. Waktu inkubasi adalah waktu yang diperlukan Staphylococcus aureus,
Escherichia coli, dan Candida albicans untuk tumbuh, yaitu 24 jam.
i. Suhu inkubasi merupakan suhu optimum untuk pertumbuhan
Staphylococcus aureus, Escherichia coli, dan Candida albicans, yaitu
pada 350 C.
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini, yaitu getah Jarak tintir yang diambil dari Universitas Sanata Dharma, Yogyakarta, bakteri
Staphylococcus aureus ATCC 25923, dan Escherichia coli ATCC 25922, serta
jamur Candida albicans ATCC 10231 dari Balai Laboratorium Kesehatan, Yogyakarta, aquadest, Aquadest steril, timol 0,2 % dari Labotatorium Farmasi Biologi Universitas Gadjah Mada, Nystatin® 100.000 IU Lapi, media
Mueller-Hinton Agar (MHA), Mueller-Hinton Broth (MHB) Oxoid, Potato Dextrose
Agar (PDA) Oxoid, Brain Heart Infusion (BHI) Oxoid.
D. Alat atau Instrumen Penelitian
(diameter 5 mm), mikropipet (Pipetman), jangka sorong, autoklave (tipe STMN Y.222 100VAC), oven (Memmert), inkubator (Binder), class II BSC (Biological
Safety Cabinet) ESCO, BD PhoenixSpecTMNephelometer.
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman dilakukan dengan menggunakan daun, bunga, dan buah/biji yang dilakukan secara benar menggunakan kunci determinasi berdasarkan acuan, di Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Pengumpulan bahan
Getah jarak tintir didapat dari Universitas Sanata Dharma dengan melukai tangkai daun yang tidak terlalu muda dan tua, dan getah ditampung sampai tidak menetes lagi. Pengambilan getah jarak cina dilakukan pagi hari jam 7 sebelum pengujian.
3. Skrining fitokimia getah jarak tintir
Larutan stok dibuat dengan melarutkan dua mililiter getah jarak tintir menggunakan aquadest hingga 10 ml.
a. Uji pendahuluan
(flavonoida, antrakinon) dengan gugus hidrofilik (gula, asam, fenolat). Pada penambahan larutan kalium hidroksida LP (beberapa tetes) warna menjadi lebih intensif (Dwiatmaka, 2012).
b. Uji tanin
Sebanyak dua mililiter larutan stok ditambah 10 ml aquadest, dipanaskan 30 menit dalam penangas air mendidih dan disaring. Lima mililiter filtrat ditambahkan larutan natrium klorida 2% sebanyak satu mililiter, bila terjadi suspensi atau endapan disaring melalui kertas saring, kemudian filtrat ditambah larutan gelatin 1% sebanyak lima mililiter. Terbentuknya endapan menunjukkan adanya tanin (Dwiatmaka, 2012).
c. Uji saponin
Sebanyak dua mililiter larutan stok ditambah 10 ml aquadest, ditutup dan dikocok kuat – kuat selama 30 detik. Tabung dibiarkan dalam posisi tegak selama 30 menit. Terbentuknya buih setinggi lebih dari tiga centimeter dari permukaan cairan menunjukkan adanya saponin.
d. Uji flavonoida
Sebanyak satu mililiter larutan stok ditambah satu mililiter etanol 95% P lalu ditambahkan lagi dengan 0,1 Gram serbuk magnesium P dan 10 ml asam klorida pekat P. Warna kuning menunjukkan senyawa flavon, kalkon, dan auron. Sedangkan warna jingga menunjukkan flavonoid (Depkes RI, 1995).
e. Uji alkaloida
Sebanyak dua mililiter larutan stok ditambah asam klorida 1% sebanyak 10 ml, panaskan selama 30 menit dalam penangas air mendidih. Suspensi disaring dengan kapas ke dalam tabung reaksi A dan B sama banyak. Larutan A ditambah pereaksi Dragendroff 3 tetes dan larutan B ditambahkan pereaksi Mayer 3 tetes. Terbentuknya endapan pada kedua larutan tersebut menunjukkan adanya alkaloida (Dwiatmaka, 2012). f. Uji antrakinon
4. Uji aktivitas antimikroba
a. Persiapan konsentrasi getah jarak tintir
Getah jarak tintir diambil sesuai perhitungan dan dimasukkan ke dalam labu ukur lalu ditambahkan aquadest steril hingga tanda sehingga didapat konsentrasi 100%, 50%, 25%, dan 12,5%. Perlakuan tersebut dilakukan secara aseptis untuk mengurangi kemungkinan kontaminasi. b. Pembuatan kultur mikroba uji
Kultur murni Staphylococcus aureus, Escherichia coli dan Candida
albicans dalam media agar miring diambil satu ose dan diinokulasikan
pada media cair yang sesuai. Media cair yang digunakan untuk
Staphylococcus aureus dan Escherichia coli digunakan MHB, dan
media yang digunakan untuk Candida albicans yaitu BHI. Selanjutnya media iinkubasi selama 24 jam pada suhu 350 C. Kekeruhan bakteri disamakan dengan Standard Mac Farland II (Kepadatan populasi bakteri 6.108 CFU/ml).
c. Pengukuran diameter zona hambat
dimasukkan ke dalam lubang sumuran sebanyak 50 µ l dan ditunggu kering. Selanjutnya media diinkubasi terbalik dan dihitung diameter zona hambat menggunakan jangka sorong.
d. Penentuan KHM
Satu mililiter kultur mikroba uji dan satu mililiter getah jarak tintir diinokulasikan pada 4 ml media cair lalu diukur kekeruhannya menggunakan Nephelometer. Media diinkubasi di dalam inkubator dan diukur kembali kekeruhannya pada jam ke 24 dan 48 jam. KHM ditentukan dari konsentrasi terendah yang tidak memperlihatkan adanya pertambahan kekeruhan media.
F. Tata Cara Analisis Hasil
Hasil positif uji tabung sebagai skrining fitokimia ditentukan dengan perubahan warna dan atau terjadinya endapan dan diamati secara visual.
32 BAB IV
HASIL DAN PEMBAHASAN A. Determinasi tanaman
Determinasi tanaman dilakukan untuk meyakinkan bahwa tanaman yang getahnya digunakan dalam penelitian ini benar – benar jarak tintir. Determinasi tanaman dilakukan di Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta berdasarkan acuan Flora of Java (Backer, 1965 ). Ciri- ciri jarak tintir yaitu daun berbentuk bangun perisai
(peltatus) atau bulat (orbicularis), lebar 15-35 cm, bertoreh berbagi sampai lebih
dari setengah daun menjadi beberapa bagian. Tangkai daun (petiole) 15-35 cm, solid; daun penumpu (stipula) terbagi menjadi beberapa, panjang dan tidak mengeras. Calyx (kelopak) merah tua; daun mahkota (petalae) berbentuk oval, merah muda, panjang 6-7 mm; buah biasanya obovoid, dengan 3 belahan vertikal, 3 ruang, berwarna kuning ketika matang. Dari hasil determinasi diketahui bahwa tanaman yang getahnya digunakan dalam penelitian benar – benar jarak tintir (Jatropha multifida Linn.).
B. Pengumpulan Getah Jarak Tintir
Getah jarak tintir diambil dari tanaman jarak tintir di lingkungan Kampus III Universitas Sanata Dharma. Getah jarak tintir yang didapat berwarna orange cair (gambar getah dapat dilihat pada lampiran halaman 110). Pengambilan getah dilakukan pada pagi hari karena getah yang didapat lebih banyak. Ada beberapa cara pengambilan getah, yaitu mematahkan tangkai daun, melukai tangkai daun dan melukai batang daun. Peneliti menggunakan cara pematahan tangkai daun dan melukai tangkai daun.
Pematahan tangkai daun digunakan jika ingin mendapatkan getah lebih banyak, tetapi cara ini tidak boleh terlalu sering digunakan karena daun tanaman bisa habis. Proses melukai tangkai daun dapat dilakukan dengan menggunakan pisau atau cutter sehingga getah mengalir dari luka goresan. Hasil yang didapat dengan cara ini lebih sedikit daripada mematahkan tangkai daun tetapi bisa dilakukan berkali – kali karena daun tanaman masih ada. Pada penelitian ini menggunakan cara melukai tangkai daun dan sesekali menggunakan cara mematahkan tangkai daun saat ingin mendapat getah dalam jumlah yang lebih banyak.
C. Skrining Fitokimia Getah Jarak Tintir
diencerken menggunakan aquadest menjadi larutan stok. Getah jarak tintir dapat larut dalam aquadest sehingga digunakan aquades sebagai pelarut. Larutan stok dibuat dengan melarutkan dua mililiter getah jarak tintir menggunakan aquadest hingga 10 ml (gambar hasil skrining fitokimia dapat dilihat pada lampiran halaman 111).
1. Uji pendahuluan
Uji pendahuluan bertujuan untuk mengetahui adanya senyawa yang mengandung kromofor seperti senyawa flavonoid dan antrakinon dengan gugus hidrofilik (gula, asam, fenolat). Hasil positif uji pendahuluan yaitu warna senyawa yang berubah menjadi kuning sampai merah dan dengan penambahan larutan KOH (kalium hidroksida) warna menjadi lebih intensif. Hasil uji pendahuluan yang peneliti lakukan yaitu terbentuk warna kuning kemerahan dari warna awal kuning bening dan setelah penambahan kalium hidroksida warna menjadi merah pekat (intensif). Hal tersebut berarti bahwa getah jarak tintir mengandung golongan senyawa seperti flavonoid dan antrakinon dengan gugus hidrofilik (gula, asam, fenolat). Oleh karena adanya kemungkinan adanya kandungan antrakinon dalam getah jarak tintir maka peneliti menguji juga kandungan antrakinon dalam getah jarak tintir.
2. Uji tanin
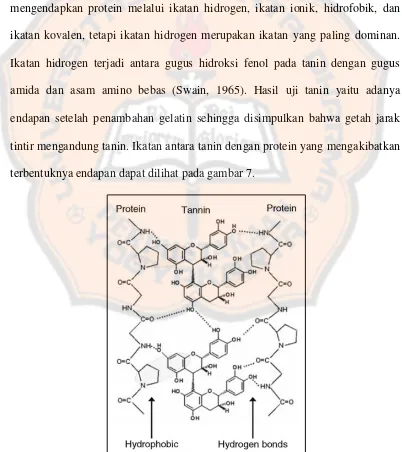
larutan gelatin 1% lalu didiamkan beberapa saat sampai terbentuk endapan yang menunjukkan adanya tanin.
Gelatin merupakan senyawa yang mengandung protein sehingga jika ditambahkan pada larutan yang mengandung tanin maka tanin akan mengendapkan protein tersebut. Reaksi pengendapan ini lebih cepat dengan penambahan natrium klorida (Prasetyo, 2013). Tanin dapat mengikat atau mengendapkan protein melalui ikatan hidrogen, ikatan ionik, hidrofobik, dan ikatan kovalen, tetapi ikatan hidrogen merupakan ikatan yang paling dominan. Ikatan hidrogen terjadi antara gugus hidroksi fenol pada tanin dengan gugus amida dan asam amino bebas (Swain, 1965). Hasil uji tanin yaitu adanya endapan setelah penambahan gelatin sehingga disimpulkan bahwa getah jarak tintir mengandung tanin. Ikatan antara tanin dengan protein yang mengakibatkan terbentuknya endapan dapat dilihat pada gambar 7.
3. Uji saponin
Uji saponin dilakukan dengan menambahkan aquadest ke dalam tabung berisi larutan stok lalu digojog kuat – kuat selama beberapa detik detik. Terbentuknya buih dengan tinggi lebih dari 3 cm yang bertahan selama lebih dari 30 menit menandakan adanya tanin. Sebelum penarikan kesimpulan ditunggu 30 menit supaya buih yang terbentuk murni karena saponin dan bukan karena penggojogan yang kuat.
Saponin mempunyai gugus hidrofob dan hidrofil sehingga menyerupai surfaktan/sabun yang dapat menurunkan tegangan permukaan antara udara/gas dengan air sehingga terbentuk emulsi gas dalam air (Prasetyo, 2013). Uji tanin yang dilakukan terbentuk buih setinggi 4 cm yang bertahan selama 30 menit lebih berarti bahwa getah jarak tintir mengandung saponin.
Mekanisme reaksi terpenoid dengan pereaksi Liebermann-Burchard diawali dengan proses asetilasi gugus hidroksil menggunakan asam asetat anhidrida. Gugus asetil akan lepas sehingga terbentuk ikatan rangkap. Selanjutnya, terjadi pelepasan hidrogen sehingga senyawa mengalami resonansi yang bertindak sebagai elektrofil atau karbokation. Serangan karbokation mengakibatkan adisi elektrofilik yang diikuti pelepasan hidrogen mengakibatkan perpanjangan konjugasi sehingga muncul warna merah – ungu. Reaksi terpenoid dengan pereaksi Liebermann-Burchard menghasilkan warna merah-ungu dapat dilihat pada gambar 8.
4. Uji flavonoid
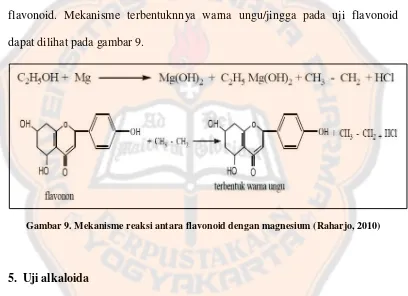
Pada uji flavonoid ditambahkan etanol untuk menyari flavonoid dari getah jarak tintir. Reaksi antara flavonoid yang merupakan senyawa fenol dengan magnesium dalam suasana asam membentuk warna kuning atau jingga. Hasil uji flavonoid menunjukkan warna kuning yang berangsur – angsur berubah menjadi jingga sehingga disimpulkan bahwa getah jarak tintir mengandung flavonoid. Mekanisme terbentuknnya warna ungu/jingga pada uji flavonoid dapat dilihat pada gambar 9.
Gambar 9. Mekanisme reaksi antara flavonoid dengan magnesium (Raharjo, 2010)
5. Uji alkaloida
pada penambahan pereaksi Dragendroff berwarna coklat bening sedangkan pada penambahan pereaksi asam pikrat terbentuk endapan coklat kehitaman.
Alkaloid mengandung atom hidrogen yang dapat bereaksi dengan logam K+ pereaksi Mayer (kalium tertaiodomerkurat(II)) dan pereaksi Dragendorff (Kalium tertaiodobismutat) membentuk kompleks kalium - alkaloid yang mengendap. Mekanisme reaksinya dapat dilihat pada gambar 10 dan 11.
Gambar 10. Mekanisme reaksi alkaloid dengan pereaksi Mayer (Marliana, 2005)
Gambar 11. Mekanisme reaksi alkaloid dengan pereaksi Dragendorff (Marliana, 2005)
6. Uji antrakinon
uji antrakinon getah jarak tintir tidak memberikan warna merah sehingga dapat disimpulkan bahwa getah jarak tintir tidak mengandung antrakinon.
Hasil keseluruhan uji tabung pada skrining fitokimia yang telah dilakukan dapat dilihat pada tabel I.
Tabel I. Hasil uji tabung pada skrining fitokimia getah jarak tintir
No. Pengujian Hasil
D. Uji Potensi Antimikroba Getah Jarak Tintir Secara Difusi Sumuran Uji potensi antimikroba bertujuan untuk mengetahui apakah getah jarak tintir memiliki daya hambat terhadap Staphylococcus aureus, Escherichia coli,
dan Candida albicans. Pengujian antimikroba ini menggunakan metode difusi
sumuran dan teknik aseptis seperti penggunaan bunsen dan mengerjakan pengujian dalam BSC. Teknik aseptis dilakukan supaya mengurangi kemungkinan kontaminasi.
Metode difusi untuk menentukan diameter zona hambat sendiri ada 2 yaitu sumuran dan paper disc. Prinsip metode difusi sumuran, yaitu senyawa uji yang berada di lubang sumuran akan berdifusi ke sekelilingnya dan menghambat pertumbuhan bakteri maupun jamur pada media. Prinsip metode paper disc, yaitu senyawa uji diserap oleh paper disc dan akan berdifusi ke sekelilingnya. Senyawa uji yang memiliki efek antibakteri maupun antifungi akan memberikan zona jernih disekitar lubang sumuran ataupun paper disc.
metode yang berbeda karena ingin membandingkan apakan dengan metode yang berbeda akan memberikan hasil yang berbeda.
Mikroba uji yang digunakan yaitu Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan Candida albicans ATCC 10231. ATCC sendiri adalah kepanjangan dari American Type Culture Collection. Sistem penomoran ini berguna untuk membedakan strain mikroba pada jenis mikroba yang sama. Jenis mikroba yang sama bisa memiliki nomor ATCC yang berbeda karena memiliki gen yang berbeda. Strain ATCC pada bakteri maupun jamur ini digunakan sebagai referensi dengan mencocokkan sifat- sifat/ karakteristik mikrobanya. Bakteri Escherichia coli ATCC 25922 memiliki antigen serotype 06 biotype 1, Candida albicans ATCC 10231 memiliki antigen
serotype A, sedangkan pada Staphylococcus aureus ATCC 25923 belum
diketahui.
Media yang digunakan pada uji antibakteri Staphylococcus aureus dan
Escherichia coli yaitu MHB (Mueller-Hinton Broth) dan MHA (Mueller-Hinton
Agar), sedangkan media yang digunakan sebagai uji antifungi Candida albicans yaitu PDA (Potato Dextrose Agar) dan BHI (Brain Heart Infusion). Media uji yang digunakan harus bisa menumbuhkan bakteri atau jamur uji. Berdasarkan orientasi, bakteri dan jamur uji dapat tumbuh merata pada media uji.
Farland II (Kepadatan populasi bakteri 6.108 CFU/ml). Penyetaraan ini bertujuan supaya bakteri dan jamur yang ditambahkan selalu sama jumlahnya.
Nephelometer merupakan alat yang digunakan untuk mengukur pertumbuhan mikroba melalui kekeruhan media. Satuan yang digunakan, yaitu CFU (colony forming unit) per ml. Prinsip alat tersebut hampir mirip dengan spektrofotometri di mana sinar yang datang akan mengenai objek dan sinar yang diteruskan akan dibaca oleh detektor dan diolah menjadi output data dalam satuan CFU/ml.
Gambar 12. BD PhoenixSpecTM Nephelometer (Miclev, 2014)
sumuran. Media dituang ke dalam cawan petri setelah agar base mengeras. Media yang telah mengeras kemudian dilubangi dengan pelubang sumuran.
Pelubang sumuran yang digunakan berdiameter lima milimeter. Media pada setiap petri dilubangi sebanyak enam bagian. Satu lubang bagian tengah sebagai kontrol negatif, dan lima lubang disekeliling sebagai satu kontrol positif dan empat konsentrasi getah jarak tintir. Volume senyawa uji yang dimasukkan dalam lubang sumuran, yaitu 50 µl. Setelah media diinkubasi selama 24 jam diamati dan diukur zona jernih yang terbentuk disekeliling lubang sumuran. Diameter zona jernih diukur menggunakan jangka sorong.
Pengujian potensi antimikroba ini menggunakan lima kali replikasi, satu kontrol media dan satu kontrol pertumbuhan mikroba. Kontrol media digunakan untuk melihat apakah media yang digunakan terkontaminasi atau tidak. Kontrol pertumbuhan mikroba ini untuk melihat apakah mikroba yang tumbuh pada perlakuan sama dengan pada kontrol. Hasil percobaan menunjukkan bahwa media yang digunakan tidak terkontaminasi dan bahwa mikroba yang tumbuh pada perlakuan sama dengan mikroba uji pada kontrol.
memberikan diameter zona hambat yang lebih baik dibandingkan konsentrasi 1%, 0,8%, dan 0,4%. Diameter zona hambat timol 0,2% pada penelitian tersebut adalah 14,33 mm terhadap Staphylococcus aureus ATCC 25923, dan 12,33 mm terhadap Escherichia coli ATCC 25922.
Kontrol positif yang digunakan pada pengukuran diameter zona hambat getah jarak tintir terhadap Candida albicans yaitu Nystatin 100.000 IU. Penggunaan kontrol positif ini karena pada penelitian yang dilakukan oleh Adelosa (2007) menggunakan Nystatin 100.000 IU sebagai pembanding. Menurut Priyanto (2010), nystatin bekerja dengan mengikat ergosterol pada dinding sel jamur. Terikatnya ergosterol menyebabkan sel jamur rusak dan lisis.
1. Uji potensi antibakteri getah jarak tintir terhadap Staphylococcus aureus
ATCC 25923
Getah jarak tintir memiliki efek antibakteri terhadap Staphylococcus
aureus yang terlihat dari adanya zona jernih / zona hambat disekitar lubang
sumuran (gambar dapat dilihat pada lampiran hal 114). Kontrol negatif aquadest yang digunakan sebagai pelarut getah jarak tintir tidak memiliki zona hambat sehingga zona hambat yang dihasilkan murni dari getah jarak tintir. Kontrol negatif diberi nilai 5 mm yang merupakan diameter sumuran sebagai faktor koreksi. Zona jernih yang terbentuk pada kontrol positif timol 0,2% pada uji ini tidak bulat sehingga untuk menentukan diameter zona hambatnya diukur dari 4 diameter yang berbeda lalu diambil rata – rata. Hasil pengukuran diameter zona hambat getah jarak tintir terhadap bakteri
Tabel II. Diameter zona hambat getah jarak tintir terhadap bakteri
Staphylococcus aureus ATCC 25923
Konsentrasi (%) Diameter Zona Hambat (mm) terhadap Staphylococcus
aureus ATCC 25923 menunjukkan perbedaan yang bermakna pada taraf kepercayaan 95% (n = 5)
Dari data diameter zona hambat dapat diketahui bahwa dengan penambahan konsentrasi akan menambah diameter zona hambat. Menurut Sari (2011) kekuatan antibakteri dibagi menjadi beberapa tingkatan yaitu : diameter zona hambat lebih dari 20 mm berati sangat kuat, 10-20 mm berarti kuat, 5-10 mm berarti sedang dan kurang dari 5 mm berarti lemah. Zona hambat getah jarak tintir terhadap Staphylococcus aureus pada konsentrasi 12,5%, 25%, 50%, dan 100% dapat digolongkan memiliki daya hambat kuat.
Hasil uji statistik menyatakan bahwa data diameter zona hambat pada bakteri Staphylococcus aureus memiliki variansi yang tidak sama dan sebaran data tidak normal sehingga selanjutnya diuji menggunakan uji
Kruskal Wallis. Uji Kruskal Wallis diameter zona didapat p=0,000 (p<0,05)
yang berarti bahwa paling tidak terdapat perbedaan diameter zona hambat antara dua kelompok.
Untuk mengetahui kelompok mana saja yang memiliki perbedaan yang bermakna diuji menggunakan Mann-Whitney. Hasil uji Mann-Whitney menyatakan bahwa semua kelompok konsentrasi memiliki perbedaan yang bermakna satu dengan yang lain (data dapat dilihat pada lampiran hal 93). Hal ini berarti bahwa getah jarak tintir memiliki aktivitas antibakteri terhadap Staphylococcus aureus.
2. Uji potensi antibakteri getah jarak tintir terhadap Escherichia coli
ATCC 25922
Getah jarak tintir memiliki aktivitas antibakteri terhadap Escherichia
coli yang terlihat dari adanya zona hambat disekitar lubang sumuran (gambar
Tabel III. Diameter zona hambat getah jarak tintir terhadap Escherichia coli ATCC 25922
Konsentrasi (%) Diameter Zona Hambat (mm) terhadap
Escherichia coli ATCC 25922
12,5 11,4 ± 0,548 a menunjukkan perbedaan yang bermakna pada taraf kepercayaan 95% (n = 5)
Dari data diameter zona hambat ini juga dapat disimpulkan bahwa dengan penambahan konsentrasi akan menambah diameter zona hambat. Diameter zona hambat getah jarak tintir konsentrasi 12,5% sampai 100% memiliki rentang dari 11,4 mm sampai 17,6 mm sehingga dapat digolongkan sebagai daya hambat kuat menurut penggolongan Sari (2011).
Data diameter zona hambat pada bakteri Escherichia coli juga memiliki variansi yang tidak sama, sebaran data tidak normal dan nilai p=0,000 pada uji Kruskal Wallis seperti pada data diameter zona hambat
Staphylococcus aureus. Hasil uji Mann-Whitney menyatakan bahwa semua
3. Uji potensi antifungi getah jarak tintir terhadap Candida albicans ATCC 10231
Pengujian potensi antifungi ini menggunakan lima kali replikasi, satu kontrol media dan satu kontrol pertumbuhan bakteri. Hasil percobaan menunjukkan bahwa media yang digunakan tidak terkontaminasi dan bahwa jamur yang tumbuh pada perlakuan sama dengan jamur pada kontrol. Hasil pengukuran diameter zona hambat dapat dilihat pada tabel IV.
Tabel IV. Diameter zona hambat getah jarak tintir terhadap bakteri Candida
albicans ATCC 10231
Konsentrasi (%) Diameter Zona Hambat (mm) terhadap Candida
albicans ATCC 10231 menunjukkan perbedaan yang bermakna pada taraf kepercayaan 95% (n = 5)