I. Judul : Titrasi Potensiometri Asam Basa II. Hari / Tanggal Percobaan : Rabu, 10 April 2013
III. Selesai Percobaan : Rabu, 10 April 2013 IV. Tujuan Percobaan :
” Untuk menentukan titik akhir titrasi asam-basa secara potensiometri” V. Tinjauan Pustaka :
Potensiometri merupakan suatu pengukuran potensial atau voltage dari suatu sel elektrokimia yang terdiri dari elektroda dan larutan. Metode ini digunakan untuk mengukur potensial, pH suatu larutan, menentukan titik akhir titrasi dan menentukan konsentrasi ion-ion tertentu dengan menggunakan elektroda selektif ion. Menurut Rouessac 2007, dasar metode potensiometri adalah membuat sel elektrik dari analat suatu larutan sehingga perbedaan potensial sel tersebut berkaitan dengan konsentrasi larutan. Larutan tersebut berisi komponen utama yang mempunyai kemampuan mengion.(Harvey 2000).
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995)
Elektroda pembanding adalah suatu elektroda yang mempunyai harga potensial tetap dengan kata lain harga potensial setengah selnya diketahui konstan dan tidak peka terhadap komposisi larutan yang sedang diselidiki. Terdapat dua jenis elektroda pembanding yaitu :
1. Elektroda pembanding primer
Contoh dari elektroda jenis ini adalah elektroda hidrogen standar. Dimana elektroda ini terbuat dari platina yang dilapisi platina hitam dengan maksud agar absorpsi gas hidrogen pada permukaan elektroda dapat berlangsung sempurna, sehingga reaksinya :
Dapat berlangsung cepat dan reversibel. Potensial setengah sel dari elektroda pembanding primer adalah nol Volt. Notasi setengah sel dari elektroda hidrogen adalah :
Pt/H2 (atm), H+ (M) atau H+ (M), H2 (atm) / Pt
2. Elektroda pembanding sekuder
Beberapa contoh elektroda pembanding yang sering digunakan untuk pengukuran secara potensiometri adalah :
a. Elektroda kalomel (calomel electrode) b. Elektroda perak-perak klorida
Elektroda indikator adalah elektroda yang potensialnya bergantung pada konsentrasi zat yang sedang diselidiki. Elektroda ini terbagi menjadi dua macam yaitu elektroda logam dan elektroda membran. Elektroda ini merupakan pasangan dari elektroda pembanding dan terbagi dalam dua kelompok, yaitu :
1. Elektroda logam
Elektroda logam terbagi dalam empat kelompok diantaranya elektroda jenis pertama, elektroda jenis kedua, elektroda jenis ketiga, dan elektroda untuk jenis sistem redoks.
2. Elektroda membran
Elektroda membran digunakan untuk menunjukkan ion tertentu. Elektroda ini biasanya disebut dengan elektroda selektif ion (ionic selective electrode, ISE). Elektroda digunakan untuk penentuan pH dengan mengukur perbedaan potensial antara larutan pembanding yang keasamannya tetap dan larutan yang dianalisis. Elektroda membran dibagi menjadi empat kelompok, yaitu :
a. Elektroda membran kaca b. Elektroda cairan
c. Elektroda padatan d. Elektroda penunjuk gas
Bila sepotong logam M dicelupkan kedalam suatu larutan yang mengandung ion logam Mn+, maka terjadilah suatu potensial elektroda, yang nilainya diberikan oleh persamaan Nerst sebagai berikut :
E = E0 + (RT/Rf) ln aMn+
Dengan E0 suatu potensial elektroda standar yang konstan dari logam itu. E dapat diukur dengan menggabungkan elektroda itu dengan elektroda rujukan (biasanya dalah elektroda kolomel jenuh), dan mengukur e.m.f. dari sel yang terbentuk. Jadi dengan mengetahui Er elektroda rujukan dapatlah nilai potensial elektroda dihitung, dan jika potensial elektroda standar E0 dari logam itu diketahui, dapatlah aktivitas ion logam aMn+
Dalam larutan itu dihitung, untuk larutan encer aktivitas ion diukur itu akan dapat dikatakan sama dengan konsentrasi ion, dan untuk larutan lebih pekat, yang koefisien aktivitasnya diketahui, dapatlah aktivitas ion terukur itu diubah menjadi konsentrasi padanannya.
Metode Analisis Potensiometri - Potensiometri Langsung
Teknik ini hanya memerlukan pengukuran potensial sebuah indikator elektron ketika dicelupkan dalam larutan yang mengandung konsentrasi yang tidak diketahui dan diketahui dari sebuah analit.Elektroda indikator selalu dianggap sebagai katoda dan elektroda referensi sebagai anoda.
Untuk pengukuran potensiometri langsung, potensial sel dapat diekspresikan sebagai perkembangan potensial oleh elektroda indikator, elektroda referensi, dan potensial jungsi.
- Titrasi Potensiometri
Pada metoda ini dilakukan proses titrasi terhadap larutan asam oleh larutan bersifat basa atau sebaliknya. Bermacam reaksi titrasi dapat diikuti dengan pengukuran potensiometri. Reaksinya harus meliputi penambahan atau pengurangan beberapa ion yang sesuai dengan jenis elektrodenya. Potensial diukur setelah penambahan sejumlah kecil volume titran secara kontinu dengan perangkat automatik. Presisi dapat dipertinggi dengan el konsentrasi.
Sehingga tujuan utama pada titrasi potensiometer adalah untuk menentukan lokasi titik ekivalen.
Titrasi Asam-Basa Menggunakan pH meter
pH meter dapat digunakan untuk mengikuti titrasi asam basa (dapat dianggap sebagai indikator). Pada dasarnya pH meter terdiri atas dua elektroda dan satu voltmeter. Untuk mengukur benda potensial (antara potensial dalam elektroda dan potensial elektroda lainnya disebut elektroda indikator, respon terhadap elektroda indikator menyebabkan pergeseran pada voltmeter yang tertera pada skala pH.
Titrasi adalah analisis dengan mengukur jumlah larutan yang diperlukan untuk bereaksi tepat sama dengan larutan lain. Titrasi ini digunakan pada reaksi netralisasi asam dengan basa pada titik ekivalen (sama tepat atau sesuai).
Cara titrasi yaitu dengan menambahkan setetes demi setetes larutan basa kepada larutan asam. Setiap basa yang diteteskan bereaksi dengan asam dan penetesan dihentikan pada saat jumlah mol H+ setara dengan jumlah mol OH-. Pada saat itulah, larutan bersifat netral dan disebut titik ekivalen.
Larutan basa yang akan diteteskan (titran) dimasukkan ke dalam buret (pipa panjang berskala) dan jumlah yang terpakai dapat diketahui dari tinggi sebelum dan sesudah titrasi. Larutan asam yang akan dititrasi dimasukkan dalam erlenmeyer dengan mengukur volumenya terlebih dahulu. Untuk mengamati titik ekivalen digunakan indikator yang perubahan warnanya disekitar titik ekivalen. Saat terjadi perubahan warna itu disebut titik akhir titrasi.
Sebelum titrasi dilakukan, larutan titrat bersifat asam yang mengandung banyak ion hidrogen dalam larutan tersebut. Namun setelah titrasi dilakukan, jumlah ion hidrogen perlahan-lahan berkurang karena telah bereaksi dengan ion hidronium membentuk air, dan saat terjadi lonjakan pH secara drastis tersebut ion hidrogen (H+) dari HCl telah habis bereaksi dengan ion hidronium (OH-) dari NaOH. Dengan demikian, tidak terdapat lagi ion hidrogen dalam bentuk bebas dalam larutan titrat. Penambahan larutan titrat setelah titik akhir titrasi terjadi menyebabkan jumlah ion hidronium akan semakin meningkat dan menyebabkan naiknya pH larutan (pH larutan basa). Tidak adanya ion hidrogen
di dalam elektrode gelas secara tiba-tiba akan membuat arus yang dihasilkan oleh elektrode gelas menjadi meningkat secara tiba-tiba dan kemudian turun secara tiba-tiba pula.
Dalam menentukan titik ekivalen tersebut dapat dilakukan dengan beberapa cara yaitu dengan membuat grafik potensial atau pH versus volume
titran atau modifikasinya, yaitu turunan pertama
V atau V pH versus volume
titran (Vx), kemudian dari grafik yang diperoleh dicari harga maksimum dan
minimumnya. Cara lain adalah dari turunan keduanya , yaitu 2 2 V atau 2 2 V pH versus volume titran (Vy), Kemudian dari grafik diperoleh titik nolnya.
pH V (ml) ∆pH ∆V V (ml) V(ml)
VI. ALAT DAN BAHAN -Alat
1. Gelas Kimia 2. Buret
3. Klem dan Statif 4. Stirer 5. Pipet 6. pH-meter -Bahan 1. HCl 0,1N 2. NaOH 0,1N 3. Aquades
VII. ALUR KERJA
1. Persiapan Alat
pH meter
Elektroda
- Dinyalakan selama 15 menit untuk pemanasan distandarisasi dengan pH 4,3 dan 9,4
Alat siap pakai
25 mL larutan NaOH 0,1 N
1 mL HCl 0,1 N
pH
- Dicuci dengan botol semprot - Dikeringkan dengan tissue
2. Titrasi Potensiometri
- Dimasukkan dalam gelas kimia
- Elektroda dimasukkan dalam gelas kimia yang berisi larutan NaOH
- Distandarisasi dengan mencatat pH
- Distandarisasi dengan mencatat pH dengan penambahan HCl 1 mL – 1 mL sampai penambahan 30 mL
VIII. HASIL PENGAMATAN No V HCl pH 1. 0 9.59 2. 5 8.58 3. 10 7.21 4. 15 6.44 5. 17 6.29 6. 19 6.09 7. 21 5.99 8. 23 5.88 9. 23.2 5.83 10. 23.4 5.75 11. 23.6 5.68 12. 23.8 5.67 13. 24 5.65 14. 24.1 5.73 15. 24.2 5.91 16. 24.3 5.87 17. 24.4 5.81 18. 24.5 5.78 19. 24.6 5.73 20. 24.7 5.69 21. 24.8 5.65 22. 24.9 5.78 23. 25 5.87 24. 26 5.96 25. 27 6.09
IX. ANALISIS DAN PEMBAHASAN
Praktikum potensiometri ini dilakukan dengan tujuan untuk membuat kurva hubungan antara pH dan volume titran, menentukan titik akhir titrasi, dan menentukan kadar larutan NaOH yang dianalisis. Pada percobaan ini, digunakan HCl yang telah distandardisasi sebagai titran dan NaOH sebagai analitnya. Konsentrasi titran HCl dan analit HCl yaitu 0.1 N. Dan dilakukan pengenceran 100 ml sehingga konsentrasinya berubah menjadi 0.001N kemudian larutan NaOH diambil sebanyak 25 mL kemudian di masukkan dalam beker gelas ditambahkan aquades hingga 50 ml agar stiren tidak mengenai beker glass. Magnetic stire dimasukkan ke dalam beaker glass, yang berfungsi untuk mengaduk larutan yang akan dititrasi. Titrasi kemudian dimulai dengan menambahkan sejumlah volume HCl sesuai petunjuk praktikum, dengan alat stire yang terus berputar saat titrasi dilakukan. Titrasi untuk mengetahui titik akhir / titik ekivalen dari titrasi tersebut.
Saat elektrode membrane gelas dicelupkan ke dalam campuran larutan NaOH dan air, terjadi kesetimbangan antara ion-ion hidrogen yang terdapat di bagian tipis bola gelas dan ion hidronium yang terletak dalam larutan yang diuji. Elektrode gelas akan membiarkan ion OH- untuk menembusnya, tetapi menahan ion yang lain. Semakin besar konsentrasi ion hidrogen dalam larutan NaOH, semakin banyak ion hidrogen yang masuk ke dalam lapisan gelas tadi. Hal ini menyebabkan pada saat awal-awal titrasi, nilai pH kecil. Semakin banyak pentiter yang ditambahkan, semakin sedikit ion hidrogen yang terdapat dalam larutan NaOH, karena ion hidronium (OH-) akan bereaksi dengan ion hidrogen dan membentuk air. Hal ini akan menyebabkan ion hidronium yang memasuki lapisan gelas juga semakin sedikit sehingga muatan elektrode gelas berkurang, maka nilai pH pun menurun. Hal ini dapat dilihat pada kurva hubungan antara pH dan volume pentiter.
0 2 4 6 8 10 12 0 10 20 30 pH volume HCl
Grafik antara V vs pH
Series1Pada kurva di atas dapat dilihat bahwa semakin banyak volume larutan pentiter (HCl) yang ditambahkan ke dalam larutan titrat, pH larutan menjadi semakin turun (asam). Penurunan pH terjadi yaitu dari pH 5.87 yaitu saat volume penambahan titran sebanyak 25 ml. Penurunan pH yang terjadi dengan penambahan sedikit volume titran ini menunjukkan titik akhir titrasi telah terjadi. Penurunan pH terjadi disebabkan terjadinya titik akhir titrasi dimana ion hidronium (OH-) dari NaOH telah habis bereaksi dengan ion hidrogen (H+) dari HCl.
Penambahan larutan titrat setelah titik akhir titrasi terjadi menyebabkan jumlah ion hidrogen akan semakin menurun dan menyebabkan turunnya pH larutan (pH larutan asam). Tidak adanya ion hidrogen di dalam elektrode gelas secara tiba-tiba akan membuat arus yang dihasilkan oleh elektrode gelas menjadi meningkat secara tiba-tiba dan kemudian turun secara tiba-tiba pula. Hal inilah yang memberi sinyal pada pH meter mengenai adanya peningkatan harga pH secara tiba-tiba dari larutan NaOH yang dititrasi oleh HCl
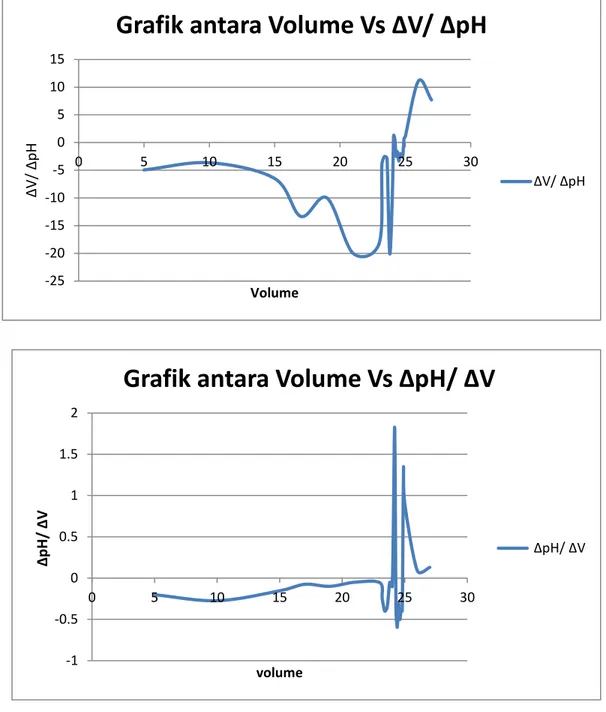
Untuk membandingkan apakah pada saat kurva titrasi naik dengan curam dan tercapai titik kesetimbangan, maka dibuat grafik hubungan antara ΔpH/ΔV dengan volume titran dan grafik hubungan Δ2E/ΔV2 dengan volume titran. Untuk Grafik antara ΔpH/ΔV dengan volume titran tersebut dapat membuktikan
-25 -20 -15 -10 -5 0 5 10 15 0 5 10 15 20 25 30 ∆ V/ ∆ pH Volume
Grafik antara Volume Vs ∆V/ ∆pH
∆V/ ∆pH -1 -0.5 0 0.5 1 1.5 2 0 5 10 15 20 25 30 ∆pH / ∆V volume
Grafik antara Volume Vs ∆pH/ ∆V
∆pH/ ∆V bahwa volume ekivalen HCl yang dibutuhkan untuk menetralkan NaOH (analit) adalah 25 ml, hal itu dapat dilihat dari puncak maksimum dari grafik tersebut.
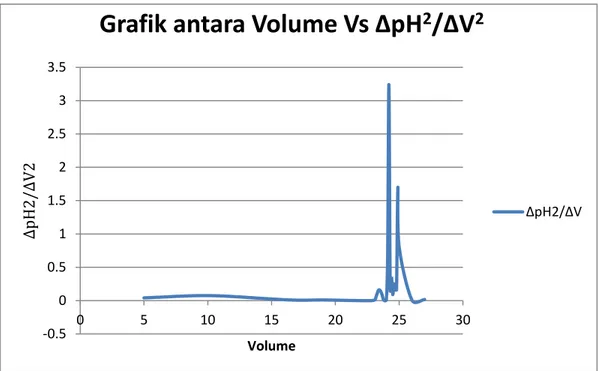
Sementara itu, kesetimbangan belum tercapai pada grafik Δ2pH/ΔV2 karena kenaikan dan penurunan yang pada grafik Δ2pH/ΔV2 dengan volume titran yaitu tidak sesuai dengan teori
-0.5 0 0.5 1 1.5 2 2.5 3 3.5 0 5 10 15 20 25 30 ∆pH 2/∆V2 Volume
Grafik antara Volume Vs ∆pH
2/∆V
2∆pH2/∆V
Hal ini dapat disebabkan oleh beberapa factor, antara lain: (1) suhu; (2) kalibrasi alat; dan factor pengenceran. Suhu dapat mempengaruhi pergeseran kesetimbangan dalam sebuah reaksi kesetimbangan, sama halnya dengan reaksi redoks. Suhu mempengaruhi cepat atau lambatnya pergerakan elektron dan besar-kecilnya tumbukkan antar molekul.
Selanjutnya, menentukan kadar HCl dalam sampel yaitu: eq NaOH = eq HCl
NNaOH . VNaOH = NHCl . VHCl
N NaOH x 25 = 0.001.25
N NaOH = 0.001 N
mg NaOH = N NaOH . V NaOH . Mr NaOH
= 0.001 mmol x 25 ml x 40 mg/mmol
Volume sampel = 52 ml
Sehingga kadar NaOH dalam sampel adalah
Kadar NaOH (mg/ml) = (mg NaOH/vol. sampel) x 100%
= (1 /50) x 100%
= 2 % b/v
X. KESIMPULAN
Berdasarkan percobaan titrasi potensiometri antara NaOH oleh HCl diperoleh bentuk kurva grafik pH vs volume titran (V HCl (ml)) atau modifikasinya, yaitu
turunan pertama ∆pH /∆V versus volume titran (V HCl (ml)) dan turunan
keduanya, yaitu ∆2pH /∆V2 versus volume titran (V HCl (ml)), sehingga diperoleh
volume ekuivalen sebesar 25ml. Serta berdasarkan perhitungan diperoleh berat HCl dalam sampel sebesar 1 mg dengan kadar 2%
DAFTAR PUSTAKA
Agung. 2012. Titrasi Potensiometri. Online.
http://agungm92.blogspot.com/2012/06/praktikum-1-titrasi-potensiometri.html. (diakses pada tanggal 22 April 2013, pukul 23.10 WIB)
Canser, Aim. 2012. Pontensiometri. Online. http://www.slideshare.net/AimCanser/kel-03potensiometri (diakses pada tanggal 22 April 2013, pukul 22.40 WIB)
Day, R.A dan Underwood A.L. 1998. Analisis Kimia Kuantitatif Edisi ke-6. Jakarta: Erlangga
Meranti, Tantri.2012. Titrasi Asam Basa Cara Potensiometri. Online.
http://id.scribd.com/doc/106716248/Percobaan-Iititrasi-Asam-Basa-Cara-Potensiometri. (diakses pada tanggal 22 April 2013, pukul 22.40 WIB)
Shenny. 2012. Potensiometri. Online.
http://shennytjioe.blogspot.com/2012/06/potensiometri.html (diakses pada
tanggal 22 April 2013, pukul 20.28 WIB)
Taufikurohmah, Titik dan Sukarmin. 2009. Penuntun Praktikum Metode Elektroanalitik. Surabaya: Unipress UNESA.
LAMPIRAN