PENGARUH POLARITAS DAN KONSENTRASI EKSTRAK
ANDALIMAN TERHADAP PERTUMBUHAN
Salmonella Typhimurium
ABSTRAK
Polaritas ekstrak andaliman mempengaruhi aktivitas antibakteri terhadap
Salmonella Typhimurium. Ekstrak yang bersifat semipolar (etilasetat) dan polar
(metanol) memiliki aktivitas penghambatan paling tinggi, sedangkan ekstrak nonpolar (heksana) tidak dapat menghambat pertumbuhan S. Typhimurium.
Penghambatan ekstrak metanol lebih rendah dibandingkan dengan ekstrak etilasetat. Fase pertumbuhan adaptasi S. Typhimurium paling peka terhadap ekstrak etilasetat dibandingkan dengan fase eksponensial dan fase stasioner. Konsentrasi ekstrak etilasetat 50% (w/w) sebesar 27.75 mm menunjukkan diameter penghambatan 2 kali lebih tinggi dibandingkan dengan konsent rasi 10% (w/w) sebesar 14.92 mm pada fase adaptasi. Ekstrak etilasetat memiliki nilai MIC dan MBC terhadap S. Typhimurium sebesar 0.80 dan 2.80%, sedangkan nilai MIC dan MBC terhadap ekstrak metanol lebih tinggi, yaitu sebesar 1.20 dan 3.20%. Aktivitas antibakteri ekstrak etilasetat dan metanol terhadap S. Typhimurium masing- masing sebesar 20.77 mm dan 16.67 mm pada konsentrasi 4000 µg/ml. Antibiotik streptomisin dan penisilin G pada konsentrasi 1000 µg/ml tidak dapat menghambat S. Typhimurium, sedangkan polimiksin pada konsentrasi 1000 µg/ml dapat menghambat dengan diameter penghambatan sebesar 11.65 mm sampai dengan 20.77 mm.
PENDAHULUAN
Struktur kimia yang berbeda-beda akan mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap pema nasan, udara, cahaya, logam berat dan derajat keasaman. Dengan diketahuinya senyawa aktif yang terkandung dalam suatu bahan tanaman akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Departemen Kesehatan 2000). Selain itu, sifat penting ya ng harus diperhatikan adalah kepolaran senyawa dilihat dari gugus polarnya, seperti gugus OH, COOH dan lain- lain. Sebelum proses ekstraksi dilakukan sebaiknya dipilih pelarut yang sesuai berdasarkan tingkat kepolaran. Senyawa polar lebih mudah larut dalam pelarut polar, dan senyawa no npolar lebih mudah larut dalam pelarut nonpolar. Derajat polaritas tergantung pada ketetapan dielektrik suatu pelarut, maka semakin besar tetapan dielektrik suatu pelarut maka semakin polar pelarut tersebut. Secara umum ekstraksi bertingkat dilakukan secara berturut-turut
dengan pelarut nonpolar (heksana), lalu dengan pelarut yang kepolarannya menengah (etilasetat atau dietileter), kemudian dengan pelarut polar (metanol atau etanol). Dengan cara demikian akan diperoleh ekstrak kasar (crude extract) yang mengandung berturut-turut senyawa nonpolar, kepolaran menengah (semipolar), dan polar (Hostettmann et al. 1997).
Parhusip et al. (1999) menunjukkan bahwa bubuk rempah andaliman pada konsentrasi 10% (v/v) dengan waktu inkubasi selama 72 jam mampu menghambat
S. Typhimurium, S. aureus, V. cholerae dan B. subtilis. Ardiansyah (2001)
melaporkan bahwa ekstrak etilasetat andaliman pada konsentrasi 5% dengan metode ekstraksi maserasi menunjukkan diameter penghambatan tertinggi terhadap S. Typhimurium yaitu sebesar 8.25 mm. Sedangkan metode refluks
menunjukkan diameter penghambatan yang lebih rendah terhadap
S. Typhimurium yaitu sebesar 4.30 mm. Berdasarkan hasil identifikasi minyak
atsiri andaliman dengan GC-MS diketahui bahwa sedikitnya ada 11 komponen dengan 5 komponen utama yang dapat diidentifikasi, yaitu alfa-pinen, limonen,
geraniol, sitronela dan geranil asetat (Yasni 2001). Diantara komponen tersebut,
telah diketahui alfa-pinen dan limonen merupakan komponen aktif yang memiliki daya antibakteri kuat (Cosentino et al. 2003).
Aktivitas antibakteri dari ekstrak polar biji picung segar dengan konsentrasi 60% terhadap sferoplast meningkat 77,8% dibandingkan dengan sel utuh Salmonella Typhimurium (Nuraida et al. 1999). Pada penelitian tersebut, telah digunakan enzim lisozim untuk menghilangkan dinding sel bakteri, sehingga yang tersisa adalah membran sitoplasma yang rapuh, yang mudah ditembus oleh senyawa-senyawa antibakteri dan selanjutnya masuk ke dalam sel.
Penelitian ini bertujuan untuk mengetahui jenis ekstrak dan konsentrasi
andaliman berdasarkan polaritasnya yang mampu menghambat pertumbuhan S. Typhimurium.
METODOLOGI Bahan dan alat
Bahan yang digunakan adalah buah andaliman Varietas Simanuk, yang berasal dari Medan dan diperoleh dari Pusat Pasar Senen Jakarta. Kultur
Salmonella Typhimurium FNCC 034 diperoleh dari koleksi kultur Pusat Antar
Universitas Pangan dan Gizi Universitas Gadjah Mada (UGM) Yogyakarta.
Ekstraksi dengan Metode Maserasi (Harbone 1996)
Ekstraksi dilakukan dengan perbandingan bahan dan pelarut 1:4 (w/v). Proses ekstraksi dilakukan secara bertingkat dengan metode maserasi selama 24 jam. Pelarut heksana digunakan untuk memperoleh ekstrak nonpolar; ampas diekstraksi lebih lanjut dengan pelarut etilasetat untuk memperoleh ekstrak semipolar; dan selanjutnya ampas yang diperoleh diekstraksi dengan pelarut metanol untuk memperoleh ekstrak polar.
Penentuan Fase Pertumbuhan S. Typhimurium (Lin et al. 2000)
Sebanyak 10 µl suspensi S. Typhimurium diinokulasikan ke dalam 10 ml NB (nutrient broth) dan diinkubasi pada suhu 370C selama 0, 1, 2, 3, 4, 5, 6, 8, 10, 12, 16, 20, 25 jam (Lin et al. 2000). Pada setiap waktu inkubasi dilakukan penghitungan jumlah sel dengan metode pour plate menggunakan media NA (nutrient agar) (Harrigan 1998).
Pengujian Antibakteri Ekstrak Andaliman Menggunakan Metode Difusi Sumur (Garriga et al. 1993)
Pada pengujian ini digunakan 60 µl ekstrak dengan konsentrasi 0, 10, 20, 30, 40, dan 50% (w/w). Cara pembuatan konsentrasi masing- masing ekstrak dapat dilihat pada Lampiran 2. Aktivitas antibakteri ekstrak ditentukan berdasarkan zona penghambatan yang ditunjukkan dengan diameter areal bening.
Pengujian Kualitatif Komponen Fitokimia Ekstrak Andaliman (Harbone 1996)
Pengujian ini dilakukan untuk menentukan penggolongan komponen ekstrak andaliman nonpolar, semipolar dan polar seperti komponen alkaloid, fenol hidrokuinon, terpenoid, steroid, flavonoid dan saponin.
Penentuan MIC dan MBC Ekstrak Andaliman (Kubo et al. 1995)
Ke dalam 14 tabung ekstrak andaliman dengan konsentrasi 0.0, 0.2, 0.4, 0.8, 1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0, 5.0, dan 6.0% (w/w) diinokulasikan 30 µl suspensi S. Typhimurium, lalu diinkubasi 370C selama 24 dan 48 jam. Nilai MIC (%) yaitu konsentrasi minimum ekstrak yang dapat menghambat pertumbuhan bakteri uji sebanyak 90% selama 24 jam. Nilai MBC diperoleh dengan menentukan konsentrasi terendah dari 14 seri tabung uji yang menunjukkan penurunan pertumbuhan S. Typhimurium secara drastis (> 99.9%) setelah diinkubasi 48 jam dibandingkan dengan jumlah S. Typhimurium awal (kontrol).
Pembandingan Potensi Bakterisidal Ekstrak Andaliman dengan Streptomisin, Polimiksin B dan Penisilin G (Lin et al. 2000)
Pengujian dilakukan dengan metode difusi sumur pada konsentrasi antibiotik masing- masing 10, 100, 1000 µg/l (Lewis et al. 2004) untuk polimiksin B, streptomisin dan penisilin G, sedangkan konsentrasi ekstrak andaliman 4000 µg/l. Penentuan potensi bakterisidal dari ekstrak terhadap S. Typhimurium didasarkan pada zona penghambatan yang ditunjukkan dengan diameter areal bening untuk masing- masing antibiotik dan ekstrak andaliman.
Pengaruh pH terhadap Aktivitas Ekstrak Andaliman (Carson dan Riley 1995)
Sebanyak 25 ml agar yang mengandung S. Typhimurium pada fase eksponensial (106 cfu/ml) dituangkan ke dalam cawan petri hingga ketebalan 4 mm. Setelah agar membeku, dibuat sumur dengan diameter 6 mm dan dimasukkan 60 µl ekstrak yang sudah diatur pHnya (pH 4, 5, 6 dan 7). Penentuan pengaruh pH ditentukan berdasarkan zona penghambatan yang ditunjukkan dengan diameter areal bening.
HASIL DAN PEMBAHASAN Rendemen dan Sifat Fisiko Kimia Ekstrak Andaliman
Rendemen ekstrak etilasetat (4.15% w/w) dan ekstrak metanol (3.17% w/w) memiliki kandungan dengan komponen yang relatif sama, seperti alkaloid, fenol hidrokuinon, flavonoid, triterpenoid, saponin, dan steroid. Beberapa hasil penelitian seperti: Woolf (1999), Naidu dan Davidson (2000), Ozean dan Erkmen
(2001), dan Kalemba dan Kunicka (2003) melaporkan bahwa komponen-komponen di atas merupakan komponen-komponen aktif yang dapat bersifat sebagai antibakteri terhadap bakteri patogen.
Selain komponen tersebut di atas, pada ekstrak metanol terdapat juga tanin. Tanin dapat menggumpalkan protein, dan membentuk kompleks dengan beberapa polisakarida, asam nukleat dan alkaloid. Tanin dapat pula mempengaruhi warna, serta berkontribusi terhadap rasa dan aroma (Shahidi dan Naczk 1995). Senyawa tanin telah terbukti memiliki aktivitas antibakteri terutama yang berasal dari ekstrak teh hijau yang mempunyai kemampuan untuk menghambat pertumbuhan bakteri Streptococcus mutans. Penghambatan oleh senyawa aktif gallokatekin diduga karena terdapatnya gugus hidroksil (Sakanaka
et al. 1989).
Senyawa saponin dan antosianin yang terdapat pada daun kedaung merupakan senyawa yang bersifat antibakteri dan antiparasit (Zuhud et al. 2001). Beberapa hasil penelitian lain menyebutkan bahwa senyawa saponin dan flavonoid memiliki daya antibakteri terhadap beberapa spesies bakteri, dan senyawa terpen merupakan senyawa antibakteri utama dalam rempah (Naidu dan Davidson 2000).
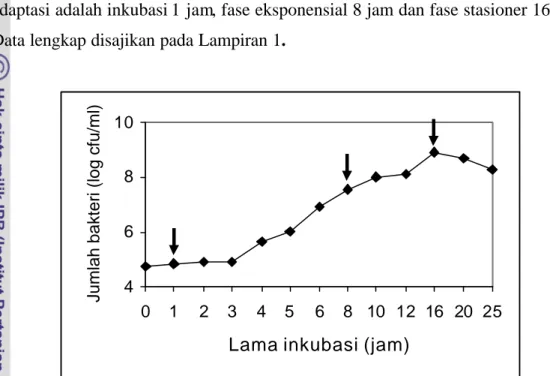
Pola Pertumbuhan S. Typhimurium
Hasil pengamatan fase pertumbuhan bakteri S. Typhimurium dapat dilihat pada Gambar 6.1. Fase adaptasi sel S. Typhimurium terdapat pada interval waktu inkubasi 1-3 jam, sedangkan fase eksponensial berlangsung selama inkubasi 13 jam mulai dari jam ke 3 sampai dengan jam ke 16, sementara fase stasioner berlangsung mulai dari jam ke 16 sampai dengan jam ke 25.
Jumlah sel S. Typhimurium selama fase adaptasi belum meningkat yaitu pada jam ke-3 sebesar 9.0x 104 cfu/ml. Fase eksponensial mulai jam ke-3 sampai jam ke-12 meningkat sampai 3.5x 107 cfu/ml dan setelah jam ke-12 hingga jam ke-16 jumlahnya tetap (fase stasioner), yaitu sebesar (8.30x108 cfu/ml). Fase adaptasi sel S. Typhimurium berlangsung selama 3 jam dan merupakan persiapan untuk fase berikutnya. Berdasarkan penelitian sebelumnya bahwa inkubasi 16 jam pertumbuhan sel S. Typhimurium lebih tinggi (8.30x108 cfu/ml) dibandingkan
dengan S. aureus (7.20x107 cfu/ml) dan B. cereus (3.40x107 cfu/ml). Fase eksponensial berlangsung 3-12 jam, dengan pertumbuhan bakteri sangat cepat, teratur, dan semua bahan dalam sel berada dalam keadaan seimbang (Madigan
et al. 2003). Berdasarkan data di atas ditetapkan bahwa untuk mewakili fase
adaptasi adalah inkubasi 1 jam, fase eksponensial 8 jam dan fase stasioner 16 jam. Data lengkap disajikan pada Lampiran 1.
Gambar 6.1 Kurva Pola Pertumbuhan S. Typhimurium
Pengaruh Polaritas Ekstrak Andaliman terhadap S. Typhimurium
Hasil pengujian aktivitas antibakteri dari ekstrak heksana (nonpolar), etilasetat (semipolar) dan metanol (polar) terhadap S. Typhimurium dengan metode difusi sumur dapat disimak pada Lampiran 8, 9, 10. Ekstrak etilasetat (semipolar) memiliki daya penghambatan lebih tinggi dibandingkan ekstrak metanol (polar) terhadap S. Typhimurium pada masing- masing fase pertumbuhan, sedangkan ekstrak heksana (nonpolar) tidak menunjukkan efek penghambatan terhadap S. Typhimurium.
Ekstrak Nonpolar
Hasil pengujian ekstrak nonpolar andaliman terhadap S. Typhimurium tidak menunjukkan adanya aktivitas antibakteri baik pada pertumbuhan fase adaptasi, fase eksponensial maupun fase stasioner (Lampiran 8, 9, 10). Hal ini dapat dijelaskan bahwa medium nutrient agar (NA) yang digunakan bersifat
4 6 8 10
0 1 2 3 4 5 6 8 10 12 16 20 25 Lama inkubasi (jam)
polar, sedangkan ekstrak andaliman bersifat nonpolar yang dominan mengandung komponen minyak atsiri, sehingga ekstrak nonpolar tidak mampu berdifusi secara baik dalam media NA. Pada pengujian minyak atsiri dilakukan pengamatan terhadap aktivitas Tween 80 sebagai bahan untuk membantu kelarutan minyak dalam media NA (Rahayu 1999) dan dimetil sulfoksida (DMSO) (Ardiansyah 2001).
Meskipun rendemen ekstrak heksana relatif tinggi (6.30% w/w), yang berarti kemampuan pelarut heksana untuk melarutkan banyak kelompok senyawa organik terutama dalam bentuk senyawa nonpolar dalam suatu campuran organik lebih besar, ternyata tidak menunjukkan tingginya daya penghambatan pada fase pertumbuhan S. Typhimurium (Lampiran 8, 9 dan 10). Kemungkinan komponen aktif yang terdapat pada ekstrak heksana tersebut pada konsentrasi 10-50% masih belum dapat menunjukkan penghambatan pertumbuhan S. Typhimurium, sedangkan pada ekstrak etilasetat dan metanol pada konsentrasi tersebut sudah menunjukkan penghambatan.
Menurut Kalemba dan Kunicka (2003) aktivitas antibakteri tergantung pada tipe mikroorganisme dan terutama struktur dinding sel maupun membran luar. Bakteri Gram negatif secara intrinsik lebih tahan terhadap beberapa komponen minyak atsiri seperti terdapatnya permukaan yang bersifat hidrofilik pada membran luar, yang banyak mengandung molekul lipopolisakarida (LPS). Molekul yang bersifat hidrofilik dapat melewati membran luar karena terdapatnya protein porin. Diduga ekstrak heksana (senyawa minyak atsiri dan lipida lainnya) yang mempunyai ukuran molekul besar tidak dapat masuk berpenetrasi dalam dinding sel. Ukuran molekul besar tersebut akan menjadi penghalang masuknya komponen minyak atsiri maupun senyawa fenolik ke dalam sel akibatnya sel tetap dapat tumbuh (Kanazawa et al. 1995).
Hasil identifikasi komponen aktif ekstrak heksana menunjukkan terdapatnya senyawa alkaloid, flavonoid, triterpenoid dan steroid yang relatif rendah dibandingkan dengan ekstrak etilasetat dan ekstrak metanol. Ekstrak heksana tidak mengandung tanin, fenol hidrokuinon dan saponin. Kemungkinan komponen aktif pada ekstrak heksana tersebut pada konsentrasi 10-50% (w/w) tidak dapat menghambat pertumbuhan S. Typhimurium. Parhusip et al. (2005)
melaporkan bahwa ekstrak heksana andaliman terhadap sel B. cereus tidak menunjukkan adanya aktivitas penghambatan, dan pada hasil penelitian sebelumnya dinyatakan S. aureus juga tidak menunjukkan aktivitas penghambatan. Berbeda dengan ekstrak etilasetat dan metanol pada konsentrasi 10-50% menunjukkan adanya aktivitas penghambatan baik terhadap B. cereus,
S. aureus maupun S. Typhimurium.
Ekstrak semipolar
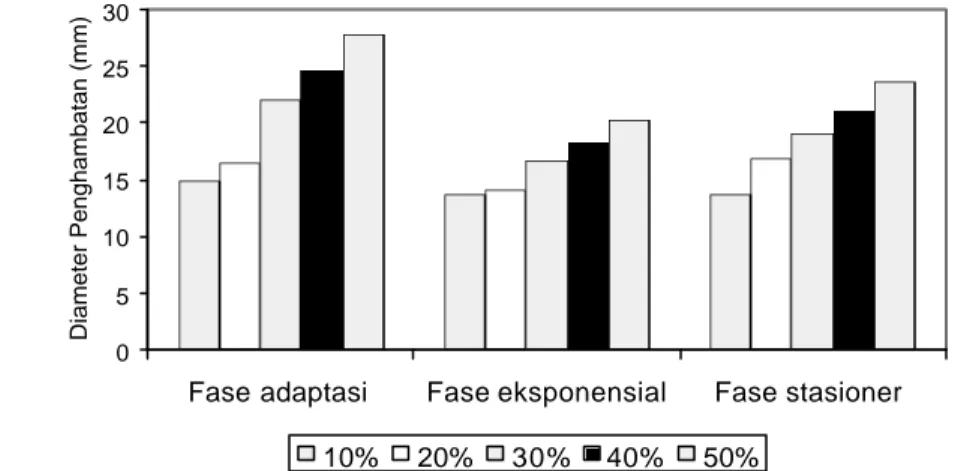
Ekstrak etilasetat lebih tinggi aktivitas antibakterinya dibandingkan ekstrak heksana dan ekstrak metanol. Aktivitas antibakteri ekstrak etilasetat andaliman terhadap S. Typhimurium dapat dilihat pada Gambar 6.2. Aktivitas antibakteri ekstrak etilasetat andaliman terhadap S. Typhimurium memberikan pengaruh berbeda nyata (p<0.01) (Lampiran 23, 24, 25). S. Typhimurium lebih peka pada fase adaptasi terhadap ekstrak etilasetat konsentrasi 50% dengan diameter penghambatan sebesar 27.75 mm dibanding pada fase eksponensial (20.22 mm) dan fase stasioner (23.55 mm). Ekstrak etilasetat memiliki diameter penghambatan terbesar dibanding ekstrak metanol andaliman. Fase adaptasi
S. Typhimurium lebih peka terhadap ekstrak etilasetat dibandingkan ekstrak
metanol. Hal ini kemungkinan karena sel bakteri S. Typhimurium selama fase adaptasi merupakan sel muda yang masih rentan terhadap lingkungan dan memiliki keseimbangan nutrien yang tinggi karena aktivitas metabolisme sel masih tinggi (Madigan et al. 2003).
Aktivitas ekstrak etilasetat andaliman pada setiap fase pertumbuhan (fase adaptasi, fase eksponensial dan fase stasioner) berpengaruh sangat nyata (p<0.01) pada konsentrasi 10-50%. Semakin tinggi konsentrasi ekstrak andaliman yang digunakan (10-50%) menunjukkan semakin tinggi pula diameter penghambatan terhadap S. Typhimurium. Pada fase adaptasi, secara umum konsentrasi ekstrak etilasetat terutama pada konsentrasi lebih besar dari 10% memiliki daya penghambatan lebih besar terhadap S. Typhimurium sebesar 14.92-27.75 mm. Untuk lebih jelasnya aktivitas ekstrak etilasetat pada tiap fase pertumbuhan dapat dilihat pada Gambar 6.2.
Gambar 6.2 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman pada Fase Pertumbuhan S. Typhimurium
Salmonella Typhimurium (Gram negatif) memiliki susunan molekuler
membran luar yang mengandung lipopolisakarida dan memiliki selaput khusus berupa molekul protein (porin) yang memudahkan difusi pasif senyawa hidrofilik dengan berat molekul rendah, seperti gula, asam amino dan ion- ion tertentu. Porin pada S. Typhimurium dan E. coli yaitu OmpC, D dan F dan PhoE, merupakan protein trimer yang menembus kedua permukaan membran luar (Moat
et al. 2002). Protein ini membentuk pori-pori yang relatif tidak khusus yang
memungkinkan difusi bebas zat- zat hidrofil kecil menembus membran. Porin dari spesies yang berbeda mempunyai batas berdifusi yang berbeda, dari bobot molekul 600 kda pada E. coli dan S. Typhimurium sampai lebih dari 3000 kda pada P. aeruginosa (Jawetz et al. 1996; Murray et al. 1998). Semakin tinggi berat molekul protein semakin sulit untuk menembus permukaan membran luar. Umumnya dinding sel bakteri Gram negatif mengandung membran luar yang dapat menghalangi lewatnya molekul- molekul besar (Jawetz et al. 1996; Kalemba dan Kunicka 2003).
Pada Gambar 6.2 terlihat bahwa S. Typhimurium pada fase adaptasi memiliki diameter penghambatan tertinggi sebesar 27.75 mm terhadap ekstrak etilasetat dengan konsentrasi 50% (w/w). Ekstrak etilasetat andaliman pada konsentrasi 10-50% memiliki penghambatan yang berbeda pada setiap fase pertumbuhan S. Typhimurium. Fase adaptasi merupakan fase pertumbuhan bakteri
0 5 10 15 20 25 30
Fase adaptasi Fase eksponensial Fase stasioner
Diameter Penghambatan (mm)
yang masih rentan, maka dengan adanya ekstrak etilasetat akan mempengaruhi penghambatan. Pada fase eksponensial dan stasioner juga terjadi penghambatan terhadap S. Typhimurium namun penghambatannya lebih rendah bila dibandingkan dengan fase adaptasi.
Beberapa senyawa antibakteri dapat merusak integritas membran luar
S. Typhimurium dengan cara merusak ikatan antara kation divalent Ca++ dan Mg++ dengan LPS. Asam-asam organik seperti etilen diamin tetraacetic acid (EDTA), asam sitrat, asam malat (Friedman et al. 2004a), asam tartarat, asam laktat (Gao et al. 1999; Stratford 2000) dan asam klorida (Alakomi et al. 2000) dapat menghambat pertumbuhan bakteri Gram negatif dengan mengkelat kation bivalen Ca++ dan Mg++ tersebut. Terlepasnya kation-kation tersebut dari membran luar akan memudahkan masuknya senyawa antibakteri ke dalam sel (Stratford 2000). Membran luar berfungsi sebagai penghalang masuknya senyawa-senyawa yang tidak diperlukan sel seperti bakteriosin, enzim dan senyawa hidrofobik (Alakomi
et al. 2000).
Ekstrak polar
Ekstrak polar andaliman memberikan pengaruh yang berbeda-beda terhadap S. Typhimurium baik pada fase adaptasi, fase eksponensial maupun fase stasioner (Lampiran 2, 3, 4). Ekstrak polar andaliman memberikan pengaruh sangat nyata (p<0.01) terhadap S. Typhimurium (Lampiran 26, 27 dan 28). Pada konsentrasi yang sama diameter penghambatan ekstrak etilasetat lebih tinggi dibandingkan ekstrak metanol pada setiap fase pertumbuhan S. Typhimurium (Gambar 6.3). S. Typhimurium memiliki ketahanan lebih tinggi terhadap ekstrak polar andaliman dibandingkan ekstrak semipolar. Berdasarkan ketiga fase pertumbuhan (adaptasi, eksponensial dan stasioner) S. Typhimurium ternyata fase stasioner yang memiliki kepekaan lebih tinggi dengan ekstrak metanol.
Pada hasil penelitian sebelumnya terhadap bakteri B. cereus dan S. aureus dilaporkan bahwa diameter penghambatan ekstrak metanol lebih tinggi
menghambat pertumbuhan B. cereus dan S. aureus dibandingkan dengan
S. Typhimurium. Pengaruh ekstrak metanol andaliman lebih tinggi menghambat
B. cereus dihambat sebesar 14.60 mm dan S. aureus sebesar 14.15 mm
masing-masing pada konsentrasi 50%. Penghambatan ekstrak metanol ini lebih rendah dibandingkan dengan penghambatan ekstrak etilasetat pada setiap fase pertumbuhan bakteri patogen uji. Selisih diameter penghambatan ekstrak metanol pada konsentrasi 50% lebih tinggi pada fase eksponensial (6.02 mm) dibandingkan pada fa se adaptasi (4.90 mm) maupun fase stasioner (3.98 mm). Namun penghambatan ekstrak metanol pada konsentrasi 10% tertinggi pada fase stasioner yaitu sebesar 13.77 mm dibandingkan dengan fase eksponensial sebesar 11.35 mm dan fase adaptasi sebesar 10.42 mm terhadap S. Typhimurium.
Gambar 6.3 Pengaruh Konsentrasi Ekstrak Metanol Andaliman pada Fase Pertumbuhan S. Typhimurium
Komponen yang banyak terdapat pada tumbuh-tumbuhan dan bersifat polar antara lain senyawa dari golongan fenolik. Antibakteri fenolik pada umumnya akan berinteraksi dengan protein yang ada pada dinding sel atau sitoplasma melalui ikatan hidrogen dan interaksi hidrofobik (Naidu dan Davidson 2000). Mekanisme lainnya dari ekstrak polar andaliman dalam menghambat pertumbuhan bakteri kemungkinan adalah mengganggu aktivitas enzim dalam sel. Ekstrak air dan ekstrak etanol dari cengkeh, kayu manis dan saga yang bersifat polar akan menghambat enzim dekarboksilase khususnya histidin, lisin dan ornitin dekarboksilase dari bakteri Enterobacter aerogenes (Wendaken dan Sakaguchi 1995). Polaritas suatu senyawa mempengaruhi aktivitas antibakteri seperti
0 5 10 15 20 25 30
Fase adaptasi Fase eksponensial Fase stasioner
Diameter Penghambatan (mm)
6-gingerol yang mempunyai rantai alkil lebih polar daripada 10-gingerol memberikan penghambatan yang lebih rendah terhadap Mycobacterium avium (Hiserodt et al. 1998). Fenomena ini menunjukkan bahwa senyawa polar juga cenderung mempunyai aktivitas antibakteri yang lebih rendah.
Potensi Aktivitas Ekstrak Andaliman dibandingkan dengan Antibiotik
Diameter penghambatan ekstrak etilasetat dan ekstrak metanol andaliman dibandingkan dengan beberapa jenis antibiotik pada beberapa konsentrasi terhadap S. Typhimurium dapat dilihat pada Tabel 6.1.
Tabel 6.1 Perbandingan Diameter Penghambatan Beberapa Antibiotik dan Ekstrak Andaliman Terhadap S. Typhimurium
Antibiotik Konsentrasi Rataan (mm) ± Standar deviasi
Streptomisin 10 µg/ml 0.00 100 µg/ml 0.00 1000 µg/ml 0.00 Penisilin G 10 µg/ml 0.00 100 µg/ml 0.00 1000 µg/ml 0.00 Polimiksin B 10 µg/ml 11.65 ± 0.63 100 µg/ml 19.05 ± 0.64 1000 µg/ml 27.75 ± 0.35 Etilasetat 4000 µg/ml 20.77 ± 0.64 Metanol 4000 µg/ml 16.67 ± 0.49
Streptomisin dan penisilin G tidak menunjukkan adanya aktivitas penghambatan terhadap S. Typhimurium. Penghambatan tertinggi ditunjukkan pada antibiotik polimiksin B sebesar 20.77 mm. Ekstrak etilasetat andaliman dapat menghambat sebesar 20.77 mm dan ekstrak metanol sebesar 16.67 mm pada konsentrasi 4000 µg/ml. Penisilin G merupakan antibiotik yang berspektrum luas dan biasanya efektif terhadap kebanyakan bakteri Gram positif dan Gram negatif terutama strain Staphylococcus aureus dan enterokokus yang biasanya menimbulkan penyakit infeksi pencernaan, kardiovaskular, kulit, dan lain sebagainya. Streptomisin dapat menghambat sintesis protein pada bakteri Gram positif dan Gram negatif seperti enterokokus pada penyakit endokarditis, tuberkulosis terutama pada sub unit ribosom 30S. Polimiksin bersifat bakterisidal
terhadap bakteri Gram negatif berbentuk basil biasanya digunakan untuk mengobati infeksi pada permukaan kulit dan mata.
Polimiksin B merupakan antibiotik yang mengganggu keutuhan membran sel bakteri. Polimiksin B sebagai senyawa amonium kuaterner dapat merusak membran sel setelah bereaksi dengan fosfat pada fosfolipid membran sel bakteri. Antibiotik yang mengubah tegangan permukaan (surface active agents) dapat merusak permeabilitas selektif dari membran sel bakteri. Kerusakan membran sel menyebabkan keluarnya berbagai komponen penting dari dalam sel bakteri yaitu protein, asam nukleat, nukleotida dan lain- lain (Setiabudy dan Gan 1999).
Dalam memenuhi pertumbuhan sel bakteri perlu mensintesis berbagai protein. Sintesis protein berlangsung dalam ribosom, dengan bantuan mRNA dan tRNA. Pada bakteri, ribosom terdiri atas dua subunit yang berdasarkan konstanta sedimentasi dinyatakan sebagai ribosom 30S dan 50S. Untuk berfungsi pada sintesis protein, kedua komponen ini akan bersatu pada pangkal rantai mRNA menjadi ribosom 70S. Salah satu penghambatan sintesis protein dengan adanya antibiotik streptomisin. Antibiotik streptomisin ini berikatan dengan komponen ribosom 30S dan menyebabkan kode pada mRNA salah dibaca oleh tRNA pada waktu sintesis protein. Akibatnya akan terbentuk protein yang abnormal dan nonfungsional bagi sel bakteri.
MIC dan MBC Ekstrak Andaliman
Ekstrak etilasetat dan metanol andaliman memmberikan pengaruh nilai MIC dan MBC yang berbeda-beda terhadap bakteri S. Typhimurium. N ilai MIC dan MBC ekstrak etilasetat lebih peka terhadap S. Typhimurium sebesar 0.80 dan 2.80% dibandingkan terhadap ekstrak metanol dengan nilai MIC dan MBC yang lebih tinggi yaitu sebesar 1.20 dan 3.20%.
Salmonella Typhimurium merupakan bakteri Gram negatif, umumnya
relatif lebih tahan terhadap zat–zat antibakteri tanaman yang bersifat semi polar
dibandingkan kelompok bakteri Gram positif. Struktur dinding sel
S. Typhimurium yang mempunyai membran luar yang terdiri dari beberapa
senyawa antara lain: lipopolisakarida, peptidoglikan, dan lipoprotein (Friedman
dan nisin dapat menghambat S. enterica serovar Typhimurium 790026 terutama merusak membran luar.
Aktivitas senyawa antibakteri yang bersifat hidrofobik (nonpolar) relatif lebih terbatas terutama terhadap bakteri Gram negatif dengan kemampuan seleksi oleh lapisan lipoposakarida dari dinding sel bakteri (Branen dan Davidson 1993). Secara umum, peningkatan daya antibakteri yang seiring dengan penurunan polaritas (mendekati nonpolar) senyawa-senyawa antibakteri, akan lebih efektif menghambat pertumbuhan kelompok bakteri Gram positif dibandingkan bakteri Gram negatif (Branen dan Davidson 1993). Hal ini sejalan dengan hasil- hasil penelitian Farag et al. (1989) dan Kim et al. (1995) yang membuktikan bahwa komponen-komponen minyak atsiri yang bersifat semipolar sampai nonpolar, lebih kuat daya antibakterinya terhadap bakteri Gram positif dibandingkan bakteri Gram negatif. Membran luar ini akan memberikan ketegaran yang lebih kuat dibandingkan dengan bakteri Gram positif. Adanya ketiga senyawa ini pada membran luar menyebabkan bakteri Gram negatif mempunyai ketahanan terhadap senyawa antibakteri (Friedman et al. 2002).
Pengaruh pH terhadap Aktivitas Antibakteri Ekstrak Andaliman
Diameter penghambatan ekstrak etilasetat dan metanol andaliman memberikan pengaruh berbeda tidak nyata (p>0.01) terhadap beberapa pH yang berkisar antara pH 4-7. Kisaran diameter penghambatan ekstrak etilasetat terhadap
S. Typhimurium pada pH 4 – pH 7 adalah sebesar 21.75-19.13 mm (Lampiran
32). Ekstrak etilasetat andaliman pada pH 4 menunjukkan penghambatan paling tinggi yaitu sebesar 21.75 mm. Kisaran diameter penghambatan ekstrak metanol andaliman pada pH 4 - pH 7 adalah sebesar 9.40-11.60 mm (Lampiran 33). Seperti halnya pada ekstrak etilasetat, hasil ini menunjukkan bahwa pada kisaran pH 4 sampai dengan pH 7 ekstrak metanol memiliki daya penghambatan relatif sama, tetapi daya penghambatannya lebih rendah dibandingkan ekstrak etilasetat. Menurut Friedman dan Jurgens (2000) rendahnya konsentrasi minyak atsiri (<1%) menunjukkan pengaruh penghambatan yang berbeda-beda terhadap bakteri, sedangkan konsentrasi 15% minyak atsiri oregano kurang efektif menghambat
seafennel hanya efektif menghambat B. cereus pada konsentrasi tinggi yaitu
sebesar 10 dan 15%.
SIMPULAN
Fase adaptasi S. Typhimurium paling peka terhadap ekstrak etilasetat andaliman dengan diameter penghambatan sebesar 27.75 mm, dibandingkan ekstrak metano l andaliman menghambat sebesar 15.32 mm. Semakin tinggi konsentrasi ekstrak andaliman menunjukkan diameter penghambatan semakin tinggi yaitu ekstrak andaliman pada konsentrasi 50%. Semakin tinggi konsentrasi ekstrak andaliman menunjukkan diameter penghambatan terhadap pertumbuhan
S. Typhimurium akan semakin tinggi baik pada fase adaptasi, eksponensial dan
stasioner. S. Typhimurium peka terhadap ekstrak etilasetat dengan nilai MIC sebesar 0.80 % dan nilai MBC sebesar 2.80% dibandingkan terhadap ekstrak metanol dengan nilai MIC dan MBC yang lebih tinggi, masing- masing sebesar 1.20% dan 3.20%. Diemeter penghambatan ekstrak etilasetat andaliman terhadap
S. Typhimurium efektif pada pH 4, yaitu sebesar 21.75 mm.
Salmonella Typhimurium paling resisten terhadap ant ibiotik penisilin G
dan streptomosin dengan tidak menunjukkan adanya aktivitas penghambatan, sedangkan polimiksin B menunjukkan penghambatan. Aktivitas penghambatan polimiksin B terhadap S. Typhimurium pada konsentrasi 100 µg/ml adalah sebesar 19.05 mm. Ak tivitas ekstrak etilasetat dan ekstrak metanol andaliman pada S. Typhimurium relatif sama dibandingkan polimiksin B pada konsentrasi 4000 µg/ml dengan penghambatan sebesar 20.77 mm dan sebesar 16.67 mm.
DAFTAR PUSTAKA
Ardiansyah. 2001. Teknik ekstraksi komponen antimikroba buah andaliman (Zanthoxylum acanthopodium DC) dan antarasa (Litsea cubeba). [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Alakomi HL, Skytta E, Saarela M, Mattila-Sandholm T. 2000. Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane.
Best GK. 1999. Antibacterial Chemotheraphy. http://pharminto.com/publ/msb/newdrgs.html. [18 Agustus 1999]
Branen AL dan Davidson PM. 1993. Antimicrobials in Foods. Marcel Dekker Inc. New York.
Carson CF dan Riley TV. 1995. Antimicrobial activity of the major components of the essential oil of Melaleuca alternifolia. J Appl Bacteriol 78: 264-269. Conner DE. 1993. Naturally occuring compounds. Di dalam: Davidson PM and
Brannen AL. Antimicrobials in Foods. 2nd eds. Marcel Dekker, New York. Cosentino S, Barra A, Pisano B, Cabizza M, Pirisi FM dan Palmas F. 2003.
Composition and antimicrobial properties of sardinan Juniperus essential oils against foodborne pathogens and spoilage microorganisms. J Food
Prot 66(7):1288-1291.
Departemen Kesehatan RI. 2000. Parameter Standar Umum Ekstrak Tumbuhan
Obat. Direktorat Jendral Pengawasan Obat dan Makanan. Direktorat
Pengawasan Obat Tradisional. Jakarta.
Farag RS, Daw ZY, Hewedl FM dan El-Baroty GSA. 1989. Antimicrobial activity of some Egyption spice essential oils. J Food Prot 52(9):665-667.
Friedman M dan Jurgens HS. 2000. Effect of pH on the stability of plant phenolic compounds. J Agric Food Chem 48: 2101-2110.
Friedman M, Henika PR, Mandrell RE. 2002. Bactericidal activities of plants essential oils and some of their isolated constituents againts
Campylobacter jejuni, Escherichia coli, Listeria monocytogenes and Salmonella enterica. J Food Prot 65: 1545-1560.
Friedman M, Henika PR, Levin CE dan Mandreil RE. 2004a. Antibacterial activities of plant essential oils and their components against Escherichia
coli O157:H7 and Salmonella enteritica in apple juice. J Agric Food Chem
52: 6042-6048.
Friedman M, Buick R dan Elliott CT. 2004b. Antibacterial activities of naturally occuring coumpounds against antibiotic-resistant Bacillus cereus vegetative cells and spora, Escherichia coli, and Staphylococcus aureus. J
Food Prot 67:1774-1778
Gao Yan, Van Belkum MJ dan Stiles ME. 1999. The outer membrane of gram-negative bacteria inhibits antibacterial activity of brochocin-C. App and
Garriga M, Hugas M, Aymerich T dan Monfort JM. 1993. Bacteriocinogenic activity of Lactobacilli from fermentor sausages. J Appl Bacterio 75: 142-148.
Gorman SP, 1991. Microbial adherence and biofilm production. Di dalam Denyer SP, dan Hugo WB. Mechanism of Action of Chemical Biocides Their Study
and Exploitatiton. Blackwell Scientific Publications. London.
Harbone JB. 1996. Metode Fitokimia. Penuntun cara modern menganalisis
tumbuhan. Padmawinata K, Sudiro I, Penerjemah. Bandung: Penerbit ITB.
Harrigan WF. 1998. Laboratory Methods in Food Microbiology. 3rd edition. San Diego.
Hiserodt RD, Franzblau SG dan Rosen RT. 1998. Isolation of 6-,8- and 10-Gingerol from ginger rhizome by HPLC and preliminary evaluation of inhibition of Mycobacterium avium and ycobacterium tuberculosis. J
Agric Food Chem 3: 477-480.
Hostetmann K, Wolfender JL dan Rodrigue ZS. 1997. Rapid detection and subsequent isolation of bioactive constituents of crude plant extracts.
Planta Med 63:2-10
Jawetz E, Melnick J dan Adelberg E. 1996. Medical Microbiology. Appleton & Lange. San Fransisco.
Kalemba D dan Kunicka A. 2003. Antibacterial and antifungal properties of essential oils. Current Medicinal Chemistry.10 (10): 813-829
Kanazawa A, Ikeda T dan Endo T.1995. A novel approach to mode of action of cationic biocides morphological effect on antibacterial activity. J Appl
Bacteriol 78: 55-60.
Kim JM, Marshal MR, Cornell JA, Boston JF dan Wei CI. 1995. Antibacterial activity of carcacrol, citral and geraniols againts Salmonella typhimurium in culture medium and fish cubes. J Food Sci 60 (6): 1365-1368.
Kubo A, Lunde CS, Kubo I. 1995. Antimicrobial activity of the olive oil flavor compounds. J Agric Food Chem. 40(6):999-1003.
Lewis K, Salyers AA, Taber HW, Wax RG. 2004. Bacterial Resistance to
Antimicrobials. Marcel Dekker, Inc.
Lin CM, Preston JF III dan Wei CI. 2000. Antibacterial mechanism of allyl isothiocyanate. J Food Prot Vol 63 (6): 727-734.
Madigan MT, Martinko JM, Parker J. 2003. Brock Biology of Microorganisms. Tenth Edition. Southern Illinois University Carbondale.
Moat AG, Foster JW, dan Spector MP. 2002. Microbial Physiology. Ed ke-4d. New York: Wiley-Liss.
Murhadi. 2002. Isolasi dan karakterisasi komponen-komponen antibakteri dari biji Atung (Parinarium glaberimum Hassk). [disertasi]. Bogor. Program Pascasarjana Institut Pertanian Bogor.
Murray PR. Rosenthal KS. Kobayashi GS. Pfaller MA. 1998. Medical
Microbiology. Third edition. Mosby. London.
Naidu AS dan Davidson PM. 2000. Phyto-phenols. Di dalam Naidu AS, editor.
Natural Food Antimicrobial Systems. New York: CRC Press
Nuraida L, Andarwulan N dan Kristikasari E. 1999. Aktivitas antimikroba biji picung (Pangium edule Reinw.) segar dan terfermentasi terhadap bakteri patogen dan perusak makanan. J Ilmu dan Tek Pangan 4 (2): 18-26.
Oyen LPA dan Nguyen XD. 1999. Plant resources of South-East Asia No. 19. Essential oil plants. Bogor: Prosea Bogor Indonesia.
Ozean M, dan Erkmen O. 2001. Antimicrobial activityof the essential oils of Turkish plant spices. Eur Food Res Technol 212: 658-660.
Parhusip AJN, Posman S, dan Adelina T. 1999. Studi tentang aktivitas antimikroba alami pada andaliman. Di dalam: Prosiding Seminar Nasional Perhimpunan Ahli Teknologi Pangan Indonesia. Jakarta, 12-13 Okt 1999. Parhusip AJN, Jenie BSL, Rahayu WP dan Yasni S. 2005. Pengaruh ekstrak
andaliman (Zanthoxylum acanthopodium DC) terhadap permeabilitas dan hidrofobisitas Bacillus cereus. Jurnal Teknologi dan Industri Pangan XVI (1): 24-30.
Purseglove JW. Spices. Volume II. New York: Longman Inc.
Rahayu WP. 1999. Kajian aktivitas antimikroba ekstrak dan fraksi rimpang lengkuas (Alpina galanga L. Swart) terhadap mikroba patogen dan perusak makanan. [disertasi]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Sakanaka S, Kim M, Taniguchi M, Yamamoto T. 1989. Antibacterial substances in Japanese green tea extract against Streptococcus mutan, a cariogenic bacterium. Agric Biol Chem 53(9):2307-2311.
Setiabudy R. dan Gan VHS. 1995. Antimikroba. Di Dalam: Ganiswarna SG, Setiabudy R, Suyatna FD, Purwantyastuti dan Nafrialdi. Farmakologi dan
Shahidi F dan Naczk M. 1995. Foods Phenolics. Technomic Co., Inc. Lancaster. Stratford M. 2000. Traditional preservatives-organic acids. Di dalam: Robinson
RK, Batt CA, Patel PD, editor. Encyclopedia of Food Microbiology. Volume 1. London: Academic Press.
Wendaken CN dan Sakaguchi M. 1995. Inhibition of amino acid decarboxylase activity of Enterobacter aerogenes by active components in spices. J
Food Prot 58(3): 280.
Woolf A. 1999. Essential oil poisoning. Clinical Toxicology. 37 (6): 721-727. Yasni S. 2001. Aktivitas antimikroba minyak atsiri buah andaliman
(Zanthoxyllum acanthopodium DC) dan antarasa (Litsea cubeba) terhadap bakteri dan kapang serta profil deskriptif komponen aktif penyusunnya.Di dalam: Nuraida L, Dewanti-Hariyadi R, editor. Pangan Tradisional: Basis
Bagi Industri Pangan Fungsional dan Suplemen. Pusat Kajian Makanan
Tradisional IPB. Bogor. Hal 130-138.
Zuhud EAM, Rahayu WP, Wijaya CH dan Sari PP. 2001. Aktivitas antimikroba ekstrak kedawung (Parkia roxburghii G. Don) terhadap bakteri patogen.