BAB II
TINJAUAN PUSTAKA
2.1. Otitis Media Supuratif Kronik (OMSK)
Otitis Media Supuratif Kronis (OMSK) adalah radang kronis telinga tengah dengan perforasi membran timpani dan riwayat keluarnya sekret dari telinga (otorea), baik terus menerus atau hilang timbul lebih dari 2 bulan. Sekret mungkin encer atau kental, bening atau berupa nanah (Helmi, 2005). WHO (2004) menentukan batasan waktu 2 minggu, sedangkan beberapa penulis lain seperti Chole & Nason (2009) serta Deb & Ray (2012) memberikan batasan waktu lebih dari 3 bulan.
Insidens OMSK tinggi di negara berkembang, karena lingkungan yang padat, pelayanan kesehatan yang tidak memadai, higiene yang buruk, dan infeksi saluran pernafasan atas yang rekuren, nutrisi yang kurang dan polusi (WHO, 2004; Chole & Nason 2009). Prevalensi OMSK di seluruh dunia menunjukkan, beban dunia akibat penyakit ini berkisar antara 65-330 juta penderita, 60% (39-200 juta) diantaranya mengalami gangguan pendengaran yang signifikan (WHO, 2004). Prevalensi OMSK di indonesia adalah 2,1% -5,2% (Edward, 2013; Ghanie A, 2013).
2.1.1. Etiologi OMSK
Faktor risiko pada otitis media adalah disfungsi tuba eustachius (misalnya rinosinusitis, hipertrofi adenoid, atau karsinoma nasofaring), imunodefisiensi (primer atau didapat), gangguan fungsi silia, anomali midfasial kongenital (cleft palate atau Down syndrome), dan refluks gastroesofageal. Faktor risiko yang menonjol pada OMSK adalah infeksi otitis media yang berulang dan orang tua dengan riwayat otitis media kronis dengan perawatan yang tidak baik (WHO, 2004; Chole & Nason, 2009).
Streptococcus pneumoniae merupakan bakteri yang terbanyak dijumpai
pada otitis media akut. Pada isolasi dari otitis media kronis, kuman aerobik dan anaerobik juga terlibat pada sebagian kasus. Kuman aerob yang sering dijumpai adalah Pseudomonas aeruginosa, Staphylococcus aureus (Akyıldız et al, 2013), basil gram negatif seperti Escherichia coli, Proteus species, dan Klebsiella species. Kuman anaerob yang paling sering
dijumpai adalah Bacteroides spp. dan Fusobacterium spp. (WHO, 2004; Chole & Sudhoff, 2005; Wright & Valentine, 2008; Chole & Nason, 2009). Jamur dapat pula dijumpai pada otitis media kronis khususnya Aspergillus spp. dan Candida spp. (Chole & Nason 2009).
2.1.2. Klasifikasi OMSK
Secara umum, OMSK dapat dibagi menjadi 2 kelompok (Aboet, 2008; Djaafar et al, 2007; Ghanie, 2013; Dhingra, 2014) :
1. OMSK tipe jinak, tipe benigna, tubo timpanal ditandai dengan perforasi membran timpani dibagian sentral.
2. OMSK tipe bahaya, tipe tulang, atau atikoantral dimana perforasi membran timpani terletak dibagian marginal terutama dibagian posterosuperior. Biasanya OMSK tipe ini disertai pertumbuhan kolesteatoma dan mengakibatkan komplikasi yang serius.
2.1.3. Patogenesis
OMSK ditandai dengan keadaan patologis yaitu inflamasi yang yang terjadi pada telinga tengah dan mastoid. Disfungsi tuba Eustachius memegang peranan penting pada otitis media akut dan otitis media kronis. Kontraksi muskulus veli palatini menyebabkan tuba Eustachius membuka selama proses menelan dan pada kondisi fisiologik tertentu, mengalirkan sekret dari telinga tengah ke nasofaring, mencegah sekret dari nasofaring masuk ke telinga tengah dan menyeimbangkan tekanan antara telinga tengah dengan lingkungan luar (Chole & Nason, 2009).
timpani yang utuh secara normal menghasilkan bantalan gas, yang menolong untuk mencegah refluks sekresi nasofaring ke dalam telinga tengah melalui tuba Eustachius. Hilangnya mekanisme protektif ini menyebabkan terpaparnya telinga tengah terhadap bakteri patogen dari nasofaring (Yates & Anari, 2008).
Bila bakteri memasuki telinga tengah melalui nasofaring atau defek membran timpani, terjadi replikasi bakteri di dalam efusi serosa. Hal ini diikuti oleh pelepasan mediator inflamasi ke dalam ruang telinga tengah. Hiperemia dan leukosit polimorfonuklear yang mendominasi fase inflamasi akut memberi jalan pada fase kronis, ditandai dengan mediator selular mononuklear (makrofag, sel plasma dan limfosit), edema persisten dan jaringan granulasi. Selanjutnya dapat terjadi metaplasia epitel telinga tengah, dimana terjadi perubahan epitel kuboidal menjadi epitel kolumnar pseudostratified yang mampu meningkatkan sekret mukoid. Jaringan
granulasi menjadi lebih fibrotik, kadang-kadang membentuk adhesi terhadap struktur penting di telinga tengah. Hal ini akan mengganggu aerasi antrum dan mastoid dengan mengurangi ruang antara osikel dan mukosa yang memisahkan telinga tengah dari antrum. Obstruksi kronis menyebabkan perubahan yang ireversibel di dalam tulang dan mukosa (Chole & Nason 2009).
2.1.4 Diagnosis
Diagnosa dari OMSK dapat ditegakkan melalui anamnesa yang tepat, pemeriksaan otoskopi, pemeriksaan radiologi, pemeriksaan audiologi serta pemeriksaan mikrobiologi. Gejala klinis meliputi tuli, otorhea, otalgia, obstruksi hidung, tinitus dan vertigo. Tuli dan otorea merupakan gejala yang paling umum terjadi (Chole & Nason, 2009).
otitis media kronis disebabkan oleh reaksi inflamasi (Yates & Anari, 2008; Chole & Nason, 2009).
Pemeriksaan radiologi diperlukan untuk melihat perluasan penyakit dan untuk mengidentifikasi ada tidaknya kolesteatoma. Foto polos proyeksi Schuller perlu untuk melihat perkembangan pneumatisasi sel mastoid dan perluasan penyakit (Helmi, 2005), sedangkan pemeriksaan CT-Scan lebih efektif untuk menunjukkan anatomi tulang temporal dan kolesteatoma. Computed Tomography (CT) dianggap merupakan ”gold standard” untuk mendiagnosis kolesteatoma, namun spesifitasnya kurang
untuk membedakan kolesteatoma dengan jaringan granulasi atau edema. Pada CT-Scan, kolesteatoma terlihat sebagai lesi yang halus dan berbatas tajam, umumnya CT-Scan dilakukan tanpa kontras (Wright & Valentine, 2008; Chole & Nason, 2009).
Pemeriksaan magnetic resonance imaging (MRI) pada kolesteatoma sangat berguna bila disangkakan terjadi komplikasi intrakranial karena keunggulannya dalam visualisasi densitas jaringan lunak. MRI juga efektif untuk mendiagnosis penyakit yang menyebar ke apeks petrosa. Sementara itu pemeriksaan sekret telinga penting untuk menentukan jenis kuman dan menentukan pemilihan antibiotik yang tepat (Wright & Valentine, 2008; Chole & Nason, 2009).
2.2. OMSK Tipe Bahaya
Kasus kolesteatoma telinga tengah ditemukan pertama kalinya pada tahun 1683 oleh Du Verney (Maru et al, 2006). Kata “kolesteatoma” pertama kali perkenalkan oleh Johannes Mueller pada tahun 1838 (Maru et al, 2006; Zarandy & Rutka, 2010).
Secara histologi, epitel kolesteatoma memiliki lapisan yang sama dengan epitel epidermis kulit normal, yang terdiri dari empat lapisan epitel (stratum germitativum, stratum spinosum, stratum granulosum dan stratum corneum). Epitel kolesteatoma dikenal sebaga matriks kolesteatoma, yang tersusun atas epitel keratinizing stratified squamous dan lapisan perimatriks yang mengandung jaringan sub epitel penghubung longgar serta serat kolagen, fibroblas dan sel inflamasi (Alves & Ribeiro, 2004). Sprekelsen et al (2001) sebagaimana dikutip oleh Maru & Pop (2006) menyatakan bahwa matriks dan perimatriks dibentuk oleh kolagen tipe IV, tenascin, fibronectin, b-FGF dan metalloproteinase.
2.2.1. Kekerapan
Angka pasti dari prevalensi tidak diketahui, angka kolesteatoma didapat berkisar 10% dari penderita OMSK. Secara umum, angka kejadian kolesteatoma tergolong rendah, Chole & Nason (2009) menyebutkan insiden kolesteatoma berkisar antara 3-12 kasus per 100.000 populasi. Chole & Sudhoff (2005) menemukan insiden tahunan pada anak-anak sebesar 3 per 100.000 sedangkan pada dewasa 12,6 per 100.000. Jenis kelamin lebih didominanasi laki- laki dibanding perempuan. Baig et al (2011) menemukan sebanyak 10,6% kasus OMSK merupakan tipe bahaya dan sebanyak 30% memiliki komplikasi ke ekstrakranial dan 4% memiliki komplikasi ke intrakranial. Rout et al (2014) menemukan sebanyak 210 penderita OMSK dengan perforasi sentral ternyata 7 diantaranya memiliki kolesteatoma. Gailardin et al (2012) menemukan sebanyak 113 penderita OMSK dengan kolesteatoma ternyata 53 pasien memiliki kolesteatoma yang berada didaerah medial atik, 7 pasien didaerah lateral atik, 43 pasien berada didaerah retrotimpanum dan 10 pasien didaerah cavum timpani epidermois (Chole & Sudhoff, 2005; Chole & Nason, 2009; Baig et al 2011; Rout et al., 2014).
dilakukan oleh Suryanti menemukan 331 penderita OMSK yang berobat di RSUD Soetomo Surabaya periode Januari - Desember 2002.
Di RSUP H. Adam Malik Medan, Nora (2011) menemukan penderita OMSK dengan kolesteatoma yang berkunjung di departemen THT-KL RSUP H. Adam Malik Medan periode 1 Januari 2009 – 31 Desember 2009 adalah sebanyak 47 penderita. Siregar (2013) menemukan sebanyak 119 pasien OMSK dengan kolesteatoma Departemen THT-KL RSUP. H. Adam Malik Medan periode 1 Januari 2006 - 31 Desember 2010.
2.2.2. Etiologi
Etiologi kolesteatoma masih belum diketahui secara pasti dan masih menjadi perdebatan (Dhingra, 2014).
Secara umum kolesteatoma dapat dibagi menjadi : 1. Kolesteatoma Kongenital
Kolesteatoma kongenital pertama kali ditemukan oleh Darlacki dan Clemis sebagai suatu sisa dari jaringan epitel embrionik didalam telinga tanpa perforasi membran timpani dan tanpa riwayat infeksi telinga tengah sebelumnya (Chole & Nason 2009; Dhingra, 2014; Meyer et al, 2014).
Patogenesis kolesteatoma kongenital masih belum diketahui secara pasti dan masih menjadi perdebatan. Ada beberapa teori patogenesis kolesteatoma kongenital :
a. Teori Migrasi
Aimi (1983) mengemukakan bahwa anulus timpanikus mempunyai peranan yang penting dalam mengatur proliferasi dan migrasi dari kulit liang telinga selama masa perkembangan janin. Hilangnya barrier yaitu jaringan ikat dari anulus timpanikus menyebabkan lapisan ektodermal bermigrasi dari liang telinga ke telinga tengah dan membentuk kolesteatoma (Persaud et al, 2007; Fukuda et al, 2011). b. Teori Kontaminasi Cairan Amnion
mesotimpanum melalui tuba Eustachius (Persaud et al, 2007; Maniu et al, 2014).
Gambar 2.1. Tulang temporal bayi baru lahir, menunjukkan cavum timpani terisi oleh cairan amnion (Maniu et al, 2014)
c. Teori Inklusi
Tos (2000) menyatakan bahwa pada kondisi inflamasi yang berulang, terdapat peningkatan risiko terjadinya retraksi, perlekatan dan pelepasan membran timpani dari tulang-tulang pendengaran. Pada proses pelepasan membran timpani, beberapa sel dari membran timpani menjadi terperangkap pada kavum timpani dan membentuk kolesteatoma (Persaud et al, 2007).
d. Teori Pembentukan Epidermoid
Teed (1936) menyatakan penebalan lapisan ektodermal epitel berkembang di dekat ganglion genikulatum, di arah medial dari leher maleus. Massa epitel ini segera mengalami involusi menjadi lapisan telinga tengah yang matur. Jika gagal mengalami involusi, epitel ini menjadi sumber dari kolesteatoma kongenital (Persaud et al, 2007; Maniu et al, 2014).
2. Kolesteatoma di dapat / Acquired Cholestatoma
Kolesteatoma telinga tengah yang didapat bisa terbentuk dari dua mekanisme; retraction pocket dan kolesteatoma sekunder. Kolesteatoma yang terbentuk dari retraction pocket dikenal dengan primary acquired cholesteatoma.
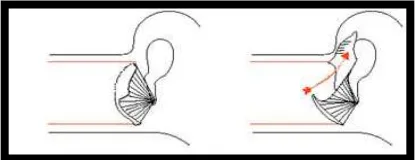
a. Kolesteatoma Didapat Primer 1. Teori Invaginasi
Teori ini didukung oleh penelitian dari Aschof pada tahun 1897 dan Wittmack pada tahun 1933. menyatakan invaginasi membran timpani dari atik atau pars tensa regio posterosuperior membentuk retraction pocket. Kemudian pada tempat ini terbentuk matriks dari kolesteatoma
berupa sel-sel epitel yang tertumpuk pada tempat tersebut (Meyer, 2006; Fukuda et al, 2011; Dhingra, 2014)
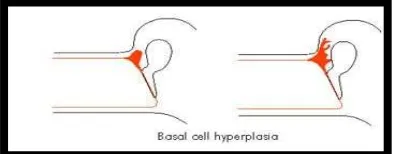
Gambar 2.2. Teori invaginasi (Dhingra, 2014) 2. Teori Hiperplasia Sel Basal (Teori Ruedi)
Terdapat hiperplasia pada lapisan sel basal pars flaksida yang dipicu oleh infeksi telinga tengah pada masa anak-anak. Perluasan kolesteatoma kemudian menembus pars flaksida yang membentuk perforasi attik (Karnik, 2011; Dhingra, 2014; Meyer et al, 2014).
Gambar 2.3. Teori Hiperplasia sel basal (Dhingra, 2014) 3. Teori Otitis Media Efusi
4. Teori Invasi Epitel
Epitel skuamosa pada kulit liang telinga luar dan membran timpani bagian luar bermigrasi ke telinga tengah melalui perforasi membran timpani (Meyer, 2006; Dhingra, 2014).
Gambar 2.4. Teori invasi epitel (Dhingra, 2014). b. Kolesteatoma Didapat Sekunder
1. Migrasi Epitel Skuamosa
Epitel skuamosa berkeratinisasi pada liang telinga luar bermigrasi ke telinga tengah melalui perforasi membran timpani. Sehingga terjadi penumpukan debris-debris sel epitel yang akan menjadi kolesteatoma (Meyer, 2006; Dhingra, 2014).
2. Teori Metaplasia Skuamosa
Epitel dari bagian attic mengalami metaplasia keratinizing skuamosa diakibatkan oleh infeksi. Infeksi kronik diketahui menjadi penyebab dari terjadinya metaplasia. Metaplasia juga ditunjukkan pada kasus otitis media efusi (Meyer, 2006; Fukuda et al, 2011; Dhingra, 2014). 3. Implantasi
Kolesteatoma terjadi akibatimplantasi iatrogenik dari kulit ke telinga tengah atau membran timpani akibat operasi, benda asing atau trauma ledakan (Meyer, 2006; Dhingra, 2014).
2.2.3. Patogenesis Kolesteatoma
Studi dan penelitian yang dipubilkasikan akhir – akhir ini menunjukkan banyak data tentang biologi kolesteatoma. Namun masih banyak pertanyaan yang belum terjawab. Meskipun kolesteatoma merupakan proses hiperproliferatif, namun tidak menunjukkan sifat seperti neoplasia dimana tidak dijumpai metastase dan perubahan genetik (Maniu et al, 2014).
Albino et al (2006) sebagaimana yang dikutip oleh Morales et al (2007) menyimpulkan bahwa: (1) Terbentuknya kolesteatoma tidak berhubungan dengan faktor genetik, yang menjadikannya berbeda dengan keganasan. (2) Induksi terhadap hiperproliferasi sel pada basal epidermis dari kolesteatoma mengimplikasikan suatu respon idiopatik yang potensial, yang berasal rangsangan baik dari dalam maupun luar, melalui produksi sitokin oleh sel-sel pro inflamasi. (3) Bakteri dapat memicu proses terbentuknya kolesteatoma. (4) Sejauh ini, tidak dijumpai perbedaan komposisi molekular maupun selular pada jenis kolesteatoma yang berbeda, baik pada kolesteatoma kongenital, primer, sekunder maupun kolesteatoma rekuren.
Beberapa peneliti telah mempelajari kolesteatoma untuk menemukan etiopatogenesis penyakit yang tetap masih kontroversial ini. Banyak studi yang menggunakan metode imunohistokimia untuk menganalisis sitokin dan perannya dalam etiopatogenesis dari kolesteatoma (Alves & Ribeiro, 2004). Alves et al (2012) meneliti tentang ekspresi EGFR pada 50 pasien dengan kolestatoma dan menemukan peningkatan ekspresi EGFR pada 44 pasien dengan kolesteatoma. Shudoff dkk (2010) menemukan peningkatan ekspresi VEGF pada kolesteatoma dibandingkan dengan kulit liang telinga normal.
makrofag. Sitokin diproduksi oleh banyak sel pada tubuh kecuali eritrosit, sebagai bentuk inisial respon imun yang dapat menstimulasi respon tubuh terhadap inflamasi termasuk penyembuhan luka dan proses remodeling jaringan (Alves & Ribeiro, 2004).
Inflamasi menyebabkan proliferasi sel dan berhubungan dengan terjadinya peningkatan ekspresi dari enzim litik dan sitokin, termasuk asam arakidonat, Intercellular Adhesion Molecule (ICAM), Receptor Activator of Nuclear Factor Kappa-B Ligand (RANKL), Interleukin-1,-2,dan -6 (IL-1, IL-2, IL-6), Matriks Metalloproteinase -2 dan -9 (MMP-2, MMP-9) dan juga Tumor Necrosis Factor-Alpha (TNF-α) (Juhn et al, 2008; Frickmann & Zautner, 2012). Interleukin-1 (IL1) diproduksi terutama oleh makrofag. IL-1 menstimulasi terjadinya resorbsi tulang melalui peningkatan sel prekusor osteoklas. Tumor necrosis factor-alpha (TNF-α) yang juga dikenal sebagai cachectin, juga diproduksi oleh makrofag dan dapat menginduksi produksi kolagenase dan prostaglandin serta bersifat kemotaktik terhadap sel inflamasi. Epidermal growth factor (EGF), merupakan polipeptida yang dapat memicu proliferasi sel,fibroblas dan angiogenesis. Sitokin lain yang juga dapat dijumpai adalah Transforming Growth Factor-Alpha (TGF-α) dan Transforming Growth Factor-Beta (TGF-β) (Juhn et al, 2008).
2.2.4. Stadium OMSK Tipe Bahaya
Menurut Japan Otological Society (JOS) seperti yang dikutip oleh Hashimoto-Ikehara et al. (2011), kolesteatoma memiliki stadium :
• Stadium I : Kolesteatoma tidak meluas melebihi daerah atik
• Stadium II : Kolesteatoma meluas melebihi daerah atik
• Stadium III : Sejumlah kolesteatoma yang menyebabkan sedikitnya satu komplikasi di bawah ini:
1. Kelumpuhan saraf fasialis 2. Komplikasi intrakranial 3. Fistel labirin
4. Defek luas pada liang telinga luar
Kuczkowski et al. (2011) membagi derajat destruksi tulang akibat kolesteatoma menjadi :
a. Ringan : erosi skutum dan osikel.
b. Sedang : destruksi tegmen dan seluruh osikel.
c. Berat : destruksi seluruh osikel, tulang labirin, kanalis fasialis dan liang telinga luar.
Derajat invasi kolesteatoma dan jaringan granulasi dibagi atas: 1. Meliputi 1 area: epitimpanum atau mesotimpanum
2. Meliputi 2 area: epitimpanum atau mesotimpanum dan antrum 3. Meliputi 3 area: mesotimpanum, epitimpanum dan antrum.
2.2.5. Komplikasi Akibat Kolesteatoma
Secara garis besar, komplikasi dari kolesteatoma dibagi menjadi komplikasi intratemporal dan intrakranial :
A. Infeksi intra temporal :
1. Konduktif dan sensorineural hearing loss 2. Paralisis nervus fasialis
3. Fistel labirin 4. Petrositis 5. Mastoiditis B. Infeksi intra kranial :
1. Meningitis 2. Epidural abses 3. Abses otak
4. Empyema subdural 5. Trombosis sinus sigmoid 6. Hidrosefalus otitis
2.3. Penatalaksanaan OMSK Tipe Bahaya
2.3.1. Radical Mastoidectomy
ke ujung mastoid, kemudian membuang inkus dan maleus, hanya stapes atau sisa stapes yang dipertahankan, sehingga membentuk kavitas yang merupakan gabungan rongga mastoid, kavum timpani dan liang telinga. Mukosa kavum timpani juga dibuang seluruhnya, muara tuba eustachius ditutup dengan tandur jaringan lunak. Kerugian cara ini adalah kesulitan rekonstruksi membran timpani, sehingga terdapat kesulitan dalam usaha memperbaiki pendengaran penderita namun dengan teknik ini dapat dicapai suatu safe ear. Untuk kasus kolesteatoma yang lebih lanjut dengan perluasan yang hebat, mastoidektomi radikal perlu dipertimbangkan tanpa melihat kemungkinan mempertahankan fungsi pendengaran (Chole & Nason, 2009).
2.3.2. Modified Radical Mastoidectomy
Modified Radical Mastoidectomy adalah operasi untuk eradikasi
penyakit sehingga epitimpani, antrum mastoid dan liang telinga menjadi suatu rongga yang berhubungan langsung dengan dunia luar melalui meatus akustikus eksternus. Tindakan ini seperti mastoidektomi radikal, kecuali tetap mempertahankan osikel dan membran timpani yang ada untuk mempertahankan fungsi transformasi suara. Teknik operasi ini adalah dengan membersihkan seluruh rongga mastoid, merendahkan dinding posterior liang telinga, dan diikuti dengan tindakan timpanoplasti. Dengan operasi ini fungsi pendengaran dapat dipertahankan. Indikasi operasi ini adalah adanya kolesteatoma di atik dan antrum dengan mesotimpanum normal dan defek hanya pada pars flaksida (Chole & Nason, 2009).
2.3.3. Atikotomi
2.4.Matriks metalloproteinase (MMP)
Matriks metalloproteinase (MMP) pertama kali diidentifikasi pada vertebra oleh Jerome Gross dan Charles M. Laepiere pada tahun 1962 yang meneliti degradasi kolagen tripel-helical selama metamorfose kecebong (Krizkova et al, 2011).
Matrix metalloproteinase (MMP), yang juga dikenal dengan matrixin, adalah keluarga dari Zn-dependent endopeptidase, yang pada pH normal, bertanggung jawab terhadap proses degradasi berbagai jenis protein seperti kolagen, elastin, gelatin, matriks glikoprotein dan proteoglikan pada matriks intraseluler dan membran basal (Verma & Hansch, 2007). MMP disekresikan oleh bermacam connective tissue dan sel pro inflamasi termasuk sel fibroblas, osteoblas, keratinosit, makrofag, neutrofil, limfosit dan sel endotel (Khasigov et al, 2001; Verma & Hansch, 2007; Maniu et al, 2014).
Sejauh ini, terdapat 26 jenis MMP berbeda yang berhasil diidentifikasi pada manusia termasuk data dan struktur primer masing-masing (Amalinei et al, 2007). Berdasarkan struktur primer, spesifikasi substrat dan lokasi sel, enzym- enzym ini dapat dibagi setidaknya menjadi 6 sub famili sebagaimana yang dapat dilihat pada tabel 1:
Enzim MMP
- Stromelysin–1 (progelatinase) - Stromelysin–2
- Matrilysin–1 (uterine matrilysin) - Matrilysin–2 (endometase)
MMP–7 MMP–26 Membrane-type MMPs Transmembrane
- MT1–MMP - MT2–MMP
- MT3–MMP
- Macrophage elastase - RASI–1 Tabel 2.1. Grup MMP ( Amilinei et al, 2007)
Secara fisiologis, enzym tersebut berperan pada remodelling jaringan seperti pada perkembangan embrio, angiogenesis, ovulasi, pertumbuhan payudara dan pada proses penyembuhan luka (Amilinei, 2007; Decock et al, 2008). Dalam keadaan normal, aktifits MMP dikendalikan oleh sel endogen spesifik Tissue Inhibitors of Metalloproteinases (TIMPs). Hilangnya kontrol terhadap regulasi tersebut dapat menimbulkan berbagai keadaan seperti artritis, arterosklerosis, aneurisma, nefritis, radang jaringan lunak, dan fibrosis (Bode et al, 1999). Pada kondisi fisiologis maupun patologis, ekspresi MMP akan cepat terangsang ketika remodelling jaringan diperlukan (Decock et al, 2008).
Pada penyakit keganasan, MMP telah diketahui memiliki peranan penting terhadap proliferasi, migrasi, invasi dan metastasis berbagai jenis kanker pada manusia karena MMP juga dapat diproduksi oleh sel tumor dan/atau sel stroma disekitar sel tumor tersebut (Stark et al, 2007; Decock et al, 2008).
Aktivitas MMP diatur pada tiga tahap yaitu transkripsi, aktivasi zimogen prekursor dan inhibisi oleh inhibitor terutama Tissue Inhibitors of Metalloproteinases (TIMPs) (Amalinei, 2007). TIMP terdiri dari empat
gelatinase. TIMP-2 mengikat MMP-2 dan juga menghambat aktivitas MMP-1, MMP-3, MMP-7 dan MMP-9 (Chen et al, 2011).
2.4.1. Matriks metalloproteinase-9 (MMP-9) pada OMSK tipe bahaya
MMP-9 (92-kDa gelatinase) pertama kali disaring dari makrofag manusia (Vasala, 2008). Dari keseluruhan jenis MMP yang telah ditemukan sampai saat ini, jenis gelatinase dalam hal ini MMP-2 dan MMP-9 merupakan enzim yang utama dalam perannya sebagai enzim yang mendegradasi kolagen tipe IV, V, VII, X, XI dan XIV, gelatin dan elastin (Khasigov et al, 2001; Amalinei 2007; Chen et al, 2011).
MMP-2 dan MMP-9 adalah enzim yang paling banyak diteliti karena sangat berhubungan dengan pertumbuhan dan perkembangan sel kanker (Decock et al, 2008). Ekspresi MMP-2 dan MMP-9 mempunyai peranan dalam karakter invasi sel melalui kemampuannya untuk mendegradasi kolagen tipe IV yang merupakan komponen utama membran basal (Yoshizaki et al, 1998).
OMSK dengan kolesteatoma memiliki karakteristik berupa terjadinya destruksi struktur telinga tengah maupun dalam melalui resorbsi tulang secara terus menerus yang pada akhirnya dapat menyebabkan gangguan pendengaran dan berbagai komplikasi lainnya. saat ini telah disepakati bahwa resorbsi dan destruksi tulang disebabkan oleh aktifitas lokal dari osteoklas (Juhasz et al, 2009). Pada tahun 1969, Abramson melaporkan keterlibatan kolagenolisis pada kolesteatoma untuk pertama kalinya (Schonermark et al, 1996). Pada kolesteatoma, beberapa studi menerangkan bahwa ketidakseimbangan fungsi pengaturan MMP dan peningkatan ekspresi MMP secara keseluruhan dan berkurangnya inhibisi dari TIMP menyebabkan kerusakan pada matriks ekstraseluler (Maniu et al, 2014).
Isoenzym spesifik pada kolesteatoma (MMP-2, MMP-3 dan MMP-9) pertama kali diidentifikasi pada tahun 1996 melalui pemeriksaan imunohistokimia. Bernal et al (2001) menyatakan bahwa MMP dan fibroblast basic growth factor dapat menjelaskan sifat destruksi dan
melibatkan kolesteatoma dan kanker telinga tengah. Mereka berpendapat bahwa perubahan antara metalloproteinase dan inhibitornya menjadi alasan dibalik aktifitas resobsi tulang pada kolesteatoma dan kanker telinga tengah. Jazionek et al (2008) menemukan tingkat aktifitas yang signifikan pada MMP-9 (92-kDa) dibanding pada kulit liang telinga normal dengan pemeriksaan zymography. Schmidt et al (2001) juga menemukan peningkatan ekspresi MMP-9 dibandingkan dengan kulit liang telinga normal.
Pada kolesteatoma, gelatinase memainkan perannya melalui pembersihan pada bagian osteoid pada permukaan tulang sehingga memicu aktivasi dari osteoklas (Schmidt et al, 2001).
2.5. Anatomi Telinga Tengah
Secara anatomi telinga dibagi atas 3 yaitu telinga luar, telinga tengah, dan telinga dalam (Dhingra, 2014). Telinga tengah adalah suatu ruang antara membran timpani dengan badan kapsul dari labirin pada daerah petrosa dari tulang temporal yang dimana terdapat rantai tulang pendengaran. Telinga tengah terdiri dari membran timpani, kavum timpani, tuba eustachius, dan prosesus mastoid. (Wright & Valentine, 2008; Gacek 2009; Dhingra, 2014) .
2.5.1. Membran timpani
Membran timpani membentuk dinding lateral kavum timpani dan memisahkan telinga luar dan telinga tengah. Membran timpani berbentuk bulat dan mempunyai ukuran vertikal kira-kira 9-10 mm, horizontal 8-9 mm, tebal ± 0,1 mm (Wright & Valentine 2008; Dhingra, 2014).
Membran timpani secara anatomi terdiri dari 2 bagian yaitu pars tensa terletak di bagian bawah, tegang dan lebih luas, serta pars flaksida (membran Shrapnell) di bagian atas yang lebih tipis karena mengandung sedikit lapisan fibrosa (Gacek, 2009).
Secara histologis membran timpani terdiri dari tiga lapisan, yaitu (Gulya, 2003; Menner, 2003; Wright & Valentine 2008; Dhingra 2014) :
2. Lapisan mukosa (stratum mukosum) yang berasal dari mukosa telinga tengah.
3. Lapisan fibrosa (lamina propria) terletak diantara stratum kutaneum dan stratum mukosum.
2.5.2. Kavum timpani
Kavum timpani merupakan suatu ruang yang terletak diantara membran timpani dan telinga dalam. Kavum timpani adalah suatu ruang bikonkaf dengan diameter vertikal dan antero-posteriornya sekitar 15 mm dan diameter transversal 2-6 mm, yang mempunyai 6 dinding, yang dibatasi oleh (Helmi 2005; Wright & Valentine 2008; Lee, 2008). :
1. Dinding atas, dibatasi oleh tulang yang tipis yang disebut tegmen timpani, kadang-kadang mengalami dehisensi.
2. Dinding bawah, dibentuk oleh tulang tipis yang membatasi kavum timpani dari bulbus vena jugularis.
3. Dinding lateral, dibentuk terutama oleh membran timpani.
4. Dinding anterior, berhubungan dengan m. tensor timpani, ostium tuba Eustachius, dan dinding dari karotis.
5. Dinding medial, memisahkan kavum timpani dari telinga dalam. Pada dinding medial terdapat promontorium yang merupakan lingkaran basal koklea. Pada bagian belakang bawah dinding media ini terdapat fenestra koklea (rotundum), dan pada bagian belakang atas terdapat fenestra ovale.
6. Dinding posterior, bagian atas berhubungan dengan sellulae mastoideus melalui aditus ad antrum.
Dalam kavum timpani terdapat tulang-tulang pendengaran yang berhubungan satu sama lain terdiri dari maleus, inkus dan stapes yang menghubungkan membran timpani dengan foramen ovale (Helmi 2005; Wright & Valentine 2008; Gacek 2009).
2.5.3. Tuba Eustachius
(Poe & Gopen, 2009). Kestabilannya oleh karena adanya kontraksi muskulus tensor veli palatini dan muskulus levator veli palatini pada saat mengunyah dan menguap. Tiga perempat medial merupakan tulang rawan yang dikelilingi oleh jaringan lunak, jaringan adiposa dan epitel saluran nafas (Menner, 2003; Wright & Valentine 2008; Gacek 2009).
Tuba Eusthacius memiliki ukuran 17-18 mm pada bayi baru lahir serta tumbuh menjadi 35 mm pada saat dewasa. Tuba Eusthacius memiliki tekanan 200-300 mmH2O (Gulya, 2003; Lee, 2008).
2.5.4. Prosesus mastoid
Pneumatisasi mastoid ternyata saling berhubungan dan drainasenya menuju aditus ad antrum. Terdapat tiga tipe pneumatisasi, yaitu pneumatik atau selular, diploik dan sklerotik atau aselular (Dhingra, 2014). Pada tipe pneumatik, hampir seluruh prosesus mastoid terisi oleh pneumatisasi, pada tipe sklerotik tidak terdapat pneumatisasi sama sekali, sedangkan pada tipe diploik pneumatisasi kurang berkembang. Sel mastoid dapat meluas ke daerah sekitarnya, sampai ke arkus zigomatikus dan ke pars skuamosa tulang temporal (Wright & Valentine 2008; Gacek 2009; Dhingra, 2014).
Antrum mastoid adalah suatu rongga di dalam prosesus mastoid yang terletak tepat di belakang epitimpani. Aditus ad antrum adalah saluran yang menghubungkan antrum dengan epitimpani. Lempeng dura merupakan bagian tulang tipis yang biasanya lebih keras dari tulang sekitarnya yang membatasi rongga mastoid dengan duramater, sedangkan yang membatasi rongga mastoid dengan sinus lateralis disebut lempeng sinus. Sudut sinodura dapat ditemukan dengan membuang sebersih-bersihnya sel pneumatisasi mastoid di bagian superior inferior lempeng dura dan posterior superior lempeng sinus (Wright & Valentine 2008; Gacek 2009).
2.5.5. Vaskularisasi kavum timpani
masuk melalui fisura petrotimpani dan berjalan sepanjang tuba Eustachius dan kanalis semisirkularis menuju tensor timpani. Arteri meningea media bercabang menjadi arteri petrosus superfisialis yang berjalan bersama nervus petrosus superfisialis mayor dan memasuki kanalis fasialis di hiatus. Anastomosis pembuluh darah ini dengan cabang arteri aurikularis posterior, arteri stilomastoideus, yang memasuki kanalis fasialis di bagian inferior melalui foramen stilomastoideus. Cabang arteri stilomastoideus meninggalkan kanalis Fallopian dan berjalan melalui kanalikulus bersama nervus korda timpani untuk memasuki telinga tengah. Akhirnya, arteri timpani inferior, cabang dari arteri faringeal asenden, memasuki telinga tengah melalui kanalikulus timpani di dalam hipotimpani dengan cabang timpani dari nervus ke sembilan (Helmi, 2005; Gacek, 2009).
2.6. Pemeriksaan Imunohistokimia
Pemeriksaan imunohistokimia dapat memberi informasi mengenai kandungan berbagai unsur molekul di dalam sel normal maupun sel neoplastik. Dasar dari pemeriksaan ini adalah pengikatan antigen (yang terkandung dalam sel) dengan antibodi spesifiknya yang diberi label chromogen. Teknik ini diawali dengan prosedur histoteknik yaitu prosedur
pembuatan irisan jaringan (histologi) untuk diamati di bawah mikroskop. Irisan jaringan yang didapat kemudian memasuki prosedur imunohistokimia (Hardjolukito & Endang 2005).
Imunohistokimia menjadi teknik pilihan untuk menentukan petanda-petanda biologik tersebut karena relatif mudah, murah dan dapat diterapkan pada sediaan rutin histopatologik. Namun demikian perlu diperhatikan sejumlah faktor yang dapat mempengaruhi hasil pemeriksaan, dimana pengaruh faktor-faktor tersebut dimulai dari tahap pembedahan, pengolahan jaringan hingga penilaian hasil pulasan (Hardjolukito & Endang, 2005).
2.6.1. Metode pewarnaan imunohistokimia
antara antigen dengan antibodi, dan reaksi kimiawi ditandai adanya reaksi antara enzim dengan substrat (Sudiana & Ketut 2005).
Pemeriksaan imunohistokimia dimaksudkan untuk mengenali bahan spesifik tertentu didalam jaringan dengan menggunakan antibodi dan sistem deteksi yang memungkinkan untuk mengenali bahan spesifik tersebut secara visual (Sudiana & Ketut 2005).
Antibodi bereaksi terhadap determinan dari antigen yang berada dalam bahan spesifik yang diperiksa. Antibodi-antibodi ini akan berikatan dengan bahan dalam jaringan, dan antibodi-antibodi ini diketahui dengan menggunakan antibodi-antibodi lain yang dirancang untuk mengenal immunoglobulin tersebut dari spesies-spesies yang terekspos dengan bahan asli atau original (Sudiana & Ketut 2005).
Antibodi-antibodi penentu (anti-antibodi dari spesies lain) ini ditempeli (tagged) dengan beberapa molekul pelapor (reporter molecule) misalnya fluorecein atau enzim yang dapat mengkatalisa reaksi selanjutnya menuju produk yang dapat dilihat (Sudiana & Ketut 2005).
Pewarnaan imunohistokimia pada dasarnya ada dua macam metode yaitu (Sudiana & Ketut 2005):
a. Metode direct
Pada metode ini antibodi monoklonal yang digunakan untuk mendeteksi suatu marker pada sel, langsung di label dengan suatu enzim.
b. Metode indirect
2.7. Kerangka Konsep / Teori
= variabel yang diperiksa
Bakteri ↑, Biofilm ↑, Granulasi Inflamasi Kronis, Hiperplasia jaringan
Respon imun seluler ↑:
T-Limfosit, Makrofag, Sel Langerhans, sel Mast
Degradasi matriks ekstra seluler tulang
Resorbsi tulang ↑
Otitis Media Supuratif Kronik Tipe Bahaya/ Kolesteatoma
Komplikasi
Intrakranial Intratemporal
Ekspresi Matrix Metalloproteinase
(MMP-9) ↑
PertumbuhanKolesteatoma↑ Proliferasi epitel ↑,
Angiogenesis ↑
Aktivasi osteoklas ↑
Sitokin proinflamasi ↑ :
Asam Arakidonat, ICAM, RANKL, IL-1,-2,-6, TNF-α, EGF, VEGF,
TGF- α, TGF-β, Ki-67
Regulasi TIMP
Destruksi tulang ↑
Pada OMSK dengan kolesteatoma terjadi akumulasi sel debris dan keratinosit diinvasi oleh sel sistem imun termasuk sel Langerhans, sel-T dan makrofag. Proses ini distimulasi oleh proliferasi epitel yang tidak seimbang, diferensiasi dan maturasi keratinosit dan pemanjangan apoptosis. Migrasi sel digantikan oleh hiperplasia dalam kondisi inflamasi. Inflamasi yang mendorong proliferasi epitel berhubungan dengan peningkatan ekspresi enzim litik dan sitokin termasuk asam arakidonat, Intercellular Adhesion Molecule (ICAM), Receptor Activator Of Nuclear
Factor Kappa-β Ligand (RANKL), EGFR, VEGF, Interleukin-1, 2 dan 6 (IL-1, IL-2, IL-6), Matriks Metalloproteinase-2 dan 9 (MMP-2, MMP-9) dan Tumor Necrosis Factor Alpha yang sebagian diinduksi oleh antigen