4
BAB 2
TINJAUAN PUSTAKA
2.1. Leukemia Limfoblastik Akut Pada Anak 2.1.1. Definisi
Leukemia limfoblastik akut merupakan penyakit keganasan sel darah yang berasal dari sumsum tulang, ditandai dengan proliferasi maligna sel leukosit immatur, dan pada darah tepi terlihat adanya pertumbuhan sel-sel yang abnormal. Sel leukosit dalam darah penderita leukemia berproliferasi secara tidak teratur dan menyebabkan perubahan fungsi menjadi tidak normal sehingga mengganggu fungsi sel normal lain (Permono, 2005).
2.1.2. Epidemiologi
Setiap tahun di Amerika Serikat ada sekitar 14.382 kasus kanker baru yang didiagnosis pada penduduk di bawah usia 20 tahun. Sekitar 2.970 (21%) dari kasus-kasus ini merupakan Leukemia Limfoblastik Akut (LLA). Tingkat kejadian tahunan AS untuk LLA dibawah usia 20 tahun adalah 35,0 per satu juta penduduk, dengan laki-laki memiliki insiden yang lebih tinggi daripada perempuan. Terdapat perbedaan yang signifikan pada kejadian LLA antara ras kulit hitam dan kulit putih, dimana anak-anak kulit putih memiliki insiden hampir 2 kali lipat lebih besar. Puncak insidens LLA paling tinggi terjadi pada usia 2-5 tahun. Secara internasional, terdapat variasi antara kejadian LLA pada masa kanak-kanak dan remaja, dengan rata-rata kejadian pertahun berkisar 9-47 per juta untuk laki-laki dan 7-43 per juta untuk wanita (Robinson, 2011).
5
kronis. Insiden dari LLA pada tahun 2005 terdapat 85 kasus baru (Widiaskara, et al, 2010).
2.1.3. Etiologi dan Faktor Resiko
Etiologi leukemia akut belum diketahui, akan tetapi faktor-faktor berikut ini penting dalam patogenesis leukemia:
1. Radiasi ionisasi.
2. Bahan-bahan kimia (misalnya, benzena pada Leukemia Myeloid Akut (LMA)).
3. Obat-obatan (misalnya, penggunaan alkylating agen baik sendiri atau dalam kombinasi dengan terapi radiasi meningkatkan risiko LMA).
4. Pertimbangan Genetik:
Kembar identik: Jika salah satu kembar mengalami leukemia pada usia dibawah 5 tahun, risiko kembar kedua mengalami leukemia adalah 20%. Kejadian leukemia pada saudara kandung dari pasien leukemia adalah empat kali lebih besar dibandingkan dengan populasi umum.
Kelainan kromosom:
Grup Interval Risiko Waktu
Trisomi 21 (sindrom Down) 1 di 95 <10 tahun
Sindrom Bloom 1 di 8 <30 tahun
Anemia Fanconi 1 di 12 <16 tahun
Peningkatan kejadian dengan kondisi genetik sebagai berikut: (1) Agammaglobulinemia kongenital
(2) Sindrom Polandia
(3) Sindrom Shwachman Diamond (4) Ataksia telangiectasia
(5) Sindrom Li-Fraumeni (mutasi gen p-53) (6) Neurofibromatosis
(7) Diamond-Blackfan anemia (8) Penyakit Kostmann.
6
2.1.4. Klasifikasi
Leukemia limfoblastik akut, sel B atau sel T, dibagi lagi oleh WHO (2008) berdasarkan defek genetik yang mendasarinya. Pada kelompok B-LLA (LLA sel B) terdapat beberapa subtipe genetik spesifik misalnya subtipe dengan translokasi t (9; 22) atau t (12; 21), tata ulang gen (gene rearrangement) atau perubahan jumlah kromosom (diploidi). Subtipe merupakan petunjuk penting untuk protokol pengobatan optimal dan prognosis. Pada T-LLA (LLA sel T) kariotipe abnormal ditemukan pada 50% - 70% kasus (Hoffbrand, 2013).
Sedangkan secara morfologik, menurut FAB (French, British and America), LLA dibagi menjadi tiga yaitu:
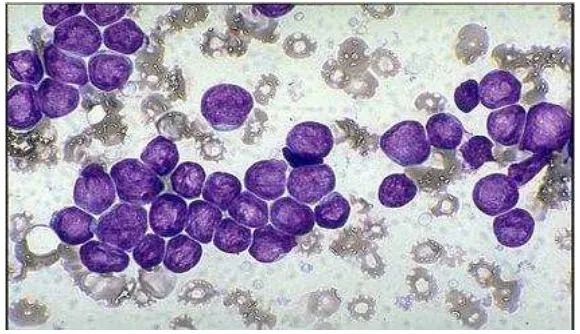
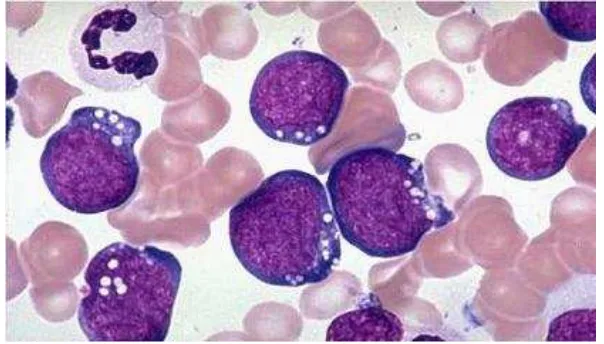
1. L1 : LLA dengan sel limfoblas kecil-kecil dan merupakan 84% dari LLA. 2. L2 : Sel lebih besar, inti ireguler, kromatin bergumpal, nukleoli prominen
dan sitoplasma agak banyak, merupakan 14% dari LLA.
3. L3 : LLA mirip dengan limfoma Burkitt, yaitu sitoplasma basofil dengan banyak vakuola, hanya merupakan 1% dari LLA (Bakta,2006)
7
Gambar 2.2. Leukemia Limfoblastik Akut Tipe L-2 (Roganovic, 2013)
Gambar 2.3. Leukemia Limfoblastik Akut Tipe L-3 (Roganovic, 2013)
Menurut imunofenotipenya, LLA diklasifikasikan menjadi:
1. Sel pra-B awal : 60%-70% dari pasien LLA dengan precursor sel B, biasanya terdapat antigen CD10, dan tidak ditemukan sitoplasmik immunoglobulin (cIg), sehingga disebut dengan “LLA umum”, Juga terdapat human leukocyte antigen (HLA)-DR.
8
namun kurang matur dari sel B. ditemukan antigen CD10 dan HLA-DR, memiliki prognosis lebih buruk dari penderita dengan sel pra-B awal.
3. Sel pra-B transisional : Terdapat pada anak kurang dari 12 bulan, CD10 negatif, dan terdapat beberapa ketidaknormalan pada kromosom, prognosis paling buruk.
4. Sel T : 10%-15% LLA, biasanya pada anak yang lebih tua, hitung leukosit lebih tinggi dan prognosisnya lebih jelek dibandingkan prekursor sel B.
5. Sel B mature : 1%-2% LLA, immunoglobulin permukaan IgM positif, terdapat antigen CD19, CD20, dan HLA-DR (Orkin, et al., 2009).
2.1.5. Gambaran Klinis
Gambaran klinis terjadi karena hal-hal berikut: Kegagalan Sumsum Tulang
1. Anemia (pucat, letargi, dan dispnea);
2. Neutropenia (demam, malaise, gambaran infeksi mulut, tenggorokan, kulit, saluran napas, perianus, atau bagian lain);
3. Trombositopenia (memar spontan, purpura, gusi berdarah, dan menoragia) (Hoffbrand, 2013).
Infiltrasi Organ
9
lebih jarang adalah pembengkakan testis atau tanda-tanda penekanan mediastinum pada LLA sel T (Hoffbrand, 2013).
Jika yang menonjol adalah kelenjar limfe dan massa ekstranodus dengan
blast <20% di sumsum tulang, penyakitnya disebut limfoma limfoblastik, tetapi
diterapi juga seperti LLA (Hoffbrand,2013).
2.1.6 Gambaran Laboratorium
Beberapa pemeriksaan laboratorium diperlukan untuk konfirmasi diagnostik LLA, klasifikasi prognostik dan perencanaan terapi yang tepat, yaitu :
1. Hitung Darah Lengkap (Complete Blood Count) dan Apus Darah Tepi Jumlah leukosit dapat normal, meningkat, atau rendah pada saat diagnosis. Hiperleukositosis (>100.000/mm³) terjadi pada kira-kira 15% pasien dan dapat melebihi 200.000/mm³. Pada umumnya terjadi anemia dan trombositopenia. Proporsi sel blast pada hitung leukosit bervariasi dari 0 sampai 100%. Kira-kira sepertiga pasien mempunyai hitung trombosit kurang dari 25.000mm³ (Fianza, 2009).
2. Aspirasi dan Biopsi Sumsum Tulang
Pemeriksaan ini sangat penting untuk konfirmasi diagnosis dan klasifikasi, sehingga semua pasien LLA harus menjalani prosedur ini. Apus sumsum tulang tampak hiperselular dengan limfoblas yang sangat banyak, lebih dari 90% sel berinti pada LLA dewasa. Jika sumsum tulang seluruhnya digantikan oleh sel-sel leukemia, maka aspirasi sumsum tulang dapat tidak berhasil, sehingga touch imprint dari jaringan biopsi penting untuk evaluasi gambaran sitologi (Fianza, 2009).
3. Sitokimia
10
berguna untuk membedakan precursor B dan B-LLA dari T-LLA. Pewarnaan fosfatase asam akan positif pada limfosit T yang ganas, sedangkan sel B dapat memberikan hasil yang positif pada pewarnaan
periodic acid Schiff (PAS). TdT yang diekspresikan oleh limfoblas dapat
dideteksi dengan pewarnaan imunoperoksidase atau flow cytomerty (Fianza, 2009).
4. Imunofenotip (dengan sitometri arus/F low cytometry)
Pemeriksaan ini berguna dalam diagnosis dan klasifikasi LLA. Reagen yang dipakai untuk diagnosis dan identifikasi subtipe imunologi adalah antibodi terhadap :
a. Untuk sel prekursor B : CD10 (common ALL antigen), CD19, CD79A, CD22, cytoplasmic m-heavy chain, dan TdT.
b. Untuk sel T : CD1a, CD2, CD3, CD4, CD5, CD7, CD8 dan TdT. c. Untuk sel B : kappa atau lambda, CD19, CD20, dan CD22.
Pada sekitar 15%-54% LLA dewasa didapatkan ekspresi antigen mieloid. Antigen mieloid yang biasa dideteksi adalah CD13, CD15, dan CD33. Ekspresi yang bersamaan dari antigen limfoid dan mieloid dapat ditemukan pada leukemia bifenotip akut. Kasus ini jarang, dan perjalanan penyakitnya buruk (Fianza, 2009).
5. Pemeriksaan lainnya
11
2.1.7. Faktor Prognostik
Pasien dimasukkan kategori risiko tinggi (HR) bila jumlah leukosit darah tepi >50.000/ml, ditemukan sel blast pada susunan saraf pusat, jumlah total blast setelah 1 minggu diterapi lebih dari 1000/mm, ada masa di mediastinum, dan umur <1 tahun atau >10 tahun (Widiaskara, et al, 2010). Pasien yang berusia antara 1 dan 9 dengan awal WBC (White Blood Count) <50.000 / mm³ (Risiko Standar), yang mencakup dua pertiga dari pasien pre-B LLA, memiliki angka ketahanan hidup 4 tahun sebanyak 80%. Para pasien yang tersisa (risiko tinggi) memiliki angka ketahanan hidup 4 tahun sebanyak 65%. Faktor-faktor yang harus dimasukkan dalam klasifikasi risiko adalah:
1. Umur: Pasien di bawah usia 1 tahun dan lebih dari 10 tahun memiliki prognosis yang lebih buruk dari anak-anak dengan usia > 1 tahun dan <10 tahun. Bayi di bawah usia 1 tahun memiliki prognosis terburuk.
2. Jumlah sel darah putih: Anak-anak dengan WBC yang tinggi cenderung memiliki prognosis yang buruk.
3. Imunofenotipe: pre-B LLA memiliki prognosis terbaik. Mature T-sel LLA memiliki kelangsungan hidup yang lebih buruk karena hubungannya dengan usia yang lebih tua dan lebih tingginya angka WBC pada saat diagnosis. Mature B-sel LLA sebelumnya memiliki prognosis buruk dengan risiko kekambuhan yang cepat dan keterlibatan SSP tetapi terapi agresif baru-baru ini telah meningkatkan prognosis.
4. Indeks DNA > 1,16 hyperdiploid LLA dengan jumlah kromosom lebih dari 50 dikaitkan dengan hasil yang baik karena peningkatan apoptosis dan meningkatnya kepekaan terhadap agen kemoterapi.
12
6. Penyakit SSP: Kehadiran penyakit SSP pada saat diagnosis merupakan faktor prognostik yang merugikan meskipun intensifikasi terapi dengan iradasi SSP dan tambahan terapi intratekal. Adanya blast pada cytospin tanpa peningkatan WBC (status CNS2) juga dikaitkan dengan hasil yang buruk.
7. Respon awal terhadap terapi induksi: Pasien yang tidak mengalami remisi pada akhir terapi induksi memiliki prognosis yang sangat buruk. Hasil sumsum tulang pada hari ke 7 dan hari ke 14 terapi induksi juga telah digunakan untuk memperkirakan respon terhadap terapi (Lanzkowsky, 2008).
2.1.8. Pengobatan
Terapi untuk leukemia akut dapat digolongkan menjadi dua,yaitu terapi spesifik dalam bentuk kemoterapi, dan terapi suportif untuk mengatasi kegagalan sumsum tulang, baik karena proses leukemia sendiri atau sebagai akibat terapi (Bakta, 2006).
1. Terapi Spesifik (Kemoterapi)
Menurut Protokol Indonesia tahun 2006 terapi LLA dibagi menjadi 2 klasifikasi berdasarkan faktor risikonya, yaitu risiko tinggi (High Risk/HR) dan risiko normal (Standard Risk/SR). Pada pasien dengan risiko tinggi, terdapat 4 fase terapi, yaitu fase induksi, konsolidasi, reinduksi, dan rumatan (maintenance). Sedangkan pada pasien dengan risiko standar, terdapat 3 fase terapi, yaitu fase induksi, konsolidasi, dan rumatan
(maintenance) (Pertiwi, et al., 2013)
a. Fase induksi
Anak-13
anak dengan risiko tinggi atau LLA dengan risiko sangat tinggi dan hampir semua dewasa muda dengan LLA menerima empat atau lebih obat selama terapi remisi-induksi. Perbaikan dalam kemoterapi dan perawatan suportif telah meningkatkan tingkat remisi lengkap sekitar 98 persen untuk anak-anak dan sekitar 85 persen untuk orang dewasa. Telah terbukti jika upaya pengobatan dilakukan lebih cepat dan terjadi pengurangan lengkap beban sel-leukemia dapat mencegah resistensi obat dan meningkatkan tingkat kesembuhan.(Pui,et al 2006).
Terapi induksi yang terlalu agresif mungkin, pada kenyataannya, menyebabkan peningkatan morbiditas dan mortalitas. Selain itu siklofosfamid, sitarabin dosis tinggi, atau dosis tinggi anthracycline menunjukkan hasil yang tidak terlalu menguntungkan pada orang dewasa, sebagian karena terapi tersebut buruk toleransinya oleh pasien yang lebih tua. Mungkin karena penetrasi yang lebih banyak ke dalam sistem saraf pusat dan waktu paruh yang lebih panjang, penggunaan deksametason di induksi dan terapi post remisi tampaknya memberikan kontrol yang lebih baik dalam sistem saraf pusat dan sistemik dibandingkan baik prednisone atau prednisolon. Namun, satu studi kecil menyatakan bahwa dosis prednisolon yang ditingkatkan dalam konteks perawatan intensif lainnya dapat menghasilkan hasil yang serupa dengan yang dicapai dengan deksametason (Pui, et al., 2006).
14
b. Fase Konsolidasi (intensifikasi)
Terapi ini menggunakan dosis tinggi beragam obat kemoterapi untuk mengeliminasi penyakit atau mengurangi beban tumor ke tingkat yang sangat rendah. Dosis kemoterapi mendekati batas toleransi pasien dan selama intensifikasi pasien mungkin memerlukan bantuan yang cukup banyak (Hoffbrand, 2013).
Pada protokol tipikal berisi vinkristin, siklofosfamid, sitosin arabinosid, etoposid, atau merkaptopurin yang diberikan sebagai blok dalam berbagai kombinasi. Biasanya diberikan tiga blok intensifikasi untuk anak, dengan jumlah yang lebih banyak kadang digunakan untuk dewasa (Hoffbrand, 2013).
c. Fase reinduksi
Fase reinduksi - pada dasarnya merupakan pengulangan terapi induksi awal yang diberikan selama beberapa bulan pertama remisi –merupakan salah satu komponen dari suksesnya protokol LLA. Penting untuk dicatat bahwa vincristine tambahan dan prednisone setelah satu pengobatan reinduksi tidak menguntungkan, diperkirakan bahwa perbaikan yang terjadi adalah karena peningkatan intensitas dosis agen lain, seperti asparaginase. Karena sering terjadinya osteonekrosis setelah pengobatan reinduksi, terapi glukokortikoid sedang diselidiki sebagai strategi untuk mengurangi komplikasi (Pui, et al., 2006).
d. Fase rumatan (maintenance)
Obat yang pada umumnya dipakai adalah 6 mercaptopurin (6 MP) per oral dan metrotreksat tiap minggu. Diberikan selama 2-3 tahun dengan diselingi terapi konsolidasi atau intensifikasi (Bakta, 2006).
2. Terapi Suportif
15
oleh penyakit leukemia itu sendiri dan juga untuk mengatasi efek samping obat. Terapi suportif yang diberikan adalah :
a. Terapi untuk mengatasi anemia: transfusi PRC (Packed Red Cells) untuk mempertahankan hemoglobin sekitar 9-10g/dl. Untuk calon transplantasi sumsum tulang, transfusi darah sebaiknya dihindari. b. Terapi untuk mengatasi infeksi, terdiri atas :
1) Antibiotika adekuat
2) Transfusi konsentrat granulosit 3) Perawatan khusus (isolasi)
4) Hemopoietic growth factor
c. Terapi untuk mengatasi perdarahan terdiri atas :
Transfusi konsentrat trombosit untuk mempertahankan trombosit. d. Terapi untuk mengatasi hal-hal lain, yaitu :
1) Pengelolaan leukostasis: dilakukan dengan hidrasi intravenous dan leukapharesis. Segera lakukan induksi remisi untuk menurunkan jumlah leukosit.
2) Pengelolaan sindrom lisis tumor: dengan hidrasi yang cukup, pemberian alopurinol dan alkalinisasi urine (Bakta,2006).
2.2. Efek Kemoterapi pada Ginjal
Kemoterapi merupakan pengobatan utama untuk pasien LLA, namun kemoterapi dapat mempengaruhi sel dan organ normal tubuh. Efek samping kemoterapi dibagi menjadi early side effect contohnya neutropenia dan stomatitis, serta delayed side effect misalnya acute kidney injury (Adam,2015).
16
mempengaruhi glomerulus, tubulus, pembuluh darah ginjal atau sistem ekskresi tergantung pada obat yang terlibat (Vagace,2011).
17
Tabel 2.1. Gangguan Ginjal yang Berhubungan dengan Obat Kemoterapi
Gangguan Vaskularisasi Ginjal
Hemodinamik AKI (capillary leak syndrome) IL-2, denileukin diftitox
Thrombotik mikroangiopati
Obat antiangiogenesis (bevacizumab dan inhibitor tirosin kinase) Gemcitabine dan cisplatin
Glomerulosklerosis fokal segmental IFN
18
2.2.1 Metotrexat (MTX)
Metotreksat (MTX) adalah obat anti-metabolit yang banyak digunakan dalam kemoterapi, efek samping yang dapat timbul akibat obat ini terutama apabila digunakan dalam dosis yang tinggi yaitu kerusakan mukosa ginjal, depresi sumsum tulang, sampai dengan terjadinya acute kidney injury (Adam,2015).
Insiden penggunaan HDMTX (High Dose Methrotrexate) terkait cedera ginjal akut (AKI) adalah sekitar 1.8 % (berkisar antara 0 % sampai 12 %). Nefrotoksisitas muncul melalui dua mekanisme utama. Yang pertama adalah kristal nefropati, yang terjadi ketika MTX dan metabolitnya mengendap dalam tubulus ginjal. Pada tahap awal dari presipitasi kristal, uji mikroskop urin menunjukkan sel-sel epitel tubulus ginjal dan, jarang, kristal MTX. Kristal nefropati awalnya bermanifestasi dengan peningkatan asimtomatik dalam kreatinin serum dan kemudian berkembang menjadi nekrosis tubular dan yang lebih parah, cedera ginjal. Mekanisme kedua cedera ginjal terkait HDMTX adalah toksisitas tubular langsung ; MTX menginduksi pembentukan radikal oksigen di ginjal, dengan selanjutnya terjadi cedera selular (Ahmed, 2013).
2.2.2 Leucovorin
Selama lebih dari 30 tahun, leucovorin rescue telah menjadi dasar dari terapi HDMTX (High Dose Methotrexate). Protokol HDMTX awal didasarkan pada pengamatan bahwa toksisitas MTX dapat dicegah atau diperbaiki pada pasien dengan konsentrasi MTX plasma tinggi yang menerima dosis leucovorin secara terpadu. Leucovorin sangat efektif dalam mencegah myelosupresi, toksisitas GI (Gastro intestinal) dan neurotoksisitas selama pengobatan dengan HDMTX. Protokol standar kemoterapi pada saat ini memasukkan pemberian
leucovorin dalam 24 sampai 36 jam pemberian HDMTX untuk mencegah sel-sel
normal dari kerusakan (Ahmed, 2013).
19
terkait HDMTX. Penelitian retrospektif dilakukan terhadap 13 pasien dengan konsentrasi MTX median 164 pM setelah 24 jam pemberian HDMTX, 16,3 pM pada 48 jam, dan 6,2 pM pada 72 jam. Selain perawatan suportif standar dengan hidrasi dan pemberian natrium bikarbonat, semua pasien diobati dengan
leucovorin dengan dosis mulai 0,24-8g/hari. Pengobatan leucovorin rescue
dimulai dalam waktu 24 jam (n = 9), 48 jam (n = 3), dan 72 jam (n = 1) dari awal terapi HDMTX. Efek samping termasuk neutropenia signifikan (n = 8) dan trombositopenia (n = 7), serta mucositis (n = 6) dan diare (n = 4). Namun, semua pasien sembuh dari efek samping. Pengobatan agresif awal dengan dosis yang sangat tinggi dari leucovorin memungkinkan seluruh (13 orang) pasien untuk menghindari extracorporeal removal meskipun dosis MTX sangat tinggi (Ahmed,2013).
2.2.3. 6-Mercaptopurine (6-MP)
6-MP merupakan analog tiopurin pertama yang terbukti efektif dalam terapi kanker. Seperti tiopurin lainnya, 6-MP tidak aktif dalam bentuk induknya dan harus dimetabolisme terlebih dahulu oleh hipoxantin-guanin fosforibosil
transferase (HPGRT) menjadi asam 6-tioinosinat, suatu nukleotida monofosfat,
yang selanjutnya menghambat beberapa enzim dalam sintesis de novo nukleotida purin. 6-MP terutama digunakan dalam terapi leukemia akut pada anak, dan analog yang terkait dengannya, yakni azatioprin, digunakan sebagai agen imunosupresif (Katzung, 2010).
2.2.4. Cyclophosphamide (Siklofosfamid)
20
pemberian siklofosfamid akan mencegah eliminasi obat pada pasien dengan gagal ginjal (Emadi, et al., 2009).
2.3. Pemeriksaan Fungsi Ginjal
Fungsi ginjal dapat dievaluasi dengan berbagai uji laboratorium secara mudah. Langkah awal dimulai dengan pemeriksaan urinalisis lengkap, termasuk pemeriksaan sedimen kemih. Berbagai informasi penting mengenai status fungsi ginjal dapat diperoleh dari urinalisis. Pengukuran kadar nitrogen urea darah (BUN) dan kreatinin serum berguna untuk evaluasi gambaran fungsi ginjal secara umum. Dalam keterbatasannya kedua uji tersebut mampu membuat estimasi Laju Filtrasi Glomerulus (LFG) yang akurat. Untuk menetapkan LFG yang lebih tepat dapat dilakukan pengukuran dengan klirens kreatinin atau klirens inulin atau penetapan LFG secara kedokteran nuklir. Evaluasi fungsi tubulus diukur melalui pengukuran metabolisme air dan mineral serta keseimbangan asam basa (Noer,2006). Pemeriksaan yang biasanya dilakukan adalah :
1. Kreatinin serum
Kreatinin merupakan hasil metabolisme kreatin dan phosphocreatine, disintesis terutama dalam otot bergaris, juga disintesis dalam hepar, pankreas dan ginjal. Kreatinin secara eksklusif diekskresi melalui ginjal, terutama melalui proses filtrasi glomerulus dan sedikit sekali melalui sekresi tubulus (Noer, 2006).
21
Setiap 1gr daging yang dimakan akan menghasilkan 3.5 sampai 5.0 mg kreatin. Proses pemasakan merubah sekitar 65% kreatin menjadi kreatinin, yang akan diabsorbsi dari saluran cerna. Sebailknya kadar kreatinin serum akan turun pada pasien yang masa ototnya berkurang, akibat malnutrisi atau panyakit otot lanjut. Obat-obat tertentu seperti misalnya cimetidine, trimethoprim, dan probenecid, dapat meningkatkan kadar kreatinin serum melalui proses kompetitif dalam transport kreatinine tubular ginjal (Noer, 2006).
2. Nitrogen Urea Darah/Blood Urea Nitrogen (BUN)
Kadar BUN normal pada seorang anak dengan gizi dan hidrasi yang baik dianggap mencerminkan LFG yang normal. Dibandingkan dengan kreatinin serum, BUN agak kurang akurat dalam menilai LFG, oleh karena beberapa faktor ekstra renal yang mempengaruhi kadarnya dalam serum. Meskipun bebas filtrasi dalam glomerulus, urea mengalami reabsorbsi yang bermakna dalam tubulus renal. Sejumlah urea yang telah difiltrasi direabsorbsi dalam tubulus proksimal, loop of Henle, dan dalam ductus collegentes medulla (Noer, 2006).
Reabsorbsi urea disepanjang tubulus proksimal dan loop of Henle terjadi secara pasif, reabsorbsi dalam duktus collegentes sangat bergantung pada vasopressin. Dalam keadaan antidiuresis atau apabila aliran kemih berkurang, absorbsi urea dalam nefron distal meningkat; menurun bila telah terjadi diuresis. Adanya proses reabsorbsi urea dalam tubulus ginjal menurunkan kegunaan BUN sebagai indikator LFG (Noer,2006).
Hal-hal yang dapat menyebabkan peningkatan kadar ureum, yaitu : a. Perdarahan gastrointestinal
b. Dehidrasi
c. Peningkatan asupan protein d. Peningkatan katabolisme protein e. Infeksi sistemik
22
g. Terapi Glucocorticoid
Hal-hal yang dapat menyebabkan penurunan kadar ureum,yaitu : a. Penurunan asupan protein
b. Malnutrisi c. Penyakit Liver
(Noer, 2006).
3. Laju filtrasi glomerulus
Laju filtrasi glomerulus menunjukkan fungsi filtrasi ginjal. Cara yang paling sering dipakai untuk menghitung LFG dalam klinik adalah dengan menggunakan prinsip klirens. Klirens suatu zat adalah volume plasma yang dibutuhkan untuk membersihkan suatu zat dari glomerulus dalam suatu periode waktu. Marker yang digunakan untuk mengukur LFG dengan prinsip ini haruslah bebas filtrasi dalam glomerulus dan tidak direabsorbsi maupun disekresi oleh tubulus renal. Bila marker dengan karakteristik seperti tersebut diatas diberikan, jumlah marker yang difiltrasi oleh glomerulus dalam 1 menit (LFG x P) harus sama dengan jumlah marker yang diekskresi dalam kemih dalam 1 menit (U x V).
LFG = laju filtrasi glomerulus P = kadar marker dalam plasma U = kadar marker dalam kemih
V = volume kemih yang dikeluarkan selama masa uji (Noer, 2006).
Marker yang ideal untuk pengukuran LFG adalah marker yang nontoksik, dapat mencapai kadar plasma yang stabil dalam keadaan keseimbangan, tidak terikat pada protein plasma, difiltrasi bebas oleh glomerulus, tidak disekresi dan direabsorbsi oleh tubulus ginjal (Noer, 2006).
1. Klirens inulin
anak-23
anak. Pengukuran LFG dengan klirens inulin hanya dipakai dalam riset, karena klirens inulin sulit dilakukan dalam praktek sehari-hari. Prosedur pemeriksaan adalah dengan cara infus inulin selama 3 jam agar diperoleh kadar yang stabil dalam cairan ekstraseluler. Dibutuhkan intake cairan yang banyak (Noer, 2006).
2. Klirens kreatinin