1 BAB II
TINJAUAN PUSTAKA
2.1 Superkapasitor
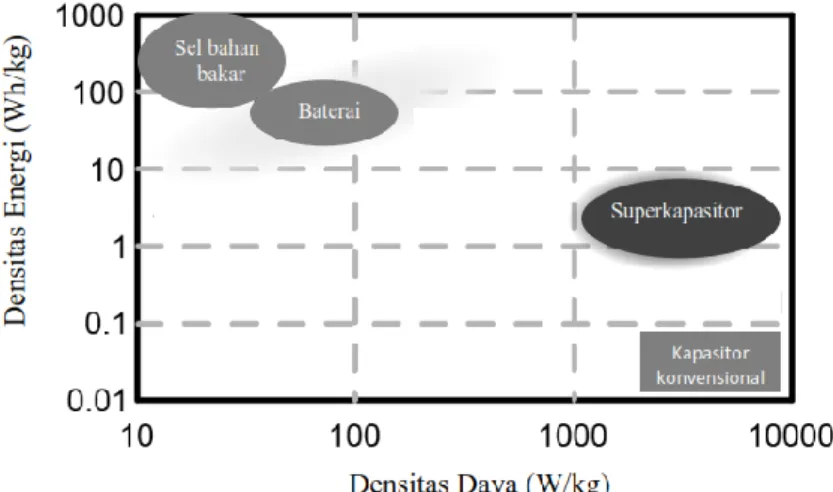
Superkapasitor merupakan salah satu jenis perangkat penyimpan energi elektrokimia yang memiliki densitas energi yang lebih tinggi daripada baterai dan sel bahan bakar serta densitas daya yang lebih tinggi daripada kapasitor konvensional seperti yang ditunjukkan pada Gambar 1. Superkapasitor menempati wilayah antara kapasitor konvensional dan baterai (Halper dan Ellenbogen, 2006;
Shukla dkk., 2000). Superkapasitor dapat memberikan setidaknya 1000 kali lebih banyak energi daripada kapasitor dielektrik dan 10 kali lebih banyak daya dari baterai. Selain itu, superkapasitor memiliki siklus hidup yang lama yaitu lebih dari 500000 siklus (Zhou, 2015).
Gambar 1. Kemampuan daya dan energi dari berbagai perangkat penyimpanan energi (Hsia, 2013).
Superkapasitor memiliki prinsip dasar yang sama seperti kapasitor konvensional. Pada kapasitor konvensional, kapasitansi (C) berbanding lurus dengan luas permukaan (A) dari masing-masing elektroda dan berbanding terbalik
2 dengan jarak antara elektroda (D) yang dinyatakan dalam persamaan (1) dan energi (E) yang disimpan berbanding lurus dengan kapasitansi yang dinyatakan dalam persamaan (2) (Halper dan Ellenbogen, 2006).
Superkapasitor memiliki bahan elektroda dengan luas permukaan yang lebih tinggi (A) dan dielektrik lebih tipis daripada kapasitor konvensional sehingga menurunkan jarak antara elektroda (D). Dengan demikian, persamaan (1) dan (2) menunjukkan peningkatan pada superkapasitor baik kapasitansi maupun energi (Halper dan Ellenbogen, 2006).
Superkapasitor terdiri dari tiga komponen penting yaitu elektroda, elektrolit, dan pemisah. Kinerja keseluruhan dari superkapasitor ditentukan oleh sifat fisik dari kedua elektroda dan bahan elektrolit. Kinerja elektrokimia superkapasitor dapat diketahui melalui pengukuran charge-discharge dengan voltametri siklik dan galvanostat. Kapasitansi (C) ditentukan dari arus discharge konstan menurut persamaan (3) (Chen dan Dai, 2013).
Dimana I adalah discharge dan dV/dt dihitung dari kemiringan kurva. Kemudian, kapasitansi spesifik (CSP) untuk satu elektroda di superkapasitor dapat dihitung menggunakan persamaan (4).
Dimana C adalah kapasitansi terukur untuk dua elektroda dan m adalah massa total bahan aktif dalam kedua elektroda. Massa juga dapat diganti dengan volume
3 atau luas elektroda tergantung pada sifat dari aplikasi yang ditargetkan. Untuk kerapatan daya (P) superkapasitor dapat dihitung menggunakan persamaan (5).
Superkapasitor menyimpan energi dengan cara membentuk lapisan ganda listrik pada antarmuka elektroda/elektrolit dan muatan listrik diakumulasi pada permukaan elektroda serta muatan ion yang berlawanan disusun di sisi elektrolit.
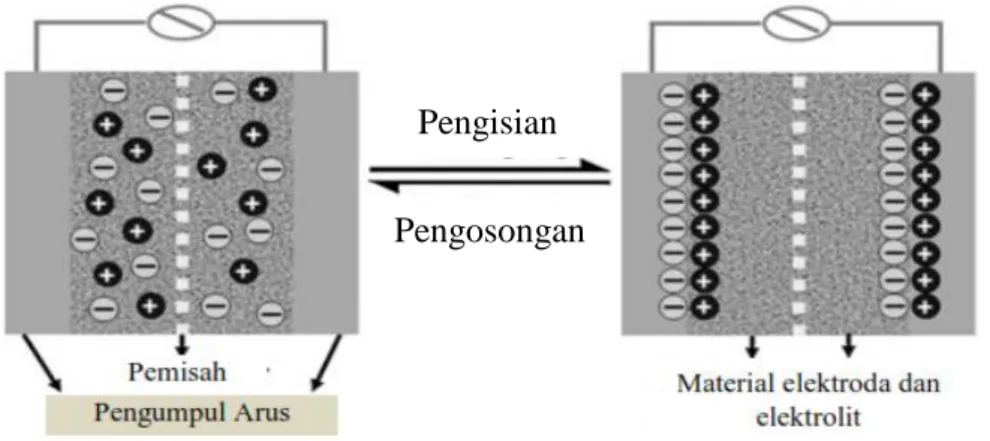
Gambar 2 menunjukkan proses charge (pengisian) dalam pembentukan lapisan ganda listrik dan discharge (pengosongan) (Antonucci dan Antonucci, 2011).
Gambar 2. Proses charge/discharge pada superkapasitor (Chen dan Dai, 2013).
Pada proses pengisian, elektron bergerak dari elektroda negatif ke elektroda positif dan dalam elektrolit, kation bergerak menuju elektroda negatif sementara anion bergerak menuju elektroda positif. Selama pengosongan proses sebaliknya terjadi. Dalam kapasitor elektrokimia tidak ada transfer muatan di antarmuka elektroda/elektrolit dan tidak ada pertukaran ion yang terjadi antara elektroda dan elektrolit. Hal ini menunjukkan bahwa konsentrasi elektrolit tetap konstan selama proses pengisian dan pengosongan. Dengan cara ini, energi disimpan dalam antarmuka lapisan ganda (Wang dkk., 2012).
Pengisian
Pengosongan
4 Menurut Wang dkk., (2012) jika dua permukaan elektroda dinyatakan sebagai ES1 dan ES2, anion sebagai A-, kation sebagai C+ dan antarmuka elektroda/elektrolit sebagai //, proses elektrokimia untuk pengisian dan pengosongan pada elektroda positif dinyatakan dalam persamaan (6) dan (7).
ES1 + A- → //A- + e- (6)
//A- + e- → S1 + A-
(7) Proses pengisian dan pengosongan pada elektroda negatif dinyatakan dalam persamaan (8) dan (9).
ES2 + C+ + e- → //C+
(8)
//C+ → S2 + C+ + e-
(9)
2.2 Karbon Aktif
Karbon aktif merupakan karbon amorf dari pelat-pelat datar disusun oleh atom-atom C yang terikat secara kovalen dalam suatu kisi heksagonal datar dengan satu atom C pada setiap sudutnya dan mempunyai permukaan yang berongga dan struktur berlapis seperti yang ditunjukkan pada Gambar 3a dan 3b.
Karbon aktif berkualitas tinggi ditandai dengan luas permukaan dan volume pori yang tinggi (Hartanto dan Ratnawati, 2010).
Gambar 3. (a) Granul karbon aktif (b) penampang pori (c) ukuran pori butiran karbon aktif (Sabatier, 2012).
a b
a b c
5 Luas permukaan karbon aktif berkisar antara 300 m2/g sampai 3500 m2/g (Hartanto dan Ratnawati, 2010). Sedangkan, Pori-pori karbon aktif mempunyai bentuk dan ukuran yang bervariasi dan tidak teratur seperti yang ditunjukkan pada gambar 3c dan 3d dengan ukuran berkisar antara 10 – 10000 Å (Basuki, 2007).
Beberapa ukuran pori karbon aktif yaitu mikropori (< 20 Å), mesopori (20 - 500 Å) dan makropori ( > 500 Å) (Halper dan Ellenbogen, 2006).
Proses pembuatan karbon aktif dilakukan dengan dua tahap. Tahap pertama proses karbonisasi bahan baku yang dilakukan untuk menghasilkan arang dan tahap kedua merupakan proses aktivasi untuk menghilangkan hidrokarbon yang melapisi permukaan arang sehingga porositas meningkat (Lempang, 2014).
a. Karbonisasi
Karbonisasi merupakan proses pembakaran tidak sempurna atau pemecahan bahan-bahan organik dengan jumlah oksigen yang sangat terbatas, sehingga menghasilkan karbon (Faisal dkk., 2014; Salamah, 2008). Proses pembakaran bahan baku dengan temperatur udara 300 – 900 °C sesuai dengan kekerasan bahan baku yang digunakan. Proses ini menyebabkan terjadinya penguraian senyawa organik yang menyusun struktur bahan membentuk metanol, uap asam asetat, tar dan hidrokarbon. Material padat yang tertinggal adalah karbon dalam bentuk arang. Pelepasan unsur-unsur volatil ini menyebabkan struktur pori-pori terbuka (Surest dkk., 2008).
b. Aktivasi
Proses aktivasi merupakan proses penting dalam pembuatan karbon aktif.
Aktivasi karbon bertujuan untuk memperbesar luas permukaan arang dengan membuka pori-pori yang tertutup sehingga memperbesar daya serapnya dan menghilangkan pengotor pada pori-pori karbon. Proses aktivasi karbon dapat
6 dilakukan melalui dua metode yaitu aktivasi fisika dan aktivasi kimia (Rahayu dan Adhitiyawarman, 2014; Salamah, 2008).
Aktivasi fisika merupakan proses pemutusan rantai karbon dari senyawa organik dengan bantuan panas pada suhu tinggi (Hartanto dan Ratnawati, 2010).
Aktivasi secara kimiawi umumnya dilakukan dengan mengkondisikan bahan dasar dengan dehydrating agent kuat, misalnya asam fosfat atau bahan kimia lain seperti HNO3, ZnCl2,CaCl2. Keunggulan cara aktivasi kimiawi dibandingkan dengan aktivasi fisik adalah aktivasi kimiawi biasanya terjadi pada suhu lebih rendah, efek dehydrating agent dapat memperbaiki pengembangan pori di dalam struktur karbon dan produk dengan menggunakan metode ini lebih banyak jika dibandingkan dengan aktivasi secara fisik (Suhendra dan Gunawan, 2010;
Salamah, 2008).
2.3 Tempurung Kemiri Sebagai Sumber Karbon Aktif
Kemiri (Aleurites moluccana) merupakan salah satu tanaman tahunan yang tersebar luas di daerah tropis dan subtropis. Tanaman kemiri mempunyai banyak manfaat bagi kehidupan manusia karena hampir semua bagian tanaman ini dapat dimanfaatkan. Biji kemiri mempunyai kulit biji yang dikenal sebagai tempurung atau cangkang yang beratnya mencapai 65-75% dari berat biji seluruhnya dan tebal tempurung 3-5 mm. Permukaan luarnya kasar dan berlekuk serta berwarna coklat kehitaman (Halimah, 2016).
Tempurung kemiri hasil kupasan seperti yang terlihat pada Gambar 4 merupakan limbah organik yang dapat diuraikan namun teksturnya yang cukup keras membutuhkan waktu yang lama untuk menguraikannya secara alamiah sehingga kulit kemiri dapat dimanfaatkan sebagai bahan baku pembuatan karbon aktif (Surest dkk., 2008).
7 Gambar 4. Tempurung kemiri (Halimah, 2016).
Tempurung kemiri memiliki kadar karbon terikat sebesar 75,79 % dan mengandung beberapa komponen seperti yang ditunjukkan pada Tabel 2 (Lempang, 2009).
Tabel 2. Komponen kimia tempurung kemiri (Lempang, 2009).
Komponen Kadar (% dari berat kayu)
Holoselulosa (Polisakarida) 49,22
Pentosan 14,55
Lignin 54,46
Abu 8,73
2.4 Modifikasi Permukaan Karbon Aktif
Meningkatnya penggunaan karbon aktif menumbuhkan kreativitas untuk memaksimalkan fungsi karbon, bukan hanya luas permukaan dan pori-porinya saja tetapi pada permukaan karbonnya juga. Modifikasi permukaan karbon aktif dapat dilakukan dengan menggunakan berbagai teknik. Salah satu metode modifikasi dengan mengubah struktur pori dan mendistribusikan kelompok fungsional permukaan karbon aktif (Wibowo dkk., 2004).
Karakteristik kimia karbon aktif sebagian besar ditentukan oleh permukaannya yang berkaitan dengan adanya heteroatom dalam struktur karbon seperti oksigen, nitrogen, hidrogen, sulfur dan fosfor. Jenis dan kuantitas unsur-unsur atau kelompok fungsional menentukan karakter asam atau basa
8 permukaan karbon aktif. Karakter asam permukaan karbon aktif berkaitan erat dengan gugus oksigen pada permukaan (Shafeeyan dkk., 2010).
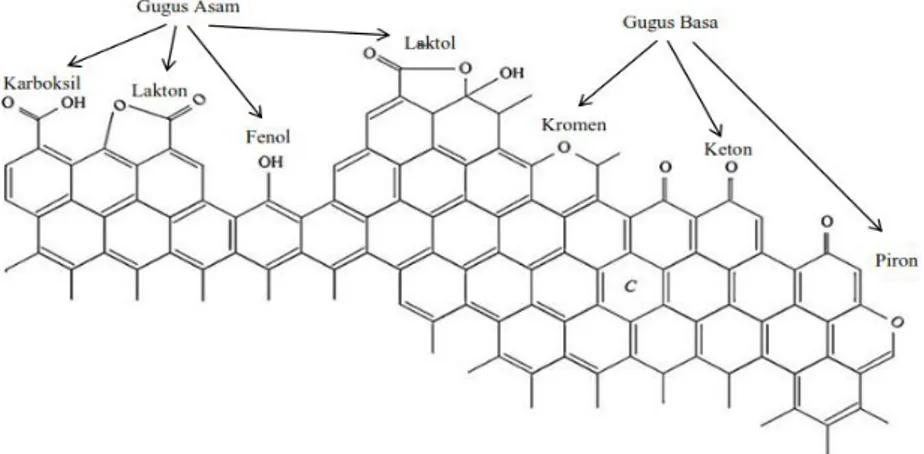
Modifikasi permukaan dengan treatment dengan larutan asam umumnya digunakan untuk mengoksidasi permukaan pori karbon, meningkatkan karakter asam, menghilangkan unsur-unsur mineral, dan meningkatkan sifat hidrofilik dari permukaan karbon aktif (Shim dkk., 2001). Dari penelitian sebelumnya, ada beberapa larutan oksidator yang pernah digunakan pada proses modifikasi permukaan karbon seperti H2O2, NaOCl, (NH4)S2O8, AgNO3, HNO3 dan H2SO4 (Wibowo dkk., 2004). Contoh gugus oksigen yang terkandung pada permukaan karbon meliputi karboksilat, lakton, fenol, karbonil, piron, kromen, kuinon dan kelompok eter seperti pada Gambar 5 (Shafeeyan dkk., 2010).
Gambar 5. Permukaan karbon aktif dengan beberapa tipe gugus yang mengandung oksigen (Figueiredo dkk., 1999).
2.5 Pengaruh Elektrolit Terhadap Kapasitansi Spesifik Superkapasitor Kapasitansi spesifik (Csp) didefenisikan sebagai kemampuan sel superkapasitor menyimpan muatan terhadap rasio massa elektroda karbon yang dinyatakan dengan satuan F/g. Kapasitansi spesifik sangat berpengaruh dalam menentukan kinerja superkapasitor. Respon pemberian tegangan yang dihasilkan oleh sebuah sel superkapasitor adalah berupa nilai rapat arus, dimana nilai arus
9 ditentukan oleh pergerakan ion-ion didalam sebuah pori elektroda dalam membentuk lapisan pasangan muatan (Taer dkk., 2016). Pergerakan ion dipengaruhi oleh ukuran, konduktivitas dan mobilitas ion dari suatu elektrolit.
Semakin tinggi konduktivitas dan mobilitas ion serta semakin kecil ukuran ion maka pergerakan ion pada permukaan elektroda/elektrolit semakin cepat sehingga meningkatkan kapasitansi spesifik superkapasitor (Barzegar dkk., 2015; Lota dkk., 2013). Tabel 2 menunjukkan ukuran, konduktivitas dan mobilitas ion dari beberapa larutan elektrolit.
Tabel 2. Ukuran, konduktivitas dan mobilitas ion (Zhang dkk., 2012).
Ion Jari-jari ion (Å)
Konduktivitas molar (cm2Ω-1mol-1)
Mobilitas ion (10-5 cm2 S-1V-1)
H+ 0,021 349,8 36,2
Na+ 1,02 50,1 5,2
SO42-
2,30 79,8 8,3
OH- 0,46 198 20,6
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik.
Elektrolit sebagai salah satu komponen penting dari superkapasitor karena tegangan dan hambatan dari perangkat superkapasitor bergantung pada elektrolit.
Tegangan kerja sel yang tinggi memberikan kepadatan energi yang tinggi dan daya yang tinggi (Lota dkk., 2013). Dalam pemilihan elektrolit harus memenuhi kriteria yaitu stabilitas elektrokimia dan konduktivitas ion. Stabilitas elektrokimia dapat meningkatkan penyimpanan energi yang dinyatakan dalam persamaan 2 sedangkan konduktivitas ion memiliki pengaruh besar terhadap nilai daya yang dinyatakan dalam persamaan 5 (Beguin dkk., 2014; Sabatier, 2012).
10 Elektrolit cair yang digunakan dalam superkapasitor diklasifikasikan menjadi tiga jenis yaitu larutan elektrolit, elektrolit organik dan cairan ionik (Beguin dkk., 2014). Beberapa keunggulan larutan elektrolit yaitu resistensi yang lebih rendah, biaya produksi murah, stabil dalam suhu ruangan dan jika menggunakan elektroda dengan karbon aktif yang diperkaya dengan heteroatom (N, O dan P), kapasitansi dapat ditingkatkan melalui reaksi redoks antara fungsi permukaan elektroda dan larutan elektrolit (Demarconnay dkk., 2010; Qu dkk., 2009). Selain itu, superkapasitor yang menggunakan larutan elektrolit menunjukkan kapasitansi yang lebih tinggi dan daya yang lebih besar karena konsentrasi ion yang tinggi dan jari-jari ion yang kecil (Wang dkk., 2012).
Larutan eletrolit yang biasa digunakan sebagai elektrolit superkapasitor adalah asam, basa dan garam (Lota dkk., 2013).
Elektrolit asam yang paling umum digunakan untuk superkapasitor adalah H2SO4 karena memiliki konduktivitas ion yang sangat tinggi (0,8 S cm-1 untuk 1M pada 25 °C) dan hambatan atau ESR dari superkapasitor dengan H2SO4 sebagai elektrolit umumnya lebih rendah dibandingkan dengan elektrolit netral antara bahan elektroda dan elektrolit yang disebabkan oleh elektrolit yang berbeda (Zhong dkk., 2015). Selain itu, elektrolit H2SO4 terurai menjadi ion H+ dan ion SO42- dalam larutan yang memiliki ukuran ion yang sangat kecil sehingga mudah berpartisipasi dalam proses pengisian dan pengosongan (Endo dkk., 2001). Untuk superkapasitor dengan elektrolit asam kuat H2SO4, kapasitansi spesifik yang dilaporkan dalam literatur yang diterbitkan dalam beberapa tahun terakhir dalam kisaran antara 100 dan 300 F/g seperti beberapa hasil penelitian yang ditunjukkan pada Tabel 3. Superkapasitor berbasis elektrolit H2SO4 memiliki kapasitansi
11 spesifik yang lebih tinggi bila dibandingkan dengan berbasis elektrolit organik, bahkan jika menggunakan bahan elektroda yang sama. Hal ini mungkin menggambarkan interaksi yang berbeda antara bahan elektroda dan elektrolit yang disebabkan oleh elektrolit yang berbeda (Zhong dkk., 2015).
Tabel 3. Penggunaan elektrolit H2SO4
Bahan Elektroda Konsentrasi elektrolit (M)
Kapasitansi
spesifik (F/g) Referensi Karbon aktif
rumput laut 1 255 Bichat dkk., 2010
Karbon aktif
ampas tebu 1 300 Rufford dkk., 2010
Karbon aktif
amilum gandum 1 320,6 Senthilkumar dkk.,
2011 Karbon aktif biji
kersen 2 230 Marín dkk., 2009
Karbon aktif biji
kopi 1 368 Rufford dkk., 2008
Karbon mesopori
termodifikasi 2 247,8 Lang dkk., 2012
Elektrolit basa juga salah satu jenis elektrolit yang paling banyak digunakan seperti KOH, NaOH dan sebagainya. Larutan asam kuat jauh lebih efektif daripada larutan kuat KOH atau NaOH. Namun, elektrolit hidroksida sangat larut dalam air dan anion OH- yang memiliki konduktivitas yang sangat baik sebagai elektrolit superkapasitor (Robinson dan Stokes, 2002).
Penggunaan elektrolit berbasis garam juga banyak diteliti untuk kapasitor elektrokimia. Hal ini disebabkan karena memiliki potensial jendela elektrokimia yang lebih besar, kurang korosi dan keamanan yang lebih besar. Di antara berbagai elektrolit netral, Na2SO4 adalah elektrolit yang paling umum digunakan seperti beberapa penelitian yang ditunjukkan pada Tabel 5 dan telah terbukti menjadi elektrolit yang menjanjikan bagi banyak bahan pseudokapasitif.
12 Kapasitor elektrokimia berbasis karbon dengan elektrolit netral bisa memberikan tegangan operasi yang lebih besar karena meningkatnya potensial jendela elektrolit bila dibandingkan dengan elektrolit asam dan basa (Zhong dkk., 2015).
Tabel 4. Penggunaan elektrolit Na2SO4
Bahan Elektroda Konsentrasi elektrolit (M)
Kapasitansi spesifik
(F/g) Referensi Karbon aktif serat
pisang 1 74 Subramanian
dkk., 2007 Karbon aktif
rumput laut 0,5 125 Bichat dkk.,
2010 Karbon mesopori
termodifikasi 2 82,3 Lang dkk.,
2012 Karbon aktif
komersial
1 0,5 0,2 0,1
78,1 86,1 74,7 74,2
Tsay dkk., 2012
2.7 Metode Voltametri Siklik (CV)
Voltametri siklik (CV) adalah alat yang secara luas digunakan di bidang elektrokimia untuk mengkarakterisasi kinerja berbagai perangkat penyimpanan energi listrik seperti kapasitor elektrokimia, baterai dan sel bahan bakar. Dalam aplikasi ini, elektroda bermuatan biasanya direndam dalam larutan elektrolit.
Lapisan ganda listrik terbentuk pada antarmuka elektroda/elektrolit yang dapat diakses dengan adanya ion dalam elektrolit (Wang dan Pilon, 2012).
Voltametri siklik sebagai metode pengukuran sifat elektrokimia superkapasitor yang menampilkan hubungan antara arus dan tegangan.
Pengukuran dengan metode siklis voltametri ini berdasarkan variasi tegangan awal dan tegangan akhir. Kurva yang dihasilkan pada metode siklis voltametri berbentuk histeresis dimana semakin lebar bentuk kurvanya maka nilai kapasitansi yang dihasilkan akan semakin besar (Taer dkk., 2015).