BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
Oleokimia merupakan bahan kimia yang berasal dari minyak/lemak alami, baik
tumbuhan maupun hewani. Bidang keahlian teknologi oleokimia merupakan salah
satu bidang keahlian yang mempunyai prospek yang baik dan penting dalam teknik
kimia, pada saat ini dan pada waktu yang akan datang. Produk oleokimia diperkirakan
akan semakin banyak berperan menggantikan produk-produk turunan minyak bumi
(petrokimia). Pada saat ini, permintaan akan produk oleokimia semakin meningkat.
Hal ini dapat dimaklumi karena produk oleokimia mempunyai beberapa keunggulan
dibandingkan produk petrokimia, seperti harga, sumber yang dapat diperbaharui dan
produk yang ramah lingkungan.
Oleokimia didefinisikan sebagai pembuatan asam lemak dan gliserin serta
turunannya baik yang berasal dari hasil pemecahan trigliserida yang dikandung
minyak atau lemak alami maupun yang berasal dari produk petrokimia. Produk
oleokimia dasar yang utama adalah asam lemak, ester asam lemak, alkohol asam
lemak, amina asam lemak, serta gliserol yang merupakan produk samping yang juga
tidak kalah pentingnya.
Dari antara produk-produk oleokimia, asam lemak merupakan produk dari
bahan oleokimia yang terpenting yang digunakan dalam berbagai jenis reaksi
modifikasi kimia untuk menghasilkan berbagai produk alirnya yang berasal dari
turunan asam lemak, turunannya dapat diaplikasikan industrial yang berbeda.
Asam lemak banyak digunakan dalam pembuatan sabun, produk-produk karet,
kosmetika, lilin, dan bahan baku untuk produksi turunan amina asam lemak. Disisi
lain, aplikasi gliserol pada industri oleokimia juga sangat luas, yang digunakan pada
produk kosmetika, farmasi, bahan peledak, serta monogliserida yang digunakan
diaplikasikan sebagai surfaktan pada produk-produk kosmetika, toleteries, serta
produk pencuci/pembersih, baik untuk kebutuhan rumah tangga, maupun industri
seperti tekstil, plastik, pertambangan, dan pengolahan limbah cair pabrik. Tabel (2.1)
menunjukkan bidang aplikasi minyak dan lemak pada industri kimia secara luas
(Elisabeth, 1999).
Tabel 2.1. Tabel Bidang Aplikasi Minyak Dan Lemak Pada Industri Kimia. Asam Lemak dan turunannya Plastik, sabun, kosmetika, bahan pencuci
/pembersih, cat, tekstil, industri kulit dan
kertas, karet, lubrikan/pelumas.
Metil ester asam lemak Kosmetik,bahan pembersih/pencuci
Gliserol Kosmetika, pasta gigi, farmasetikal,
perekat, plastik, resin sintetik, peledak,
tembakau
Asam lemak dan turunannya Kondisioner, dan industri pabrik
Biosida Aditif minyak mineral
Minyak netral dan turunannya Sabun
Minyak pengering Perekat, cat vernis
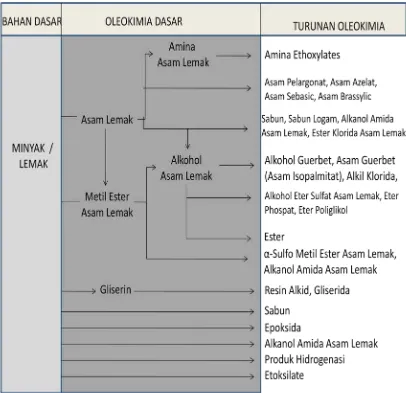
Hasil olahan oleokimia dapat dibagi atas beberapa bahan dasar oleokimia dan
turunannya yang dapat dilihat pada gambar 2.1. Dimana pada gambar ini dapat dilihat
diagram alur proses oleokimia dari bahan baku menjadi oleokimia dan turunan
oleokimia, dimana bahan oleokimia berasal dari bahan lemak dan minyak alami serta
Gambar 2.1: Diagram Alur Proses Oleokimia Dari Bahan Dasar Minyak atau Lemak Menjadi Oleokimia Dan Turunan Oleokimia (Richtler and Knault, 1984).
2.1.1. Asam Lemak
Asam lemak adalah asam karboksilat yang diperoleh dari hidrolisis suatu lemak atau
minyak, umumnya memiliki rantai hidrokarbon panjang dan tidak bercabang.
Kebanyakan trigliserida alami adalah trigliserida campuran, yaitu triester dengan
komponen asam lemak yang berbeda (Wilbraham, 1992).
Asam-asam lemak mempunyai jumlah atom C genap dari C4 hingga C30 dan
ditemukan dalam bahan pangan adalah asam palmitat, yaitu 15 sampai 50% dari
seluruh asam-asam lemak yang ada (Ketaren, 2005).
2.1.2. Metil Ester Asam Lemak
Dalam beberapa waktu terakhir ini, pemanasan global , polusi, dan penipisan
sumber bahan bakar fosil untuk dikonsumsi dengan jumlah yang besar sehingga
energi biomasa diharapkan untuk menyelesaikan permasalahan-permasalahan tersebut
dan mendapat perhatian international, sebagai sumber bahan bakar yang dapat
diperbaharui dan energi yang ramah lingkungan. Bahan bakar biodiesel, metil ester
asam lemak (MEAL), diproduksi dengan menggunakan reaksi transesterifikasi dari
minyak nabati dan lemak hewani dengan menggunakan metanol yang mengikuti
karakteristik dari metil ester asam lemak tersebut. Bahan bakar yang berasal dari
nabati tidak mengandung komponen-komponen aromatik, dan gas buangnya dapat di
daur ulang dan rendah kandungan SOx dan material-material lainnya yang terkandung
didalam gas buang dari bahan bakar fosil (Schuchardt et al., 1998).
Biodiesel merupakan salah satu perintis teknologi bioenergi, dengan
menggunakan minyak nabati yang pertama kali di usulkan oleh mesin berbahan bakar
buatan Rudolf diesel, sekitar 100 tahun yang lalu. Ketika Diesel mempresentasikan
mesin diesel, dia menggunakan minyak kacang tanah, karena tidak ada bahan bakar
spesifik yang cocok dengan mesin sebelum munculnya bahan bakar fosil.
Penemuan yang original dari Diesel yang menyatakan bahwa minyak nabati
dapat digunakan sebagai bahan bakar mesin diesel, namun tingginya viskositas dari
minyak tumbuhan sehingga pemanfaatannya tidak dapat diterima (Shay, 1993).
Modifikasi minyak nabati atau hewani salah satunya dapat dilakukan melalui
reaksi transesterifikasi dengan alkohol rantai pendek menggunakan katalis
menghasilkan ester mono alkil (Mittelbach and Ramschmidt, 2004; Knothe et al.,
2005). Berbagai penelitian telah menunjukkan bahwa biodiesel dapat dipergunakan
sebagai pengganti bahan bakar solar atau dapat juga digunakan secara bersamaan
dapat dilakukan mengingat biodiesel dan bahan bakar solar memiliki sifat fisik dan
kimia yang hampir mirip (Clark et al., 1984).
Biodiesel dapat diperoleh dari berbagai macam metode seperti reaksi
transesterifikasi, esterifikasi, mikroemulsi, pirolisis dan lainnya. Metode reaksi
transesterifikasi merupakan metode yang paling sering digunakan dalam memperoleh
biodiesel dimana dalam reaksi ini, lemak atau minyak direaksikan dengan alkohol
rantai pendek menggunakan katalis. Reaksi transesterifikasi dapat dikatalisis baik oleh
katalis homogen seperti NaOH, KOH, H2SO4, HCl dan lain sebagainya serta katalis
heterogen seperti enzim, titanium silikat, resin penukar anion, CaO, MgO, ZnO dan
lain sebagainya (Pinto et al., 2005; Vasudevan and Briggs, 2008).
Katalis alkali hidroksida terlarut dalam metanol diketahui dapat digunakan
mengkatalisis reaksi transesterifikasi lebih cepat dibandingkan jenis katalis lainnya.
Hanya dalam waktu 6 menit saja menggunakan 1% natrium hidroksida sebagai katalis
pada suhu reaksi 600C dapat diperoleh biodiesel dari minyak biji matahari sampai
dengan 90% (Freedman et al., 1984). Namun demikian, katalis homogen ini sensitif
terhadap asam lemak bebas dan air yang terkandung dalam lemak atau minyak. Asam
lemak bebas akan bereaksi dengan katalis alkali tersebut membentuk sabun apabila
jumlahnya banyak. Adanya sabun mempengaruhi pemisahan gliserol dan dapat
mengurangi produk biodiesel yang dihasilkan. Air yang terdapat dalam lemak atau
minyak juga tidak boleh karena akan menyebabkan hidrolisis metil ester oleh adanya
katalis asam atau basa (Ma et al., 1998).
2.2. Lemak Dan Minyak
Lemak dan minyak adalah trigliserida atau triasilgliserol yang berarti triester dari
gliserol (Fessenden, 1989). Suatu lemak tertentu biasanya mengandung campuran dari
trigliserida yang berbeda panjang dan derajat ketidakjenuhan asam-asam lemaknya
Lemak dan minyak dapat diklasifikasikan berdasarkan sumbernya, sebagai
berikut:
1. Bersumber dari hewani:
a. Susu hewan peliharaan: Lemak susu
b. Daging hewan peliharaan: lemak sapi dan turunan oleostearin, oleo oil dari
oleostock, lemak babi, dan mutton tallow.
c. Hasil laut: Minyak ikan sardin, menhaden dan sejenisnya, dan minyak ikan
paus
2. Bersumber dari tanaman:
a. Biji-bijian palawija: minyak jagung, biji kapas, kacang, rape seed, wijen,
kedele, Bunga matahari
b. Kulit buah tanaman tahunan: kelapa, coklat, inti sawti, babassu, cohune, dan
sejenisnya (Hart, 1990)
Perbedaan umum antara lemak nabati dengan hewani dapat dilihat pada tabel 2.2.
berikut:
Tabel 2.2. Perbedaan Umum Antara Lemak Nabati Dengan Hewani
Lemak hewani Lemak nabati
Mengandung kolesterol Mengandung filtosterol
Kadar asam lemak jenuh lebih kecil Kadar asam lemak jenuh lebih besar
Mempunyai bilangan Reichert-meissl lebih
besar
Mempunyai bilangan polenske lebih
besar
Lemak yang lazim meliputi mentega, lemak hewan, dan bagian berlemak dari
daging, sedangkan minyak terutama berasal dari tumbuh-tumbuhan termasuk jagung,
biji kapas, zaitun, kacang, dan minyak kedelai (Hart,1990).
Lemak dan minyak dapat dibedakan dari titik lelehnya dimana pada suhu
kamar lemak berwujud padat, sedangkan minyak berwujud cair (Wilbraham, 1992).
Meskipun lemak berwujud padat dan minyak berwujud cair, keduanya memiliki
struktur organik dasar yang sama (Hart, 1990). Lemak dan minyak pada dasarnya
tidak larut dalam air tetapi larut dalam beberapa pelarut organik seperti karbon
Kelarutan minyak atau lemak dalam suatu pelarut ditentukan oleh sifat
polaritas asam lemaknya. Asam lemak yang bersifat polar cenderung larut dalam
pelarut polar, sedangkan asam lemak non polar larut dalam pelarut non polar. Sifat
dan daya kelarutan ini digunakan sebagai dasar pada praktek pengujian-pengujian
analitis dan ekstraksi minyak dengan pelarut. Sifat minyak dan lemak yang larut
dalam pelarut tertentu digunakan dalam pengolahan minyak secara komersial melalui
ekstraksi pelarut.
Daya kelarutan asam lemak biasanya lebih tinggi dari komponen
trigliseridanya, dan dapat larut dalam pelarut organik yang bersifat polar dan non
polar. Semakin panjang rantai atom karbon maka minyak dan lemak tersebut akan
bersifat non polar, sehingga semakin sukar larut dalam pelarut polar dan sebaliknya.
Minyak atau lemak yang tidak jenuh lebih mudah larut dalam pelarut organik daripada
asam lemak jenuh dengan panjang rantai atom karbon yang sama. Minyak atau lemak
yang asam lemak dengan derajat ketidakjenuhannya tinggi akan lebih mudah larut
daripada asam lemak dengan derajat ketidakjenuhan rendah.
Salah satu dari beberapa tanaman golongan nabati yang menghasilkan minyak
adalah dari bahan kepala sawit, minyak dihasilkan berasal dari inti kelapa sawit yang
dinamakan miyak inti sawit (Palm Kernel Oil) (Ketaren, 2005).
2.3. Inti Sawit
Minyak inti sawti yang baik adalah minyak inti sawit berkadar asam lemak bebas
yang rendah dan berwarna kuning terang, serta mudah dipucatkan. Bungkil inti sawit
yang diinginkan berwarna relatif terang dan nilai gizi serta kandungan asam aminonya
Tabel 2.3. Komposisi Rata-Rata Inti Sawit ( Bailey, 1950)
Kelapa sawit mengandung kurang lebih 80% perikarp dan 20% buah yang
dilapisi kulit yang tipis; kadar minyak dalam perikarp sekitar 34-40%. Minyak kelapa
sawit adalah lemak semi padat yang mempunyai kompoisis yang tetap. Rata-rata
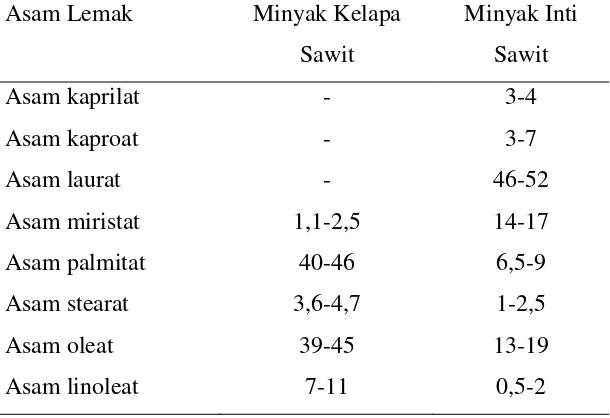
komposisi asam lemak minyak kelapa sawit dengan minyak inti sawit dapat dilihat
pada tabel 2.4 (Ketaren, 2005).
Tabel 2.4. Perbandingan Komposisi Asam Lemak Minyak Kelapa Sawit Dengan Minyak Inti Sawit (Eckey, 1995)
Asam Lemak Minyak Kelapa
2.4. Katalis
Produk metil ester asam lemak yang terbentuk (MEAL) harus melewati serangkaian
proses lagi untuk mendapatkan MEAL yang murni, yaitu dengan menghilangkan
sejumlah katalis, produk samping yaitu gliserin yang masih bergabung dengan MEAL
dengan mencucinya menggunakan air dan membutuhkan sejumlah air yang besar
untuk memisahkannya, tentunya hal ini memakan biaya produksi yang besar dan bila
dibandingkan dengan bahan bakar dari minyak bumi tidak sebanding harganya.
Untuk mengatasi masalah tersebut, sudah dipelajari beberapa tipe dari
pembuatan metil ester asam lemak, yaitu: katalis asam dan basa heterogen (Freedman
et al., 1984), proses superkritikal (Demirbas, 2006), proses enzim (Akoh et al., 2007),
dan proses katalis heterogen. Katalis heterogen semakin intensif untuk diteliti, hal ini
dikarenakan proses produksi yang dan proses pemurnian yang simpel, karena
mengurangi penggunaan sejumlah besar air.
2.4.1. Katalis Homogen
Katalis Homogen dibedakan menjadi 2 jenis, yaitu katalis homogen asam dan katalis
homogen basa.
2.4.1.1. Katalis Asam Homogen
Katalis Asam Homogen yang biasa digunakan untuk reaksi transesterifikasi seperti
sulphur, Phospor, klorida, dan asam sulponik organik, beberapa keuntungan dan
kekurangan dari katalis asam homogen untuk reaksi transesterifikasi adalah sebagai
berikut ini.
Kelebihannya:
1. Dapat dilakukan pada reaksi transesterifikasi dengan nilai asam lemak yang
tinggi dan air yang banyak.
2. Katalis asam dapat digunakan untuk minyak dengan komponen material yang
Kekurangannya:
Reaksi transesterifikasi lebih lambat dibandingkan dengan katalis basa.
2.4.1.2. Katalis Basa Homogen
Tipe dari katalis basa yang digunakan untuk transesterifikasi contohnya adalah
NaOH, KOH, Karbonat, dan Alkoksida, seperti natrium metoksida, etoksida,
propoksida, butoksida. beberapa keuntungan dan kekurangan dari katalis asam
homogen untuk reaksi transesterifikasi adalah sebagai berikut:
Kelebihannya:
1. Lebih cepat hingga 4000 kali dari pada katalis asam untuk reaksi
transesterifikasi
2. Metoksi lebih efektif dibandingkan dengan hidroksi
3. Asam lemak bebas dari minyak harus serendah mungkin
Kekurangannya:
1. Gliserida dan alkohol harus bebas air, karena akan mengakibatkan terjadinya
proses saponifikasi, yang akan mengurangi efisiensi katalis dan akan terbentuk
gel sehingga gliserol semakin sulit dipisahkan.
2. Perbandingan molar antara metanol dan minyak harus 6:1 atau lebih tinggi hal
ini disebabkan karena perbandingan stoikiometrinya 3:1.
(Narasimharao et al., 2007)
2.4.2. Katalis Heterogen
Katalis heterogen terbagi menjadi dua, yaitu katalis heterogen asam, dan katalis
heterogen basa, keuntungan katalis heterogen asam adalah dapat digunakan untuk
pembuatan ester dengan asam lemak bebas yang tinggi, tetapi katalis jenis ini
memiliki aktifitas yang rendah, membutuhkan waktu reaksi yang lama, dan suhu yang
tinggi, beberapa katalis heterogen asam yang telah diteliti adalah logam sulfate oksida
(Furuta et al., 2004), asam poli hetero (Narasimharao et al., 2007), karbon amorf
sulfonat (Toda et al., 2005), resin asam penukar ion (Lopez et al., 2007).
Tabel 2.5. Contoh-Contoh Katalis Heterogen Asam Dan Heterogen Basa
Katalis asam Katalis Basa
Resin penukar ion sulphur Hidrotalsetis (Mg-Al)
Amberlist – 15 Oksida, seperti MgO, CaO, La2O3, ZnO
Nafion CaCO3, Ba(OH)2
Alumina Zinc aluminat
Asam heteropoli Logam garam dari asam amino
Katalis basa heterogen memiliki keaktifitasan yang tinggi. Katalis CaO
merupakan katalis yang sering diteliti, karena sifat basanya tinggi, kelarutannya
rendah, harganya murah, dan mudah dikendalikan dibanding dengan KOH (Peterson
and Scarrah, 1984).
Perbandingan antara katalis homogen dan katalis heterogen adalah sebagai berikut:
2.4.3. Perbandingan Katalis Homogen Dengan Heterogen
Perbandingan antara katalis homogen dengan katalis heterogen ada terdapat dalam
tabel 2.6.
Tabel 2.6. Perbandingan Antara Katalis Homogen Dengan Katalis Heterogen
Faktor Katalis Homogen Katalis Heterogen
Waktu reaksi Waktu reaksi cepat dan
konversinya tinggi
Waktu rekasi lebih lambat
dan konversi tinggi
Katalis Katalis tidak bisa
didapatkan kembali, harus
Metodologi Proses Digunakan terbatas Digunakan kontinu
Air / asam lemak bebas Sensitif Tidak sensitif
Penggunaan katalis kembali Tidak mungkin Mungkin
Biaya Harganya cenderung tinggi Berpotensi murah
2.4.4. Katalis Heterogen Logam Alkali Tanah Oksida
Dalam bagian in akan dibahas mengenai katalis logam alkali tanah oksida, yaitu MgO,
CaO, SrO, BaO. Dari penelitian Hatori tentang perbandingan katalis logam alkali
tanah oksida yaitu MgO, CaO, SrO, dan pengaruhnya mengenai yield dari metil ester
asam lemak untu reaksi transesterifikasi dengan menggunakan logam oksida alkali
tanah, dan itu diidentifikasikan bahwa aktifitas katalis yang diurutkan sebagai MgO
<< CaO < SrO. Hal ini dipengaruhi dari area permukaan, semakin besar luas
permukaan maka akan semakin reatif katalis tersebut, sehingga semakin tinggi yield
metil ester asam lemak yang dihasilkan, dimana dapat kita lihat luas permukaan dari
masing-masing katalis yaitu: SrO (2 m2/g) < CaO (13 m2/g) < MgO (200 m2), dengan
luas permuakaan 2m2/g maka SrO merupakan katalis yang lebih reaktif dibandingkan
dengan katalis CaO dan MgO sehingga yield metil ester asam lemak yang dihasilkan
dengan menggunakan katalis SrO akan lebih tinggi dari katalis CaO dan MgO, hal ini
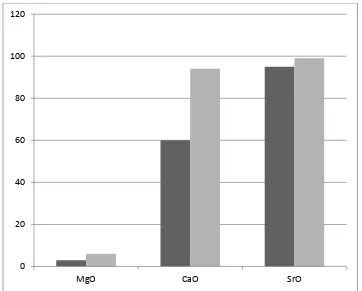
dapat dilihat pada Gambar 2.2 (Hattori, 2004).
Gambar 2.2. Pebandingan Yield Metil Ester Asam Lemak Dengan Menggunakan Katalis MgO, CaO, Dan SrO
0 20 40 60 80 100 120
Keterangan: Grafik Hitam menyatakan keadaan refluks dengan waktu 30 menit
Grafik abu-abu menyatakan keadaan refluks dengan waktu 60 menit
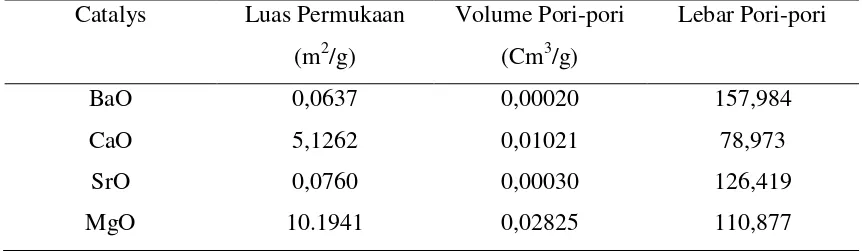
Karakteristik dari katalis heterogen logam alkali tanah oksida dapat dilihat pada
Tabel 2.7.
Tabel 2.7. Karakteristik Dari Katalis Heterogen Logam Alkali Tanah Oksida Catalys Luas Permukaan
Dengan luas permuakaan yang minum, sehingga mengakibatkan katalis BaO
dan SrO lebih kuat dan aktif sebagai katalis, serta menghasilkan persen konversi lebih
besar, ketimbang dengan CaO dan MgO, hal ini dikarenakan adanya hubungan antara
jari-jari dan sifat alkali dari suatu unsur dalam satu golongan, dimana semakin besar
jari-jari akan semakin meningkatkan sifat alkali unsur tersebut.
Dalam penggunaannya kembali, katalis CaO dan MgO terjadi sedikit
perubahan dari yang fresh dan yang telah digunakan, hal ini dikarenakan waktu dan
temperature reaksi, sedangkan di lain pihak, katalis BaO dan SrO yang memiliki
struktur yang besar sehingga keefektifitasannya akan berkurang, setelah reaksi untuk
mendapatkan yield maksimum dari biodiesel, sehingga tidak bisa digunakan beberapa
kali untuk mendapatkan yield yang tinggai dari biodiesel (Yan et al., 2008).
Dalam hasil peneliitiannya menunjukkan bahwa yield dari biodiesel dengan
menggunakan katalis heterogen alkali oksida dengan urutan sebagai berikut:
BaO>SrO>CaO>MgO. Maksimum biodiesel yield adalah dengan menggunakan
katalis BaO, tetapi karena sifat dari katalis BaO yang beracun dan berbahaya,
Katalis SrO merupakan katalis yang sangat aktif untuk menyelesaikan
konversi ke MEAL dalam 0,5 jam, tetapi endapan yang terdapat dalam campuran
tidak dapat diamati setelah proses reaksi dan setelah pemisahaan metanol berlebih
dalam campuran, produk tersebut bercampur dengan katalis yang kelihatan seperti
organosol berwarna putih, tentunya hal ini tidak dapat dikatakan bahwa metil ester
asam lemak mudah dipisahkan dari produk yang diperoleh dengan reaksi
transesterifikasi dengan menggunakan katalis CaO (Kouzu et al., 2007), sehingga
katalis CaO cenderung sering digunakan dalam proses transesterifikasi.
2.4.5. Katalis CaO
Katalis kalsium oksida telah banyak digunakan dalam industri. Penggunaan CaO
sebagai katalis logam alkali tanah oksida, yang merupakan katalis golongan heterogen
telah banyak diteliti, penggunaan CaO sebagai katalis untuk transesterifikasi
menghasilkan 98% metil ester asam lemak yield selama proses reaksi yang pertama
kali (Veljkovic et al., 2009).
Kalsium oksida (CaO) adalah katalis logam oksida tunggal yang sering
digunakan untuk sintesis biodiesel, hal ini barangkali dikarenakan harganya yang
murah, sifat racun yang rendah, dan ketersediannya yang tinggi (Gryglewicz, 1999).
Dalam penggunaan katalis CaO sebagai katalis basa diperlukan beberapa
penanganan yang hati-hati, karena CaO sangat aktif dan bereaksi dengan H2O dan
CO2, oleh karena itu, bahan-bahan yang tidak diinginkan tersebut harus dibuang pada
suhu tinggi (lebih dari 973o K) (Lo’pez et al., 2007).
Kereaktifan dari katalis CaO ditentukan dari temperature kalsinasi, Modifikasi
CaO menjadi logam organo alami sebagai contoh Ca(OCH3), Ca(C3H7O3)2, menurut
laporan dari literature lainnya menyebutkan bahwa yield biodiesel sekitar 93% setelah
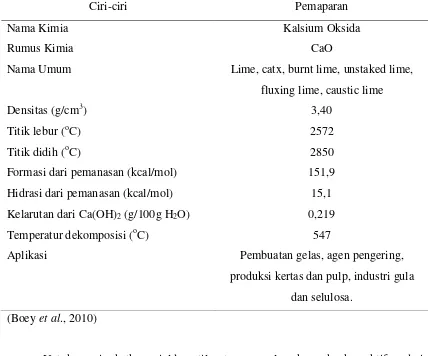
Ciri-ciri kalsium oksida (CaO) dapat dilhat dalam tabel 2.8.
Tabel 2.8. Ciri-Ciri Kalsium Oksida (CaO)
Ciri-ciri Pemaparan
Nama Kimia Kalsium Oksida
Rumus Kimia CaO
Nama Umum Lime, catx, burnt lime, unstaked lime,
fluxing lime, caustic lime
Densitas (g/cm3) 3,40
Titik lebur (oC) 2572
Titik didih (oC) 2850
Formasi dari pemanasan (kcal/mol) 151,9
Hidrasi dari pemanasan (kcal/mol) 15,1
Kelarutan dari Ca(OH)2 (g/100g H2O) 0,219
Temperatur dekomposisi (oC) 547
Aplikasi Pembuatan gelas, agen pengering,
produksi kertas dan pulp, industri gula
dan selulosa.
(Boey et al., 2010)
Untuk meningkatkan yield metil ester asam lemak, maka kereaktifan dari
katalis CaO harus ditingkatkan, sehingga CaO harus dikalsinasi pada suhu tinggi
terlebih dahulu untuk memurnikan CaO tersebut dari pengotor-pengotor lainnya, dari
penelitian yang pernah dilakukan terkait kalsinasi dari katalis CaO adalah, Granados
et al, melakukan sintesis metil ester asam lemak dengan menggunakan reaksi
transesterifikasi dari minyak biji bunga matahari dengan bantuan katalis CaO, dimana
CaO dikalsinasi terlebih dahulu pada suhu 700oC, disini menunjukkan besar yield
yang tinggi. Kouzu et al, meneliti kalsinasi katalis CaO pada suhu 900oC selama 1,5
jam, dalam proses kalsinasi ini CaO menjadi katalis yang sangat reaktif dalam reaksi
2.5. Transesterifikasi
Sintesis metil ester asam lemak (MEAL) cara kimia yaitu dengan menggunakan reaksi
transesterifikasi dari trigliserida (yang bersumber dari minyak) menjadi alkil ester
menggunakan metanol, proses perubahan tersebut dapat berlangsung dalam keadaan
katalis asam, basa, atau enzim.
Secara stoikiometri rasio antara trigliserida dengan alkohol adalah 1:3 dan
reaksi akan menghasilkan 3 mol dari alkil ester dari 1 mol trigliserida. Reaksi
transesterifikasi merupakan reaksi yang berturut-turut, reaksi reversibel, dengan
digliserida dan monogliserida ditempatkan sebagai intermediate (Huber et al., 2006).
Pada dasarnya tranesterifikasi terdiri atas 4 tahapan:
- Pencampuran katalis alkali (umumnya sodium hidroksida atau potasium hidroksida)
dengan alkohol (umumnya metanol). Konsentrasi alkali yang digunakan bervariasi
antara 0,5-1 wt% terhadap massa minyak, sedangakn alkohol digunakan pada rasio
molar 9:1 terhadap minyak.
- Pencampuran alkohol ditambahkan alkali dengan minyak didalam wadah yang
dijaga pada temperature tertentu (40-600C) dan dilengkapi dengan pengaduk (baik
magnetik maupun motor elektrik) dengan kecepatan konstan (pada umumnya pada
600 rpm). Keberadaan pengaduk sangat penting untuk memastikan terjadinya reaksi
metanolisis secara menyeluruh dalam campuran. Reaksi metanolisis ini dilakukan
sekitar 1-2 jam.
- Setelah reaksi metanolisi berhenti, campuran didiamkan dan perbedaan densitas
senyawa didalam campuran akan mengakibatkan terjadi pemisahan antara metil ester
dan pengotor.
- Metil ester yang sering disebut biodiesel tersebut kemudian dibersihkan
menggunakan air destilat untuk memisahkan zat-zat pengotor seperti metanol, sisa
Pada proses transesterifikasi minyak nabati dihasilkan gliserin sebagai hasil
samping selain metil ester atau biodiesel sebagai hasil utama. Reaksi antara minyak
atau lemak dengan alkohol merupakan reaksi yang bersifat bolak-balik. Menurut azas
Le Chatelier bahwa “ Setiap perubahan pada salah satu variabel sistem kesetimbangan
akan menggeser posisi kesetimbangan ke arah tertentu yang akan menetralkan atau
meniadakan pengaruh variabel yang berubah tadi (Bird, 1993).
Dalam proses transesterifiaksi, untuk memisahkan metil ester asam lemak
dengan campuran lainnya dapat digunakan dengan metode sentrifugasi (Kawashima,
2008). Secara umum sentrifugasi adalah proses pemisahan dengan menggunakan gaya
sentrifugal sebagai driving force. Pemisahan dapat dilakukan terhadap fasa padat cair
tersuspensi maupun campuran berfasa cair-cair. Pada pemisahan dua fasa cair dapat
dilakukan apabila kedua cairan mempunyai perbedaan rapat massa. Semakin besar
perbedaan rapat massa dari kedua cairan semakin mudah dipisahkan dengan cara
sentrifugasi. Semakin mudah dipisahkan yang dimaksud adalah semakin kecil energi
yang diperlukan untuk proses pemisahannya.