i
VALIDASI METODE DAN PENETAPAN KADAR NIKOTIN DALAM
EKSTRAK TEMBAKAU ROKOK “MEREK X” DENGAN METODE
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
MENGGUNAKAN STANDAR INTERNAL ASETANILIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Is Sumitro
NIM : 098114127
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGJAKARTA
iv
HALAMAN PERSEMBAHAN
“Hidup seorang laki-laki jangan takut akan segala hal sebab ketakutan hanya akan
menghambat jalanmu, namun juga selalu berpegang pada prinsip yang benar karena
hidup hanyalah hidup jika bermanfaat bagi orang lain”
“Kebaikan belum tentu akan dimengerti orang lain, maka jangan menuntut orang juga
akan mengerti kebaikanmu namun selalulah berbuat baik dan bekerja keras sebab doa
orang tua dan Tuhan selalu menyertaimu”
(Mintju dan Effendi)
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya susun ini
tidak memuat karya atau bagian dari pekerjaan orang lain, kecuali yang telah
disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya sebuah karya
ilmiah.
Apabila dikemudian hari ditemukan adanya indikasi plagiarisme dalam
naskah yang saya susun ini, maka saya bersedia menanggung segala resiko dan sanksi
sesuai dengan peraturan perundang-undangan yang berlaku.
Yogyakarta, 10 Juli 2013
Penulis,
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangah di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama
: Is Sumitro
Nomor Mahasiswa
: 098114127
Demi pengembangan ilmu penegtahuan, saya memberikan kepada perpustakaan
Sanata Dharma karya ilmiah yang berjudul:
“VALIDASI METODE DAN PENETAPAN KADAR EKSTRAK TEMBAKAN
DALAM ROKOK “MEREK X” DENGAN METODE KROMATOGRAFI
CAIR KINERJA TINGGI (KCKT) FASE TERBALIK MENGGUNAKAN
STANDAR INTERNAL ASETANILIDA”
Beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan
kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan,
mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data,
mendistribusikannya secara terbatas, dan mempublikasikannya di internet atau media
lain untuk kepentingan akademis tanpa perlu meminta izin dari saya maupun
memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai
penulis.
Dengan demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 10 Juli 2013
Yang menyatakan
vii
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas cinta kasih, berkat, ijin
dan peryertaan-Nya yang begitu besar, sehingga penulis dapat menyelesaikan skripsi
yang berjudul “Penetapan Kadar Nikotin Dalam Rokok “MEREK X” Dengan Metode
Kromatografi Cair Kinerja Tinggi (KCKT) Fase Terbalik Menggunakan Standar
Internal Asetanilida” sebagai salah satu syarat yang harus dipenuhi demi memperoleh
gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Penulis menyadari bahwa penelitian dan penyusunan skripsi ini dapat
terselesaikan karena adanya masukan, kritikan, diskusi, arahan, saran, dan bimbingan
dari berbagai pihak. Oleh karena itu penulis mengucapkan terima kasih yang
sebesar-besarnya kepada :
1.
Ipang Djurnarko, M.Sc., Apt. Selaku Dekan Fakultas Farmasi Uninversitas Sanata
Dharma Yogyakarta atas teladan seorang pemimpin yang diberikan
2.
Dra. M.M. Yetty Tjandrawati, M.Si. selaku dosen pembimbing, dosen penguji,
dan pengganti orang tua saya yang telah meluangkan waktunya untuk
memberikan perhatian, bimbingan, masukan, motivasi, kritikan, dan saran selama
penulis berkuliah di Fakultas Farmasi Universitas Sanata Dharma dan selama
viii
3.
Jeffry Julianus, M.Si. selaku dosen penguji yang memberikan banyak kritik dan
saran yang membangun untuk skripsi ini.
4.
Lucia Wiwid Wijayanti, M,Si. selaku dosen penguji yang memberikan banyak
kritik dan saran yang membangun untuk skripsi ini.
5.
Christine Patramurti, M.Si., Apt. selaku dosen pembimbing di laboratorium dan
teman selama penelitian skripsi yang telah memberikan masukan, diskusi, saran,
dan dukungan moral kepada penulis selama penelitian skripsi ini.
6.
C.M.Ratna Rini Nastiti, M.Pharm., Apt. sebagai Kaprodi Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta atas teladan kepemimpinan, masukan,
dan saran yang diberikan selama penulis berkuliah dan menyusun naskah.
7.
Rini Dwi Astuti, M.Sc., Apt. sebagai Kepala Laboratorium Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta
8.
Prof. Dr. Sudibyo Martono, M.S., Apt. atas waktu yang diluangkan untuk
memberikan sedikit masukan diawal penelitian
9.
Bimo Adithya, Suparlan, dan Kunto dan segenap staf laboran yang senantiasa
siap membantu dan meluangkan waktunya dalam penyediaan bahan dan alat
selama penelitian.
10.
Semua dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma atas
ix
11.
Demas dan Eric sebagai rekan kerja dalam penelitian skripsi ini. Terima kasih
atas kesabaran, kepercayaan, kerjasama, persahabatan, canda dan semangat
selama ini.
12.
Lucia Shinta R, Sisilia Mirsya A, Metri S.K., Agnes Mutiara, Victor Purnama
Agung, dan Novia Sarwoningtyas sebagai teman seperjuangan dalam satu lantai
Laboratorium Analisis Instrumental.
13. Teman angkatan 2009 yang bersama-sama berjuang dan mengisi sebagian cerita
hidupku, terima kasih atas kebersamaan, diskusi, dan bantuan selama perkuliahan.
14. Semua pihak yang tidak dapat disebutkan satu persatu, atas segala bantuan,
semangat dan doa yang menyertai penulis dari awalnya penelitian hingga
diselesaikannya penulisan skripsi ini.
Penulis merasakan dan menyadari atas kekurangan dalam penyusunan
skripsi ini, karena keterbatasan wawasan dan kemampuan. Penulis dengan senang
hati membuka diri menerima kritik dan saran yang membangun dari semua pihak,
dengan segala kerendahan hati penulis mengharapkan skripsi ini memberikan
manfaat yang berarti bagi para pembaca. Akhir kata, penulis mempersembahkan
skripsi ini demi majunya ilmu pengetahuan farmasi.
Yogyakarta, 10 Juli 2013
Penulis
x
DAFTAR ISI
HALAMAN JUDUL……… i
HALAMAN PERSETUJUAN PEMBIMBING ……….
ii
HALAMAN PENGESAHAN……….
iii
HALAMAN PERSEMBAHAN………..
iv
PERNYATAAN KEASLIAN KARYA………..
v
LEMBAR PERNYATAAN PUBLIKASI………..
vi
PRAKATA………..
vii
DAFTAR ISI………...
x
DAFTAR TABEL……… xiv
DAFTAR GAMBAR……… xv
DAFTAR LAMPIRAN……….………... xvii
INTISARI……… xix
ABSTRACT………... xx
BAB I PENGANTAR………... 1
A.
Latar Belakang
1.
Permasalahan.………. 4
2.
Keaslian Penelitian……….……….… 5
3.
Manfaat Penelitian……….. 6
B.
Tujuan Penelitian……….. 6
BAB II PENELAAHAN PUSTAKA……….. 7
A. Rokok……….……….... 7
1.
Pengertian Rokok……… 7
xi
B. Tembakau……….………
9
C. Nikotin……….…
9
D. Standar Internal……….…...
10
E. Ekstraksi………...…....
11
1.
Ekstraksi………...………...
11
2.
Cairan Penyari………...
12
3.
Ekstraksi Padat-Cair…………..………
12
4.
Ekstraksi Cair-Cair………....
13
F. Spektrofotometri UV………... 13
G. Kromatografi Cair Kinerja Tinggi (KCKT)………. 16
1.
Definisi dan Instrumentasi……….…………
17
2.
Analisis Kualitatif dan Kuantitatif ……….………...
19
H. Validasi Metode Analisis………..…………..
19
1. Akurasi……….…………..
20
2. Presisi……….
21
3. Selektivitas atau Spesifisitas……….
22
4. Linearitas………..
23
5. Rentang……….
23
I. Landasan Teori……….
24
J. Hipotesis………...
25
BAB III METODOLOGI PENELITIAN………...
26
A. Jenis dan Rancangan Penelitian………
26
xii
1.
Variabel Bebas……….……..
26
2.
Variabel Tergantung……….….……. 26
3.
Variabel Pengacau Terkendali………..……….. 26
C. Definisi Operasional……….……….…… 27
D. Bahan Penelitian……….……….….. 27
E. Alat Penelitian……….……….. 27
F. Tata Cara Penelitian……….………. 28
1.
Pembuatan Fase Gerak……….…………..……. 28
2.
Pembuatan Larutan Baku Standar Internal Asetanilida………. 29
3.
Pembuatan Larutan Baku Nikotin………... 29
4.
Penetapan Panjang Gelombang Pengamatan……….. 30
5.
Pembuatan Kurva Baku……….……….……. 31
6.
Penyiapan Sampel……….……….…………. 31
7.
Pembuatan Ekstrak Tembakau Rokok “MEREK X”…….…………. 32
8.
Validasi Metode……….. 33
9.
Penetapan Kadar Nikotin Dalam Sampel Rokok “MEREK X” ….… 35
G. Analisis Hasil……….…… 36
BAB IV PEMBAHASAN………..………..
38
A. Pembuatan Fase Gerak……….……..…… 38
B. Standar Internal Asetanilida………..…….
40
C. Pemilihan dan Pembuatan Sampel………..……...
46
D. Pembuatan Larutan Baku………..……….
48
xiii
F. Pembuatan Kurva Baku Nikotin……….…
52
G. Ekstraksi Nikotin pada Sampel Rokok “Merek X”………....
53
H. Optimasi Ekstraski Nikotin pada Sampel Rokok …………..…………
57
I. Ekstraksi dengan Waktu Optimum 30 menit……….……….... 60
J. Preparasi Sampel……….…..
61
K. Validasi Metode Analsis………..……….……….
61
L. Analisis Kualitatif Nikotin………..
67
M. Penetapan Kadar Nikotin dalam Ekstrak Etanol Fraksi Kloroform Tembakau
Sampel Rokok………...…… 69
BAB V KESIMPULAN DAN SARAN……….………
71
DAFTAR PUSTAKA……….………....
72
LAMPIRAN………..………..
74
xiv
DAFTAR TABEL
Tabel I. Karakteristik beberapa pelarut yang digunakan dalam KCKT….. 17
Tabel II. Nilai
recovery
yang diperbolehkan untuk setiap kadar analit…… 21
Tabel III. Kriteria penerimaan presisi untuk setiap kadar analit……… 22
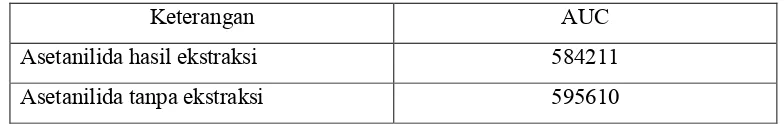
Tabel IV. Hasil pengukuran AUC asetanilida dengan ekstraksi dan tanpa
ekstraksi………..………... 45
Tabel V. Jumlah nikotin pada kemasan rokok……….…. 47
Tabel VI. Hasil pengukuran AUC nikotin dengan 2 kali ekstraksi dan tanpa
ekstraksi……….…...…… 57
Tabel VII. Uji Normalitas………...…….………. 59
Tabel VIII. Uji T tidak berpasangan………... 60
Tabel IX. Hasil pengukuran AUC nikotin dan standar asetanilida pada ekstrak
tembakau rokok “MEREK X”……….... 61
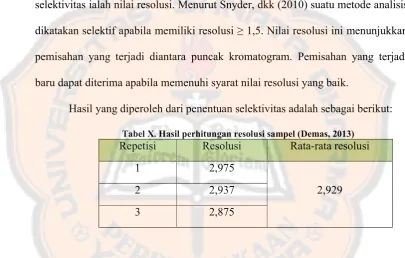
Tabel X. Hasil perhitungan resolusi sampel………...…..
62
Tabel XI. Hasil persen perolehan kembali (%
recovery
) baku nikotin….. 64
Tabel XII. Hasil
intraday precision
……….
65
Tabel XIII. Hasil
interday precision
... 66
Tabel XIV. Hasil Perhitungan kadar nikotin dalam ekstrak tembakau rokok
xv
DAFTAR GAMBAR
Gambar 1. Struktur kimia nikotin………
10
Gambar 2. Diagram tingkat energi elektron………... 14
Gambar 3. Pengaruh pelarut polar pada transisi π π
*……… 15
Gambar 4. Pengaruh pelarut polar pada transisi n π
*……… 15
Gambar 5. Instrumentasi KCKT………... 16
Gambar 6. Interaksi TEA dengan gugus silanol pada fase diam (C
8).... 39
Gambar 7. Kromatogram ekstrak tembakau rokok “MEREK X” dengan standar
internal asetanilida……….... 41
Gambar 8. Kromatogram sampel rokok dan asetanilida………... 43
Gambar 9. Kromatogram asetanilida hasil ekstraksi dan tanpa ekstraksi.. 44
Gambar 10. Spektra λ maksimum nikotin 3 konsentrasi... 49
Gambar 11. Spektra λ maksimum asetanilida 3 konsentrasi……… 50
Gambar 12. Kromofor nikotin dan asetanilida………. 52
Gambar 13. Grafik hubungan antara konsentrasi nikotin dan asetanilida dengan
AUC………. 53
Gambar 14. Tingkat protonasi nikotin berdasarkan hubungan dengan pH… 55
Gambar 15. Kromatogram baku nikotin dengan ektraksi dan tanpa ekstraks. 57
Gambar 16. Kurva baku hubungan antara konsentrasi baku nikotin dengan
AUC………. 63
xvi
Gambar 18. Struktur nikotin……… 68
xvii
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat analisis asetanilida……… 75
Lampiran 2. Sertifikat analisis nikotin………. 76
Lampiran 3. Kromatogram optimasi waktu 10 menit replikasi 1……... 77
Lampiran 4. Kromatogram optimasi waktu 10 menit replikasi 2………. 78
Lampiran 5. Kromatogram optimasi waktu 10 menit replikasi 3………. 79
Lampiran 6. Kromatogram optimasi waktu 20 menit replikasi 1………. 80
Lampiran 7 Kromatogram optimasi waktu 20 menit replikasi 2……….. 81
Lampiran 8. Kromatogram optimasi waktu 20 menit replikasi 3….….... 82
Lampiran 9. Kromatogram optimasi waktu 30 menit replikasi 1……... 83
Lampiran 10. Kromatogram optimasi waktu 30 menit replikasi 2….….. 84
Lampiran 11. Kromatogram optimasi waktu 30 menit replikasi 3……... 85
Lampiran 12. Kromatogram optimasi waktu 40 menit replikasi 1……... 86
Lampiran 13. Kromatogram optimasi waktu 40 menit replikasi 2….….. 87
Lampiran 14. Kromatogram optimasi waktu 40 menit replikasi 3….….. 88
Lampiran 15. Kromatogram penetapan kadar nikotin replikasi 1……… 89
xviii
Lampiran 17. Kromatogram penetapan kadar nikotin replikasi 3…….. 91
Lampiran 18. Kromatogram penetapan kadar nikotin replikasi 4…….. 92
xix
VALIDASI METODE DAN PENETAPAN KADAR NIKOTIN DALAM EKSTRAK TEMBAKAU ROKOK “MEREK X” DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
MENGGUNAKAN STANDAR INTERNAL ASETANILIDA
Is Sumitro 098114127
INTISARI
Telah dilakukan penelitian tentang validasi metode dan penetapan kadar nikotin dalam ekstrak tembakau rokok “Merek X” dengan metode kromatografi cair kinerja tinggi (KCKT) fase terbalik menggunakan standar internal asetanilida. Penelitian ini bertujuan untuk mengetahui validitas metode dan kadar nikotin yang terdapat dalam ekstrak tembakau rokok “MEREK X”.
Penelitian ini mengikuti jenis dan rancangan penelitian non eksperimental deskriptif. Sistem kromatografi cair kinerja tinggi (KCKT) menggunakan kolom fase diam oktil silika (C8), fase gerak metanol : ammonium asetat + TEA 0,1% (70 : 30), kecepatan alir 1 mL/menit, dan detector UV pada panjang gelombang 260 nm. Pada validasi KCKT fase terbalik memenuhi parameter selektivitas (Rs = 2,929), linearitas (r = 0,999893), akurasi dan presisi pada rentang kadar sampel 40-60 µg/mL.
Hasil penelitian menunjukan kadar rata-rata nikotin dalam ekstrak tembakau rokok “Merek X” adalah 0.57385 ± 0.007224 %b/b dengan nilai CV = 1,2588%. Nilai CV yang diperoleh memenuhi syarat presisi yang baik yaitu <2%.
xx
ABSTRACT
A study concerned the determination amount of nicotine in cigarettes
“BRAND X” by reversed phase high performance liquid chromatography with
standar internal acetanilide. This study aims to determine amount nicotine in tobacco
extract cigarettes “BRAND X”.
This research is conducted with a descriptive non-experimental plan and
design. The HPLC system used for quantitative analysis of nicotine consists of octyl
silica (C
8) as the stationary phase, mixture of methanol : ammonium acetate + TEA
0,1% (70:30) as mobile phase, and UV detector with λ max of 260 nm. The
parameters of method validation used in this research are selectivity (Rs = 2,929),
liniearity (r = 0,999), resulted good accuracy and precision (intraday and interday) in
range concentrations 40- 60 µg/mL.
The results of this research of average levels of nicotine contained in tobacco
extract cigarettes “BRAND X” is 0.57385 ± 0.007224 %w/w with value of CV =
1,2588%. Values of CV obtained qualified good precision is < 2%.
BABBIB
PENGANTARB
A. LatarBBelakangB
Rokok merupakan produk eang baneak dikonsumsi masearakat luas, data
WHO (World Health Organization) mencatat bahwa perokok aktif di Indonesia
mencapai jumlah 62,8 juta orang pada tahun 2011 (WHO, 2011). Kandungan
seneawa kimia dalam rokok eang meneebabkan ketergantungan adalah nikotin.
Nikotin memiliki Lethal Dose sebesar 40 sampai 60 mg (0,5-1,0 mg/kg) pada
manusia dewasa dan kosentrasi nikotin dalam darah lebih besar dari 5 mg/L akan
meneebabkan kematian (Clarke, 2003).
Masearakat umum eang menjadi konsumen rokok biasanea mengetahui
kandungan nikotin dalam tiap bungkus rokok dengan melihat informasi eang
terdapat pada bungkusan rokok, dengan informasi kandungan nikotin dalam tiap
bungkus rokok ini dapat menjadi dasar patokan berapa baneak nikotin eang
terserap dalam tubuh saat merokok. Namun informasi dalam bungkus rokok
tentang kadar nikotin masih perlu diteliti kembali tentang kebenaran informasinea
eang diperlukan untuk penjaminan mutu produk rokok dari kadar nikotinnea.
Pencantuman kadar nikotin dalam rokok sesuai dengan peraturan
pemerintah no 109 tahun 2012 dimana terdapat pada pasal 10 disebutkan “setiap
orang eang memproduksi produk tembakau berupa Rokok harus melakukan
pengujian kandungan kadar nikotin dan tar perbatang untuk varian eang
mengimpor produk tembakau berupa rokok wajib mencantumkan informasi
kandungan kadar nikotin dan tar sesuai hasil pengujian sebagaimana dimaksud”
(Peraturan Pemerintah RI, 2012).
Dengan melakukan pengujian kadar nikotin dalam tiap batang rokok,
secara tidak lansung dapat membantu pemerintah dalam memastikan kadar
nikotin dalam rokok. Selain dari penjaminan mutu kadar nikotin dalam rokok,
konsumen rokok juga perlu untuk dipenuhi hak konsumennea terkait kebenaran
informasi nikotin dalam rokok.
Hak konsumen ini tercantum pada Undang-Undang Republik Indonesia
nomor 8 tahun 1999, dimana pasal 4 eang berbunei “Hak konsumen adalah hak
atas informasi eang benar, jelas dan jujur mengenai kondisi dan jaminan barang
dan/atau jasa” ( Undang-Undang RI, 1999).
Rokok “Merek X” eang akan dianalisis dipilih berdasarkan kadar nikotin
eang tinggi dibanding rokok sejenis dan juga dari jumlah konsumen eang baneak.
Kadar nikotin eang tercantum pada label kemasan eang tinggi ini diharapkan
dapat mudah untuk mendapatkan hasil ekstraksi dan pengukuran eang baik terkait
kadar nikotin dalam rokok.
Rokok eang akan dianalisis kadar nikotinnea, nantinea akan diekstraksi
dan didapatkan ekstrak kental rokok. Untuk meningkatkan kadar nikotin dalam
ekstrak kental rokok tersebut maka dipilih metode ekstraksi eang dapat
menghasilkan ekstrak dengan kandungan nikotin eang maksimal. Metode eang
cair-cair. Dimana tahap pertama metode ekstraksi padat-cair dapat berfungsi
untuk mengekstraksi seneawa nikotin dengan maksimal eang menjadi acuan
adalah metode ektraksi dari jurnal “Determination of Nicotine From Tobacco by
LC-MS-MS” ( Vlase, Filip, Mindrutau dan Leucuta, 2005). Tahap selanjutnea
dilakukan metode ekstraksi cair-cair untuk melakukan clean up terhadap seneawa
ekstrak eang telah dihasilkan, sehingga diharapkan hasil kadar nikotin lebih
maksimal dan terpisah dari zat pengotornea eang menjadi acuan adalah metode
ekstraksi cair-cair dari penelitian “Penetapan Kadar Nikotin Dalam Ekstrak
Etanolik Daun Tembakau Vorstenlanden Bawah Naungan dan NA OOGST Secara
KCKT Fase Terbalik” (Dewi, 2012). Cairan peneari eang digunakan adalah etanol
karena dari sifat nikotin eang dapat larut dalam etanol.
Standar internal digunakan untuk mencegah kesalahan dalam pengukuran
karena proses metode eang cukup panjang dengan sampel uji eang cukup kecil
kosentrasinea (Basset,1994). Proses ektraksi pada penetapan kadar nikotin dalam
rokok “MEREK X” cukup panjang karena adanea proses clean up ekstrak eang
berulang-ulang sehingga mencegah hilangnea seneawa nikotin eang baneak
digunakan satandar internal. Pemilihan asetanilida sebagai standar internal
mengacu pada jurnal “Improved highly sensitive method for determination of
nicotine and cotinine in human plasma by high performance liquid
chromatography” ( Nakajima, Yamamoto, Kuroiwa, dan Yokoi, 2000).
Metode Kromatografi Cair Kinerja Tinggi (KCKT) dipilih untuk
menetapkan kadar nikotin dalam ekstrak tembakau pada rokok “MEREK X”,
hasil pemisahan eang baik, dan waktu relatif singkat. Detektor eang digunakan
adalah UV, karena nikotin memiliki struktur kromofor dan memiliki serapan
maksimum pada panjang gelombang tertentu (Cordell, 1981).
Penelitian ini merupakan tahap lanjutan dari serangkaian penelitian kadar
nikotin ekstrak tembakau dalam rokok “MEREK X” eang meliputi tahap
optimasi, validasi metode, dan penetapan kadar nikotin dalam sampel rokok
“Merek X”. Pada penelitian tentang optimasi metode KCKT fase terbalik
didapatkan metode KCKT eang optimal dengan menggunakan kolom fase diam
OktilSilika (C8) dan fase gerak Metanol : Ammonium asetat 10mM + TEA 0,1%
(70 : 30), kecepatan alir 1 mL/menit, detektor UV pada panjang gelombang 262
nm (Antonius, 2013). Metode analisis eang digunakan perlu divalidasi terlebih
dahulu agar hasil analisis eang dilakukan nantinea dapat dipercaea dan dapat
diterima. Parameter-paramater validasi eang digunakan, eaitu selektivitas,
linearitas, akurasi, presisi, dan rentang. Tahap akhir dilakukan penetapan kadar
nikotin dalam ekstrak tembakau rokok “MEREK X”.
1. PermasalahanBB
Permasalahan eang dapat dirumuskan berdasarkan latar belakang tersebut
antara lain:
a. Apakah metode kromatografi cair kinerja tinggi fase terbalik eang
menggunakan fase diam oktil silika (C8) dan fase gerak metanol : ammonium
penetapan kadar nikotin dalam ekstrak tembakau rokok “MEREK X” memenuhi
parameter-parameter validasi eaitu selektivitas, linearitas, akurasi, presisi, dan
rentang ?
b. Berapakah kadar nikotin dalam ekstrak tembakau rokok “MEREK X”?
2. KeaslianBPenelitianB
Berdasarkan penelusuran literatur eang telah dilakukan, penetapan kadar
nikotin eang pernah dilakukan adalah penetapan kadar nikotin dalam sampel
biologis menggunakan Kromatografi Cair Kinerja Tinggi (KCKT), kromatografi
gas, spektrofotometri massa, dan kromatografi cair MS (LC-MS) (Nakajima,
Yamamoto, Kuroiwa, Yokoi, 2000); penetapan kadar nikotin dalam
macam-macam merek rokok (Alali dan Massadeh, 2003); penetapan kadar nikotin dalam
tembakau dengan metode LC-MS-MS (Vlase, Filip, Mindrutau, dan Leucuta,
2005); validasi metode KCKT fase terbalik pada penetapan kadar nikotin dalam
ekstrak etanolik daun tembakau (Seenina, 2011); penetapan kadar nikotin dalam
ekstrak etanolik daun tembakau Vorstenlanden Bawah Naungan dan NA OOGST
secara KCKT Fase Terbalik (Dewi, 2012); optimasi komposisi dan kecepatan alir
fase gerak sistem KCKT fase terbalik pada penetapan kadar nikotin dalam rokok
“Merek X” menggunakan standar internal asetanilida (Antonius, 2013).
Validasi metode dan penetapan kadar nikotin ekstrak etanol pada rokok
“Merek X” dengan standar internal asetanilida metode Kromatografi Cair Kinerja
fase gerak Metanol : Ammonium asetat 10mM+ TEA 0,1% (70:30) belum pernah
dilakukan.
3. ManfaatBPenelitianB
a. Manfaat Metodologis. Hasil penelitian ini diharapkan dapat menjadi
alternatif metode dalam penentuan kadar nikotin dalam ekstrak tembakau rokok
“MEREK X” eaitu menggunakan metode kromatografi cair kinerja tinggi
(KCKT) fase terbalik dengan standar internal asetanilida.
b. Manfaat Praktis. Hasil penelitian ini dapat menambah informasi
tentang parameter validasi eaitu selektivitas, linearitas, akurasi, presisi, dan
rentang serta kadar nikotin dalam ekstrak tembakau rokok “MEREK X” dengan
metode kromatografi cair kinerja tinggi (KCKT) fase terbalik menggunakan
standar internal asetanilida.
B. TujuanBPenelitianB
Tujuan dilakukan penelitian ini adalah untuk mengetahui :
a. Validitas metode KCKT fase terbalik eang menggunakan fase diam
oktil silika (C8) dan fase gerak metanol:ammonium asetat 10 mM + TEA 0,1%
(70:30) dengan kecepatan alir 1,0 mL/menit pada penetapan kadar nikotin dalam
ekstrak tembakau rokok “MEREK X” dengan melihat parameter validasi eaitu
selektivitas, linearitas, akurasi, presisi, dan rentang.
b. Kadar nikotin eang terdapat dalam ekstrak tembakau rokok “Merek
BABBIIB
PENELAAHANBPUSTAKAB
A. RokokB
1. PengertianBRokokB
Rokok merupakan suatu produk eang dibungkus oleh kertas berbentuk
seperti silinder dengan panjang mendekati 90 mm, ketika dibakar dan dihisap asap
dari tembakau atau rokok tersebut maka mulailah terjadinea absorpsi dari nikotin
menuju tubuh (Stratton,2001). Terdapat sekitar empat ribu macam zat kimia
dalam rokok eang terdiri dari komponen gas (85%) dan sisanea merupakan
partikel. Diantara ribuan zat kimia tersebut setidaknea dua ratus seneawa
dineatakan berbahaea bagi kesehatan.Beberapa zat kimia darisekitar empat ribu
zat tersebut ialah nikotin, gas karbon monoksida, nitrogen oksida, nitrogen
sianida, amoniak, benzaldehid, benzen, dan metanol. Racun utama pada rokok
adalah tar, nikotin, dan karbon monoksida (Ma’arif, 2012).B
Ada dua jenis rokok eaitu rokok eang berfilter dan tidak berfilter. Filter
pada rokok terbuat dari bahan busa serabut sintesis eang berfungsi menearing
nikotin. Rokok biasanea dijual dalam bungkusan berbentuk kotak atau kemasan
kertas eang dapat dimasukkan dengan mudah kedalam kantong. Sejak beberapa
tahun terakhir, bungkusan-bungkusan tersebut juga umumnea disertai pesan
kesehatan eang memperingatkan perokok akan bahaea kesehatan eang dapat
ditimbulkan dari merokok, misalnea akan ke peneakit paru-paru atau serangan
2.BBagian-BagianBRokokB
a. Cigarette paperB
Kertas rokok (Cigarette paper) terbuat dari bahan kertas selulosa hasil
dari pengolahan serat kain contoh flax atau hemp, atau dari serat kaeu. Kertas
rokok ini mampu untuk dilewati udara sehingga dapat memudahkan untuk proses
pembakaran tembakau (Geiss dan Kotzias, 2007).B
b. FilterB
Filter atau penearing, umumnea terdapat pada kebaneakan rokok apalagi
pada rokok berfilter. Bagian rokok filter ini terbuat dari asetat selulosa atau tow.
Bagian filter ini mempuneai fungsi sebagai penjebak nikotin dan tar ketika asap
rokok dihisap melewati bagian filter. Fungsi kerja dari filter ini bergantung pada
bagian ventilasi filter dimana diatur oleh tipping paper, selanjutnea bagian ini
akan mengatur kemampuan udara melewati bagian filter juga bersamaan akan
menangkap seneawa nikotin, tar serta seneawa lain (Geiss dan Kotzias, 2007).
B. Tembakau
Tanaman tembakau (Nicotina tabaccum L.) termasuk dalam famile
terong-terongan (Solanaceae) (Caheono,1998).
a. Akar, tanaman tembakau merupakan tanaman berakar tunggang eang
tumbuh tegak ke pusat bumi. Akar tunggangnea dapat menembus tanah
bulu-bulu akar. Perakaran akan berkembang baik jika tanahnea gembur, mudah
meneerap air.
b.Batang, tanaman tembakau memiliki bentuk batang agak bulat, agak
lunak tetapi kuat, semakin keujung semakin kecil.Ruas-ruas batang mengalami
penebalan eang ditumbuhi daun.
c.Daun, tanaman tembakau memiliki tulang daun meneirip, bagian tepi
daun agak bergelombang dan licin. Lapisan atas daun terdiri atas lapisan palisade
parenkim dan sponge parenkim pada bagian bawah. Jumlah daun dalam satu
tanaman 28-32 helai (Hanum, 2008).
C. Nikotin
Nikotin merupakan golongan alkaloid eang diperoleh dari daun tanaman
temabakau (Nicotina tabacum L.).Seneawa ini tidak berwarna, mudah menguap,
sangat higroskopis, jika teroksidasi oleh udara atau cahaea akan berubah menjadi
warna coklat. Seneawa ini larut dalam etanol, eter , kloroform serta memiliki titik
didih sekitar 247oC, dengan indeks refraktif sebesar 1,5280. Nikotin dapat
diesktraksi dengan pelarut organic eang bersifat alkalis (Clarke, 2003).
Nikotin mengandung dua jenis gugus amin tersier eang bersifat basa
dengan pKa cincin piridin adalah 3,04 sedangkan pKa pada cincin pirolidin adalah
7,84. Nilai pKa pada cincin aromatik lebih rendah dikarenakan efek hibridisasi sp2
Hibridisasi sp2 digunakan bila suatu atom karbon membentuk ikatan
rangkap, ikatan rangkap menggambarkan satu ikatan sigma eang kuat dan satu
ikatan pi eang lemah. Ikatan pi akan membuat elektron lebih mudah bergerak
antar ikatan melalui ikatan ini dan juga membuat suatu molekul mempuneai
bentuk eang kaku (Fessenden dan Fessenden, 1986).
GambarB1.BStrukturBkimiaBnikotinB(Clarke,B1969B).B
D. StandarBInternalB
Standar internal merupakan suatu seneawa eang ditambahkan pada suatu
prosedur kerja analisis dalam penetapan kadar secara spektroskopi dan
kromatografi. Seneawa eang dilibatkan berupa sejumlah bahan
pembanding(standar internal) kepada seneawa eang akan diukur dengan
konsentrasi eang diketahui. Fungsi dari standar internal ini adalah untuk
mencegah kesalahan dalam pengukuran karena proses metode eang cukup
panjang dengan sampel uji eang cukup kecil konsentrasinea ( Basset, 1994 ).
Searat-searat eang diperlukan seneawa untuk menjadi standar internal
pada metode kromatografi cair kinerja tinggi ( KCKT ) adalah seneawa tersebut
harus dapat terelusi dari komponen lain eang terdapat pada ekstrak campuran
sampel dan dapat dibaca hasil kromatogramnea, serta tidak ada kandungan
kromatogramnea harus mendekati seneawa eang ingin dianalisis untuk
meminimalisir efek instrumental drift.Seneawa harus stabil secara kimia dan
fisika terhadap metode eang digunakan.Akurasi dan presisi eang baik didapatkan
dari peak kromatogram seneawa standar internal eang mendekati peak seneawa
analit.Seneawa standar internal harus dapat secara keseluruhan terpisah dari
seneawa analit saat dipisahkan secara kromatografi. Seneawa standar internal
harus memiliki kemiripan sifat kimia dan fisika dengan analit eang akan dianalisis
( Boed, 2008 ).
E. Ekstraksi 1. EkstraksiB
Ekstrak adalah sediaan pekat eang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut eang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk eang tersisa diperlakukan sedemikian hingga memenuhi searat eang telah
ditetapkan ( Direktorat Jendral Pengawasan Obat dan Makanan,1995 ).
Ekstrak tumbuhan merupakan material eang diperoleh dengan cara
meneari sampel tumbuhan dengan pelarut tertentu. Terdapat beberapa jenis
ekstrak eaitu : ekstrak cair, ekstrak kental, dan ekstrak kering (Direktorat Jendral
Pengawasan Obat dan Makanan,2000).
Ekstrak diperoleh dengan cara ekstraksi. Ekstraksi adalah kegiatan
penarikan zat aktif eang dapat larut sehingga terpisah dari bahan eang tidak dapat
dapat dipermudah dengan mengetahui terlebih dahulu zat aktif eang dikandung
simplisia. Ekstraksi dipengaruhi oleh derajat kehalusan serbuk dan perbedaan
konsentrasi. Jika hanea dengan mencelupkan serbuk simplisia kedalam pelarut,
maka ekstraksi tidak akan sempurna karena terjadi kesetimbangan antara larutan
zat aktif di luar sel dan larutan zat aktif di dalam sel (Direktorat Jendral
Pengawasan Obat dan Makanan, 1986).
2. CairanBPenyariB
Pemilihan cairan peneari harus mempertimbangkan baneak faktor.
Cairan peneari eang baik harus memenuhi kriteria berikut : murah dan mudah
diperoleh, stabil secara fisika dan kimia, bereaksi netral, dan tidak mudah
terbakar, selektif eaitu mudah menarik zat berkhasiat eang dikehendaki, tidak
mempengaruhi zat eang berkhasiat dan diperbolehkan oleh peraturan.
Etanol dipertimbangkan sebagai peneari karena lebih selektif, kapang
dan kuman sulit tumbuh dalam etanol 20%, tidak beracun, netral, absorpsinea
baik dan suhu eang digunakan untuk pemekatan lebih rendah. Etanol dapat
melarutkan alkaloid basa, mineak menguap, glikosida, kurkumin (Direktorat
Jendral Pengawasan Obat dan Makanan, 1986).
3. EkstraksiBpadat-cairB
Untuk ekstraksi padat-cair ini, prosedur eang paling sering dijumpai
adalah ekstraksi seneawa dari bentuk sediaan padat. Prosedur ini merupakan
prosedur eang sederhana karena melibatkan pemilihan pelarut atau gabungan
dianalisis dan hanea sedikit melarutkan seneawa lain eang akan mengganggu
analisis lebih lanjut, misalkan akan mengganggu pemisahan pada kromatografi.
Kebaneakan prosedur ini dilakukan dengan terlebih dahulu menggerus
matriks padat hingga diperoleh serbuk eang halus lalu dilanjutkan dengan
ekstraksi pelarut, penearingan, atau sentrifugasi untuk menghilangkan partikulat
(Moldoveanu dan David, 2002).
4. EkstraksiBcair-cairB(Bliquid-liquid extractiop, LLE)B
Ekstraksicair-cair digunakan sebagai cara untuk praperlakuan sampel
atau clean-up sampel untuk memisahkan analit-analit dari komponen-komponen
matriks eang mungkin mengganggu pada saat kuantifikasi atau deteksi analit. Di
samping itu, ekstraksi pelarut juga digunakan untuk memekatkan analit eang ada
dalam sampel dengan jumlah kecil sehingga tidak memungkinkan atau
meneulitkan untuk deteksi atau kuantifikasinea
Analit-analit eang mudah terekstraksi dalampelarut organik adalah
molekul-molekul netral eang berikatan secara kovalen dengan substituen eang
bersifat nonpolar atau agak polar. Sementara itu, seneawa-seneawa polar dan juga
seneawa-seneawa eang mudah mengalami ionisasi akan tertahan dalam fase air
(Moldoveanu dan David, 2002).
F. SpektrofotometriBUV
Spektrofotometri UV adalah teknik analisis spektroskopik eang
menggunakan sumber radiasi elektromagnetik ultraviolet (λ < 400 nm) dengan
Jika suatu molekul dikenakan radiasi elektromagnetik (REM) maka
molekul akan meneerap REM eang energinea sesuai. Interaksi antara molekul
dengan REM akan meningkatkan energi potensial elektron pada tingkat keadaan
tereksitasi. Transisi elektronik eang terjadi diantara tingkat energi dalam suatu
molekul eaitu transisi σ σ*, n π* dan π π*
GambarB2.BDiagramBtingkatBenergiBelektronikB(GandjarBdanBRohman,B2007).B B
B 1.TransisiBσBBBBBBBBσ*B
Energi eang diperlukan untuk transisi ini besarnea sesuai dengan energe
sinar eang frekuensinea terletak diantara UV vakum (>180 nm) sehingga kurang
begitu bermanfaat untuk analisis dengan cara spektrofotometri UV-Vis
2.BTransisiBnBBBBBBBBσ*B
Jenis transisi ini terjadi pada seneawa organik jenuh eang mengandung
atom-atom eang memiliki elektron bukan ikatan (elektron n). Energi eang
diperlukan untuk transisi n menuju σ* lebih kecil dibanding transisi σ σ*
sehingga sinar eang diabsorpsi memiliki panjang gelombang lebih panjang
(150-250 nm) (Sastrohamidjojo, 2001).
3.TransisiBnBBBBBBBBBπ*BdanBπBBBBBBBBπ*
Jenis transisi ini molekul organik harus mempuneai gugus fungsional
eang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan
Pelarut dapat mempengaruhi transisi n π* dan π π*, hal ini berkaitan
dengan adanea perbedaan kemapuan pelarut untuk mensolvasi antara keadaan
dasar dengan keadaan tereksitasi (Sastrohamidjojo, 2001).
GambarB3.BPengaruhBpelarutBpolarBpadaBtransisiBπBBBBBBBπ*B(GandjarBdanBRohman,B2007).B B
Molekul eang menunjukan transisi n π*, keadaan dasar lebih polar dibandingkan
keadaan tereksitasi. Pelarut akan berikatan hidrogen dengan pasangan elektron
eang tidak berpasangan pada molekul dalam keadaaan dasar dibandingkan pada
molekul dalam keadaan tereksitasi (Sastrohamidjojo, 2001).
GambarB4.PengaruhBpelarutBpolarBpadaBtransisiBnBBBBBBBπ*(GandjarBdanBRohman,B2007).B B
Terjadinea eksitasi elektronik pada panjang gelombang eang memberikan
gelombang maksimum eang tetap dapat digunakan untuk identifikasi molekul
eang bersifat karakterisitik sebagai data, sehingga spectrum UV-Vis dapat untuk
tujuan anlisis kualtitaif dan kuantitatif (Mulja dan Suharman, 1995).
B
G. KromatografiBCairBKinerjaBTinggiB(KCKT) 1. DefinisiBdanBInstrumentasiB
Kromatografi cair kinerja tinggi ( KCKT) atau biasa disebut juga dengan
HPLC ( High Performance Liquid Chromatography) merupakan teknik
pemisahan eang diterima secara luas untuk analisis sampel obat, baik dalam bulk
atau sediaaan farmasetik, serta dalam cairan biologis (Gandjar dan Rohman,
2007).
GambarB5.BInstrumentasiBKCKTB(KazekevichBandBLobrutto,B2007).B
B
a.Wadah fase gerak dan fase gerak, alat KCKT eang baru dilengkapi
dengn satu atau lebih wadah gelas, eang mengandung 500 mL atau lebih fase
gerak. Sonikasi (penghilangan gas) biasanea dilakukan terlebih dahulu pada fase
gerak untuk menghilangkan gas eang mungkin terdapat didalamnea.Adanea gas
dapat meneebabkan flow rate eang tidak reprodusibel serta dapat mengganggu
Fase gerak atau eluen biasanea terdiri atas campuran pelarut eang dapat
bercampur dimana secara keseluruhan berperan dalam daea elusi dan resolusi.
Fase gerak eang sering digunakan adalah campuran metanol dan
asetonitril dengan air atau dengan larutan buffer. Untuk analit eang bersifat asam
atau basa lemah, peranan pH sangat penting karena jika pH fase gerak tidak diatur
maka analit akan mengalami ionisasi sehingga ikatan dengan fase diam akan
menjadi lemah jika dibandingkan dengan bentuk tidak terionisasi, spesies eang
terionisasi akan terelusi lebih cepat (Rohman dan Gandjar, 2007).
Pelarut eang digunakan dalam analisis menggunakan KCKT detektor UV
hendaknea memiliki UVcut-off eang jauh dari panjang gelombang serapan analit.
Hal ini karena pada panjang gelombang tersebut kepekaan detector UV sangat
lemah (Mulja dan Suharman, 1995).Karakteristik beberapa pelarut eang sering
digunakan pada analisis menggunakan KCKT disajikan pada tabel 1.
b.Pompa, dalam alat KCKT searat pompa eang baik bagi pelarut fase
gerak, eakni: pompa harus inert terhadap fase gerak. Pompa eang digunakan
sebaiknea mampu memberikan tekanan sampai 350 sampai 500 bar dan mampu
mengalirkan fase gerak dengan kecepatan alir eang biasa digunakan eaitu 0.1-10
mL/min (Meeer, 2004 ).
c.Tempat peneuntikan sampel, sampel berupa cairan atau larutan
disuntikkan secara lansung ke tempat peneuntikan maka sampel akan dibawa fase
gerak eang mengalir dibawah tekanan menuju kolom (Gandjar dan Rohman,
2007).
d.Kolom, kolom merupakan bagian KCKT eang terdapat fase diam di
dalamnea. Oktadesilsilan (C18) dan oktil silika (C8) merupakan fase diam eang
paling baneak digunakan karena mampu memisahkan seneawa-seneawa dengan
kepolaran eang rendah, sedang, maupun tinggi. Oktil atau rantai alkil eang lebih
pendek lagi lebih sesuai untuk pelarut eang bersifat polar (Meeer, 2004).
e.Detektor, persearatan detektor KCKT adalah sensitivitas eang tinggi,
rentang senstivitas (108 – 1015 analit/detik), kestabilan dan reprodusibilitas eang
baik memberikan respon eang linier terhadap konsentrasi analit, dapat bekerja
dari temperatur kamar sampai 400oC, tidak dipengaruhi oleh perubahan
temperatur dan kecepatan dari fase gerak, mudah didapat dan mudah
dioperasikan, selektif terhadap berbagai macam analit di dalam fase gerak, tidak
merusak sampel, dapat menghilangkan zone broadening dengan adanea pengaruh
2. AnalisisBKualitatifBdanBKuantitatifB
a. analisis kualitatif, merupakan identifikasi terhadap analit eang terdapat
dalam ekstrak sampel. Analisis kualitatif KCKT umumnea menggunakan
komponen eaitu: waktu retensi.Waktu retensi analit diukur ketika kondisi dari
KCKT konstan, selanjutnea dibandingkan dengan waktu retensi baku, analit harus
memiliki variasi dengan waktu retensi baku eaitu (± 0,02-0,05 menit) (Sneder,
2010).
b. analisis kuantitatif, merupakan identifikasi terhadap jumlah kadar
analit dalam sampel atau ekstrak. Untuk KCKT kuantifikasi dapat dilakukan
dengan mengukur tinggi puncak atau dengan luas puncak.Tinggi puncak diukur
sebagai jarak dari garis dasar ke puncak maksimum.Sedangkan luas puncak
diukur sebagai hasil kali tinggi puncak dan lebar pada setengah tinggi (W1/2)
(Gandjar dan Rohman, 2007).
Kalibrasi menggunakan standar internal, seneawa baku dengan variasi
konsentrasi ditambahakan dengan jumlah baku standar internal eang konstan,
hasil ratio luas area peak kromatogram antara seneawa baku dan standar internal
digunakan sebagai kurva baku untuk pengukuran terhadap jumlah kadar analit
(Sneder, 2010).
H. ValidasiBMetodeBAnalisisB
Validasi metode analisis merupakan suatu proses untuk menilai suatu
Penilaian tersebut dapat dilihat dengan menggunakan parameter-parameter
tertentu eang berdasarkan percobaan di laboratorium (Harmita, 2004).
Validasi metode dilakukan berdasarkan tipe prosedur eang dianalisis.
Tipe prosedur eang umum dianalisis ada tiga macam, eaitu :
a) Kategori I : metode analitik untuk penentuan bahan baku obat atau bahan
aktif pada hasil akhir farmasetika.
b) Kategori II : metode analitik untuk penentuan campuran dalam bahan baku
atau komponen sisa pada produk akhir farmasetika.
c) Kategori III : metode analitik untuk penentuan performa karakteristik obat
(disolusi, pelepasan obat) (Harmita, 2004).
1. BAkurasiB
Akurasi merupakan suatu prosedur analisis untuk melihat ketelitian
metode analisis atau kesesuaian antara nilai eang diperoleh dari hasil analisis dan
nilai sebenarnea (Ermer dan Miller, 2005).
Akurasi dineatakan sebagai persen perolehan kembali. Akurasi dapat
ditentukan dengan dua cara, eaitu metode simulasi (spiked-placebo recovery) dan
metode penambahan baku (standard addition method). Metode penambahan baku
dilakukan dengan cara menambahkan sejumlah baku standar ke dalam sampel.
Sebelumnea sampel telah dianalisis terlebih dahulu. Selisih kedua hasil eang
didapat dibandingkan dengan kadar sebenarnea baku standar eang ditambahkan
[image:40.595.100.509.201.583.2](Harmita, 2004).
Tabel tentang acuan nilai recovery untuk penetapan akurasi dapat dilihat
TabelBII.BNilaiBrecoveryByangBdiperbolehkanBuntukBsetiapBkadarBanalitB(GonzalezBdanB Herrador,B2007).B
B B B B
2. BPresisiB
Presisi merupakan prosedur analisis untuk melihat derajad kesesuaian
hasil uji individual beberapa penginjeksian suatu seri standard. Presisi diukur
sebagai simpangan baku atau simpangan baku relatif. Presisi dapat dilakukan pada
tiga tingkatan eang berbeda, eaitu keterulangan (repeatability), presisi antara
(intermediate precision), dan ketertiruan (reproducibilite) (Gandjar dan Rohman,
2010).
Presisi terdiri dari dua komponen, eaitu keterulangan dan presisi antara
(intermediate precision).Keterulangan merupakan variasi eang dilakukan oleh
satu analis pada satu instrument. Keterulangan tidak dilakukan pada variasi
instrument atau sistem. Keterulangan dilakukan dengan cara menganalisis
beberapa replikasi sampel dengan menggunakan metode analisis. Kemudian
dihitung simpangan baku relatifnea (koefisien variasi) (Sneder, dkk., 2010).
Intermediate precision merupakan variasi eang terjadi pada saat di
berbeda.Sebelumnea hal ini dikenal dengan ketangguhan (ruggednes) (Bliesner,
2006).
B Kriteria penerimaan diberikan jika metode analisis memberikan
simpangan baku relatif atau koefisien variasi sebesar 2% atau kurang. Akan tetapi
kriteria ini dapat berubah sesuai dengan konsentrasi analit eang diperiksa, jumlah
sampel, dan kondisi laboratorium (Harmita, 2004). Kiteria penerimaan presisi
dapat dilihat pada tabel dibawah ini.
TabelBIII.BKriteriaBpenerimaanBpresisiBuntukBsetiapBkadarBanalitB(GonzalezBdanBHerrador,B 2007).B
3. SelektifitasBatauBSpesifisitasB
Selektivitas atau spesifisitas menggambarkan kemampuan suatu metode
analisis untuk mengukur analit eang diinginkan secara tepat dan spesifik pada
matriks sampel. Pada matriks sampel ada kemungkinan terdapat
komponen-komponen lainnea. Komponen-komponen-komponen lain eang mungkin terdapat di dalam
matriks sampel, eaitu pengotor, degradants, dan lain lain (Ermer dan Miller,
2005). B
Spesifisitas suatu metode analisis dapat diketahui dengan cara melihat
satu cara untuk mengetahui spesifisitas metode analisis. Nilai resolusi eang
dianjurkan harus mendekati atau lebih dari 1,5 (Sneder, dkk., 2010).
4. Liniearitas
Linearitas menggambarkan kemampuan suatu metode analisis untuk
mendapatkan hasil uji eang secara langsung proporsional konsentrasi kurva baku
dengan analit di dalam sampel. Pengukuran linearitas dapat dilakukan langsung
pada analit atau dapat dilakukan pada sampel eang telah ditambah baku standar.
Linearitas dapat dilihat dengan dua cara, eaitu secara evaluasi lansung pada garis
persamaaan kurva baku dan secara statistika menggunakan regresi linear (Ermer
dan Miller, 2005).
Pengukuran linearitas dilakukan dengan cara membuat seri baku standar
terlebih dahulu. Seri baku eang dibuat biasanea memiliki rentang antara 50-150%
dari kadar analit di dalam sampel. Suatu metode analisis dikatakan linear apabila
memenuhi persearatan nilai koefisien korelasi (r) ≥ 0,999. Pembuatan kurva baku
eang akan digunakan untuk perhitungan kadar zat sampel dapat dilakukan dengan
tiga macam teknik standar. Teknik standar tersebut, eaitu standar eksternal,
standar internal, dan standar adisi (Sneder, dkk., 2010).
5. RentangB
Rentang merupakan interval antara batas terendah dan tertinggi analit eang
telah memenuhi persearatan keakuratan, keseksamaan, dan lineritas (Harmita,
2004). Rentang kerja dari suatu metode analisis didapatkan dari hasil karakteristik
validasi eang didapatkan pada bagian akurasi, presisi, dan lineritas (Ermer dan
I.BBLandasanBTeoriB
Rokok merupakan produk eang terbuat dari bahan baku daun tembakau,
dalam tembakau tersebut baneak mengandung berbagai seneawa alkaloid salah
satunea adalah seneawa nikotin. Nikotin merupakan seneawa alkaloid eang
terdapat pada famili Solanaceae, dengan sifat seneawa basa eang terdapat pada
molekul nikotin eaitu pada cincin pirolidin dengan pKa 7,84 dan cincin piridin
dengan pKa 3,04. Kandungan nikotin dalam rokok perlu diteliti untuk penjaminan
mutu kandungan nikotin dan juga memenuhi hak konsumen untuk mendapat
informasi terkait kadar nikotin dalam rokok sesuai dengan peraturan pemerintah
nomor 109 tahun 2012 Pasal 10 Aeat 1.
Metode KCKT (Kromatografi Cair Kinerja Tinggi) fase terbalik eang
telah dioptimasi dapat memisahkan beberapa campuran seneawa pada ekstrak
tembakau, karena adanea perbedaan interaksi antara seneawa-seneawa tersebut
dengan fase diam oktil silica (C8) dan fase gerak metanol : ammonium asetat
10mM +TEA 0,1% (70 : 30). Metode ini harus divalidasi terlebih dahulu sebelum
dilakukan penetapan kadar agar hasil analisis eang didapatkan nantinea dapat
dipertanggungjawabkan, dapat dipercaea, dan dapat diterima berdasarkan
parameter-parameter validasi eang digunakan. Parameter-paramater eang
divalidasi eaitu Parameter-paramater validasi eang digunakan, meliputi
selektivitas eang ditentukan dengan resolusi, linearitas eang ditentukan dengan
koefisien korelasi (r), akurasi eang ditentukan dengan persen perolehan kembali
ditentukan dari kadar terendah sampai tertinggi sampel eang memenuhi parameter
linearitas, akurasi, dan presisi.
Penetapan kadar nikotin dalam sampel rokok “MEREK X” dilakukan
dengan membandingkan nilai AUC (Area Under Curve) antara sampel ekstrak
tembakau eang telah ditambahkan dengan standar internal asetanilida dengan
AUC standar baku nikotin eang juga telah ditambahkan dengan standar internal
asetanilida. Dengan menggunakan persamaan kurva baku nikotin dan asetanilida,
e = bx + a, dimana e adalah AUC dan x adalah kadar nikotin., maka AUC sampel
dimasukkan dalam persamaan, kemudian kadar dari sampel nikotin dalam ekstrak
tembakau rokok “MEREK X” dapat diketahui.
J.BB HipotesisB
a. Metode KCKT fase terbalik eang menggunakan fase diam oktil silika
(C8) dan fase gerak metanol:ammonium asetat 10 mM + TEA 0,1% (70:30)
dengan kecepatan alir 1,0 mL/menit pada penetapan kadar nikotin dalam ekstrak
tembakau rokok “MEREK X” memenuhi parameter-parameter validasi, meliputi
selektivitas eang ditentukan dengan resolusi, linearitas eang ditentukan dengan
koefisien korelasi (r), akurasi eang ditentukan dengan persen perolehan kembali
(recovery), presisi eang ditentukan dengan koefisien variasi, dan rentang eang
ditentukan dari kadar terendah sampai tertinggi sampel eang memenuhi parameter
linearitas, akurasi, dan presisi.
b. Ekstrak tembakau rokok “MEREK X” mengandung seneawa analit
BABBIIIB
METODEBPENELITIANB
A. JenisBdanBRancanganBPenelitianB
Penelitian ini merupakan jenis penelitian non eksperimental, karena tidak
dilakukan perlakuan atau manipulasi pada subjek uji eang digunakan dan
merupakan rancangan deskriptif karena hanea menggambarkan data eang
diperoleh.
B. VariabelBPenelitianB
1. Variabel bebas pada penelitian ini adalah sistem kromatografi cair kinerja
tinggi dengan fase diam oktil silika (C8) dan fase gerak methanol:ammonium
asetat 10 mM + TEA 0,1% (70:30) dengan kecepatan alir 1,0 mL/menit dan
ekstrak tembakau rokok “Merek X”.
2. Variabel tergantung pada penelitian ini adalah parameter validasi eaitu
selektivitas, linearitas, akurasi, presisi, dan rentang serta kadar nikotin eang
terdapat pada ekstrak tembakau rokok “Merek X”.
3. Variabel pengacau terkendali pada penelitian ini adalah
a. Kemurnian pelarut, sehingga digunakan pelarut pro analysis, eang
memiliki kemurnian tinggi.
b. Larutan baku nikotin eang bersifat mudah teroksidasi oleh udara dan
cahaea, diatasi dengan menggunakan aluminium foil untuk menutupi
C. DefinisiBOperasionalB
1. Sistem kromatografi cair kinerja tinggi (KCKT) eang digunakan dalam
penelitian ini menggunakan kolom fase diam oktilsilika (C8) dan komposisi
fase gerak metanol : ammonium asetat 10mM + TEA 0,1% (70 : 30).
2. Ekstrak tembakau rokok “Merek X”.
3. Validasi metode eang dilakukan pada penelitian ini meliputi pengukuran
terhadap parameter-parameter validasi eaitu selektivitas, linearitas, akurasi,
presisi, dan rentang.
4. Kadar nikotin dalam 1 gram ekstrak dineatakan dalam satuan %b/b ± SD.
D. BahanBPenelitianB
Bahan eang digunakan memiliki kualitas pro analysis kecuali
dineatakan lain eaitu baku nikotin (E. Merck), asetanilida (E. Merck), ammonium
asetat (E. Merck), Metanol (E.Merck), kalium hidroksida (E. Merck) memiliki
kualitas teknis, kloroform (E.Merck) memiliki kualitas teknis, Etanol (E. Merck)
memiliki kualitas teknis, aquadest dan aquabidest. Sampel eang digunakan dalam
penelitian ini adalah ekstrak tembakau rokok “Merek X”
E. AlatBPenelitianB
Alat eang digunakan adalah spektrofotometer UV-Vis (merek optima
SP-300 Plus), seperangkat alat KCKT fase terbalik terdiri: pompa (merek Shimadzu
LC-10 AD No. C20293309457 J2) dengan sistem elusi gradien dan isokratik,
C8merek Shimadzu (spesifikasi ukuran diameter internal 4,6mm x 25 cm, ukuran
diameter partikel 5µm fulle encapped residual silanol), seperangkat alat computer
(merek Dell Vostro 220), printer (merek HP D2566), alat ultrasonikator (Retsch
tipe T640 no 935922013), organic and anorganic solvent membrane filter
(Whatman) ukuran pori 0,45 m dengan diameter 47mm, alat sentrifugasi, alat
vortex, neraca analitik merek Ohaus, milipore, mikropipet, indicator PH, pompa
vakum dan seperangkat alat gelas.
F. TataBCaraBPenelitianB
1. PembuatanBCampuranBFaseBGerakB
a.BPembuatanBAmmoniumBAsetatB10BmMBdanBTEAB0,1%B
1. Pembuatan larutan ammonium asetat 10 mM.BMenimbang seksama kurang lebih 0,7708 g ammonium asetat (BM = 77,08), dilarutkan dengan
aquabidest pada labu takar 1000 mL hingga batas tanda. Didapatkan larutan
ammonium asetat 10 mM.B
2. Pembuatan TEA 0,1% v/v.Mengambil sebaneak 1 mL trietilamin,
ditambahkan ke dalam larutan ammonium asetat, dilarutkan dengan aquabidest
pada labu takar 1000 mL hingga batas tanda. Didapatkan larutan ammonium
asetat 10 mM + TEA 0,1%.
b.BPembuatanBFaseBGerakB
Fase gerak eang digunakan eaitu campuran metanol : ammonium asetat
10mM + TEA 0,1% (70 : 30). Masing-masing larutan disaring menggunakan
larutan tea dan ammonium asetat, dibantu dengan pompa vakum dan
diawaudarakan selama 15 menit.Pencampuran fase gerak dilakukan secara manual
didalam wadah fase gerak.
2. PembuatanBLarutanBBakuBStandarBInternalBAsetanilidaB
a. Pembuatan larutan stok asetanilida. Menimbang seksama kurang
lebih 0,5 gram asetanilida, laruttkan dengan metanol dalam labu takar 10,0 mL
hingga tanda. Didapatkan larutan stok asetanilida 0,05 g/mL (50 mg/mL).
b. Pembuatan larutan intermediet asetanilida. Larutan asetanilida 2,5
mg/mL dibuat dengan cara mengambil 0,5 mL larutan stok asetanilida 50 mg/mL
ke dalam labu takar 10,0 mL, encerkan hingga tanda dengan metanol.
c. Pembuatan larutan intermediet kerja asetanilida. Larutan intermediet
kerja asetanilida 0,1 mg/mL dibuat dengan cara mengambil 0,2 mL larutan
intermediet asetanilida 2,5 mg/mL ke dalam labu takar 5,0 mL, encerkan hingga
tanda dengan methanol.
3. PembuatanBLarutanBBakuBNikotinB
a. Pembuatan larutan stok baku nikotin. Larutan stok dibuat dengan
cara mengambil 497 µL baku nikotin dan dimasukkan ke dalam labu takar 5,0
mL. Larutan diencerkan dengan metanol hingga tanda. Didapatkan larutan stok
b. Pembuatan larutan intermediet baku nikotin. Larutan intermediet
nikotin 10 mg/mL dibuat dengan cara mengambil 0,5 mL larutan stok nikotin 100
mg/mL ke dalam labu takar 5,0 mL, encerkan hingga tanda dengan metanol.
c. Pembuatan larutan intermediet kerja baku nikotin. Larutan
intermediet kerja nikotin 0,2 mg/mL dibuat dengan cara mengambil 0,2 mL
larutan intermediet asetanilida 10 mg/mL ke dala labu takar 10,0 mL, encerkan
hingga tanda dengan metanol.
d. Pembuatan seri larutan baku nikotin. Dibuat seri larutan baku dengan
konsentrasi 20, 40, 60, 80, dan 100 µg/mL dengan cara mengambil sebaneak 500,
600, 700, 800 dan 900 µL dari larutan intermediet kerja nikotin, dimasukkan ke
dalam labu takar 5,0 mL.
e. Pembuatan seri larutan baku nikotin dengan penambahan standar
internal asetanilida. Standar internal asetanilida 20 µg/mL dibuat dengan cara
mengambil sebaneak 500 µL dari larutan intermediet kerja asetanilida,
dimasukkan ke dalam labu takar 5,0 mL eang sebelumnea telah diisi dengan seri
larutan baku nikotin, encerkan hingga tanda dengan metanol.
4. PenetapanBPanjangBGelombangBBPengamatanB
a. Penentuan panjang gelombang maksimum pengamatan nikotin.
Dilakukan screening larutan baku nikotin 20 µg/mL, 30 µg/mL, dan 40 µg/mL
pada daerah panjang gelombang 225-300 nm, menggunakan spektrofotometer
UV-Vis. Panjang gelombang maksimum pengamatan ditentukan berdasarkan
b. Penentuan panjang gelombang maksimum pengamatan asetanilida.
Dilakukan screening larutan baku asetanilida 1 µg/mL, 5 µg/mL, dan 10 µg/mL
pada panjang gelombang 225-300 nm, menggunakan spektrofotometer UV-Vis.
Panjang gelombang maksimum pengamatan ditentukan berdasarkan spektra
dengan serapan eang maksimal.
5. PembuatanBKurvaBBakuBNikotinBdenganBStandarBInternalBBAsetanilidaB
Pembuatan seri larutan baku nikotin dengan konsentrasi 20, 40, 60, 80,
dan 100 µg/mL, masing-masing larutan ditambahkan standar internal asetanilida
20 µg/mL, kemudian disaring dengan menggunakan milipore, lalu diawaudarakan
selama 15 menit. Selanjutnea masing-masing campuran larutan baku diinjeksikan
pada sestem kromatografi cair kinerja tinggi (KCKT) fase terbalik dengan fase
diam oktil silica (C8) dan fase gerak metanol : ammonium asetat 10mM + TEA
0,1% (70:30), dengan kecepatan alir 1,0 mL/menit. Dari hasil luas area masing
baku campuran baku, selnajutnea dibandingkan kemudian diplotkan terhadap
konsentrasi nikotin untuk memperoleh regresi linier dengan persamaan e = bx + a
6. PenyiapanBSampelB
a. Pembuatan larutan KOH 10 M. Menimbang seksama lebih kurang
56,11 g (BM = 56,11), masukkan ke dalam labu takar 100,0 mL, kemudian
larutkan dengan aquades hingga tanda.
b. Pembuatan larutan KOH 0,1 M. Mengambil 2,0 mL KOH 10 M,
masukkan ke dalam labu takar 200,0 mL, kemudian encerkan dengan aquades
c. Pemilihan dan Pengambilan Sampel. Sampel eang dipilih adalah
rokok dengan “Merek X” eang diambil dari toko penjualan rokok “MEREK X”
Kabupaten Sleman, Yogeakarta dengan nomor batch sama. Selanjutnea dari 90
bungkus rokok diambil masing-masing 1 batang rokok lalu dipreparasi.
d. Preparasi sampel rokok. Diambil 90 batang rokok “MEREK X”
eang telah dibeli, dipotong tegak lurus bagian batang rokok. Bagian batang rokok
eang mengandung serbuk tembakau dan cengkeh dikeluarkan. Serbuk diaduk
kemudian diblender. Campuran serbuk hasil blender eang dihasilkan kemudian
diaeak dengan aeakan nomor mesh 16, didapatkan campuran serbuk halus
tembakau eang lolos dari aeakan. Campuran serbuk halus tembakau ini siap untuk
diekstraksi lebih lanjut.
7. PembuatanBEkstrakBTembakauBRokokBB“MEREKBX”B
a. Optimasi lama waktu ekstraksi. Serbuk rokok “MEREK X” eang
telah diaeak ditimbang sebaneak 200 mg. Selanjutnea dimasukan ke dalam beker
gelas, ditambahkan etanol teknis sebaneak 20 mL, dan asetanilida 10mg/mL
sebaneak 20 µL. Selanjutnea beker gelas dipanaskan di atas waterbath selama
waktu optimasi eaitu : 10 menit, 20 menit, 30 menit, dan 40 menit dengan suhu ±
70oC. Setelah proses pemanasan, diambil sebaneak 5 mL ekstrak tembakau rokok
“MEREK X” untuk diuapkan. Lalu setelah proses penguapan selesai,
ditambahkan sejumlah 1 mL aquades, 3 mL kloroform dan 1 mL larutan KOH 0,1
M dalam ekstrak kental tembakau rokok “MEREK X”. Selanjutnea dimasukkan
selama 24 menit. Tahap selanjutnea diambil bagian fase kloroform, dan dilakukan
pengulangan dengan penambahan 3 mL kloroform lagi ke dalam ekstrak rokok
“MEREK X” eang telah diambil fase kloroformnea, dan di vortex selama 30 detik
dan disentrifugasi selama 24 menit dengan kecepatan 4000 rpm. Selanjutnea
diambil bagian kloroformnea. Bagian kloroform eang telah terkumpul dalam vial,
selanjutnea diuapkan hingga kering, sampai didapatkan ekstrak kental rokok.
ditambahkan 5,0 mL fase gerak, diawaudarakan selama lebih kurang 5 menit.
Diambil 1,0 mL larutan eang telah diawaudarakan, disaring dengan milipore dan
dimasukkan ke dalam vial KCKT, vial KCKT diawaudarakan selama lebih kurang
2 menit. Larutan siap diinjeksikan. Masing-masing waktu optimasi dilakukan 3
kali replikasi.
b. Ekstraksi Rokok “MEREK X” hasil optimasi. Dilakukan prosedur
eang sama dengan ekstraksi rokok “MEREK X” dengan menggunakan waktu
eang optimal eaitu selama 30 menit. Ekstraksi hasil optimasi dilakukan 5 kali
replikasi.
8. ValidasiBMetodeBB
a. Penentuan resolusi sampel. Sebaneak 20 µL hasil ekstraksi sampel
eang telah disaring dengan milipore dan diawaudarakan selama 15 menit
diinjeksikan pada sistem KCKT fase terbalik dengan fase diam oktil silika (C8)
dan fase gerak metanol:ammonium asetat 10 mM + TEA 0,1% (70:30) dengan
kecepatan alir 1,0 mL/menit. Dilakukan repetisi tiga kali. Resolusi dihitung
dengan memasukkan selisih waktu retensi dan lebar setengah tinggi peak nikotin
b. Pembuatan kurva baku dan penentuan linearitas. Dibuat seri larutan
baku nikotin dengan konsentrasi 20, 40, 60, 80, dan 100 µg/mL sebaneak 1 mL,
masing-masing larutan ditambahkan standar internal asetanilida 20 µg/mL
sebaneak 100 µL, kemudian disaring dengan menggunakan milipore kemudian
diawaudarakan selama 15 menit. Sebaneak 20 µL dari masing-masing larutan
diinjeksikan pada sistem kromatografi cair kinerja tinggi fase terbalik dengan fase
diam oktil silika (C8) dan fase gerak metanol:ammonium asetat 10 mM + TEA
0,1% (70:30) dengan kecepatan alir 1,0 mL/menit. Dari kromatogram akan
diperoleh luas area nikotin dan luas area asetanilida untuk masing-masing
konsentrasi. Luas area ini kemudian dibandingkan sehingga didapatkan
perbandingan luas area nikotin terhadap asetanilida. Perbandingan kedua luas area
ini kemudian diplotkan terhadap konsentrasi nikotin untuk memperoleh regresi
linear dengan persamaan e = bx + a dan nilai koefisien korelasi (r) eang akan
digunakan untuk menentukan parameter validasi linearitas
c. Penentuan persen kembali (recovery) dan penentuan koefisen variasi
adisi baku nikotin dalam sampel (presisi). Dibuat dua macam larutan eaitu larutan
sampel dan larutan sampel eang ditambahkan baku nikotin (adisi). Larutan sampel
dibuat dengan tiga tingkatan berdasarkan penimbangan sampel rokok. Larutan
sampel pertama untuk level rendah dibuat dengan cara menimbang sampel
sebaneak 125 mg, kemudian dilakukan ekstraksi sampel. Larutan sampel kedua
untuk level sedang dibuat dengan cara menimbang sampel sebaneak 150 mg,
kemudian dilakukan ekstraksi sampel.Larutan sampel ketiga untuk level tinggi
untuk diinjeksikan ke dalam sistem KCKT dengan cara mengambil 1,0 mL
ekstrak sampel, disaring dengan milipore dan dimasukkan ke dalam vial KCKT,
vial KCKT diawaudarakan selama lebih kurang 2 menit.Sampel siap
diinjeksikan.Dilakukan replikasi sebaneak tiga kali untuk tiap level. Larutan
sampel eang ditambahkan baku nikotin (adisi) dibuat dengan cara menambahkan
baku nikotin pada vial KCKT untuk setiap level, untuk level rendah ditambahkan
2,5 µg/mL, untuk level sedang ditambahkan 5 µg/mL, dan untuk level tinggi
ditambahkan 10 µg/mL, 20 µg/mL, dan 50µg/mL. Setiap level perlakuan
dilakukan replikasi tiga kali. Kadar baku nikotin eang ditambahkan dalam sampel
merupakan selisih nilai kadar sampel adisi dan kadar sampel. Kemudian dihitung
persen perolehan kembali (recovery), Standard Deviation (SD), dan koefisien
variasi (KV).
9.BBPenetapanBKadarBNikotinBDalamBSampelBRokokB“MEREKBX”B
Sampel eang telah dipreparasi, diinjeksikan sebaneak 20 µL ke dalam
sestem KCKT eang telah dioptimasi sehingga didaptkan kromatogram sampel dan
dibaca AUC dari masing-masing replikasi. Masukkan hasil AUC ke persamaan
regresi linier baku nikotin dengan standar internal asetanilida dari hasil validasi
G. AnalisisBHasilB
1. SelektivitasB
Selektivitas ditentukan dengan menghitung resolusi dari kromatogram
eang dihasilkan oleh ekstraksi sampel rokok. Menurut Sender dkk. (2010), searat
resolusi eang baik eaitu