(Scheff.)Boerl.) INTISARI
Didalam buah makuta dewa (Phaleria macrocarpa (Scheff.) Boerl.) terkandung flavonoid yang mempunyai aktivitas anti bakteri, anti fungal, anti inflamasi, anti oksidan, dan lain-lain. Senyawa flavonoid sendiri mempunyai sifat kelarutan dua bentuk yaitu larut dalam pelarut polar dan pelarut non polar. Penelitian ini bertujuan untuk mengetahui lebih lanjut kandungan flavonoid yang terdapat dalam perasan daging buah makuta dewa khususnya dalam fraksi eter.
Perasan daging buah makuta dewa didapat dari buah makuta dewa masak yang masih segar dicuci dengan air sampai bersih, dibuang bijinya, diparut dan diperas dengan kain saring. Setelah itu dilakukan uji pendahuluan dengan reaksi warna dan kromatografi kertas satu arah (KKt 1A), kertas Whatmann no 1 sebagai fase diam dan t-butanol asam asetat : air (3:1:1) sebagai fase gerak. Adanya bercak yang muncul setelah pengembangan diamati dibawah sinar UV 366 nm sebelum dan sesudah diuapi amonia. Kemudian dikromatografi kertas dua dimensi (KKt 2A) menggunakan fase diam kertas Whatmann no 1 dengan cairan pengembang fase I (t-butanol asam asetat : air (3:1:1)) dan fase II (asam asetat 15%) dan diperiksa dibawah lampu UV 366 nm. Diperoleh bercak sebagai isolat dari fraksi eter kemudian diidentifikasi struktur flavanoidnya berdasarkan data-data spektrum spektrofotometri UV (panjang gelombang 200-500 nm). Data yang diperoleh dianalisis dengan metode deskriptif komparatif berdasarkan acuan pustaka.
Dari hasil analisis reaksi warna, identifikasi kromatografi kertas, identifikasi warna bercak sebelum dan sesudah diuapi amonia dan data spektrum berdasarkan panjang gelombang puncak serta pergeseran puncak dapat diperkirakan jenis kandungan flavonoid dalam fraksi eter perasan daging buah makuta dewa termasuk Isoflavon yang mempunyai gugus orto dihidroksi pada cincin A (6,7 atau 7,8) tanpa gugus hidroksi pada C-3 dan C-5.
ABSTRACT
In fruit of makuta dewa ( Phaleria macrocarpa ( Scheff.) Boerl.) Contents of flavonoid that have antibacterial activity, anti fungal, anti inflammation, anti oxidant, and others. Flavonoid compounds it self have dissolve character in two form that is dissolve in polar solvent and non polar solvent. This research aim to know furthermore contents of flavonoid which there are in squizzed juice of fruits flesh makuta dewa especially in ether fraction.
Squizzed juice of fruits flesh makuta dewa got from fruit of makuta dewa still ripe be fresh washed until cleanness, thrown the seed, grated and extorted with cloth filter. Then done by antecedent test with reaction of one way paper chromatography and colors ( KKt 1A), paper Whatmann no.1 as stationary phase and t-butanol acetic acid : water ( 3:1:1) as mobile phase. Existence mark that appears after development is observed under UV of 366 nm before and after steamed with ammonia. Then paper chromatography of two dimension ( KKt 2A) apply paper stationary phase Whatmann no.1 with dilution of developer of phase I ( t-butanol acetic acid : water ( 3:1:1)) and phase II ( acetic acid of 15%) and checked under UV lamp of 366 nm. Obtained by mark as isolate from ether fraction then identification by the flavanoid structure based on UV spectroscopy spectrums data (wavelength of 200-500 nm). Data which analyzed obtained with descriptive method of comparability based on book reference.
From analysis result reaction of colour, identify paper chromatography, identify mark colour before and after steamed with ammonia and spectrum data based on top wavelength and also friction of top can estimate type of contents of flavonoid in ether fraction of squizzed juice of fruits flesh makuta dewa cum Isoflavon having bunch orto hydroxy at ring A (6,7 or 7,8) without hydroxy bunch at C-3 and C-5.
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Diajukan Oleh:
ATOK WIDIYANTO
NIM : 998114206 NIRM : 990051122004120178
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
TIDAK ADA APA PUN YANG INDAH YANG
PERNAH DICAPAI OLEH MEREKA YANG
BERANI MEMPERCAYAI BAHWA SESUATU
DI DALAM DIRI MEREKA LEBIH UNGGUL
DARIPADA KEADAAN
(BRUCE BARTON)
K
KAARRYYAAIINNIIKKUUPPEERRSSEEMMBBAAHHKKAANNUUNNTTUUKK::
B
BAAPPAAKK--IIBBUUKKUUTTEERRCCIINNTTAA,,
S
SEEBBAAGGAAIIUUNNGGKKAAPPAANNRRAASSAAHHOORRMMAATTDDAANNBBAAKKTTIIKKUU,,
S
SAAUUDDAARRAA--SSAAUUDDAARRAAKKUU,,
K
KAAKKAAKKKKUU((AALLMM))WWIIWWIIDD,,WWIIBBII,,DDAANNAADDIIKKKKUUFFIIFFIINN,,
I
ISSTTRRIIKKUUYYAANNGGTTEERRCCIINNTTAA““YYAANNII””
T
TEEMMAANN--TTEEMMAANNDDAANNSSAAHHAABBAATT,,BBUUAATTDDOOAA,,SSEEMMAANNGGAATTDDAANNBBAANNTTUUAANNKKAALLIIAANN
A
(Scheff.)Boerl.) INTISARI
Didalam buah makuta dewa (Phaleria macrocarpa (Scheff.) Boerl.) terkandung flavonoid yang mempunyai aktivitas anti bakteri, anti fungal, anti inflamasi, anti oksidan, dan lain-lain. Senyawa flavonoid sendiri mempunyai sifat kelarutan dua bentuk yaitu larut dalam pelarut polar dan pelarut non polar. Penelitian ini bertujuan untuk mengetahui lebih lanjut kandungan flavonoid yang terdapat dalam perasan daging buah makuta dewa khususnya dalam fraksi eter.
Perasan daging buah makuta dewa didapat dari buah makuta dewa masak yang masih segar dicuci dengan air sampai bersih, dibuang bijinya, diparut dan diperas dengan kain saring. Setelah itu dilakukan uji pendahuluan dengan reaksi warna dan kromatografi kertas satu arah (KKt 1A), kertas Whatmann no 1 sebagai fase diam dan t-butanol asam asetat : air (3:1:1) sebagai fase gerak. Adanya bercak yang muncul setelah pengembangan diamati dibawah sinar UV 366 nm sebelum dan sesudah diuapi amonia. Kemudian dikromatografi kertas dua dimensi (KKt 2A) menggunakan fase diam kertas Whatmann no 1 dengan cairan pengembang fase I (t-butanol asam asetat : air (3:1:1)) dan fase II (asam asetat 15%) dan diperiksa dibawah lampu UV 366 nm. Diperoleh bercak sebagai isolat dari fraksi eter kemudian diidentifikasi struktur flavanoidnya berdasarkan data-data spektrum spektrofotometri UV (panjang gelombang 200-500 nm). Data yang diperoleh dianalisis dengan metode deskriptif komparatif berdasarkan acuan pustaka.
Dari hasil analisis reaksi warna, identifikasi kromatografi kertas, identifikasi warna bercak sebelum dan sesudah diuapi amonia dan data spektrum berdasarkan panjang gelombang puncak serta pergeseran puncak dapat diperkirakan jenis kandungan flavonoid dalam fraksi eter perasan daging buah makuta dewa termasuk Isoflavon yang mempunyai gugus orto dihidroksi pada cincin A (6,7 atau 7,8) tanpa gugus hidroksi pada C-3 dan C-5.
ABSTRACT
In fruit of makuta dewa ( Phaleria macrocarpa ( Scheff.) Boerl.) Contents of flavonoid that have antibacterial activity, anti fungal, anti inflammation, anti oxidant, and others. Flavonoid compounds it self have dissolve character in two form that is dissolve in polar solvent and non polar solvent. This research aim to know furthermore contents of flavonoid which there are in squizzed juice of fruits flesh makuta dewa especially in ether fraction.
Squizzed juice of fruits flesh makuta dewa got from fruit of makuta dewa still ripe be fresh washed until cleanness, thrown the seed, grated and extorted with cloth filter. Then done by antecedent test with reaction of one way paper chromatography and colors ( KKt 1A), paper Whatmann no.1 as stationary phase and t-butanol acetic acid : water ( 3:1:1) as mobile phase. Existence mark that appears after development is observed under UV of 366 nm before and after steamed with ammonia. Then paper chromatography of two dimension ( KKt 2A) apply paper stationary phase Whatmann no.1 with dilution of developer of phase I ( t-butanol acetic acid : water ( 3:1:1)) and phase II ( acetic acid of 15%) and checked under UV lamp of 366 nm. Obtained by mark as isolate from ether fraction then identification by the flavanoid structure based on UV spectroscopy spectrums data (wavelength of 200-500 nm). Data which analyzed obtained with descriptive method of comparability based on book reference.
From analysis result reaction of colour, identify paper chromatography, identify mark colour before and after steamed with ammonia and spectrum data based on top wavelength and also friction of top can estimate type of contents of flavonoid in ether fraction of squizzed juice of fruits flesh makuta dewa cum Isoflavon having bunch orto hydroxy at ring A (6,7 or 7,8) without hydroxy bunch at C-3 and C-5.
Penulis memanjatkan puji syukur ke hadirat Tuhan Yang Maha Esa atas berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan dengan baik dan lancar skripsi yang berjudul ISOLASI DAN IDENTIFIKASI FLAVONOID DARI FRAKSI ETER PERASAN DAGING BUAH MAKUTA DEWA (Phaleria macrocarpa (Scheff.) Boerl.). skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Far.) pada program studi Farmasi di Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Penyusunan skripsi ini tidak lepas dari bantuan berbagai pihak, baik berupa materi, moral, maupun spiritual. Penulis menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Ibu Rita Suhadi, S.Si., Apt, selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Ibu Erna Tri Wulandari, M.Si., Apt., selaku dosen pembimbing yang dengan kesabaran dan tanggung jawab telah mengarahkan, membimbing serta memotivasi secara tulus. Terima kasih atas setiap waktu, bantuan, saran, serta dorongan semangat sampai selesainya penyusunan skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen penguji, terima kasih untuk waktu yang diberikan untuk menguji serta memberikan saran-saran membangun, terima kasih untuk perhatiannya.
penyelesaian skripsi ini.
6. Mas Wagiran, mas Sigit, mas Andri, mas Sarwanto selaku laboran Laboratorium Farmakognosi Fitokimia USD, serta Kebun Obat USD. Terima kasih untuk waktu serta keikhlasan dalam membantu pelaksanaan penelitian sampai selesainya penyusunan skripsi ini.
7. Semua pihak yang tidak bisa penulis sebutkan satu-persatu, atas bantuan dan dukungan yang telah diberikan sehingga penulis menyelesaikan skripsi ini dengan baik.
1. Isolasi Flavonoid... 2. Kromatografi Kertas ... 3. Kromatografi Kertas Dua Dimensi (KKt 2A)... C. Spektrofotometri ... D. Identifikasi Flavonoid Secara Spektrofotometri UV ... BAB III. METODOLOGI PENELITIAN... A. Jenis Penelitian... B. Bahan Penelitian ... 1. Bahan Tanaman ... 2. Bahan Kimia ...
3. Bahan Untuk Kromatografi Kertas ... D. Alat... E. Rancangan Penelitian... 1. Determinasi ...
2. Pembuatan Perasan Daging Buah Makuta dewa ... 3. Reaksi Warna Untuk Flavonoid... 4. Identifikasi Pendahuluan dengan Kromatografi Kertas
A. Kesimpulan ...
B. Saran ... 53
53
Tabel I Pengembang yang berguna pada Analisis Flavonoid
dengan Kromatografi Kertas Menurut Markham ... Tabel II Hubungan warna Bercak dengan Struktur Flavonoid
Menurut Mabry et al... Tabel III Rentangan serapan maksimum Spektrofotometri
UV Flavonoid (Markham, 1988). ... Tabel IV Penafsiran spektra UV dengan penambahan
NaOH (Markham, 1988)... Tabel V Penafsiran spektra UV dengan penambahan
NaOAc (Markham, 1988) ... Tabel VI Penafsiran spektra UV dengan penambahan
NaOAc/H3BO3 (Markham,1988)... Tabel VII Penafsiran spektra UV dengan penambahan AlCl3 dan
AlCl3/HCl (Markham, 1988) ... Tabel VIII Reaksi warna flavonoid untuk menentukan interpretasi
golongan flavonoid dibandingkan dengan pustaka
Venkataraman (1962)... Hal Tabel IX Data kromatogram dari bercak KKt 1A masing-masing sampel dengan fase diam kertas Whatmann no 1 dan fase gerak
TBA (3:1:1). Deteksi dengan sinar UV 366 nm sebelum dan sesudah diuapi amonia, serta interpretasi
warna bercak (Markham,1998)... Tabel X Data harga Rf dan deteksi sinar UV 366 nm dari bercak-bercak pada kromatogram KKt 2A fraksi eter ekstrak metanol. ... Tabel XI Interpretasi struktur flavonoid menurut warna bercak KKt 2A
dibawah sinar UV 366 nm sebelum dan sesudah
Gambar 1. Kerangka dasar flavonoid ( Robinson, 1995 ) ... Gambar 2. Kerangka dasar dan penomoran
flavonoid ( Mabry et al., 1970 )... Gambar 3. Kerangka umum dan penomoran
flavonoid (Mabry et al.,1970)... Gambar 4. Pembagian cincin flavonoid (Mabry et al., 1970) ... Gambar 5. Kromatogram dari bercak KKt 1A dari masing-masing sampel.. Gambar 6. Kromatogram KKt 2A fraksi eter air perasan daging
makuta dewa ... Gambar 7. Daerah penyebaran bercak-bercak dari kromatogram hasil
KKt2A dibandingkan dengan peta penyebaran bercak
Hal 8
9
10 22 37
42
56
65
67 69
70 Lampiran 1. Data hasil spektroskopi Ultra Violet fraksi eter perasan
daging buah makuta dewa... Lampiran 2. Foto hasil KK satu-arah fase diam kertas Whatmann no. 1 fase
pengembang (TBA) ... Lampiran 3. Foto hasil KK dua-arah fase diam kertas Whatmann no. 1 fase
pengembang (TBA) dan fase pengembang II (asam asetat 15%)... Lampiran 4. Foto hasil reaksi warna... Lampiran 5. Foto tanaman makuta dewa, buah makuta dewa dan perasan
BAB I PENGANTAR
A. LATAR BELAKANG
Makuta dewa (Phaleria macrocarpa (Scheff.) Boerl.) merupakan salah satu tanaman obat yang banyak digunakan oleh masyarakat sebagai obat tradisional. Secara empiris, makuta dewa terbukti mampu menyembuhkan beberapa macam penyakit berat, seperti penyakit lever, kanker, jantung, lemah syahwat, reumatik, diabetes mellitus, asam urat, tekanan darah tinggi, dan ketagihan narkoba, serta penyakit ringan seperti eksim, jerawat, dan luka bekas gigitan serangga (Harmanto, 2003).
Tanaman makuta dewa memiliki beberapa bagian yang mengandung senyawa-senyawa yang agak berbeda satu sama lain. Pada daging buah dan kulit biji mengandung alkaloid, terpenoid, saponin, dan senyawa polifenol (Lisdawati, 2002). Kulit buah makuta dewa mengandung alkaloid dan saponin, sedangkan daunnya mengandung alkaloid, saponin, polifenol (Sumastuti, 2001).
Buah makuta dewa banyak mengandung flavonoid yang merupakan salah satu dari sekian banyak zat aktif yang terkandung dalam tumbuhan dan dapat dimanfaatkan untuk mengobati penyakit (Djumidi dkk, 1999). Flavonoid mempunyai aktivitas anti bakteri, anti fungal, anti inflamasi, anti oksidan, anti hemorhagi, diuretik, aktivitasnya estrogenik dan hipoglikemik (Harborne, 1987).
Penelitian tentang kandungan flavonoid dalam perasan daging buah maakuta dewa telah dilakukan oleh Sisilia (2001), tentang efek hepatoprotektif
perasan daging buah makuta dewa pada mencit jantan terinduksi parasetamol. Perasan daging buah makuta dewa dengan komposisi tiga buah makuta dewa diperas airnya (lebih kurang 79 g menghasilkan 10 ml air perasan) dapat memberikan efek hepatoprotektif. Dari penelitian tersebut dibuktikan adanya efek hepatoprotektif berasal dari kandungan flavonoid yang terdapat dalam perasan daging buah makuta dewa, dikarenakan adanya gugus fenol yang mampu menangkap radikal bebas (zat antara yang toksik) dari parasetamol pada struktur flavonoid (Pudjono, 2001).
Flavonoid adalah polifenol dan karena itu mempunyai sifat kimia senyawa fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Untuk diketahui bahwa sifat kelarutan flavonoid ada dua bentuk, yaitu larut dalam pelarut polar dan pelarut yang non polar. Pelarut polar yang umum digunakan seperti etanol (EtOH), metanol (MeOH), butanol (BuOH), aseton, dimetilsulfoksida (DMSO), dimetil formamida (DMF), air, dan lain-lain. Adanya gula yang terikat pada flavonoid (bentuk yang umum ditemukan) cenderung menyebabkan flavonoid lebih mudah larut dalam air dan dengan demikian campuran pelarut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
makuta dewa khususnya dalam fraksi eter. Bukti ilmiah tentang jenis kandungan flavonoid yang terdapat dalam fraksi eter perasan daging buah makuta dewa belum pernah diteliti.
1. Permasalahan
Berdasarkan latar belakang diatas maka timbul masalah menarik untuk diteliti yaitu : golongan flavonoid apa saja yang terkandung dalam fraksi eter perasan daging buah makuta dewa?
2. Keaslian Penelitian
Sudah banyak dilakukan penelitian tentang flavonoid dalam makuta dewa tentang potensi anti bakteri ekstrak etanol dan ekstrak kloroform daun makuta dewa terhadap Staphylococcus aureus oleh Hosen Jaya Edi (2005), daya sitotoksik infusa kulit batang makuta dewa pada sel hela oleh Esti Pusparanti (2003), isolasi dan identifikasi flavonoid dari fraksi eter ekstrak metanol daging buah makuta dewa oleh Dianisius Iwan Susanto (2003).
Penelitian mengenai isolasi dan identifikasi flavonoid dari fraksi eter perasan daging buah makuta dewa, sampai sejauh ini belum pernah dilakukan..
3. Manfaat Penelitian
Dengan adanya penelitian ini diharapkan akan memberikan suatu terobosan baru bagi dunia kesehatan pada umumnya maupun bagi perkembangan ilmu kefarmasiaan dan kedokteran khususnya berupa sumbangan teoritis dan manfaat praktis.
a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi tentang senyawa flavonoid apa saja yang terdapat dalam fraksi eter perasan daging buah makuta dewa.
b. Manfaat praktis
Penelitian ini juga diharapkan dapat memberi informasi kepada masyarakat bahwa didalam perasan daging buah makuta dewa khususnya dalam fraksi eter terdapat senyawa flavonoid (aglikon) yang mempunyai kegunaan dalam pengobatan penyakit.
B. Tujuan Penelitian
BAB II
PENELAAHAN PUSTAKA
A. Makuta dewa 1. Nama tanaman
Makuta dewa sering disebut dengan nama botani Phaleria
macrocarpa (Scheff.) Boerl. atau dengan sinonim Phaleria papuana Warb.
Var. Wichanii (Val.) Back. Di Jawa Tengah tanaman inin disebut makuto
dewo, makuto rojo atau makuto ratu. Sebutan lain untuk tanaman ini yaitu raja
obat (Banten), disebut demikian karena khasiatnya dalam mengobati aneka
penyakit; pau (etnik Cina), berarti obat pusaka; simalakama (Depok, Jawa
Barat; Melayu); makuto mewo (Java) (Harmanto, 2003; Dalimartha, 2003).
2. Klasifikasi
Klasifikasi tanaman makuta dewa (Phaleria macrocarpa (Scheff.)
Boerl.) termasuk dalam bangsa Thymelales, suku Thymelaleaceae, marga
Phaleria dan spesies Phaleria macrocarpa (Scheff.) Boerl. (Dalimartha,
2003).
Kedudukan tanaman makuta dewa (Phaleria macrocarpa (Scheff.)
Boerl.) dalam sistematika tumbuhan adalah sebagai berikut :
Divisi : Magnoliophyta
Kelas : Magnoliopsida (Anonim, 1997)
Anak kelas : Rosidae
Bangsa : Malvales
Suku : Thymelaeaceae (APG, 1998; Bremer, Bremer dan Thulin,
1999)
Marga : Phaleria Jack
Jenis : Phaleria macrocarpa (Scheff.) Boerl. (Backer dan
Bakhuizen van den Brink, 1963)
3. Morfologi tanaman
Tanaman makuta dewa berupa herba, tajuk pohonnya
bercabang-cabang (Harmanto, 2003). Tanaman ini tumbuh tegak dengan ketinggian 1-2,5
m, tumbuh ditanah yang gembur dan subur pada ketinggian 10-1.200 m dpl
(Dalimartha, 2003). Namun, jika dibiarkan ketinggiannya bisa mencapai 5
meter (Harmanto, 2003).
a. Batang bulat, permukaannya kasar, wamanya cokelat, berkayu, dan
bergetah, percabangan simpodial (Dalimartha, 2003).
b. Daun tunggal, letaknya berhadapan, bertangkai pendek, bentuknya lanset
atau jorong, ujung dan pangkal runcing, tepi rata, pertulangan menyirip,
urat daun agak menonjol tersusun agak rapat melengkung ke atas,
permukaan atas mengkilat dan permukaan bawah suram, warnanya hijau
tua, panjang 7-10 cm, lebar 2-5 cm (Budiana, 2000; Dalimartha, 2003).
c. Bunga merupakan bunga majemuk payung dengan anak bunga berjumlah
2-4 tanpa tangkai; daun tenda bunga berjumlah empat berlekatan
membentuk tabung, tenda bunga berwarna putih pada bagian pangkalnya
berwama hijau, bagian ujung dari tenda bunga berbelah empat, panjang
dua kali jumlah tenda bunga dalam dua lingkaran panjang dan pendek,
tangkai sari yang panjang melekat pada bagian tengah daun tenda bunga
dan yang pendek di antara daun tenda bunga; tangkai putik bulat panjang
berwarna putih, setinggi tenda bunga bakal bulat menumpang (Budiana,
2000).
d. Buah bentuknya bulat, diameter 3-5 cm, permukaan licin beralur, ketika
muda wamanya hijau dan merah setelah masak. Buah batu berdaging,
daging buah berwama putih, berserat dan berair (Budiana, 2000;
Dalimartha, 2003).
4. Khasiat dan kegunaan tanaman
Secara empiris makuta dewa terbukti mampu menyembuhkan
beberapa penyakit berat seperti lever, kanker, jantung, lemah syahwat,
reumatik, diabetes mellitus, asam urat, tekanan darah tinggi, dan ketagihan
narkoba, serta penyakit ringan seperti eksim, jerawat, dan luka bekas gigitan
serangga (Harmanto, 2003).
5. Kandungan kimia tanaman
Tanaman makuta dewa memiliki beberapa bagian yang mengandung
senyawa-senyawa yang agak berbeda satu sama lain.
a. Daging buah dan kulit biji mengandung alkaloid, terpenoid, saponin, dan
senyawa polifenol (Lisdawati, 2002).
b. Kulit buah mengandung alkaloid dan saponin.
6. Penelitian tentang makuta dewa dan hasilnya
Penelitian tentang makuta dewa telah banyak dilakukan oleh
mahasiswa farmasi USD seperti oleh Betasari (2001) yang melakukan penelitian
mengenai efek hipoglikemik perasan daging buah makuta dewa pada tikus
diabetes melitus tidak tergantung insulin, hasilnya disebutkan bahwa perasan
daging buah makuta dewa dapat memberikan efek hipoglikemik pada tikus
diabetes melitus tidak tergantung insulin. Sisilia (2001) melakukan penelitian
mengenai efek hepatoprotektif air perasan daging buah makuta dewa pada mencit
jantan terinduksi parasetamol, hasilnya disebutkan bahwa air perasan daging buah
makuta dewa dapat memberikan efek hepatoprotektif pada mencit terinduksi
parasetamol.
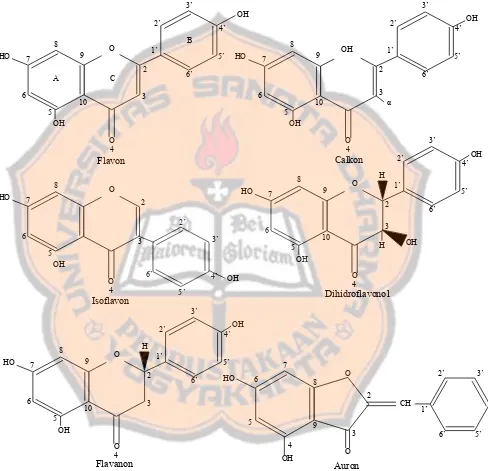
B. Flavonoid
Senyawa Flavonoid adalah golongan senyawa yang mengandung 15
karbon dalam inti dasarnya dan tersusun dalam kerangka dasar C6 – C3 – C6 terdiri
dari dua cincin benzena yang dihubungkan dengan rantai alifatik tiga karbon.
(Markham,1988; Pramono, 1989; Robinson, 1995 ).
C C C
Senyawa flavonoid merupakan salah satu golongan senyawa fenol alam
terbesar dan hampir terdapat pada semua tumbuhan hijau kecuali algae dan bisa
terdapat pada semua bagian tumbuhan yaitu daun, akar, kayu, kulit, tepung sari,
nektar, bunga, buah dan biji (Markham, 1988). Senyawa flavonoid dalam
tumbuhan terbentuk sebagai glikosida atau berupa aglikon (Markham, 1988;
Pramono, 1989).
Flavonoid merupakan senyawa yang relatif stabil terhadap pemanasan,
mudah dideteksi keberadaannya dan memiliki sebaran yang luas pada semua
tumbuhan tingkat tinggi baik pada Angiospermae maupun Gymnospermae
(Harborne et al., 1971).
Secara umum flavonoid mempunyai cincin piran yang menghubungkan
rantai tiga karbon dengan salah satu dari cincin benzena (Robinson,1995). Untuk
pembacaan strukturnya pada kerangka flavonoid cincin aromatiknya diberi tanda
A,B dan C atom karbon dinomori menurut sistem penomoran yang menggunakan
angka biasa untuk cincin A dan C serta. angka beraksen untuk cincin B. Sistem
penomoran tersebut dapat dijelaskan pada gambar 2.
O
Klasifikasi senyawa flavonoid ditentukan oleh pola subtitusi dan
hidroksilasi pada atom C3. Klasifikasi tersebut meliputi flavon, flavanon,
flavonol, isoflavon, auron dan kalkon.
Secara individual kelarutan senyawa flavonoid sangat bermacam-macam,
sesuai dengan golongan dan substitusi yang terjadi. Flavonoid merupakan
senyawa polar, karena mempunyai gugus hidroksi yang tak tersulih atau suatu
gula, maka umumnya flavonoid cukup larut dalam pelarut polar seperti metanol,
air, butanol, etanol, aseton, dimetilsulfoksida, dimetil formida. Adanya gula
terikal yang biasa ditemukan pada flavonoid cenderung flavonoid lebih mudah
larut dalam air dan dengan demikian campuran tersebut diatas dengan air
merupakan pelarut yang lebih baik untuk glikosida flavonoid. Scbaliknya aglikon
yang kurang polar seperti isoflavon, flavanon, flavon serta flavonoid yang
termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter, etil asetat
dan kloroform (Mursyidi, 1990).
Untuk mengekstraksi senyawa flavonoid dari tumbuhan biasanya
digunakan pelarut yang memiliki polaritas yang sesuai dengan flavonoid tersebut
karena kelarutan flavonoid berbeda-beda (Robinson, 1995). Aglikon flavonoid
adalah senyawa polifenol, sehingga mempunyai sifat kimia senyawa fenol yaitu
agak bersifat asam sehingga dapat larut dalam basa. Flavonoid yang mempunyai
gugus hidroksil tak tersubtitusi atau suatu gula merupakan senyawa polar dan
umumnya cukup larut dalam pelarut seperti etanol, metanol, aseton, air dan
lain-lain ( Markham, 1988).
Adanya gula yang terikat pada flavonoid, air merupakan pelarut yang
baik untuk glikosida. Sebaliknya aglikon yang kurang polar cenderung lebih
mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
flavonoid, biasanya digunakan etanol, metanol dan propanol. Bahan-bahan segar
dapat diekstraksi dengan menggunakan pelarut-pelarut alkohol tersebut.
Sedangkan bahan-bahan kering dan berkayu dapat menggunakan pelarut alkohol
berair, hal ini disesuaikan dengan glikosida flavonoidnya. (Harborne et al., 1975}
1. Isolasi Flavonoid
Metode yang paling menguntungkan untuk mengisolasi atau
memisahkan campuran flavonoid adalah dengan kromatografi kertas dan
kromatografi lapis tipis karena hanya membutuhkan sampel yang relatif
sedikit dan waktu yang relatif singkat. Pemilihan fase diam dan fase gerak
dalam kromatografi disesuaikan dengan tipe flavonoid yang akan dipisahkan.
Fase diam yang paling umum adalah poliamid dan selulosa mikrokristal
(Markham, 1988).
Pemilihan pelarut tidak hanya tergantung pada senyawa yang akan
diuji, tetapi juga dipengaruhi oleh faktor-faktor lain seperti pada bagaimana
substituen tersebut diambil. Bila flavonoid terdapat dafam vakuola sel, yang
umumnya bersifat hidrofilik maka penyarian dilakukan dengan menggunakan
air atau pelarut-pelarut alkoholik Bila flavonoidnya terdapat dalam kloroplas
diperlukan pelarut-pelarut lemah sebelum melakukan penyarian dengan
alkohol.
Penyarian flavonoid untuk tujuan analisis, akan lebih ideal bila
digunakan bagian tanaman yang masih segar, walaupun simplisia kering
masih memberikan hasil yang memuaskan Untuk pembuatan simplisia kering
100° C . Selanjutnya simplisia yang sudah kering ini diserbuk, disari dengan
pelarut yang sesuai (Mursyidi, 1990).
2. Kromatografi Kertas
Kromatografi kertas merupakan jenis dari sistem partisi. Fase diam
adalah kertas (selulosa) dan sebagai fase gerak biasanya merupakan campuran
dari satu atau lebih pelarut - pelarut organik dan air. Senyawa-senyawa yang
terpisahkan dapat segera dideteksi pada kertas dan diidentifikasikan. Jika
dikehendaki, komponen-komponen yang terpisahkan dapat diambil dari kertas
dengan jalan memotong kemudian dilarutkan secara terpisah (Hardjono,
1985).
Metode identifikasi dapat dilakukan berdasarkan pada perbandingan
dari kedudukan noda (bercak) pada kromatogram. Cara lain untuk
mengidentifikasi senyawa flavonoid yaitu dengan reaksi-reaksi yang
karakteristik. Cara ini terutama berguna dalam pemisahan senyawa anorganik.
Untuk pengembangan dapat digunakan metode ascending (penaikan),
descending (penurunan) dan horisontal (mendatar).
a. Metode ascending:
Kertas digantung dicelupkan sehingga pelarut bergerak dari bawah ke atas.
b. Metode descending:
Dilakukan dengan mencelup kertas dalam solven, sehingga pelarut
c. Metode horisontal:
Cuplikan di tempatkan pada pusat kertas yang biasanya berbentuk bulat.
Pelarut diteteskan dari pusat kertas. Kertas dalam pemisahan terutama
berpengaruh pada kecepatan aliran pelarut.
Kecepatan aliran akan naik dengan kenaikan suhu. Tetapi aliran
pelarut pada suhu tertentu dipengaruhi oleh kerapatan dan ketebalan kertas.
Penurunan kerapatan atau kenaikan ketebalan kertas memberikan kecepatan
aliran lebih tinggi. Kertas Whatman no.4 mempunyai sifat yang mirip dengan
kertas Whatman no. I namun bahan kertas yang pertama memberikan efek
kira-kira 2 kali lebih cepat. Kertas yang lebih tebal (Whatman no.3 / 3MM )
biasanya digunakan untuk pemisahan dalam jumlah yang lebih besar, karena
dapat menampung lebih banyak cuplikan tanpa menaikkan area dari noda
mula - mula ( Hardjono, 1985 ).
Oleh karena uap-uap, terutama amonia mempunyai afinitas yang
tinggi terhadap selulosa, maka kertas-kertas ini harus disimpan
ditempat-tempat yang jauh dari sumber-sumber uap tersebut. Kebanyakan untuk
pelarut-pelarut kromatografi cepat menguap tanpa meninggalkan residu.
Hanya untuk fenol, penguapan sempurnanya kira-kira membutuhkan waktu 4
jam. Harus diusahakan penghilangan pelarut dengan segera dan sempurna, hal
ini untuk mencegah terjadinya reaksi pada penambahan reagen. Yang lebih
penting lagi terutama dalam kromatografi dua arah dimana jejak pelarut yang
pertama harus dihilangkan sebelum pengembangan pelarut yang kedua. Pada
meninggalkan kertas setelah bergerak. Umumnya fase gerak merupakan
campuran yang terdiri atas komponen-komponen organik, air dan senyawa -
senyawa asam, basa atau pereaksi komplek untuk memperbesar kelarutannya.
Senyawa organik polar akan lebih mudah larut dalam air dari pada digunakan
pelarut non polar (Hardjono, 1985).
3. Kromatografi Kertas Dua Dimensi (KKt 2A)
Kadang-kadang dalam pemisahan bercak yang terdiri atas dua bercak
atau lebih pada kromatografi kertas satu arah (KKt 1A) tidak terpisahkan
dengan baik. Karena alasan tersebut perlu dilakukan pemisahan dengan
kromatografi kertas dua dimensi (KKt 2A). Kertas yang disarankan untuk
tujuan ini ialah kertas Whatman 3MM (46 x 57cm) atau yang setara. Jumlah
ekstrak yang ditotolkan dapat merupakan faktor kritis yang menentukan mutu
flavonoid yang terjadi kemudian. Bila ekstrak yang ditotolkan terlalu sedikit,
bercak flavonoid yang terbentuk mungkin sukar untuk dideteksi, sedangkan
bila lerlalu banyak maka akan terjadi pencorengan dan resolusi menjadi jelek
(Markham, 1988).
Namun bila cara diatas tidak memungkinkan untuk dilakukan
disebabkan ukuran lembaran kertas dan bejana kromatografi yang terlalu
besar, maka pcnyesuaian ukuran dapat dilakukan. Bejana kaca yang lebih
kecil dapat dipakai bila lembar kertas dibagi dua atau empat sebelum ekstrak
ditotolkan, Tetapi bila hal itu dilakukan, ukuran bercak yang ditotolkan dan
Untuk penilaian kandungan flavonoid suatu ekstrak, sudah menjadi
kebiasaan umum untuk menggunakan pengembang beralkohol pada
pengembangan pertamanya. Demikian juga dalam KKt dua dimensi ini. Untuk
pengembangan pertama dapat digunakan pengembang n-butanol:asam
asetat:air (BAA 4:1:5, fase atas) atau t-butanol:asam asetat:air (TBA 3:1:1)
menurut arah tepi kertas yang terpanjang. Garis depan pengembang akan
mencapai ujung lembaran kertas dalam waktu 12-30 jam (kira-kira
membutuhkan 50-60 ml pengembang per kertas). Untuk pengembangan arah
kedua dapat digunakan pengembang berupa larutan dalam air seperti larutan
asam asetat 15%, dengan menggunakan bejana lain. Waktu yang dibutuhkan
dalam pengembangan arah kedua ini 4-6 jam (Markham, 1988).
Cara lain adalah dengan menggunakan pengembang yang berbeda.
Beberapa dari pengembang yang banyak tersedia dicantumkan pada tabel I,
yang disertai dengan ulasan tentang penggunaan yang sebaiknya. Sebagian
pengembang tersebut boleh digunakan setelah penggunaan BAA atau TBA
yang biasanya merupakan pengembang terbaik dari segi kekuatan pelarut dan
pemisahan bercak (Markham, 1988).
Tabel. I. Pengembang pada analisis flavonoid dengan kromatografi kertas (Markham, 1988).
Pengembang Susunan pengembang (jangka
waktu pengembangan)
Penggunaan yang dianjurkan*
BAA n
-BuOH;HOAc;H2O(4:1:5);dicam
pur baik-baik dalam corong pisah, dipakai fase atas (17 jam)
Glikosida, aglikon, dan gula (24-48 jam), glukosa dan galaktosa tak terpisahkan
TBA t-BuOH;HOAc;H2O (3:1:1) (24
jam)
Seperti pada BAA
KAA CHCl3:HOAc:H2O (30:15:2);
campur baik-baik dalam corong pisah, air yang berlebih dibuang (5-7 jam)
Aglikon (terutama yang dimetilasi),
glikosida yang diasilasi, glikosida yang
dimetilasi. Baik untuk memisahkan
isoramnetilkemferol/siringetin/laristrin (pola OH pada cincin B sama)
Forestal HOAc:H2O:HCl (30:10:3) (15
jam)
Flavon, flavonol, dan aglikonantosianidin. Sering tidak dapat memisahkan glikosida dari aglikon
Asam Format HCOOH:H2O:HCl (5:3:2) Antosianidin. Dapat memisahkan glikosida
dari aglikon (Bandingkan dengan forestal) Bu/HCl n-BuOH:HCl 2M (1:1); campur
baik-baik dalam corong pisah dan setimbangkan semalam (24 jam)
Antosianin (sebelum pengembangan kertas harus disetimbangkan dalam uap pengembang)
BEA n-BuOH:EtOH:H2O (4:1:2,2);
jika tidak mencampur pada suhu kamar tambah lagi sedikit EtOH (20-24 jam)
Pengembang berkemampuan rendah, ideal untuk pemurnian ahkir glikosida glikosida
dan gula yang hampir murni
Benzena-asam asetat-air
Bz:HOAc:H2O (125:72:3);
pengembang atsiri, jadi perlu penjenuhan bujana bejana (4 jam)
Aglikon, asam fenolat
EPAA EtOAc:Pir:HOAc:H2O
(36:36:7:21)
Gula, terutama KLT
Fenol Fenol (4g): H2O (1 ml).
Keringkan kromatogram dalam tanur berventilasi (50-60oC) selama 2-3 jam lalu dalam lemari asam 24 jam (untuk menghilangkan fenol) (24 jam)
Glikosida, memisahkan visenin-2 dari skaftosida; glukoronida<glikosida; ramnosida>glukosida. Dapat memisahkan glukosa dari alosa dan galaktosa. Gula (30-48 jam)
H2O (4 jam) Glikosida, biasanya O-Glukoronida >C-Glukosida>O-Glukosida. Ideal untuk membedakan antara O-Glukoronida dan
O-glikosida lain HOAc HOAc 5% (3jam)
HOAc 15% (5 jam)
HOAc 50% (12 jam); terbaik jika “lewat kembang”
Poliglikosida
Glikosida. Baik untuk membedakan antara mono-, di-, triglikosida
Aglikon
HCl 1% (5 jam) Antosianin, asam fenolat BBPA n-BuOH:Bz:Pir:H2O (5:1:3:3)
(20 jam)
Gula. Memisahkan glukosa dari galaktosa, xilosa, dan arabinosa
*Lambang <,> menunjukan kelincahan bercak Untuk lembaran kertas besar
Letak bercak yang menggunakan fase diam selulosa yang dikembangkan
dua arah dengan dua macam fase gerak (TBA/HOAc) juga merupakan informasi
yang berharga karena dapat untuk mengetahui apakah suatu flavonoid merupakan
aglikon/glikosida (Mabry. Et al., 1970).
Cara lain yang paling mudh untuk mendeteksi flavonoid adalah dengan
merupakan golongan senyawa fenol yang bersifat asam, sehingga menimbulkan
perubahan warna yang khas dengan adanya amonia (Markham, 1988). Jika tidak
tercampur dengan pigmen lain, flavonoid dapat dideteksi dengan uap amonia dan
akan menimbulkan warna yang spesifik untuk masing-masing golongan. Flavon
dan flavonol memberikan warna kuning kemerahan. Antosianin berwarna merah
biru, sedangkan flavanon memberikan warna oranye atau coklat. Warna merah
dan lembayung yang mendadak dalam suasana basa disebabkan oleh adanya
khalkon atau auron (Robinson, 1995).
Tabel II. Hubungan warna bercak dengan struktur flavonoid (Mabry et al., 1962)
Warna bercak flavonoid
UV 366 nm NH3/UV 366 nm
Tipe flavonoid
Violet tua Kuning, kuning hijau
atau hijau
Perubahan warna sedikit atau tanpa perubahan warna
Biru muda
merah atau jingga
a. Biasanya 5-OH flavon atau flavonol (tersulih ada 3-O dan mempunyai 4’-OH)
b. Flavanon 5-OH dan 4’-OH
khalkon tanpa OH pada cincin B
a. flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas.
b. 6- atau 8-OH flavon dan flavonol tersulih pada 3-O serta mengandung 5-OH
c. Isoflavon, dihidroflavonol, biflavonil dan flavanon dengan 5-OH
d. Calkon dengan 2’- atau 6’-OH tetapi tidak memiliki 2- atau 4-OH bebas
flavanon dengan 5-OH
calkon dengan gugus hidroksil bebas pada posisi 2- atau posisi 4- Fluoresensi biru muda Fluoresensi
hijau-kuning atau hijau-biru
a. flavon dan flavanon yang tak mengandung OH, misalnya 5-OH-glikosida
Perubahan warna sedikit atau tanpa perubahan warna
Fluoresensi murup biru terang
Isoflavon yang tak mengandung 5-OH bebas
Isoflavon yang tak mengandung 5-OH bebas
Tidak tampak Fluoresensi biru muda Isoflavon yang tak mengandung 5-OH bebas
Kuning redup dan kuning atau fluoresensi jingga
Perubahan warna sedikit atau tanpa perubahan warna
Flavonol dengan 3-OH bebas dan atau tanpa 5-OH bebas
(kadang-kadang berasal dari dihidroflavonol)
Fluoresensi kuning
,
Jingga atau merah Auron yang mengandung 4’-OH bebas dan calkon 2- atau 4-OH
Kuning-hijau atau hijau-biru atau hijau
Perubahan warna sedikit atau tanpa perubahan warna
a. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas
b. Flavanol yang mengandung 3-OH bebas dan dengan atau tanpa 5-OH bebas
Merah jingga redup atau merah senduduk
Biru Antosianidin 3-glikosida
Merah jambu atau fluoresensi kuning
Biru Antosianidin 3,5-diglikosida
Hasil dari KKt 2A ini dapat juga digunakan untuk mengisolasi flavonoid
dengan cara bercak yang sesuai digunting dari kromatogram, lalu bercak yang
sama digabungkan dan setelah digunting menjadi potongan kecil-kecil diekstraksi
dengan pelarut yang sesuai (biasanya digunakan metanol (MeOH)). Bila
diperlukan, hasil pemisahan KKt 1A dapat digabungkan dengan hasil pemisahan
KKt 2A hasil replikasi agar diperoleh flavonoid murni (Markham, 1988).
C. Spektrofotometri
Spektrofotometri merupakan studi mengenai interaksi cahaya dengan
atom-atom atau molekul. Ada dua sifat radiasi elektromagnetik yaitu teori
menerangkan parameter elektromagnetik berupa kecepatan, frekuensi, panjang
gelombang, dan amplitudo.
Untuk menggambarkan interaksi antar radiasi elektromagnetik dengan
benda, maka dianggap berkas sinar sebagai suatu foton (partikel yang bertenaga),
dimana tenaga setiap foton berbanding lurus dengan frekuensi radiasi.
Dinyatakan dengan rumus :
E = h . f
E = h . c/n.λ ket: E = tenaga foton ( erg )
h = tetapan Planck ( 6,624 x 10-34 joule det)
f = frekuensi radiasi magnetik ( Hertz )
Serapan cahaya oleh molekul dalam daerah spektroskopi UV tergantung
pada struktur elektromagnetik dari molekul. Spektra UV dari senyawa organik
berkaitan dengan transisi-transisi diantara tingkatan energi elektronik, transisi
tersebut meliputi orbital ikatan dan orbital anti ikatan. Panjang gelombang serapan
merupakan ukuran dari perbedaan-perbedaan energi transisi dari orbital tersebut.
Pemisahan energi terbesar terjadi bila elektron ikatan tereksitasi yang
akan menimbulkan serapan pada daerah serapan 120-200 nm (daerah UV vakum)
dan relatif tidak memberikan penjelasan. Dan diatas 200 nm eksitasi elektron dari
orbital p dan d dan orbital phi (π) terutama terkonjugasi π dapat diukur spektranya
sehingga memberikan keterangan berguna pada struktur molekulnya. Dalam hal
ini spektroskopi UV terbatas pada sistem-sistem terkonjugasi, akan tetapi
karaktenstik dapat dikenal dalam molekul-molekul yang sangat komplek
Beberapa istilah dalam spektroskopi ultra violet (UV) :
1. Gugus kromofor
Gugus tidak jenuh kovalen yang dapat menyerap sinar tampak dan lembayung
(200-800 nm) yang disebabkan adanya transisi elektron.
2. Gugus auksokrom
Gugus fungsional bcrsifat jenuh yang tidak menyerap sinar diatas 200 nm
akan tetapi jika terikat pada suatu gugus kromofor maka akan menggeser
puncak serapan gugus kromofor tersebut kepanjang gelombang yang lebih
panjang dan mempertinggi intensitasnya.
3. Pergeseran batokromik
Pergeseran puncak serapan ke panjang gelombang yang lebih tinggi.
4. Pergeseran hipsokromik
Pergeseran puncak serapan ke nilai panjang gelombang yang lebih rendah.
5. Efek hiperkromik
Peristiwa bertambah besamya intensitas suatu gugus kromofor.
6. Efek hipokromik
Peristiwa bertambah kecilnya intensitas serapan suatu gugus kromofor.
(Sastrohamidjoyo, 1985)
D. Identifikasi Flavonoid secara Spektrofotometri UV
Penentuan struktur flavonoid akhir-akhir ini banyak dilakukan dengan
cara spektrofotometri. Pada spektrofotometri UV cara ini didasarkan pada
aromatic terkonjugasi, sehingga menghasilkan serapan spektrum pada daerah UV.
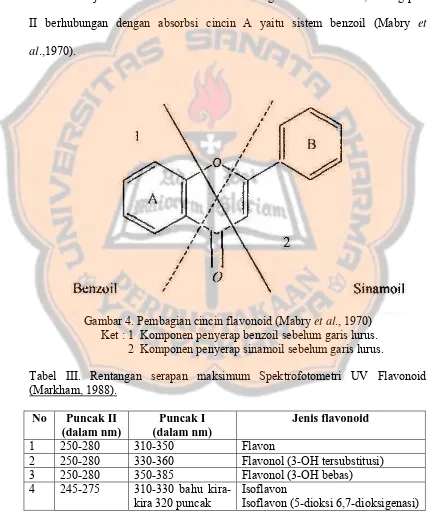
Senyawa flavonoid memberikan 2 puncak serapan utama. Dua puncak utama
tersebut biasanya menunjukkan pita I yang terletak pada panjang gelombang
300-380 nm dan pita II terletak pada daerah dengan panjang gelombang 240-280 nm.
Pita 1 menunjukkan absorbsi unluk cincin B dengan sistem sinamoil, sedang pita
II berhubungan dengan absorbsi cincin A yaitu sistem benzoil (Mabry et
al.,1970).
Gambar 4. Pembagian cincin flavonoid (Mabry et al., 1970) Ket : 1 Komponen penyerap benzoil sebelum garis lurus.
2 Komponen penyerap sinamoil sebelum garis lurus.
Tabel III. Rentangan serapan maksimum Spektrofotometri UV Flavonoid (Markham, 1988).
No Puncak II (dalam nm)
Puncak I (dalam nm)
Jenis flavonoid
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi)
3 250-280 350-385 Flavonol (3-OH bebas)
4 245-275 310-330 bahu
kira-kira 320 puncak
Isoflavon
5 275-295 300-330 bahu Flavonon dan dihidro flavonol
6 230-270 340-390 Khalkon
7 230-270 380-430 Auron
8 270-280 465-560 Antosianidin dan antosianin
Selain itu hasil spektra dan flavonoid tergantung pada pola hidroksilasi
dan subtitusi senyawa tersebut. Untuk mempelajari cara ini dapat dilihat dari hasil
pergeseran spektrum UV dan spektrum tampak pada rutin. Rutin atau kuersetin
3-rutinosida pertama kali diisolasi dari Fagopyrum esculentum dan sampai sekarang
masih digunakan sebagai sumber rutin niaga. Tidak diragukan lagi bahwa dari
semua glikosida kuersetin, rutin paling luas penyebarannya dan mungkin terdapat
pada 25% dari flora setempat. Sumber yang mudah diperoleh termasuk bunga
Magnolia, Viola dan Aesculus hippocastanum, daun tembakau (Nikotiana
tabacum), Rheum, teh dan Phaseolus vulgaris. Bahan tumbuhan yang diperoleh
dari sumber tersebut di atas harus dikumpulkan dan diekstraksi dengan etanol
95% panas (jaringan segar) atau etanol 70% (jaringan kering) selama 30 menit,
lalu ekstrak dipekatkan sampai volume tinggal sedikit (Harborne, 1973).
Menurut Markham (1988), langkah pertama yamg perlu dilakukan untuk
mengidentifikasi flavonoid adalah menentukan jenis flavonoid dengan
memperhatikan:
a. Bentuk umum spektrum metanol (MeOH)
b. Panjang gelombang pita serapan
c. Data kromatografi kertas
Langkah kedua adalah mempertimbangkan arti perubahan spectrum yang
disebabkan oleh berbagai spektrum geser. Makna peubahan yang disebabkan oleh
a. Spektrum Natrium Hidroksida (NaOH)
Spektrum ini merupakan petunjuk “sidik jari” pola hidroksilasi dan
juga bermanfaat untuk mendeteksi gugus hidroksi yang lebih asam dan tidak
tersubtitusi. Degradasi atau pengurangan spektrum setelah waktu tertentu
merupakan petunjuk baik adanya gugus yang peka terhadap basa. Pada
flavonol dan flavon digunakan untuk mendeteksi adanya gugus 3 dan 4,-OH.
b. Spektrum Natrium Asetat (NaOAc)
Natrium asetat hanya menyebabkan pengionan yang berarti pada
gugus hidroksi flavanoid yang paling asam. Jadi natrium asetat digunakan
terutama untuk mendeteksi adanya gugus 7 hidroksi bebas (atau yang setara).
c. Spektrum Natrium Asetat dan Asam Borat (NaOAc/H3BO3)
NaOAc/H3BO3 menjembatani kedua gugus hidroksi pada gugus
orthodihidroksi dan digunakan untuk mendeteksinya.
d. Spektrum Alumunium Klorida dan Asam Klorida (AlCl3 dan HCl)
Pereaksi ini menyebabkan gugus OH pada C-3 dan C-5 flavon dan
flavonol akan membentuk kompleks yang stabil, sedangkan kompleks antara
AlCl3 dan gugus orthodihidroksi bersifat labil sehingga terdekomposisi
dengan penambahan asam. Adanya gugus orthodihidroksi pada cincin B dapat
diketahui dengan penambahan asam terhadap spektra AlCl3. Keberadaan gugus
Tabel IV. Penafsiran spektra UV dengan penambahan NaOH (Markham, 1988).
Pergeseran panjang gelombang puncak Jenis flavonoid Mantap + 40-65nm
Intensitas tidak menurun
4’-OH
Mantap + 60-65nm 3-OH tidak ada
4’-OH bebas Flavon
Flavonol
Pita baru (bandingkan MeOH) 320-335nm 7-OH Tidak ada
o-diOH pada cincin A (penurunan lambat : o-diOH pada cincin B isoflavon)
Tabel V. Penafsiran spektra UV dengan penambahan NaOAc (Markham, 1988).
Pergeseran panjang gelombang puncak
Intensitas berkurang dengan bertambahnya waktu
Gugus yang peka terhadap basa, -OH pada 6,7 atau 7,8 atau 3,4’
Flavonon + 35nm
+ 65nm
7-OH (dengan 5-OH) 7-OH (tanpa 5-OH)
Dihidroflavonol Intensitas berkurang dengan
bertambahnya waktu
Gugus yang peka terhadap basa, -OH pada 6,7 atau 7,8 Calkon
Auron
Pergeseran batokromik atau bahu pada panjang gelombang yang lebih panjang
4’ dan atau 4-OH (calkon)
4’ dan atau 6-OH (auron)
Tabel VI. Penafsiran spektra UV dengan penambahan NaOAc/H3BO3
(Markham,1988).
Tabel VII. Penafsiran spektra UV dengan penambahan AlCl3 dan AlCl3/HCl (Markham, 1988).
Pergeseran yang tampak Jenis flavonoid
5-OH dengan oksigenasi pada 6
Mungkin 5-OH dengan gugus prenil pada 6
+ 50-60nm Mungkin 3-OH (dengan
atau tanpa 5-OH) Pergeseran
AlCl3/HCl + 30-40nm
o-diOH pada cincin B Flavon
o-diOH pada cincin A (tambahan pada
pergeseran o-diOH pada cincin B)
o-diOH pada cincin A (6,7 dan 7,8) OH (tambahan pada sembarang pergeseran
o-2’-OH (khalkon) dengan oksigenasi pada 3’
(AlCl3) + 60-70nm
o-diOH pada cincin B
mungkin o-diOH pada cincin A
Banyak diOH atau o-diOH (3-deoksi
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk penelitian non eksperimental dan bersifat deskriptif komparatif yang dilakukan di laboratorium Farmakognosi Fitokimia, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
B. Bahan Penelitian 1. Bahan tanaman
Buah makuta dewa diperoleh dari daerah Samigaluh, Kulon Progo, Yogyakarta. Diambil buahnya yang benar-benar segar (tidak busuk) dan telah masak, dengan spesifikasi kulit buah bersih, agak benjol-benjol, berwarna merah maron, dan daging buah terasa agak lunak bila ditekan.
2. Bahan kimia
Semua bahan kima yang digunakan dalam penelitian berderajat pro analis (p.a) produksi MERCK kecuali aqua destilata. Bahan-bahan tersebut adalah metanol, asam asetat, amonia, t-butanol, kloroform, dietil eter, natrium hidroksida, natrium asetat, aluminium klorida dan asam klorida.
3. Bahan untuk kromatografi kertas
Bahan untuk identifikasi senyawa flavanoid dengan KKt adalah kertas Whatmann no 1.
C. Alat
a. Alat penyarian: alat-alat gelas, alat parut, kain saring, timbangan elektrik (Mettler Toledo, Switzerland), penangas air.
b. Alat kromatografi dan spektroskopi: bejana kromatografi, lampu UV 366 nm, pipa kapiler 5 mikroliter, spektrofotometer UV Thermo Spectronic Genesys 6 tipe split beam.
D. Rancangan Penelitian Langkah-langkah dalam penelitian meliputi :
1. Determinasi
Determinasi tanaman makuta dewa mengacu pada pustaka. 2. Pembuatan perasan daging buah makuta dewa
Buah makuta dewa masak yang masih segar dicuci dengan air sampai bersih, dibuang bijinya, kemudian diparut bersama kulitnya. Hasil parutan diperas dengan bantuan kain saring sampai seluruh sari buah makuta dewa terperas habis.
3. Reaksi warna untuk flavonoid
Perasan daging buah makuta dewa diuji menggunakan pereaksi : tiga tetes larutan pada drop plate ditambah 1 tetes larutan AlCl3, tiga tetes larutan pada drop plate tambah 1 tetes larutan NaOH 1%, dan tiga tetes larutan pada drop plate ditambah 2 tetes HCI pekat dan serbuk Mg.
4. Identifikasi Pendahuluan dengan Kromatografi Kertas Satu Arah (KKt 1A) Sebanyak 10 ml perasan daging buah makuta dewa ditambah 10 ml kloroform, fase kloroform dibuang ulangi sampai 3 kali. Untuk fase air ditambali eter 10 ml lalu dipisahkan. Hasil yang didapatkan berupa fraksi eter (sampel 2) dan fraksi air (sampel 3). Masing-masing fraksi diuapkan hingga tinggal sedikit. Selanjutnya masing-masing fraksi ditotolkan pada kertas Whatman no 1 dengan menggunakan pipa kapiler ukuran 5 µi dan dielusi dengan t-butanol asam asetat : air (TBA 3:1:1). Setelah terelusi pada batas yang ditentukan lalu diangkat, keringkan. Catat adanya warna bercak di bawah penyinaran UV 366 nm sebelum dan sesudah diuapi dengan amonia.
5. Kromatografi Kertas Dua Dimensi (KKt 2A)
Hasil dan KKt 2A ini dapat juga digunakan unluk mengisolasi flavonoid dengan cara bercak yang sesuai digunting dari kromatogram, lalu bercak yang sama digabungkan dan setelah digunting menjadi potongan kecil-kecil diekstraksi dengan pelarut yang sesuai (digunakan metanol (MeOH)). Bila diperlukan, hasil pemisahan KKt 1A dapat digabungkan dengan hasil pemisahan KKt 2A hasil replikasi agar diperoleh flavonoid murni (Markham, 1988).
6. Identifikasi Isolat Flavonoid dengan Spektrofotometri UV
Isolat diperoleh dari pemotongan masrng-masing bercak pada kertas kromatogram (KKt 2 A) yang telah dipisahkan. Kertas dipotong kecil-kecil kemudian direndam dalam 10 ml metanol PA selama 24 jam, kemudian disaring dengan kertas saring (sebagai isolat).
Identifikasi dan penentuan struktur isolat flavonoid dengan metode spetrofotometri UV berturut-turut dilakukan pemberian pereaksi geser yaitu NaOH, H3BO3, AlCl3, HCl dan NaOAc dengan tahap-tahap:
a. Tahap I
Larutan isolat dalam metanol dimasukkan dalam kuvet sampel. Pada kuvet blangko dimasukkan metanol. Kemudian dibaca serapannya bersama-sama pada gelombang 200-500 nm.
b. Tahap II
menit kemudian dibaca serapannya kembali untuk mengetahui kemungkinan terjadinya dekomposisi flavonoid.
a. Tahap III
Larutan isolat flavonoid yang baru dalam kuvet sampel ditambah 3 tetes AlCl3 kemudian dibaca serapannya pada panjang gelombang 200-500 nm.
b. Tahap IV
Larutan pada kuvet sampel tahap III ditambahkan 3 tetes pereksi HCl kemudian dibaca serapannya pada panjang gelombang 200-500 nm.
c. Tahap V
Larutan isolat flavonoid dalam kuvet sampel ditambah serbuk NaOAc anhidrat sebanyak kira-kira 2 mm dari dasar kuvet, digojog dan dibaca serapannya pada panjang gelombang 200-500 nm.
d. Tahap VI
Larutan pada kuvet sampel tahap V ditambahkan serbuk H3BO3 dengan jumlah setengah dari jumlah penambahan NaOAc, digojog dan dibaca serapannya pada panjang gelombang 200-500 nm.
F. Analisis Hasil
BAB IV
HASIL DAN PEMBAHASAN A.Determinasi
Determinasi tanaman dilakukan untuk mengetahui bahwa tanaman yang
digunakan dalam penelitian adalah sesuai yang dimaksud. Determinasi dilakukan
dengan mencocokan tanaman dengan kunci-kunci determinasi yang ada dalam buku
Flora of Java karangan Backer dan Van den Brink (1963), dan hasilnya adalah
Phaleria macrocarpa (Scheff.) Boerl. Kunci-kunci determinasi tanaman berdasarkan
buku Flora of Java karangan Backer dan Van den Brink (1963) adalah sebagai
berikut:
1b-2b-3b-4b-12b-13b-14b-17b-18b-19b-20b-21b-22b-23b-24b-25b-26b-27b-799b-
800b-801b-802b-803b-804b-805c-806b-807b-809b-810b-811a-812b-815b-816b-
818b-820b-821b-822a-823b-824b-825b-826b-829b-830b-831b-832b-833b-834a-
835a-836a-837c-851b-856b-857a-858b-860b-872b-874b-875b-876b-877d-933b-934a-935b-936b-937a-938c-939a-940a-941b-942b-64. Familia
Thymelaeaceae-la-genus1.Phaleria-la-2b-Phaleria macrocarpa (Scheff.) Boerl.
B.Pembuatan Perasan Daging Buah Makuta Dewa 1. Pengumpulan dan pencucian bahan
Buah makuta dewa yang telah masak dan masih segar diperoleh dari daerah
Samigaluh, Kulon Progo, Yogyakarta dengan spesifikasi kulit buah bersih, agak
benjol-benjol, berwarna merah maron, dan daging buah terasa agak lunak bila
ditekan. Penggunaan buah makuta dewa yang telah masak dimaksudkan agar
memudahkan dalam proses pemerasan karena daging buah makuta dewa yang telah
masak dapat dipastikan terasa agak lunak sehingga dalam pembuatan perasan tersebut
dapat diperoleh perasan yang cukup untuk penelitian selain itu juga diharapkan
diperoleh kandungan senyawa kimia yang terdapat dalam buah telah optimal.
Sebelumnya dilakukan pencucian dengan air bersih yang mengalir secara berulang
kali untuk memastikan bahwa buah makuta dewa benar-benar bersih dari tanah, debu,
pasir atau kotoran lainnya. Air yang mengalir untuk memastikan kotoran yang
terbilas tidak menempel kembali pada buah. Setelah dicuci kemudian antara daging
buah dan biji dipisahkan dan diambil daging buahnya beserta kulit buahnya.
2. Pembuatan perasan
Daging buah beserta kulitnya kemudian diparut sehingga diperoleh hasil
parutan yang selanjutnya diperas dengan bantuan kain saring sampai seluruh sari
daging buah makuta dewa terperas habis, cukup untuk mendapatkan perasan yang
dibutuhkan dalam penelitian. Hasil perasan selanjutnya digunakan untuk
langkah-langkah selanjutnya dalam penelitian ini.
C.Pemeriksaan Flavonoid dengan Reaksi Warna
Pemeriksaan dilakukan untuk memastikan ada tidaknya flavonoid dalam
perasan daging buah makuta dewa. Dari pemeriksaan tersebut juga dapat disimpulkan
perkiraan golongan flavonoid yang terkandung dalam air perasan daging buah makuta
Tabel VIII. Reaksi warna flavonoid untuk menentukan interpretasi golongan flavonoid dibandingkan dengan pustaka Markham (1988).
Pereaksi Perubahan warna Pustaka
AlCl3 Merah Kuning
NaOH Coklat Kuning/hijau kuning
Serbuk Mg-HCl Coklat kemerahan Kuning/jingga/merah
Dengan penambahan pereaksi AlCl3, bila disemprotkan pada KKt yang
kemudian dikeringkanakan menunjukkan semua 5-hidroksi-flavonoid sebagai bercak
berfluoresensi kuning bila dilihat dibawah sinar UV (366 nm), selain itu bercak yang
semula tak tampak menjadi terlihat (Markham, 1988). Dari hasil penelitian
menunjukan adanya perubahan warna perasan menjadi merah setelah penambahan
AlCl3, ini menunjukan tidak adanya 5-hidroksi-flavonoid. Penambahan pereaksi
NaOH, menunjukan 3’,4’-dihidroksi-flavon dan 3’,4’-dihidroksi-flavonol sebagai
bercak jingga (UV atau tampak) dan 4’-hidroksi-flavon dan 4’-hidroksi-flavonol
berupa hijau kuning. Hasil penelitian memberikan warna coklat pada perasan setelah
penambahan pereaksi NaOH, ini menunjukkan bahwa pada perasan tidak terdapat
jenis-jenis senyawa flavonoid seperti diatas. Penambahan pereaksi serbuk Mg-HCl
menunjukan adanya gugus hidroksi fenol bila terlihat kuning, jingga, atau merah.
Dari hasil penelitian menunjukan warna coklat kemerahan, sehingga dapat
diinterpretasikan bahwa perasan daging buah makuta dewa memiliki gugus hidroksi
Berdasarkan interpretasi diatas dapat disimpulkan bahwa perasan daging
bvuah makuta dewa terdapat senyawa flavonoid yang mempunyai gugus hidroksi
fenol pada strukturnya.
D.Identifikasi Pendahuluan Flavonoid dengan KKt 1A
Dalam identifikasi ini digunakan 10 ml perasan daging buah makuta dewa
difraksinasi secara bertingkat dengan 10 ml kloroform. Fase kloroform dibuang,
penambahan ini diulang sampai tiga kali. Penggunaan kloroform disini untuk
menghilangkan senyawa-senyawa yang kurang polar dalam fraksi air misalnya
lemak, terpena, klorofil, dan xantofil (Mursyidi, 1990). Fraksi air yang didapat
kemudian difraksinasi kembali menggunakan 10 ml dietil eter, kemudian dipisahkan.
Hasil yang didapatkan berupa fraksi eter (sebagai sampel 2) dan fraksi air (sebagai
sampel 3). Kedua fraksi ditotolkan diatas kertas Whatmann no 1 (ukuran 5x15 cm)
dengan pembanding rutin untuk identifikasi pendahuluan keberadaan flavonoid.
Penotolan bercak menggunakan pipa kapiler ukuran 5 µl, dan diulang
sebanyak tiga kali agar didapatkan bercak yang dapat dideteksi. Apabila
penotolannya sedikit maka bercak yang terbentuk mungkin akan sukar dideteksi
sedangkan apabila penotolannya banyak, maka akan terjadi pencorengan sehingga
resolusi menjadi jelek. Pengembangan satu arah ini dielusi menggunakan fase gerak
t-butanol : asam asetat : air (TBA 3:1:1). Pengembangan dilakukan dengan jarak10
366 nm sebelum dan sesudah diuapi amonia. Hasil yang didapatkan berupa warna
bercak dan harga Rf untuk masing-masing bercak.
A
B C
D E F
Spl 3 Spl 2
Spl 1
Rf 1,00
0,50
0,00
Gambar 5. Kromatogram dari bercak KKt 1A dari masing-masing sampel.
Ket. Sampel 1 : Rutin (pembanding)
Sampel 2 : Fraksi eter Sampel 3 : Fraksi air
Fase diam : kertas Whatmann no. 1 (5x15 cm)
Fase gerak : t-butanol-asam asetat-air (TBA 3:1:1)
Pengembangan : ± 10 cm
Deteksi : sinar UV 366 nm
Warna bercak A : ungu
B : kuning
C : ungu
D : coklat
E : kuning
Tabel IX. Data kromatogram dari bercak KKt 1A masing-masing sampel dengan fase diam kertas Whatmann no 1 dan fase gerak TBA (3:1:1). Deteksi dengan sinar UV
366 nm sebelum dan sesudah diuapi amonia, serta interpretasi warna bercak (Markham,1988). flavonoid berdasar warna
bercak
standar 0,51 Kuning Ungu Kuning Ungu a. flavon atau flavonol
dengan 3-OH tersubstitusi dan 5-OH
bebas tetapi tanpa 4’-OH bebas
b. flavon atau flavonol
dengan 3-OH tersubstitusi yang mengandung 5-OH dengan 6-OH atau 8-OH
c. Isoflavon, dihidroflavon,
biflavonil dan flavonon dengan 5-OH
d. Calkon dengan 2 atau 6-OH tetapi tidak memiliki 2 atau 4-OH bebas
B 0,45 Tidak tampak
Kuning Tidak tampak
Kuning a. Flavonol dengan
3-OH bebas dan atau tanpa 5-OH bebas (dihidroflavonol)
b. Auron tanpa 4’-OH
bebas dan flavon tanpa 5-OH bebas
c. Flavanol dengan 3-OH bebas dan dengan atau tanpa 5-OH bebas
Ungu a. flavon atau flavonol
dengan 3-OH tersubstitusi dan 5-OH
bebas tetapi tanpa 4’-OH bebas
b. flavon atau flavonol
tersubstitusi yang mengandung 5-OH dengan 6-OH atau 8-OH
c. Isoflavon, dihidroflavon,
biflavonil dan flavonon dengan 5-OH
d. Calkon dengan 2 atau 6-OH tetapi tidak memiliki 2 atau 4-OH bebas
D 0,22 Tidak tampak
Coklat Tidak tampak
Coklat Tidak dapat
diinterpelasikan
E 0,41 Kuning Kuning Kuning Kuning a. Flavonol dengan
3-OH bebas dan atau tanpa 5-OH bebas (dihidroflavonol)
b. Auron tanpa 4’-OH
bebas dan flavon tanpa 5-OH bebas
c. Flavanol dengan 3-OH bebas dan dengan atau tanpa 5-OH bebas
Ungu a. flavon atau flavonol
dengan 3-OH tersubstitusi dan 5-OH
bebas tetapi tanpa 4’-OH bebas
b. flavon atau flavonol
dengan 3-OH tersubstitusi yang mengandung 5-OH dengan 6-OH atau 8-OH
c. Isoflavon, dihidroflavon,
biflavonil dan flavonon dengan 5-OH
d. Calkon dengan 2 atau 6-OH tetapi tidak memiliki 2 atau 4-OH bebas
Penggunaan uap amonia dalam pemeriksaan awal KKt 1A untuk memastikan
ada tidaknya flavonoid yang terkandung dalam fraksi air maupun fraksi eter. Warna
kuning yang dapat dilihat dalam sinar tampak setelah bercak diuapi amonia
menunjukan adanya flavonoid. Setelah itu bercak diamati dibawah sinar UV 366 nm
untuk penafsiran golongan flavonoid berdasarkan warna bercak yang tampak.
Dari hasil pengamatan KKt 1A dengan fase gerak TBA (3:1:1) sebelum
diuapi amonia pada sinar UV 366 nm pada masing-masing bercak menunjukan warna
yang berbeda. Bercak A berwarna ungu, bercak B berwarna kuning, bercak C
berwarna ungu, bercak D berwarna coklat, bercak E berwarna kuning, dan bercak F
berwarna ungu. Sedangkan setelah diuapi amonia pada sinar UV 366 nm tidak
menunjukan perubahan warna atau perubahan warna sedikit, dimana bercak A
berwarna ungu, bercak B berwarna kuning, bercak C berwarna ungu, bercak D
berwarna coklat, bercak E berwarna kuning, dan bercak F berwarna ungu.
Menurut Mabry et al (1970), dari hasil pengamatan bercak tersebut dapat
diperkirakan tipe flavonoid apa yang terkandung dalam masing-masing bercak.
Bercak C dan F kemungkinan merupakan suatu flavonoid tipe flavon atau flavonol
dengan 3-OH tersubstitusi dan 5-OH bebas tetapi tanpa 4’-OH bebas; flavon atau
flavonol dengan 3-OH tersubstitusi yang mengandung 5-OH dengan 6-OH atau
8-OH; isoflavon; dihidroflavon; biflavonil dan flavonon dengan 5-8-OH; calkon dengan
2 atau 6-OH tetapi tidak memiliki 2 atau 4-OH bebas. Sedangkan bercak B dan E
atau dihidroflavonol; auron tanpa 4’-OH bebas dan flavon tanpa 3-OH bebas;
flavanol dengan 3-OH bebas dan dengan atau tanpa 5-OH bebas. Untuk bercak
sampel D tidak dapat diinterpretasikan, kemungkinan bercak tersebut bukan
merupakan golongan flavonoid. Untuk identifikasi warna dan harga Rf
masing-masing bercak dapat dilihat pada tabel X.
E.Identifikasi dan Isolasi Flavonoid Fraksi Eter dengan KKt 2A
Identifikasi flavonoid dengan KKt 2A ini berguna untuk mengetahui apakah
flavonoid tersebut merupakan aglikon atau glikosida. Pada identifikasi dengan KKt
1A pemisahan bercak tidak terpisahkan dengan baik karena terdapat bercak yang
terdiri atas dua bercak/lebih sehingga diperlukan pemisahan yang lebih spesifik lagi
yaitu dengan KKt 2A (Markham, 1988).
Dalam identifikasi flavonoid ini digunakan kertas Whatmann no 1 ukuran 20
x 20 sebagai fase diamnya sedangkan untuk fase geraknya digunakan dua fase gerak.
Fase gerak yang pertama digunakan t-butanol : asam asetat : air (TBA 3:1:1)
sedangkan fase gerak kedua digunakan larutan asam asetat 15%. Fase diam kertas
Whatmann no 1 karena jumlah pemisahan yang relatif kecil serta dibutuhkan
kecepatan aliran yang lebih tinggi, apabila menggunakan kertas Whatmann yang lain
seperti kertas Whatmann no.3 yang mempunyai ketebalan lebih besar maka
kecepatan alirannya akan semakin turun, sehingga dibutuhkan waktu yang relatif
larutan asam asetat 15%v/v (fase gerak II) merupakan fase gerak (pengembang) yang
terbaik dari segi kekuatan pelarut dan pemisahan bercak.
Hasil bercak yang diperoleh diamati dibawah sinar UV 366 nm, lalu dipetakan
bercak yang diperoleh diatas kertas dan dicatat warna bercaknya (sebelum dan
sesudah uapi amonia). Hasil dibandingkan dengan pustaka yang ada untuk
memperkirakan jenis flavonoid apa yang terkandung dalam masing-masing bercak.
A
B
C
D
E
F G
I II
Rf 0.0
Rf 1.0 Rf
1,0
Rf 0.50
Rf 0.50
Gambar 6. Kromatogram KKt 2A fraksi eter air perasan daging makuta dewa
Fase diam : kertas Whatmann no. 1 (20x20 cm)
Fase gerak I : t-butanol-asam asetat-air (TBA 3:1:1)
II : asam asetat 15% v/v
Tabel X. Data harga Rf dan deteksi sinar UV 366 nm dari bercak-bercak pada kromatogram KKt 2A fraksi eter ekstrak metanol.
Harga Rf Warna bercak UV 366 nm
Bercak
sampel Pengembangan TBA (3:1:1 v/v)
Tabel XI. Interpretasi struktur flavonoid menurut warna bercak KKt 2A dibawah sinar UV 366 nm sebelum dan sesudah diuapi amonia (NH3).
Bercak Deteksi UV 366
Interpretasi menurut Markham (1988)
IIA Ungu tua Tanpa perubahan
warna
a. Biasanya flavon atau flavonol tersubstitusi pada 3-O
mempunyai 5-OH tetapi tanpa 4’-OH bebas.
b. Beberapa 6-OH atau 8-OH flavon dan flavonol ersubstitusi pada 3-O serta mengandung 5-OH.
flavanon yang mengandung 5-OH.
d. Khalkon yang mengandung 2’-atau 6’-OH tetapi tidak
mengandung 2-OH atau 4-OH bebas.
IIB Ungu tua Tanpa perubahan
warna
a. Biasanya flavon atau flavonol tersubstitusi pada 3-O
mempunyai 5-OH tetapi tanpa 4’-OH bebas.
b. Beberapa 6-OH atau 8-OH flavon dan flavonol
tersubstitusi pada 3-O serta mengandung 5-OH.
c. Isoflavon, dihidroflavonol, biflavonil dan beberapa flavanon yang mengandung 5-OH.
d. Khalkon yang mengandung 2’-atau 6’-OH tetapi tidak
mengandung 2-OH atau 4-OH bebas.
IIC Coklat Coklat Tidak dapat diinterpretasikan
IID Kuning Tanpa perubahan
warna
a. Flavonol yang mengandung
3-OH bebas dan mempunyai atau tak mempunyai 5-OH bebas (kadang-kadang berasal dari dihidroflavonol)
b. Auron yang mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas
c. Flavonol yang mengandung
3-OH bebas dengan atau tanpa 5-OH bebas
IIE Fluoresensi Biru
muda
Fluoresensi biru hijau
a. Flavon dan flavanon yang tak mengandung OH, misalnya 5-OH-glikosida
b. Flavonol tanpa 5-OH bebas tetapi tersulih pada 3-OH
c. Isoflavon yang tak mengandung 5-OH bebas
5-OH bebas.
e. Flavonol yang mengandung 3-OH bebas dan disertai atau tanpa 5-OH bebas
IIF Fluoresensi Biru
muda
Fluoresensi biru hijau
a. Flavon dan flavanon yang tak mengandung OH, misalnya 5-OH-glikosida
b. Flavonol tanpa 5-OH bebas tetapi tersulih pada 3-OH
c. Isoflavon yang tak mengandung 5-OH bebas
d. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas
e. Flavonol yang mengandung 3-OH bebas dan disertai atau tanpa 5-OH bebas
IIG Biru tua Fluoresensi biru
hijau
a. Flavon dan flavanon yang tak mengandung OH, misalnya 5-OH-glikosida
b. Flavonol tanpa 5-OH bebas tetapi tersulih pada 3-OH
c. Isoflavon yang tak mengandung 5-OH bebas
d. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas
Gbr 7. Daerah penyebaran bercak-bercak dari kromatogram hasil KKt 2A dibandingkan dengan peta penyebaran bercak flavonoid menurut Markham (1988)
Tabel XII. Penggolongan daerah penyebaran bercak-bercak menurut kromatogram KKT 2A berdasar pada pola penyebaran bercak menurut Markham (1988).
Bercak Daerah penyebaran Interpretasi jenis flavonoid
IIA Flavonoid sulfat Flavonol tri-O-glikosida (3,7)
IIB Flavon C- dan C-/O-glikosida Isoflavon 7-O-diglikosida
Isoflavon 7-O-monoglikosida
IIC Flavon C- dan C-/O-glikosida Isoflavon 7-O-diglikosida
Isoflavon 7-O-monoglikosida Flavonol 3-O-diglikosida Katekin/Epikatekin
Flavonol 3-O-monoglikosida