AKTIVITAS ANTIMIKROBA SEDIAAN BIOMATERIAL SELULOSA BAKTERI DARI LIMBAH KETELA RAMBAT (Ipomoea batatas Poir) DENGAN PENAMBAHAN KITOSAN TERHADAP Staphylococcus aureus
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Arvi Mahendra
NIM: 098114120
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi
Berjalan Bersama Yesus Tuhanku, aku tidak takut
menghadapi tantangan di depanku
( Arvi Mahendra)
Karena itu aku senang dan rela di dalam kelemahan, di dalam
siksaan, di dalam kesukaran, didalam penganiayaan dan kesesakan
oleh karena Kristus. Sebab jika aku lemah, maka aku kuat
( 2 Korintus 12 :10)
Berjuanglah hingga kau mencapai
tujuan mu
( papa dan mama)
Karya ini Kupersembahkan bagi :
vii PRAKATA
Segala puji syukur penulis haturkan kepada Tuhan Yesus atas segala berkat
dan penyertaan yang senantiasa menyertai penulis hingga akhirnya dapat
menyelesaikan skripsi yang berjudul “Aktivitas Anti Mikroba Sediaan Biomaterial Selulosa Bakteri dari Limbah Ketela Rambat (Ipomoea batatas Poir)
dengan Penambahan Kitosan terhadap Staphylococcus aureus”. Skripsi ini
merupakan langkah awal untuk mendapatkan gelar sarjana farmasi.
Penulis juga mengucapkan banyak terima kasih kepada pihak-pihak yang telah
membantu penulis dalam menyelesaikan skripsi ini. Penulis ingin mengucapkan
terima kasih kepada :
1. Ibu Dr. Eli Rohaeti selaku Dosen Pembimbing Utama yang selalu
memberikan saran dan semangat untuk menyelesaikan skripsi ini.
Kebersediaan dalam meluangkan waktu bagi kami untuk berdiskusi
berdampak positif bagi kemajuan penulisan skripsi ini.
2. Bapak Yohanes Dwiatmaka, M.Si selaku Dosen Penguji yang telah bersedia
meluangkan waktu untuk menguji serta memberikan saran dan masukan
kepada penulis
3. Bapak Prof. Dr. CJ. Soegihardjo, Apt selaku Dosen Penguji yang telah
meluangkan waktu untuk menguji dan memberikan masukan bagi penulis
4. Mas Narto, Mas Dwi dan Mas Sarwanto yang telah membantu dalam
viii
5. Bapak Mukminin, Mas Heru, Mas Parjiman, Mas Wagiran, Mas Sigit, Pak
Parlan, Pak Mus, beserta segenap laboran dan karyawan lain yang telah
membantu Penulis dalam menyelesaikan skripsi ini.
6. Papa dan mama yang senantiasa memberikan dorongan, nasihat dan doa agat
skripsi ini berjalan dengan baik.
Penulis menyadari bahwa skripsi yang disusun ini masih ada kekurangan dan
ketidak sempurnaan, oleh karena itu penulis mengharapkan kritik dan saran agar
karya ini menjadi lebih baik lagi. Semoga penelitian skripsi ini dapat bermanfaat
dan menginspirasi penelitian berikutnya.
ix DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN KARYA ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... v
HALAMAN PERSEMBAHAN ... vi
BAB II PENELAAHAN PUSTAKA ... 6
x
D. Aplikasi Selulosa Bakteri dalam Bidang Medis ... 12
E. Acetobacter Xylinum ... 13
F. Staphylococcus aureus ... 15
G. Kitosan ... 17
H. Karakteristik Kitosan ... 18
I. Gliserol ... 19
J. Analisis Gugus Fungsi dengan Spektofotometri Infra Merah ... 20
K. Analisis Permukaan dengan Teknik Scanning Electron Microscopy (SEM) .. 23
L. Analisis Kristalinitas dengan Difraksi Sinar X (XRD) ... 24
M. Antibakteri ... 25
N. Pengujian Aktivitas Antimikroba... 27
O. Landasan Teori ... 27
P. Hipotesis ... 28
BAB III METODE PENELITIAN ... 29
A. Jenis Penelitian ... 29
B. Variabel Penelitian ... 29
xi
2. Variabel pengacau ... 29
C. Definisi Operasional ... 30
D. Alat dan Bahan ... 31
E. Tata Cara Penelitian ... 32
1. Determinasi tanaman ... 32
2. Pemilihan bahan ... 32
3. Preparasi limbah ketela rambat ... 32
4. Pembuatan kitosan sebagai pembanding ... 33
5. Pembuatan material selulosa bakteri ... 33
6. Pembuatan material selulosa bakteri+gliserol+kitosan ... 34
7. Analisis karakteristik biomaterial ... 35
8. Sterilisasi produk ... 37
9. Pengujian aktivitas antimikroba ... 37
F. Analisis Data ... 39
BAB IV HASIL DAN PEMBAHASAN ... 40
A. Hasil Determinasi Tanaman ... 40
B. Hasil Pemilihan Bahan ... 41
C. Preparasi Limbah Ketela Rambat ... 41
D. Pembuatan Membran Kitosan ... 42
E. Pembuatan Membran Selulosa ... 44
F. Pembuatan Membran Selulosa+Gliserol+kitosan (SGK) ... 47
G. Analisis Karakteristik Membran ... 48
xii
2. Analisis gugus fungsi dengan instrumen FT-IR ... 49
3. Analisis struktur morfologi ... 54
4. Analisis kristalinitas dengan XRD ... 57
H. Pengujian Aktivitas Antimikroba... 60
BAB V KESIMPULAN DAN SARAN ... 69
A. Kesimpulan ... 69
B. Saran ... 69
DAFTAR PUSTAKA ... 70
LAMPIRAN ... 76
xiii
DAFTAR TABEL
Tabel I. Kandungan kimia ketela rambat ... 7
Tabel II. Hasil korelasi gugus fungsi ... 23
Tabel III. Sifat fisik membran kitosan secara makroskopik ... 43
Tabel IV. Hasil pengamatan sifat fisik membran ... 48
Tabel V. Hasil interpretasi gugus fungsi membran... 53
Tabel VI. Hasil absorbansi selulosa dan selulosa+kitosan+gliserol ... 54
Tabel VII. Hasil pengamatan aktivitas antimikroba sampel biomaterial ... 62
xiv
DAFTAR GAMBAR
Gambar 1. Struktur molekul amilosa ... 8
Gambar 2. Struktur molekul amilopektin ... 9
Gambar 3. Struktur selulosa ... 9
Gambar 4. Skema pembentukan selulosa ... 10
Gambar 5. Struktur selulosa bakteri ... 11
Gambar 6. Struktur dinding sel bakteri gram positif ... 16
Gambar 7. Struktur kitosan ... 17
Gambar 8. Metode mengkonstruksi garis dasar dalam spektrum infra merah... 21
Gambar 9. Spektra inframerah dari selulosa bakteri dan kitosan ... 22
Gambar 10. Foto SEM selulosa bakteri ... 24
Gambar 11. Difraktogram XRD dari selulosa bakteri dan kitosan ... 25
Gambar 12. Membran kitosan ... 43
Gambar 13. Bagan biosintesis selulosa ... 44
Gambar 14. Membran selulosa ... 46
Gambar 15. Spektra IR serbuk kitosan ... 49
Gambar 16. Spektra IR selulosa bakteri ... 51
Gambar 17. Spektra IR selulosa+kitosan+gliserol... 52
Gambar 18. Foto Permukaan SEM Selulosa+kitosan+gliserol... 55
Gambar 19. Foto penampang melintang selulosa+kitosan+gliserol ... 56
Gambar 20. Foto permukaan membran selulosa ... 56
Gambar 21. Foto penampang melintang selulosa bakteri ... 57
xv
Gambar 23. Difraktogram selulosa+kitosan+gliserol ... 59
Gambar 24. Hasil pengamatan aktivitas antimikroba membran selulosa ... 62
Gambar 25. Hasil pengamatan aktivitas antimikroba membran kitosan ... 64
Gambar 26. Hasil pengamatan aktivitas antimikroba membran
Selulosa+Kitosan+gliserol ... 64
Gambar 27. Struktur asam teikoat ... 65
xvi
DAFTAR PERSAMAAN
Persamaan 1. Rumus perhitungan DD kitosan... 18
Persamaan 2. Rumus perhitungan absorbansi menurut hukum Lambert-Beer ... 20
Persamaan 3. Rumus perhitungan absorbansi ... 20
Persamaan 4. Rumus perhitungan % kristalinitas ... 24
Persamaan 5. Rumus perhitungan % daya hambat ... 38
xvii
DAFTAR LAMPIRAN
Lampiran 1. Hasil determinasi tanaman ketela rambat ... 76
Lampiran 2. Surat pengesahan determinasi ... 77
Lampiran 3. Formula yang digunakan (per 100 mL) ... 78
Lampiran 4. Skema jalannya penelitian ... 78
Lampiran 5. Foto bahan yang digunakan ... 79
Lampiran 6. Foto masing-masing sampel ... 79
Lampiran 7. Hasil penimbangan berat basah sampel ... 80
Lampiran 8. Perhitungan konsentrasi NaOH dan HCl yang digunakan ... 80
Lampiran 9. Hasil spektra IR kitosan beserta perhitungan derajat deasetilasi... 81
Lampiran 10. Hasil spektra IR masing-masing sampel ... 82
Lampiran 11. Hasil perhitungan absorbansi tiap sampel ... 83
Lampiran 12. Hasil foto morfologi permukaan tiap sampel dengan instrument SEM ... 83
Lampiran 13. Hasil XRD tiap sampel ... 84
Lampiran 14. Hasil perhitungan luas total di bawah kurva tiap sampel ... 85
Lampiran 15. Hasil perhitungan luas background tiap sampel ... 86
Lampiran 16. Hasil perhitungan luas kristal+amorf tiap sampel ... 87
Lampiran 17. Hasil perhitungan luas kristal tiap sampel ... 87
Lampiran 18. Hasil perhitungan kristalinitas tiap sampel... 88
Lampiran 19. Hasil pengamatan aktivitas antimikroba ... 89
Lampiran 20. Hasil perhitungan % daya hambat ... 91
xviii
Aktivitas Anti Mikroba Sediaan Biomaterial Selulosa Bakteri dari Limbah Ketela Rambat (Ipomoea batatas Poir) dengan Penambahan Kitosan
terhadap Staphylococcus aureus
Arvi Mahendra 098114120 INTISARI
Penelitian dilakukan untuk melihat aktivitas anti mikroba biomaterial selulosa bakteri yang berasal dari pemanfaatan limbah cair ketela rambat yang ditambah dengan gliserol dan kitosan terhadap Staphylococcus aureus.
Sediaan biomaterial terbuat dari selulosa bakteri sebagai kontrol karakterisasi, dan selulosa bakteri+gliserol+kitosan sebagai perlakuan. Kitosan yang ditambahkan sebesar 2%. Analisis karakteristik biomaterial meliputi analisis gugus fungsional, analisis permukaan biomaterial dengan SEM (Scanning Electron Microscopy), serta analisis kristalinitas dengan XRD (X-ray Diffraction). Untuk melihat aktivitas anti mikroba dilakukan pengujian dengan metode difusi cakram (disk), namun untuk membran biomaterial (selulosa bakteri dan selulosa bakteri+gliserol+kitosan) dan membran kitosan 2%, menggunakan metode tempel pada media MHA (Mueller-Hinton Agar), untuk kontrol positif (amoxicillin) menggunakan paper disk, begitu pula kontrol negatif (asam asetat 2%). Aktivitas anti mikroba terlihat dari adanya zona hambat yang dapat dihitung melalui persen daya hambat.
Hasil pengujian karakteristik biomaterial selulosa dengan penambahan kitosan adalah adanya perubahan spektra IR, penurunan absorbansi gugus fungsi, perubahan morfologi permukaan, serta perubahan persen kristalinitas dari 72% menjadi 63%. Untuk pengujian aktivitas anti mikroba, dengan penambahan 2% kitosan dapat memberikan zona hambat, sedangkan untuk selulosa bakteri tanpa penambahan kitosan tidak memberikan zona hambat. Rata-rata diameter zona hambat membran selulosa yang ditambahkan kitosan adalah 7,6 mm dengan rata-rata persen zona hambat adalah 24%.
Kata Kunci: aktivitas anti mikroba, biomaterial selulosa bakteri, Ipomoea batatas
xix
Anti Microbial Activity of Bacterial Cellulose Biomaterial from Sweet Potato Waste (Ipomoea batatas Poir) with Addition of Chitosan Agains
Staphylococcus aureus
ABSTRACT
The study was conducted to see the anti microbial activity of bacterial cellulose biomaterials produced from sweet potato waste with addition of chitosan and glycerol agains Staphylococcus aureus.
Biomaterials was prepared from bacterial cellulose as a control characterization, bacterial cellulose+glycerol+chitosan as a treatment. Addition of chitosan is about 2% ( two grams chitosan in 100 mL acetate acid 2%). Characterization analysis included analysis functional groups, morphology structure using SEM (Scanning Electron Microscopy), crystallinity using XRD (X-ray Diffraction) instrument. Anti microbial activity assay performed with disc diffusion method for amoxicillin as control positive and acetate acid as control negative. Bacterial cellulose and bacterial cellulose+glycerol+chitosan was assay by put the membrane into media MHA (Mueller-Hinton Agar). Anti microbial activity was seen through blocked zone or clean zone around membrane.
The result showed that addition of chitosan changing characteristic in functional groups, lowering absorbance of the fuctional groups, structural change in morphology, and changing crystalinity from 72% to 63%. The result also showed that bacterial cellulose with addition of chitosan giving anti microbial activity.
BAB I PENGANTAR
A. Latar Belakang
Ketela rambat atau ubi jalar merupakan sejenis umbi-umbian yang banyak
diproduksi di Indonesia. Berdasarkan data Badan Pusat Statistik tahun 2012
menunjukkan bahwa produksi ketela rambat mencapai 2.196.033 ton. Hal ini
tentu saja membuat ketela rambat menjadi salah satu komoditas yang dapat
dikembangkan di Indonesia.
Berdasarkan penelitian Siti Rahayu (2005), setiap 100 kg ketela rambat
segar, dapat diubah menjadi tepung sebanyak 19,63 kg. Saat proses pembuatan
tepung akan dihasilkan air cucian yang akan dibuang oleh masyarakat.
Pembuangan air limbah dapat menyebabkan polusi bagi lingkungan sekitar bila
tidak dilakukan dengan benar. Air limbah tersebut akan mengalami penguraian
senyawa di perairan dan menimbulkan bau tidak sedap. Untuk mengurangi polusi
akibat limbah dapat dilakukan pengolahan air limbah.
Menurut Pratomo dan Rohaeti (2010), selulosa bakteri dapat dibentuk dari
bahan alam yang mengandung nutrisi untuk fermentasi yang dilakukan oleh
bakteri. Diketahui pula bahwa limbah cair ketela rambat memiliki nutrisi yang
diperlukan bakteri untuk melakukan fermentasi, sehingga Limbah cair dari ketela
rambat ini dapat dimanfaatkan sebagai bahan dasar pembuatan selulosa (Pratomo
Selulosa bakteri adalah selulosa yang diproduksi oleh bakteri asam asetat
dan memiliki beberapa keunggulan dibandingkan selulosa yang berasal dari
tumbuhan. Keunggulan tersebut di antaranya memiliki kemurnian yang tinggi,
struktur jaringan yang sangat baik, kemampuan degradasi tinggi, dan kekuatan
mekanik yang unik (Takayasu and Fumihiro, 1997). Selain itu, selulosa bakteri
memiliki kandungan air yang tinggi (98-99%), penyerap cairan yang baik, bersifat
non-alergenik, dan dapat dengan aman disterilisasi tanpa menyebabkan perubahan
karakteristiknya (Ciechańska, 2004). Selain itu selulosa bakteri dapat diaplikasikan sebagai pengganti kulit dalam proses penyembuhan luka kulit.
Selulosa bakteri ini memiliki kelemahan, yaitu mudah menyerap cairan
sehingga mudah terkontaminasi oleh mikroba. Selain itu menurut Seichi Tokura
(2008), selulosa bakteri tidak memiliki aktivitas antimikroba untuk mencegah
kontaminasi mikroba pada selulosa bakteri maupun mencegah infeksi pada luka.
Untuk mengatasi kelemahan tersebut, maka menurut Ciechanska (2004)
dapat dilakukan modifikasi dengan cara penambahan suatu bahan lain pada
selulosa bakteri tersebut. Dalam kasus ini, modifikasi ditujukan dapat
memberikan sifat bakteriostatik pada selulosa bakteri. Bahan yang ditambahkan
diantaranya adalah kitosan.
Kitosan adalah produk terdeasetilasi dari kitin yang merupakan polimer
alami kedua terbanyak di alam setelah selulosa, yang banyak terdapat pada
serangga, crustaceae, dan fungi. Sebagai negara maritim, Indonesia sangat
berpotensi menghasilkan kitin dan produk turunannya. Namun, pengolahannya
lingkungan (Sandford, 2003). Kitosan bersifat tidak toksik, biokompatibilitas,
biodegrabilitas, bioadhesif, dan mudah dimodifikasi secara kimia sehingga
berpotensi besar untuk diaplikasikan dalam dunia farmasi (Burkatovskaya, 2006;
Kumar, Joydeep, dan Tripathi, 2004).
Kitosan memiliki aktivitas antibakteri (ElGhaouth, Arul, Aselin, dan
Benhamou, 1993; Chen et al. 2002; Yadav 2004; Alexandra, Anna, Bogumila,
Alojzy, dan Lukasz, 2005 ). Terkait dengan itu, di Institue of Chemical Fibers
(IWCh) Polandia, telah melakukan modifikasi selulosa bakteri dengan chitosan
yang bertujuan untuk meningkatkan sifat bioaktif dari selulosa bakteri, dimana
dengan meningkatnya sisi bioaktif dari selulosa bakteri maka akan meningkatkan
kemampuan dari selulosa bakteri tersebut untuk digunakan sebagai komponen
bioaktif dari suatu material sementara untuk merawat luka (Ciechańska, 2004). Berdasarkan sifat dari kitosan yang menguntungkan, maka kombinasi dari
selulosa-kitosan dapat saling menutupi kelemahan masing-masing dan
memberikan efek yang diharapkan.
Seiring adanya penambahan kitosan pada selulosa bakteri seringkali
membuat lapisan komposit selulosa kitosan menjadi rapuh (Mourya dan Inamdar,
2008). Untuk mengatasi kekurangan tersebut, ditambahkan bahan pemlastis
seperti gliserol. Gliserol dapat digunakan karena sifat pemlastisnya, efisiensi
pemlastis yang baik, mudah diperoleh, serta biaya produksi yang rendah (Epure,
Griffon, Pollet dan Averous, 2011)
Penelitian ini merupakan suatu penelitian untuk penemuan polimer
rambat sebagai material penutup luka.Sebagai material penutup luka, biomaterial
ini diuji aktivitas anti mikrobanya terhadap Staphylococcus aureus.
1. Rumusan masalah
a. Bagaimana karakteristik (gugus fungsi, struktur morfologi, dan
kristanilitas) biomaterial selulosa bakteri dari limbah ketela rambat dengan
penambahan kitosan dan gliserol?
b. Bagaimana aktivitas anti mikroba biomaterial selulosa bakteri dari limbah
ketela rambat dengan penambahan kitosan dan gliserol terhadap
Staphylococcus aureus dilihat dari % daya hambat?
2. Keaslian penelitian
Penelitian yang terkait dengan “Aktivitas Antimikroba Sediaan Biomaterial Selulosa Bakteri dari Limbah Ketela Rambat (Ipomoea Batatas
Poir) dengan Penambahan Kitosan terhadap Staphylococcus aureus” pernah
dilakukan oleh Seiichi Tokura (2008) dengan judul “Impregnation of silver
nanopartikel into bacterial cellulose for antimicrobial wound dressing”
dimana pada penelitian ini, didapatkan hasil bahwa nanopartikel yang
dimasukkan dalam selulosa bakteri memberikan aktivitas antimikroba
terhadap Staphylococcus aureus. Namun penelitian yang menggunakan
limbah ketela rambat sebagai bahan dasar selulosa bakteri ditambahkan
kitosan untuk pengujian anti mikroba sejauh yang peneliti ketahui belum
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memperkaya ilmu
pengetahuan tentang pembuatan biomaterial selulosa bakteri dari limbah
rumah tangga untuk keperluan biomedis.
b. Manfaat metodologis. Penelitian ini diharapkan dapat menjadi salah satu
metode pengembangan selulosa bakteri sebagai penutup luka dari
limbah-limbah yang tidak digunakan.
c. Manfaat praktis. Penelitian ini diharapkan dapat menjadi alternatif penutup
luka yang dibuat dari limbah ketela rambat (Ipomoea batatas Poir) yang
bersifat ramah lingkungan.
B. Tujuan
1. Penelitian ini bertujuan untuk mengetahui karakteristik (gugus fungsi,
morfologi permukaan, dan kristanilitas) biomaterial selulosa bakteri dari
limbah ketela rambat dengan penambahan kitosan dan gliserol.
2. Penelitian ini bertujuan untuk mengetahui aktivitas anti mikroba biomaterial
selulosa bakteri dari limbah ketela rambat dengan penambahan kitosan pada
BAB II
PENELAAHAN PUSTAKA
A. Ketela Rambat 1. Sistematika tanaman
Klasifikasi tanaman ketela rambat menurut web www.plantamor.com sebagai
berikut :
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Asteridae
Ordo : Solanales
Famili :Convolvulaceae(suku kangkung-kangkungan)
Genus :Ipomoea
Spesies :Ipomoea batatasPoir
2. Nama tanaman
Nama tanaman ketela rambat dapat dibedakan menurut Anonim (2012) :
Nama Inggris : Sweet potato
Nama Indonesia : Ubi jalar, ketela rambat
Common name : Ubi keledek (Melayu), Phak man thet (Thailand), Kamote
(Filipina), Satsumaimo (Jepang).
3. Kandungan kimia
Kandungan kimia pada ketela rambat adalah protein, lemak, karbohidrat,
kalori, serat, abu, kalsium, fosfor, zat besi, karoten, vitamin B1, B2, C, dan
asam nikotinat, pati, sukrosa, dan selulosa. Efek farmakologisnya berkhasiat
sebagai tonik, menghentikan perdarahan. Bagian yang bisa dimanfaatkan
adalah ubi dan daun (Rukmana, 1997). Ketela rambat memiliki kadar air yang
cukup tinggi berkisar 61,2-89,0% (b/b) sehingga bahan kering yang
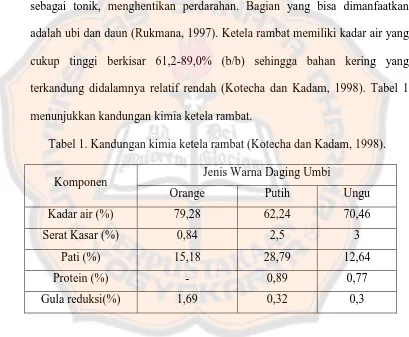
terkandung didalamnya relatif rendah (Kotecha dan Kadam, 1998). Tabel 1
menunjukkan kandungan kimia ketela rambat.
Tabel 1. Kandungan kimia ketela rambat (Kotecha dan Kadam, 1998).
Komponen Jenis Warna Daging Umbi
Orange Putih Ungu
Ketela rambat merupakan tanaman dikotil yang terdiri tidak kurang dari
400 spesies. Tanaman ini merupakan salah satu penghasil karbohidrat, vitamin
dan mineral (Damanhuri et al, 2005). Ketela rambat merupakan tanaman
ujung runcing, tidak berbulu, lubak, hijau sampai ungu, lebar 5-15 cm,
panjang tangkai 5-30 cm. Bunga ungu muda, bentuk corong, buah
diameternya 8 mm, tidak berbulu, berbiji empat dengan warna hitam,
bersudut, dan panjang 3 mm. Umbi berwarna putih, ungu, kuning, orange
dengan kulit putih atau ungu ( Rukmana, 1997).
B. Pati
Pati merupakan homopolimer glukosa dengan ikatan α- glikosidik yang
tersusun atas atom-atom karbon, hidrogen dan oksigen dengan perbandingan :
6:10:5 (C6H10O5)n. Pati merupakan polimer kondensasi dari suatu glukosa yang
tersusun dari unit-unit anhidroglukosa (Damanhuri et al. 2005).
Pati terdiri dari 2 fraksi yang dapat dipisahkan dengan air panas. Fraksi
terlarut disebut amilosa dan fraksi yang tidak larut disebut amilopektin. Amilosa
merupakan polimer linier yang mengandung 500-2000 unit glukosa yang terikat
oleh ikatan α-(1,4) sedangkan amilopektin selain mengandung ikatan α-(1,4) juga mengandung ikatan α-(1,6) sebagai titik percabangannya (Sukadarti et al. 2001). Hidrolisis lengkap amilosa meghasilkan hanya D-Glukosa; hidrolisis parsial
menghasilkan maltose sebagai satu-satunya disakarida. Molekul amilosa dan
amilopektin dapat dilihat pada Gambar 1 dan Gambar 2.
Gambar 1. Struktur molekul amilosa
Gambar 2. Struktur molekul amilopektin
(Sukadarti et al. 2001)
Tidak seperti amilosa, amilopektin bercabang sehingga terdapat satu
glukosa ujung kira-kira tiap 25 satuan glukosa. Ikatan pada titik percabangan ialah
ikatan 1,6-α-glikosida (Sukadarti et al. 2001). Hidrolisis lengkap amilopektin hanya menghasilkan D-glukosa. Namun hidrolisis tak lengkap menghasilkan
suatu campuran disakarida maltosa dan isomaltosa, yang kedua ini berasal dari
percabangan-1,6 (Sukadarti et al. 2001).
C. Selulosa Bakteri
Selulosa merupakan material yang terdapat secara alamiah pada kayu,
kapas, rami serta tumbuhan lainnnya. Selulosa juga merupakan polimer dari β -glukosa dengan ikatan β- 1-4 antara unit-unit glukosa (Hoenich, 2006). Struktur selulosa dapat dilihat dari Gambar 3 :
Gambar 3. Struktur selulosa
Selulosa bakteri adalah selulosa yang diproduksi oleh mikroba terutama
bakteri dari galur Acetobacter, Rhizobium, Agrobacterium dan Sarcina (El-Saied
et al. 2004). Selulosa bakteri memiliki karakteristik yaitu, mengandung air
sebanyak 98-99%, tidak menimbulkan reaksi alergi, dapat disterilisasikan tanpa
menyebabkan perubahan pada selulosanya. Dapat diaplikasikan untuk pengobatan
ketika kulit mengalami luka bakar. Selulosa bakteri disintesis oleh bakteri asam,
terutama Acetobacter xylinum (Ciechanska, 2004). Pembentukan selulosa bakteri
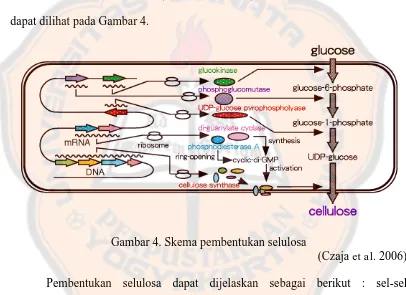
dapat dilihat pada Gambar 4.
Gambar 4. Skema pembentukan selulosa
(Czaja et al. 2006)
Pembentukan selulosa dapat dijelaskan sebagai berikut : sel-sel
Acetobacter xylinum mengambil glukosa dari larutan gula dan air limbah ubi jalar
yang kemudian digabungkan dengan asam lemak menjadi prekursor (penciri
nata). Pada membran sel prekursor ini selanjutnya dikeluarkan dalam bentuk
ekskresi dan bersama-sama dengan enzim akan mempolimerisasikan glukosa
Selulosa bakteri berbeda dari selulosa tanaman dalam hal kemurnian,
kristalinitas, derajat polimerisasi, dan tensile strength. Selulosa bakteri memiliki
bentuk Kristal Iα dan Iβ, sedangkan selulosa tanaman hanya memiliki struktur Kristal Iβ (Attala et al. 1984). Menurut Czaja et al. (2006) selulosa bakteri memiliki keunggulan antara lain : kemurnian tinggi, derajat kristalinitas tinggi,
mempunyai kerapatan antara 300-900 kg/m3, kekuatan tarik tinggi, elastic dan
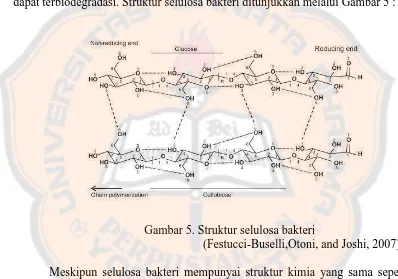
dapat terbiodegradasi. Struktur selulosa bakteri ditunjukkan melalui Gambar 5 :
Gambar 5. Struktur selulosa bakteri
(Festucci-Buselli,Otoni, and Joshi, 2007)
Meskipun selulosa bakteri mempunyai struktur kimia yang sama seperti
selulosa yang berasal dari tumbuhan, selulosa bakteri tersusun oleh serat selulosa
yang lebih baik yang dihasilkan oleh bakteri. Setiap serat tunggal dari selulosa
bakteri mempunyai diameter 50 nm, dan selulosa bakteri terdapat dalam bentuk
kumpulan serat-serat tunggal yang berdiameter sekitar 0,1-0,2 nm. Panjang
saling melilit satu sama lain membentuk struktur jaringan. Diameter dari selulosa
bentuk kristalin adalah 10–30 nm (Philips dan Williams, 2000).
D. Aplikasi Selulosa Bakteri dalam Bidang Medis
Selulosa mikrobial yang disintesis oleh Acetobacter xylinum menunjukkan
kinerja yang cukup baik untuk dapat digunakan dalam penyembuhan luka.
Selulosa bakteri juga mempunyai kerangka jaringan yang sangat baik dan
hidrofilisitas yang tinggi sehingga dapat digunakan sebagai pembuluh darah
buatan yang sesuai untuk pembedahan mikro (Hoenich, 2006).
Selulosa bakteri menunjukkan kandungan air yang tinggi (98-99%), daya
serap yang baik terhadap cairan, bersifat non-allergenik dan dapat disterilisasi
tanpa mempengaruhi karakteristik dari bahan tersebut. Selulosa bakteri dapat
digunakan sebagai pengganti kulit untuk merawat luka bakar yang serius karena
karakteristiknya yang mirip seperti kulit manusia. (Ciechanska, 2004).
Penutup luka yang ideal menurut Eldin, Soliman, Hashem dan Tamer
(2008) serta Czaja et al. (2006) adalah sebagai berikut. Menyediakan lingkungan
yang lembab bagi luka / permukaan penutup luka, melindungi luka secara fisik
dari infeksi bakteri, steril, murah dan mudah digunakan, menyerap kelebihan
eksudat tanpa kebocoran di permukaan penutup luka, menyerap bau luka,
melindungi luka secara mekanik dan suhu, mampu menyediakan pori-pori yang
digunakan untuk sirkulasi pergantian udara dan cairan, secara signifikan
mengurangi rasa nyeri pada luka, tidak toksik, tidak mengandung pirogen, tidak
medis, tidak menempel di luka dan ketika dilepas tidak menyebabkan rasa nyeri
atau trauma pada luka.
E. Acetobacter xylinum
Bakteri Acetobacter xylinum berbentuk elips atau tongkat yang
melengkung, memiliki lebar 0,5-1 µm dan panjang 2-10 µm. Acetobacter
merupakan bakteri aerob, yang memerlukan respirasi dalam metabolisme. Bakteri
Acetobacter xylinum mampu mengoksidasi glukosa menjadi asam glukonat dan
asam organik lain pada waktu yang sama. Sifat yang paling menonjol dari bakteri
itu adalah memiliki kemampuan untuk mempolimerisasi glukosa menjadi
selulosa. Acetobacter dapat mengoksidasi etanol menjadi asam asetat, juga dapat
mengoksidasi asetat dan laktat menjadi CO2 dan H2O (Warisno, 2004).
Acetobacter xylinum menghasilkan selulosa sebagai produk metabolit
sekunder, sedangkan produk metabolit primernya adalah asam asetat. Semakin
banyak kadar nutrisi, semakin besar kemampuan menumbuhkan bakteri tersebut
maka semakin banyak selulosa yang terbentuk (Çoban dan Biyik, 2011)
Acetobacter xylinum mampu mensintesis selulosa dari gula yang
dikonsumsi. Nata yang dihasilkan berupa pelikel yang mengambang dipermukaan
substrat. Untuk dapat menghasilkan massa yang kokoh, kenyal, tebal, putih dan
tembus pandang, perlu diperhatikan suhu inkubasi, komposisi, dan pH medium
(Warisno, 2004).
Beberapa faktor menurut Warisno (2004) yang mempengaruhi pertumbuhan
a) Sumber karbon
Sumber karbon yang dapat digunakan dalam fermentasi nata adalah
senyawa karbohidrat yang tergolong monosakarida dan disakarida.
Pembentukan nata dapat terjadi pada media yang mengandung senyawa – senyawa glukosa, sukrosa, dan laktosa. Sementara yang paling banyak
digunakan berdasarkan pertimbangan ekonomis, adalah sukrosa atau gula
pasir.
b) Sumber nitrogen
Sumber nitrogen yang dapat digunakan dapat berupa ekstrak yeast dan
kasein. Sumber nitrogen lainnya yang dapat digunakan atas dasar alasan
ekonomis adalah urea, dan ammonium fosfat.
c) Tingkat keasaman (pH)
Meskipun bisa tumbuh pada kisaran pH 3,5 – 7,5 , bakteri Acetobacter xylinum sangat cocok tumbuh pada suasana asam (pH 4,3). Jika kondisi
lingkungan dalam suasana basa, bakteri ini akan mengalami gangguan
metabolisme selnya.
d) Temperatur
Adapun suhu ideal (optimal) bagi pertumbuhan bakteri Acetobacter
xylinum adalah 280C – 310C. Kisaran suhu tersebut merupakan suhu kamar. Pada suhu di bawah 280C, pertumbuhan bakteri terhambat. Suhu
diatas 310C, bibit nata akan mengalami kerusakan dan bahkan mati,
meskipun enzim ekstraseluler yang telah dihasilkan tetap bekerja
F. Staphylococcus aureus
Bakteri adalah sel prokariotik tanpa klorofil yang khas, dan bersel tunggal
(uniseluler). Bahan sel bakteri (sitoplasma dan intinya) dikelilingi oleh membran
sitoplasma yang berfungsi mengendalikan keluar masuknya suatu bahan ke dalam
sel. Bagian luar yang menutupi membran sitoplasma ialah dinding sel yang kaku
yang mengandung peptidoglikan. Staphylococcus aureus merupakah salah satu
bakteri gram positif yang ditemukan saat kulit mengalami luka/infeksi (Lay dan
Sugyo 1992).
Ciri bakteri gram positif adalah : memiliki struktur yang tebal (15-80 nm);
dinding sel berlapis tunggal; memiliki kandungan lipid yang rendah (1-4%);
dinding sel terdiri dari peptidoglikan yang lebih dari 50% bobot kering, ada asam
teikoat (Pelczar dan Chan, 1986)
Peptidoglikan adalah suatu polimer yang terdiri dari tiga macam bahan
pembangun, yaitu asam N-asetil-glukosamin (NAG), Asam N-Asetil-Muramat
(NAM) dan suatu peptida yang terdiri dari empat sampai lima asam amino, yaitu
L-Alanin, D-Alanin, asam D-Glutamat dan Lisin atau diamino tinelat.
Peptidoglikan ini memberikan bentuk dan kakunya dinding sel (Lay dan Sugyo
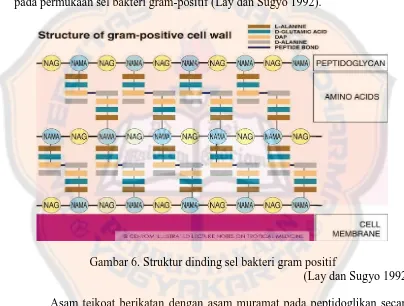
1992). Dinding sel bakteri gram positif dapat dilihat pada Gambar 6.
Susunan kimiawi dari peptidoglikan khas untuk masing-masing bakteri
NAG dan NAM merupakan komponen tetap, akan tetapi keragaman ada pada
asam amino yang ada dan sifat ikatannya. Pelczar dan Chan (1986) menjelaskan
dua kelompok berdasarkan respon yang berbeda terhadap pewarnaan Gram, yaitu
bakteri Gram positif dan Gram negatif
Bakteri gram-positif memiliki kandungan peptidoglikan yang tinggi
dibandingkan dengan bakteri gram-negatif. Bakteri gram-positif memiliki asam
teikoat, polimer yang bersifat asam yang mengandung ribitol fosfat atau gliserol
fosfat. Asam teikoat ini bermuatan negatif, sehingga menyebabkan muatan negatif
pada permukaan sel bakteri gram-positif (Lay dan Sugyo 1992).
Gambar 6. Struktur dinding sel bakteri gram positif
(Lay dan Sugyo 1992)
Asam teikoat berikatan dengan asam muramat pada peptidoglikan secara
kovalen. Adanya gugus fosfat dari asam teikoat, membuat asam teikoat
bermuatan negatif. Sehingga asam teikoat ini berperan dalam menjaga
keseimbangan dinding sel bakteri gram positif dengan memberikan muatan
G. Kitosan
Kitosan merupakan polimer linier yang tersusun oleh 2000-3000 monomer
N-asetil-D-glukosamin dalam ikatan β-(1-4), tidak toksik dengan LD50 setara
dengan 16 g/kg BB dan mempunyai berat molekul 800 KDa. (Muzzarelli, 1997;
Shahidi, Arachchi, dan Jeon, 1999). Kitosan merupakan senyawa kitin yang sudah
mengalami deasetilasi. Kitosan merupakan komponen mayoritas yang menyusun
dinding sel dari jamur tertentu, terutama spesies Zygomycetes. Sekarang ini
kitosan telah diproduksi secara komersial melalui deasetilasi kitin yang diperoleh
dari crustaceae (Muzzarelli, 1997). Gambar 7 menunjukkan struktur dari kitosan.
Gambar 7. Struktur kitosan (Kumar, 2004)
Kitosan memiliki sifat biodegradable dan biokompatibel, tidak
mengandung racun dan banyak digunakan dalam industri. Kitosan dan turunannya
merupakan antimikroba alami dan beberapa studi telah membuktikan kemampuan
kitosan sebagai antimikroba (Jin Xiaoxiao, Wang, dan Bai, 2009).
Pelzcar dan Chan (1986) mengungkapkan mekanisme penghambatan
senyawa antimikroba yaitu, (1) menghambat sintesis dinding sel; (2)
menghambat keutuhan permeabilitas membran sitoplasma, sehingga terjadi
metabolisme sel dengan menghambat kerja enzim intraseluler; dan (5)
menghambat sintesis protein yang menyebabkan kerusakan total sel.
Kitosan memiliki reaktivitas kimia yang baik karena mempunyai sejumlah
gugus hidroksil (OH) dan gugus amin (NH2) pada rantainya. Kitosan adalah
contoh polisakarida yang bersifat basa dan merupakan suatu heteropolimer
(Kumar, 2004).
H. Karakteristik Kitosan
Kitosan merupakan padatan putih yang tidak larut dalam air, pelarut
organik, alkali, dan asam mineral, dalam berbagai kondisi. Kitosan larut dalam
asam formiat, asam asetat, dan asam organik lainnya dalam keadaan dipanaskan
sambil diaduk. Kitosan larut dalam asam mineral pekat, apabila dalam kondisi
yang bagus diperoleh dalam bentuk endapan. Namun dengan asam nitrat, kitosan
yang terbentuk adalah kitosan nitrat yang sukar larut. Pelarut yang paling sering
digunakan adalah asam asetat. Kelarutan kitosan yang paling baik adalah dalam
larutan asam asetat 2% (Nadarajah, 2005)
Parameter lain yang berpengaruh pada sifat kitosan adalah berat molekul
(BM) dan derajat deasetilasi (DD). Derajat deasetilasi menunjukkan berkurangnya
gugus asetil dari kitin menjadi gugus amino pada kitosan. Penentuan DD dapat
dilakukan dengan beberapa metode, seperti titrimetri HBr, spektroskopi IR, X-Ray
Diffraction dan spektroskopi 1H NMR. Penentuan DD dengan spektroskopi IR
dilakukan dengan metode base line. Berikut ini rumus untuk perhitungan DD
seperti ditunjukkan oleh Persamaan 1.
DD = 100 – �1655
�3450 � 100
Keterangan:
DD = Derajat Deasetilasi
A1655 = absorbansi pada bilangan gelombang 1655 cm-1 yang menunjukkan
serapan karbonil dari amida.
A3450 = absorbansi pada bilangan gelombang 3450 cm-1 yang menunjukkan
serapan hidroksil dan digunakan sebagai standar internal.
Faktor 1,33 merupakan nilai perbandingan �1655
�3450 untuk kitosan terdeasetilasi 100% (Khan, Peh dan Chang, 2002).
I. Gliserol
Gliserol adalah senyawa poliol netral, dengan rasa manis, tidak berwarna,
cairan kental dengan titik lebur 200 C dan memiliki titik didih yang tinggi yaitu
2900 C. Gliserol dapat larut sempurna dalam air dan alkohol, tetapi tidak dalam
minyak. Sebaliknya banyak zat dapat lebih mudah larut dalam gliserol dibanding
dalam air maupun alkohol. Oleh karena itu gliserol merupakan pelarut yang baik
(Goudung, 2004).
Senyawa poliol banyak digunakan sebagai pemlastis maupun pemantap.
Senyawa poliol ini dapat diperoleh dari hasil industri petrokimia, maupun
langsung dari transformasi minyak nabati dan olahan industri oleokimia.
Dibandingkan dengan hasil industri petrokimia, senyawa poliol dari minyak
nabati dan industri oleokimia dapat diperbaharui, sumbernya mudah diperoleh,
dan juga akrab dengan lingkungan karena mudah terdegradasi dalam alam
J. Analisis Gugus Fungsi dengan Spektofotometri Infra Merah
Analisis kualitatif, dilakukan untuk mengetahui ada atau tidaknya absorbsi
pada frekuensi tertentu dan merupakan penanda ada tidaknya gugus fungsional
tertentu. Penggunaan spektrofotometri infra merah pada bidang kimia organik
menggunakan daerah dari 650-4000 cm-1 (15,4-2,5 μm) (Sastrohamidjojo, 2007). Gugus fungsional dalam molekul dianalisis secara kualitatif dengan
melihat bentuk spektrumnya yaitu dengan melihat puncak spesifik yang
menunjukkan jenis gugus funsgional. Analisis secara kuantitatif dilakukan
berdasarkan hukum Lambert-Beer, ditunjukkan pada Persamaan 2.
A = log (Io/I) = a x c x l……….(2) Keterangan :
A = absorbansi
Io = intensitas sinar masuk
I = Intensitas sinar yang ditransmisikan
a = koefisien absorpsi (M-1 cm-1)
c = konsentrasi zat (M)
l = panjang lintasan (cm)
Untuk mengoreksi kesalahan yang timbul akibat adanya overlap puncak
absorpsi, maka garis dasar (base line) dalam spektrum infra merah harus dibuat
seperti ditunjukkan pada Gambar 9, I dan Io ditentukan sebagai intesitas transmisi
pada garis dasar. Absorbansi (A) pada frekuensi yang diberikan (dalam cm-1)
terlihat pada Persamaan 3.
Keterangan :
AC= Io = intensitas sinar masuk
AB= I = intensitas sinar yang ditransmisikan
AC dan AB ditentukan dari spektrum infra merah seperti ditunjukkan pada
Gambar 8.
Gambar 8. Metode mengkonstruksi garis dasar dalam spektrum infra merah
(Sastrohamidjojo, 2007)
Gambar 9 menunjukkan karakteristik serapan dari selulosa bakteri
menunjukkan puncak di sekitar daerah 3350 cm-1 yang menunjukkan O-H
stretching dan di sekitar daerah 2916,81 cm-1 yang menunjukkan CH stretching.
Adanya pita di sekitar daerah 1649,8 cm-1 yang menunjukkan deformasi vibrasi
dari molekul air yang terabsorbsi (Wonga, Kasapis dan Tan, 2009). Adapun
karakteristik serapan dari kitosan ditunjukkan dengan puncak di sekitar 1559,17
cm-1 yang menunjukkan vibrasi stretching dari gugus amino kitosandan di sekitar
daerah 1333,5 cm-1 yang menunjukkan vibrasi dari C-H. Adanya pita di sekitar
3367,1 cm-1 menunjukkan vibrasi simetrik dari amina NH. Adanya puncak di
daerah 896,73 cm-1 dan 1154,19 cm-1 berkaitan dengan struktur sakarida dari
kitosan. Adanya puncak yang melebar di sekitar daerah 1080,91 cm-1
menunjukkan vibrasi stretching C-O (de Souza Costa-Junior, Pereira dan Mansur,
2009; Rao, Naidu, Subha, Sairam dan Aminabhavi, 2006). Gambar 9
menunjukkan contoh spektra inframerah dari selulosa bakteri dan kitosan.
Gambar 9. Spektra inframerah dari selulosa bakteri dan kitosan
(Anicuta, Dobre, Stroescu dan Jipa, 2010)
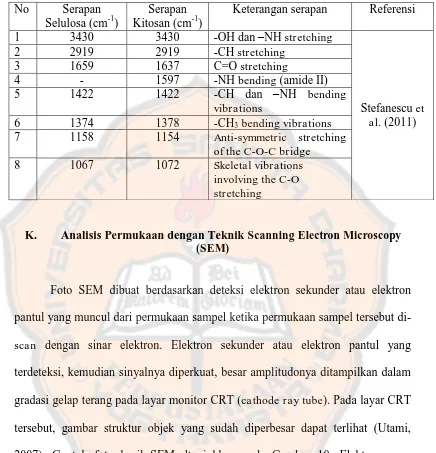
Berdasarkan Gambar 9 dapat dikorelasikan untuk memudahkan dalam
pembacaan gugus-gugus fungsi dari spectra inframerah yang didapatkan. Hasil
korelasi disajikan pada Tabel II.
Selulosa Bakteri
Tabel II. Hasil korelasi gugus fungsi
7 1158 1154 Anti-symmetric stretching of the C-O-C bridge
8 1067 1072 Skeletal vibrations involving the C-O stretching
K. Analisis Permukaan dengan Teknik Scanning Electron Microscopy (SEM)
Foto SEM dibuat berdasarkan deteksi elektron sekunder atau elektron
pantul yang muncul dari permukaan sampel ketika permukaan sampel tersebut
di-scan dengan sinar elektron. Elektron sekunder atau elektron pantul yang
terdeteksi, kemudian sinyalnya diperkuat, besar amplitudonya ditampilkan dalam
gradasi gelap terang pada layar monitor CRT (cathode ray tube). Pada layar CRT
tersebut, gambar struktur objek yang sudah diperbesar dapat terlihat (Utami,
2007). Contoh foto hasil SEM dtunjukkan pada Gambar 10. Elektron yang
berinteraksi dengan atom akan memproduksi sinyal berupa informasi mengenai
topografi permukaan sampel, komposisi, dan lainnya. Membrane selulosa bakteri
secara umum akan berbentuk jalinan pita yang halus (Gambar 10). Pengamatan
morfologi permukaan terhadap membrane kitosan, akan menunjukkan hasil
Gambar 10. Foto SEM Selulosa bakteri
(Freire, Silvestre, Gandini dan Neto, 2011)
L. Analisis kristalinitas dengan Difraksi Sinar X (XRD)
Difraksi sinar X merupakan metode analisis yang didasarkan pada
hamburan cahaya pada kisi kristal yang dikenai sinar X. Teknik ini
memungkinkan determinasi derajat kristalinitas sampel beserta data kristalografik
lainnya (Braun, et al. 2005).
Derajat kristalinitas dari suatu polimer akan mempengaruhi aktivitas
polimer tersebut, selain itu derajat kristalinitas berhubungan dengan struktur rantai
polimer. Semakin linier rantai polimer maka derajat kristalinitasnya akan semakin
besar, sehingga bersifat semakin kristalin, sebaliknya apabila strukturnya
bercabang maka akan cenderung bersifat amorf. XRD sangat penting untuk
analisis polimer karena XRD dapat memperlihatkan indeks dari struktur kristal,
dan derajat kristalinitas (Rosida, 2007).
Menurut Anggraeni (2003), derajat kristalinitas dapat ditentukan dengan
cara menghitung perbandingan luas difraksi kristalin terhadap luas total difraksi
(amorf dan kristalin) seperti ditunjukkan oleh Persamaan 4.
Derajat kristanilitas = Luas kristalin
Contoh hasil difraksi sinar-X dari selulosa dan kitosan dapat dilihat dari
Gambar 11.
Gambar 11. Difraktogram XRD dari selulosa bakteri dan kitosan
(Stefanescu et al.,2012)
M. Antibakteri
Antibakteri diartikan sebagai zat yang dapat menggangu pertumbuhan dan
metabolisme bakteri (Pelzcar dan Chan, 1986). Berdasarkan aktivitasnya, zat
antibakteri dibedakan menjadi dua, yaitu yang memiliki aktivitas membunuh yang
dikenal dengan bakterisidal seperti penisilin, basitrasin, dan neomisin, dan yang
memiliki aktivitas menghambat pertumbuhan atau dikenal dengan bakteriostatik
seperti tetrasiklin, kloramfenikol, dan novobiosin (Pelzcar & Chan 1986).
Penggolongan antibiotika/antibakteri berdasarkan cara kerjanya terhadap
bakteri menurut Lüllmann, Mohr, Hein & Bieger (2005) adalah sebagai berikut :
a. Antibiotika yang bekerja dengan menghambat sintesis dinding sel bakteri,
misalnya penisilin, sefalosporin, carbapenem, basitrasin, vankomisin,
b. Antibiotika yang mengganggu keutuhan membran sel mikroba, yang
termasuk kelompok ini adalah polimiksin, golongan polien serta berbagai
antibakteri kemoterapetik.
c. Antibiotika yang bekerja dengan menghambat sintesa protein, yang
termasuk golongan ini adalah kloramfenikol, eritromisin, linkomisin,
tetrasiklin dan antibiotika golongan aminoglikosida.
Penggolongan antibiotika berdasarkan gugus kimanya menurut Katzung
(2007) adalah sebagai berikut :
a. Senyawa Beta-laktam dan Penghambat Sintesis Dinding Sel Lainnya.
Mekanisme aksi penisilin dan antibiotika yang mempunyai struktur mirip
dengan β-laktam adalah menghambat pertumbuhan bakteri melalui pengaruhnya terhadap sintesis dinding sel. Dinding sel ini tidak ditemukan
pada sel-sel tubuh manusia dan hewan, antara lain: golongan penisilin,
sefalosporin dan sefamisin serta betalaktam lainnya.
b. Kloramfenikol, Tetrasiklin, Makrolida, Clindamisin dan Streptogramin.
Golongan agen ini berperan dalam penghambatan sintesis protein bakteri
dengan cara mengikat dan mengganggu ribosom, antara lain:
kloramfenikol, tetrasiklin, makrolida, klindamisin, streptogramin,
oksazolidinon.
c. Aminoglikosida
Golongan Aminoglikosida, antara lain: streptomisin, neomisin, kanamisin,
amikasin, gentamisin, tobramisin, sisomicin, etilmicin, dan lain-lain.
N. Pengujian Aktivitas Antimikroba
Menurut Pelzcar dan Chan (1986) terdapat dua cara pengujian antibakteri,
yaitu teknik dilusi dan teknik difusi. Teknik dilusi yaitu dengan mencampur zat
antibakteri dengan medium yang kemudian diinokulasi dengan bakteri uji. Dasar
pengamatannya adalah dengan melihat tumbuh tidaknya bakteri uji tersebut. Ada
2 cara teknik dilusi, yaitu cara penipisan lempeng agar dan cara pengenceran
tabung. Pada teknik difusi, zat yang akan ditentukan aktivitas antibakterinya
berdifusi pada lempeng agar yang telah ditanami bakteri. Dasar pengamatannya
adalah ada atau tidaknya zona hambatan pertumbuhan bakteri. Teknik difusi ini
ada 3 macam cara, yaitu cara parit (ditch), cara lubang/cawan (hole/cup) dan cara
cakram (disc).
Todar (1997) mengemukakan bahwa ketentuan kekuatan
antibiotik-antibakteri antara lain, daerah hambatan 20 mm atau lebih berarti sangat kuat,
daerah hambatan 10 sampai 20 mm berarti kuat, daerah hambatan 5 sampai 10
mm berarti sedang, dan daerah hambatan 5 mm atau kurang berarti lemah.
O. Landasan Teori
Selulosa bakteri dapat dibuat dari bahan dasar limbah ketela rambat
melalui proses fermentasi yang dilakukan oleh bakteri Actobacter xylinum.
Selulosa bakteri ini memiliki sifat bioaktif dimana dapat digunakan sebagai
perawatan sementara untuk luka bakar. Kelemahan selulosa bakteri ini adalah
mudah menyerap air dari lingkungan sekitar sehingga kemungkinan bakteri lain
modifikasi pada selulosa bakteri dengan menambahkan bahan lain tertentu, salah
satunya adalah kitosan.
Kitosan sendiri ini bersifat sebagai bakteriostatik serta mempercepat
regenerasi sel pada kulit yang rusak. Penambahan kitosan ini diharapkan dapat
meningkatan sifat bioaktif dari selulosa bakteri. Untuk mengetahui karakterisasi
membran yang terbentuk maka dilakukan analisis karakteristik membran yang
meliputi analisis gugus fungsi, serta analisis permukaan membran. Untuk
mengetahui nilai aktivitas antimikroba dari membran (selulosa,
selulosa+kitosan+gliserol, kitosan) maka dilakukan pengujian dengan metode
difusi cakram (disk), sehingga dapat memberikan nilai aktivitas antimikroba
selulosa bakteri terhadap Staphylococcus aureus yang dapat teramati dari % daya
hambat.
P. Hipotesis
1. Selulosa bakteri dapat dibuat dengan bahan air cucian ketela rambat, dan dapat
dimodifikasi dengan penambahan kitosan, serta memiliki karakteristik (gugus
fungsi, morfologi permukaan, dan kristalinitas) yang berbeda dibandingkan
selulosa bakteri tanpa modifikasi..
2. Modifikasi selulosa bakteri dengan penambahan kitosan akan memberikan
aktivititas antimikroba.
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan jenis penelitian yang bersifat eksperimental murni
dengan rancangan pola searah.
B. Variabel Penelitian
Variabel dalam penelitian ini terdapat dua variabel, yaitu :
1. Variabel utama
Variabel utama dalam penelitian ini meliputi :
a. Variabel bebas : Konsentrasi kitosan yang ditambahkan dalam
preparasi sediaan biomaterial selulosa bakteri.
b. Variabel tergantung
1) Karakteristik biomaterial yang dihasilkan (gugus fungsi, morfologi
permukaan, serta kristalinitas)
2) Diameter zona hambat yang dihasilkan oleh biomaterial selulosa
bakteri-kitosan terhadap pertumbuhan Staphylococcus aureus.
2. Variabel pengacau
Variabel pengacau dalam penelitian ini meliputi :
a. Variabel pengacau terkendali : tempat tumbuh tanaman, usia tanaman,
waktu panen, cara panen, media pertumbuhan bakteri Staphylococcus
b. Variabel pengacau tak terkendali : kelembaban dan kemurnian
kitosan, kondisi bakteri.
C. Definisi Operasional
1. Selulosa bakteri adalah polimerisasi glukosa yang merupakan hasil fermentasi
bakteri Acetobacter xylinum selama 7 hari.
2. Ketela rambat adalah ketela yang tumbuh merambat di atas tanah yang
memiliki varietas bermacam-macam. Pada penelitian ini ketela rambat yang
digunakan adalah ketela rambat dengan varietas berwarna putih.
3. Limbah ketela rambat adalah limbah cair yang dihasilkan dari proses
pencucian ketela rambat pada saat pembuatan tepung ketela rambat.
4. Kitosan adalah senyawa hasil deasetilasi chitin, terdiri dari unit N-asetil
glukosamin dan N-glukosamin.
5. Staphlococcus aureus ATCC 25923 merupakan bakteri gram positif yang
diperoleh dari Laboratorium Balai Kesehatan Yogyakarta.
6. Film adalah lembaran tipis dari biomaterial yang telah dikeringkan.
7. Metode difusi cakram adalah metode pengukuran daya hambat suatu bahan
obat terhadap mikroorganisme tertentu dengan mengukur zona radikal yang
terbentuk di sekeliling cakram.
8. Kristalinitas adalah nilai yang menyatakan perbandingan daerah kristal suatu
polimer dengan nilai kristal+amorf yang dapat menunjukkan keteraturan
9. Analisis struktur morfologi merupakan analisis untuk melihat bentuk
morfologi/kenampakan dari biomaterial baik kenampakan bentuk permukaan
maupun kenampakan bentuk melintang
D. Alat dan Bahan 1. Alat
Alat-alat yang digunakan dalam penelitian ini meliputi : Spektrofotometer
IR (IR Shimadzu Prestige-21), seperangkat instrumen SEM (Jeol JSM T300),
fine coat ion sputter (Jeol JFC 1100), alat XRD (Rigaku Multiflex 2 kW),
pH stik Merck, karet, kertas pembungkus, sendok, penggaris skala milimeter.
2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah air limbah
ketela rambat yang daging umbinya berwarna putih, kitosan kualitas teknis
dari Chemix, urea kualitas teknis dari p.a E.Merck, asam asetat 25% dari
p.a.E.Merck, alkohol 70 % kualitas teknis, asam asetat glasial kualitas teknis, gliserol kualitas teknis, NaOH kualitas p.a. buatan E.Merck, HCl kualitas p.a.
buatan E.Merck, glukosa, supratul, aquades, pH stik buatan E.Merck,
Mikrobiologi Balai Kesehatan Yogyakarta, kloramfenikol. media
Mueller-Hinton Agar (MHA), media Brain Heart Infusion broth (BHI broth), starter
Bakteri Acetobacter xylinum dari Chemix.
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman ketela rambat ini dilakukan dengan bantuan seorang
determinator. Cara determinasi dengan membandingkan ciri-ciri tanaman
ketela rambat yang ditumbuhkan sendiri dengan ciri-ciri tanaman ketela
rambat yang ada dalam web botani resmi (www.plantamor.com), serta
mencocokkan dengan buku deskripsi tanaman ketela rambat menurut Huaman
(1991).
2. Pemilihan bahan
Umbi ketela rambat yang dipilih adalah umbi berwarna putih, kulitnya
berwarna kekuningan, serta dengan kondisi yang baik, tidak belubang-lubang.
Masa panen 110 hari setelah penanaman. Umbi didapatkan di pasar Klaten.
3. Preparasi Limbah Ketela Rambat
Langkah-langkah yang dilakukan yaitu umbi dikupas, lalu dicuci sampai
bersih. Kemudian umbi ditimbang sebanyak 500 gram, dipotong kecil-kecil
lalu dimasukkan kedalam blender dan diberi air sebanyak 500 mL
(perbandingan umbi dengan air adalah 1:1. Lalu diblender hingga menjadi
bubur umbi (bentuk seperti jus). Lalu bubur umbi ini dimasukkan dalam kain
mori untuk disaring dan diperas agar pati lolos dari saringan sebagai suspensi
hasil penyaringan pertamanya langsung dipindahkan ke dalam botol plastik
sambil dibiarkan selama 3 jam agar pati yang belum mengendap ini
mengendap di dalam botol plastik. Cairan di atas endapan ini diambil untuk
proses pembuatan biomaterial.
4. Pembuatan Kitosan Sebagai Pembanding
Sejumlah 2 gram kitosan dilarutkan dalam 100 mL asam asetat 2% di atas
hot plate. Pada nampan yang sudah dicuci dengan alkohol 70% dan di oven,
kemudian larutan dituang dan diletakkan selama beberapa hari dalam ruangan
inkubasi untuk menjamin penguapan solven secara sempurna. Setelah
beberapa hari maka akan terbentuk produk membran yang transparan dan
fleksibel. Produk ini lalu disimpan dalam toples yang sudah diberi silika gel
sebelumnya (Eldin, Soliman, Hashem, Tamer, 2008)
5. Pembuatan Material Selulosa Bakteri
Sebanyak 200 mL air limbah ketela rambat hasil penyaringan dituangkan
ke dalam elenmeyer yang telah dilengkapi dengan magnetic stirer, kemudian
ditambahkan 20 gram gula pasir dan 1 gram urea, dan diaduk hingga larut.
Campuran diasamkan dengan penambahan asam asetat 25% hingga pH = 3-4,
diaduk hingga larut. Selanjutnya dituangkan dalam keadaan panas ke dalam
nampan yang telah disterilkan dengan alkohol 70% dan ditutup dengan kertas
koran dan diplester pada beberapa bagian nampan. Larutan dalam wadah
dibiarkan hingga suhu kamar, lalu ditambahkan 50 mL Acetobacter xylinum.
Setelah ditambahkan Acetobacter xylinum, nampan diplester pada semua sisi
Setelah 7-14 hari, lapisan pelikel yang terbentuk dicuci dengan aquabidest
untuk menghilangkan residu media kultur, lalu dengan air panas, lalu lapisan
pelikel ini ditimbang dengan timbangan digital. Setelah itu lapisan pelikel
direndam dengan natrium hidroksida 3% selama 48 jam. Setelah 48 jam,
lapisan pelikel dicuci kembali dengan aquadest, lalu direndam dengan asam
klorida 3% selama 15 menit. Setelah 15 menit, lapisan pelikel dicuci kembali
dengan aquadest hingga pH netral. Kemudian lapisan pelikel ditimbang, lalu
lapisan pelikel dikeringkan dalam oven pada suhu 40-500C. Setelah kering,
lapisan pelikel ini ditimbang, lalu dimasukkan dalam toples yang sudah diisi
silika gel sebelumnya. (Chawla, Bajaj, Survase, Singhal, 2008).
6. Pembuatan Material Selulosa Bakteri + Gliserol + Kitosan (SGK)
Sebanyak 200 mL air limbah ketela rambat hasil penyaringan dituangkan
ke dalam Elenmeyer yang telah dilengkapi dengan magnetic stirer, kemudian
ditambahkan 20 gram gula pasir dan 1 gram urea, dan 1.2 mL gliserol,
kemudian diaduk hingga larut. Campuran diasamkan dengan penambahan
asam asetat 25% hingga pH = 3-4, diaduk hingga larut. Selanjutnya
dituangkan dalam keadaan panas ke dalam nampan yang telah disterilkan
dengan alkohol 70% dan ditutup dengan kertas koran dan diplester pada
beberapa bagian nampan. Larutan dalam wadah dibiarkan hingga suhu kamar,
lalu ditambahkan 50 mL Acetobacter xylinum. Setelah ditambahkan
Acetobacter xylinum, nampan diplester pada semua sisi hingga tertutup rapat.
Lalu diinkubasi selama 7-14 hari pada suhu kamar. Setelah 7-14 hari, lapisan
media kultur, lalu dengan air panas, lalu lapisan pelikel ini ditimbang dengan
timbangan digital. Setelah itu lapisan pelikel direndam dengan natrium
hidroksida 3% selama 48 jam. Setelah 48 jam, lapisan pelikel dicuci kembali
dengan aquadest, lalu direndam dengan asam klorida 3% selama 15 menit.
Setelah 15 menit, lapisan pelikel dicuci kembali dengan aquadest hingga pH
netral. Kemudian ditambahkan 2 gram kitosan yang telah dilarutkan dalam
100 mL asam asetat 2% dalam keadaan panas ke dalam wadah yang terdapat
pelikel/membran selulosa bakteri. Pelikel kemudian dikeringkan dalam oven
pada suhu 40-500C . Setelah kering, membran selulosa+kitosan+gliserol ini
dimasukkan dalam toples yang berisi silika gel (Chawla et al. 2009).
7. Analisis Karakteristik Biomaterial :
a. Analisis sifat fisik secara makroskopis.
Analisis ini meliputi pengamatan dari warna, tekstur, bentuk dan
transparansi dari masing-masing sampel.
b. Analisis FT – IR
Analisis ini menggunakan seperangkat alat FTIR dan dilakukan di
Laboratorium Kimia Organik Fakultas MIPA UII. Langkah-langkahnya
adalah lapisan tipis atau pelikel yang diperoleh dari hasil fermentasi dijepit
pada tempat sampel kemudian diletakkan pada alat ke arah sinar
inframerah. Hasilnya akan direkam ke dalam kertas berskala berupa alur
b. Analisis SEM
Material selulosa kitosan bakteri dipotong sedemikian rupa,
kemudian ditempatkan di atas tempat sampel yang terbuat dari kuningan.
Sampel disepuh dengan dengan emas (coating) dengan alat ion coater
selama kurang lebih 5 menit. Selanjutnya sampel dimasukkan ke unit
elektron gun melalui bilik pergantian sampel. Kemudian sampel diset
dengan bantuan mikrostage sampai mendapatkan fokus yang tepat.
Tombol utama pada posisi ON dan diset detektor Accelerate voltage set,
20 kilo volt.
c. Analisis kristalinitas dengan alat X-ray Diffraction (XRD)
Uji XRD ini dilakukan dengan memakai instrumen X-Ray
Diffraction yang dilakukan di Laboratorium XRD, Jurusan Teknik
Geologi UGM. Langkah-langkahnya adalah lembaran film dipotong
dengan ukuran 2x2 cm. Sampel tersebut kemudian dipasang di sample
holder dan sampel diusahakan rata di atas sample holder. Selanjutnya
pendingin alat XRD dihidupkan dan instrumen XRD dihidupkan lalu
diatur kondisi alat dengan sudut putar 2θ = 2° sampai 80°, scan step = 0,04 dan scan speed = 4°/menit serta tegangan dan arus pada instrumen
disesuaikan dengan standard measurenment dari instrumen dan
dirotasikan agar benar-benar terorientasi secara acak. Hasil uji ini berupa
8. Sterilisasi produk
Produk biomaterial yang sudah dikeringkan ini lalu dibungkus dengan
kertas coklat lalu diautoklaf dengan suhu 1210 C selama 15 menit.
9. Pengujian aktivitas anti mikroba
1. Pembuatan suspensi bakteri uji
Isolat murni Staphylococcus aureus ditambahkan ke dalam media BHI
broth yang diinkubasi pada 37oC selama kurang lebih 4 jam sampai kekeruhan
Brain Heart Infusion broth (BHI broth) menyamai kekeruhannya McFarland
no. 0,5 (Christoforus, 2010).
2. Pembuatan media
Media yang digunakan untuk uji aktivitas antimikroba adalah MHA.
Larutan MHA dituangkan ke dalam cawan petri sebanyak 25 mL dan
dibiarkan beberapa saat hingga memadat (Christoforus, 2010).
3. Penanaman bakteri uji
Hasil suspensi bakteri uji sebanyak 0,2 mL dimasukkan ke dalam media
Mueller-Hinton Agar (MHA) dengan cara dioleskan secara merata dengan
menggunakan kapas kirbi bauer, lalu didiamkan kurang lebih selama 5 menit
(Christoforus, 2010).
4. Pemberian kontrol positif pada bakteri uji
Sebagai kontrol positif, digunakan antibiotik Amoxicilin. Bakteri uji yang
sudah ditanamkan pada Mueller-Hinton Agar kemudian diberi paper disk
berisi amoxicilin tadi sebanyak 1 disk per plate. Kemudian inkubasikan pada
5. Pemberian kontrol negatif pada bakteri uji
Sebagai kontrol negatif, digunakan asam asetat. Sebanyak 20 µ L asam
asetat diteteskan pada paper disk. Bakteri uji yang sudah ditanamkan pada
Mueller-Hinton Agar kemudian diberi paper disk berisi asam asetat tadi
sebanyak 1 disk per plate. Kemudian inkubasikan pada 37oC selama 24 jam.
6. Pemberian biomaterial selulosa, selulosa+kitosan+gliseral, dan kitosan pada
bakteri uji
Bakteri uji yang sudah ditanamkan pada Mueller-Hinton Agar kemudian
diberi potongan biomaterial selulosa yang sudah disterilisasi sebelumnya.
Biomaterial selulosa ini dipotong serupa dengan bentuk dan ukuran paper disk
yang bertindak sebagai kontrol positif dan kontrol negatif tadi. Diletakkan
sebanyak 1 potongan biomaterial per plate. Kemudian inkubasikan pada 37oC
selama 24 jam. Hal yang sama juga dilakukan untuk membran kitosan dan
selulosa bakteri+kitosan+gliserol.
7. Pengukuran zona hambat
Pengukuran zona hambat dilakukan dengan mengukur diameter zona
hambat dalam millimeter, kemudian dihitung persentase kekuatan aktivitas
daya hambat dihitung menggunakan rumus berikut :
% daya hambat = ..
(Ardhuha, dan Harapan, 2010). (diameter zona hambat zat uji – kontrol negatif)
(diameter zona hambat kontrol positif) positif)
F. Analisis Data
1.
Analisis karakteristik dari biomaterial yang terbentuk ini meliputi analisis sifatfisik secara makroskopik dan organoleptis, gugus fungsi, uji morfologi
permukaan, dan uji kristalinitas untuk membran kitosan, membran selulosa,
serta membran selulosa+kitosan+gliserol.
2. Analisis hasil untuk uji aktivitas anti mikroba dilakukan dengan mengukur
zona jernih yang muncul (zona hambat) menggunakan penggaris skala
milimeter, kemudian dihitung persentase daya hambat untuk setiap perlakuan
(biomaterial selulosa+kitosan+gliserol, membran kitosan, selulosa bakteri,
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mengetahui karakteristik biomaterial
selulosa bakteri dari limbah cair ketela rambat (Ipomoea batatas Poir) dengan
penambahan kitosan sebagai material penutup luka dan mengetahui aktivitas
antimikroba membran selulosa bakteri yang sudah ditambahkan kitosan. Aktivitas
antimikroba ini terlihat dari zona hambat yang terbentuk.
Penelitian ini merupakan suatu rangkaian penelitian untuk melihat
aktivitas biomaterial selulosa dari limbah cair ketela rambat yang sudah
dimodifikasi dengan penambahan kitosan terhadap Staphylococcus aureus.
Rangkaian penelitian lain adalah mengetahui pengaruh pemberian kitosan pada
membran selulosa bakteri sebagai material penutup luka pada tikus jantan galur
Wistar dilihat secara makroskopis.
A. Hasil Determinasi Tanaman
Determinasi merupakan langkah penting dalam penelitian bila menggunakan
tanaman sebagai sampel penelitian, agar diketahui kebenaran identitas tanaman
yang digunakan. Determinasi tanaman juga menghindarkan peneliti agar tidak
salah dalam pengambilan sampel. Determinasi dilakukan dengan bantuan seorang
determinator.
Pada penelitian ini, hasil determinasi menunjukkan bahwa tanaman ketela
rambat yang digunakan tidak salah, yaitu tanaman ketela rambat yang memiliki
membandingkan ciri-ciri tanaman ketela rambat termasuk umbi yang digunakan
dengan ciri-ciri yang ada pada literatur. Untuk literaturnya sendiri memakai
sumber dari www.plantamor.com serta buku pustaka yang dikarang oleh Huaman
(1991). Bagian tanaman yang dibandingkan adalah bagian daun, petiole dan
umbinya.
B. Hasil Pemilihan Bahan
Berdasarkan determinasi yang dilakukan maka bahan yang dipilih sudah benar
merupakan ketela rambat yang memiliki umbi berwarna putih. Umbi berwarna
putih ini digunakan karena memiliki kandungan pati yang terbesar daripada umbi
warna lainnya atau varietas lainnya. Menurut Kotecha dan Kadam (1998),
kandungan pati dari umbi berwarna putih sebesar 28,79%. Pati ini diperlukan
sebagai nutrisi untuk membuat membran selulosa bakteri.
C. Preparasi Limbah Ketela Rambat
Preparasi limbah ketela rambat dilakukan dengan memodifikasi cara kerja,
dengan harapan dapat memudahkan untuk mendapatkan limbah ketela rambatnya.
Setelah dicuci, umbi dipotong kecil-kecil dengan tujuan memudahkan proses
pemblenderan untuk mendapatkan bubur umbi/ jus umbi. Setelah dilakukan
penyaringan, lalu disimpan pada wadah pengendapan selama 3 jam untuk
mengendapkan pati. Lalu setelah 3 jam dipindah ke botol plastik untuk
diperlakukan dalam pembuatan biomaterial selulosa bakteri. Penggunaan cairan
setelah 3 jam dikarenakan memiliki kandungan nutrisi yang melimpah
D. Pembuatan Membran Kitosan
Membran kitosan dibuat dengan cara melarutkan 2 gram kitosan dalam 100
mL asam asetat 2%. Sebelumnya dilakukan orientasi dahulu untuk mendapatkan
metode yang pas dalam melarutkannya. Hal yang perlu dicatat adalah dalam
melarutkan kitosan tidak boleh menggunakan panas yang berlebihan, sebaiknya
tidak dipanaskan. Hal ini akan berakibat larutan kitosan yang terbentuk akan
mengalami Maillard reaction.
Maillard reaction merupakan reaksi kimia yang terjadi antara asam amino
dengan gula pereduksi akibat adanya pengaruh suhu. Umemura, Mihara dan
Kawai (2010) melaporkan efek dari Maillard reaction antara glukosa dengan
dalam membran kitosan ditemukan pada membran yang dilarutkan dalam asam
asetat 1% dan dikeringkan dengan cawan petri pada suhu 500 C. Proses Mailard
reaction ini dapat terjadi jika asam amino dengan gula pereduksi yang terdapat
dalam senyawa berinteraksi secara kimia dengan bantuan suhu dan dalam kondisi
yang kering. Warna yang terbentuk bila terjadi mailard reaction adalah coklat
kehitaman, hal ini akan memperngaruhi penampilan serta penerimaan pasien bila
diaplikasikan. Warna kitosan yang baik adalah berwarna kuning jernih.
Berdasarkan hasil orientasi didapatkan bahwa kitosan dapat larut dalam asam
asetat 2%. Hal ini dikarenakan kitosan memiliki gugus amino yang mudah
terprotonasi yang terdapat dalam D-glucosamine unit. Gugus amino ini akan
terprotonasi dengan adanya gugus asetil pada asam asetat, sehingga akan