i
UJI AKTIVITAS ANTI MIKROBA SEDIAAN BIOMATERIAL BAKTERI
Acetobacter xylinum DARI LIMBAH AIR CUCIAN BERAS DENGAN
PENAMBAHAN KITOSAN PADA BAKTERI STAPHYLOCOCCUS AUREUS
Skripsi
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Prog Studi Farmasi
Oleh:
Yustisia Larassetyaningtyas
NIM: 098114100
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iv
Commit to the Lord wathever you do, and your plans will succed (Proverbs 16:3)
God make everything for its purpose (Proverbs 16:4a)
Karya ini saya persembahkan kepada,
Tuhan Yesus Kristus as my great Father, my best friend, my everything. Kepada kedua orang tuaku, keluargaku dan kepada setiap orang yang akan membutuhkan naskah skripsi ini.
-Yustisia-v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Yustisia Larassetyaningtyas Nomor mahasiswa : 098114100
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul Uji Aktivitas Anti
Mikroba Sediaan Biomaterial Bakteri Acetobacter xylinum dari Limbah Air Cucian
Beras dengan Penambahan Kitosan pada Bakteri Staphylococcus aureus berserta
perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pengkalan data, mendistribusikan secara terbatas dan mempublikasikannya dalam internet atau media lain untuk kepentingan akademis tanpa meminta izin dari saya maupun meberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis. Demikian pernyataan ini saya buat dengan sebenarnya.
Yogyakarta, 19 Juli 2013 Yang menyatakan
vi
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya dari orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka sebagaimana tata aturan dalam penulisan sebuah karya ilmiah.
Apabila dikemudian hari ditemukan ada indikasi plagiarism dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai dengan peraturan perundang-undangan yang diberlakukan di Indonesia.
Yogyakarta, 6 Juli 2013 Penulis
vii PRAKATA
Penulis mengucapkan puji dan syukur kepada Tuhan Yang Maha Esa karena
atas berkat, rahmat dan kasih-Nya yang diberikan, penulis dapat menyelesaikan
skripsi yang berjudul “Uji Aktivitas Anti Mikroba Sediaan Biomaterial Bakteri
Acetobacter xylinum dari Limbah Air Cucian Beras dengan Penambahan Kitosan
pada Bakteri Staphylococcus aureus”. Skripsi ini disusun guna memenuhi salah satu
syarat untuk memperoleh gelar Sarjana Strata Satu Farmasi (S.Farm.), di prog studi
Farmasi Fakultas Farmasi Universitas Sanata Dharma,Yogyakarta.
Selama perkuliahan, penelitian dan penyusunan skripsi ini, Penulis telah
mendapatkan banyak bantuan, sarana, dukungan, bimbingan, saran dan kritik dari
berbagai pihak. Oleh karena itu, perkenakanlah Penulis ingin mengucapkan terima
kasih yang sebesar-besarnya kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma, Yogyakarta.
2. Ibu Dr. Eli Rohaeti selaku Dosen Pembimbing Utama dan penguji yang telah
memberikan bantuan, dukungan semangat, perhatian, bimbingan, perhatian serta
meluangkan waktu untuk berdiskusi bersama Penulis selama proses penyusunan
proposal hingga penyelesaian skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang telah meluangkan
viii
4. Prof. Dr. C.J. Soegihardjo, Apt. selaku Dosen Penguji yang telah meluangkan
waktu untuk menguji serta memberi beberapa masukan terkait skripsi Penulis.
5. Ibu Christophori Maria Ratna Rini Nastiti, M.Pharm., Apt., selaku Ketua Prog
Studi Farmasi yang telah membantu dan memberi dukungan kepada Penulis
dalam menyelesaikan administrasi dosen pembimbing serta meluangkan waktu
untuk berdiskusi dengan Penulis dalam menyelesaikan skripsi ini.
6. Ibu Rini Dwiastuti, M.Sc., Apt., selaku Kepala Laboratorium Fakultas Farmasi
Universitas Sanata Dharma.
7. Ibu Dra. MM. Yetty Tjandrawati, M.Si., selaku Dosen Pembimbing Akademik
yang telah membimbing dan mendampingi Penulis sejak selama kegiatan
perkuliahan di Fakultas Farmasi Universitas Sanata Dharma.
8. Dekan dan segenap dosen serta jajaran staf Dekanat Fakultas Matematika dan
Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta yang telah membantu
mengijinkan Ibu Dr. Eli Rohaeti menjadi Dosen Pembimbing Penulis.
9. Mas Narto, Mas Dwi dan Mas Sarwanto yang telah membantu dalam mengurus
beberapa administrasi dan surat ijin terkait penelitian bagi Penulis.
10. Bapak Mukminin, Mas Ratijo, Mas Heru, Mas Parjiman, Mas Kayat, Mas
Wagiran, Mas Sigit, Pak Parlan, Pak Mus, Mas Darto beserta segenap laboran
dan karyawan lain yang telah membantu Penulis dalam menyelesaikan skripsi
ini.
11. Keluarga yang senantiasa selalu memberikan dukungan, doa, nasehat dan
ix
12. Anugerah Adhi Laksana, David Candra Putra, Michael Raharja Gani, Haris
Witantyo dan Arvi Mahendra selaku partner skripsi Penulis yang senantiasa
menemani dan berjuang bersama serta memberikan masukan, motivasi dan
semangat dari awal hingga penyelesaian skripsi ini.
13. Geng konco kekal saya (Sisilia Mirsya Anastasia, Metri Setyadhiani Karunawati,
Tri Pamulatsih, Novia Sarwoningtyas, Agnes Mutiara Kurniawan, Lucia Shinta
Ratnaningtyas, Eric Antonius dan Is Sumitro) yang telah mendukung kepada
Penulis selama menyelesaikan skripsi ini.
14. Wasu saya yang beranggotakan Sisilia Mirsya Anastasia, Metri Setyadhiani
Karunawati dan penulis sendiri Yustisia Larassetyaningtyas. Sebuah tim wanita
super yang luar biasa, tim entrepreneur dan motivator yang selalu membuat saya
melihat ke visi kehidupan ini, sehingga saya tidak pernah punya keinginan untuk
menyerah.
15. Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu
Penulis dalam menyelesaikan skripsi ini.
Penulis menyadari masih banyak kekurangan dan ketidaksempurnaan yang
ada dalam penyusunan skripsi ini. Oleh karena itu, Penulis mengharapkan kritik dan
saran yang dapat membuat karya ini menjadi lebih baik. Akhir kata, semoga
penelitian skripsi ini dapat bermanfaat bagi pembaca terutama bagi perkembangan
ilmu pengetahuan.
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN PERSETUJUAN PUBLIKASI KARYA ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR PERSAMAAN ... xvi
DAFTAR LAMPIRAN ... xvii
2. Keaslian Penelitian ... 4
3. Manfaat Penelitian ... 5
B. Tujuan Penelitian ... 5
xi
A. Selulosa Bakteri ... 6
B. Acetobacter xylinum ... 9
C. Beras ... 10
D. Kitosan ... 12
E. Staphylococcus aureus ... 14
F. Aktivitas Antimikroba ... 16
G. Analisis Gugus Fungsi dengan Spektrofotometri Infra Merah ... 16
H. Analisis Kristalinitas dengan Difraksi Sinar X (XRD) ... 24
I. Pengamatan Morfologi Permukaan dengan Teknik Scanning Electron Microscopy ... 26
J. Landasan Teori ... 29
K. Hipotesis ... 29
BAB III METODE PENELITIAN ... 30
A. Jenis dan Rancangan Penelitian ... 30
B. Identifikasi Variabel ... 30
C. Definisi Operasional ... 31
D. Alat dan Bahan Penelitian ... 31
E. Tata Cara Penelitian ... 32
1. Pemilihan Bahan ... 32
2. Pembuatan Limbah Air Cucian Beras ... 32
3. Pembuatan Membran Kitosan ... 33
xii
5. Pembuatan Membran Selulosa Kitosan Bakteri ... 35
6. Analisis Karakteristik Biomaterial ... 36
a. Analisis FT – IR ... 36
b. Analisis SEM ... 36
c. Analisis XRD ... 37
7. Pengujian Aktivitas Antimikroba ... 38
a. Penyiapan Suspensi Bakteri Uji ... 38
b. Pembuatan Media ... 38
c. Penanaman Bakteri Uji ... 38
d. Pemberian Kontrol Positif pada Bakteri Uji ... 38
e. Pemberian Kontrol Negatif pada Bakteri Uji ... 38
f. Pemberian Biomaterial Selulosa dan Kitosan pada Bakteri Uji ... 39
g. Pengukuran Zona Hambat ... 39
F. Analisis Data ... 40
BAB IV PEMBAHASAN ... 41
A. Pembuatan Biomaterial Selulosa Bakteri ... 41
B. Pembuatan Membran Kitosan ... 45
C. Pembuatan Biomaterial Selulosa Bakteri dengan Penambahan Kitosan ... 46
D. Analisis Karakteristik Biomaterial ... 48
1. Analisis Sifat Fisik secara Makroskopik dan Organoleptis ... 49
xiii
3. Pengamatan Morfologi Permukaan dengan SEM... 55
4. Analisis Kristalinitas dengan XRD ... 58
E. Uji Aktivitas Antimikroba Biomaterial ... 60
BAB V KESIMPULAN DAN SARAN ... 67
A. KESIMPULAN ... 67
B. SARAN ... 67
DAFTAR PUSTAKA ... 68
LAMPIRAN ... 75
xiv
DAFTAR TABEL
Tabel I. Komposisi kimia dalam 100 g beras ... 12
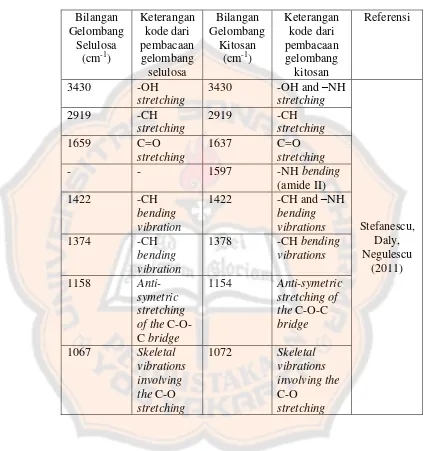
Tabel II. Hasil korelasi dari serapan infra merah selulosa dan kitosan ... 24
Tabel III. Hasil sifat fisik sampel biomaterial ... 49
Tabel IV. Korelasi serapan gugus infra merah ... 51
Tabel V. Hasil spektra IR biomaterial selulosa dan selulosa kitosan ... 53
Tabel VI. Absorbansi biomaterial yang digunakan ... 54
Tabel VII. Zona daya hambat ... 62
Tabel VIII. Rata – rata diameter zona hambat ... 63
xv
DAFTAR GAMBAR
Gambar 1. Selulosa dengan ikatan -1,4-glikosidik ... 6
Gambar 2. Jalur metabolism pembentukan selulosa oleh Acetobacter xylinum ... 8
Gambar 3. Struktur kimia kitin dan kitosan ... 14
Gambar 4. Struktur dinding sel bakteri G positif dan G negatif ... 15
Gambar 5. Struktur kimia dinding sel Staphylococcus aureus ... 15
Gambar 6. Sistem optik Fourier Transform Infra Red ... 20
Gambar 7. Spektra infra merah dari selulosa bakteri dan kitosan ... 23
Gambar 8. Difraktog XRD dari selulosa bakteri dan kitosan ... 26
Gambar 9. Pengamatan morfologi permukaan SEM ... 27
Gambar 10. Identifikasi beras yang digunakan ... 42
Gambar 11. Proses pembentukkan selulosa bakteri ... 43
Gambar 12. Spektra IR serbuk kitosan ... 50
Gambar 13. Overlay spektra IR ... 52
Gambar 14. Permukaan selulosa bakteri dengan pengamatan pada perbersaran 500x .. 56
Gambar 15. Permukaan melintang selulosa bakteri ... 56
xvi
DAFTAR PERSAMAAN
Persamaan 1. Pengikatan proton oleh kitosan... 13
Persamaan 2. Perhitungan absorbansi dengan hukum Lambert-Beer ... 21
Persamaan 3. Rumus Overlap puncak absorbsi ... 21
Persamaan 4. Rumus derajat kristalinitas ... 25
Persamaan 5. Rumus panjang gelombang De Broglie ... 27
xvii
DAFTAR LAMPIRAN
Lampiran 1. Komposisi bahan pembentuk sampel membran per 200 mL limbah ... 75
Lampiran 2. Perbandingan berat basah dan berat kering sampel membran ... 75
Lampiran 3. Uji statistik antimikroba sampel biomaterial dengan SPSS ... 75
Lampiran 4. Perhitugan derajat deasetilasi kitosan... 91
Lampiran 5. Perhitungan absorbansi IR ... 92
Lampiran 6. Gambar spektra IR masing – masing sampel ... 94
Lampiran 7. Difraktog masing – masing sampel ... 97
Lampiran 8. Gambar hasil pengamatan zona hambat membran selulosa kitosan dan larutan kitosan pada masa orientasi ... 100
Lampiran 9. Gambar hasil pengamatan zona hambat masing – masing sampel ... 103
Lampiran 10. Gambran membran sampel ... 105
Lampiran 11. Gambar alat yang digunakan selama penelitian ... 105
xviii INTISARI
Tujuan dari peneletian ini adalah untuk mengetahui karakteristik biomaterial selulosa dari limbah air cucian beras yang ditambahkan kitosan serta mengetahui aktivitas anti mikrobanya pada bakteri Staphylococcus
aureus.
Penelitian ini menggunakan kitosan dan limbah air cucian beras. Limbah air cucian beras digunakan sebagai media bakteri Acetobacter
xylinum untuk membentuk suatu selulosa bakteri. Terdapat tiga macam
sampel biomaterial yang diujikan, yaitu membran selulosa bakteri, membran selulosa bakteri+kitosan, dan membran kitosan. Uji anti mikroba dilakukan dengan metode difusi, yaitu meletakkan potongan masing-masing sampel membran dengan diameter sebesar 0,7 mm pada media Mueller Hinton Agar yang telah ditanami bakteri Staphylococcus aureus. Pengamatan zona hambat kemudian dilakukan setelah inkubasi selama 24 jam. Uji karakteristik meliputi analisis gugus fungsional, kristalinitas dan struktur morfologi.
Karakteristik membran selulosa yang dihasilkan memiliki sifat kristalin tinggi, sedangkan kitosan memiliki sifat amorf. Adanya sifat amorf dari kitosan yang masuk ke dalam membran selulosa ini menyebabkan terjadinya penurunan kristalinitas membran selulosa. Penurunan ini dapat terlihat dari jumlah puncak yang berkurang dan menjadi lebih lebar. Pada pengamatan gugus fungsi menggunakan FT-IR, terjadi peningkatan absorbansi dari gugus –OH dan gugus C=O dari selulosa bakteri ketika ditambah dengan kitosan. Untuk analisis topografi permukan membran selulosa dengan penambahan kitosan juga menjadi lebih halus. Zona hambat ditunjukkan oleh membran selulosa bakteri dan membran selulosa bakteri+kitosan 10%, sedangkan pada membran kitosan ataupun membran selulosa bakteri+kitosan konsentrasi 2% tidak ditemukan adanya zona hambat. Kitosan dengan derajat deasetilasi yang rendah ini mengakibatkan jumlah muatan positifnya sedikit, sehingga tidak mampu menimbulkan zona hambat pada bakteri Staphylococcus aureus.
Kata kunci : air cucian beras, difusi paperdisk, kitosan, selulosa bakteri,
xix ABSTRACT
The purpose of this study is to determine the characteristics of biomaterials produced from waste rice water plus chitosan as well as anti-microbial activity of the bacterium Staphylococcus aureus.
This study uses chitosan and waste water from washing rice. Waste rice water is used as a medium of Acetobacter xylinum bacteria to form a bacterial cellulose. There are three kinds of biomaterial samples are tested, the bacterial cellulose membrane, bacterial cellulose membrane + chitosan, and chitosan membranes. Anti-microbial testing conducted by the diffusion method, ie put the pieces of each membrane sample with a diameter of 0.7 mm on Mueller Hinton Agar media has planted Staphylococcus aureus ½ Mc Farland. Observation of inhibition zone then performed after incubation for 24 hours. Test characteristics meluputi functional group analysis, kristanilitas and morphological structures.
Characteristics of the resulting cellulose membrane has a high crystalline nature, whereas chitosan has an amorphous nature. The existence of the amorphous nature of chitosan into the cellulose membrane caused a decrease in the crystallinity of cellulose membrane. This decrease can be seen from the number of peaks is reduced and becomes wider. In observation of functional groups using FT-IR, an increase in absorbance of the-OH group and the C = O group of bacterial cellulose when coupled with chitosan. For the analysis of biomaterial surface topography with the addition of chitosan also be more subtle. Inhibition zone indicated by the bacterial cellulose membrane biomaterial and bacterial cellulose membrane biomaterial chitosan + 10%, whereas the chitosan membrane or bacterial cellulose membrane + 2% chitosan concentration did not reveal any inhibition zone. Chitosan with a low degree of deacetylation This resulted in the number of positive charges slightly, so it is not able to cause inhibition zone on Staphylococcus aureus bacteria.
Keywords: cellulose bacteria, chitosan, diffusion paperdisk, Staphylococcus
1 BAB I
PENDAHULUAN
A. Latar Belakang
Perkembangan ilmu pengetahuan dan teknologi khususnya
mikrobiologi dan tekhnologi sejalan dengan kebutuhan manusia yang semakin
meningkat. Penerapan ilmu tersebut sangat berguna bagi kehidupan manusia,
diantaranya pengolahan limbah-limbah industri. Menurut Mahida (1986)
limbah adalah sampah cair dari suatu lingkungan masyarakat dan terutama
terdiri dari air yang telah dipergunakan, di dalamnya terdiri atas 0,1% berupa
benda-benda padat baik zat organik maupun anorganik. Sugiharto (1987)
mengartikan limbah sebagai benda atau bahan yang tidak dipergunakan lagi.
Selanjutnya secara garis besar zat-zat yang terdapat di dalam air limbah dapat
dikelompokkan menjadi bahan padat sekitar 0,1% yang terdiri atas bahan
organik berupa protein sekitar 65%, karbohidrat 25% dan lemak 10% serta
bahan anorganik lain. Dalam penentuan pemilihan jenis limbah untuk
penulisan skripsi ini, penulis memilih untuk menggunakan limbah air cucian
beras.
Beras menempati urutan pertama dalam konsumsi pangan sehari-hari
bagi sebagian besar penduduk Indonesia yaitu sekitar 69% berupa
padi-padian, 10% umbi-umbian, 2% buah-buahan, 5% kacang-kacangan, 1% gula
bangsa Indonesia sangat potensial dalam memanfaatkan beras, terutama
limbahnya yang berupa air cucian beras secara maksimal Hardjono (1984).
Menurut Rachmat dan Fransiska (2004). Hingga saat ini limbah rumah
tangga, berupa air limbah cucian beras belum termanfaatkan, padahal
kandungan organik dan vitaminnya cukup banyak. Pencucian beras biasanya
menghasilkan air cucian beras berwarna putih susu, yang mengandung
karbohidrat serta protein dan vitamin B yang banyak terdapat pada pericarpus
dan aleuron yang ikut terkikis.
Air cucian beras yang terbuang sia-sia ternyata masih bernilai
ekonomis dan berpotensi mendatangkan keuntungan. Hal ini didasari
pemikiran bahwa air cucian beras memenuhi syarat untuk pertumbuhan
bakteri Acetobacter xylinum, yaitu terdapat kandungan gula dan karbohidrat.
Acetobacter merupakan mikroorganisme yang telah lama dikenal sebagai
penghasil selulosa adalah dari golongan bakteri terutama Sifat yang paling
menonjol dari bakteri ini adalah memiliki kemampuan untuk mempolimerisasi
glukosa sehingga menjadi selulosa Heryawan (2004). Terlebih lagi, menurut
Ciechanska (2004) selulosa ini memiliki keunggulan yaitu karakteristiknya
yang mirip dengan kulit manusia. Selulosa bakteri dapat digunakan sebagai
pengganti kulit manusia untuk merawat luka bakar dan sebagai benang jahit
untuk operasi.
Kitosan adalah biopolimer karbohidrat (polisakarida) dari glukosamin
antibakteri kitosan menyatakan bahwa kitosan efektif dalam menghambat
pertumbuhan bakteri. Namun, kelemahan dari kitosan adalah kelarutannya
dalam air. Kitosan memiliki sifat fisik yang rapuh dan tidak cocok digunakan
dalam kondisi kering. Kitosan dan beberapa tipe modifikasinya dilaporkan
penggunaannya untuk aplikasi biomedik, seperti pelembab kulit, penyembuh
luka, anti koagulan, jahitan pada luka (suuture), obat-obatan, bahan vaksin,
dan dietary fiber. Di pasaran dunia, harga kitosan ini cukup mahal. Kitosan
dengan derajat deasetilasi 70% dapat mencapai US $ 750/kg (Djaeni,2003).
Institute of Chemical Fibers (ICWH) Polandia telah memproduksi suatu
bahan komposit selulosa bakteri dengan mengkombinasikan sifat – sifat
selulosa bakteri dan kitosan. Modifikasi dilakukan dengan menambahkan
polisakarida bioaktif seperti kitosan ke dalam media kultur pembentukan
selulosa. Hasil modifikasi tersebut menunjukkan bahwa unit glukosamin dan
N-asetil glukosamin dari kitosan mengalami interaksi dengan rantai selulosa
yang dihasilkan. Ternyata bahan komposit ini dapat digunakan untuk
pengobatan luka buring, kulit bernanah, luka yang sukar sembuh dan luka –
luka yang memerlukan penggantian pembalut berulang kali
(Ciechanska,2004).
Bakteri yang paling umum ditemukan di luka adalah Staphylococcus
aureus. Menurut 3M health care, skin and wound care division,
Staphylococcus aureus menimbulkan terjadinya luka pada kulit pasca operasi
staphylococci, 11,2% Enterococcus spp, 9,6% Escherichia coli, 5,6%
Pseudomonas aeruginosa, 4,2% Enterobacter spp. 3,0% Klebsiella
pneumonia, 2,0% Candida spp, 0,7% Klebsiella oxytoca 0,6% Acinetobacter
baumanii.
Hingga saat ini, upaya untuk meningkatkan aktivitas antibakteri pada
kitosan yang dikombinasikan dengan bahan lain masih menarik untuk diteliti.
Tingginya harga kitosan di pasaran dan air cucian beras yang selama ini masih
dianggap masyarakat sebagai suatu bahan yang tidak bermanfaat ini semakin
menarik perhatian peneliti untuk ikut meneliti aktivitas antibakteri dari
kitosan dan kombinasinya dengan selulosa bakteri Acetobacter xylinum dalam
media air cucian beras.
1. Rumusan masalah
a. Bagaimana karakteristik biomaterial selulosa bakteri dari limbah air
cucian beras dengan penambahan kitosan ?
b. Apakah biomaterial selulosa bakteri dari limbah air cucian beras dengan
penambahan kitosan memiliki aktivitas antimikroba terhadap bakteri
Staphylococcus aureus ?
2. Keaslian penelitian
Berdasarkan penelusuran pustaka yang dilakukan, penelitian uji aktivitas
anti mikroba sediaan biomaterial selulosa bakteri Acetobacter xylinum dari
limbah air cucian beras dengan penambahan kitosan pada bakteri
ada dan telah dilakukan adalah penelitian daya antibakteri kitosan terhadap
Escherichia coli, Pseudomonas aeuginosa, Staphylococcus aureus dan
Bacillus subtilis.
3. Manfaat penelitian
a. Manfaat teoritis : Penelitian ini diharapkan dapat memperkaya ilmu
pengetahuan pada pembuatan biomaterial selulosa bakteri dari limbah air
cucian beras.
b. Manfaat metodologis : Penelitian ini diharapkan dapat menjadi salah satu
metode pengembangan selulosa bakteri sebagai penutup luka dari limbah
air cucian beras.
c. Manfaat praktis : Penelitian ini diharapkan dapat menjadi alternatif
penutup luka yang dibuat dari limbah cucian beras yang bersifat ramah
lingkungan.
B. Tujuan
1. Penelitian ini bertujuan untuk mengetahui karakteristik biomaterial
selulosa bakteri dari limbah air cucian beras dengan penambahan kitosan
2. Penelitian ini bertujuan untuk mengetahui aktivitas antimikroba sediaan
biomaterial selulosa bakteri dari limbah air cucian beras dengan
6 BAB II
PENELAAHAN PUSTAKA
A. Selulosa Bakteri
Biomaterial adalah suatu material, baik alami maupun buatan manusia
(sintetis) yang digunakan sebagai suatu sistem atau bagian dari sistem pada
jaringan, organ atau fungsi tubuh. Penggunaan biomaterial ini bertujuan untuk
memperbaiki (repair), memulihkan (restore) atau mengganti (replace)
jaringan yang rusak atau sakit (Darwis 2008).
Pada awalnya, selulosa dicirikan sebagai polimer dengan unit-unit
pembangun monosakarida. Kemudian, pada awal 1900 Cross & Bevan
mencirikan selulosa dengan cara melarutkan materi yang mengandung
kombinasi selulosa ke dalam natrium hidroksida. Mereka menamakan materi
yang tidak larut sebagai α-selulosa. Materi yang larut (dinamakan -selulosa
dan -selulosa) yang diketahui belakangan bukan merupakan selulosa, tetapi
lebih sebagai gula sederhana. Besarnya kadar α-selulosa merupakan indikator
kemurnian selulosa (Tanaka R., Daud W.R.W., 2002).
Mikroorganisme yang telah lama dikenal sebagai penghasil selulosa
adalah dari golongan bakteri terutama Acetobacter. Acetobacter xylinum
merupakan bakteri berbentuk batang pendek, yang mempunyai panjang 2
mikron dengan permukaan dinding yang berlendir. Bakteri ini biasanya
membentuk rantai pendek dengan satuan 6-8 sel dan menunjukkan g negatif.
Sifat yang paling menonjol dari bakteri ini adalah memiliki kemampuan untuk
mempolimerisasi glukosa sehingga menjadi selulosa. Selanjutnya selulosa
tersebut membentuk matrik yang dikenal sebagai nata (Heryawan, 2004).
Tipe dari serat-serat selulosa dapat digambarkan sebagai sebuah kabel
dimana benang-benang yang menyusunnya adalah rantai-rantai polimer yang
panjang yang hanya terdiri dari D-glukosa. Pada masing-masing rantai,
monomer-monomer gula berikatan secara seragam di dalam ikatan -1,4
glikosidik. Laju produksi selulosa oleh Acetobacter xylinum sebanding
dengan laju pertumbuhan sel dan tidak tergantung pada sumber karbon.
Terdapat 4 langkah (reaksi) enzimatis di dalam pembentukan selulosa oleh
Acetobacter xylinum yang menunjukkan lintasan yang lengkap dari glukosa
menjadi selulosa, yaitu : (1) fosforilasi dari glukokinase, (2) isomerasi dari
glukosa-6-fosfat (G6P) menjadi glukosa-1-fosfat (G1P) oleh
fosfoglukomutase, (3) sintesis UDP-glukosa oleh UDPG-pirofosforilase dan
(4) reaksi pembentukan selulosa. Jalur biosintesis selulosa oleh Acetobacter
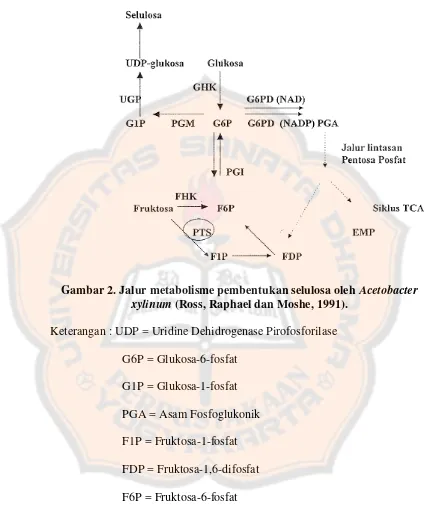
Gambar 2. Jalur metabolisme pembentukan selulosa oleh Acetobacter xylinum (Ross, Raphael dan Moshe, 1991).
Keterangan : UDP = Uridine Dehidrogenase Pirofosforilase
G6P = Glukosa-6-fosfat
G1P = Glukosa-1-fosfat
PGA = Asam Fosfoglukonik
F1P = Fruktosa-1-fosfat
FDP = Fruktosa-1,6-difosfat
F6P = Fruktosa-6-fosfat
GHK = Glukosa heksokinase
PGM = Fosfoglukomutase
G6PD = Glukosa-6-fosfat dehidrogenase
PGI = Fosfoglukosa isomerase
FHK = Fruktosa heksokinase
PTS = Sistem Fosfotransferase
EMP = Jalur lintasan Embden Myerhoff
B. Acetobacter xylinum
Bakteri Acetobacter xylinum berbentuk elips atau tongkat yang
melengkung. Kultur yang masih muda merupakan bakteri g negatif,
sedangkan kultur yang sudah agak tua merupakan bakteri dengan g yang
bervariasi. Acetobacter merupakan bakteri aerob, yang memerlukan respirasi
dalam metabolisme. Acetobacter dapat mengoksidasi etanol menjadi asam
asetat, juga dapat mengoksidasi asetat dan laktat menjadi CO2 dan H2O
(Banwart,1981)
Acetobacter xylinum berperan dalam pembuatan nata de coco.
Acetobacter xylinum mampu mensintesis selulosa dari gula yang dikonsumsi.
Nata yang dihasilkan berupa pelikel yang mengambang dipermukaan substrat
Acetobacter xylinum dapat membentuk suatu lapisan yang mencapai beberapa
sentimeter pada permukaan substrat cair tempat hidupnya. Bakteri itu sendiri
terperangkap di dalam massa fibril yang dibuatnya. Untuk dapat
menghasilkan massa yang kokoh, kenyal, tebal,putih dan tembus pandang
Pembentukan nata de coco atau selulosa bakteri dapat dijelaskan
sebagai berikut: sel-sel Acetobacter xylinum mengambil glukosa dari larutan
gula dan air kelapa kemudian digabungkan dengan asam lemak membentuk
precursor (penciri nata), pada membran sel precursor ini selanjutnya
dikeluarkan dalam bentuk ekskresi dan bersama-sama dengan enzim
mempolimerisasikan glukosa menjadi selulosa di luar sel. Selulosa yang
terbentuk diduga berasal dari pelepasan lendir Acetobacter xylinum yang
merupakan hasil sekresi proses metabolisme gula yang ditambahkan pada air
kelapa dan berfungsi sebagai bahan perangsang aktivitas bakteri Acetobacter
xylinum akan membentuk nata pada permukaan medium ( Hidayat, 2006 ).
Bakteri Actobacter xylinum tumbuh baik dalam media yang memiliki
pH 3 – 4. Jika pH lebih dari empat atau kurang dari tiga, proses fermentasi
tidak akan bisa berjalan sempurna. Suhu optimum untuk pertumbuhan.
Acetobacter xylinum adalah 26 – 27o( Warisno, 2004 ) .
C. Beras
Padi termasuk dalam subdivisi angiospermae, kelas monocotyledone,
family gineae, genus oryza dan spesies Oryza sativa L. (Prihatman, 2000).
Senyawa organik yang terkandung dalam beras antara lain : karbohidrat,
asetaldehid, asam p-aminobenzoat, amilosa, asam arakidonat, asparagin, asam
askorbat dan masih banyak lagi, sedangkan kandungan anorganik beras antara
Beras memenuhi syarat menjadi makan pokok jika dilihat dari zat gizi
yang dikandungnya. Hidrat arang atau karbohidrat adalah komposisi zat gizi
yang dominan yang terdapat pada beras dan beberapa macam makanan pokok
lainnya. Kebiasaan para ibu-ibu rumah tangga mencuci beras tujuannya
adalah pencucian tersebut dilakukan sampai benar-benar bersih (pencucian
dilakukan sampai air cucian beras berwarna putih susu, termasuk juga protein
dan vitamin B yang banyak terdapat pada pericarpus dan aleuron yang ikut
terkikis. Air cucian beras memenuhi syarat untuk pertumbuhan bakteri
Acetobacter xylinum, yaitu terdapat kandungan gula dan karbohidrat. Prinsip
utama suatu bahan pangan dapat diolah menjadi nata adalah adanya
kandungan karbohidrat yang cukup memadai dalam bahan tersebut. Nata
merupakan selulosa yang dibentuk oleh bakteri Acetobacter xylinum (Yayu,
Nelly, Reka, Anik, dan Imam, 2010).
Air cucian beras mengikis kandungan-kandungan yang berada pada
beras, kandungan yang ada dalam air cucian ini paling besar diperkirakan
adalah pati, kemudian dilanjutkan vitamin B. Vitamin B akan membantu
pertumbuhan Acetobacter xylinum di saat lingkungan tidak baik. Sumber
glukosa dari limbah air cucian beras ini cukup untuk memfermentasikan
bakteri hingga hari ke 14 (Rachmat dan Agustina, 2009).
Komposisi kimia beras berbeda-beda tergantung varietas dan cara
pengolahannya. Selain sumber energi dan protein, beras juga mengandung
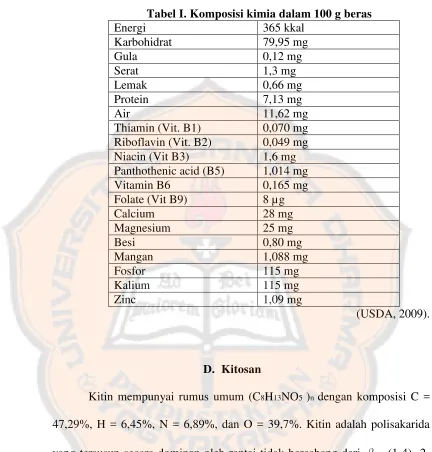
Tabel I. Komposisi kimia dalam 100 g beras
Riboflavin (Vit. B2) 0,049 mg
Niacin (Vit B3) 1,6 mg
Panthothenic acid (B5) 1,014 mg
Vitamin B6 0,165 mg
yang tersusun secara dominan oleh rantai tidak bercabang dari β -(1-4)
-2-asetamido-2-deoksi-Dglukosa (juga dapat disebut sebagai
N-Asetil-D-glukosamina). Kitin sama dengan selulosa dalam hal struktur kimia dan fungsi
dengan selulosa dalam rangkaian ikatan hidrogen didalam rantainya dan
antara rantai yang satu dengan rantai yang lainnya (Anonim, 1976).
Kitin merupakan padatan yang berbentuk amorf, tidak larut dalam air,
asam encer, alkali pekat maupun encer, alkohol dan pelarut-pelarut organik
lainnya. Tetapi kitin dapat larut dalam HCl dan H2SO4 pekat, H3PO4 78-97%,
dan anhidrida asam format (Anonim, 1976).
Kitosan merupakan polimer linear yang tersusun oleh 2000-3000
monomer N-asetil-D-glukosamin dalam ikatan -(1-4), tidak toksik dengan
LD50 setara dengan 16 g/kg BB dan mempunyai berat molekul 800 Kda.
Berat molekul ini tergantung dari derajat deasetilasi yang dihasilkan pada saat
ekstraksi (Tang, Shi, dan Qian, 2007).
Sifat-sifat penting kitosan antara lain disebabkan memiliki muatan
positif dalam larutan asam, dimana gugus amina pada molekul kitosan
mengikat proton sesuai dengan persamaan reaksi:
kitosan-NH2 + H3O+↔ kitosan-NH3+ + H2O ………...(1)
dimana kitosan-NH3 + juga memiliki aktivitas antimikroba terhadap berbagai
mikroorganisme (Rhoades dan Rastall, 2006).
Antibakteri kitosan lebih efektif terhadap bakteri g negatif daripada
bakteri g positif. Penyerapan kitosan oleh bakteri g negatif lebih besar
daripada bakteri g positif. Menurut penelitian tersebut, penyerapan kitosan
juga berhubungan dengan lingkungan sekitar yaitu nilai pH dan derajat
deasetilasi yang tinggi (95%) kitosan akan bermuatan lebih positif dan lebih
mudah menghambat gugus amino (NH3+) yang akan mempermudah
penyerapan bakteri terhadap kitosan dibandingkan dengan suasana pH 5 dan
derajat deasetilasi yang rendah (75%) (Chung, Su, Chen, Jia, Wang, Wu, dan
Lin, 2004).
Gambar 3. Struktur kimia kitin dan kitosan (Thayza, Thatiana, Horacinna, Rui, dan Galba, 2012)
E. Staphylococcus aureus
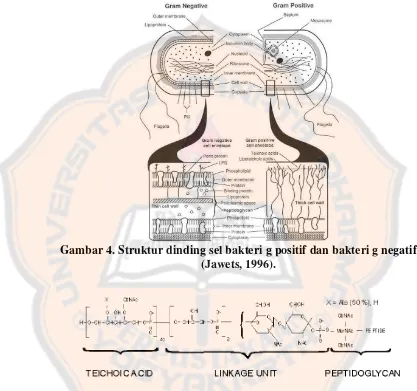
Staphylococcus aureus merupakan bakteri g positif berbentuk bulat
dan diameter kurang lebih 1 mikro meter, tidak mempunyai spora, tidak
bergerak dan membentuk kelompok yang tidak teratur. Staphylococcus aureus
dapat tumbuh baik pada suhu 37oC dan pada suhu 20oC akan membentuk
pigmen berwarna kuning emas. Dinding sel terdiri dari sebagian besar
peptidoglikan dan asam teikoat. Koloni pada perbenihan berwarna abu – abu
sampai kuning emas tua. Bakteri ini merupakan patogen utama bagi
manusia. Staphylococcus aureus yang pathogen cenderung menghasilkan
Staphylococcus aureus dapat menyebabkan bisul, borok serta nanah pada luka
(Jawetz, 1996).
Gambar 4. Struktur dinding sel bakteri g positif dan bakteri g negatif (Jawets, 1996).
F. Aktivitas antimikroba
Faktor – faktor yang mempengaruhi aktivitas antibakteri antara lain
adalah pH lingkungan / pH medium, komponen medium, stabilitas obat /
senyawa penghambat bakteri, lama inkubasi, dan aktivitas metabolisme
bakteri (Jawetz, 1991).
Uji aktivitas antibakteri secara in vitro dilakukan dengan 2 metode,yaitu :
1. Metode dilusi
Suatu senyawa antibakteri dengan berbagai kadar dimasukkan ke
dalam medium biakan bakteri padat atau cair, kemudian medium
diinokulasi untuk uji bakteri dan diinkubasi. Pada hasil akhir dapat
diamati dari kadar senyawa antibakteri yang menghambat atau
membunuh bakteri (Jawetz, 1991).
2. Metode difusi
Metode ini menggunakan kertas saring berbentuk lingkaran atau
silinder tanpa alas yang berisi jumlah obat yang telah ditentukan,
ditempatkan dalam medium padat untuk uji bakteri. Setelah inkubasi,
diameter dari zona hambatan di sekitat perlakuan menunjukkan daya
hambat obat melawan bakteri (Jawetz, 1991).
G. Analisis Gugus Fungsi dengan Spektrofotometri Infra Merah
Spektrofotometri infra-merah adalah sangat penting dalam kimia
alat rutin dalam penemuan gugus fungsional, pengenalan senyawa, dan
analisis campuran. Spektrofotometri infra-merah juga digunakan untuk
penentuan struktur, khususnya senyawa organik dan juga untuk analisis
kuantitatif, seperti analisa kuantitatif pencemaran udara, misalnya karbon
monoksida dalam udara dengan teknik non-dispersive (Khopkar, 2003).
Radiasi gelombang elektromagnetik adalah energi yang dipancarkan
menembus ruang dalam bentuk gelombang-gelombang atau paket-paket
energi. Tiap tipe radiasi gelombang elektromagnetik (mulai dari radiasi
gelombang radio hingga radiasi gamma) dicirikan oleh panjang gelombang
(λ) atau frekuensi (υ) dari gelombang tersebut. Ketika suatu radiasi
gelombang elektromagnetik mengenai suatu materi, akan terjadi suatu
interaksi yang berupa penyerapan energi (absorbsi) oleh atom-atom atau
molekul-molekul dari materi tersebut (Petrucci,1987).
Pancaran infra-merah pada umumnya mengacu pada bagian spektrum
elektromagnet yang terletak di antara daerah tampak dan daerah gelombang
mikro. Bagi kimiawan organik, sebagian besar kegunaannya terbatas di
antara 4000 cm-1 dan 666 cm-1 (2,5 – 15,0 m). Akhir-akhir ini muncul
perhatian pada daerah infra-merah dekat, 14.290 – 4000 cm-1 (0,7 –β,5 m)
dan daerah infra-merah jauh, 700 – 200 cm-1 (14,3 – 50 m) (Silverstein.,
1986).
Absorbsi sinar ultraviolet dan cahaya tampak oleh suatu materi akan
tingkat-tingkat energi yang lebih tinggi. Pada absorbsi radiasi infra merah
oleh suatu materi, radiasi yang diserap tersebut tidak cukup mengandung
energi untuk mengeksitasi elektron, namun akan menyebabkan
membesarnya amplitudo getaran (vibrasi) dari atom-atom yang terikat satu
sama lain yang membentuk suatu ikatan molekul. Keadaan ini disebut
dengan vibrasi tereksitasi (Fessenden, 1997).
Salah satu metode spektroskopi yang sangat populer digunakan adalah
metode spektroskopi FTIR (Fourier Transform Infrared), yaitu metode
spektroskopi inframerah modern yang dilengkapi dengan teknik transformasi
Fourier untuk deteksi dan analisis hasil spektrumnya. Dalam hal ini metode
spektroskopi yang digunakan adalah metode spektroskopi absorbsi, yaitu
metode spektroskopi yang didasarkan atas perbedaan penyerapan radiasi
inframerah oleh molekul suatu materi. Absorbsi inframerah oleh suatu
materi dapat terjadi jika dipenuhi dua syarat, yakni kesesuaian antara
frekuensi radiasi inframerah dengan frekuensi vibrasional molekul sampel
dan perubahan momen dipol selama bervibrasi (Chatwal, 1985).
Spektroskopi FTIR (fourier transform infrared) merupakan salah satu
teknik analitik yang sangat baik dalam proses identifikasi struktur molekul
suatu senyawa. Komponen utama spektroskopi FTIR adalah interferometer
Michelson yang mempunyai fungsi menguraikan (mendispersi) radiasi
inframerah menjadi komponen-komponen frekuensi. Penggunaan
dibandingkan metode spektroskopi inframerah konvensional maupun metode
spektroskopi yang lain. Diantaranya adalah informasi struktur molekul dapat
diperoleh secara tepat dan akurat (memiliki resolusi yang tinggi).
Keuntungan yang lain dari metode ini adalah dapat digunakan untuk
mengidentifikasi sampel dalam berbagai fase (gas, padat atau cair).
Kesulitan-kesulitan yang ditemukan dalam identifikasi dengan spektroskopi
FTIR dapat ditunjang dengan data yang diperoleh dengan menggunakan
metode spektroskopi yang lain (Harmita, 2006).
Sistim optik Spektrofotometer FT-IR seperti pada gambar 2 dilengkapi
dengan cermin yang bergerak tegak lurus dan cermin yang diam. Dengan
demikian radiasi infra-merah akan menimbulkan perbedaan jarak yang
ditempuh menuju cermin yang bergerak (M) dan jarak cermin yang diam
(F). Perbedaan jarak tempuh radiasi tersebut adalah 2 yang selanjutnya
disebut sebagai retardasi ( δ ). Hubungan antara intensitas radiasi IR yang
diterima detektor terhadap retardasi disebut sebagai interferog. Sistem optik
dari Spektrofotometer IR yang didasarkan atas bekerjanya interferometer
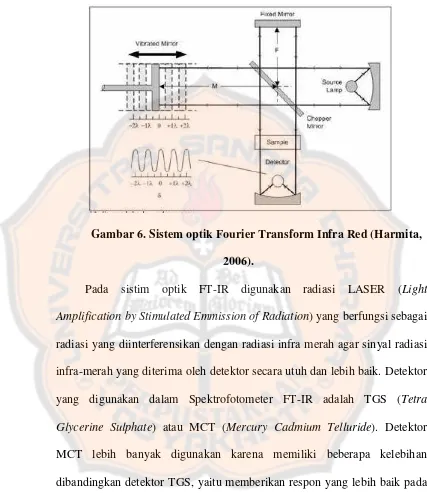
Gambar 6. Sistem optik Fourier Transform Infra Red (Harmita,
2006).
Pada sistim optik FT-IR digunakan radiasi LASER (Light
Amplification by Stimulated Emmission of Radiation) yang berfungsi sebagai
radiasi yang diinterferensikan dengan radiasi infra merah agar sinyal radiasi
infra-merah yang diterima oleh detektor secara utuh dan lebih baik. Detektor
yang digunakan dalam Spektrofotometer FT-IR adalah TGS (Tetra
Glycerine Sulphate) atau MCT (Mercury Cadmium Telluride). Detektor
MCT lebih banyak digunakan karena memiliki beberapa kelebihan
dibandingkan detektor TGS, yaitu memberikan respon yang lebih baik pada
frekwensi modulasi tinggi, lebih sensitif, lebih cepat, tidak dipengaruhi oleh
temperatur, sangat selektif terhadap energi vibrasi yang diterima dari radiasi
Gugus fungsional dalam molekul dianalisis secara kualitatif dengan
melihat bentuk spektrumnya yaitu dengan melihat puncak spesifik yang
menunjukkan jenis gugus funsgional. Analisis secara kuantitatif dilakukan
berdasarkan hukum Lambert-Beer, ditunjukkan pada Persamaan 2.
A = log (Io/I) = a c l ………..….. (β)
Keterangan :
A = absorbansi
Io = intensitas sinar masuk
I = Intensitas sinar yang ditransmisikan
a = koefisien absorpsi (M-1 cm-1)
c = konsentrasi zat (M)
l = panjang lintasan (cm).
Untuk mengoreksi kesalahan yang timbul akibat adanya overlap
puncak absorpsi, maka garis dasar (base line) dalam spektrum infra merah
harus dibuat seperti ditunjukkan pada Gambar 4, I dan Io ditentukan sebagai
intesitas transmisi pada garis dasar. Absorbansi (A) pada frekuensi yang
diberikan (dalam cm-1) terlihat pada Persamaan 3.
Keterangan :
AC = Io = intensitas sinar masuk
AB = I = intensitas sinar yang ditransmisikan
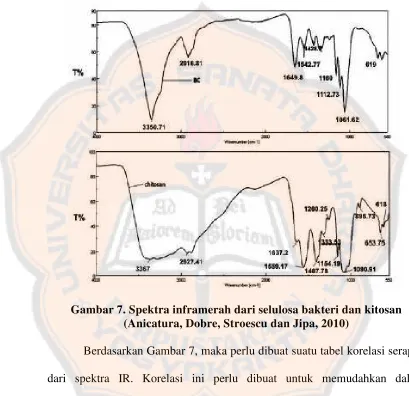
Gambar 7 menunjukkan karakteristik serapan dari selulosa bakteri
menunjukkan puncak di sekitar daerah 3350 cm-1 yang menunjukkan O-H
stretching dan di sekitar daerah 2916,81 cm-1 yang menunjukkan CH
stretching. Adanya pita di sekitar daerah 1649,8 cm-1 yang menunjukkan
deformasi vibrasi dari molekul air yang terabsorbsi (Wonga, Kasapis dan
Tan, 2009). Adapun karakteristik serapan dari kitosan ditunjukkan dengan
puncak di sekitar 1559,17 cm-1 yang menunjukkan vibrasi stretching dari
gugus amino kitosan dan di sekitar daerah 1333,5 cm-1 yang menunjukkan
vibrasi dari C-H. Adanya pita di sekitar 3367,1 cm-1 menunjukkan vibrasi
simetrik dari amina NH. Adanya puncak disekitar daerah 2927,41 cm-1
menunjukkan vibrasi C-H. Adanya puncak disekitar daerah 896,73 cm-1 dan
1154,19 cm-1 berkaitan dengan struktur sakarida dari kitosan. Adanya
puncak yang melebar di sekitar daerah 1080,91 cm-1 menunjukkan vibrasi
Naidu, Subha, Sairam dan Aminabhavi, 2006). Gambar 7. menunjukkan
contoh spektra inframerah dari selulosa bakteri dan kitosan.
Gambar 7. Spektra inframerah dari selulosa bakteri dan kitosan (Anicatura, Dobre, Stroescu dan Jipa, 2010)
Berdasarkan Gambar 7, maka perlu dibuat suatu tabel korelasi serapan
dari spektra IR. Korelasi ini perlu dibuat untuk memudahkan dalam
menginterpretasikan gugus-gugus fungsi dari spektra IR yang didapatkan.
Tabel II. Hasil korelasi dari serapan inframerah pada selulosa dan
H. Analisis Kristalinitas dengan Difraksi Sinar X (XRD)
Spektroskopi difraksi sinar-X (X-ray difraction/XRD) merupakan
salah satu metoda karakterisasi material yang paling tua dan paling sering
fasa kristalin dalam material dengan cara menentukan parameter struktur kisi
serta untuk mendapatkan ukuran partikel (Widyawati, 2012).
XRD memberikan data-data difraksi dan kuantisasi intensitas difraksi
pada sudut-sudut dari suatu bahan. Data yang diperoleh dari XRD berupa
intensitas difraksi sinar-X yang terdifraksi dan sudut-sudut βθ. Tiap pola
yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki
orientasi tertentu (Widyawati, 2012).
Suatu kristal yang dikenai oleh sinar-X tersebut berupa material
(sampel), sehingga intensitas sinar yang ditransmisikan akan lebih rendah
dari intensitas sinar datang. Berkas sinar-X yang dihamburkan ada yang
saling menghilangkan (interferensi destruktif) dan ada juga yang saling
menguatkan (interferensi konstrktif) (Grant & Suryanayana, 1998).
Menurut Anggraeni (2003), derajat kristalinitas dapat ditentukan bila
difraksi kristalin dipisahkan dari difraksi amorf, dengan cara menghitung
perbandingan luas difraksi kristalin terhadap luas total difraksi (amorf dan
kristalin) seperti ditunjukkan oleh Persamaan 4.
Derajat kristalinitas = Luas kristalin ×100% ….…………. (4)
Luas (kristalin+amorf)
Contoh hasil difraksi sinar-X dari selulosa bakteri dan kitosan
Gambar 8. Difraktogram XRD dan selulosa bakteri dan kitosan (Stefanescu, et. al., 2012).
I. Pengamatan Morfologi Permukaan dengan Teknik Scanning Electron
Microscopy
SEM merupakan mikroskop elektron yang menampilkan gambar
permukaan sampel (Gambar 9). Elektron berinteraksi dengan tiap bagian
permukaan sampel, elektron tersebut diemisikan dan dideteksi. Gambar yang
terbentuk sama dengan jumlah elektron yang berinteraksi dengan sampel.
Untuk meningkatkan resolusi dari gambar dapat dilakukan dengan cara
mengecilkan diamater sumber cahaya. Diameter cahaya yang kecil akan
mentransmisikan elektron pada permukaan sampel tertentu. Diameter cahaya
lebar, maka interaksi yang terjadi dengan banyak objek dalam waktu yang
Gambar 9. Pengamatan morfologi permukaan SEM (a). Selulosa bakteri dengan perbesaran 5000x (b). Film kitosan murni dengan perbesaran 6000x (Goh, Rosman, Kaur, Fazilah Karim, dan Bhat,
2012; Bhuvaneshwari, Sruthi, Sivasubramanian, Kalyani, dan Sugunabai, 2011).
SEM memiliki resolusi yang lebih tinggi daripada mikroskop optik.
Hal ini disebabkan oleh panjang gelombang de Broglie yang dimiliki
elektron lebih pendek daripada gelombang optik. Makin kecil panjang
gelombang yang digunakan maka makin tinggi resolusi mikroskop. Panjang
gelombang de Broglie elektron adalah :
= h/ p………..………(5)
dengan h konstanta Planck dan p adalah momentum elektron. Momentum
elektron dapat ditentukan dari energi kinetik melalui hubungan :
K = K p2 /2m…………..………..……….(6)
dengan K energi kinetik elektron dan m adalah massanya (Allen, 2008).
Syarat agar SEM dapat menghasilkan citra yang tajam adalah
permukaan benda harus bersifat sebagai pemantul elektron atau dapat
melepaskan elektron sekunder ketika ditembak dengan berkas elektron.
diamati di bawah SEM maka profil permukaan akan tampak dengan jelas.
Apabila material yang diamati ini seperti isolator dan bukan logam, maka
agar profil permukaan bukan logam dapat diamati dengan jelas dengan SEM,
permukaan material tersebut harus dilapisi dengan logam. Film tipis logam
dibuat pada permukaan material tersebut. sehingga dapat memantulkan
berkas elektron. Metode pelapisan yang umumnya dilakukan adalah
evaporasi dan sputtering (Echlin, 2009; Rice, 2012).
Pada metode evaporasi, material yang akan diamati permukaannya
ditempatkan dalam satu ruang (chamber) dengan logam pelapis. Ruang
tersebut dapat divakumkan dan logam pelapis dapat dipanaskan hingga
mendekati titik leleh. Logam pelapis diletakkan di atas filament pemanas.
Mula-mula chamber divakumkan yang diikuti dengan pemanasan logam
pelapis. Atom-atom menguap pada permukaan logam. Ketika sampai pada
permukaan material yang memiliki suhu lebih rendah, atom-atom logam
terkondensasi dan membentuk lapisan film tipis di permukaan material yang
memiliki suhu lebih rendah, atom-atom logam terkondensasi dan
membentuk lapisan film tipis di permukaan material. Ketebalan lapisan
dapat dikontrol dengan mengatur lama waktu evaporasi. Agar proses ini
dapat berlangsung efisien maka logam pelapis yang digunakan harus yang
memiliki titik lebur rendah. Logam pelapis yang umumnya digunakan adalah
Prinsip kerja sputtering mirip dengan evaporasi. Namun, sputtering
dapat berlangsung pada suhu rendah (suhu kamar). Permukaan logam
ditembak dengan ion gas berenergi tinggi sehingga terpental keluar dari
permukaan logam dan mengisi ruang di dalam chamber. Ketika mengenai
permukaan sampel, atom-atom logam tersebut membentuk fase padat dalam
bentuk film tipis. Ketebalan lapisan dikontrol dengan mengatur lama waktu
sputtering (Echlin, 2009; Rice, 2012).
J. Landasan Teori
Kitosan merupakan biopolimer alam yang diproses melalui deasetilasi
kitin. Kitosan memiliki banyak manfaat, salah satunya adalah sebagai suatu
agen antimikroba.
Selulosa bakteri dengan medium air cucian beras merupakan suatu
polimer dari alam yang mengandung karbohidrat dan dapat dimetabolisme
oleh suatu bakteri, salah satunya Acetobacter xylinum menjadi suatu selulosa.
Kombinasi dari kitosan dan selulosa bakteri ini akan menghasilkan suatu
polimer yang memiliki karakteristik yang baik dan aktivitas antibakteri
terhadap Staphylococcus aureus yang merupakan bakteri yang biasa hidup di
kulit yang luka.
Mekanisme penyembuhan dari membran penutup luka adalah dengan
cara difusi. Zat aktif dari membran tersebut akan berdifusi dan membantu
ikatan yang kuat antara kitosan dengan beberapa senyawa atau pembawa
seperti selulosa dapat menyebabkan kitosan tidak mampu berdifusi dan
memberikan efek dengan maksimal.
K. Hipotesis
1. Air cucian beras dapat digunakan sebagai substrat pembentuk biomaterial.
2. Sediaan biomaterial selulosa bakteri Acetobacter xylinum dari limbah air
cucian beras dengan penambahan kitosan memiliki daya antibakteri
30 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni
sederhana rancangan pola searah.
B. Identifikasi Variabel
1. Variabel bebas : Kitosan yang ditambahkan dalam preparasi sediaan
biomaterial selulosa bakteri.
2. Variabel tergantung : Karakteristik polimer yang dihasilkan, diameter
zona hambat sediaan biomaterial selulosa bakteri terhadap pertumbuhan
bakteri Staphylococcus aureus.
3. Variabel pengacau terkendali : asal air cucian beras diperoleh, media
pertumbuhan bakteri Staphylococcus aureus (MHA), suhu inkubasi
(37oC), lama inkubasi (24 jam).
C. Definisi Operasional
1. Selulosa bakteri merupakan polimer glukosa yang dihasilkan oleh bakteri
Acetobacter xylinum dengan cara fermentasi selama 7 hari.
2. Air cucian beras adalah limbah cair berwarna putih yang diperoleh dari
hasil pencucian beras varietas rajalele.
3. Kitosan merupakan biopolimer yang dibentuk dari proses deasetilasi kitin
dengan derajat deasetilasi 74,94%.
4. Staphylococcus aureus merupakan bakteri coccus gram positif yang
diperoleh dari Balai Kesehatan Kota Yogyakarta dengan nomor ATCC
25923.
5. Zona hambat adalah zona jernih yang ditimbulkan oleh sampel membran
setelah masa inkubasi 24 jam pada media Mueller Hinton agar yang telah
ditumbuhi bakteri Staphylococcus aureus.
6. Diameter zona hambat adalah pengukuran zona hambat yang diukur tanpa
dikurangi oleh diameter sampel membran.
D. Alat dan Bahan Penelitian
1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer
IR (IR Shimadzu Prestige-21), seperangkat instrumen SEM (Jeol JSM T300),
fine coat ion sputter (Jeol JFC 1100), alat XRD (Rigaku Multiflex 2 kW),
pendingin (Rigaku), timbangan digital (Mettler-Toledo B.V.PC 2000), oven
stirrer-hot plate (Heidolph MR 2002), seperangkat alat gelas (Pyrex dan
Duran), Nampan (Lion Star dengan dimensi 230x176x39 mm), spatula,
magnetic stirrer, timbangan, pisau, talenan, gunting (Han Kwang Korea),
blender (Moulinex), baskom, cawan petri (Pyrex), kain mori, kain warna
hitam, plastik, toples, spuit injeksi i.p. ukuran 1 mL (Terumo), jangka sorong
(Mitutuyo), incubator (Memmert), cawan petri (pyrex), lidi kapas steril (Kirby
bauer).
2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah air limbah
cucian beras, kitosan dari p.a E.Merck, urea dari p.a E.Merck, asam asetat
25% dari p.a.E.Merck, glukosa, supratul, aquades, Staphylococcus aureus
ATCC 25923, starter Bakteri Acetobacter xylinum yang diperoleh dari
Laboratorium Mikrobiologi Balai Kesehatan Yogyakarta, kloramfenikol.
media Mueller-Hinton Agar (MHA), media Brain Heart Infusion broth (BHI
broth).
E. Tata Cara Penelitian
1. Pemilihan bahan
Beras yang dipilih adalah beras yang diambil dari satu jenis merk beras,
yaitu Raja lele. Bahan ini diperoleh dari pembelian di supermarket Indogrosir.
2. Pembuatan limbah air cucian beras
Beras sebanyak 0,5 kg ditampung di baskom, lalu diberi air 1 liter. Beras
didiamkan selama 1 jam. Lalu terbentuk 2 lapisan, lapisan airnya ini diambil
dan digunakan pada tahap selanjutnya.
3. Pembuatan membran kitosan
Sejumlah 2 g dan 10 g kitosan masing-masing dilarutkan dalam 100
mL asam asetat dengan konsentrasi 2% di atas hot plate sambil diaduk dengan
magnetic stirrer. Larutan kitosan lalu dituang ke atas nampan yang telah
dicuci alkohol 70% dan dikeringkan lalu diletakkan selama beberapa hari di
udara terbuka untuk menjamin penguapan solven secara sempurna. Setelah
beberapa hari maka akan terbentuk produk membran yang transparan dan
fleksibel. Membran kitosanyang terbentuk lalu disimpan di dalam toples yang
sebelumnya telah diberi silika gel.
4. Pembuatan material selulosa bakteri
Sebanyak 200 mL air cucian beras hasil penyaringan dituangkan ke
dalam erlenmeyer yang telah dilengkapi dengan pengaduk magnet (stirer),
kemudian ditambahkan 20 g gula pasir dan 1,0 g urea, dan diaduk hingga
larut. Selanjutnya pH dicek, apabila pH larutan masih berkisar antara 5-6,
maka campuran diasamkan dengan penambahan asam asetat 25% hingga pH
= 4 dan diaduk hingga larut. Selanjutnya campuran didinginkan sebentar dan
ditambahkan gliserol sebanyak 1,0 g lalu dituangkan dalam keadaan hangat ke
dalam nampan yang telah disterilkan dengan alkohol 70% dan telah ditutup
sebagian dengan koran sambil didinginkan hingga tercapai suhu kamar. Lalu
dengan rapat menggunakan koran dan difermentasi selama 7 hari pada suhu
kamar.
Setelah 7 hari, penutup koran dibuka dan lapisan pelikel yang
terbentuk diambil lalu dicuci berturut-turut dengan air PAM, dengan aquades,
dengan air panas kemudian lapisan pelikel ini ditimbang dengan timbangan
digital. Lapisan pelikel lalu direndam dengan larutan Natrium hidroksida 3%
selama 48 jam dimana tiap 24 jam sekali larutan Natrium hidroksida 3% ini
diganti lalu setelah 48 jam, lapisan pelikel ini dicuci kembali dengan aquades
setelah dicuci dengan aquades lalu lapisan pelikel ini direndam dengan larutan
asam klorida 3% selama kurang lebih 24 jam. Setelah 24 jam, lapisan pelikel
ini lalu dicuci kembali dengan aquades dan dicek pH-nya dengan pH stik, jika
pH pada pH stik sudah menunjukkan pH mendekati range pH netral,
pencucian dengan aquades ini dihentikan kemudian air di lapisan pelikel ini
dibuang lalu lapisan pelikel ini ditimbang. Setelah ditimbang, lapisan pelikel
ini lalu dikeringkan dalam oven pada suhu 40oC selama kurang lebih dua
minggu.
Setelah 2 minggu atau setelah air pada nampan ini kering, lapisan
pelikel ini dikeluarkan dari oven dan dijemur dibawah cahaya matahari
selama kurang lebih 1 minggu dengan sebelumnya nampan yang berisi pelikel
ini ditutup dengan kain hitam. Setelah 1 minggu atau setelah lapisan pelikel
dalam plastik dan diletakkan di dalam toples yang sebelumnya telah diberi
silika gel.
5. Pembuatan Material Selulosa Kitosan Bakteri
Sebanyak 200 ml air cucian beras hasil penyaringan dituangkan ke
dalam Erlenmeyer yang telah dilengkapi dengan pengaduk magnet,
ditambahkan 20,0 g gula pasir dan 1,0 g urea, selanjutnya diaduk hingga larut.
Campuran diasamkan dengan penambahan asam asetat glasial hingga pH
berkisar antara 3-4. Selanjutnya campuran didinginkan sebentar dan
ditambahkan gliserol sebanyak 1,0 g lalu dituangkan dalam keadaan hangat ke
dalam nampan yang telah disterilkan dengan alkohol 70% dan ditutup dengan
koran sambil didinginkan hingga sesuai suhu kamar. Lalu campuran
ditambahkan 40 mL Acetobacter xylinum dan wadah ditutup dengan rapat
menggunakan koran dan difermentasi selama 7 hari pada suhu kamar.
Lapisan pelikel yang terbentuk dicuci beberapa kali dengan air kran,
lalu dengan aquades, lalu dengan air panas, lalu lapisan pelikel ini ditimbang
dengan timbangan digital. Lapisan pelikel lalu direndam dengan larutan
natrium hidroksida 3% selama 48 jam dimana tiap 24 jam sekali larutan
natrium hidroksida 3% ini diganti lalu setelah 48 jam, lapisan pelikel ini
dicuci kembali dengan aquades setelah dicuci dengan aquades lalu lapisan
pelikel ini direndam dengan larutan asam klorida 3% selama kurang lebih 15
menit. Setelah 15 menit, lapisan pelikel ini lalu dicuci kembali dengan
menunjukkan pH mendekati range pH netral, pencucian dengan aquades ini
dihentikan kemudian air di lapisan pelikel ini dibuang dan lapisan pelikel
ditimbang.
Setelah ditimbang lalu larutan kitosan 2% yang telah dibuat
dituangkan ke atas lapisan pelikel. Lapisan pelikel+larutan kitosan ini lalu
dikeringkan dalam oven pada suhu 40o C selama kurang lebih 2 minggu atau
sampai lapisan pelikel berbentuk lembaran tipis. Setelah lapisan pelikel itu
berbentuk lembaran tipis yang kering dikeluarkan dari oven lalu disimpan di
dalam plastik dan diletakkan di dalam toples yang telah diberi silica gel
supaya biomaterial tetap terjaga kekeringannya.
6. Analisa karakteristik biomaterial :
a. Analisis FT – IR
Analisis ini menggunakan seperangkat alat FTIR dan dilakukan di
Laboratorium Analisis Farmasi Fakultas Farmasi UII.
Langkah-langkahnya adalah lapisan tipis atau pelikel yang diperoleh dari hasil
fermentasi dijepit pada tempat sampel kemudian diletakkan pada alat ke
arah sinar inframerah. Hasilnya akan direkam ke dalam kertas berskala
berupa alur kurva bilangan gelombang terhadap intensitas.
b. Analisa SEM
Material selulosa kitosan bakteri dipotong sedemikian rupa,
kemudian ditempatkan di atas tempat sampel yang terbuat dari kuningan
selama kurang lebih 5 menit. Selanjutnya sampel dimasukkan ke unit
elektron gun melalui bilik pergantian sampel. Kemudian sampel diset
dengan bantuan mikrostage sampai mendapatkan fokus yang tepat.
Tombol utama pada posisi ON dan diset detector Acceleratevoltage set, 20
kilo volt.
c. Analisa XRD
Uji XRD ini dilakukan dengan memakai instrumen X-Ray
Diffraction yang dilakukan di Laboratorium XRD, Jurusan Teknik Kimia
UNY. Langkah-langkahnya adalah lembaran film dipotong dengan ukuran
2x2 cm. Sampel tersebut kemudian dipasang di sample holder dan sampel
diusahakan rata di atas sample holder. Selanjutnya pendingin alat XRD
dihidupkan dan instrumen XRD dihidupkan lalu diatur kondisi alat dengan
sudut putar βθ = β° sampai 80°, scan step = 0,04 dan scan speed = 4
°/menit serta tegangan dan arus pada instrumen disesuaikan dengan
standard measurenment dari instrumen dan dirotasikan agar benar-benar
terorientasi secara acak. Hasil uji ini berupa difraktrogram hubungan
antara intensitas dan sudut βθ.
7. Sterilisasi produk
Saat akan digunakan, produk biomaterial yang sudah dikeringkan
disterilkan dengan etanol 96% selama 15 menit, kemudian dibilas dengan
8. Pengujian aktivitas antimikroba
a. Pembuatan suspensi bakteri uji
Isolat murni Staphylococcus aureus ditambahkan ke dalam media BHI
broth yang diinkubasi pada 37oC selama kurang lebih 4 jam sampai
kekeruhan Brain Heart Infusion broth (BHI broth) menyamai
kekeruhannya McFarland no.0,5.
b. Pembuatan media
Media yang digunakan untuk uji aktivitas antimikroba adalah MHA.
Larutan MHA dituangkan ke dalam cawan petri sebanyak 20 mL dan
dibiarkan beberapa saat hingga memadat.
c. Penanaman bakteri uji
Hasil suspensi bakteri uji dimasukkan ke dalam media Mueller-Hinton
Agar (MHA) dengan cara dioleskan secara merata dengan menggunakan
lidi kapas steril Kirby bauer , lalu didiamkan kurang lebih selama 5
menit.
d. Pemberian kontrol positif pada bakteri uji
Sebagai kontrol positif, digunakan paper disk antibiotik amoxicillin.
Bakteri uji yang sudah ditanamkan pada Mueller-Hinton Agar kemudian
diberi paper disk amoxicillin tadi sebanyak 1 disk per plate. Kemudian
inkubasikan pada 37oC selama 24 jam.
Sebagai kontrol negatif, digunakan asam asetat. Sebanyak 20 µl asam
asetat diteteskan pada paper disk. Bakteri uji yang sudah ditanamkan pada
Mueller-Hinton Agar kemudian diberi paper disk berisi asam asetat tadi
sebanyak 4 disk per plate. Kemudian inkubasikan pada 37oC selama 24
jam.
f. Pemberian biomaterial,selulosa dan kitosan pada bakteri uji
Bakteri uji yang sudah ditanamkan pada Mueller-Hinton Agar
kemudian diberi potongan biomaterial. Biomaterial ini dipotong serupa
dengan bentuk dan ukuran paper disk yang bertindak sebagai kontrol
positif dan kontrol negatif tadi dan sudah disterilisasi menggunakan
etanol 96% dan buffer phosphat. Potongan masing-masing biomaterial
kemudian diletakkan sebanyak 4 potongan biomaterial per plate.
Kemudian inkubasikan pada 37oC selama 24 jam. Hal yang sama juga
dilakukan untuk membran kitosan dan selulosa bakteri.
g. Pengukuran zona hambat
Pengukuran zona hambat dilakukan dengan mengukur diameter zona
hambat dalam millimeter, kemudian dihitung dengan menggunakan
program statistik SPSS untuk mengetahui ada tidaknya perbedaan
F. Analisis Data
1. Analisis karakteristik dari biomaterial yang terbentuk ini meliputi analisis
gugus fungsional, kristalinitas dan topografi permukaan dari biomaterial.
2. Analisis hasil untuk pengamatan makroskopis dilakukan dengan cara
pengamatan zona hambat setelah pemberian biomaterial pada bakteri
Staphylococcus aureus.
3. Analisis sifat mekanik dan diameter luka diuji dengan statistik Kruskal
wallis (distribusi tidak normal) dan Uji Post Hoc – Mann Whitney
41 BAB IV
HASIL DAN PEMBAHASAN
Tujuan penelitian ini adalah untuk mengetahui karakteristik
biomaterial selulosa bakteri dari air cucian beras dengan penambahan kitosan
dan untuk mengetahui aktivitas antimikroba sediaan biomaterial selulosa
bakteri dari air cucian beras dengan penambahan kitosan sebagai material
penutup luka pada bakteri Staphylococcus aureus.
A. Pembuatan Biomaterial Selulosa Bakteri
Dalam penelitian ini, digunakan beras dengan jenis dan merk yang
sama, supaya adanya variabel pengacau bisa sedikit dikendalikan. Beras yang
digunakan adalah jenis rojolele. Pembelian beras juga dilakukan di tempat
yang sama, agar memudahkan peneliti untuk memperoleh beras dengan jenis
dan merk yang sama.
Sebelum melakukan pembuatan biomaterial selulosa, beras
diidentifikasi terlebih dahulu melalui pembuktian bahwa yang digunakan
dalam penelitian ini adalah beras. Dilakukan juga pengujian terhadap
kandungan amilum dari beras tersebut. Alasan dilakukan identifikasi amilum
ini karena gula merupakan sumber utama media pertumbuhan Acetobacter
xylinum. Hal ini sesuai dengan pernyataan Hidayat (2006) yang mengatakan