PENGUJIAN MUTU BEBERAPA SEDIAAN PARASETAMOL DROPS YANG BEREDAR DI SALAH SATU INSTALASI
FARMASI RUMAH SAKIT DI KOTA MEDAN
SKRIPSI
OLEH:
RIDHA ANNISA NIM 141501051
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGUJIAN MUTU BEBERAPA SEDIAAN PARASETAMOL DROPS YANG BEREDAR DI SALAH SATU INSTALASI
FARMASI RUMAH SAKIT DI KOTA MEDAN
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
RIDHA ANNISA NIM 141501051
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2018
KATA PENGANTAR Bismillahirahmanirrahim,
Puji dan syukur kehadiratan Allah yang Maha Kuasa yang telah melimpahkan rahmat, karunia dan ridhoNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pengujian Mutu Beberapa Sediaan Parasetamol Drops yang Beredar di Salah Satu Instalasi Farmasi Rumah Sakit di Kota Medan”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Salah satu parameter mutu sediaan drops adalah penentuan pH, bobot jenis, viskositas, studi rhelogi dan penetapan kadar. Tujuan penelitian ini adalah untuk memberikan informasi mutu kepada masyarakat apakah sediaan drops parasetamol yang beredar di salah satu instalasi farmasi rumah sakit di Kota Medan memenuhi persyaratan Farmakope Indonesia atau tidak. Hasil penelitian dengan parameter uji pH, bobot jenis dan penetapan yang dilakukan memenuhi persyaratan Farmakope Indonesia dan evaluasi studi rheologi menghasilkan aliran pseudoplastis.
Penulis mengucapkan terima kasih kepada Bapak Drs. Agusmal Dalimunthe, M.S., Apt., selaku pembimbing yang telah memberikan panduan dan kepercayaan penuh kepada penulis untuk menyempurnakan kajian ini. Ucapan terima kasih juga penulis sampaikan kepada Bapak Prof. Dr. Wiryanto, M.S., Apt., selaku ketua penguji dan Ibu Sri Yuliasmi, M.Si., Apt., selaku anggota penguji yang telah memberikan kritik dan saran yang membangun untuk penyempurnaan skripsi ini. Penulis juga mengucapkan terima kasih kepada Ibu Prof. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera
Utara yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi.
Penulis juga mengucapkan terima kasih kepada kedua orang tua penulis yang terspesial, Ayahanda Sumantri dan Ibunda Khairiah Lubis yang telah memberikan banyak bantuan baik materi, moral maupun spiritual, beserta abang penulis Heri Muda Setiawan, S.Hut., dan Firman Adi Putra, kakak penulis Rizky Iskandar, S.E., dan adik penulis Aidil Nurul Ichwan serta keluarga besar penulis.
Penulis juga mengucapkan terima kasih kepada teman-teman stambuk 2014 yang tidak disebutkan satu persatu namanya, terkhusus Elsya, Fitrah, dan Sherly yang selalu memberikan semangat selama jurusan Farmasi USU, serta Erwin Harahap, Nur Hasnah Parinduri, S.P, Husna Syukrika S.Pi, dan Ismi Hamzah Harahap yang juga selalu bisa menjadi rekan diskusi, bercanda serta menjadi rekan yang selalu mengingatkan penulis ketika rasa malas datang dalam proses pengerjaan Skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat memberikan manfaat bagi kita semua.
Medan, Desember 2018 Penulis
Ridha Annisa NIM 141501051
SURAT PERNYATAAN ORISINALITAS Saya yang bertanda tangan dibawah ini,
Nama : Ridha Annisa
Nomor Induk Mahasiswa : 141501051
Program Studi : S-1 Reguler Farmasi
Judul Skripsi : Pengujian Mutu Beberapa Sediaan Parasetamol Drops yan Beredar di Salah Satu Instalasi Farmasi Rumah Sakit di Kota Medan
Dengan ini menyatakan bahwa skripsi yang saya buat adalah asli karya saya sendiri dan bukan plagiat. Apabila di kemudian hari diketahui skripsi saya tersebut terbukti plagiat karena kesalahan sendiri, maka saya bersedia diberi sanksi apapun oleh Program Studi Sarjana Farmasi Fakultas Farmasi Universitas Sumatera Utara. Saya tidak menuntun pihak manapun atas perbuatan saya tersebut.
Demikian surat pernyataan ini saya perbuat dan dalam keadaan sehat.
Medan, Desember 2018
Ridha Annisa NIM 141501051
PENGUJIAN MUTU BEBERAPA SEDIAAN PARASETAMOL DROPS YANG BEREDAR DI SALAH SATU INSTALASI FARMASI RUMAH
SAKIT DI KOTA MEDAN ABSTRAK
Latar Belakang: Teknologi farmasi sejak dulu sudah berkembang pesat sehingga dengan adanya perkembangan tersebut industri farmasi akan lebih mudah dalam memproduksi obat-obat dengan kualitas yang baik, khususnya dalam hal kestabilan obat. Stabilitas obat penting untuk diperhatikan karena akan berdampak pada efektifitas, keamanan dan mutu obat. Uji mutu adalah pengujian laboratorium yang dilakukan untuk membuktikan mutu obat selalu konsisten memenuhi standar dan persyaratan.
Tujuan: Tujuan dari penelitian ini adalah untuk mengetahui mutu bentuk sediaan drops yang mengandung parasetamol yang beredar di apotek kota Medan.
Metode: Pengujian mutu drops ini diambil empat merek drops parasetamol dari salah satu instalasi farmasi rumah di kota Medan. Empat merek drops parasetamol tersebut yaitu Parasetamol 15 mL/botol (Generik), Fasidol 15 mL/botol (Ifars), Grafadon (Graha farma), Sanmol 15 mL/botol (Sanbe Farma). Pengujian mutu dilakukan berdasarkan parameter mutu drops meliputi uji pH dengan alat pH meter, uji bobott jenis dengan alat piknometer, uji viskositas dengan alat viskometer, studi rheologi dan penetapan kadar dilakukan secara spektrofotometri.
Hasil: Hasil uji menunjukkan bahwa hasil uji pH berkisar antara 5,1 s/d 6,1, uji bobot jenis diperoleh berkisar antara 1,22 g/ mL s/d 1,23 g/ mL, uji viskositas 50 cp s/d 125 cp dan pada penetapan kadar yang diperoleh berkisar antara 100,412 % s/d 109,948 % dan studi rheologi menunjukkan aliran pseudoplastis.
Kesimpulan: Berdasarkan hasil penelitian dapat disimpulkan bahwa bentuk sediaan drops yang mengandung parasetamol yang beredar di instalasi farmasi rumah sakit di kota Medan yang diuji berdasarkan uji penetapan kadar memenuhi persyaratan yaitu tidak kurang dari 90,0 % dan tidak lebih dari 110,0 %, uji pH memenuhi persaratan yaitu antara 3,6-6,1 dan uji bobot jenis memenuhi persyaratan yaitu antara1,21-1,23 g/mL (Badan POM, 2014). Dan parameter lainnya yaitu uji viskositas dan studi rheologi yang menghasilkan aliran pseudoplastis.
Kata Kunci: pengujian mutu, parasetamol drops, instalasi farmasi rumah sakit kota medan
TESTING OF SOME QUALITY OF DROPS PARACETAMOL INVOLVED IN ONE HOSPITAL PHARMACEUTICAL INSTALLATION
IN MEDAN CITY ABSTRACT
Background: Pharmaceutical technology has developed rapidly so that with the development of the pharmaceutical industry, it will be easier to produce good quality drugs, especially in terms of drug stability. The stability of the drug is important to note because it will have an impact on the effectiveness, safety and quality of the drug. Quality testing is laboratory testing conducted to prove the quality of the drug is always consistent with the standards and requirements.
Objective: The purpose of this study was to determine the quality of drop dosage forms containing paracetamol circulating in the pharmacy in Medan.
Method: Four drops of paracetamol were taken from one of the home pharmacy installations in the city of Medan. Four brands of paracetamol drops were Paracetamol 15 mL / bottle (Generic), 15 mL Fasidol / bottle (Ifars), Grafadon (Graha farma), Sanmol 15 mL / bottle (Sanbe Farma). Quality testing was carried out based on the quality parameters of drops including pH test with a pH meter, specific gravity test with a picnometer, viscosity with a viscometer, rheological study and drug content determination carried out by spectrophotometry.
Results: The test results showed that the pH test results ranged from 5.1 to 6.1, the density test obtained ranged from 1.21 g / mL to 1.23 g / mL, the viscosity test was 50 cp until 125 cp and the determination of the levels obtained ranged from 100.412% to 109.948% and rheological studies showed pseudoplastic flow.
Conclusion: Based on the results of the study it can be concluded that the dosage forms of drops containing paracetamol circulating in hospital pharmacy installations in the city of Medan were tested based on the assay that met the requirements, not less than 90.0% and no more than 110.0%, test pH meets the requirements, which are between 3.6-6.1 and the density test meets the requirements, which are between 1.21-1.23 g / mL (Badan POM, 2014). And other parameters are viscosity tests and rheological studies that produce pseudoplastic flow.
Keywords: quality testing, paracetamol drops, hospital pharmacy installation, medan city
DAFTAR ISI
HALAMAN JUDUL ...i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
SURAT PERNYATAAN ORISINALITAS ... v
ABSTRAK ...vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ...xi
DAFTAR LAMPIRAN ... ...xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 3
1.2 Perumusan Masalah ... 3
1.3 Hipotesa ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Instalasi Farmasi Rumah Sakit ... 5
2.2 Uraian Umum ... 6
2.3.1 Sifat Fisika dan Kimia Parasetamol ... 6
2.3 Farmakologi ... 7
2.4 Spektrofotometri Ultraviolet ... 8
2.5 Pengertian Drops ... 10
2.5.1 Macam-Macam Drops ... 10
2.6 Sediaan Larutan Oral ... 11
2.6.1 Pengertian Larutan ... 11
2.6.2 Jenis-Jenis Larutan ... 11
2.6.2 Keuntungan dan Kerugian Sediaan Larutan ... 12
2.7 Evaluasi Sediaan Drops ... 12
2.7.1 Uji Viskositas ... 12
2.7.2 Studi Rheologi ... 13
2.7.3 Uji pH ... 15
2.7.4 Uji Bobot Jenis ... 15
BAB III METODE PENELITIAN ... 16
3.1 Alat dan Bahan ... 16
3.1.1 Alat-alat ... 16
3.1.2 Bahan-bahan ... 16
3.2 Pembuatan Pereaksi ... ....16
3.2.1 Air Bebas Karbondioksida ...16
3.2.2 Pembuatan NaOH 0,1 N ... 16
3.3 Prosedur Penelitian... 17
3.3.1 Pembuatan Larutan Induk Baku Pembanding ... 17
3.3.2 Penetapan Panjang Gelombang Serapan Maksimum ... 17
3.3.3 Pembuatan dan Penentuan Liniearitas Kurva Kalibrasi ... 17
3.3.4 Penetapan kadar Parasetamol dalam Sediaan Drops ... 18
3.3.5 Parameter Evaluasi ... 18
3.3.5.1 Uji Viskositas ... 18
3.3.5.2 Uji pH ... ... ...18
3.3.5.3 Uji Berat Jenis ... 19
3.3.9 Studi Rheologi Sediaan ... 19
3.3.7 Analisis Data Secara Statistik ... 20
BAB IV HASIL DAN PEMBAHASAN ... 21
4.1 Hasil ... ... ... 21
4.1.1 Hasil Uji pH Drops Parasetamol ... 21
4.1.2 Hasil Berat Jenis Drops Parasetamol ...21
4.1.3 Hasil Uji Viskositas Drops Parasetamol ... 22
4.1.4 Hasil Uji Rheologi Drops Parasetamol ... 23
4.1.5 Hasil Penentuan Panjang Gelombang Serapan Maksimum dan Linieritas Kurva Kalibrasi ... ... 24
4.1.6 Hasil Penetapan Kadar Parasetamol Dalam Sampel Sediaan ... 25
BAB V KESIMPULAN DAN SARAN ... 26
5.1 Kesimpulan ... 26
5.2 Saran ... 26
DAFTAR PUSTAKA ... 27
LAMPIRAN ... 29
DAFTAR TABEL
4.1 Hasil Uji pH Drops Parasetamol ... 21
4.2 Hasil Uji Bobot Jenis Drops Parasetamol ... 21
4.3 Hasil Uji Viskositas Drops Parasetamol ...\22
4.4 Kadar Rata-rata Parasetamol pada Sediaan Drops ... 25
DAFTAR GAMBAR
4.1 Grafik Hasil Uji Rheologi ... 23
DAFTAR LAMPIRAN
1. Sertifikat Baku Pembanding ... 29
2. Daftar Spesifikasi Sampel ...30
3. Kurva Panjang Gelombang ... ...31
4. Kurva Kalibrasi ... ...32
5. Data Kalibrasi dan Perhitungan Persamaan Regresi Parasetamol Drpos ... 33
6. Pehitungan Kadar Sampel ... 35
7. Perhitungan Statistik Kadar Parasetamol Drops ... 53
8. Perhitungan Statistik Kadar Fasidol® Drops ... ...55
9. Perhitungan Statistik Kadar Grafadon® Drops ... ...57
10. Perhitungan Statistik Kadar Sanmol® Drops ... ...59
11. Perhitungan Viskositas Sampel ... 61
12. Perhitungan Bobot Jenis... 62
13. Tabel Hasil Uji Rheologi Sampel ... 63
14. Gambar Sampel ... 65
15. Gambar Alat ... 66
BAB I PENDAHULUAN
1.1 Latar Belakang
Teknologi farmasi sejak dulu sudah berkembang pesat sehingga dengan adanya perkembangan tersebut industri farmasi akan lebih mudah dalam memproduksi obat-obat dengan kualitas yang baik, khususnya dalam hal kestabilan obat. Stabilitas obat penting untuk diperhatikan karena akan berdampak pada efektifitas, keamanan dan mutu obat (Deviarny, 2012).
Stabilitas fisika adalah mengevaluasi perubahan sifat fisika dari suatu produk yang tergantung waktu (periode penyimpanan). Contoh dari perubahan fisika antara lain migrasi (perubahan) warna, perubahan rasa, perubahan bau, perubahan tekstur atau penampilan. Evaluasi dari uji stabilitas fisika meliputi:
pemeriksaan organoleptis, homogenitas, pH, bobot jenis (Vadas, 2000).
Uji mutu adalah pengujian laboratorium yang dilakukan untuk membuktikan mutu obat selalu konsisten memenuhi standar dan persyaratan (Permenkes RI, 2016).
Pada penelitian ini peneliti melakukan survei pendahuluan ke beberapa Apotek Rumah Sakit di kota Medan untuk mengetahui obat demam apa yang sering digunakan pada anak-anak khususnya anak bayi yanag berusia 0 bulan sampai 1 tahun dan yang sering digunakan adalah sediaan drops yang mengandung parasetamol. Jumah merek drops parasetamol yang beredar di pasaran ada 9 yaitu Parasetamol generik dan merek lainnya yaitu Fasidol®, Sanmol®, Grafadon®, Ottopan®, Naprex®, Panadol®, Praxion®, Tempra®. Merek
obat yang dijadikan sampel adalah Parasetamol generik, Fasidol®, Sanmol® dan Grafadon®. Penelitian ini dilakukan untuk memberikan informasi kepada masyarakat bahwa efek dari obat generik dan yang bermerek memiliki efek yang sama.
Demam merupakan salah satu keluhan utama tersering yang disampaikan pasien pada saat berobat ke dokter atau ke tempat pelayanan kesehatan. Demam atau pireksia didefinisikan bila suhu tubuh lebih dari normal sebagai akibat peningkatan pusat pengaturan suhu dihipotalamus yang dipengaruhi oleh Interleukin 1 (Soedarmo, 2002). Demam disebabkan karena substansi pirogen yang berhasil memasuki sirkulasi, baik sistemik maupun lokal, serta akibat respon terhadap stimulan awal yang biasanya timbul karena infeksi atau inflamasi (Harrison, 1999). Untuk mengurangi atau menurunkan demam dapat digunakan obat antipiretik. Obat antipiretik yang biasa digunakan adalah parasetamol (Heirmayani, 2007).
Parasetamol merupakan salah satu obat golongan analgetik-antipiretik yang digunakan sangat luas di kalangan masyarakat Indonesia, selain harganya yang cukup terjangkau juga memiliki aktifitas yang mampu menekan sistem saraf pusat secara selektif dan relatif aman dengan dosis terapi. Parasetamol adalah paraaminofenol yang merupakan metabolit fenasetin dan telah digunakan sejak tahun 1893 (Wilmana, 1995). Parasetamol (asetaminofen) mempunyai daya kerja analgetik, antipiretik, tidak mempunyai daya kerja anti radang dan tidak menyebabkan iritasi serta peradangan lambung (Sartono,1993). Hal ini disebabkan parasetamol bekerja pada tempat yang tidak terdapat peroksid sedangkan pada tempat inflamasi terdapat peroksid yang melepaskan peroksid
sehingga efek anti inflamasinya tidak bermakna. Parasetamol berguna unuk nyeri ringan sampai sedang seperti nyeri kepala, mialgia, nyeri paska melahirkan dan keadaan lain (Katzung, 1992).
Oral drops adalah larutan, emulsi, atau suspensi yang dibuat dalam jumlah kecil atau volume kecil, dan drops menggunakan bahan-bahan yang sesuai (British Pharmacopoeia, 2002). Larutan Oral Parasetamol mengandung Parasetamol, C8H9NO2 tidak kurang dari 90,0% dan tidak lebih dari 110,0 % dari jumlah yang terera pada etiket (Badan POM, 2014).
Parasetamol dapat ditentukan kadarnya dengan metode nitrimetri, spektrofotometri (baik UV maupun dengan cara spektrofotometri visibel) dan kromatografi cair kinerja tinggi (KCKT) (Sudjadi dan Rohman, 2008). Secara spektrofotometri ultraviolet dalam suasana basa dengan panjang gelombang 257 nm dan suasana asam pada panjang gelombang 245 nm. (Moffat, 1986).
Metode spektrofotometri ultraviolet memiliki banyak keuntungan antara lain dapat digunakan untuk analisis zat dalam jumlah kecil, pengerjaan mudah, sederhana, cukup sensitif, selektif, biayanya murah dan mempunyai kepekaan analisis yang cukup tinggi (Munson,1984).
1.2 Perumusan Masalah
Apakah sediaan drops Parasetamol yang beredar di Instalasi Farmasi Rumah Sakit Kota Medan memenuhi persyaratan mutu menurut Farmakope Indonesia.
1.3 Hipotesa
Sediaan drops Parasetamol yang beredar di Instalasi Farmasi Rumah Sakit Kota Medan memenuhi persyaratan mutu menurut Farmakope Indonesia.
1.4 Tujuan Penelitian
Untuk mengetahui apakah sediaan drops Parasetamol yang beredar di Instalasi Farmasi Rumah Sakit Kota Medan memenuhi persyaratan mutu Farmakope Indonesia.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat untuk memberikan informasi kepada masyarakat dan instansi terkait, terutama bagi pelayanan kesehatan mengenai mutu sediaan drops Parasetamol yang beredar di Instalasi Farmasi Rumah Sakit Kota Medan memenuhi persyaratan Farmakope Indonesia.
1.6 Kerangka pikir Penelitian
Variabel bebas Variebal terikat pH
Viskositas Berat jenis Studi rheologi Penetapan kadar
Pengujian mutu obat
drops yang
mengandung parasetamol
BAB II
TINJAUAN PUSTAKA
2.1 Instalasi Farmasi Rumah Sakit
Rumah Sakit adalah institusi pelayanan kesehatan yang menyelenggarakan pelayanan kesehatan perorangan secara paripurna yang menyediakan pelayanan rawat inap, rawat jalan, dan gawat darurat (Permenkes RI, 2016).
Standar Pelayanan Kefarmasian adalah tolok ukur yang dipergunakan sebagai pedoman bagi tenaga kefarmasian dalam menyelenggarakan pelayanan kefarmasian (Permenkes RI, 2016).
Pelayanan Kefarmasian adalah suatu pelayanan langsung dan bertanggung jawab kepada pasien yang berkaitan dengan sediaan farmasi dengan maksud mencapai hasil yang pasti untuk meningkatkan mutu kehidupan pasien (Permenkes RI, 2016).
Instalasi farmasi merupakan suatu unit yang memberi pendapatan yang cukup berarti untuk sebuah rumah sakit serta adanya tuntutan pasien dan masyarakat akan mutu pelayanan farmasi, mengharuskan adanya perubahan pelayanan dari paradigma lama (drug oriented) ke paradigma baru (patient oriented) dengan filosofi pharmaceutical care (pelayanan kefarmasian) maka pelayanan kesehatan di rumah sakit harus selalu berbenah diri dalm meningkatkan mutu layanan kesehatan, salah satu hal yang menjadi indikator dalam menilai mutu pelayanan kesehatan di rumah sakit menurut dimensi pasien adalah waktu tunggu pelayanan resep di instalasi farmasi (Rakhmisari, 2006).
2.2 Uraian Umum
2.2.1 Sifat Fisika dan Kimia Parasetamol
Sinonim : Paracetamolum
Asetaminofen.
Nama kimia : 4-hidroksiasetanilida.
Rumus molekul : C8H9NO2
Rumus bangun : HO NHCOCH3
Kandungan : tidak kurang dari 90,0 % dan tidak lebih dari 110,0% C8H9NO2, dihitung terhadap zat yang telah dikeringkan.
Pemerian : Serbuk hablur, putih, tidak berbau, rasa sediki pahit.
Kelarutan : Larut dalam air mendidih dan dalam natrium hidroksida 1 N, mudah larut dalam etanol.
Penyimpanan : Dalam wadah tertutup rapat dan tidak tembus cahaya
(Ditjen POM., 1995).
2.3 Farmakologi
Parasetamol merupakan obat yang bersifat analgesik (penahan rasa sakit/
nyeri) dan antipiretik (penurun panas/demam) adalah obat yang paling banyak dikonsumsi oleh masyarakat, karena obat ini dapat berkhasiat untuk menyembuhkan demam, sakit kepala dan rasa nyeri. Umumnya obat yang bersifat analgetik dan antipiretik ini mengandung zat aktif yang disebut asetaminofen atau
lebih dikenal dengan nama parasetamol. Obat ini beredar di masyarakat dalam berbagai macam sediaan tablet, kaplet, kapsul, sirup, dan serbuk (Rachdiati, 2008).
Parasetamol merupakan metabolit fenasetin dengan efek antipiretik ditimbulkan oleh gugus aminobenzen. Asetaminofen di Indonesia lebih dikenal dengan nama parasetamol, dan tersedia sebagai obat bebas (Wilmana, 1995).
Parasetamol (asetaminofen) merupakan golongan para aminofenol bersama dengan fenasetin. Efek samping golongan ini serupa dengan salisilat yaitu menghilangkan atau mengurangi nyeri ringan sedang, dan dapat menurunkan suhu tubuh dalam keadaan demam, dengan mekanisme efek sentral.
Efek samping dari parasetamol dan kombinasinya pada penggunaan dosis besar atau jangka lama dapat menyebabkan kerusakan hati (Dermawan, 2015).
Efek analgetik Parasetamol dapat menghilangkan atau mengurangi nyeri ringan sampai sedang. Paracetamol menghilangkan nyeri, baik secara sentral maupun secara perifer. Secara sentral diduga Paracetamol bekerja pada hipotalamus sedangkan secara perifer, menghambat pembentukan prostaglandin di tempat inflamasi, mencegah sensitisasi reseptor rasa sakit terhadap rangsang mekanik atau kimiawi. Efek antipiretik dapat menurunkan suhu demam. Pada keadaan demam, diduga termostat di hipotalamus terganggu sehingga suhu badan lebih tinggi (Dermawan, 2015).
Parasetamol bekerja dengan mengembalikan fungsi termostat ke keadaan normal. Pembentukan panas tidak dihambat tetapi hilangnya panas dipermudah dengan bertambahnya aliran darah ke perifer dan pengeluaran keringat. Efek
penurunan suhu demam diduga terjadi karena penghambatan terbentuknya prostaglandin (Stinger, 2009).
2.4 Spektrofotometri Ultraviolet
Teknik spektroskopis adalah suatu teknik analisis fisika kimia yang mengamati tentang interaksi atom atau molekul dengan rasdiasi elektromagnetik.
Pada prinsipnya interaksi radiasi elektromagnetik dengan molekul akan menghasilkan satu atau dua dari tiga kejadian yang mungkin terjadi. Ketiga macam kejadian yang mu gkin terjadi adalah hamburan (scattering), absorpsi (absorption), dan emisi (emision) radiasi elektromagnetik oleh atom atau molekul yang diamati (Mulja dan Suharman, 1997).
Spektrofotometer adalah alat yang terdiri dari spektrometer dan fotometer.
Spektrometer berfungsi untuk menghasilkan sinar dengan panjang gelombang tertentu dan fotometer berfungsi sebagai alat pengukur intensitas cahaya yang diabsorbsi (Khopkar,1990). Keuntungan utama metode spektrofotometri yaitu dapat menetapkan kadar suatu zat yang sangat kecil (Vogel,1994).
Spektrofotometri Ultraviolet adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet yang diabsorbsi oleh sampel. Sinar ultraviolet memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi ultraviolet biasanya digunakan untuk senyawa di dalam larutan. Spektrum ultraviolet mempunyai pita yang lebar dan hanya sedikit informasi tentang struktur yang biasa didapatkan dari spektrum ini.
Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif.
Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur serapan
pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer (Dachriyanus,2004).
Menurut hukum Lambert, serapan (A) berbanding lurus dengan ketebalan lapisan (b) yang disinari :
A= k. b
Dengan bertambahnya ketebalan lapisan, serapan akan bertambah.
Menurut Hukum Beer, yang hanya berlaku untuk cahaya monokromatis dan larutan yang sangat encer, serapan (A) dan konsentrasi (c) adalah proporsional:
A= k. c
Jika konsentrasi bertambah, jumlah molekul yang dilalui berkas sinar akan bertambah, sehingga serapan juga bertambah.
Kedua persamaan ini digabungkan dalam hukum Lambert-Beer, maka diperoleh bahwa serapan berbanding lurus dengan konsentrasi dan ketebalan lapisan:
A= k . c. b
Nilai tetapan (K ) dalam hukum Lambert-Beer tergantung pada sistem konsentrasi mana yang digunakan. Bila c dalam gram perliter, tetapan tersebut disebut dengan absorptivitas (a) dan bila dalam mol per liter tetapan tersebut adalah absorbtivitas molar (∈ ) (Day and Underwood,1999).
Parasetamol secara struktur diketahui mempunyai gugus kromofor dan gugus auksokrom yang menyebabkan senyawa ini dapat menyerap radiasi pada daerah ultraviolet. Parasetamol mempunyai spektrum ultraviolet dalam suasana asam pada panjang gelombang 245 nm ( 668 a) dan dalam suasana basa pada panjang gelombang 257 nm ( 715 a) (Moffat, 1986).
2.5 Pengertian Drops (Guttae)
Drops atau guttae adalah sediaan cair berupa larutan, emulsi atau suspensi dimaksudkan untuk obat dalam atau obat luar, digunakan dengan cara meneteskan menggunakan penetes yang menghasilkan tetesan yang setara dengan penetes baku (Ditjen POM, 1979).
2.5.1 Macam-Macam Drops (Guttae)
a. Guttae Ophthalmicae (obat tetes mata): sediaan steril, berupa larutan jernih atau suspensi, bebas partikel asing, digunakan untuk mata dengan cara meneteskan obat pada selaput lendir mata di sekitar kelopak mata dan bola mata.
b. Solutio otic/guttae auriculares (obat tetes telinga): larutan yang mengandung atau gliserin atau pelarut lain dan bahan pendispensi, untuk penggunaan telinga luar. Biasanya mengandung antibiotik, sulfonamida, anestetik lokal, peroksida (H2O2), fungisida, asam borat, NaCl, gliserin, dan propilen glikol.
c. Guttae nasales/Nose drops (obat tetes hidung): obat tetes yang digunakan untuk hidung dengan cara meneteskan obat ke dalam rongga hdung, dapat mengandung zat pensuspensi, pemdapar, dan pengawet.
d. Nebula/Inhalationes/Nose spray (obat semprot hidung): sediaan yang dimaksudkan untuk disedot hidung atau mulut, atau disemprotkan (nose spray) dalam bentuk kabut ke dalam saluran pernafasan.
e. Guttae oris (obat tetes mulut): obat tetes yang digunakan untuk mulut dengan cara mengencerkan lebih dahulu dengan sir untuk dikumur-kumurkan, tidak untuk ditelan (Syamsuni, 2006).
2.6 Sediaan Larutan Oral 2.6.1 Pengertian Larutan
Larutan adalah sediaan cair yang mengandung satu atu lebih zat kimia yang terlarut, misal: terdispersi secara molekuler dalam pelarut yang sesuai atau campuran pelarut yang saling bercampur. Karena molekul-molekul dalam laurtan terdispesi secara merata, maka penggunaan larutan sebagai bentuk sediaaan, umumnya memberikan jaminan keseragaman dosis dan memiliki ketelitian yang baik jika larutan diencerkan atau dicampurkan (Ditjen POM, 1995).
Larutan oral adalah sediaan cair yang dibuat untuk pemberian oral, mengandung satu atau lebih zat dengan atau tanpa bahan pengaroma, pemanis atau pewarna yang larut dalam ir atau campuran kosolven-air. Larutan oral dapat diformulaasikan untuk diberikan langsung secara oral kepada pasien atau dalam bentuk lebih pekat yang harus diencerkan lebih dulu sebelum diberikan (Ditjen POM, 1995).
2.6.2 Jenis-Jenis Larutan
Larutan dapat dibedakan menjadi beberapa sifat, yaitu sebagai berikut (Keenan, 1996):
1. Larutan encer adalah larutan yang mengandung sejumlah kecil zat terlarut relatif terhadap jumlah zat pelarut.
2. Larutan pekat adalah larutan yang mengandung sebagian besar jumlah zat terlarut.
3. Larutan lewat jenuh adalah larutan yang tidak dapat melarutkan zat terlarut atau sudah terjadi pengendapan.
4. Larutan belum jenuh adalah larutan yang masih bisa untuk melarutkan zat terlarut atau belum terjadi atau terbentuk endapan.
5. Larutan tepat jenuh adalah larutan yang menimbulkan endapan.
2.6.3 Keuntungan dan Kerugian Sediaan Larutan
Menurut (Syamsuni, 2006), keuntungan dari sediaan larutan antara lain:
1. Merupakan campuran homogen
2. Dosis dapat diubah-ubah dalam pembuatan
3. Dapat diberikan dalam larutan encer, sedangkan kapsul dan tablet sulit diencerkan
4. Kerja awal obat lebih cepat, karena obat cepat di absorbsi 5. Mudah diberi pemanis, pengaroma, pewarna
6. Untuk pemakaian luar mudah digunakan.
Kerugian dari sediaan larutan ntara lain:
1. Ada obat yang tidak stabil dalam larutan
2. Ada obat yang sukar ditutupi rasa dan baunya dalam larutan.
2.7 Evaluasi Sediaan Drops 2.7.1 Uji Viskositas
Viskositas adalah suatu pernyataan tahanan dari suatu cairan untuk mengalir; makin tinggi viskositas makin tingggi tahanannya (Martin, 1993).
Viskositas biasanya diterima sebagai “kekentalan” atau penolakan terhadap penuangan. Viskositas menggambarkan penolakan dalam fluid kepada aliran dapat dipikir sebagai cara untuk mengukur gesekan fluid. Prinsip dasar
penerapan viskositas digunakan dalama sifat alir zat cair atau rheologi (Moechtar, 1990).
2.7.2 Studi Rheologi
Rheologi berasal dari bahasa Yunani rheo (mengalir) dan logos (ilmu).
Rheologi penting dalam farmasi dan penerapannya adalah dalam formulasi dan analisi dari produk farmasi, seperti: emulsi, suspensi, pasta, suppositoria, dan penyalutan tablet (Martin, 1993).
Rheologi meliputi pencampuran dan aliran dari bahan, pemasukannya ke dalam wadah, dan pemindahannya sebelum digunakan, apakah dicapai dengan penuangan dari botol, pengeluaran dari tube, atau pelewatan dari suatu jarum suntik. Rheologi dari suatu produk tertentu yang dapat berkisar dalam konsistensi dari bentuk cair ke semisolid sampai ke padatan dapat mempengaruhi penerimiaan bagi pasien, stabilitas fisika, dan bakan bioavaibilitas. Jadi viskositas telah terbukti mempengaruhi laju absorbsi obat dari saluran cerna (Martin, 1993).
Reogram rheologi terbagi dua kurva yang berbeda. Satu kurva menunukkan peningkatan laju geser (kurva menaik). Sedangkan, kurva lainnya menggambarkan perlambatan laju geser (kurva menurun). Kedua kurva ini didapatkan dengan melakukan pengukuran dari laju geser nol ke maksimum dan kembali lagi ke laju geser nol (Triantafillopoulos, 1998).
Berdasarkan hukum Newton tentang sifat alir cairan, maka tipe aliran dibedakan menjadi 2, yaitu:
1. Newtonian
Cairannya mengalir mengikuti aturan-aturan viskositas.
2. Non Newtonian
Aturannya tidak mengikuti aturan viskositas. Cairan biasanya memiliki ukuran molekul yang paling besar atau mempunyai struktur tambahan, misalnya koloid. Untuk mengalirkan cairan bukan cairan Newton sehingga diperlukan tambahan gaya atau jika perlu memecah strukturnya (Wiroatmojo, 1988).
Cairan yang mengikuti hukum Newton, viskositasnya tetap, tidak dipengaruhi oleh kecepatan geser. Sehingga untuk menentukan viskositas cairan Newton dapat ditentukan hanya menggunakan satu titik rate og shear saja. Cairan non Newton ini dibagi ke dalam ke dalam dua kelompok, yaitu:
1. Cairan yang sifat alirannya tidak dipengaruhi waktu, diantaranya:
a. Aliran plastis
b. Aliran pseudoplastis c. Aliran dilatan
2. Cairan yang sifat alirannya dipengaruhi waktu, diantaranya:
a. Aliran thisotropik b. Aliran antihitksotropik
c. Aliran rhepeksi (Wiroatmojo, 1988).
Faktor- fator yang mempengaruhi viskositas adalah sebagai berikut:
a. Tekanan
Viskositas cairan naik dengan naiknya tekanan, sedangkan viskositas gas tidak dipengaruhi oleh tekanan.
b. Temperatur
Viskositas akan turun dengan naiknya suhu, sedangkan viskositas gas naik dengan naiknya suhu. Pemanasan zat cair menyebabkan molekul-molekulnya memperoleh energi. Molekul-molekul cairan bergerak sehingga gaya interaksi
antar molekul melemah. Dengan demikian viskositas cairan akan turun dengan kenaikan temperatur.
c. Kehadiran zat lain
Adanya bahan tambahan seperti bahan suspensi menaikkan viskositas air.
Pada minyak ataupun gliserin adanya penambahan air akan menyebabkan viskositas akan turun karena gliserin maupun minyak akan semakin encer, waktu alirnya semakin cepat.
d. Ukuran dan berat molekul
Viskositas naik dengan naiknya berat molekul. Misalnya laju aliran alkohol cepat, larutan minyak laju alirannya lambat dan kekentalannya tinggi seta laju aliran lambat sehingga viskositas juga tinggi.
e. Berat molekul
Viskositas akan naik jika ikatan rangkap semakin banyak.
f. Kekuatan antar molekul
Viskositas air naik denghan adanya ikatan hidrogen (Bird, 1987).
2.7.3 Uji pH
Pengujian PH merupakan salah satu bagian dari kriteria pemeriksaan fisika dan kimia dalam memprediksi kestabilan suatu sediaan. Pengujian PH dilakukan untuk menentukan stabilitas bahan aktif dalam susunan asam maupun basa (Voight, 1984).
2.7.4 Uji Bobot Jenis
Kecuali dinyatakan lain, bobot jenis suatu zat adalah perbandingan bobot zat pada suhu 25 derajat C dengan bobot air pada volume dan suhu yang sama (Ditjen POM, 1979).
BAB III
METODE PENELITIAN
Penelitian ini dilaksanakan di Laboratorium Farmasi Fisik dan Laboratorium Penelitian Fakultas Farmasi USU pada tahun 2018.
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat yang digunakan dalam penelitian ini adalah Neraca listrik (DjSeries), Spektrofotometer Ultra Violet (Shimadzu), pH meter (Hanna), penunjuk waktu (stopwatch), Viskometer Brookfield dan alat- alat gelas laboratorium.
3.1.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah aquadest dan NaOH 0,1 N. Sampelnya adalah drops Parasetamol generik Indo Farma, Fasidol® (Ifars), Sanmol® (Sanbe Farma), Grafadon® (Graha Farma).
3.2 Pembuatan Pereaksi
3.2.1. Air bebas Karbondioksida
Air suling yang telah dididihkan selama 5 menit atau lebih dan didiamkan sampai dingin dan tidak boleh menyerap karbon dioksida dari udara (Ditjen POM, 1995).
3.2.2 Pembuatan NaOH 0,1 N
Dilarutkan 4,0 gram NaOH dalam akuades bebas CO2 hingga 1000 mL (Ditjen POM, 1995).
3.3 Prosedur Penelitian
3.3.1 Pembuatan Larutan Induk Baku Pembanding
Ditimbang seksama 50 mg baku pembanding parasetamol, dimasukkan ke dalam labu tentukur 50 mL. Ditambahkan NaOH 0,1 N, dihomogenkan hingga larut, lalu dicukupkan dengan NaOH 0,1 N sampai garis tanda, sehingga diperoleh larutan dengan konsentrasi 1000 mcg/mL, larutan ini disebut Larutan Induk Baku I (LIB I). Dari larutan ini dipipet 5 mL, dimasukkan ke dalam labu tentukur 50 mL, diencerkan dengan NaOH 0,1 N sampai garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 100 mcg/mL (LIB II).
3.3.2 Penetapan Panjang Gelombang Serapan Maksimum
Dipipet 3 mL Larutan Induk Baku II, dimasukkan ke dalam labu tentukur 50 mL, dicukupkan dengan NaOH 0,1 N hingga garis tanda, lau dihomogenkan sehingga diperoleh larutan dengan konsentrasi 6,0 mcg/mL, kemudian diukur serapan pada rentang panjang gelombang 200-400 nm.
3.3.3 Pembuatan dan Penentuan Liniearitas Kurva kalibrasi
Dipipet Larutan Induk Baku II berturut-turut 1,5 mL; 2 mL; 2,5 mL; 3,5 mL; 4 mL, kemudian masing-masing dimasukkan ke dalam labu tentukur 50 mL, dicukupkan dengan NaOH 0,1 N hingga garis tanda lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 3,0 mcg/mL; 5 mcg/mL; 5,5 mcg/mL; 7 mcg/mL; 8 mcg/mL. Diukur serapannya pada panjang gelombang maksimum yang diperoleh, sebagai blanko digunkan NaOH 0,1 N, kemudian dihitung persamaan regresi dan koefisien korelasi.
3.3.4 Penetapan Kadar Parasetamol dalam Sediaan Obat Drops
Diukur (dipipet) sampel sediaan obat tetes 1 mL (setara dengan 100 mg parasetamol), yang sebelumnya telah dikocok homogen dimasukkan ke dalam labu tentukur 100 mL, diencerkan dengan NaOH 0,1 N hingga garis tanda, lalu dikocok sampai homogen. Kemudian disaring, 5 mL filtrat pertama dibuang dalam filtrat selanjutnya ditampung. Selanjutnya dipipet 0,6 mL, dimasukkan ke dalam labu tentukur 100 mL, diencerkan dengan NaOH 0,1 N hingga garis tanda, lalu dikocok sampai homogen. Diukur serapannya pada panjang gelombang maksimum yang diperoleh.
3.3.5 Parameter Evaluasi 3.3.5.1 Uji Viskositas
Pengujian menggunakan Viskometer Brokfield. Viskometer diletakkan ditempat yang datar kemudian diatur bulatan pada waterpass. Dipasang spindel nomor 61 dan speed 12 (faktor koreksi = 5). Masukkan sampel ke dalam gelas beker sebanyak 200 ml. Celupkan spindel ke dalam sampel sampai batas pencelupan.
Jalankan viskometer kemudian baca skala yang ditunjukkan oleh jarum.
Viskositas sampel didapat dengan mengalikan skala yang terbaca dengan faktor koreksi.
3.3.5.2 Uji pH
Pengujian pH menggunakan pH meter Hanna. Sebelum digunakan pH meter terlebih dahulu dikalibrasi dengan larutan netral (pH = 7,01) kemudian dikalibrasi lagi dengan buffer asam (pH = 4,01). Sampel dimasukkan ke dalam gelas beker 100 ml sebanyak 50 ml. Celupkan pH meter ke dalam sampel, biarkan hingga pH
3.3.5.3 Uji Bobot Jenis
Menggunakan alat piknometer. Timbang piknometer kosong dengan menggunakan neraca analitik sebanyak 3 kali. Ambil sampel yang telah diletakkan didalan beaker glass dengan menggunakan pipet volume sebanyak 10 ml sampel ke dalam piknometer. Ditimbang piknometer berisi sampel sebanyak 3 kali. Berat jenis sampel didapat dengan membagikan selisih dari piknometer berisi sampel dan piknometer yang kosong dengan volume sampel yang diambil.
3.3.6 Studi Rheologi Sediaan
Pengujian daya alir atau rheologi dilakukan dengan menggunkan viskometer Thomas Stromer. Viskositas adalah suatu pernyataan tentang tahanan dari suatu cairan untuk mengalir, semakin tinggi viskositas maka semakin besar tahanannya (Shinko, 2014).
Pengujian dilakukan dengan meletakkan viskometer pada meja datar sehinnga alat penggerak dapat jatuh tanpa gangguan dan dipasang rotor tipe baling-baling. Viskometer sebelumnya dikalibrasi dengan menggunakan aquadest.
Pengujian dilakukan dengan meletakkan sediaan yag akan diuji pada meja pengukuran dan meja pengukuran dinaikkan sampai rotor terendam ditengah- tengah sampel. Dengan stopwatch, lepaskan ren dan ukur waktu yang diperlukan untuk 50 putaran rotor seperti yang ditunjukkan pada penghitung putaran. Dari hasil yang diperoleh maka dapatlah digambar grafik untuk menentukan tipe aliran sediaan.
3.3.7 Analisis Data Secara Statistik
Untuk mengetahui apakah data diterima atau ditolak digunakan rumus dibawah
̅
⁄√
Keterangan: t = Harga t tabel sesuai dengan dk= n-1 ̅ = Kadar rata-rata sampel
SD = Standar deviasi X = Kadar sampel
Standar deviasi (SD) dihitung dengan rumus :
SD =
√
∑ ̅
Dengan dasar penolakan data adalah t hitung ≥ t tabel dan bila t hitung mempunyai nilai negatif , data ditolak jika t hitung ≤ -t tabel
Untuk mencari kadar sebenarnya dengan taraf kepercayaan (ik) 99% , dengan derajat kebebasan dk=n-1 , digunakan rumus
μ =
̅
± t( ⁄ )
dk ×⁄ √
Keterangan: μ = Interval kepercayaan α= tingkat kepercayaan
dk = derajat kebebasan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Hasil Uji pH Drops Parasetamol
Tabel 4.1 Hasil uji pH drops parasetamol
No. Nama Obat pH
1. Parasetamol (Generik) 6,1
2. Fasidol® (Ifars) 5,1
3. Grafadon® (Graha Farma) 5,1
4. Sanmol® (Sanbe Farma) 5,7
Berdasarkan Tabel 4.1 diatas dapat dilihat bahwa pH drops yang mengandung parasetamol memenuhi persayaratan Farmakope Indonesia yaitu antara 3,6 dan 6,1 (Ditjen POM, 1995).
pH dapat mempengaruhi tingkat dekomposisi obat. Obat biasanya stabil pada pH 4 sampai 8. Dengan adanya penambahan asam ataupun basa dapat menyebabkan penguraian larutan obat menjadi dipercepat dan menyebabkan obat menjadi tidak stabil (Gokani, H., dkk, 2012).
4.1.2 Hasil Bobot Jenis Drops Parasetamol
Tabel 4.2 Hasil uji bobot jenis drops parasetamol
No. Nama Obat Bobot Jenis (g/mL)
1. Parasetamol (Generik) 1,23
2. Fasidol® (Ifars) 1,22
3. Grafadon® (Graha Farma) 1,22
4. Sanmol® (Sanbe Farma) 1,22
Bobot jenis (𝜌) dilakukan dengan mengunakan piknometer. Piknometer kosong yang telah diketahui volumenya (a) ditimbang (b), kemudian diisi dengan sampel dan di timbang (c), berat jenisnya dapat dihitung dengan persamaan:
𝜌 =
(Voight, 1994).
Menurut Farmakope Indonesia Edisi III, parasetamol memiliki bobot jenis 1,21 sampai 1,23 g/mL. Sedangkan hasil yang didapat 1,22 sampai 1,23 g/mL.
Hasil yang diperoleh sesuai dengan Farmakope Indonesia.
4.1.3 Hasil Uji Viskositas Drops Parasetamol
Tabel 4.3 Hasil uji viskositas drops parasetamol
No. Nama Obat Viskositas
1. Parasetamol (Generik) 115 cp
2. Fasidol® (Ifars) 125 cp
3. Grafadon® (Graha Farma) 70 cp
4. Sanmol® (Sanbe Farma) 50 cp
Penentuan viskositas dilakukan dengan menggunkan viskometer Brookfield spindel 61 kecepatan 12 dan dilakukan dengan pengulangan tiga kali.
Dari Tabel 4.3 diatas dapat disimpulkan bahwa viskosits yang palimg tinggi adalah Fasidol® (Ifars) yaitu 125 cp dan yang terendah adalah Sanmol® (Sanbe Farma) yaitu 50 cp. Semakin tinggi viskositasnya maka smakin kental larutan tersebut dan sebaliknya semakin rendah viskositasnya semakin encer larutan tersebut.
Pengujian viskositas sediaan larutan ditujukan untuk mendapatkan kekentalan yang sedang, karena pada sediaan larutan dibutuhkan viskositas sedang. Jika viskositas terlalu tinggi, maka sediaan akan sulit untuk dituang, dan sebaliknya jika viskositas terlalu rendah, dikhawatirkan sediaan akan tumpah saat dituang (Sinko, 2014).
Pengukuran viskositas merupakan salah satu faktor penting untuk
mengetahui tahanan suatu cairan untuk mengalir, semakin tinggi nilai viskositas, semakin besar tahanannya (Sinko, 2014).
4.1.4 Hasil Uji Rheologi Drops Parasetamol
Studi rheologi merupakan suatu pengujian yang penting untuk mengetahui tahahan dari suatu cairan untuk mengalir, yang meliputi pencampuran dan aliran dari bahan, pengemasan bahan-bahan kedalam wadah, ketahanan sediaan pada saat digunakan, penuangan dan pengeluaran dari tube, atau pelewatan dari jarum suntik (Shinko,2014).
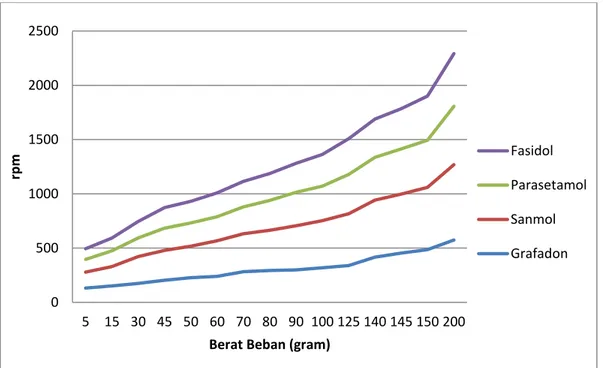
Grafik 4.1 Hasil Uji Rheologi Semua Sampel
Dari Grafik 4.1 diatas dapat dihasilkan bahwa semua sampel dari sediaan obat drops yang mengandung parasetamol termasuk kedalam aliran pseudoplastis dimana kurva konsistensinya mulai dari titik (0,0) atau paling tidak mendekatinya.
Dapat dilihat Fasidol dan Parasetamol memiiki kurva yang lebih jelas lengkungannya dibandingkan dengan kurva Sanmol dan Grafadon.
0 500 1000 1500 2000 2500
5 15 30 45 50 60 70 80 90 100 125 140 145 150 200
rpm
Berat Beban (gram)
Fasidol Parasetamol Sanmol Grafadon
Viskositas aliran pseudoplastis berkurang dengan meningkatnya rate of shear. Rheogram lengkung untuk bahan-bahan pseudoplastis ini disebabkan adanya aksi shearing terhadap molekul-molekul polimer (atau suatu bahan berantai panjang). Dengan meningkatnya shearing stress, molekul-molekul yang secara normal tidak beraturan, mulai menyusun sumbu yang panjang dalam arah aliran. Pengarahan ini mengurangi tahanan dari dalam bahan tersebut dan mengakibatkan rate of shear yang lebih besar pada tiap shearing stress berikutnya (Martin, 1993).
4.1.5 Hasil Penentuan Panjang Gelombang Serapan Maksimum dan Linieritas Kurva Kalibrasi
Dari hasil pengukuran secara spektrofotometri ultra violet dengan menggunakan pelarut NaOH 0,1 N diperoleh serapan maksimum parasetamol BPFI pada panjang gelombang 257 nm dengan serapan 0,4313.
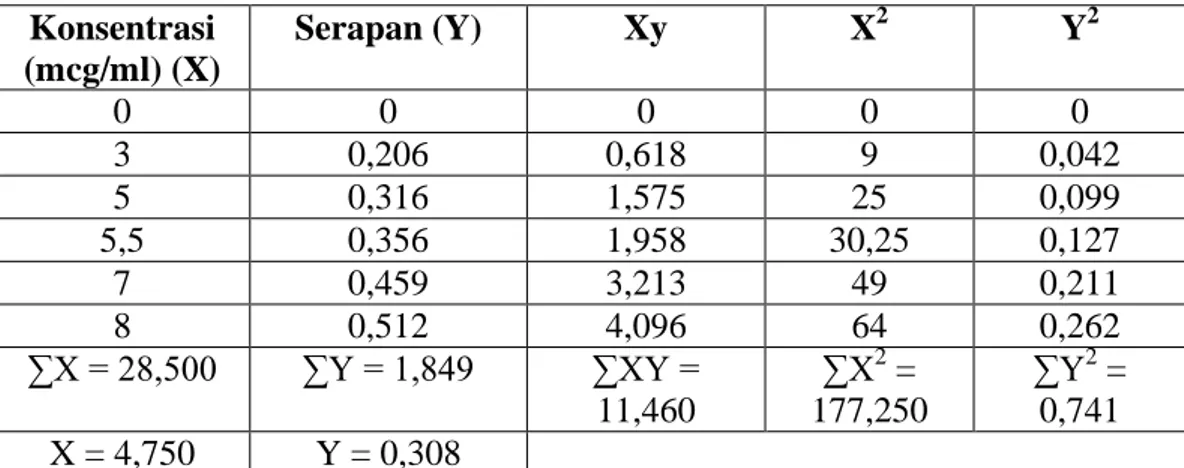
Dari hasil penentuan linieritas kurva kalibrasi parasetamol BPFI dalam rentang 3 mcg/ml – 8 mcg /ml pada panjang gelombang maksimum 257 nm diperoleh hubungan yang linier antara serapan dengan konsentrasi dimana koefisien korelasi
= 0,998, artinya terdapat 0,998 senyawa pada garis lurus (linear) dan persamaan regresi Y = 0,064X + 0,004 yang berfungsi untuk menghitung kadar dari setiap sampel. Koefisien korelasi yang didapat masih memenuhi kriteria penerimaan yaitu r ≥ 0,9950.
4.1.6 Hasil Penetapan Kadar Parasetamol Dalam Sampel Sediaan Tabel 4.4 Kadar rata-rata parasetamol pada sediaan drops
No. Nama Sediaan Kadar
sebenarnya(%)
Persyaratan 1. Parasetamol (Generik) 108,948 % -
109,786 %
Memenuhi persyaratan jika kadar diantara 90% - 110%
2. Fasidol® (Ifars) 105,550 % - 109,734 % 3. Grafadon® (Graha Farma) 105,237 % -
109,820 % 4. Sanmol® (Sanbe Farma) 100,412 % -
107,493 %
Keterangan : Persyaratan Penetapan Kadar Larutan Oral menurut Farmakope Indonesia Edisi V (2014)
Menurut Farmakope Indonesia edisi V (Badan POM,2014), larutan oral Parasetamol mengandung tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket. Dari hasil penetapan kadar pada Tabel 4.4 dapat dilihat bahwa semua sediaan drops yang mengandung Parasetamol generik dan merek dagang memenuhi standar persyaratan kadar berdasarkan Farmakope Indonesia Edisi V (Badan POM, 2014). Kadar Parasetamol dalam sediaan drops yang mengandung Parasetamol antara 100,412 % sampai 109,948 % dimana kadar tertinggi diperoleh pada sediaan drops yang mengandung Parasetamol Generik dan yang terendah diperoleh pada sediaan drops yang mengandung Parasetamol merek Sanmol® (Sanbe Farma).
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Hasil penelitian dapat disimpulkan bahwa bentuk sediaan drops yang mengandung parasetamol yang beredar di instalasi farmasi rumah sakit di kota Medan yang diuji berdasarkan uji penetapan kadar memenuhi persyaratan yaitu tidak kurang dari 90,0 % dan tidak lebih dari 110,0 %, uji pH memenuhi persaratan yaitu antara 3,6-6,1 dan uji bobot jenis memenuhi persyaratan yaitu antara1,21-1,23 g/mL (Badan POM, 2014). Dan parameter lainnya yaitu uji viskositas dan studi rheologi yang menghasilkan aliran pseudoplastis.
5.2 Saran
Disarankan agar dilakukan penelitian lebih lanjut untuk memeriksa mutu bentuk sediaan drops yang mengandung parasetamol dengan parameter lainnya seperti dilakukan uji volume terpindahkan.
DAFTAR PUSTAKA
Badan POM. 2014. Farmakope Indonesia. Edisi V . Departemen Kesehatan RI.Jakarta. Halaman: 999-1000.
Bird,T. 1987. Kimia Fisik Untuk Universitas. Jakarta: PT. Gramedia. Halaman 87.
British Pharmacopeia. 2002. British Pharmacopeia. Volume III. London: The Stationary Office. Halaman 1882.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi.
Padang: Andalas University Press. Halaman 1.
Day and Underwood. 1999. Analisis Kimia Kuantitatif. Jakarta : Erlangga.
Halaman 382.
Dermawan, D. 2015. Farmakologi Untuk Keperawatan. Yogyakarta: Gosye Publishing. Halaman 79.
Deviarny, C., dkk. (2012). Uji Stabilitas Kimia Natrium Askorbil Fosfat Dalam Mikroemulsi Dan Analisisnya Dengan HPLC. Jurnal Farmasi Andalas Vol 1.
Ditjen POM. 1979. Farmakope Indonesia. Edisi III . Departemen Kesehatan RI.Jakarta. Halaman 38.
Ditjen POM. 1995. Farmakope Indonesia. Edisi IV . Departemen Kesehatan RI.Jakarta. Halaman 4, 649-650, 999-1000, 1066, 1085-1087, 1124-1210.
Gokani, H., dkk. 2012. Stability Study : Regulatory Requirenment. International Journal of Advances in Pharmaceutical Analysis. Vol 2. No 3 : 62-67.
Harrison, A.C. 1999. Prinsip-prinsip Ilmu Penyakit Dalam. Penerjemah P.
Andrianto. Edisi 13. Jakarta: ECG. Halaman 93–104 .
Heirmayani. 2007. Toksikopatologi Hati Mencit Pada Pemberian Parasetamol.
Bogor: Penerbit IPB.
Katzung, B. G. 1992. Basic and Clinical Pharmacology. 3th ed. Appleton &
Lange A Publishing Division of Prentice Hill: 268-70, 448-9.
Keenan, Charles W, dkk. 1991. Ilmu Kimia Untuk Universitas. Jakarta : Erlangga.
Halaman 87.
Khopkar, S. M. 2002. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia Press. Halaman 325.
Moffat, A.C., et al. 1986. Clarke’s Isolation and Identification of Drug. Second Edition. Londo: Pharmaceutical Press. Halaman: 327.
Martin, A., dkk. 1993. Farmasi Fisik : Dasar-Dasar Kimia Fisik dalam Ilmu Farmsetika. Edisi Ketiga. Jilid I. Jakarta: UI Press. Halaman 240.
Moechtar. 1990. Farmasi Fisik. Yogyakarta: Universitas Gajah Mada-Press.
Mulja, M., dan Suharman. 1997. Validasi Metode Analisa Instrumental. Surabaya:
Airlangga University Press.
Munson, J.W. 1984. Pharmaceutical Analysis Modern Methods. Penerjemah:
Harjana. 1991. Analisis Farmasi Metode Modern. Surabaya: Airlangga University Press. Halaman 334.
Permenkes Nomor 75. 2016. Penyelenggaraan Uji Mutu pada Instalasi Farmasi Pemerintah. Jakarta: Kementrian Kesahatn RI.
Permenkes Nomor 72. 2016. Standar Pelayanan Kefarmasian di Rumah Sakit.
Jakarta: Kementrian Kesahatn RI.
Rachdiati., dkk. 2008. Penentuan Waktu Kelarutan Parasetamol Pada Uji Disolusi. Volume 8. Bandung: Nsa Kimia.
Rakhmisari, D. 2006. Manajemen Instalasi Farmasi Rumah Sakit. Jakarta:
Fakultas Kedokteran Universitas Indonesia.
Sartono. 1993. Pengaruh pemberian dosis tunggal parasetamol terhadap komposisi metabolit parasetamol dalam urin tikus jantan malnutrisi. Majalah Kedokteran Diponegoro 30 (3,4): 227-32.
Suryana. 2006. Kewirausahan,Pedoman Praktis, Kiat dan menuju sukse. Jakarta:
Salemba Empat. Halaman 8.
Sinko, P.J. 2014. Farmasi Fisik dan Ilmu Farmasetika. Edisi Kelima. Jakarta:
Penerbit Buku Kedokteran ECG. Halaman 556.
Soedarmo, P., dkk. 2002. Infeksi dan Penyakit Tropis. Jakarta : Fakultas Kedokteran Universitas Indonesia. Halaman 27-51.
Stringer, J. L. 2009. Konsep Dasar Farmakologi Paduan Untuk Mahasiswa.Edisi Ketiga. Jakarta: EGC. Halaman 239.
Sudjadi., dan Rohman, A. 2008. Analisis Kuantitatif Obat. Yogyakarta: Gajah Mada University Press. Halaman 49-51.
Syamsuni, A. 2006. Ilmu Resep. Jakarta: Penerbit Buku Kedokteran EGC.
Halaman 81-87.
Trianntafillopoulos, N. 1998. Measurement of Fluid Rheology and Interpretation of rheograms. Second Edition. Michigan: Kaltec Scientific Inc.
Vadas, E.B. 2002. Stability of Pharmaceutical Products. dalam Remington. The Science and Practivce of Pharmacy. Volume I. Editor Alfonso Gennaro. London:
Lipponcott William and Wilkins. Halaman 988-989.
Vogel, A., I. 1994. Kimia Analisis Kuantitatif Anorganik. Edisi Kesatu. Jakarta : Penerbit Buku Kedokderan ECG. Halaman 810.
Voight, R. 1984. Buku Pelajaran Teknologi Farmasi. Edisi Kelima. Terjemahan S. Noerono, Yogyakarta: Gajah Mada University Press.
Wilmana, P.F., dan Sulistia, G. 2011. Farmkologi dan Terapi. Edisi V. Jakarta:
Universitas Indonesia. Halaman 237.
Wiroatmodjo. 1988. Kimia Fisika. Jakarta: Departemen Pendidikan dan Kebudayaan. Halaman 25.
Lampiran 1. Sertifikat Baku Pembanding
Lampiran 2. Daftar Spesifikasi Sampel 1. Paracetamol Drops (PT. Indofarma)
Komposisi : Tiap 0,6 mL mengandung paracetamol 100 mg No. Batch : 1609067
No. Registrasi : GBL 0920936436 A1 Exp. Date : 09 2018
2. Sanmol® Drops (PT. Sanbe Farma)
Komposisi : Tiap 0,6 mL mengandung paracetamol 60 mg No. Batch : TL1976
No. Registrasi : DBL 9722221636 A1 Exp. Date : 11 2020
3. Grafadon® Drops (PT. Graha Farma)
Komposisi : Tiap 0,6 mL mengandung paracetamol 60 mg No. Batch : YD204G
No. Registrasi : DBL 0231108036 A1 Exp. Date : 04 2021
4. Fasidol® Drops (PT. Ifars)
Komposisi : Tiap 0,6 mL mengandung paracetamol 60 mg No. Batch : 80303
No. Registrasi : DBL 0309213936 A1 Exp. Date : 03 2020
Lampiran 3. Kurva Panjang Gelombang
Lampiran 4. Kurva kalibrasi
Lampiran 5. Data Kalibrasi dan Perhitungan Persamaan Regresi Parasetamol
Drpos
Tabel Data Kurva kalibrasi Konsentrasi
(mcg/ml) (X)
Serapan (Y) Xy X2 Y2
0 0 0 0 0
3 0,206 0,618 9 0,042
5 0,316 1,575 25 0,099
5,5 0,356 1,958 30,25 0,127
7 0,459 3,213 49 0,211
8 0,512 4,096 64 0,262
∑X = 28,500 ∑Y = 1,849 ∑XY =
11,460
∑X2 = 177,250
∑Y2 = 0,741 X = 4,750 Y = 0,308
a =∑ y ∑ ∑ y n
∑ 2 ∑ 2 n a =11,460 28,500 1,849 6
177,250 28,500 2 6 a = 11,460 8,783
177,250 135,375 a = 2,677
41,875 a = 0,064 Maka, y = ax + b b = y – ax
b = 0,308 - 0,064 (4,750) b = 0,308 – 0,304
b = 0,004
Persamaan regresi diperoleh degan mensubsitusikan nilai a dan b, sehingga persamaan regresi adalah :
y = 0,064X + 0,004
Dengan nilai r sebagai berikut : r = ∑ y ∑ ∑ y n
√[∑ 2 ∑ 2 n][∑ y2 ∑ y 2 n ]
r = 11,460 28,500 1,849 6
√[177,250 28,500 2 6][0,741 1,849 2 6 ]
r = 11,460 8,783
√[41,875][0,172]
r = 2,677
√7,203 r = 0,998
Lampiran 6. Pehitungan kadar sampel (Parasetamol, Fasidol, Grafadon, Sanmol) Volume 1 bobot larutan = 15 ml mengandung 100 mg/ml
Dipipet sejumlah larutan setara dengan 100 mg Paracetamol Volume larutan yang dipipet 100 mg
100 mg ml = 1 ml
Dipipet 1 ml larutan obat tetes → diencerkan hingga 100 ml Konsentrasi teoritis sampel (awal) 100 mg
100 ml
=
100000 mcg100 ml
Dipipet 0,6 ml larutan → diencarkan hingga 100 ml Konsentrasi teoritis sampel (uji) 0,6 ml 1000 mcg ml
100 ml
=
600 mcg100 ml
Parasetamol 1. A = 0,4232 Y = 0,064X + 0,004 0,4232 0,064X + 0,004
X 0,4232 - 0,004 0,064
X = 6,55 mcg/ml
Konsentrasi sebelum pengenceran = 6,55 mcg/ml x 100/0,6
= 1091,67 mcg/ml Bobot dalam labu awal
= 1091,67 mcg/ml x 100 ml
= 109167 mcg
= 109,167 mg Kadar
109,167 mg
100 mg
99,97 = 109,134 %
2. A = 0,4238 Y = 0,064X + 0,004 0,4238 0,064X + 0,004
X 0,4232 - 0,004 0,064
X = 6,55 mcg/ml
Konsentrasi sebelum pengenceran = 6,550 mcg/ml x 100/0,6
= 1091,670 mcg/ml Bobot dalam labu awal
= 1091,670 mcg/ml x 100 ml
= 109167 mcg
= 109,167 mg Kadar
109,167 mg
100 mg
99,97
= 109,134 % 3. A = 0,4250 Y = 0,064X + 0,004 0,4250 0,064X + 0,004
X 0,4250 - 0,004 0,064
X = 6,578 mcg/ml
Konsentrasi sebelum pengenceran
= 6,578 mcg/ml x 100/0,6
= 1096,34 mcg/ml Bobot dalam labu awal
= 1096,34 mcg/ml x 100 ml
= 1096,34 mcg
= 109,634 mg
Kadar
= 109,601 % 4. A = 0,4250 Y = 0,064X + 0,004 0,4250 0,064X + 0,004
X 0,425 0 - 0,004 0,064
X = 6,578 mcg/ml
Konsentrasi sebelum pengenceran
= 6,578 mcg/ml x 100/0,6
= 1096,34 mcg/ml Bobot dalam labu awal
= 1096,34 mcg/ml x 100 ml
= 109634 mcg
= 109,634 mg Kadar
106,634 mg
100 mg 99,97
= 109,601 % 5. A = 0,4250 Y = 0,064X + 0,004 0,4250 0,064X + 0,004
X 0,4250 - 0,004 0,064
X = 6,578 mcg/ml
Konsentrasi sebelum pengenceran
= 6,578 mcg/ml x 100/0,6
= 1096,34 mcg/ml Bobot dalam labu awal
= 1096,34 mcg/ml x 100 ml
= 109634 mcg
= 109,634 mg Kadar
109,634 mg
100 mg 99,97
= 109,601 % 6. A = 0,4238 Y = 0,064X + 0,004 0,4238 0,064X + 0,004 X
X = 6,55 mcg/ml
Konsentrasi sebelum pengenceran = 6,550 mcg/ml x 100/0,6
= 1091,670 mcg/ml Bobot dalam labu awal
= 1091,670 mcg/ml x 100 ml
= 109167 mcg
= 109,167 mg
Kadar
= 109,134 %
Fasidol 1. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X 0,4140 - 0,004
0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 2. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004
X 0,4140 - 0,004 0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 3. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X 0,4140 - 0,004
0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 4. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X 0,4140 - 0,004
0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 5. A = 0,4238 Y = 0,064X + 0,004 0,4238 0,064X + 0,004
X 0,4238 - 0,004 0,064
X = 6,559 mcg/ml
Konsentrasi sebelum pengenceran = 6,559 mcg/ml x 100/0,6
= 1093,16 mcg/ml Bobot dalam labu awal
= 1093,16 mcg/ml x 100 ml
= 109316 mcg
= 109,316 mg Kadar
109,316 mg
100 mg
99,97
= 109,283 % 6. A = 0,4250 Y = 0,064X + 0,004 0,4250 0,064X + 0,004
X 0,4250 - 0,004 0,064
X = 6,578 mcg/ml
Konsentrasi sebelum pengenceran
= 6,578 mcg/ml x 100/0,6
= 1096,34 mcg/ml Bobot dalam labu awal
= 1096,34 mcg/ml x 100 ml
= 109634 mcg
= 109,634 mg Kadar
109,634 mg
100 mg 99,97
= 109,601 %
Grafadon
1. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X 0,4140 - 0,004
0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 2. A = 0,4140 Y = 0,064x + 0,004
X 0,4140 - 0,004 0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 3. A = 0,4232 Y = 0,064X + 0,004 0,4232 0,064X + 0,004
X 0,4232 - 0,004 0,064
X = 6,55 mcg/ml
Konsentrasi sebelum pengenceran
= 6,55 mcg/ml x 100/0,6
= 1091,67 mcg/ml Bobot dalam labu awal
= 1091,67 mcg/ml x 100 ml
= 109167 mcg
= 109,167 mg Kadar
109,167 mg
100 mg 99,97
= 109,134 % 7. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X 0,4140 - 0,004
0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 % 4. A = 0,4232 Y = 0,064X + 0,004 0,4232 0,064X + 0,004
X 0,4232 - 0,004 0,064
X = 6,55 mcg/ml
Konsentrasi sebelum pengenceran = 6,55 mcg/ml x 100/0,6
= 1091,67 mcg/ml Bobot dalam labu awal
= 1091,67 mcg/ml x 100 ml
= 109167 mcg
= 109,167 mg Kadar
=
109,167 mg100 mg
99,97
= 109,134 % 8. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X 0,4140 - 0,004
0,064
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg
= 106,767 mg Kadar
106,767 mg
100 mg 99,97
= 106,734 %
Sanmol
1. A = 0,3980 Y = 0,064x + 0,004 0,3980 = 0,064X + 0,004 X 0,3980 - 0,004
0,064
X = 6,156 mcg/ml
Konsentrasi sebelum pengenceran
= 6,156 mcg/ml x 100/0,6
= 1026,00 mcg/ml Bobot dalam labu awal
= 1026,00 mcg/ml x 100 ml
= 102600 mcg
= 102,600 mg Kadar
102,600 mg
100 mg 99,97
= 102,569 % 2. A = 0,3980 Y = 0,064x + 0,004
X 0,3980 - 0,004 0,064
X = 6,156 mcg/ml
Konsentrasi sebelum pengenceran
= 6,156 mcg/ml x 100/0,6
= 1026,00 mcg/ml Bobot dalam labu awal
= 1026,00 mcg/ml x 100 ml
= 102600 mcg
= 102,600 mg Kadar
102,600 mg
100 mg 99,97
= 102,569 % 3. A = 0,4140 Y = 0,064x + 0,004 0,4140 = 0,064X + 0,004 X
X = 6,406 mcg/ml
Konsentrasi sebelum pengenceran
= 6,406 mcg/ml x 100/0,6
= 1067,67 mcg/ml Bobot dalam labu awal
= 1067,67 mcg/ml x 100 ml
= 106767 mcg