II.
TINJAUAN PUSTAKA
2.1. Komponen Kimia Kayu
Kayu sebagian besar tersusun atas tiga unsur yaitu unsur C, H dan O. Unsur-unsur tersebut berasal dari udara berupa CO2 dan dari tanah berupa H2O.
Namun, dalam kayu juga terdapat unsur-unsur lain seperti N, P, K, Ca, Mg, Si, Al dan Na. Unsur-unsur tersebut tergabung dalam sejumlah senyawa organik, secara umum dapat dibedakan menjadi dua bagian (Fengel dan Wegener 1995) yaitu: 1. Komponen lapisan luar yang terdiri atas fraksi-fraksi yang dihasilkan oleh
kayu selama pertumbuhannya. Komponen ini sering disebut dengan zat ekstraktif. Zat ekstraktif ini adalah senyawaan lemak, lilin, resin dan lain-lain. 2. Komponen lapisan dalam terbagi menjadi dua fraksi yaitu fraksi karbohidrat
yang terdiri atas selulosa dan hemiselulosa, fraksi non karbohidrat yang terdiri dari lignin.
Selulosa dan Hemiselulosa
Selulosa merupakan senyawa organik yang terdapat pada dinding sel bersama lignin berperan dalam mengokohkan struktur tumbuhan. Selulosa pada kayu umumnya berkisar 40-50%, sedangkan pada kapas hampir mencapai 98%. Selulosa terdiri atas rantai panjang unit-unit glukosa yang terikat dengan ikatan 1-4β-glukosida. O H H H H OH H OH CH2O O O OH H H CH2O H H O O H H H H OH H OH CH2O O . -OH H n Selulosa
Hemiselulosa adalah polimer polisakarida heterogen tersusun dari unit D-glukosa, D-manosa, L-arabiosa dan D-xilosa. Hemiselulosa pada kayu berkisar antara 20-30%. Dilihat dari strukturnya, selulosa dan hemiselulosa mempunyai
potensi yang cukup besar untuk dijadikan sebagai penjerap karena gugus OH yang terikat dapat berinteraksi dengan komponen adsorbat. Adanya gugus OH, pada selulosa dan hemiselulosa menyebabkan terjadinya sifat polar pada adsorben tersebut. Dengan demikian selulosa dan hemiselulosa lebih kuat menjerap zat yang bersifat polar dari pada zat yang kurang polar. Mekanisme jerapan yang terjadi antara gugus -OH yang terikat pada permukaan dengan ion logam yang bermuatan positif (kation) merupakan mekanisme pertukaran ion sebagai berikut (Yantri 1998).
Y OH + M+ YO M + H+
YO
Y OH + M2+ M + 2 H+ YO
M+ dan M2+ adalah ion logam, -OH adalah gugus hidroksil dan Y adalah matriks tempat gugus -OH terikat. Interaksi antara gugus -OH dengan ion logam juga memungkinkan melalui mekanisme pembentukan kompleks koordinasi karena atom oksigen (O) pada gugus -OH mempunyai pasangan elektron bebas, sedangkan ion logam mempunyai orbital d kosong. Pasangan elektron bebas tersebut akan menempati orbital kosong yang dimiliki oleh ion logam, sehingga terbentuk suatu senyawa atau ion kompleks.
Menurut Terada et al. (1983) ikatan kimia yang terjadi antara gugus aktif
pada zat organik dengan molekul dapat dijelaskan sebagai perilaku interaksi asam-basa Lewis yang menghasilkan kompleks pada permukaan padatan. Pada sistem adsorpsi larutan ion logam, interaksi tersebut dalam bentuk umum ditulis:
[GH] + Mz+↔ [GM(z-1)]+ + H+ 2[GH] + Mz+↔ [G
2M(z-2)]+ + 2H+
dengan GH adalah gugus fungsional yang terdapat pada zat organik, dan M adalah ion bervalensi z.
2.2. Adsorpsi
Salah satu metode yang digunakan untuk menghilangkan zat pencemar dari air limbah adalah adsorpsi (Rios et al. 1999 dan Saiful et al. 2005). Adsorpsi
merupakan terjerapnya suatu zat (molekul atau ion) pada permukaan adsorben. Mekanisme penjerapan tersebut dapat dibedakan menjadi dua yaitu, jerapan secara fisika (fisisorpsi) dan jerapan secara kimia (kemisorpsi). Pada proses fisisorpsi gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya van der Waals. Molekul terikat sangat lemah dan energi yang dilepaskan pada adsorpsi fisika relatif rendah sekitar 20 kJ/mol (Castellan 1982). Sedangkan pada proses adsorpsi kimia, interaksi adsorbat dengan adsorben melalui pembentukan ikatan kimia. Kemisorpsi terjadi diawali dengan adsorpsi fisik, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya van der Waals atau melalui ikatan hidrogen. Kemudian diikuti oleh adsorpsi kimia yang terjadi setelah adsorpsi fisika. Dalam adsorpsi kimia partikel melekat pada permukaan dengan membentuk ikatan kimia (biasanya ikatan kovalen), dan cenderung mencari tempat yang memaksimumkan bilangan koordinasi dengan substrat (Atkins 1999).
2.2.1. Faktor-Faktor yang Mempengaruhi Adsorpsi
Kekuatan interaksi adsorbat dengan adsorben dipengaruhi oleh sifat dari adsorbat maupun adsorbennya. Gejala yang umum dipakai untuk meramalkan komponen mana yang diadsorpsi lebih kuat adalah kepolaran adsorben dengan adsorbatnya. Apabila adsorbennya bersifat polar, maka komponen yang bersifat polar akan terikat lebih kuat dibandingkan dengan komponen yang kurang polar.
Kekuatan interaksi juga dipengaruhi oleh sifat keras-lemahnya dari adsorbat maupun adsorben. Sifat keras untuk kation dihubungkan dengan istilah
polarizing power cation, yaitu kemampuan suatu kation untuk mempolarisasi
anion dalam suatu ikatan. Kation yang mempunyai polarizing power cation besar
cenderung bersifat keras. Sifat polarizing power cation yang besar dimiliki oleh
ion-ion logam dengan ukuran (jari-jari) kecil dan muatan yang besar. sebaliknya sifat polarizing power cation yang rendah dimiliki oleh ion-ion logam dengan
Sedangkan pengertian keras untuk anion dihubungkan dengan istilah polarisabilitas anion yaitu, kemampuan suatu anion untuk mengalami polarisasi akibat medan listrik dari kation. Anion bersifat keras adalah anion berukuran kecil, muatan besar dan elektronegativitas tinggi, sebaliknya anion lemah dimiliki oleh anion dengan ukuran besar, muatan kecil dan elektronegatifitas yang rendah. Ion logam keras berikatan kuat dengan anion keras dan ion logam lemah berikatan kuat dengan anion lemah (Atkins at al. 1990).
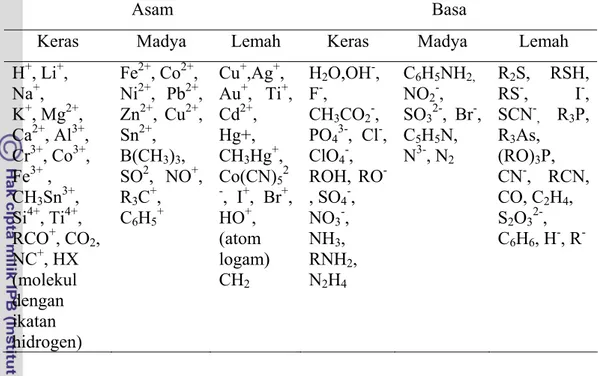
Pearson (1963) mengklasifikasikan asam-basa Lewis menurut sifat keras dan lemahnya. Menurut Pearson, situs aktif pada permukaan padatan dapat dianggap sebagai ligan yang dapat mengikat logam secara selektif. Logam dan ligan dikelompokkan menurut sifat keras dan lemahnya berdasarkan pada polarisabilitas unsur. Pearson (1963) mengemukakan suatu prinsip yang disebut
Hard and Soft Acid Base (HSAB). Ligan-ligan dengan atom yang sangat
elektronegatif dan berukuran kecil merupakan basa keras, sedangkan ligan-ligan dengan atom yang elektron terluarnya mudah terpolarisasi akibat pengaruh ion dari luar merupakan basa lemah. Sedangkan ion-ion logam yang berukuran kecil namun bermuatan positip besar, elektron terluarnya tidak mudah dipengaruhi oleh ion dari luar, ini dikelompokkan ke dalam asam keras, sedangkan ion-ion logam yang berukuran besar dan bermuatan kecil atau nol, elektron terluarnya mudah dipengaruhi oleh ion lain, dikelompokkan ke dalam asam lemah. Pengelompokan asam-basa menurut prinsip HSAB Pearson dapat dilihat pada Tabel 1.
Menurut prinsip HSAB, asam keras akan berinteraksi dengan basa keras untuk membentuk kompleks, begitu juga asam lemah dengan basa lemah. Interaksi asam keras dengan basa keras merupakan interaksi ionik, sedangkan interaksi asam lemah dengan basa lemah, interaksinya lebih bersifat kovalen.
Ion krom (Cr3+) merupakan kation yang bersifat asam keras, sehingga akan berinteraksi secara kuat dengan anion-anion yang bersifat basa keras seperti dengan OH-. Selulosa mempunyai banyak gugus -OH, dengan demikian selulosa akan mengikat ion krom secara kuat. Ikatan antara ion Cr3+ dengan -OH pada
selulosa melalui pembentukan ikatan koordinasi, di mana pasangan elektron bebas dari O pada -OH akan menempati orbital kosong yang dimiliki oleh Cr3+, sehingga terbentuk kompleks terkoordinasi.
Tabel 1 Asam dan basa beberapa senyawa dan ion menurut prinsip HSAB dari Pearson.
Asam Basa
Keras Madya Lemah Keras Madya Lemah
H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Co3+, Fe3+ , CH3Sn3+, Si4+, Ti4+, RCO+, CO2, NC+, HX (molekul dengan ikatan hidrogen) Fe2+, Co2+, Ni2+, Pb2+, Zn2+, Cu2+, Sn2+, B(CH3)3, SO2, NO+, R3C+, C6H5+ Cu+,Ag+, Au+, Ti+, Cd2+, Hg+, CH3Hg+, Co(CN)52 -, I+, Br+, HO+, (atom logam) CH2 H2O,OH-, F-, CH3CO2-, PO43-, Cl-, ClO4-, ROH, RO -, SO4-, NO3-, NH3, RNH2, N2H4 C6H5NH2, NO2-, SO32-, Br-, C5H5N, N3-, N2 R2S, RSH, RS-, I-, SCN-, R3P, R3As, (RO)3P, CN-, RCN, CO, C2H4, S2O32-, C6H6, H-, R
-Porositas adsorben juga mempengaruhi daya adsorpsi dari suatu adsorben. Adsorben dengan porositas yang besar mempunyai kemampuan menjerap yang lebih tinggi dibandingkan dengan adsorben yang memilki porositas kecil. Untuk meningkatkan porositas dapat dilakukan dengan mengaktivasi secara fisika seperti mengalirkan uap air panas ke dalam pori-pori adsorben, atau mengaktivasi secara kimia. Salah satu cara mengaktivasi adsorben secara kimia adalah aktivasi selulosa melalui penggantian gugus aktif -OH pada selulosa dengan gugus HSO3
-melalui proses sulfonasi. Selulosa yang teraktivasi dengan cara sulfonasi memberikan daya adsorpsi yang meningkat dua kali lipat dibandingkan daya adsorpsi selulosa yang tidak diaktivasi (Setiawan et al. 2004)
Jumlah zat yang diadsorpsi pada permukaan adsorben merupakan proses berkesetimbangan, sebab laju peristiwa adsorpsi disertai dengan terjadinya desorpsi. Pada awal reaksi, peristiwa adsorpsi lebih dominan dibandingkan dengan peristiwa desorpsi, sehingga adsorpsi berlangsung cepat. Pada waktu tertentu peristiwa adsorpsi cendung berlangsung lambat, dan sebaliknya laju desorpsi cendrung meningkat. Waktu ketika laju adsorpsi adalah sama dengan laju desorpsi sering disebut sebagai keadaan berkesetimbangan. Pada keadaan berkesetimbangan tidak teramati perubahan secara makroskopis. Waktu
tercapainya keadaan setimbang pada proses adsorpsi adalah berbeda-beda, Hal ini dipengaruhi oleh jenis interaksi yang terjadi antara adsorben dengan adsorbat. Secara umum waktu tercapainya kesetimbangan adsorpsi melalui mekanisme fisika (fisisorpsi) lebih cepat dibandingkan dengan melalui mekanisme kimia atau kemisorpsi (Castellans 1982)
2.2.2. Persamaan Isoterm Adsorpsi Langmuir
Isoterm adsorpsi Langmuir didasarkan atas beberapa asumsi, yaitu (a) adsorpsi hanya terjadi pada lapisan tunggal (monolayer), (b) panas adsorpsi tidak tergantung pada penutupan permukaan, dan (c) semua situs dan permukaannya bersifat homogen (Oscik J 1994). Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul-molekul zat yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut.
C m x k m x m x C mak mak ( / ) 1 ) / ( 1 / = + ... (1) C merupakan konsentrasi adsorbat dalam larutan, x/m adalah konsentrasi adsorbat yang terjerap per gram adsorben, k adalah konstanta yang berhubungan dengan afinitas adsorpsi dan (x/m)mak adalah kapasitas adsorpsi maksimum dari adsorben.
Kurva isoterm adsorpsi Langmuir dapat disajikan seperti pada Gambar 1.
C x/m
2.2.3. Persamaan Isoterm Adsorpsi Freundlich
Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya lapisan monolayer dari molekul-molekul adsorbat pada permukaan adsorben. Namun pada adsorpsi Freundlich situs-situs aktif pada permukaan adsorben bersifat heterogen. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut.
Log (x/m) = log k + 1/n log c... ..(2), sedangkan kurva isoterm adsorpsinya disajikan pada Gambar 2.
Gambar 2 Kurva isoterm adsorpsi Freundlich Log C Log x/m
2.3. Logam Krom dan Keberadaannya
Logam krom merupakan logam golongan transisi, diketemukan di alam sebagai bijih terutama kromit (Fe(CrO2)2). Krom merupakan elemen berbahaya di
permukaan bumi dan dijumpai dalam kondisi oksida antara Cr(II) sampai Cr(VI). Krom bervalensi tiga umumnya merupakan bentuk yang umum dijumpai di alam, dan dalam material biologis krom selalu berbentuk valensi tiga, karena krom valensi enam merupakan salah satu material organik pengoksidasi yang tinggi (Suhendrayatna 2001). Krom valensi tiga memiliki sifat racun yang rendah dibandingkan dengan valensi enam. Pada bahan makanan dan tumbuhan mobilitas krom relatif rendah dan diperkirakan konsumsi harian komponen ini pada manusia dibawah 100 μg, kebanyakan berasal dari makanan, sedangkan dari air dan udara dalam tingkat yang rendah.
Dalam perairan, krom berada pada bilangan oksidasi +2, +3, dan +6, dan hanya +6 merupakan tingkat oksidasi yang paling dominan. Ion kromos (Cr2+) merupakan krom tingkat oksidasi +2, bersifat tidak stabil, dan jumlahnya relatif
sedikit. Cr2+ dengan cepat teroksidasi ke tingkat oksidasi +3 yang lebih stabil dalam lingkungan aerobik. Di samping itu, sebagai Cr(OH)2, Cr2+ akan
mengendap dalam air pada pH mendekati 6. Dengan demikian krom tingkat oksidasi +3 dan +6 lebih banyak berperan dalam lingkungan perairan (Bert,1982). Senyawa Cr(III) dan Cr(VI) sering dipakai untuk bahan pelapis logam lain agar lebih tahan korosi dan kelihatan lebih baik. Selain itu senyawa Cr(III) dan Cr(VI) juga dipakai sebagai bahan pembuatan cat, pewarna tekstil dan lain-lain. Dalam zat warna tekstil jenis Grey Lanaset G mengandung krom (III) sebesar 2,5 %
sebagai senyawa kompleks organologam (Blanques et al. 2004). Krom (VI) lebih
mudah diserap oleh tubuh dibandingkan dengan Cr(III). Namun, setelah di dalam tubuh Cr(VI) segera mengalami reduksi menjadi Cr(III) (ATSDR, 2000). Keterdapatan Cr(III) dalam tubuh dapat menyebabkan kanker paru-paru. Proses penjerapan krom oleh tubuh dan dampaknya bagi kesehatan disajikan pada Gambar 3 (Kaim and Schwederski 1994).
ruang membran ruang membran inti sel extra seluler sel intra seluler inti
kompleks kompleks kompleks kompleks Cr(III) DNA Cr(III) Cr(III) Cr(III) atau protein
Reduksi reduksi reduksi perbaikan replikasi CrO4= CrO4= CrO4= DNA kesalahan
Mutasi DNA
kanker Gambar 3 Diagram masuknya krom dalam tubuh
Senyawa krom dalam bentuk Cr2(SO4)3 banyak digunakan dalam aplikasi
komersial termasuk penyamakan kulit, pengawetan kayu, dan produksi pigmen. Hampir 90% industri penyamakan kulit menggunakan krom trivalen dalam proses penyamakan karena efektif, murah, dan tersedia di pasaran. Menurut Tutem et al.
(2001), selama proses produksi, krom dalam jumlah besar dibuang ke atmosfir, tanah, dan air. Oleh karena itu, limbah penyamakan kulit diolah untuk
memperoleh krom, sehingga krom dapat digunakan kembali pada proses penyamakan kulit.
2.4. Spektrofotometer Serapan Atom
Spektrofotometer serapan atom (SSA) ditujukan untuk analisis kuantitatif terhadap unsur-unsur logam. Alat ini memiliki sensitivitas yang sangat tinggi, sehingga sering dijadikan sebagai pilihan utama dalam menganalisis unsur logam yang konsentrasinya sangat kecil (ppm bahkan ppb). Prinsip dasar pengukuran dengan SSA adalah penyerapan energi (sumber cahaya) oleh atom-atom dalam keadaan dasar menjadi atom dalam keadaan tereksitasi. Pembentukan atom-atom dalam keadaan dasar atau proses atom-atomisasi pada umumnya dilakukan dalam nyala. Cuplikan sampel yang mengandung logam M sebagai ion M+ dalam bentuk larutan garam M+ dan A- akan melalui serangkaian proses dalam nyala, sebelum akhirnya menjadi atom logam dalam keadaan dasar M0 seperti terlihat pada Gambar 4.
Atom-atom dalam keadaan dasar (Mo) akan menyerap energi sumber energi berupa lampu katode berongga, yang mana jumlah energi yang diserap adalah sebanding dengan populasi atau konsentrasi atom-atom dalam sampel (Welz 1985). M+ + A- (larutan) M+ + A- (aerosol) MA (padat) MA (cair) MA (gas) Mo + Ao (gas) Mo (gas)
Gambar 4 Proses atomisasi
Penentuan konsentrasi unsur logam dalam sampel dapat dilakukan dengan bantuan kurva kalibrasi yang merupakan aluran antara absorbansi terhadap
konsentrasi larutan standar. Hal ini sesuai dengan Hukum Lambert-Beer yang menyatakan bahwa jumlah energi yang diserap (absorbansi) adalah sebanding dengan konsentrasi ( C ) (Khopkar 2003).
C Abs
III.
METODE PENELITIAN
3.1. Rancangan Penelitian
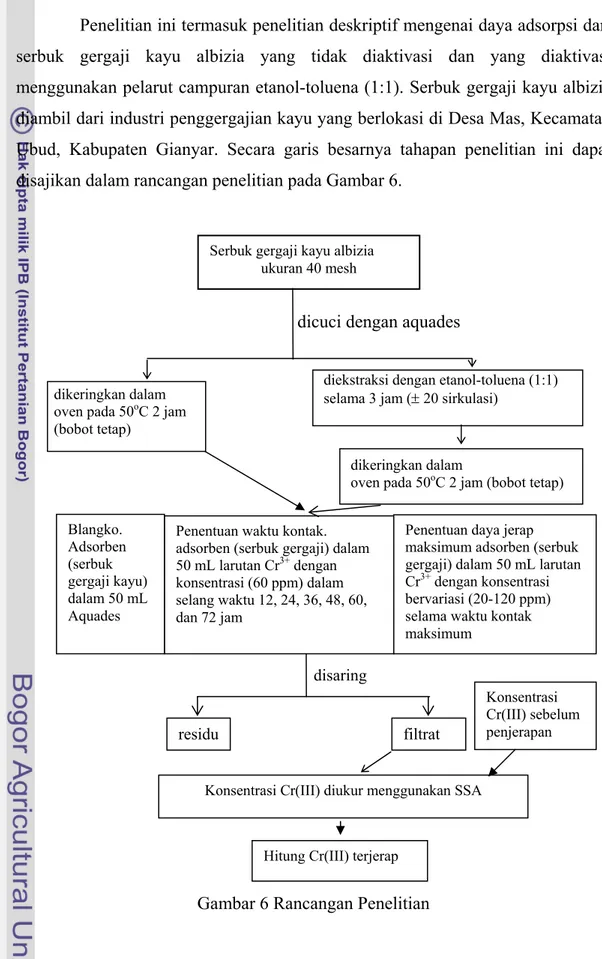
Penelitian ini termasuk penelitian deskriptif mengenai daya adsorpsi dari serbuk gergaji kayu albizia yang tidak diaktivasi dan yang diaktivasi menggunakan pelarut campuran etanol-toluena (1:1). Serbuk gergaji kayu albizia diambil dari industri penggergajian kayu yang berlokasi di Desa Mas, Kecamatan Ubud, Kabupaten Gianyar. Secara garis besarnya tahapan penelitian ini dapat disajikan dalam rancangan penelitian pada Gambar 6.
diekstraksi dengan etanol-toluena (1:1) selama 3 jam (± 20 sirkulasi)
dikeringkan dalam
oven pada 50oC 2 jam (bobot tetap) Serbuk gergaji kayu albizia
ukuran 40 mesh
dikeringkan dalam oven pada 50oC 2 jam (bobot tetap)
dicuci dengan aquades
disaring
filtrat residu
Konsentrasi Cr(III) diukur menggunakan SSA Penentuan waktu kontak.
adsorben (serbuk gergaji) dalam 50 mL larutan Cr3+ dengan konsentrasi (60 ppm) dalam selang waktu 12, 24, 36, 48, 60, dan 72 jam
Penentuan daya jerap maksimum adsorben (serbuk gergaji) dalam 50 mL larutan Cr3+ dengan konsentrasi bervariasi (20-120 ppm) selama waktu kontak maksimum Blangko. Adsorben (serbuk gergaji kayu) dalam 50 mL Aquades Konsentrasi Cr(III) sebelum penjerapan
Hitung Cr(III) terjerap Gambar 6 Rancangan Penelitian
3.2. Subyek dan Obyek Penelitian
Subyek dalam penelitian ini adalah serbuk gergaji kayu albizia yang diambil dari industri gergajian kayu di Desa Mas, Kecamatan Ubud, Kabupaten Gianyar Propinsi Bali. Sedangkan obyeknya adalah (1) waktu optimal yang diperlukan untuk adsorpsi ion Cr3+ oleh serbuk gergaji kayu albizia yang tidak diaktivasi dan diaktivasi menggunakan campuran etanol-toluena (1:1), (2) karakteristik adsorpsi ion Cr3+ oleh serbuk gergaji kayu albizia, dan (3) daya adsorpsi maksimum ion Cr3+ oleh serbuk gergaji kayu albizia.
3.3. Prosedur Penelitian
Penelitian ini dilakukan di Laboratorium Jurusan Kimia, Fakultas MIPA Universitas Pendidikan Ganesha Singaraja, dari bulan Nopember 2007 sampai dengan bulan Mei 2008. Tahapan-tahapan penelitian ini adalah meliputi dua tahapan, yaitu tahap persiapan dan tahap pelaksanaan penelitian.
3.3.1. Tahap Persiapan
3.3.1.1. Penyediaan Alat dan Bahan
Peralatan utama yang digunakan dalam penelitian ini adalah SSA model AA-6300 merek Shimadzu, oven, seperangkat alat Soxlet, dan neraca, serta beberapa peralatan tambahannya seperti batang pengaduk, gelas piala, labu ukur, pengocok (shaker), dan ayakan ukuran 40 mesh, sedangkan bahan-bahan kimia
yang digunakan antara lain : CrCl3.6H2O, toluena, etanol, kertas saring, aquades
dan serbuk gergaji kayu albizia.
3.3.1.2. Pencucian Serbuk Gergaji Kayu Albizia
Serbuk gergaji kayu albizia ditimbang 50 gram ukuran 40 mesh,
dimasukkan dalam gelas piala ukuran satu liter, kemudian tambahkan aquades sebanyak 500 mL. Campuran tersebut diaduk menggunakan pengocok (shaker)
pengadukan. Campuran didekantasi, dan selanjutnya serbuk gergaji dikeringkan dalam oven pada suhu 50oC selama kurang lebih 2 jam (sampai bobot tetap).
3.3.1.2. Aktivasi Serbuk Gergaji Kayu Albizia
Serbuk gergaji kayu albizia yang sudah dicuci dan dikeringkan, ditimbang sebanyak 25 gram. Serbuk gergaji tersebut selanjutnya diekstraksi dengan cara Soxlet menggunakan pelarut campuran etanol-toluena (1:1). Ekstraksi dihentikan apabila warna pelarut pada sirkulasi tertentu tidak berubah lagi (diperlukan waktu 3 jam atau 20 kali sirkulasi). Serbuk gergaji yang telah diekstraksi dikeringkan kembali dalam oven pada suhu 50o C selama 2 jam (sampai bobot tetap).
3.3.2. Tahap Pelaksanaan Penelitian
3.3.2.1. Penentuan Waktu Kontak Maksimum
Ke dalam 6 buah labu Erlenmeyer ukuran 100 mL dimasukkan masing-masing 1 gram serbuk gergaji kayu albizia kering yang telah dicuci, selanjutnya ke dalam gelas piala tersebut dimasukkan 50 mL larutan krom klorida heksahidrat (CrCl3.6H2O), dengan konsentrasi 60 ppm dan dikocok dengan menggunakan
pengocok masing-masing selama 12, 24, 36, 48, 60, dan 72 jam. Kemudian disaring dan filtratnya ditampung untuk diukur kadar kromnya (Cr3+) dengan SSA. Dengan cara yang sama dilakukan juga untuk serbuk gergaji kayu albizia yang telah diaktivasi menggunakan pelarut campuran etanol-toluena (1:1).
3.3.2.2. Penentuan Adsorpsi maksimum
Ke dalam 6 buah labu Erlenmeyer ukuran 100 mL, dimasukkan masing-masing sebanyak 1 gram serbuk gergaji kayu albizia kering yang telah dicuci. Selanjutnya, ke dalam gelas piala tersebut dimasukkan secara berturut-turut 50 mL larutan krom klorida heksahidrat (CrCl3.6H2O) dengan konsentrasi 20, 40, 60,
80, 100 dan 120 ppm. Campuran tersebut dikocok selama waktu kontak maksimum, kemudian disaring dan filtratnya ditampung untuk diukur kadar kromnya (Cr3+) dengan SSA. Kadar krom (III) pada larutan krom sebelum adsorpsi juga diukur. Selain itu dilakukan pengukuran pH pada sampel sebelum
dan sesudah adsorpsi berlangsung. Prosedur yang sama juga dilakukan terhadap serbuk gergaji kayu albizia yang telah diaktivasi menggunakan pelarut campuran etanol-toluena (1:1).
3.4. Analisis Data
Penentuan waktu kontak maksimum yang diperoleh dalam penelitian ini ditentukan dengan grafik hubungan antara lama waktu kontak dengan konsentrasi ion Cr3+ yang dijerap oleh adsorben.
Data kuantitatif tentang daya jerap ion Cr3+ per gram serbuk gergaji kayu
albizia (x/m) yang tidak diaktivasi dan diaktivasi yang diperoleh dalam penelitian ini akan ditentukan dengan persamaan :
(
)
adsorben gram/gram 10 50 C -C = m x 6 st o ...(3)x/m adalah banyaknya ion Cr3+ (gram) yang dijerap per gram adsorben, Co adalah
konsentrasi ion Cr3+ mula-mula, C
st adalah konsentrasi ion Cr3+ setimbang (tidak
dijerap). Untuk mengetahui karakteristik adsorpsi ion Cr3+ oleh serbuk gergaji
kayu albizia melalui uji isoterm adsorpsi Langmuir digunakan persamaan C ) m / x ( 1 k ) m / x ( 1 m / x C mak mak +
= dan isoterm adsorpsi Freundlich digunakan
persamaan log(x/m) = log k + 1/n log C, sedangkan daya adsorpsi maksimum dari adsorben ditentukan dengan membuat kurva berdasarkan karakteristik adsorpsi yang diperoleh.