PENANDAAN
131I-IOPAMIDOL SEBAGAI PERUNUT
DENGAN METODE PERTUKARAN ISOTOP
SKRIPSI
BALQIS HANIFAH
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PENANDAAN 131I-IOPAMIDOL SEBAGAI PERUNUT DENGAN
METODE PERTUKARAN ISOTOP
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh
BALQIS HANIFAH 11150960000060
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PENANDAAN
131I-IOPAMIDOL SEBAGAI PERUNUT
DENGAN METODE PERTUKARAN ISOTOP
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh BALQIS HANIFAH 11150960000060 Menyetujui, Pembimbing I Pembimbing II
Dr. Sandra Hermanto, M.Si Dra. Widyastuti, Apt, M.Farm NIP. 19750810 200501 1 005 NIP. 19561229 198702 2001
Mengetahui,
Ketua Prodi Kimia
Dr. La Ode Sumarlin, M.Si NIP. 19750918 200801 1 007
PENGESAHAN UJIAN SKRIPSI
Skripsi yang berjudul “Penandaan 131I-Iopamidol Sebagai Perunut
dengan Metode Pertukaran Isotop” telah diuji dan dinyatakan LULUS pada sidang Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada hari Senin, 20 April 2020. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia.
Menyetujui,
Penguji I Penguji II
Nurhasni, M.Si Nurmaya Arofah M.Eng NIP. 19740618 200501 1 005 NIP. 19870610 201903 2 016
Pembimbing I Pembimbing II
Dr. Sandra Hermanto, M.Si Dra. Widyastuti, Apt, M.Farm NIP. 19750810 200501 1 005 NIP. 19561229 198702 2001
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud Dr. La Ode Sumarlin, M.Si NIP. 19690404 200501 2 005 NIP. 19750918 200801 1 007
©Hak Cipta Milik UIN, Tahun 2020
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip Sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan UIN.
Dilarang mengumumkan dan memperbanyak Sebagian atau seluruh karya tulisan ini dalam bentuk apapun tanpa izin UIN dan Pusat Teknologi Radioisotop dan Radiofarmaka (PTRR), Badan Tenaga Nuklir Nasional (BATAN).
ABSTRAK
BALQIS HANIFAH. Penandaan 131I-Iopamidol Sebagai Perunut dengan Metode
Pertukaran Isotop. Dibimbing oleh SANDRA HERMANTO dan WIDYASTUTI.
Media kontras adalah suatu bahan yang sangat radiopaque atau radiolucent apabila berinteraksi dengan sinar-x, sehingga dapat membedakan antara organ dan jaringan sekitarnya. Media kontras dibagi menjadi dua jenis yaitu negatif dan positif. Media kontras iodinasi termasuk media kontras jenis positif yang dibagi lagi menjadi ionik dan nonionik, salah satu media kontras nonionik adalah iopamidol. Karakterisitik sediaan iopamidol dipelajari terutama pada biodistribusinya yang perlu dibuat iopamidol radioaktif dengan menandai molekul iopamidol dengan 131I. Penelitian ini bertujuan untuk menandai iopamidol dengan 131I yang akan digunakan sebagai perunut dalam studi preklinis sediaan iopamidol pada hewan normal. Metode yang digunakan dalam penelitian ini adalah pembuatan senyawa bertanda 131I-Iopamidol dengan variasi pH (2, 3, 5, 7 dan 9), waktu (5, 15, 45 dan 60 menit) dan suhu (140 ℃, 160 ℃ dan 180 ℃) dengan penambahan Na2S2O5 dan
CuSO4. Kondisi optimum penandaan dianalisis berdasarkan Kromatografi Lapis
Tipis (KLT) dan Kromatografi Cair Kinerja Tinggi (KCKT). Hasil penelitian menunjukkan kondisi optimum penandaan 131I-Iopamidol diperoleh pada pH 9, suhu 140 ℃ dan waktu 5 menit dengan kestabilan radiokimia selama 7 hari dengan kemurnian radiokimia 95% Hasil analisis menggunakan KCKT diperoleh puncak
131I-Iopamidol radioaktif yang muncul di waktu retensi 6,875 menit.
ABSTRACT
BALQIS HANIFAH. Labelling 131I-Iopamidol As a Tracer Using Isotope
Exchange Method. Supervised by SANDRA HERMANTO and WIDYASTUTI.
Contrast media is a highly radiopaque or radiolucent material when interacting with x-rays, which can differentiate between organs and surrounding tissues. Contrast media is divided into two types namely negative and positive. Iodinated contrast media include positive type contrast media which is further divided into ionic and nonionic, one of the nonionic contrast media is iopamidol. The characterization of iopamidol preparations is studied mainly in its biodistribution which needs to be made of radioactive iopamidol by labeling the iopamidol molecule with 131I. This study aimed to labeling iopamidol with 131I that will be used as a therapeutic in the preclinical study of iopamidol preparations in normal animals. Methods used in this study were 131I-Iopamidol Compound Synthesis with varying pH (2, 3, 5, 7 and 9), time (5, 15, 45 and 60 minutes) and temperature (140 ℃, 160 ℃ and 180 ℃) with the addition of Na2S2O5 and CuSO4.
The optimum conditions were analyzed based on Thin Layer Chromatography (TLC) and High Performance Liquid Chromatography (HPLC) analyzer. The result showed that the optimum condition of 131I-Iopamidol was obtained at pH 9, temperature 140 ℃ and 5 minutes with 7 days stability have to radiochemical purified 95% and analysis by using HPLC have 131I-Iopamidol radioactive peak and nonradioactive are obtaines at retention time of 6,875 minutes.
vi
KATA PENGANTAR
Assalamualaikum Wr. Wb
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT karena dengan Rahmat dan Karunian-Nya penulis dapat menyelesaikan penelitian yang berjudul
“Penandaan 131I-Iopamidol Sebagai Perunut Dengan Metode Pertukaran
Isotop”. Penulis menyadari penyusunan skripsi ini mendapat banyak bantuan, bimbingan, dan arahan dari berbagai pihak. Dalam kesempatan ini dengan segala kerendahan hati, penulis mengucapkan terima kasih kepada:
1. Dr. Sandra Hermanto, M.Si selaku Pembimbing I yang telah memberikan pengarahan serta bimbingannya dalam menyelesaikan skripsi.
2. Dra. Widyastuti, Apt, M.Farm selaku Pembimbing II yang telah memberikan pengetahuan, pengarahan, serta bimbingannya sehingga banyak membantu penulis dalam menyelesaikan penelitian tugas akhir ini.
3. Nurhasni, M.Si selaku penguji I dan dosen Penasehat Akademik yang telah memberikan saran pada penyusunan skripsi menjadi lebih baik dan bimbingan akademik kepada penulis.
4. Nurmaya Arofah, M.Eng selaku penguji II yang telah memberikan saran sehingga penulis dapat menyusun skripsi menjadi lebih baik.
5. Dr. La Ode Sumarlin, M.Si selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi.
6. Prof. Dr. Lily Surayya Eka Putri M.Env.Stud. selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatulllah Jakarta.
vii 7. Bapak, ibu, kakak dan adik-adik yang selalu memberikan dukungan dan doa
setiap saat kepada penulis.
8. Segenap dosen Program Studi Kimia atas ilmu pengetahuan, motivasi, serta pengalaman hidup yang dengan ikhlas diajarkan dan diberikan kepada penulis.
9. Nathasya, Zahrotul, Sofia, Novita, Nurinayah, Afifah, Evi, Dewi, Anggi, Annisa, dan Yanti yang telah mendengarkan keluh kesah dan memberikan semangat kepada penulis.
10. Khoirunnisa, kak Ilma dan Pak Amal yang telah membantu selama penelitian berlangsung kepada penulis.
11. Teman–teman Kimia 2015 yang senantiasa memberi motivasi, dukungan, dan keceriaan kepada penulis.
12. Serta semua pihak yang telah membantu penulis secara langsung maupun tidak langsung, yang tidak dapat disebutkan satu persatu.
Semoga arahan, motivasi, dan bantuan yang telah diberikan menjadi amal ibadah bagi keluarga, bapak, dan rekan-rekan, sehingga memperoleh balasan yang lebih baik dari Allah SWT. Akhir kata, penulis berharap semoga skripsi penelitian ini dapat bermanfaat.
Wassalamualaikum Wr. Wb
Ciputat, April 2020
viii
DAFTAR ISI
KATA PENGANTAR ... vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi BAB I PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Perumusan Masalah ... 4 1.3 Hipotesis ... 4 1.4 Tujuan ... 4 1.5 Manfaat ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Media Kontras ... 6 2.2. Penandaan Radioaktif ... 8 2.3 Radioiodinasi ... 10 2.4 Iopamidol ... 13 2.5 Iodium-131 ... 14 2.6 Kromatografi ... 15
2.6.1 Kromatografi Lapis Tipis (KLT) ... 15
2.6.2 Kromatografi Cair Kinerja Tinggi (KCKT) ... 17
BAB III METODE PENELITIAN ... 22
3.1 Waktu dan Tempat ... 22
3.2 Alat dan Bahan ... 22
3.3 Diagram Alir ... 23
3.4 Prosedur Kerja... 24
3.4.1 Pembuatan 131I-Eksipien ... 24
3.4.2 Pembuatan 131I-Iopamidol Variasi pH ... 24
3.4.3 Pembuatan 131I-Iopamidol Variasi Waktu dan Suhu ... 25
3.4.4 Uji Kemurnian dengan KLT ... 25
3.4.5 Uji Kestabilan dengan KLT ... 26
ix
3.4.6.1 Pembuatan Sampel ... 26
3.4.6.2 Persiapan Fasa Gerak dan Fasa Diam ... 27
3.4.6.3 Penetapan 131I-Iopamidol dan Iopamidol dengan KCKT ... 27
BAB IV HASIL DAN PEMBAHASAN... 28
4.1 Penandaan 131I-Eksipien ... 28
4.2 Penandaan 131I-Iopamidol ... 29
4.3 Uji Kemurnian Radiokimia 131I-Iopamidol ... 31
4.3.1 Hasil Optimasi Variasi pH ... 31
4.3.2 Hasil Optimasi Variasi Suhu dan Waktu ... 35
4.3.3 Kestabilan Penandaan 131I-Iopamidol ... 37
4.4 Analisa Hasil Penandaan dengan KCKT ... 38
BAB V PENUTUP ... 43
5.1 Simpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
x
DAFTAR GAMBAR
Gambar 1. Reaksi radiodinasi substitusi nukleofilik ... 12
Gambar 2. Reaksi radiodinasi substitusi elektrofilik ... 12
Gambar 3. Struktur iopamidol ... 13
Gambar 4. Instrumen KCKT ... 18
Gambar 5. Diagram alir ... 23
Gambar 6. Radiokromatogram 131I-eksipien ... 28
Gambar 7. Prediksi reaksi 131I-iopamidol ... 30
Gambar 8. Mekanisme reaksi SN2 melaui serangan nukleofilik ... 32
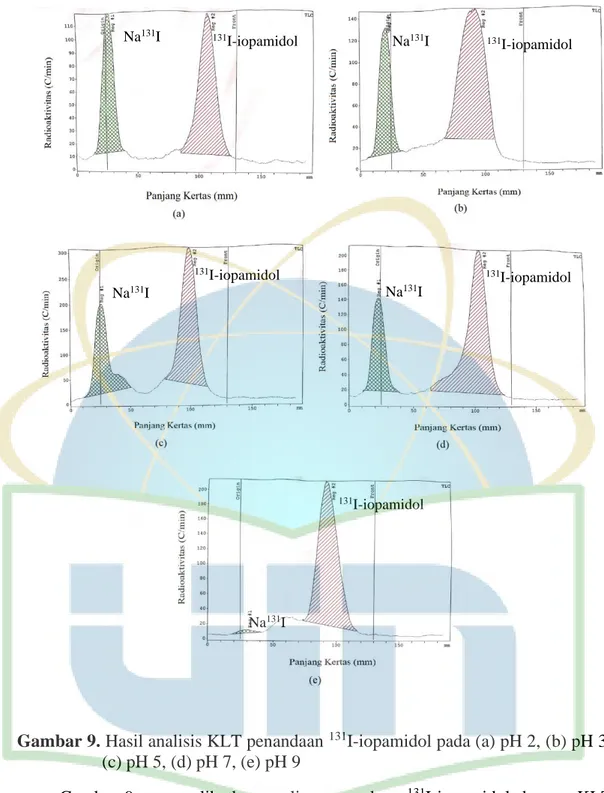
Gambar 9. Hasil analisis KLT penandaan 131I-iopamidol pada (a) pH 2, (b) pH 3, (c) pH 5, (d) pH 7, (e) pH 9 ... 34
Gambar 10. Kurva uji kemurnian dengan variasi pH ... 35
Gambar 11. Kurva uji kestabilan hari ke-0, 2, 4 dan 7 ... 36
Gambar 12. Kurva uji kemurnian dengan variasi suhu 140 °C, 160 °C, 180 °C dan waktu 5, 15, 45 dan 60 menit ... 38
Gambar 13. Gugus kromofor iopamidol ... 39
Gambar 14. Kromatogram (a) iopamidol standar (6,845 menit), (b) 131I-iopamidol detektor UV waktu retensi (6,875 menit), dan (c) 131I-iopamidol detektor radioaktif waktu retensi (6,950 menit). Laju alir (1,5 mL/menit), kolom C-18 dan fase gerak (air 100% : metanol 25%) ... 41
xi
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan ... 48
Lampiran 2. Tabel uji kemurnian 131I-iopamidol ... 48
Lampiran 3. Tabel pengulangan 131I-iopamidol ... 49
Lampiran 4. Tabel kestabilan 131I-iopamidol hari ke-0, 2, 4 dan 7 ... 49
Lampiran 5. Tabel KCKT iopamidol standar dan 131I-iopamidol ... 49
Lampiran 6. Warna 131I-iopamidol variasi pH sebelum pemanasan ... 50
Lampiran 7. Dokumentasi ... 50
Lampiran 8. Tabel hasil analisis KLT 131I-iopamidol variasi pH ... 51
Lampiran 9. Hasil analisis KLT 131I-iopamidol variasi suhu dan waktu... 52
Lampiran 10. Hasil analisis KLT 131I-iopamidol kestabilan hari ke-0, 2, 4 dan 7 ... 58
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Media kontras dengan berbagai macam jenisnya memiliki peran yang penting dengan meningkatkan teknik pencitraan dalam dunia kedokteran. Sekarang ini, penggunaan media kontras sudah umum dilakukan diinstalasi pencitraan di seluruh dunia (Wijaya & Atmadja, 2016). Media kontras adalah bahan yang sangat
radiopaque (pewarna putih) dan radiolucent (pewarna hitam) apabila berinteraksi
dengan sinar-x, dapat membedakan antara organ dan jaringan sekitarnya (Rasad, 2015). Allah SWT berfirman dalam Al-Qur’an surat Al-An’am ayat 1:
دْمَحْلا َّ ّلِل يّذَلا َقَلَخ ّتا َواَمَسلا َض ْرَ ْلْا َو َلَعَج َو ّتاَم لُّظلا َروُّنلا َو ۖ َم ث َنيّذَلا او رَفَك ْمّهّ ب َرّب َنو لّدْعَي Artinya:
“Segala puji bagi Allah yang telah menciptakan langit dan bumi, dan menjadikan gelap dan terang, namun demikian orang-orang kafir masih mempersekutukan Tuhan mereka dengan sesuatu.” (QS Al-An’am:1)
Firman Allah SWT dalam surat Al-An’am ayat 1 terdapat kalimat “Allah menjadikan gelap dan terang” hal ini dapat dikaitkan dengan salah satu kemajuan
teknik pencitraan dalam dunia kedokteran di mana hasil pencitraan tersebut menghasilkan gambar berupa gelap dan terang karena bahan media kontras tersebut. Media kontras ini diinjeksikan ke dalam tubuh kemudian akan berinteraksi dengan sinar-x sehingga menghasilkan penampakan struktur gambar suatu organ tubuh.
Media kontras dibagi menjadi dua jenis yaitu positif dan negatif. Salah satu jenis media kontras positif adalah media kontras iodinasi. Media kontras iodinasi
2 dibagi menjadi ionik dan nonionik. Media kontras nonionik umumnya lebih disukai karena osmolaritasnya yang rendah sehingga menghasilkan efek negatif yang lebih sedikit secara signifikan (Yueniwati, 2017). Media kontras iodinasi yang berupa nonionik salah satunya adalah iopamidol. Iopamidol adalah media kontras suntik iodinasi angiografi (organ tubuh), kantung kemih dan myelografi (kanal tulang belakang) (Florey, 1988). Iopamidol termasuk media kontras positif dengan monomer nonionik yang memiliki osmolaritas rendah (413-796 mosm/kg) dengan viskositas (2-9,4 cP) dan kelarutan dalam air yaitu 0,117 mg/mL. Iopamidol media kontras diinjeksikan ke dalam tubuh melalui jalur intravena. (Dowsett, 2009).
Penelitian ini dilakukan pembaruan yaitu menukar 131I dengan 127I pada iopamidol. Iopamidol digunakan sebagai bahan utama dalam penelitian ini karena media kontras ini hanya mampu mengontraskan gambaran umum saja, kurang spesifik dibagian tertentu. Pertukaran 131I dengan 127I sudah dilakukan oleh peneliti sebelumnya yang sampai saat ini produknya dapat digunakan diantaranya adalah
131I-Natrium Ortoiodohippurat (hippuran), 131I-6β-Iodometil-19-Norcholesterol
(iodocholesterol) dan 131I-Metaiodobenzylguanidin (MIBG) (Saha, 1998). Penandaan 131I dengan metode pertukaran isotop telah dilakukan penelitian
sebelumnya yaitu penandaan 131I-MIBG yang dapat dilakukan pada pH asam dengan suhu 160 ºC selama 60 menit dengan kemurnian radiokimia 98% (Neves et
al., 1992). Penandaan 131I-hippuran dilakukan pada pH 6 dengan dipanaskan pada
air mendidih selama 2 jam dengan kemurnian radiokimia 55% (Tubis et al., 1960). Penandaan 131I-iodocholesterol dengan suhu 100 ºC selama 4 jam dengan
3 peraturan bahwa standar kemurnian radiokimia untuk senyawa bertanda yaitu ≥ 95%.
131I untuk penandaan iopamidol bertujuan sebagai perunut, dimana perunut
adalah suatu teknik untuk mendapatkan informasi perilaku dari obyek dengan cara menandai obyek tersebut dengan suatu bahan tertentu. Radioisotop yang digunakan sebagai perunut banyak dimanfaatkan dibidang kedokteran sehingga perunut tersebut digunakan untuk mendeteksi jaringan atau organ tubuh tertentu (IAEA, 2008). Perunut tidak hanya digunakan dalam bidang kedokteran tetapi dibidang-bidang lainnya seperti didibidang-bidang pertanian yaitu untuk analisis waktu pemupukan tanaman sawi hijau, dibidang hidrologi yaitu untuk menyelidiki sumber daya air dan di bidang geologi yaitu untuk studi geokronologi sedimen di dasar laut (Witasari, 2015; Sidauruk, 2013; Sutapa et al., 2016).
Penelitian penggunaan radioisotop 131I yang menandai senyawa iopamidol akan digunakan untuk uji preklinis yaitu mempelajari biodistribusi iopamidol di dalam tubuh hewan coba sebagai model untuk memprediksi distribusinya di dalam tubuh manusia. Produk penandaan ini akan dilakukan uji stabilitas. Stabilitas merupakan kemampuan suatu produk untuk mempertahankan sifat dan karakteristiknya agar sama dengan yang dimilikinya saat dibuat dalam batasan yang ditetapkan sepanjang periode penyimpanan dan penggunaan (Carstensen & Rhodes, 2000)
Penelitian penandaan radioisotop 131I pada iopamidol menggunakan variasi pH yaitu 2; 3; 5; 7 dan 9, variasi waktu yaitu selama 5; 15; 45 dan 60 menit dan variasi suhu yaitu 140 ºC; 160 ºC dan 180 ºC. Hasil penandaan 131I-Iopamidol
4 dilakukan stabilitas selama 7 hari dan dilakukan analisis kromatografi cair kinerja tinggi (KCKT) dan uji kemurnian menggunakan kromatografi lapis tipis (KLT).
1.2 Rumusan Masalah
Rumusan masalah dari penelitian ini yaitu:
1. Bagaimanakah kondisi optimum penandaan 131I-iopamidol dengan tingkat kemurnian yang dihasilkan dari variasi pH, waktu dan suhu?
2. Bagaimanakah kestabilan 131I-iopamidol yang disimpan selama 7 hari?
1.3 Hipotesis
Hipotesis dari penelitian ini yaitu:
1. Kondisi optimum penandaan 131I-iopamidol diperoleh pada pH asam dengan suhu 160º C dan waktu 60 menit dengan tingkat kemurnian 131I-iopamidol yang dihasilkan ≥ 95%.
2. Kestabilan 131I-iopamidol selama 7 hari tidak mengalami penurunan berdasarkan uji kemurnian radiokimia
1.4 Tujuan Peneleitian
Tujuan dari penelitian ini yaitu:
1. Menentukan kondisi optimum penandaan 131I-iopamidol melalui variasi pH, waktu dan suhu yang berbeda.
2. Menguji kestabilan radioisotop dan kemurnian 131I-iopamidol yang
5
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi bahwa senyawa iopamidol dapat ditandai menggunakan radioisotop 131I yang dapat dijadikan sebagai salah satu perunut untuk studi preklinis sediaan agen pengontras iopamidol pada hewan uji coba.
6
BAB II
TINJAUAN PUSTAKA
2.1 Media Kontras
Media kontras adalah suatu bahan yang sangat radiopaque (warna putih) dan
radiolucent (warna hitam) apabila berinteraksi dengan sinar-x, sehingga dapat
membedakan antara organ dan jaringan sekitarnya (Rasad, 2005). Jenis bahan kontras dibagi menjadi dua, yaitu:
a) Bahan kontras negatif terdiri dari O2 (oksigen) dan CO2 (karbon dioksida).
b) Bahan kontras positif yang terdiri dari turunan barium sulfat (BaSO4) dan
turunan iodium (I).
Bahan kontras iodium terdiri dari kelompok ionik dan nonionik yang seluruhnya berasal dari bangunan gugus karbo hexagonal yang berikatan dengan tiga buah gugus iodium yang dikenal sebagai triodobenzene. Perbedaan bahan kontras ionik dan nonionik pada dasarnya adalah adanya gugus hidroksil pada bahan kontras yang nonionik, sehingga dapat membuat osmolaritas menjadi lebih rendah dibandingkan dengan yang ionik (Rasad, 2005).
Menurut Roesli (2011), jenis zat media kontras dibedakan berdasarkan osmolaritas:
1. Generasi pertama atau osmolaritas tinggi Contoh: Diatrizoate
7 Lebih banyak menimbulkan rasa nyeri dan sensasi panas saat pemberian serta terjadinya nefropathi kontras.
2. Generasi kedua atau osmolaritas rendah Contoh: Iohexol dan lopromide
Bersifat ionik, osmolaritas rendah (600 – 1000 mosm / kg) dan viskositas tinggi.
Lebih sedikit menimbulkan nyeri dan toksisitas akut lebih rendah dan paling sering dipakai.
3. Generasi ketiga atau iso osmolar Contoh: Iodixanol dan Iotrolan
Iso osmolar (290 mosm / kg) viskositas tinggi
Lebih sedikit menimbulkan diuresis osmotik, natriuresis dan hipoksia medular, deplesi volume dan aktivasi dari mediator vasoaktif
Lebih sedikit menimbulkan rasa nyeri dan panas saat injeksi, serta kejadian nefropathi kontras.
Menurut Rasad (2005) Penggolongan media kontras dari turunan iodium, yaitu:
a) Bahan kontras yang larut dalam minyak. Contoh: duroliopaque, pantopaque dahulu dipakai untuk pemeriksaan myelografi, lipiodol dipakai untuk pemeriksaan limfografi.
b) Bahan kontras yang larut dalam air terdiri dari:
1. Monomer ionik, ditandai dengan satu senyawa triodobenzene (tiga atom iodium), mempunyai ion dan terdapat gugus karboksil (garam sodium,
8 meglumine). Contoh: angiografin / turunan asam iothalamate, telebrix / turunan asam ioxithalamate.
2. Monomer nonionik, ditandai dengan satu senyawa triodobenzene, tanpa ion, tanpa gugus karboksil dan terdapat tiga atau lebih gugus hidroksil. Contoh: omnipaque / nama generic iohexol, ultravist / nama dagang iopromide. 3. Dimer ionik, ditandai dengan dua senyawa triodobenzene (enam atom
iodium), mempunyai ion dan terdapat gugus karboksil. Contoh: hexabrix / nama generik ioxaglate.
4. Dimer nonionik, ditandai dengan dua senyawa triodobenzene, tanpa ion, tanpa gugus karboksil dan terdapat gugus hidroksil. Contoh: isovist / nama generik iotrolan, visipaque / nama dagang iodixonal.
2.2 Penandaan Radioaktif
Penggunaan senyawa bertanda radionuklida telah berkembang pesat di bidang medis, biokimia, dan bidang terkait lainnya. Dibidang medis, senyawa yang ditandai mengandung emisi β dari radionuklida dibatasi pada eksperimen in vitro dan terapi pengobatan, sedangkan penandaan yang mengandung emisi γ dari radionuklida memiliki aplikasi yang jauh lebih luas. Yang terakhir khususnya berguna untuk pencitraan in vivo dari berbagai organ (Saha, 1998).
Senyawa, atom atau kelompok atom dari suatu molekul akan disubtitusi dengan atom radioaktif yang serupa atau berbeda. Dalam proses penandaan, terdapat berbagai kondisi fisikokimia yang digunakan untuk mencapai jenis penandaan tertentu (Saha, 1998). Metode-metode dan berbagai faktor yang mempengaruhi penandaan senyawa antara lain:
9
Metode Penandaan
Penandaan senyawa dengan atom radioaktif dapat dilakukan dengan beberapa metode, yaitu: reaksi pertukaran isotop, sintesis biokimia, penandaan dengan nuklida asing, dan penandaan eksitasi (Saha, 1998).
1. Penandaan dengan reaksi pertukaran isotop
Penandaan dengan metode ini dilakukan dengan menggantikan satu atau lebih atom dalam suatu molekul dengan isotop dari unsur atom yang sama tetapi punya nomor massa berbeda. Penggunaan reaksi pertukaran isotop menjadi sangat penting jika cara kimia tidak dapat dilakukan. Akan tetapi metode ini juga memiliki beberapa kelemahan, yaitu reaksi ini merupakan reaksi yang bersifat reversibel sehingga atom yang telah ditandai dapat terlepas kembali. Selain itu adanya pengotor dalam pereaksi awal yang terlibat dalam reaksi pertukaran akan lebih menyulitkan pemurnian produk utama hasil reaksi. Contoh senyawa bertanda yang disiapkan dengan metode ini adalah senyawa bertanda 125I-triiodotironin (125I-T3) dan 125I-tetraiodotironin (125I-T4).
2. Metode sintesis biokimia
Metode sintesis biokimia menggunakan enzim sebagai katalis kimia dalam merubah suatu substrat radioaktif menjadi senyawa bertanda yang diinginkan. Perubahan substrat radioaktif dengan sintesis enzimatik ini sangat mirip dengan perubahan substrat yang terjadi melalui sintesis kimia untuk penyediaan senyawa bertanda.
10 3. Metode penandaan dengan nuklida asing
Metode ini paling umum digunakan dalam penyiapan senyawa bertanda. Jenis penandaan ini melibatkan molekul yang memiliki peranan biologis yang telah dikenal, kemudian suatu radionuklida dari unsur yang bukan merupakan bagian dari molekul tersebut direaksikan melalui ikatan kovalen atau ikatan kovalen koordinasi.
4. Metode penandaan eksitasi
Metode penandaan ini melibatkan ion radionuklida anak yang sangat reaktif hasil dari peluruhan inti selama peluruhan beta atau tangkapan elektron. Dalam reaksi ini dihasilkan ion berenergi tinggi yang mampu menandai berbagai senyawa yang berada disekitarnya. Misalnya senyawa dipaparkan pada 77Kr yang meluruh menjadi 77Br, maka ion 77Br berenergi tinggi hasil peluruhan selanjutnya akan membentuk senyawa bertanda brom. Hal yang sama terjadi juga dengan berbagai protein yang dipaparkan pada 123Xe yang menghasilkan protein teriodinasi hasil peluruhan 123Xe.
2.3 Radioiodinasi
Iodinasi digunakan secara luas untuk menandai senyawa tertentu. Iodium adalah elemen logam halogen golongan VII A. Nomor atomnya adalah 53 dan satu-satunya isotop stabilnya adalah 127I. Dari semua isotop yodium, 123I paling cocok untuk diagnosis secara in vivo karena memiliki waktu paruh (13,2 jam) dan energi foton (159 keV), dan memberikan dosis radiasi yang rendah untuk pasien. Isotop
125I paling umum digunakan untuk memproduksi penandaan antigen atau senyawa
11 energinya rendah (27-35 KeV) foton membuatnya tidak cocok untuk pencitraan in
vivo. Isotop 131I banyak digunakan dalam bidang kedokteran, terutama untuk studi
in vivo, karena memiliki waktu paruh 8 hari dan energi 364 keV foton (Saha, 1998). Prinsip Radioiodinasi
Proses radioiodinasi pada prinsipnya dapat dibagi yaitu reaksi substitusi nukleofilik dan elektrofilik (Coenen et al., 2006)
1. Subtitusi nukleofilik
Reaksi yang terjadi apabila gugus yang mengganti merupakan pereaksi nukleofil. Beberapa mekanisme berbeda tergantung pada substratnya (alifatik atau aromatik), leaving group dan kondisi reaksi (pelarut, suhu, dll.) (Sumardjo, 2006). Radioiodinasi melalui substitusi nukleofilik paling sering dilakukan dengan senyawa alifatik dan aromatik.
a. Pertukaran halogen dengan senyawa alifatik
Dalam senyawa alifatik, reaksi terjadi pada atom karbon jenuh dan sesuai dengan mekanisme SN1 dan SN2 yang paling umum. Parameternya
mempengaruhi jenis reaksi ini seperti sifat senyawa, nukleofil, leaving
group, suhu pelarut, kinetika dan stereokimia. Perbedaan utamanya
adalah ikatan kelompok yang pergi rusak sebelum (SN1) atau setelah
(SN2) pembentukan ikatan nukleofil.
b. Pertukaran halogen dengan senyawa aromatik
Substitusi nukleofilik berlangsung lambat pada karbon aromatik. Untuk keberhasilan reaksi substitusi nukleofilik pada aromatik ini, substrat reaksi harus diaktifkan dengan penarikan kelompok elektron, lebih disukai dalam posisi orto atau para untuk leaving group, atau
12 menggunakan katalis. Reaksi radioiodinasi subtitusi nukleofilik berdasarkan reaksi antar halogen menggunakan katalis tembaga:
Gambar 1. Reaksi radiodinasi substitusi nukleofilik (Vallabhajosula &
Nikolopoulou, 2011) 2. Subtitusi elektrofilik
Radioiodinasi elektrofilik adalah proses yang secara formal di mana iodium bermuatan positif (I+) menyerang sistem dengan kerapatan elektron yang tinggi seperti cincin aromatik atau ikatan rangkap. Akibatnya ikatan karbon-iodium kovalen yang terbentuk dengan hilangnya muatan positif ke leaving group. Yang paling penting leaving group terbaik adalah yang bisa ada tanpa pasangan elektron yang diperlukan untuk mengisi kulit terluar. Leaving group yang paling umum adalah proton. Dalam sistem alifatik, proton bisa menjadi leaving group, tetapi reaktivitas tergantung pada keasaman. Reaksi radioiodinasi subtitusi elektrofilik berdasarkan reaksi antar halogen:
Gambar 2. Reaksi radiodinasi substitusi elektrofilik (Vallabhajosula &
13
2.4 Iopamidol
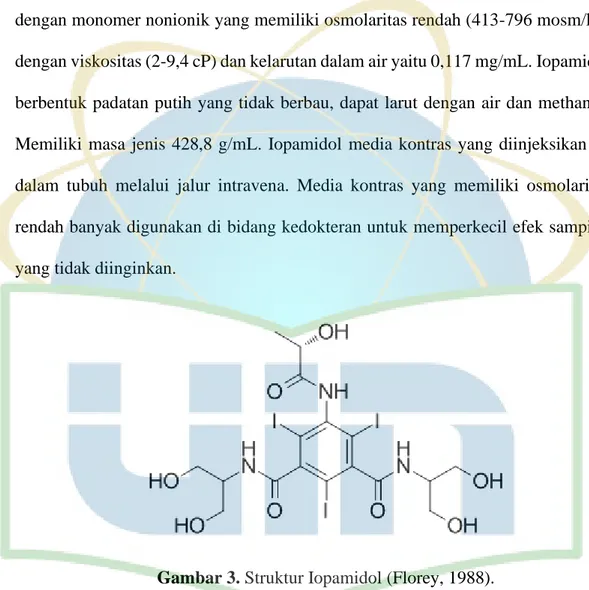
Iopamidol atau iopamiro adalah agen kontras suntik iodinasi angiografi, ekskresi urografi dan myelography. Iopamidol terdapat pada kelas turunan asam benzoat triiodinated nonionik dengan tiga yodium atom per partikel dalam larutan. (Florey, 1988). Menurut Dowsett (2009) iopamidol adalah media kontras positif dengan monomer nonionik yang memiliki osmolaritas rendah (413-796 mosm/kg) dengan viskositas (2-9,4 cP) dan kelarutan dalam air yaitu 0,117 mg/mL. Iopamidol berbentuk padatan putih yang tidak berbau, dapat larut dengan air dan methanol. Memiliki masa jenis 428,8 g/mL. Iopamidol media kontras yang diinjeksikan ke dalam tubuh melalui jalur intravena. Media kontras yang memiliki osmolaritas rendah banyak digunakan di bidang kedokteran untuk memperkecil efek samping yang tidak diinginkan.
Gambar 3. Struktur Iopamidol (Florey, 1988).
Iopamidol telah digunakan sebagai agen diagnostik untuk CT protocol sejak 1981. Media kontras nonionik ini dapat digunakan untuk pencitraan X-ray dalam aplikasi diagnostik termasuk gangguan sistem saraf pusat, sistem kardiovaskular dan saluran kemih. Kelarutan air tinggi yang ditunjukkan oleh iopamidol, ditambah dengan toksisitas yang sangat rendah, membuat senyawa ini aman diberikan pada
14 intravena dengan menggunakan dosis yang sangat tinggi (hingga 400 mg/ml). Iopamidol memiliki atom tiga yodium yang diperlukan untuk berkas sistem dengan X-ray radiopasitas tinggi, struktur kimia iopamidol ditandai dengan adanya tiga amida yang berfungsi sebagai bearing substituen hidrofil yang merespon untuk kelarutan air (Aime et al., 2005).
2.5 Iodium-131
Radioisotop Iodium-131 adalah radioisotop yang salah satunya tersedia dalam bentuk senyawa natrium iodida (Na131I). Senyawa ini dihasilkan dari fisi
uranium atau penembakan telurium dengan neutron sedemikian hingga bebas pengemban dan hanya mengandung sejumlah kecil iodium-127 (127I) alamiah (Coenen et al., 2006). Larutan dapat mengandung bahan pengawet atau penstabil. Larutan Na131I jernih dan tidak berwarna. Larutan dan wadah kaca dapat menjadi gelap akibat pengaruh radiasi. Waktu paruh dari 131I adalah 8,05 hari dengan memancarkan sinar β (beta) dan γ (gamma) (Kemenkes, 2014). Iodium-131 merupakan radioisotop yang dapat diaplikasikan untuk diagnosis dan terapi. Terapi dapat dilakukan dengan Iodium-131 dikarenakan mengemisikan sinar beta. Emisi sinar beta pada Iodium-131 dapat menghancurkan folikel sel tiroid, sehingga digunakan untuk pengobatan pada penderita kanker tiroid (Islamiaty & Halimah, 2008)
Diagnosis dapat dilakukan melalui Iodium-131 dikarenakan radioisotop ini memancarkan sinar gamma. Namun, dalam dosis yang tinggi bisa mengakibatkan efek yang membahayakan untuk jaringan. Untuk mengurangi pengaruh tersebut maka dosis pemberiannya dikurangi yang menyebabkan kurang sensitif dalam
15 diagnosisnya (Alzahrani et al., 2001). 131I dapat digunakan sebagai perunut di mana
131I akan masuk ke struktur senyawa lain yang disebut penandaan (labelling)
sehingga dapat dilihat biodistribusi dalam jaringan. Perunut adalah suatu teknik untuk mendapatkan informasi perilaku dari obyek dengan cara menandai obyek tersebut dengan suatu bahan tertentu. Pada penelitian ini radioisotop yang digunakan sebagai perunut yaitu di bidang kedokteran sehingga perunut tersebut untuk mendeteksi pada jaringan atau organ tubuh tertentu (IAEA, 2008).
2.6 Kromatografi
Kromatografi merupakan suatu teknik pemisahan campuran berdasarkan perbedaan kecepatan perambatan komponen dalam medium tertentu. Prinsip pemisahan kromatografi yaitu adanya distribusi komponen-komponen dalam fase diam dan fase gerak berdasarkan perbedaan sifat fisik komponen yang akan dipisahkan (Gandjar & Rohman, 2012). Kromatografi berdasrkan fase geraknya dibedakan menjadi kromatografi cair dan kromatografi gas, sedangkan berdasarkan jenis fase diamnya dibedakan menjadi kromatografi planar dan kromatografi kolom.
2.6.1 Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) adalah metode pemisahan fitokimia dengan menggunakan lapisan planar/ datar. Lapisan fase diam yang memisahkan terdiri atas butiran-butiran (fase diam), yang ditempatkan pada penyangga berupa pelat gelas, logam, atau lapisan yang cocok. Campuran yang akan dipisahkan berupa larutan, ditotolkan berupa bercak. Setelah pelat atau lapisan diletakkan di dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak),
16 pemisahan terjadi selama perambatan kapiler selanjutnya senyawa yang tidak berwarna harus ditampakkan (dideteksi melalui pewarnaan) (Stahl, 1985).
Silika gel merupakan fasa diam yang paling sering digunakan untuk KLT. Untuk penggunaan dalam suatu tipe pemisahan perbedaannya tidak hanya pada struktur, tetapi juga pori-porinya dan struktur lubangnya menjadi penting, disamping pemilihan fasa gerak (Sudjadi, 1896). Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan Rf atau hRf. Harga Rf umumnya kurang dari 1, sedangkan bila dikalikan dengan 100 akan berharga antara 1-100, untuk itulah parameter ini dapat digunakan untuk perhitungan kualitatif dalam pengujian sampel dengan KLT (Stahl, 1985).
Bercak yang terjadi setelah dielusi dapat dideteksi dengan cara fisika maupun kimia. Cara fisika ini digunakan untuk substansi yang berfluoresensi, defluoresensi pada lampu UV. Untuk substansi yang tidak berfluoresensi penjerap ditambah indikator fluoresensi, bercak akan kelihatan gelap dengan cara penyemprotan. Bercak kemudian dilihat dengan sinar tampak atau lampu UV. Setelah penyemprotan kadang-kadang diperlukan pemanasan (Stahl, 1985).
Menurut Sastrohamidjojo (2002) identifikasi dari senyawa-senyawa yang terpisah pada lapisan tipis lebih baik dikerjakan dengan pereaksi lokasi kimia dan reaksi warna. Tetapi lazimnya untuk identifikasi menggunakan harga Rf meskipun harga Rf dalam lapisan tipis kurang tepat bila dibandingkan pada kertas. Harga Rf didefinisikan sebagai berikut:
Harga Rf = gerak fasa dari an pengembang Jarak awal titik dari senyawa oleh an pengembang Jarak (pers. 1)
17
2.6.2 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi (KCKT) atau biasa juga disebut dengan
High Performance Liquid Chromatography (HPLC) dikembangkan pada akhir
tahun 1960-an dan awal tahun 1970-an. Saat ini, KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang, antara lain: farmasi, lingkungan, bioteknologi, polimer, dan industri-industri makanan (Putra, 2004).
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian (impurities), analisis senyawa-senyawa tidak mudah menguap (non-volatil), penentuan molekul-molekul netral, ionik, maupun zwitter ion; isolasi dan pemurnian senyawa: pemisahan senyawa-senyawa yang strukturnya hampir sama; pemisahan senyawa-senyawa dalam jumlah sekelumit (trace elements), dalam jumlah banyak, dan dalam skala proses industri. KCKT merupakan metode yang tidak destruktif dan dapat digunakan baik untuk analisis kualitatif maupun kuantitatif (Putra, 2004).
Menurut Johnson 1991, Kromatografi Cair Kinerja Tinggi (KCKT) atau High Pressure Liquid Chromatography (HPLC) merupakan salah satu metode kimia dan fisikokimia. termasuk metode analisis terbaru yaitu suatu teknik kromatografi dengan fasa gerak cairan dan fasa diam cairan atau padat. Banyak kelebihan metode ini jika dibandingkan dengan metode lainnya. Kelebihan itu antara lain:
a. Mampu memisahkan molekul-molekul dari suatu campuran b. Mudah melaksanakannya
18 c. Kecepatan analisis dan kepekaan yang tinggi
d. Dapat dihindari terjadinya dekomposisi / kerusakan bahan yang dianalisis e. Resolusi yang baik
f. Dapat digunakan bermacam-macam detektor
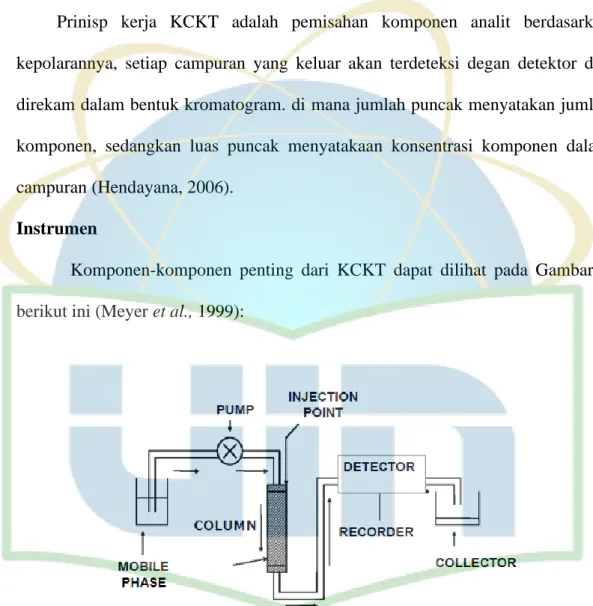
Prinsip Kerja KCKT
Prinisp kerja KCKT adalah pemisahan komponen analit berdasarkan kepolarannya, setiap campuran yang keluar akan terdeteksi degan detektor dan direkam dalam bentuk kromatogram. di mana jumlah puncak menyatakan jumlah komponen, sedangkan luas puncak menyatakaan konsentrasi komponen dalam campuran (Hendayana, 2006).
Instrumen
Komponen-komponen penting dari KCKT dapat dilihat pada Gambar 4 berikut ini (Meyer et al., 1999):
Gambar 4. Instrumen KCKT (Lindsay et al., 1992)
1. Pompa
Fase gerak dalam KCKT adalah suatu cairan yang bergerak melalui kolom. Ada dua tipe pompa yang digunakan, yaitu tekanan konstan (constant pressure)
19 dan pemindahan konstan (constant displacement). Pemindahan konstan dapat dibagi menjadi dua, yaitu: pompa reciprocating dan pompa syringe. Pompa
reciprocating menghasilkan suatu aliran yang teratur (pulsating), oleh karena itu
membutuhkan peredam elektronik untuk menghasilkan garis dasar (base line) detektor yang stabil, bila detektor sensitif terhadapan aliran. Keuntungan utamanya ialah ukuran reservoir tidak terbatas. Pompa syringe memberikan aliran yang tidak berdenyut, tetapi reservoirnya terbatas.
2. Injektor
Sampel yang akan dimasukkan ke bagian ujung kolom, pada waktu sampel diinjeksikan ke dalam kolom, diharapkan agar aliran pelarut tidak mengganggu masuknya keseluruhan sampel ke dalam kolom. Sampel dapat langsung diinjeksikan ke dalam kolom atau digunakan katup injeksi (Adnan, 1997). Ada tiga tipe dasar injektor yang dapat digunakan:
a. Stop-Flow: Aliran dihentikan, injeksi dilakukan pada kinerja atmosfir,
sistem tertutup, dan aliran dilanjutkan lagi. Teknik ini bisa digunakan karena difusi di dalam cairan kecil resolusi tidak dipengaruhi.
b. Septum: Septum yang digunakan pada KCKT sama dengan yang digunakan pada Kromatografi Gas. Injektor ini dapat digunakan pada kinerja sampai 60-70 atmosfir, tetapi septum ini tidak tahan dengan semua pelarut-pelarut kromatografi cair. Partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
c. Loop Valve: Tipe injektor ini umumnya digunakan untuk menginjeksi
volume lebih besar dari 10 μL dan dilakukan dengan cara automatis (dengan
20 diinjeksifan secara manual). Pada posisi Load, sampel diisi ke dalam loop pada kinerja atmosfir, bila Valve difungsikan, maka sampel akan masuk ke dalam kolom.
3. Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom dapat dibagi menjadi dua kelompok:
a. Kolom analitik: Diameter dalam 2-6 mm. Panjang kolom tergantung pada jenis material pengisi kolom. Untuk kemasan pallikular, panjang yang digunakan adalah 50 -100 cm. Untuk kemasan poros mikropartikulat, 10 - 30 cm. Dewasa ini ada yang 5 cm.
b. Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan panjang kolom 25 -100 cm.
Kolom umumnya dibuat dari stainlesteel dan biasanya dioperasikan pada temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama untuk kromatografi penukar ion dan kromatografi eksklusi. Pengepakan kolom tergantung pada model KCKT yang digunakan (Liquid Solid Chromatography, LSC; Liquid Liquid Chromatography, LLC; Ion Exchange Chromatography, IEC,
Exclution Chromatography, EC).
4. Detektor
Detektor dibutuhkan untuk mendeteksi adanya komponen sampel di dalam kolom (analisis kualitatif) dan menghitung kadarnya (analisis kuantitatif). Detektor yang baik memiliki sensitivitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang luas, dan memberi respons untuk semua tipe
21 senyawa. Suatu kepekaan yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi tidak selalu dapat diperoleh. Detektor KCKT yang umum digunakan adalah detektor UV-Vis 254 nm. Variabel panjang gelombang dapat digunakan untuk mendeteksi banyak senyawa dengan range yang lebih luas. Detektor indeks refraksi juga digunakan secara luas, terutama pada kromatografi eksklusi, tetapi umumnya kurang sensitif jika dibandingkan dengan detektor UV-Vis.
5. Elusi Gradien
Elusi Gradien didefinisikan sebagai penambahan kekuatan fasa gerak selama analisis kromatografi berlangsung. Efek dari elusi gradien adalah mempersingkat waktu retensi dari senyawa-senyawa yang tertahan kuat pada kolom. Elusi gradien menawarkan beberapa keuntungan:
a. Total waktu analisis dapat direduksi
b. Resolusi persatuan waktu setiap senyawa dalam campuran bertambah c. Ketajaman peak bertambah (menghilangkan tailing).
22
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Pusat Teknologi Radioisotop dan Radiofarmaka, Badan Tenaga Nuklir Nasional (BATAN) Puspitek Serpong, Tangerang, Banten. Penelitian ini dilaksanakan dari bulan Agustus sampai Desember 2019.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini yaitu timbangan analitik, peralatan gelas, pemanas (hotplate), dose calibrator, penangas, vial, pH Indikator, silika gel Merck, Eppendorf mikropipet, Radiochromatografi Scanner Elysia Raytest Comecer, dan KCKT Thermo Scientific kolom C-18 250x4.6 mm.
Bahan yang digunakan dalam penelitian ini yaitu sediaan pengontras iopamidol (Iopamiro, Bracco), natrium metabisulfit, tembaga (II) sulfat, Na131Idari
Pusat Reaktor Serba Guna BATAN, trometamin, EDTA, amonium hidroksida 32%, natrium hidroksida, asam asetat glasial, etil asetat, dan air.
23
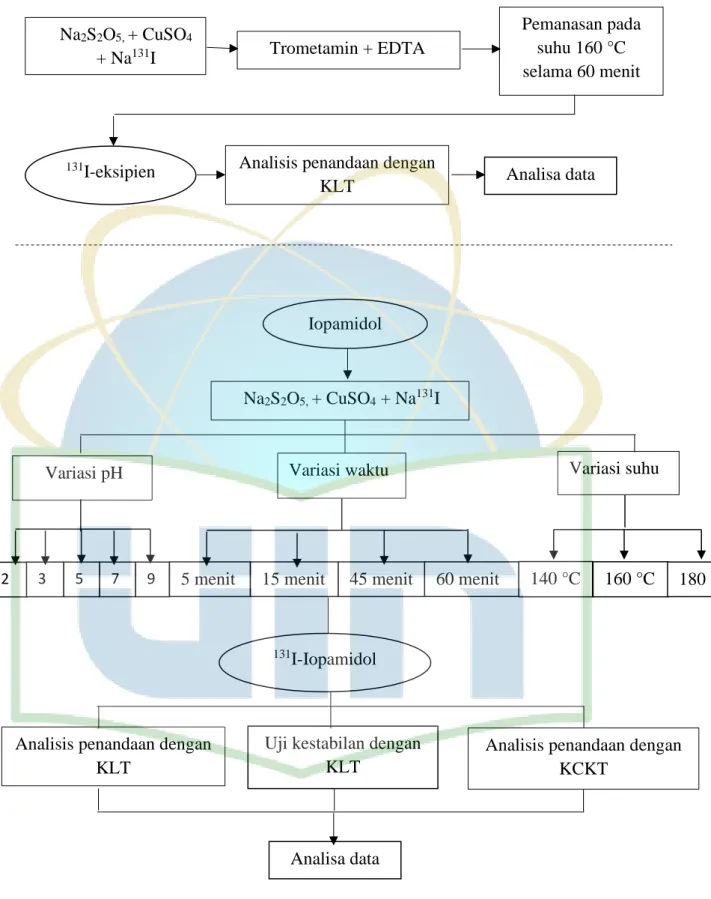
3.3 Diagram Alir
Gambar 5. Diagram alir penelitian
Na2S2O5, + CuSO4 + Na131I
Variasi pH Variasi waktu
Analisis penandaan dengan KCKT
Variasi suhu
Analisis penandaan dengan KLT
2 3 5 7 9 5 menit 15 menit 45 menit 60 menit 140 °C 160 °C 180 °C
Analisa data Uji kestabilan dengan
KLT
131I-Iopamidol
Iopamidol
131I-eksipien Analisis penandaan dengan
KLT Analisa data Trometamin + EDTA Pemanasan pada suhu 160 °C selama 60 menit Na2S2O5, + CuSO4 + Na131I
24
3.4 Prosedur Penelitian
Prosedur pembuatan 131I-Iopamidol mengikuti metode Neves et al., (1992)
yaitu metode untuk sintesis yang 131I-MIBG yang sedikit dimodifikasi meliputi variasi pH, waktu dan suhu.
3.4.1 Pembuatan 131I-Eksipien
Na2S2O5 sebanyak 4 mg dimasukkan ke dalam vial, ditambahkan 100 μL
larutan CuSO4 2 mg yang telah dilarutkan dengan air 1 mL, trometamin 1 g, EDTA
1 g dan 1 mCi larutan Na131I kemudian larutan dikocok menggunakan alat pengocok vortex hingga homogen, dicek pH. Vial ditutup dengan karet septa. Penangas dipanaskan hingga 160 °C. Vial yang telah berisi bahan reaksi 131 I-Iopamidol diberi ventilasi dan dihubungkan melalui tubing dan jarum ke dalam NaOH 1N. Larutan reaksi 131I-eksipien dipanaskan pada suhu 160 °C selama 60
menit. Larutan yang sudah dipanaskan, didinginkan selama beberapa saat. Air ditambahkan pada 131I-eksipien kemudian dilakukan pengujian radiokimia
menggunakan KLT.
3.4.2 Pembuatan 131I-Iopamidol Variasi pH
Na2S2O5 sebanyak 4 mg dimasukkan ke dalam vial, ditambahkan 100 μL
larutan CuSO4 2 mg yang telah dilarutkan dengan air 1 mL, 8 μl Iopamidol
(konversi 2 g iopamidol) dan 1 mCi larutan Na131I kemudian larutan dikocok menggunakan alat pengocok vortex hingga homogen, dicek pH. Variasi pH 2, 3 ditambahkan CH3COOH sedangkan untuk variasi pH 7, 9 menggunakan NH4OH,
dikocok kembali. Vial ditutup dengan karet septa. Penangas dipanaskan hingga 160 °C. Vial yang telah berisi bahan reaksi 131I-Iopamidol diberi ventilasi dan dihubungkan melalui tubing dan jarum ke dalam NaOH 1N. Larutan reaksi 131
I-25 Iopamidol dipanaskan pada suhu 160 °C selama 60 menit. Larutan yang sudah dipanaskan, didinginkan selama beberapa saat. Air ditambahkan pada 131
I-Iopamidol kemudian dilakukan pengujian radiokimia menggunakan KLT.
3.4.3 Pembuatan 131I-Iopamidol Variasi Waktu dan Suhu
Na2S2O5 sebanyak 4 mg dimasukkan ke dalam vial, ditambahkan 100 μL
larutan CuSO4 2 mg yang telah dilarutkan dengan air 1 mL, 8 μl Iopamidol
(mengandung mg iopamidol) dan 1 mCi larutan Na131I kemudian larutan dikocok menggunakan alat pengocok hingga homogen, dicek pH. pH diatur menjadi 9. Vial ditutup dengan karet septa. Penangas dipanaskan hingga 140 °C, 160 °C, 180 °C selama 5, 15, 45 dan 60 menit. Vial yang telah berisi bahan untuk sintesis 131 I-Iopamidol diberi ventilasi dan dihubungkan melalui tubing dan jarum ke dalam NaOH 1N. Larutan 131I-Iopamidol dinginkan setelah selesai pemanasan. Air ditambahkan pada 131I-Iopamidol kemudian dilakukan pengujian radiokimia menggunakan KLT.
3.4.4 Uji Kemurnian Radiokimia dengan KLT (Florey, 1998)
Bejana kromatografi diisi dengan larutan eluen campuran etil asetat, asam asetat glasial dan air dengan perbandingan 5:2:1 v/v kemudian ditutup dan didiamkan selama 5 menit. Cuplikan ditotolkan ke salah satu ujung silika gel lalu dibiarkan sampai kering. Setelah kering, kaitkan bagian atas silica gel pada gantungan bejana sehingga silika gel terendam sedalam 1 cm di dalam eluen dengan posisi berdiri tegak. Eluen dibiarkan naik sampai ± 11 cm, kemudian diangkat dan dikeringkan. Silika gel yang sudah terelusi dan kering diukur kemurnian radiokimianya dengan menggunakan Alat Radiochromatografi Scanner Elysia
26
3.4.5 Uji Kestabilan Radiokimia dengan KLT (Florey, 1998)
Na2S2O5 sebanyak 4 mg dimasukkan ke dalam vial, ditambahkan 100 μL
larutan CuSO4 2 mg yang telah dilarutkan dengan air 1 mL, 8 μl Iopamidol dan 1
mCi larutan Na131I kemudian larutan dikocok menggunakan alat pengocok hingga
homogen, dicek pH. Vial ditutup dengan karet septa. Penangas dipanaskan hingga 140 °C. Vial yang telah berisi bahan 131I-Iopamidol diberi ventilasi dan dihubungkan melalui tubing dan jarum ke dalam NaOH 1N. Larutan 131I-Iopamidol
dipanaskan pada suhu 140 °C selama 5 menit. Larutan yang sudah dipanaskan, didinginkan selama beberapa saat. 131I-iopamidol disimpan selama 7 hari pada suhu
ruang.
Bejana kromatografi diisi dengan larutan eluen campuran etil asetat, asam asetat glasial dan air dengan perbandingan 5:2:1 v/v kemudian ditutup dan didiamkan selama 5 menit. Cuplikan ditotolkan ke salah satu ujung silika gel lalu dibiarkan sampai kering. Setelah kering, kaitkan bagian atas silika gel pada gantungan bejana sehingga silika gel terendam sedalam 1 cm di dalam eluen dengan posisi berdiri tegak. Eluen dibiarkan naik sampai ± 11 cm, kemudian diangkat dan dikeringkan. Silika gel yang sudah terelusi dan kering diukur kemurnian radiokimianya dengan menggunakan Alat Radiochromatografi Scanner Elysia
Raytest Comecer. Pada hari ke-0, 2, 4 dan 7 dilakukan pengulangan kembali analisis
kromatografi ini.
3.4.6 Analisis penandaan dengan KCKT (USP, 2007) 3.4.6.1 Pembuatan sampel
Sampel yang akan digunakan yaitu iopamidol standar (nonradioisotop) dan
27 air sebanyak 10 mL lalu dimasukkan ke dalam vial. 131I-iopamidol 200 μL dengan aktivitas 1 mCi diencerkan menggunakan air sebanyak 1 mL lalu dimasukkan ke dalam vial.
3.4.6.2 Persiapan Fasa Gerak
Fasa gerak yang digunakan adalah larutan A air dan larutan B adalah air:metanol (3:1 v/v) yang telah disaring dan di degassing. Pemisahan dilakukan dengan metode elusi gradien
3.4.6.3 Analisis 131I-Iopamidol dengan KCKT
Kolom C-18 (250x4.6 mm) dimasukkan ke dalam KCKT. Detektor panjang gelombang UV-Vis diatur pada 420 nm. Laju alir yang digunakan adalah 1.5 mL/menit. Program KCKT diatur dengan pencampuran variasi larutan A dan B dengan persentase larutan B 8% mulai saat sampel diinjeksi hingga 6 menit lalu bertambah menjadi 35% selama 18 menit kemudian bertambah lagi hingga 92% selama 30 menit dan ditahan selama 4 menit lalu dikurangi pelarut tersebut hingga 8% selama 36 menit dan ditahan selama 4 menit. Hasil analisis KCKT dibandingkan antara 131I-iopamidol dengan iopamidol standar berdasarkan waktu retensinya.
28
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penandaan 131I-Eksipien
Bahan baku iopamidol yang digunakan untuk penelitian ini bukan bahan baku murni melainkan sediaan pengkontras iopamidol (Iopamiro, Bracco) yang mengandung 30,62 g iopamidol, 50 mg trometamin dan 16,5 mg EDTA dalam pelarut air. Untuk itu perlu dibuktikan terlebih dahulu bahan eksipien yang terkandung di dalamnya tidak berpengaruh pada reaksi penandaan 131I-iopamidol. Eksipien adalah bahan bukan zat aktif yang ditambahkan dalam formulasi suatu sediaan untuk berbagai tujuan atau fungsi (Kemenkes, 2018). Penandaan ini dibuat dengan larutan yang terdiri dari bahan eksipien tersebut tanpa adanya iopamidol dan direaksikan dengan 131I menggunakan protokol penandaan iopamidol yang digunakan pada penelitian ini. Analisis dilakukan dengan Kromatografi Lapis Tipis (KLT). Berikut radiokromatogram 131I-eksipien:
Gambar 6. Radiokromatogram 131I-eksipien Na131I
29 Gambar 6 memperlihatkan bahwa 131I tidak mengalami pergeseran nilai faktor retensi atau retention factor (Rf), puncak tersebut tetap berada di tempat penotolan awal silika gel. Bila puncak berada di Rf tertentu atau mengalami pergeseran maka 131I diperkirakan berikatan dengan senyawa lain. Dari hasil
tersebut dapat disimpulkan bahwa adanya bahan eksipien dalam bahan baku iopamidol tidak berpengaruh pada reaksi penandaan 131I-iopamidol.
4.2 Penandaan 131I-Iopamidol
Penandaan 131I-iopamidol berdasarkan metode pertukaran isotop di mana
menggunakan reaksi substitusi nukleofilik pada komponen aromatik. Reaksi nukleofilik adalah reaksi yang terjadi apabila gugus yang mengganti merupakan pereaksi nukleofil (Sumardjo, 2006). Dalam penelitian ini substratnya adalah iopamidol, sedangkan nukleofil adalah 131I dan leaving group yaitu 127I. Metode yang digunakan mengacu pada penelitian sebelumnya berasal dari Neves et al., (1992) dengan modifikasi variasi pH, waktu dan suhu. Penandaan ini biasa digunakan untuk aktivitas radioisotop yang kecil. menggunakan bahan Na2S2O5,
CuSO4, NH4OH dan asam asetat glasial. Bahan tersebut mempunyai fungsi
masing-masing penambahan Na2S2O5 digunakan sebagai pereduksi, untuk CuSO4 berfungsi
sebagai katalis (Coenen et al., 2006). Adapun reaksi penandaan 131I-iopamidol dapat dilihat pada Gambar 7:
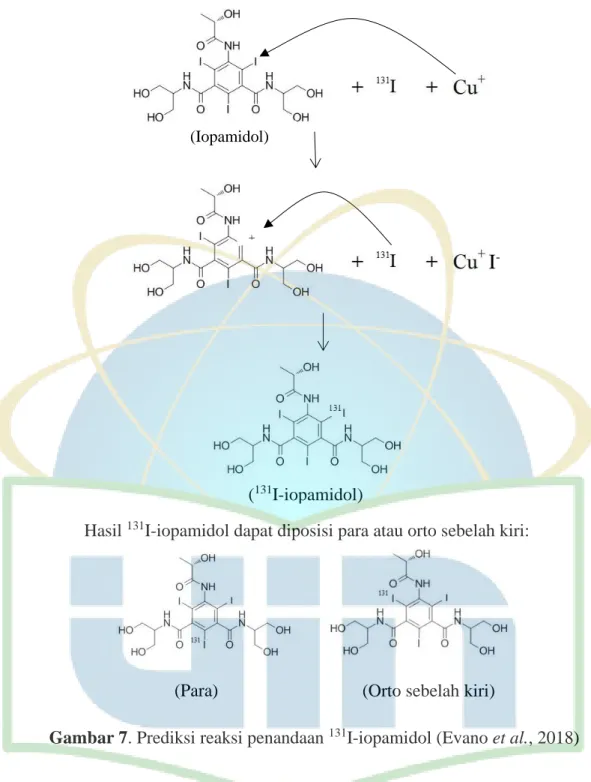
30
Gambar 7. Prediksi reaksi penandaan 131I-iopamidol (Evano et al., 2018)
Prediksi reaksi penandaan 131I-iopamidol berdasarkan reaksi finkelstein yaitu
reaksi substitusi nukleofilik antar halogen menggunakan katalis tembaga (Evano et
al., 2018). Cu2+ tereduksi dengan bantuan Na2S2O5sehingga menjadi Cu+. Cu+
mengalami oksidasi untuk berikatan dengan 127I. 131I kemudian masuk ke struktur iopamidol sehingga membentuk produk 131I-iopamidol. Reaksi pertukaran ini bisa
Hasil 131I-iopamidol dapat diposisi para atau orto sebelah kiri:
(Para) (Orto sebelah kiri) (131I-iopamidol)
+
I
-31 membentuk produk dengan diposisi 131I orto sebelah kiri atau para karena terdapat gugus aktivasi distruktur iopamidol yaitu -NHR yang mengarahkan terjadinya pertukaran diposisi tersebut (Gambar 7) (Fessenden & Fessenden, 1986). NH4OH
digunakan sebagai pengatur pH menjadi basa dan asam asetat glasial digunakan sebagai pengatur pH menjadi asam, bahan untuk variasi pH tersebut dipilih karena bahan tersebut tidak mengganggu penandaan selama proses berlangsung. Asam setat glasial ditambahkan untuk membuat pH menjadi 2 dan 3 sedangkan NH4OH
ditambahkan untuk membuat pH menjadi 7 dan 9. Larutan yang sudah ditambahkan semua bahan-bahan kemudian dipanaskan dengan variasi suhu dan waktu yang telah ditentukan.
Variasi pH dilakukan sebagai parameter awal keberhasilan pembentukan senyawa bertanda karena pH memengaruhi presentase kemurnian radioaktif yang didapat. Setelah diperoleh pH optimum tahap selanjutnya adalah variasi suhu dan waktu yang menjadi salah satu faktor keberhasilan senyawa bertanda. Variasi suhu dan waktunya adalah 140 °C, 160 °C, 180 °C dengan masing-masing waktu 5, 15, 45 dan 60 menit.
4.3 Uji Kemurnian Radiokimia 131I-Iopamidol
4.3.1 Hasil Optimasi Variasi pH
Penandaan 131I-iopamidol dilakukan variasi pH terlebih dahulu karena proses ini terjadi saat pencampuran dengan berbagai macam bahan sebelum dilanjutkan ke proses pemanasan yang di mana proses pemanasan akan membentuk reaksi senyawa bertanda. pH dalam proses penandaan menjadi salah satu faktor keberhasilan terjadinya pertukaran isotop karena sebagai aditif untuk terjadinya
32 pertukaran isotop (Gambar 8). Pengaturan pH menggunakan CH3COOH dan
NH4OH, asam dan basa ini termasuk asam basa lemah. Penggunaan asam basa
lemah ini agar selama proses reaksi tidak membentuk produk yang tidak diinginkan yang membuat proses berjalannya reaksi menjadi tidak sempurna. Bila menggunakan asam basa kuat maka akan membuat I- menjadi I2 (Tesic et al., 1991).
Gambar 8. Mekanisme reaksi SN2 melaui serangan nukleofilik
(https://chem.libretexts.org)
Setelah pengaturan pH dilakukan dilanjutkan ke proses pemanasan. Untuk mengetahui hasil kemurnian yang diapat dilakukan analisis-analisis dengan Kromatografi Lapis Tipis (KLT). Analisis menggunakan KLT ini dapat memisahkan dan mengindentifikasi senyawa berdasarkan polaritas. Afinitas analit tehadap fase diam dan fase gerak tergantung kedekatan polaritas analit terhadap fase diam dan fase gerak. Analit akan cenderung larut dalam fase dengan polaritas sama (Wulandari, 2011). Waktu elusi dilakukan yaitu selama 2 jam untuk pemisahan senyawa hingga ke titik akhir. Hal ini terjadi karena campuran pelarut dengan tingkat kepolaran yang berbeda mampu mempengaruhi laju rambat analit pada fase diam (Trivana & Karouw, 2015). Pelarut yang digunakan termasuk semi polar, pelarut tersebut berinteraksi cukup kuat dengan permukaan silika gel/fase diam. Akibatnya eluen akan sulit membawa komponen yang akan dipisahkan melalui fase diam sehingga membutuhkan waktu elusi yang lebih lama. Secara
33 visual hasil yang telah dielusi tidak menimbulkan bercak warna pada silika gel. Silika gel yang telah dielusi dikeringkan kemudian dibaca menggunakan alat
Radiochromatografi Scanner Elysia Raytest Comecer, alat ini memiliki detektor
radioaktif sehingga bila sampel nonradioaktif maka tidak dapat terbaca.
Analisis menggunakan KLT dalam penelitian ini hanya mengetahui senyawa yang terdapat radioaktifnya saja sehingga tidak bisa membandingkan dengan senyawa nonradioaktif. Identifikasi iopamidol menurut Florey (1988) menggunakan fase diam yaitu silika gel 60 F254 dan fase gerak yaitu etil asetat:asam
asetat glasial:air (5:2:1 v/v) yang menghasilkan Rf iopamidol yaitu 0,6-0,8 dan untuk senyawa NaI berada pada Rf 0,0. Terjadinya pemisahan senyawa ini berdasarkan polaritas yang di mana senyawa polar bertahan pada fase diam karena fasa diam yang digunakan adalah silika gel yang mempunyai sifat polar, sedangkan senyawa yang bersifat nonpolar akan tergerak naik karena fasa gerak yang digunakan bersifat semi polar. Bila senyawa yang tidak terdapat pada kedua rentang Rf tersebut maka bukan termasuk senyawa iopamidol dan NaI.
34
Gambar 9. Hasil analisis KLT penandaan 131I-iopamidol pada (a) pH 2, (b) pH 3, (c) pH 5, (d) pH 7, (e) pH 9
Gambar 9 memperlihatkan analisa penandaan 131I-iopamidol dengan KLT dengan dideteksi oleh detektor radioaktif yang dapat diketahui kemurnian radiokimianya. Gambar di atas menunjukan adanya dua puncak yang nampak pada penandaan 131I-iopamidol dengan variasi 2, 3, 5, 7 dan 9 terdapat puncak Na131I
131I-iopamidol 131 I-iopamidol 131I-iopamidol 131I-iopamidol 131I-iopamidol Na131I Na131I Na131I Na131I Na131I
35 yang berada pada Rf 0,0 dan puncak 131I-iopamidol yang berada pada Rf 0,6-0,8. Adapun hasil uji kemurnian radiokimia variasi pH dapat dilihat pada Gambar 10:
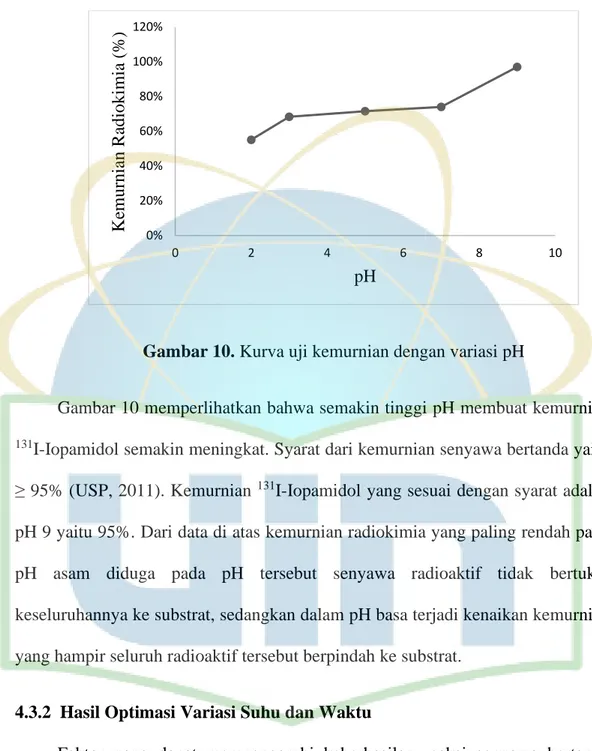
Gambar 10. Kurva uji kemurnian dengan variasi pH
Gambar 10 memperlihatkan bahwa semakin tinggi pH membuat kemurnian
131I-Iopamidol semakin meningkat. Syarat dari kemurnian senyawa bertanda yaitu
≥ 95% (USP, 2011). Kemurnian 131I-Iopamidol yang sesuai dengan syarat adalah
pH 9 yaitu 95%. Dari data di atas kemurnian radiokimia yang paling rendah pada pH asam diduga pada pH tersebut senyawa radioaktif tidak bertukar keseluruhannya ke substrat, sedangkan dalam pH basa terjadi kenaikan kemurnian yang hampir seluruh radioaktif tersebut berpindah ke substrat.
4.3.2 Hasil Optimasi Variasi Suhu dan Waktu
Faktor yang dapat mempengaruhi keberhasilan reaksi senyawa bertanda selain pH yaitu suhu dan waktu pemanasan. Setelah didapat pH yang optimum, suhu dan waktu pemanasan dilakukan variasi. Suhu yang berada pada prosedur yaitu 160 ℃ sehingga dilakukan variasi di bawah dan di atas dari suhu tersebut
0% 20% 40% 60% 80% 100% 120% 0 2 4 6 8 10 Ke murnian R adioki mi a (% ) pH
36 yaitu 140 ℃ dan 180 ℃. Suhu pemanasan memengaruhi reaksi di mana energi
menjadi lebih besar yang membuat partikel semakin aktif bergerak sehingga tumbukan semakin besar sedangkan waktu pemanasan mempengaruhi kesempurnaan reaksi untuk menghasilkan produk yang sesuai (Chang, 2005).
Waktu yang divariasikan yaitu 5, 15, 45 dan 60 menit. setelah dilakukan proses pemanasan sesuai variasi suhu dan waktu dilanjutkan ke analisis kemurnian
131I-Iopamidol dengan KLT yang proses pengerjaannya sama dengan sebelumnya
yaitu menggunakan fase diam yaitu silika gel 60 F254 dan fase gerak yaitu etil
asetat:asam asetat glasial:air (5:2:1). Adapun hasil uji kemurnian radiokimia dengan variasi suhu dan waktu adalah sebagai berikut:
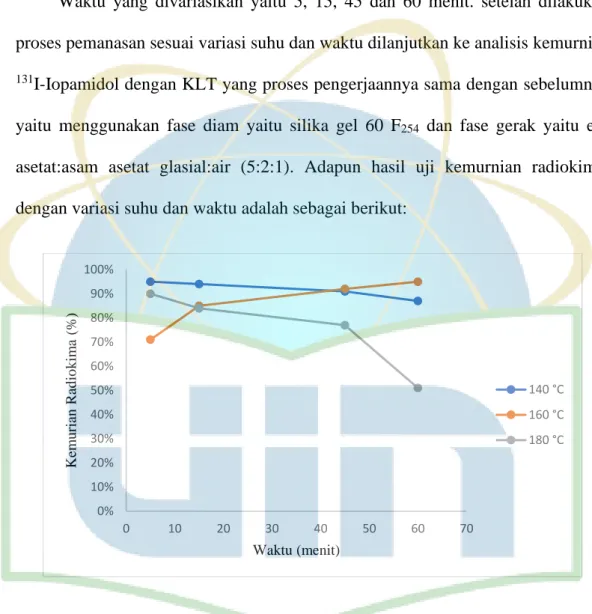
Gambar 11. Kurva uji kemurnian dengan variasi suhu 140 °C, 160 °C, 180 °C dan
waktu 5, 15, 45 dan 60 menit
Gambar 11 menunjukkan bahwa pada suhu 140 °C selama 5-60 menit memiliki penurunan yang perbedaan kemurniannya tidak terlalu jauh. Pada suhu 160 °C selama 5-60 menit dan suhu 180 °C selama memiliki hasil yang sebagian besar berada di bawah 95% diduga menggunakan suhu yang terlalu tinggi dengan
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% 0 10 20 30 40 50 60 70 Kem u rian R ad io k im a (%) Waktu (menit) 140 °C 160 °C 180 °C
37 pemanasan yang terlalu lama membuat 131I membentuk produk samping. Produk samping yang dihasilkan seperti IO3- atau IO4-. Syarat dari kemurnian senyawa
bertanda sama seperti sebelumnya juga yaitu ≥ 95% sehingga yang sesuai dengan syarat tersebut adalah suhu 140 °C selama 5 menit yaitu 95% dan suhu 160 °C selama 60 menit yaitu 95% (Lampiran 3).
Kemurnian 131I-Iopamidol yang sesuai dengan syarat adalah suhu 140 °C selama 5 menit dan suhu 160 °C selama 60 menit karena memiliki kemurnian radiokimia yaitu 95% dan 95%. Kemudian penandaan 131I-Iopamidol dilakukan pengulangan sebanyak 3 untuk variasi suhu 140 °C selama 5 menit dan 160 °C selama 60 menit yang akan diketahui nilai standar deviasi (SD). Nilai SD pada penandaan 131I-Iopamidol dengan variasi suhu 140 °C selama 5 menit adalah 96%±1% dan 160 °C selama 60 menit adalah 84%±14%. Nilai SD 131I-Iopamidol dengan variasi suhu 140 °C selama 5 menit lebih kecil dibandingkan nilai SD 131 I-Iopamidol dengan variasi suhu 160 °C selama 60 menit yang menunujukkan nilai presisi hasil penandaan yang lebih tinggi sehingga penandaan menggunakan suhu 140 °C selama 5 menit dinyatakan sebagai kondisi optimum.
4.3.3 Kestabilan Penandaan 131I-Iopamidol
Penandaan 131I-Iopamidol yang telah di optimasi pH, suhu dan waktu dilakukan uji kestabilan untuk mengetahui ketahanan senyawa bertanda pada waktu tertentu. Uji kestabilan dilakukan menggunakan metode pengujian yang sama seperti sebelumnya yaitu dengan menggunakan KLT. Uji kestabilan ini dilihat berdasarkan kemurnian radiokimianya yaitu dengan kemurnian 131I-Iopamidol yang tidak mengalami penurunan selama masa penyimpanan. Kestabilan 131 I-Iopamidol dilakukan selama 7 hari dengan masa penyimpanan di suhu ruang (22
38 °C), ditutup secara rapat yang tidak terlihat cahaya. Pengujian kestabilan ini dilakukan pada hari ke-0, 2, 4 dan 7. Berikut kurva kestabilan penandaan 131
I-Iopamidol setalah dilakukan penyimpanan selama 7 hari:
Gambar 12. Kurva uji kestabilan hari ke-0, 2, 4 dan 7
Gambar 12 memperlihatkan bahwa pada hari ke-2 terjadi peningkatan kemurnian, kemungkinan dosebabkan oleh berkurangnya pengotor 131I (Iodium bebas) karena teroksidasi membentuk gas I2 dan keluar dari larutan. Kemudian dari
hari ke-2 hingga ke-7 mengalami kestabilan kemurnian radiokimianya. Secara garis besar uji kestabilan ini termasuk stabil hal ini membuktikan bahwa kestabilan 131I memiliki waktu paruh selama 8 hari apabila lebih dari 8 hari maka terjadi peluruhan atau 131I yang terdapat pada iopamidol berubah membentuk 131I bebas.
4.4 Analisis Hasil Penandaan dengan KCKT
Analisis penandaan dengan Kromatografi Cair Kinerja Tinggi (KCKT) mempunyai keuntungan yaitu sampel yang digunakan sedikit dan dapat memisahkan senyawa dengan kecepatan tinggi serta waktu yang digunakan untuk
95% 96% 97% 98% 99% 100% 101% 0 1 2 3 4 5 6 7 8 Ke murnian R adioki mi a (% ) Hari
39 menganalisis tidak lama. Analisis yang dilakukan dalam penelitian ini merupakan analisis kualitatif karena hanya mengetahui keberadaan senyawa dari proses penandaan 131I-iopamidol. Analisis dengan KCKT ini dapat menampakan senyawa yang radioaktif dan nonradioaktif karena instrumen KCKT UHPLC Thermo Scientific ini dapat menghubungkan detektor UV dan radioaktif dalam waktu yang bersamaan sehingga dari data tersebut dapat memperlihatkan senyawa yang mengandung radioaktif dan nonradioaktif.
Prinsip kerja KCKT adalah pemisahan komponen analit berdasarkan kepolarannya, setiap campuran yang keluar akan terdeteksi dengan detektor dan direkam dalam bentuk kromatogram di mana jumlah puncak menyatakan jumlah komponen, sedangkan luas puncak menyatakan konsentrasi komponen dalam campuran (Hendayana, 2006). Senyawa iopamidol ini memiliki gugus kromofor dalam strukturnya yang dapat menyerap sinar ultraviolet pada 420 nm dan bila senyawa iopamidol berhasil tertandai oleh 131I maka pancaran gamma dari 131I akan diserap oleh detektor radioaktif. Berikut gugus kromofor iopamidol yang memberikan serapan di 420 nm (USP, 2007)
40
Gambar 13. Gugus kromofor iopamidol (USP, 2007)
Fase gerak yang digunakan dalam analisis ini yaitu air 100% dan metanol 30% sehingga fase gerak ini bersifat polar sedangkan, fase diam yang digunakan adalah kolom C18 yang bersifat nonpolar. Maka, sistem kromatografi ini adalah kromatografi fase terbalik. Proses elusi yang digunakan adalah elusi gradien, fase gerak yang dialirkan secara gradien dapat diatur kepolarannya selama pemisahan berlangsung sehingga gradien dapat memperbaiki efisiensi pemisahan (Shrivastava & Gupta, 2012). Analisis KCKT yang dilakukan dalam penelitian ini bersifat kualitatif karena hanya membuktikan bahwa senyawa yang nonradioaktif maupun radioaktif berada di puncak sama atau tidak.
41
Gambar 14. Kromatogram (a) iopamidol standar (6,845 menit), (b) 131I-iopamidol
detektor UV waktu retensi (6,875 menit), dan (c) 131I-iopamidol detektor radioaktif waktu retensi (6,950 menit). Laju alir (1,5 mL/menit), kolom C18 dan fase gerak (air 100% : metanol 25%)
iopamidol standar (6,845 menit) 131I-iopamidol detektor UV-vis (6,875 menit) 131I-iopamidol detektor radioaktif (6,950 menit)
42 Kromatogram di atas memperlihatkan puncak 131I-iopamidol yang pada detektor UV-Vis muncul pada menit ke-6,875 hampir sesuai dengan standar iopamidol yang muncul pada waktu retensi 6,845 menit (Gambar 14a dan 14b). 131 I-iopamidol dengan detektor radioaktif memperlihatkan puncak pada waktu retensi yang hamper sama yaitu di waktu 6,950 menit (Gambar 14c). Perbedaan waktu retensi yang muncul pada detektor UV-Vis dan radioaktif disebabkan sampel masuk terlebih dahulu ke dalam detektor UV-Vis lalu ke detektor radioaktif. Hasil analisis penandaan 131I-iopamidol menggunakan KCKT ini membuktikan bahwa iopamidol yang sebelumnya memiliki 127I telah terjadi pertukaran dengan 131I
karena iopamidol yang terdapat 131I muncul pada puncak yang sama dengan puncak iopamidol standar.
Hasil kedua kromatogram juga menunjukkan terdapat puncak lain selain iopamidol yang muncul di waktu retensi 1,30 menit puncak tersebut diduga adalah pengotor. Berdasarkan prinsip like dissolve like, senyawa akan larut dalam pelarut sejenis maka hal ini mengindikasikan bahwa senyawa yang keluar dari kolom terlebih dahulu adalah senyawa yang bersifat polar karena fase diam yang digunakan yang bersifat nonpolar sehingga senyawa bersifat nonpolar tertahan dan akan keluar lebih lama. Waktu retensi antar tiap senyawa berbeda-beda karena dipengaruhi oleh interaksi masing-masing senyawa terhadap fase diam dan fase geraknya.
43
BAB V PENUTUP
5.1 Simpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Kondisi optimum proses penandaan 131I-iopamidol diperoleh pada pH 9 dengan suhu 140 °C pada waktu 5 menit dengan kemurnian radiokimia sebesar ≥ 95%.
2. Stabilitas radiokimia 131I-iopamidol yang dihasilkan memiliki kemurnian
yang relatif stabil selama penyimpanan 7 hari.
5.2 Saran
Untuk penelitian selanjutnya disarankan untuk optimasi suhu di bawah 140 ℃ bila reaksi penandaan 131I-iopamidol dilakukan pada skala besar harus