Dalam bab ini Anda akan mempelajari materi-materi berikut.
1. Terbentuknya ikatan kimia 2. Ikatan ion
3. Ikatan kovalen dan ikatan logam
Intan merupakan salah satu batu mulia yang melimpah di Bumi. Akan tetapi intan sulit diperoleh. Intan diperoleh melalui penambangan bawah tanah. Tambang intan biasanya terletak di saluran bawah tanah dari gunung berapi yang telah mati. Proses penambangan membutuhkan peralatan dan biaya yang mahal. Intan banyak digunakan sebagai perhiasan karena mempunyai kilau yang indah. Selain itu, intan juga banyak digunakan di bidang industri. Contohnya kepingan intan yang digunakan pada pembuatan bor gigi untuk mempermudah melubangi gigi. Intan bersifat keras. Hal ini karena intan mempunyai struktur yang ikatan kimianya sangat kuat. Ikatan tersebut terutama antara atom karbon yang satu dengan empat atom karbon lain. Apakah yang dimaksud ikatan kimia?
Standar Kompetensi:
1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia.
Kompetensi Dasar:
1.2 Peserta didik mampu meng-analisis dan membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk.
Sumber:Chemistry Matters; Volume 1, Grolier
A. Terbentuknya Ikatan Kimia
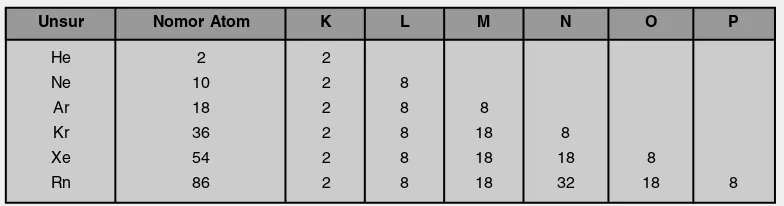
Antara dua atom atau lebih dapat saling berinteraksi dan membentuk molekul. Interaksi ini selalu disertai dengan pelepasan energi. Adapun gaya-gaya yang menahan atom-atom dalam molekul merupakan suatu ikatan yang dinamakan ikatan kimia. Ikatan kimia terbentuk karena unsur-unsur cenderung membentuk struktur elektron stabil. Struktur elektron stabil yang dimaksud yaitu struktur elektron gas mulia (Golongan VIII A), seperti dalam Tabel 3.1 berikut.
Tabel 3.1 Struktur Elektron Gas Mulia
Walter Kossel dan Gilbert Lewis, pada tahun 1916 menyatakan bahwa terdapat hubungan antara stabilnya gas mulia dengan cara atom berikatan. Mereka mengemukakan bahwa jumlah elektron terluar dari dua atom yang berikatan, akan berubah sedemikian rupa sehingga susunan elektron kedua atom tersebut sama dengan susunan elektron gas mulia. Kecenderungan atom-atom untuk memiliki struktur atau konfigurasi elektron gas mulia atau 8 elektron pada kulit terluar disebut kaidah Oktet.
Contoh:
Sementara itu, atom-atom yang mempunyai nomor atom kecil dari hidrogen sampai dengan boron cenderung memiliki konfigurasi elektron gas helium, atau mengikuti kaidah Duplet.
Elektron yang berperan dalam reaksi kimia yaitu elektron pada kulit terluar atau elektron valensi. Elektron valensi menunjukkan kemampuan suatu atom untuk berikatan dengan atom lain. Contoh elektron valensi dari beberapa unsur dapat dilihat dalam tabel berikut.
Tabel 3.2 Elektron Valensi Beberapa Unsur
Unsur Susunan Elektron Elektron Valensi
6C 2 . 4 4
8O 2 . 6 6
12Mg 2 . 8 . 2 2
13Al 2 . 8 . 3 3
15P 2 . 8 . 5 5
17Cl 2 . 8 . 7 7
Unsur-unsur dari golongan alkali dan alkali tanah, untuk mencapai kestabilan cenderung melepaskan elektron terluarnya sehingga membentuk ion positif. Unsur-unsur yang mempunyai kecenderungan membentuk ion positif termasuk unsur elektropositif. Unsur-unsur dari golongan halogen dan khalkogen mempunyai kecenderungan menangkap elektron untuk mencapai kestabilan sehingga membentuk ion negatif. Unsur-unsur yang demikian termasuk unsur elektronegatif.
Unsur Nomor Atom K L M N O P
He Ne Ar Kr Xe Rn
2 10 18 36 54 86
2 2 2 2 2 2
8 8 8 8 8
8 18 18 18
8 18 32
8
18 8
• • • • • •
• • • • • • • •
Br + Br → Br Br• • • •
• • • • • •
• •
• • • • • • • •
atau Br – Br• •• •
Contoh:
1. Fluorin (9F) mempunyai susunan elektron 2 . 7. Fluorin memerlukan satu elektron untuk mencapai
kestabilan (elektron terluar 8).
+ elektron
F + e– F–
2. Kalsium (20Ca) mempunyai susunan elektron 2 . 8 . 8 . 2. Kalsium melepaskan dua elektron untuk
mencapai kestabilan (elektron terluar 8).
+ 2 elektron
Ca Ca2+ + 2e–
Atom-atom yang belum stabil yaitu unsur-unsur selain gas mulia. Unsur ini selalu berusaha untuk mencapai keadaan yang stabil. Agar dapat mencapai struktur elektron seperti gas mulia, antarunsur melakukan hal-hal berikut.
1. Perpindahan elektron dari satu atom ke atom lain (serah terima elektron).
Atom yang melepaskan elektron akan membentuk ion positif, sedangkan atom yang menerima elektron akan berubah menjadi ion negatif, sehingga terjadilah gaya elektrostatik atau tarik-menarik antara kedua ion yang berbeda muatan. Ikatan ini disebut ikatan ion.
2. Pemakaian bersama pasangan elektron oleh dua atom yang bergabung membentuk susunan elektron
seperti gas mulia. Cara ini dikenal dengan nama ikatan kovalen. Selain itu, dikenal juga adanya ikatan lain yaitu:
1. Ikatan logam,
2. Ikatan hidrogen,
3. Ikatan Van der Waals.
Lengkapilah tabel berikut dengan mengisi konfigurasi elektron, elektron valensi, dan ion yang terbentuk untuk mencapai kestabilan!
No. Atom Unsur Nomor Atom Konfigurasi Elektron Elektron Valensi Ion yang Terbentuk
1. N 7 2 . 5 5 N3–
2. Na 11 2 . 8 . 1 1 Na+
3. Mg 12 2 . 8 . 2 2 Mg2+
4. S 16 2 . 8 . 6 6 S2–
5. K 19 2 . 8 . 8 . 1 1 K+
6. Ca 20 2 . 8 . 8 . 2 2 Ca2+
7. Br 35 2 . 8 . 18 . 7 7 Br–
8. C 6 2 . 4 4 C4–
9. O 8 2 . 6 6 O2–
10. H 1 1 1 H+
11. Ba 56 2 . 8 . 18 . 18 . 8 . 2 2 Ba2+
A. Pilihlah satu jawaban yang tepat!
1. Gas mulia sulit bereaksi dengan unsur lain. Hal ini dikarenakan . . . .
a. merupakan molekul monoatomik
b. merupakan molekul diatomik
c. kulit terluar terisi penuh elektron
d. kulit terluar terisi setengah penuh elektron
e. susunan elektron kurang stabil
Jawaban: c
Unsur-unsur yang termasuk dalam golongan gas mulia mempunyai susunan elektron yang stabil. Oleh karena itu, kulit terluarnya terisi penuh elektron, sehingga sulit untuk bereaksi dengan unsur lain.
2. Suatu unsur Z mempunyai susunan elektron seperti gambar di samping. Per-nyataan yang benar tentang unsur Z yaitu . . .
a. Konfigurasi
elektron-nya: 2 . 8 . 2.
b. Cenderung
melepas-kan 1 elektron.
c. Cenderung menangkap 1 elektron.
d. Sulit bereaksi dengan unsur lain.
e. Termasuk dalam golongan gas mulia.
Jawaban: b
Dari gambar pada soal, dapat diketahui bahwa konfi-gurasi elektron atom Z yaitu 2 . 8 . 1. Atom Z mempunyai elektron valensi 1 (termasuk dalam golongan alkali (IA)). Atom ini untuk memenuhi aturan Oktet (stabil) cenderung melepas 1 elektron. Dengan demikian, atom Z sangat mudah bereaksi dengan unsur lain.
3. Cermati tabel berikut!
Unsur Konfigurasi Elektron
P 2 . 2
Q 2 . 8
R 2 . 8 . 1
S 2 . 8 . 6
T 2 . 8 . 7
Tabel di atas menunjukkan konfigurasi elektron unsur P, Q, R, S, dan T. Unsur yang paling mudah menangkap satu elektron yaitu . . . .
a. P d. S
b. Q e. T
c. R
Jawaban: e
Unsur logam cenderung melepas elektron, sedang-kan unsur nonlogam cenderung menangkap elektron. Dari konfigurasi elektronnya, unsur T termasuk dalam golongan halogen (VIIA) atau termasuk unsur nonlogam. Unsur nonlogam cenderung menangkap elektron. Oleh karenanya, unsur T menangkap 1 elektron untuk memenuhi aturan oktet.
4. Elektron valensi dari unsur yang mempunyai nomor atom 12 yaitu . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: b
Konfigurasi elektron suatu unsur dengan nomor atom 12 yaitu 2 . 8 . 2. Elektron valensinya yaitu 2.
5. Di antara unsur-unsur di bawah ini yang paling mudah melepas elektron yaitu . . . .
a. 19K d. 12Mg
b. 17Cl e. 8O
c. 14Si
Jawaban: a
Konfigurasi elektron 19K: 2 . 8 . 8 . 1.
Unsur ini paling mudah melepaskan 1 elektron agar stabil seperti unsur-unsur gas mulia.
6. Unsur 15Y mempunyai elektron valensi 5. Cara
unsur Y mencapai konfigurasi elektron yang stabil yaitu . . . .
a. mengikat 1 elektron
b. melepas 1 elektron
c. mengikat 7 elektron
d. melepas 3 elektron
e. mengikat 3 elektron
Jawaban: e
Unsur dikatakan stabil apabila konfigurasi elektronnya memenuhi aturan Duplet dan Oktet. Oleh karena itu, unsur Y cenderung menangkap 3 elektron untuk memenuhi aturan oktet.
7. Di antara sifat unsur gas mulia berikut yang me-nunjang kestabilan gas mulia yaitu . . . .
a. konfigurasi elektron oktet
b. energi ionisasi tinggi
c. gas monoatomik
d. sukar bereaksi
Jawaban: d
Kestabilan gas mulia ditunjang oleh sifatnya yang sukar bereaksi.
8. Di antara unsur-unsur berikut yang bersifat elektronegatif yaitu . . . .
a. 10A d. 18D
b. 12B e. 20D
c. 16C
Jawaban: c
Konfigurasi elektron unsur:
10A = 2 . 8 18D = 2 . 8 . 8
12B = 2 . 8 . 2 20D = 2 . 8 . 8 . 2
16C = 2 . 8 . 6
Unsur yang bersifat elektronegatif yaitu unsur yang cenderung menangkap elektron agar stabil seperti
gas mulai. Unsur 16B dapat stabil dengan
menangkap 2 elektron.
9. Atom 7N mencapai kestabilan dengan cara . . . .
a. melepas 2 elektron
b. menangkap 2 elektron
c. melepas 3 elektron
d. menangkap 3 elektron
e. menangkap 1 elektron
Jawaban: d
Konfigurasi elektron 7N: 2 . 5.
Suatu atom dikatakan stabil apabila konfigurasi elektronnya seperti gas mulia (memenuhi aturan oktet atau duplet).
Atom N agar stabil menangkap tiga elektron.
7N(2 . 5) + 3e– → N3–(2 . 8)
10. Unsur bernomor atom 15 mempunyai elektron valensi . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: e
Konfigurasi elektron unsur bernomor atom 15 yaitu 2 . 8 . 5. Jadi, elektron valensinya 5.
11. Hidrogen dalam membentuk ikatan kimia memenuhi aturan duplet, bukan aturan oktet seperti atom lainnya, karena . . . .
a. melepas 1 elektron
b. menangkap 1 elektron
c. merupakan molekul diatomik
d. mencapai kestabilan dengan jumlah elektron
terluar = 2
e. dapat membentuk ikatan kovalen dan ikatan
ion
Jawaban: d
Aturan duplet berarti bahwa untuk mencapai kestabilan membentuk atom dengan jumlah elektron terluar = 2.
12. Suatu unsur dikatakan bersifat elektronegatif apabila unsur tersebut . . . .
a. melepas elektron
b. menangkap elektron
c. termasuk dalam golongan IA
d. mempunyai elektron valensi 1
e. termasuk dalam golongan gas mulia
Jawaban: b
Unsur bersifat elektronegatif apabila unsur tersebut cenderung membentuk ion negatif (menangkap elek-tron).
13. Di antara unsur-unsur berikut yang bersifat elektronegatif yaitu . . . .
a. 10Ne d. 12Mg
b. 11Na e. 20Ca
c. 9F
Jawaban: c
Unsur bersifat elektronegatif artinya unsur tersebut cenderung menangkap elektron membentuk ion negatif.
14. Unsur dengan nomor massa 23 dan mempunyai 12 neutron akan mencapai kestabilan dengan cara . . . .
a. menangkap 1 elektron
b. menangkap 2 elektron
c. melepas 1 elektron
d. melepas 2 elektron
e. melepas 3 elektron
Jawaban: c
A = p + n 23 = p + 12 p = 11
Unsur dengan nomor atom (p) = 11 mempunyai konfigurasi elektron: 2 . 8 . 1. Oleh karena itu, untuk mencapai kestabilan unsur tersebut akan melepas-kan 1 elektron.
15. Golongan unsur yang mencapai kestabilan dengan menangkap 1 elektron yaitu . . . .
a. alkali d. nitrogen
b. alkali tanah e. karbon
c. halogen
Jawaban: c
Konfigurasi elektron unsur-unsur halogen (golongan VIIA) mempunyai elektron valensi 7 sehingga agar dapat stabil unsur-unsur tersebut cenderung menangkap 1 elektron.
B. Kerjakanlah dengan singkat dan jelas!
1. a. Sebutkan unsur-unsur gas mulia!
b. Mengapa unsur-unsur gas mulia merupakan
B. Ikatan Ion (Ikatan Elektrovalen)
Ikatan ion yaitu ikatan yang terbentuk sebagai akibat adanya gaya tarik-menarik antara ion positif dan ion negatif. Ion positif terbentuk karena unsur logam melepaskan elektronnya, sedangkan ion negatif terbentuk karena unsur nonlogam menerima elektron. Ikatan ion terjadi karena adanya serah terima elektron. Pada saat terjadi pelepasan elektron, atom tersebut berubah menjadi sebuah kation (ion positif) karena kelebihan muatan positif. Energi ionisasi diperlukan untuk melepas sebuah elektron. Harga energi ionisasi berbeda antara atom satu dengan lainnya.
Jawaban:
a. Helium (He), neon (Ne), argon (Ar), kripton
(Kr), xenon (Xe), dan radon (Rn).
b. Unsur-unsur gas mulia merupakan
unsur-unsur yang paling stabil, karena kulit terluarnya sudah penuh dengan elektron sehingga sukar bereaksi dengan unsur lain.
2. Di antara ion-ion berikut, manakah yang mem-punyai konfigurasi elektron seperti gas mulia? Na+, Mg2+, Al3+, Cl–, O–, dan P3–
(NA : Na = 11, Mg = 12, Al = 13, Cl = 17, O = 8, P = 15)
Jawaban:
Konfigurasi elektron gas mulia mempunyai elektron terluar 8 atau 2, menganut kaidah oktet atau duplet.
11Na = 2 . 8 . 1
Na+ = 2 . 8 (seperti gas mulia)
12Mg = 2 . 8 . 2
Mg2+ = 2 . 8 (seperti gas mulia)
13Al = 2 . 8 . 3
Al3+ = 2 . 8 (seperti gas mulia)
17Cl = 2 . 8 . 7
Cl– = 2 . 8 . 8 (seperti gas mulia)
8O = 2 . 6
O– = 2 . 7 (tidak seperti gas mulia)
15P = 2 . 8 . 5
P3– = 2 . 8 . 8 (seperti gas mulia)
3. Bagaimanakah cara unsur-unsur di bawah ini men-capai kestabilan?
a. Unsur dengan nomor atom 17.
b. Unsur dengan nomor massa 40 dan jumlah
neutron 29.
Jawaban:
a. Nomor atom 17
Konfigurasi elektron = 2 . 8 . 7 mencapai kesta-bilan dengan menangkap 1 elektron.
b. A = p + n
40 = p + 29 p = 11
Konfigurasi elektron = 2 . 8 . 1 mencapai kestabilan dengan melepas 1 elektron.
4. Apakah yang dimaksud dengan unsur elektro-positif dan elektronegatif? Berilah contohnya!
Jawaban:
Unsur-unsur elektropositif adalah unsur yang mempunyai kecenderungan melepaskan elektron terluarnya sehingga membentuk ion positif. Contoh:
Golongan IA = H, Li, Na,K, Rb, Cs, dan Fr. Golongan IIA = Be, Mg, Ca, Sr, Ba, dan Ra. Unsur-unsur elektronegatif adalah unsur-unsur yang mempunyai kecenderungan menangkap elektron untuk mencapai kestabilan sehingga membentuk ion negatif.
Contoh:
Golongan VIA = O, S, Se, Te, dan Po. Golongan VIIA = F, Cl, Br, I, dan At.
5. Bagaimanakah atom-atom berikut mencapai susunan elektron yang stabil? Jelaskan!
a. 8O c. 19K
b. 20Ca
Jawaban:
a. 8O = 2 . 6
Mencapai susunan elektron stabil dengan menangkap 2 elektron.
(O + 2e–→ O2–) b. 20Ca = 2 . 8 . 8 . 2
Mencapai susunan elektron stabil dengan melepas 2 elektron.
(Ca → Ca2+ + 2e–) c. 19K = 2 . 8 . 8 . 1
Mencapai susunan elektron stabil dengan melepas 1 elektron.
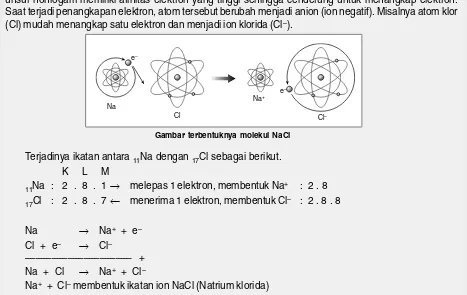
Pada umumnya, atom-atom dari unsur logam memiliki energi ionisasi yang lebih rendah. Oleh karena itu, unsur-unsur tersebut cenderung melepas elektron dan berubah menjadi kation. Sebagai contoh unsur
natrium (Na) mudah melepaskan satu elektron menjadi ion natrium (Na+). Sementara itu, atom-atom dari
unsur nonlogam memiliki afinitas elektron yang tinggi sehingga cenderung untuk menangkap elektron. Saat terjadi penangkapan elektron, atom tersebut berubah menjadi anion (ion negatif). Misalnya atom klor (Cl) mudah menangkap satu elektron dan menjadi ion klorida (Cl–).
Terjadinya ikatan antara 11Na dengan 17Cl sebagai berikut.
K L M
11Na : 2 . 8 . 1 → melepas 1 elektron, membentuk Na+ : 2 . 8
17Cl : 2 . 8 . 7 ← menerima 1 elektron, membentuk Cl– : 2 . 8 . 8
Na → Na+ + e–
Cl + e– → Cl–
–––––––––––––––––––– +
Na + Cl → Na+ + Cl–
Na+ + Cl– membentuk ikatan ion NaCl (Natrium klorida)
Peristiwa pelepasan dan penangkapan elektron tersebut menghasilkan gaya elektrostatik dan membentuk ikatan ion antara dua ion (Na+ dan Cl–). Contoh ikatan ion yang lain yaitu ikatan yang terjadi pada senyawa MgO. Atom Mg kelebihan 2 elektron dan atom O kekurangan 2 elektron. Dengan demikian, 2 elektron dari atom Mg yang dilepaskan, ditangkap oleh atom O untuk berikatan dan membentuk susunan yang stabil. Reaksi tersebut dituliskan sebagai berikut.
12Mg (2 . 8 . 2) → Mg2+ (2 . 8) + 2e– (melepas 2 elektron)
8O (2 . 6) + 2e– → O2– (2 . 8) (menangkap 2 elektron)
––––––––––––––––––––––––––––––––––––––––––––––––––––
12Mg (2 . 8 . 2) + 8O (2 . 6) → Mg2+ (2 . 8) + O2– (2 . 8)
MgO
Ikatan ion mudah terjadi jika atom-atom suatu unsur mempunyai perbedaan elektronegativitas yang besar (lebih besar dari 1,7). Menurut Pauling, jika perbedaan elektronegativitas semakin besar, ikatan kimia yang terbentuk semakin bersifat ionik. Pada umumnya ikatan ion terjadi antara unsur-unsur golongan IA dan IIA (unsur logam) dengan unsur-unsur golongan VIIA dan VIA (unsur nonlogam).
Sifat-sifat senyawa ion sebagai berikut.
1. Dalam bentuk padatan tidak dapat menghantarkan listrik karena partikel-partikel ionnya terikat kuat
pada kisi, sehingga tidak ada elektron yang bebas bergerak.
2. Leburan dan larutannya menghantarkan listrik.
3. Umumnya berupa zat padat kristal yang permukaannya keras dan sukar digores.
4. Titik leleh dan titik didihnya tinggi.
5. Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar. Gambar terbentuknya molekul NaCl
e–
e–
Na
Cl
Na+
A. Pilihlah satu jawaban yang tepat!
1. Unsur Y mempunyai konfigurasi elektron 2 . 8 . 1. Unsur ini lebih mudah membentuk ikatan ion dengan unsur lain yang mempunyai konfigurasi elektron . . . .
a. 2 . 8 . 2 d. 2 . 8 . 6
b. 2 . 8 . 4 e. 2 . 8 . 7
c. 2 . 8 . 5
Jawaban: e
Ikatan ion merupakan ikatan yang terjadi akibat serah terima elektron. Unsur Y dapat berikatan ion dengan unsur yang mempunyai konfigurasi elektron 2 . 8 . 6 (elektron valensinya 6) dan 2 . 8 . 7 (elektron valensinya 7). Namun, unsur Y cenderung melepas 1 elektron sehingga lebih mudah membentuk ikatan ion dengan unsur yang mempunyai elektron valensi 7. Hal ini karena unsur tersebut cenderung menangkap 1 elektron.
2. Pernyataan di bawah ini yang sesuai dengan sifat-sifat senyawa ion yaitu . . . .
a. dalam bentuk padatan bersifat konduktor
b. titik didih dan titik lelehnya relatif rendah c. dalam bentuk leburan bersifat isolator
d. larut dalam pelarut nonpolar
e. dalam bentuk larutan bersifat konduktor
Jawaban: e
Dalam bentuk leburan atau larutan, senyawa ion bersifat konduktor. Dalam bentuk padatan, senyawa ion bersifat isolator. Titik didih dan titik lelehnya tinggi serta larut dalam pelarut polar.
3. Ikatan ion terjadi antara . . . .
a. unsur logam dengan unsur logam
b. unsur logam dengan unsur nonlogam
c. unsur logam dengan unsur golongan transisi
d. unsur nonlogam dengan unsur nonlogam
e. unsur golongan utama dengan unsur golongan
transisi
Jawaban: b
Salah satu ciri khas ikatan ion yaitu terbentuk dari unsur logam dengan unsur nonlogam.
4. Suatu unsur dengan nomor atom 9 akan mengada-kan ikatan ion dengan unsur yang mempunyai nomor atom . . . .
a. 17 d. 35
b. 19 e. 32
c. 15
Jawaban: b
Atom dengan NA 9 : 2 . 7 menangkap 1 elektron, yang dilepaskan atom dengan NA 19 : 2 . 8 . 8 . 1.
5. Kecenderungan atom untuk bermuatan positif disebabkan oleh . . . .
a. afinitas elektronnya besar
b. energi ionisasinya kecil
c. keelektronegatifannya besar
d. potensial ionisasinya besar
e. keelektropositifannya sedang
Jawaban: b
Atom yang cenderung melepaskan elektron untuk bermuatan positif, memerlukan energi ionisasi kecil.
6. Suatu unsur dengan konfigurasi elektron 2 . 8 . 6 mempunyai ciri-ciri . . . .
a. dapat membentuk senyawa ionik dengan
natrium
b. merupakan unsur logam
c. dapat membentuk ion dengan muatan 2+
d. hanya dapat bereaksi dengan unsur
nonlogam
e. memiliki 6 proton dalam setiap atomnya
Jawaban: c
Natrium melepaskan elektron yang akan ditangkap oleh unsur tersebut membentuk senyawa ionik. Karena unsur tersebut membutuhkan 2 elektron untuk mencapai kestabilan. Na hanya 1 elektron.
7. Di antara bahan berikut yang dapat menghantarkan listrik melalui pergerakan ion-ionnya yaitu . . . .
a. larutan NaCl
b. raksa
c. grafit
d. logam tembaga
e. lelehan timbal
Jawaban: a
Larutan NaCl mempunyai ion-ion yang bergerak bebas, berasal dari proses ionisasi ion-ion penyusunnya. Oleh karena itu, larutan NaCl dapat menghantarkan arus listrik.
8. Di antara unsur berikut yang memiliki kecenderung-an menkecenderung-angkap elektron yaitu . . . .
a. 11A d. 35D
b. 12B e. 38E
c. 19C
Jawaban: d
Unsur yang sudah menangkap elektron umumnya memiliki afinitas elektron tinggi. Konfigurasi elektron
9. Unsur di bawah ini yang berikatan ion dengan unsur klorin yaitu . . . .
a. hidrogen d. natrium
b. silikon e. oksigen
c. fosfor
Jawaban: d
Konfigurasi unsur klorin: 2 . 8 . 7. Oleh karena itu, unsur klorin dapat berikatan ion dengan unsur yang mempunyai energi ionisasi rendah dan elektron valensi satu seperti Na. Konfigurasi natrium 2 . 8 . 1.
Na melepaskan satu elektron yang kemudian diterima Cl sehingga terbentuk senyawa NaCl dengan konfigurasi Na+ (2 . 8) + Cl– (2 . 8 . 8) → NaCl.
10. Salah satu syarat terjadinya ikatan ion yaitu . . . . a. elektropositif dengan elektronegatif
b. sesama unsur yang elektropositif
c. sesama unsur yang elektronegatif
d. salah satu unsur memiliki elektron valensi 4
e. salah satu unsur elektron terluarnya 5
Jawaban: a
Ikatan ion terjadi antara unsur logam dengan non-logam atau terjadi serah terima elektron.
B. Jawablah soal-soal berikut!
1. Sebutkan sifat-sifat senyawa yang berikatan ion!
Jawaban:
a. Dalam bentuk padatan tidak menghantarkan
listrik karena partikel-partikel ionnya terikat erat pada kisi, sehingga tidak ada elektron yang bebas bergerak.
b. Leburan dan larutannya menghantarkan listrik.
c. Umumnya berupa zat padat kristal yang
permukaannya keras dan sukar digores. d. Titik leleh dan titik didihnya tinggi.
e. Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar.
2. Bagaimana pembentukan ikatan ion pada senyawa MgCl2? Jelaskan!
Jawaban:
12Mg = 2 . 8 . 2 17Cl = 2 . 8 . 7
Atom Mg akan stabil jika melepaskan dua buah elek-tron dari kulit terluar membentuk ion Mg2+ (2 . 8). Atom Cl akan stabil jika menerima satu elektron membentuk ion Cl– (2 . 8 . 8). Dengan demikian, dua elektron yang dilepaskan atom Mg akan diterima oleh dua buah atom klorin. Ketiga atom ini akan tarik-menarik membentuk ikatan ion.
3. Apabila diketahui besarnya elektronegativitas beberapa unsur: Br = 2,6; Be = 1,57; Mg = 1,3; Ca = 1; Sr = 0,95; Ba = 0,89. Urutkan kekuatan ikatan ion senyawa-senyawa berikut dari yang terkecil sampai dengan yang terbesar: BeBr2, MgBr2, CaBr2, SrBr2, BaBr2!
Jawaban:
Bila perbedaan elektronegativitas semakin besar, ikatan ioniknya semakin kuat. Urutan kekuatan ikatan ion dari yang terkecil sampai yang terbesar: BeBr2, MgBr2, CaBr2, SrBr2, BaBr2.
4. Tuliskan reaksi pasangan unsur-unsur berikut dalam berikatan!
5. Diketahui unsur-unsur:
11X, 35Y, 15Z, dan 32Q.
a. Buatlah konfigurasi elektronnya dan tentukan
golongannya!
b. Di antara unsur-unsur tersebut, manakah yang
dapat terjadi ikatan ion?
Jawaban:
a. 11X = 2 . 8 . 1 → golongan IA
35Y = 2 . 8 . 18 . 7 → golongan VIIA
15Z = 2 . 8 . 5 → golongan VA
32Q = 2 . 8 . 18 . 4 → golongan IVA
b. Ikatan ion terjadi antara golongan IA dan IIA
dengan golongan VIA dan VIIA. Unsur yang membentuk ikatan ion:
X+ + Y– → XY
C. Ikatan Kovalen dan Ikatan Logam
1. Ikatan Kovalen
Ikatan kovalen dapat terjadi antara unsur nonlogam dengan unsur nonlogam lain dengan cara pemakaian bersama pasangan elektron. Jadi secara langsung ikatan ini bersifat nonelektrostatik. Adakalanya dua atom dapat menggunakan lebih dari satu pasang elektron. Apabila yang digunakan bersama dua pasang atau tiga pasang maka akan terbentuk ikatan kovalen rangkap dua atau rangkap tiga. Jumlah elektron valensi yang digunakan untuk berikatan tergantung pada kebutuhan tiap atom untuk mencapai konfigurasi elektron seperti gas mulia (kaidah Duplet atau Oktet).
Penggunaan bersama pasangan elektron digambarkan oleh Lewis menggunakan titik elektron. Rumus Lewis merupakan tanda atom yang di sekelilingnya terdapat titik (·), silang (×), atau bulatan kecil (• atau ). Tanda ini menggambarkan elektron valensi atom yang bersangkutan. Oleh karena itu, rumus ini sering disebut sebagai rumus elektron atau titik elektron.
Langkah-langkah untuk menulis rumus molekul Lewis sebagai berikut.
a. Menuliskan simbol atom unsurnya.
b. Menentukan jumlah elektron valensi atom tersebut.
c. Meletakkan titik (·), silang (×), atau bulatan kecil (• atau ) yang mewakili elektron valensi pada sisi simbol atom.
Contoh:
Simbol Atom Konfigurasi Elektron Elektron Valensi Rumus Molekul Lewis
1H 1 1 H
7N 2 . 5 5 N
8O 2 . 6 6 O
17Cl 2 . 8 . 7 7 Cl
Berdasarkan bentuk ikatannya, ikatan kovalen dibedakan menjadi tiga, yaitu kovalen normal, kovalen koordinasi, serta kovalen polar dan nonpolar.
a. Ikatan Kovalen Normal
Dalam ikatan kovalen normal digunakan dasar pemakaian bersama pasangan elektron. Dalam hal ini pasangan elektron tersebut berasal dari kedua atom. Jumlah ikatan yang terdapat dalam suatu molekul dapat diramalkan dengan menghitung jumlah elektron yang digunakan bersama-sama. Selain itu juga, jumlah dan jenis atom yang membentuk molekul. Oleh karena itu, dalam ikatan ini dikenal adanya ikatan kovalen tunggal, kovalen rangkap dua, dan kovalen rangkap tiga.
1) Ikatan Kovalen Tunggal
Ikatan kovalen tunggal adalah ikatan kovalen yang terjadi karena penggunaan bersama satu pasang elektron. Ikatan ini digambarkan dengan satu garis lurus.
Contoh:
a) Ikatan H dengan H dalam molekul H2
1H rumus titik elektronnya H° 1H rumus titik elektronnya H°
1 atom H berikatan dengan 1 atom H yang lain, dan tiap-tiap atom H menyumbangkan 1 elektron.
H° + °H → H °° H → H – H → H2
ikatan kovalen tunggal
• •
• •
••
• • •
• •
•
• • • •
• •
b) Ikatan F dengan F dalam molekul F2
1 atom F berikatan dengan 1 atom F yang lain dan tiap-tiap atom F menyumbangkan 1 elektron.
ikatan kovalen tunggal
c) Ikatan H dengan Cl dalam molekul HCl
1H rumus titik elektronnya H°
17Cl (2 . 8 . 7) rumus titik elektronnya xCxx xx lxx
1 atom H berikatan dengan 1 atom Cl yang masing-masing menyumbangkan 1 elektron.
H° + xC
ikatan kovalen tunggal
d) Pembentukan ikatan antara 1H dengan 7N membentuk NH3.
Senyawa NH3
7N : 2 . 5 1H : 1
Atom nitrogen memerlukan tiga elektron untuk mendapatkan susunan elektron gas mulia, sedangkan setiap atom hidrogen memerlukan sebuah elektron untuk mem-punyai konfigurasi elektron duplet. Oleh karena itu, setiap atom nitrogen memerlukan tiga atom hidrogen.
2) Ikatan Kovalen Rangkap Dua
Ikatan kovalen rangkap dua adalah ikatan kovalen yang terjadi karena penggunaan bersama dua pasang elektron. Ikatan ini digambarkan dengan dua garis lurus.
Contoh:
Ikatan antara atom O dengan atom O yang lain dalam molekul O2
8O (2 . 6) rumus titik elektronnya O
1 atom O berikatan dengan 1 atom O yang lain dan tiap-tiap atom O menyumbangkan 2 elektron.
ikatan kovalen rangkap dua
3) Ikatan Kovalen Rangkap Tiga
Ikatan kovalen rangkap tiga adalah ikatan kovalen yang terjadi karena penggunaan bersama tiga pasang elektron. Ikatan ini digambarkan dengan tiga garis lurus.
Contoh:
Ikatan antara atom N dengan atom N yang lain dalam molekul N2
Tentukan rumus titik elektron dan jenis ikatan kovalen dari molekul-molekul berikut!
Atom-Atom yang Jumlah dan Jenis Ikatan
No. Rumus Molekul Rumus Titik Elektron Kovalen (Tunggal, Rangkap
Saling Berikatan Dua, atau Rangkap Tiga)
1. H2O xo oo
x oo o
H O H H dengan O 2 ikatan kovalen tunggal
2. CH4 xoo xx o
o x H H C H
H
H dengan C 4 ikatan kovalen tunggal
3. SiO2
O Si O Si dengan O 2 ikatan kovalen rangkap dua
4. N2
H C C H H dengan C 2 ikatan kovalen tunggal
C dengan C 1 ikatan kovalen rangkap tiga
6. CO2
x xx o o xx x o o x x
x xO C Ox x O dengan C
2 ikatan kovalen rangkap dua
7. H2S
o oo x
x oo o
H S H H dengan S 2 ikatan kovalen tunggal
8. C2H4
C dengan C 1 ikatan kovalen rangkap dua
H dengan C 4 ikatan kovalen tunggal
9. PCl3
Cl dengan P 3 ikatan kovalen tunggal
10. C2H6
C dengan C 1 ikatan kovalen tunggal
H dengan C 6 ikatan kovalen tunggal
Catatan: tulisan yang dicetak tebal merupakan kunci jawaban. 7N (2 . 5) rumus titik elektronnya o oN
1 atom N berikatan dengan 1 atom N yang lain dan tiap-tiap atom N menyumbangkan 3 elektron.
o
b. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi yaitu ikatan kovalen di mana pasangan elektron yang digunakan bersama berasal dari salah satu atom yang berikatan.
* *
A + B → *
*
A + B atau A → B
Tanda (→) menyatakan sumber pasangan elektron yang digunakan bersama. Ikatan kovalen
koordinasi dapat terjadi antara suatu atom yang mempunyai pasangan elektron bebas dan sudah mencapai konfigurasi oktet dengan atom lain. Atom lain ini membutuhkan dua elektron dan belum mencapai konfigurasi oktet.
Contoh:
Senyawa SO3
16S : 2 . 8 . 6 8 O : 2 . 6
Ketika membuat rumus Lewis dari asam-asam oksi (misalnya asam sulfat, H2SO4) lebih
dahulu kita tuliskan bayangan strukturnya. Setelah itu membuat rumus Lewisnya, dimulai dari atom hidrogen. Hal ini untuk mengetahui jenis-jenis ikatan yang ada, antara ikatan kovalen atau ikatan kovalen koordinasi.
c. Ikatan Kovalen Polar dan Nonpolar
Perbedaan keelektronegatifan dua atom menimbulkan kepolaran senyawa. Adanya perbedaan keelektronegatifan tersebut menyebabkan pasangan elektron ikatan lebih tertarik ke salah satu unsur sehingga membentuk dipol. Adanya dipol inilah yang menyebabkan senyawa menjadi polar.
Pada senyawa HCl, pasangan elektron milik bersama akan lebih dekat pada Cl karena daya tarik terhadap elektronnya lebih besar dibandingkan H. Hal itu menyebabkan terjadinya polarisasi pada ikatan H – Cl. Atom Cl lebih negatif daripada atom H, hal tersebut menyebabkan terjadinya ikatan kovalen polar.
Contoh:
1) Senyawa kovalen polar: HCl, HBr, HI, HF, H2O, NH3.
2) Senyawa kovalen nonpolar: H2, O2, Cl2, N2, CH4, C6H6, BF3.
Pada ikatan kovalen yang terdiri lebih dari dua unsur, kepolaran senyawanya ditentukan beberapa hal berikut.
1) Jumlah momen dipol. Jika jumlah momen dipol = 0, senyawanya bersifat nonpolar. Jika
momen dipol tidak sama dengan 0 maka senyawanya bersifat polar. Besarnya momen dipol suatu senyawa dapat diketahui dengan:
µ = d × l
Keterangan:
µ = momen dipol dalam Debye (D)
d = muatan dalam satuan elektrostatis (ses)
l = jarak dalam cm
2) Bentuk molekul. Jika bentuk molekulnya simetris maka senyawanya bersifat nonpolar,
sedangkan jika bentuk molekulnya tidak simetris maka biasanya senyawanya bersifat polar. Ikatan kovalen rangkap dua
Kepolaran Senyawa
A. Tujuan
Mengetahui suatu larutan bersifat polar atau non-polar.
B. Alat dan Bahan
1. statif 6. air
2. buret 7. aseton
3. corong 8. alkohol (etanol)
4. penggaris plastik 9. karbon
tetra-5. gelas kimia klorida
C. Cara Kerja
1. Pasang buret pada statif!
2. Isi buret dengan air!
3. Gosokkan penggaris pada rambut!
4. Alirkan air dari buret ke dalam gelas kimia dan dekatkan penggaris pada aliran air tersebut! Amati apa yang terjadi!
3) Jika molekul terdiri atas dua buah unsur.
a) Bila kedua unsur itu sejenis, ikatannya nonpolar.
Contoh: H2 dan Cl2.
b) Bila kedua unsur itu tidak sejenis, biasanya ikatannya polar.
Contoh: HCldan HBr.
4) Jika molekul terdiri atas tiga atau lebih unsur yang berbeda.
a) Bila atom yang berada di tengah molekul (atom pusat) mempunyai pasangan elektron
bebas sehingga pasangan elektron berikatan akan tertarik ke salah satu atom, ikatannya polar.
Contoh: H2Odan NH3.
b) Bila atom pusat tidak mempunyai pasangan elektron bebas sehingga pasangan elektron
tertarik sama kuat ke seluruh atom, ikatannya nonpolar.
Contoh: CH4 dan CO2. Sifat-sifat senyawa kovalen:
1) Pada suhu kamar umumnya berupa gas (misal H2, O2, N2, Cl2, dan CO2), cair (misal H2O dan HCl), ataupun berupa padatan.
2) Titik didih dan titik lelehnya rendah, karena gaya tarik-menarik antarmolekulnya lemah
meskipun ikatan antaratomnya kuat.
3) Larut dalam pelarut nonpolar dan beberapa di antaranya dapat berinteraksi dengan pelarut
polar.
4) Larutannya dalam air ada yang menghantarkan arus listrik (misal HCl) tetapi sebagian besar
tidak dapat menghantarkan arus listrik, baik padatan, leburan, atau larutannya.
Anda dapat memprediksi ikatan kimia apabila mengetahui konfigurasi elektron dari atom unsur tersebut (elektron valensinya). Berdasarkan elektron valensi, akan diketahui jumlah kekurangan elektron masing-masing unsur untuk mencapai kaidah Oktet (kestabilan struktur seperti struktur elektron gas mulia).
Jarak antara dua inti atom yang berikatan disebut panjang ikatan, sedangkan energi yang diperlukan untuk memutuskan ikatan disebut energi ikatan. Pada pasangan unsur yang sama, ikatan tunggal merupakan ikatan yang paling lemah dan paling panjang. Semakin banyak pasangan elektron milik bersama maka semakin kuat ikatan. Namun, panjang ikatannya semakin kecil atau pendek.
Contoh:
Ikatan : N – N N = N N ≡≡≡≡≡ N
Panjang ikatan (Å) : 1,47 1,24 1,10
E. Pertanyaan:
1. Cairan manakah yang dipengaruhi oleh
penggaris?
2. Bagaimana keadaan cairan yang
ter-pengaruh penggaris?
3. Pada molekul air (H2O) terdapat 2 pasang elektron ikatan. Jika harga elektro-negativitas atom O = 3,5 dan H = 2,1; atom manakah yang lebih kuat menarik elektron? 4. Berdasarkan hal tersebut lebih tertarik ke manakah pasangan elektron ikatannya?
5. Atom manakah yang lebih bermuatan
negatif dan positif? Jelaskan!
6. Molekul yang mengalami peristiwa di atas
disebut molekul polar. Apa yang dimaksud dengan molekul polar?
F. Unjuk Kreativitas
Berdasarkan prosedur pada praktikum di atas, gantilah bahan-bahan tersebut dengan minyak, larutan garam, dan larutan gula!
Catatan Guru:
Siswa dibagi menjadi beberapa kelompok. Setiap kelompok terdiri atas 4–5 orang. Pastikan buret dalam kondisi bersih dengan cara membilas menggunakan bahan yang akan diuji! Jika kebersihan buret tidak terjaga, akan berpengaruh pada penentuan kepolaran senyawa sebagai hasil percobaan.
2. Ikatan Logam
Logam mempunyai sifat-sifat berikut:
a. pada suhu kamar umumnya padat,
b. mengilap,
c. menghantarkan panas dan listrik dengan baik, dan
d. dapat ditempa dan dibentuk.
Dalam bentuk padat, atom-atom logam tersusun dalam susunan yang sangat rapat (closely packed). Susunan logam terdiri atas ion-ion logam dalam lautan elektron. Dalam susunan seperti ini elektron valensinya relatif bebas bergerak dan tidak terpaku pada salah satu inti atom. Ikatan logam terjadi akibat interaksi antara elektron valensi yang bebas bergerak dengan inti atau kation-kation logam yang menghasilkan gaya tarik.
Perhatikan gambar berikut ini!
5. Ulangi langkah 1–4, tetapi air diganti dengan aseton, karbon tetraklorida, dan alkohol (etanol)!
D. Hasil Pengamatan
No. Bahan
Aliran Zat Cair
Dibelokkan DibelokkanTidak
1. Air . . . .
2. Aseton . . . .
3. Karbon tetraklorida . . . .
4. Alkohol (etanol) . . . .
Ikatan dalam suatu materi akan menentukan bentuk dan struktur dari suatu molekul. Jika Anda ingin mengetahui struktur suatu kristal, bacalah buku Seri Kegiatan Sains: Menggunakan Material, pada kegiatan 2 dan Di Dalam Materi, pada kegiatan 8, terbitan Pakar Raya, Bandung!
Penggaris mika Penggaris mika
Air
CCl4
A. Pilihlah satu jawaban yang tepat!
1. Ikatan yang terjadi karena pemakaian bersama
pasangan elektron dari kedua atom yang berikatan disebut . . . .
a. ikatan ion
b. ikatan kovalen
c. ikatan kovalen koordinasi
d. ikatan kovalen rangkap 2
e. ikatan nonpolar
Jawaban: b
Ikatan kovalen berasal dari pemakaian bersama pasangan elektron dari dua atom yang berikatan.
2. Jumlah pasangan elektron ikatan dalam molekul
oksigen (NA : 8) yaitu . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: b
terdapat 2 pasangan elektron ikatan dalam molekul oksigen
2 pasang elektron ikatan
3. Suatu atom Z mempunyai konfigurasi elektron
2 . 8 . 8 . 2. Senyawa yang dapat dibentuk oleh
Z mencapai kestabilan dengan melepas 2 elektron menjadi Z2+, jika bertemu dengan F– menjadi ZF
2.
4. Ikatan elektrovalen mudah terjadi di antara
atom-atom yang memiliki perbedaan . . . .
a. keelektronegatifannya besar
b. elektron valensinya besar
c. kereaktifannya besar
d. nomor atomnya besar
e. nomor massanya besar
Jawaban: a
Ikatan elektrokovalen dapat terjadi apabila atom yang satu mempunyai elektronegativitas besar, sementara atom yang lain mempunyai elektro-negativitas kecil.
5. Molekul NH3BCl3
Ikatan kovalen koordinasi ditunjukkan pada nomor . . . .
a. 5 d. 2
b. 4 e. 1
c. 3
Jawaban: c
Dua elektron berasal dari atom N yang digunakan bersama-sama dengan atom B.
6. Unsur A dengan nomor atom 5 dan unsur B dengan nomor atom 17 membentuk senyawa dengan rumus . . . .
7. Ikatan yang terjadi karena penggunaan bersama pasangan elektron yang disumbangkan oleh salah satu atom yang berikatan disebut . . . .
a. ikatan ion
b. ikatan kovalen
c. ikatan kovalen koordinasi
d. ikatan kovalen rangkap 2
e. ikatan kovalen polar
Jawaban: c
Ikatan kovalen koordinasi terjadi karena adanya penggunaan bersama pasangan elektron yang berasal dari salah satu atom yang berikatan.
8. Unsur A memiliki konfigurasi elektron 2 . 8 . 2 Unsur B memiliki konfigurasi elektron 2 . 8 . 7 Bila A dan B bergabung akan menghasilkan . . . .
a. senyawa kovalen AB
b. senyawa kovalen A6B6
c. senyawa ionik AB
d. senyawa ionik A2B
e. senyawa ionik AB2
Jawaban: e
A2+ + B–→ AB 2
9. Salah satu sifat logam yang berkaitan dengan ikatan yang terjadi pada logam, yaitu . . . .
a. daya hantar listrik dan panas dari logam yang
sangat baik
b. massa jenis logam sangat besar dan keras
c. logam mudah melepaskan elektron valensinya
d. mudah membentuk ikatan ion dengan unsur
nonlogam
e. titik didih dan titik lebur logam sangat tinggi
Jawaban: a
Adanya ikatan logam pada unsur logam me-nyebabkan logam dapat dilalui arus listrik dan panas dengan baik sehingga logam merupakan konduktor yang baik.
10. Kepolaran suatu senyawa kovalen bergantung pada . . . .
a. jumlah elektron pada atom pusat
b. selisih momen dipol di antara atom-atom
penyusun senyawa
c. gaya tarik antaratomnya
d. potensial antara 2 atom
e. potensial ionisasi di antara 2 atom penyusun
senyawa
Jawaban: b
Jika µ = 0 → nonpolar. Jika µ≠ 0 → polar.
11. Senyawa di bawah ini yang bersifat nonpolar yaitu . . . .
a. CO d. CO2
b. H2O e. SO3
c. NH3
Jawaban: d
Bentuk molekul CO2 simetri sehingga bersifat non-polar.
12. Senyawa di bawah ini yang mempunyai ikatan kovalen koordinasi yaitu . . . .
a. PCl3 d. N2O3
b. SO2 e. C2H4
c. H2S
Jawaban: b
SO2 mempunyai rumus Lewis:
x x o o x x
ikatan kovalen koordinasi
13. Suatu unsur X dapat membentuk senyawa Na2X,
XO2, dan XO3. Unsur X tersebut yaitu . . . .
a. karbon d. nitrogen
b. klorin e. sulfur
c. timbal
Jawaban: e
Senyawa Na2X, berar ti atom X bermuatan
2– (X2–). Di antara pilihan jawaban pada soal, yang memiliki muatan 2– yaitu S (sulfur).
14. Kelompok senyawa berikut yang semuanya merupakan senyawa polar yaitu . . . .
a. HCl, HBr, NH3, H2O
Keempatnya memiliki sifat yang dimiliki senyawa polar.
15. Senyawa di bawah ini yang ikatan antaratomnya terdiri dari 2 buah ikatan kovalen rangkap dua yaitu . . . .
a. SO2 d. NO2
b. SO3 e. Al2O3
c. CO2
Jawaban: c
CO2 memiliki rumus Lewis:
x x x x
B. Jawablah soal-soal berikut!
1. Tuliskan rumus struktur Lewis dari senyawa berikut dan tunjukkan adanya ikatan kovalen tunggal!
a. H2S c. NH3
2. Tentukan jenis ikatan kovalen yang terjadi dalam senyawa di bawah ini!
a. CO2 d. CN–
b. H2O e. HCl
c. C2H2 f. C2H4
Jawaban:
Ikatan kovalen tunggal: H2O dan HCl Ikatan kovalen rangkap dua: CO2 dan C2H4 Ikatan kovalen rangkap tiga: C2H2 dan CN–
ikatan kovalen tunggal
ikatan kovalen tunggal ikatan kovalen tunggal
ikatan kovalen tunggal
ikatan kovalen tunggal
3. Apakah syarat terjadinya ikatan kovalen koordinasi?
Jawaban:
Ikatan kovalen koordinasi dapat terjadi jika salah satu atom atau molekul mempunyai pasangan elektron bebas dan sudah mencapai konfigurasi oktet.
4. a. Apakah syarat terjadinya ikatan kovalen polar
dan nonpolar?
b. Berdasarkan sifatnya, manakah di antara
senyawa: HBr, CH4, BF3, dan NH3 yang mem-punyai ikatan kovalen polar atau nonpolar?
Jawaban:
a. Atom-atom yang membentuk ikatan kovalen
mempunyai perbedaan harga keelektro-negatifan.
Ikatan kovalen yang terdiri lebih dari 2 unsur, kepolaran senyawa ditentukan oleh jumlah momen dipol (≠0) dan bentuk molekul (tidak simetris).
Atom-atom yang membentuk ikatan kovalen mempunyai harga keelektronegatifan yang sama besar atau perbedaannya sangat kecil sehingga dianggap sama.
b. HBr dan NH3 merupakan senyawa yang
memiliki ikatan kovalen polar karena unsur-unsur yang membentuk kedua senyawa berbeda jenis. Pada ikatan H – Br terjadi polarisasi karena Br lebih negatif daripada H. Atom pusat pada NH3 juga memiliki pasangan
elektron bebas. CH4 dan BF3 merupakan
senyawa yang mempunyai ikatan kovalen nonpolar karena keduanya tidak memiliki pasangan elektron bebas pada atom pusatnya.
5. a. Apa yang dimaksud dengan ikatan logam?
b. Mengapa logam memiliki titik didih dan titik
leleh yang tinggi, serta sifat konduktor yang baik dengan adanya ikatan tersebut? Jelaskan!
Jawaban:
a. Ikatan logam adalah interaksi antara elektron
valensi yang bebas bergerak dengan inti atau kation-kation logam yang menghasilkan gaya tarik.
b. Pada logam, elektron-elektron yang
me-nyebabkan terjadinya ikatan di antara atom-atom logam tidak hanya menjadi milik sepasang atom saja, tetapi menjadi milik semua atom logam, sehingga elektron-elektron dapat bergerak bebas. Oleh karena itu, logam-logam dapat menghantarkan arus listrik.
A. Pilihlah jawaban yang tepat!
1. Salah satu sifat senyawa ion yaitu . . . .
a. rapuh dan mudah hancur
b. titik lelehnya relatif rendah
c. larutannya dapat menghantarkan arus listrik
d. padatannya dapat menghantarkan arus listrik.
e. tidak larut dalam air
Jawaban: c
Sifat-sifat senyawa ion sebagai berikut.
1) Bentuk padatannya tidak menghantarkan arus
listrik karena partikel-partikel ionnya terikat kuat pada kisi, sehingga tidak ada elektron yang bergerak bebas.
2) Leburan dan larutannya menghantarkan arus
listrik.
3) Umumnya berupa zat padat kristal yang
permukaannya keras dan sukar digores. 4) Titik leleh dan titik didihnya tinggi.
5) Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar.
2. Di antara senyawa di bawah ini yang mempunyai ikatan ion dan kovalen yaitu . . . .
a. NaCl d. SO3
b. H2SO4 e. NH3
c. KOH
Jawaban: c
KOH memiliki ikatan sebagai berikut.
K+ + oo oo
4. Susunan elektron valensi gas mulia di bawah ini
He susunan elektron valensinya duplet karena mempunyai nomor atom 2.
5. Unsur Na mempunyai nomor atom 11. Elektron valensi unsur tersebut yaitu . . . .
a. 1 d. 8
b. 3 e. 11
c. 7
Jawaban: a
Konfigurasi elektron 11Na : 2 8 1.
6. Diketahui unsur-unsur P, Q, R, S, T masing-masing memiliki nomor atom 12, 13, 14, 17, dan 18. Pasangan unsur yang dapat membentuk ikatan ion yaitu . . . .
a. P dan Q d. P dan S
b. Q dan R e. P dan T
c. R dan S
Jawaban: d
P melepaskan 2 elektron dan S menangkap 1
elektron membentuk PS2.
7. Diketahui unsur-unsur A, B, C, D, dan E masing-masing mempunyai nomor atom 8, 12, 13, 16, dan 17. Di antara pasangan unsur berikut yang berikatan kovalen yaitu . . . .
a. A dan D d. C dan D
b. B dan C e. C dan E
c. B dan D
Jawaban: a
Keduanya merupakan unsur nonlogam yang ter-letak pada golongan VIA dalam tabel periodik unsur.
8. Unsur 14X berikatan kovalen dengan unsur 17Y
membentuk senyawa dengan rumus molekul . . . .
a. XY d. XY4
Unsur Y memerlukan 1 elektron dari unsur X untuk memenuhi susunan oktet. Unsur X memerlukan 4 elektron dari unsur Y untuk memenuhi susunan oktet. Jadi, unsur X dan Y saling berikatan kovalen
membentuk senyawa dengan rumus molekul X1Y4
atau XY4.
9. Satu garis (–) sama dengan sepasang elektron,
yang menggambarkan ikatan kovalen P2O3 yaitu
. . . . (nomor atom P = 15 ; O = 8)
10. Ikatan kimia yang terbentuk sebagai akibat penggunaan bersama pasangan elektron oleh dua atom yang mempunyai elektronegativitas sama disebut . . . .
a. ikatan ionik
b. ikatan kovalen koordinasi
c. ikatan kovalen nonpolar
d. ikatan Van der Waals
e. ikatan hidrogen
Jawaban: c
Ikatan kovalen nonpolar terbentuk sebagai akibat penggunaan bersama pasangan elektron oleh dua atom yang mempunyai elektronegativitas sama seperti Cl2 dan H2.
11. Ikatan kovalen koordinasi ditunjukkan pada nomor . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: d
Ikatan kovalen koordinasi terjadi pada ikatan dengan pasangan elektron yang digunakan bersama berasal dari salah satu atom.
12. Struktur Lewis senyawa PCl3 digambarkan sebagai
berikut.
Pasangan elektron bebas yang dimiliki atom pusat ditunjukkan oleh . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: c
Pasangan elektron bebas yaitu pasangan elektron yang tidak digunakan untuk berikatan.
Al
2. Kelompokkan senyawa berikut ke dalam kelompok senyawa dengan ikatan kovalen polar dan ke dalam kelompok senyawa dengan ikatan kovalen nonpolar!
3. Mengapa senyawa Cl2 dapat terjadi, sedangkan
Na2 tidak dapat terjadi?
Jawaban:
Karena elektron valensi pada Na hanya 1, sekalipun ada pemakaian bersama pasangan elektron tidak akan terjadi atau tidak mencapai konfigurasi oktet. Sementara pada Cl pemakaian bersama pasangan elektron bisa dilakukan
(elektron valensinya 7). Perkecualian pada H2
karena kestabilan yang dicapai berupa konfigurasi duplet.
4. Apabila diketahui unsur 15P dan 17Cl
Tentukan:
a. konfigurasi elektron,
b. ramalkan rumus titik elektronnya bila semua
ikatan yang dibentuk merupakan ikatan kovalen tunggal,
c. ramalkan rumus molekulnya!
Jawaban:
Gambarkan rumus titik elektronnya dan berilah tanda ikatan kovalen koordinasinya! (Nomor atom S = 16; O = 8; H = 1; P = 15; Cl = 17)
a. 2 ikatan kovalen, 1 ikatan kovalen koordinasi
b. 4 ikatan kovalen, 2 ikatan kovalen koordinasi
c. 3 ikatan kovalen, 2 ikatan kovalen koordinasi
d. 3 ikatan kovalen, 1 ikatan kovalen koordinasi
e. 4 ikatan kovalen, 3 ikatan kovalen koordinasi
Jawaban: b
14.
Ikatan kovalen koordinasi ditunjukkan pada nomor . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: c
Sepasang elektron yang digunakan bersama berasal dari nitrogen.
15. Reaksi antara gas NH3 dengan uap AlCl3
mem-bentuk ikatan menurut gambar:
Ikatan kovalen koordinasi ditunjukkan oleh nomor . . . .
a. 1 d. 4
b. 2 e. 5
c. 3
Jawaban: e
Sepasang elektron yang digunakan bersama berasal dari nitrogen.
B. Jawablah soal-soal berikut!
1. Tulis konfigurasi elektron dan rumus Lewis unsur-unsur berikut!
kovalen koordinasi kovalen
b. atau
Jawablah soal-soal berikut!
1. Jika ikatan ion didefinisikan sebagai ikatan yang terbentuk akibat serah terima elektron, tuliskan konfigurasi elektron dan rumus senyawa ion dari unsur-unsur berikut!
2. Perhatikan gambar titik Lewis dari senyawa Na3PO4 berikut!
Ikatan apa sajakah yang terdapat dalam senyawa Na3PO4? Jelaskan!
Jawaban:
Ikatan yang terjadi dalam senyawa Na3PO4, yaitu ikatan kovalen tunggal, ikatan kovalen koordinasi, dan ikatan ion.
Ikatan ion = 3 elektron dari 3 atom Na dilepaskan
sehingga atom Na menjadi Na+. Ketiga elektron
yang lepas tersebut, selanjutnya ditangkap oleh PO4 menjadi PO43–.
Ikatan kovalen tunggal = penggunaan bersama sepasang elektron, satu elektron berasal dari atom O dan satu elektron lainnya dari atom P.
Ikatan kovalen koordinasi = penggunaan bersama pasangan elektron yang keduanya berasal dari atom P.
3. Jelaskan tentang ikatan kovalen rangkap dua dan ikatan kovalen rangkap tiga berdasarkan titik Lewis beserta contoh!
Jawaban:
Ikatan kovalen rangkap dua merupakan ikatan kovalen yang terjadi karena penggunaan bersama dua pasang elektron.
Contoh:
o o x x o o x x
oO Oo x x atau O = O
ikatan kovalen satu garis mewakili
rangkap dua sepasang elektron
Ikatan kovalen rangkap tiga merupakan ikatan kovalen yang terjadi karena penggunaan bersama tiga pasang elektron.
4. Faktor apa sajakah yang mempengaruhi kepolaran suatu senyawa? Tentukan kepolaran senyawa-senyawa berikut jika harga keelektronegatifan dari H = 2,1; C = 2,5; N = 3; O = 3,5; F = 4!
a. CH4 d. HF
b. NH3 e. O2
c. H2O
Jawaban:
Kepolaran suatu senyawa ditentukan beberapa hal berikut.
– Jumlah momen dipol. Jika jumlah momen
dipol = 0, bersifat nonpolar.
– Perbedaan keelektronegatifan. Jika harga
per-bedaan keelektronegatifan mendekati nol (0), bersifat nonpolar.
– Bentuk molekul. Apabila bentuk molekulnya
simetris, biasanya bersifat nonpolar.
– Keberadaan pasangan elektron bebas. Jika
tidak mempunyai pasangan elektron bebas, bersifat nonpolar.
a. CH4 bersifat nonpolar H
| H – C – H
| H
CH4 tidak memiliki pasangan elektron bebas, sehingga pasangan elektron tertarik sama kuat ke seluruh atom.
Titik didih dan titik lebur-nya tinggi.
Larut dalam pelarut po-lar dan tidak po-larut dalam pelarut nonpolar.
Leburan dan larutannya menghantarkan listrik.
Penghantar panas yang baik.
1.
2.
3.
4.
Titik didih dan titik lebur-nya rendah.
Larut dalam pelarut non-polar dan tidak larut dalam pelarut polar.
Leburan dan larutannya tidak menghantarkan listrik.
Penghantar panas yang jelek.
b. NH3 bersifat polar
Atom pusat memiliki pasangan elektron bebas sehingga pasangan elektron akan tertarik ke salah satu atom. Selain itu, NH3 memiliki perbedaan keelektronegatifan sebesar 0,9.
c. H2O bersifat polar, karena memiliki
perbedaan keelektronegatifan sebesar 1,4.
d. HF bersifat polar dengan perbedaan
keelektronegatifan sebesar 1,9.
e. O2 bersifat nonpolar karena bentuk
molekul-nya simetris dan perbedaan keelektro-negatifannya = 0.
5. Jelaskan perbedaan sifat antara senyawa ion dengan senyawa kovalen!
Jawaban: