BAB 3
KIMIA UNSUR
3.1 Kelimpahan
Unsur-unsur di Alam
3.2 Sifat-sifat Unsur
3.3 Pembuatan dan
Manfaat
Beberapa Unsur
Logam dan
Senyawanya
3.4 Pembuatan dan
Manfaat
Beberapa Unsur
Nonlogam dan
Senyawanya
3.5 Unsur Radioaktif
3.6 Penggunaan
Keberadaan Unsur-unsur di
Kulit Bumi
a. Sekitar 90 jenis unsur terdapat di alam, sisanya merupakan unsur buatan. Sebagian dari unsur tersebut terdapat sebagai unsur bebas, tetapi lebih banyak yang berupa senyawa.
b. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) terdapat sebagai unsur bebas.
c. Beberapa unsur logam, yaitu emas, platina, perak, dan tembaga, juga ditemukan dalam bentuk bebas dan senyawa.
d. Beberapa unsur nonlogam, yaitu oksigen, nitrogen, belerang, dan karbon.
e. Bahan-bahan alam yang mengandung unsur
atau senyawa tertentu dalam kadar yang relatif besar disebut mineral.
Sifat-sifat Kimia
Gas Mulia
a. Radon ternyata dapat bereaksi spontan dengan fuorin, sedangkan xenon
memerlukan pemanasan atau penyinaran untuk memulai reaksi.
b. Kripton lebih sukar, hanya bereaksi dengan fuorin jika disinari atau jika diberi loncatan muatan listrik.
c. Sementara itu helium, neon, dan argon, ternyata lebih sukar lagi bereaksi dan
belum berhasil dibuat suatu senyawa dari ketiga unsur itu.
d. Kereaktifan gas mulia bertambah besar sesuai dengan pertambahan jari-jari
Struktur
Halogen
a. Dalam bentuk unsur, halogen (X) terdapat sebagai molekul diatomik (X2).
b. Molekul X2 dapat mengalami disosiasi menjadi
atom-atomnya.
X2(g) 2X(g)
c. Kestabilan molekul halogen (X2) berkurang
dari Cl2 ke I2.
d. Hal itu sesuai dengan pertambahan jari-jari atomnya, sehingga energi ikatan dari Cl–Cl ke I–I berkurang.
Pada suhu kamar, fuorin dan klorin berupa
gas, bromin berupa zat cair yang mudah
menguap, sedangkan iodin berupa zat
padat yang mudah menyublim.
Pemanasan iodin padat pada tekanan
atmosfr tidak membuat unsur itu meleleh,
tetapi langsung menguap (menyublim).
Warna dan Aroma
Halogen
a. Fluorin berwarna kuning muda, klorin
berwarna hijau muda (“kloros” berarti hijau), bromin berwarna merah tua, iodin padat
berwarna hitam, sedangkan uap iodin berwarna ungu.
b. Semua halogen berbau rangsang dan menusuk, serta bersifat racun.
Kelarutan
Halogen
Halogen merupakan
kelompok unsur nonlogam
yang paling reaktif. Namun
demikian, kereaktifannya
menurun dari fuorin ke
iodin.
Reaksi-reaksi
Halogen
a. Reaksi dengan logam
Halogen bereaksi dengan sebagian
besar logam menghasilkan halida
logam dengan bilangan oksidasi
tertinggi.
b. Reaksi dengan hidrogen
Semua halogen bereaksi dengan
hidrogen membentuk hidrogen halida
(HX).
c. Reaksi dengan nonlogam dan
metaloid tertentu
d. Reaksi dengan air
Fluorin bereaksi hebat dengan air
membentuk HF dan
membebaskan oksigen.
e. Reaksi dengan basa
Klorin, bromin, dan iodin
mengalami reaksi
disproporsionasi dalam basa.
f. Reaksi antarhalogen
Antarhalogen dapat bereaksi
membentuk senyawa
Daya Oksidasi
Halogen
Halogen merupakan pengoksidasi kuat. Daya
pengoksidasi halogen menurun dari atas ke bawah. Sebaliknya, daya reduksi ion halida (X–) bertambah dari atas ke bawah. Jadi, I– merupakan reduktor
terkuat, sedangkan F– merupakan reduktor terlemah. Daya oksidasi halogen atau daya pereduksi ion
halida dicerminkan oleh potensial elektrodenya.
Reaksi Pendesakan
Antarhalogen
Halogen yang bagian atas dapat
mengoksidasi halida yang bagian
bawahnya, tetapi tidak sebaliknya.
Contoh:
Klorin dapat mendesak bromin, tetapi
sebaliknya bromin tidak dapat mendesak
klorin.
Cl2(
g) + 2NaBr(aq) → 2NaCl(aq) +
Br2(l)
Reaksi-reaksi
Logam Alkali
1. Reaksi dengan Air
Semua logam alkali bereaksi dengan air
membentuk basa dan gas hidrogen.
2L(
s) + 2H2O(l) 2LOH(aq) + H2(g)
2. Reaksi dengan Hidrogen
Jika dipanaskan, logam alkali dapat
bereaksi dengan gas hidrogen membentuk
hidrida, suatu senyawa ion yang
hidrogennya mempunyai bilangan oksidasi
–1.
3. Reaksi dengan Oksigen
Logam alkali terbakar dalam oksigen membentuk oksida, peroksida atau superoksida.
4L(s) + O2(g) 2L2O(s) L
Jika oksigen berlebihan, natrium dapat
membentuk peroksida. 2Na(s) + O2(g) Na2O2(s)
Kalium, rubidium, dan sesium dapat membentuk superoksida
dalam oksigen berlebihan.
Logam alkali bereaksi hebat
dengan halogen membentuk
garam halida.
2L(
s
) + X
2→ 2LX(s
)
Beberapa Reaksi Logam
Alkali Tanah
1. Reaksi dengan Air
Kalsium, strontium, dan barium bereaksi
baik dengan air membentuk basa dan
gas hidrogen.
Magnesium bereaksi sangat lambat
dengan air dingin dan sedikit lebih baik
dengan air panas, sedangkan berilium
tidak bereaksi.
2. Reaksi dengan Udara
Semua logam alkali tanah terkorosi
terus-menerus di udara membentuk
oksida, hidroksida atau karbonat, kecuali
berilium dan magnesium.
2M(
s) + O2(g) 2MO(s)
3M(
s) + N2(g) M3N2(s)
3. Reaksi dengan Halogen (X
2)
Semua logam alkali tanah bereaksi
dengan halogen membentuk garam
halida.
4. Reaksi dengan asam dan basa
Semua logam alkali tanah bereaksi
dengan asam kuat (seperti HCl)
membentuk garam dan gas hidrogen.
Reaksi makin hebat dari Be ke Ba.
Kelarutan Senyawa Logam
Alkali Tanah
Salah satu perbedaan logam alkali dari alkali tanah adalah dalam hal kelarutan senyawanya. Senyawa logam alkali
a. Natrium, magnesium, dan aluminium merupakan logam sejati.
b. Ketiga unsur itu merupakan konduktor listrik dan panas yang baik, serta menunjukkan
kilap logam yang khas.
c. Silikon tergolong metaloid dan bersifat
semikonduktor. Fosforus, belerang, dan klorin merupakan nonlogam. Padatan ketiga unsur itu tidak menghantar listrik.
d. Secara kimia, sifat nonlogam dari fosforus, belerang, dan klorin tercermin dari
kemampuannya membentuk ion negatif.
a. Daya pereduksi unsur-unsur periode
ketiga berkurang dari kiri ke kanan,
sebaliknya daya pengoksidasinya
bertambah.
b. Jadi, pereduksi terkuat adalah natrium,
sedangkan pengoksidasi terkuat
adalah klorin.
c. Kecenderungan tersebut sesuai
dengan energi ionisasi yang cenderung
bertambah dari kiri ke kanan.
Sifat Pereduksi dan
Sifat-sifat Umum Unsur
Transisi
Unsur transisi mempunyai sifat-sifat khas yang membedakannya dari unsur golongan utama, antara lain:
1. Sifat logam, semua unsur transisi tergolong logam dengan titik cair dan titik didih yang relatif tinggi.
2. Bersifat paramagnetik (sedikit tertarik ke dalam medan magnet).
3. Membentuk senyawa-senyawa yang berwarna.
4. Mempunyai beberapa tingkat oksidasi.
5. Membentuk berbagai macam ion kompleks. 6. Berdaya katalitik, banyak unsur transisi atau
Sifat
Magnet
a. Unsur transisi periode keempat dan
senyawa-senyawanya umumnya bersifat
paramagnetik.
b. Feromagnetisme hanya diperlihatkan oleh
beberapa logam, yaitu besi, kobal, dan
nikel.
c. Sifat magnet zat berkaitan dengan
konfgurasi elektronnya.
d. Zat yang bersifat paramanetik
mempunyai setidaknya satu elektron tak
berpasangan. Semakin banyak elektron
tak berpasangan, semakin bersifat
Warna Senyawa Unsur Transisi
Periode Keempat
a. Pada umumnya unsur-unsur transisi periode keempat membentuk senyawa berwarna, baik dalam bentuk padat maupun dalam larutan. b. Warna senyawa dari unsur transisi juga
berkaitan dengan adanya subkulit d yang terisi tidak penuh.
c. Senyawa dari Sc dan Ti tidak berwarna karena subkulit 3d-nya kosong.
3+ 3+
d. Senyawa dari Zn juga tidak berwarna karena subkulit 3d-nya terisi penuh.
Struktur Ion
Kompleks
Ion kompleks adalah ion yang terbentuk dari suatu kation
tunggal (biasanya ion logam transisi) yang terikat langsung pada beberapa anion atau molekul netral.
Ion kompleks terdiri dari ion atau atom pusat dan ligan-ligan.
Bilangan
Koordinasi
Jumlah ligan sederhana atau jumlah ikatan koordinasi yang dibentuk oleh satu ion pusat disebut bilangan koordinasi ion pusat itu.
Muatan Ion
Kompleks
Tata Nama Ion
Kompleks
a. Nama ion kompleks, baik kation ataupun
anion, terdiri atas dua bagian yang
ditulis dalam satu kata. Bagian pertama
menyatakan jumlah dan nama ligan,
bagian kedua menyatakan nama ion
pusat dan bilangan oksidasinya.
Bilangan oksidasi ion pusat ditulis
dengan angka Romawi dalam tanda
kurung.
b. Bila terdapat lebih dari sejenis ligan, maka
urutan penulisannya adalah berdasarkan
urutan abjad dari nama ligan tersebut
(ligan Cl– dianggap bermula dengan huruf
Penggunaan Natrium dan
Senyawa Natrium
1. Natrium
Penggunaan yang semakin penting dari
natrium adalah sebagai cairan pendingin
(
coolant
) pada reaktor nuklir.
Selain itu, karena merupakan reduktor
kuat, natrium digunakan pada
2. Natrium Klorida (NaCl)
a. Natrium Klorida sebagai bahan baku
untuk membuat natrium, klorin, dan
senyawa- senyawa natrium seperti
NaOH dan natrium karbonat (Na2CO3);
b. dalam industri susu; mengawetkan
ikan dan daging;
c. mencairkan salju di jalan raya di
negara yang bermusim dingin;
d. regenerasi alat pelunak air;
e. pengolahan kulit;
3. Natrium Hidroksida
Natrium hidroksida digunakan terutama dalam industri sabun, detergen, pulp, dan kertas,
pengolahan bauksit untuk pembuatan
aluminium, tekstil, plastik, pemurnian minyak bumi, serta untuk membuat senyawa natrium lainnya seperti natrium hipoklorit.
4. Natrium Karbonat
Natrium karbonat digunakan untuk pembuatan kaca.
5. Natrium Bikarbonat
Natrium bikarbonat disebut soda kue untuk
a. Kegunaan utama magnesium adalah untuk membuat logam-campur.
b. Paduan magnesium dengan aluminium, yang disebut magnalium, merupakan
logam yang kuat tetapi ringan, resisten terhadap asam maupun basa, serta
tahan korosi.
c. Paduan itu digunakan untuk membuat komponen pesawat terbang, rudal, bak truk, serta berbagai peralatan lainnya. d. Magnesium digunakan untuk membuat
kembang api.
Pembuatan
Magnesium
Pembuatan
Alumunium
Penggunaan Aluminium dan
Senyawanya
1. Sektor industri otomotif: untuk membuat bak truk dan komponen kendaraan bermotor lainnya, untuk membuat badan pesawat terbang.
2. Sektor pembangunan perumahan: untuk kusen pintu dan jendela.
3. Sektor industri makanan: aluminium foil dan kaleng aluminium untuk kemasan berbagai jenis produk makanan/minuman.
4. Sektor lainnya: untuk kabel listrik, perabotan rumah tangga, dan barang kerajinan.
5. Membuat termit, yaitu campuran serbuk aluminium dengan serbuk besi(III) oksida.
Aluminium sulfat digunakan
pada pengolahan air minum,
yaitu untuk mempercepat
koagulasi lumpur koloidal.
Penggunaan
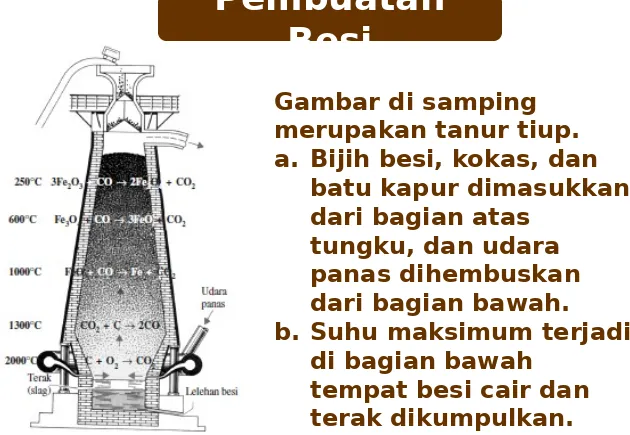
Gambar di samping
merupakan tanur tiup. a. Bijih besi, kokas, dan
batu kapur dimasukkan dari bagian atas
tungku, dan udara panas dihembuskan dari bagian bawah.
b. Suhu maksimum terjadi di bagian bawah
tempat besi cair dan terak dikumpulkan.
Penggunaan
Besi
a. Besi adalah logam yang paling luas dan paling banyak penggunaannya karena:
1. bijih besi relatif melimpah dan tersebar di berbagai penjuru dunia;
2. pengolahan besi relatif mudah dan murah; 3. sifat-sifat besi mudah dimodifkasi.
b. Kegunaan utama dari besi adalah untuk membuat baja.
c. Baja adalah istilah yang digunakan untuk semua logam campur (aliase) dari besi.
d. Salah satu contoh baja yang paling terkenal
Pembuatan
Baja
Logam-logam campur dari besi disebut baja.
Perubahan yang harus
dilakukan pada pembuatan baja dari besi gubal, yaitu:
1. menurunkan kadar karbon dari 3 – 4% menjadi 0 – 1,5%,
2. menghilangkan pengotor seperti Si, Mn, dan P,
3. menambahkan logam-logam
campur seperti Ni dan Cr, sesuai dengan jenis baja yang akan
dibuat.
Besi gubal cair dari tanur tiup dituangkan ke dalam tungku
Pembuatan
Tembaga
a. Pengolahan tembaga melalui beberapa tahap, yaitu fotasi, pemanggangan, peleburan,
pengubahan, dan elektrolisis.
b. Pada umumnya, bijih tembaga hanya mengandung 0,5% Cu.
c. Melalui pengapungan dapat diperoleh bijih pekat yang mengandung 20 – 40% Cu.
d. Bijih pekat itu kemudian dipanggang untuk mengubah besi sulfda menjadi besi oksida, sedangkan tembaga tetap berupa sulfda.
e. Bijih yang sudah melalui pemanggangan
kemudian dilebur sehingga bahan
tersebut mencair dan terpisah menjadi
dua lapisan.
f. Lapisan bawah disebut ”
copper matte”
yang mengandung Cu
2S
dan besi cair,
sedangkan lapisan atas merupakan terak
silikat yang antara lain mengandung
FeSiO
3.
g. Selanjutnya, ”
copper matte”
dipindahkan
ke dalam tungku lain dan ditiupkan udara
sehingga terjadi reaksi redoks yang
menghasilkan tembaga lepuh.
i. Tembaga lepuh mengandung 98 – 99%
Cu dengan berbagai jenis pengotor.
j. Pemurnian tembaga dilakukan dengan
elektrolisis.
k. Tembaga lepuh digunakan sebagai
anode, sedangkan tembaga murni
digunakan sebagai katodenya.
l. Elektrolit yang digunakan adalah larutan
CuSO4.
m.
Selama elektrolisis, Cu dipindahkan
dari anode ke katode.
n. Dengan menggunakan potensial
Penggunaan
Tembaga
a. Tembaga adalah logam yang berwarna kuning merah dan tergolong logam yang kurang aktif. b. Dalam udara lembab, tembaga terkorosi secara
perlahan-lahan.
c. Mula-mula warnanya menjadi coklat karena terbentuknya lapisan tipis CuO atau CuS.
d. Lama-kelamaan menjadi berwarna hijau karena terbentuknya tembaga karbonat basa,
Cu2(OH)2CO3.
a. Timah adalah logam yang relatif lunak,
berwarna putih perak dan tahan karat.
b. Timah terutama digunakan untuk
membuat kaleng kemasan, seperti untuk
roti, susu, cat, dan buah.
c. Kegunaan lain dari timah adalah untuk
membuat logam campur, misalnya
perunggu (paduan timah, tembaga, dan
zink) dan solder.
Kromiu
m
a. Kromium adalah logam yang sangat mengkilap, keras, dan tahan karat.
b. Lebih dari separo produksi kromium digunakan dalam industri logam dan sekitar sepertiga
lainnya dalam refraktori (pelapis tahan panas bagi tanur bersuhu tinggi).
Em
as
Karbon dan Senyawa
Karbon
Intan
a. Sebagian besar intan alam digunakan
untuk perhiasan.
b. Intan alam yang tidak cukup baik
untuk perhiasan dan intan buatan
digunakan untuk membuat alat
Graft
1. Sebagai anode dalam batu baterai dan
dalam berbagai proses industri yang
menggunakan elektrolisis, misalnya
pada peleburan aluminium.
2. Graft dicampur dengan tanah liat
untuk membuat pensil dan bahan
kosmetik.
3. Bahan pelumas.
Karbon Monoksida
(CO)
1. Sebagai reduktor pada
pengolahan berbagai jenis logam,
misalnya besi.
2. Sebagai bahan baku untuk
membuat metanol.
3. Merupakan komponen dari
Karbon Dioksida
(CO
2
)
1.Karbon dioksida padat
yang disebut es kering (
dry
ice)
digunakan sebagai
pendingin.
2.Untuk memadamkan
kebakaran.
Siliko
n
1. Silikon dibuat dari silika dengan kokas sebagai reduktor.
2. Penggunaan penting dari silikon adalah untuk membuat transistor, chips komputer, dan sel surya.
3. Untuk tujuan itu diperlukan silikon ultra murni. Silikon juga digunakan dalam berbagai jenis aliase dengan besi (baja).
4. Baja biasa mengandung sekitar 0,03% silikon, baja silikon mengandung sekitar 2,5 - 4%
silikon, sedangkan durion mengandung 15% silikon.
5. Durion bersifat keras tetapi rapuh dan sangat tahan karat.
Dalam industri, nitrogen diperoleh dari
udara.
Prosesnya berlangsung dalam dua
tahap, yaitu:
1. pencairan udara, dan
2. distilasi bertingkat udara cair.
Nitrogen dan
1. Sebagian besar produksi nitrogen digunakan untuk membuat amonia (NH3).
2. Oleh karena sifatnya yang kurang reaktif,
nitrogen digunakan untuk membuat atmosfer inert dalam berbagai proses yang terganggu oleh oksigen, misalnya dalam industri
elektronika.
3. Nitrogen juga digunakan sebagai atmosfer inert dalam makanan kemasan untuk
memperpanjang masa penggunaannya.
4. Nitrogen cair digunakan sebagai pendingin untuk menciptakan suhu sangat rendah.
1. Membuat pupuk, misalnya urea {CO(NH2)2},
dan ZA {(NH4)2SO4}.
2. Untuk membuat senyawa nitrogen yang lain, seperti asam nitrat (HNO3), amonium klorida
(NH4Cl), dan amonium nitrat.
3. Dalam pabrik es, digunakan sebagai
pendingin (refrigerant) karena amonia cair
mudah menguap dan mempunyai kalor penguapan yang cukup besar.
4. Untuk membuat hidrazin, N2H4.
1. untuk membuat amonium nitrat,
NH
4NO
3, dan digunakan sebagai
pupuk.
2. digunakan dalam percobaan di
laboratorium
3. digunakan dalam industri kimia
seperti industri bahan peledak,
plastik, dan obat.
Fosforus mempunyai dua bentuk
alotropi, yaitu fosforus putih dan
fosforus merah.
Fosforus dan
1. Sumber fosforus terpenting yaitu
batuan fosfat, suatu bahan kompleks
yang mengandung
flourapatit
(Ca
3(PO
4)2.CaF
2)
.
2. Senyawa Ca
3(PO
4)
2dipisahkan dari
batuan fosfat kemudian dipanaskan
dengan pasir (SiO
2) dan kokas (C).
3. Uap fosforus yang terbentuk
ditampung dalam air.
1. Sebagian besar produksi fosforus
digunakan untuk membuat asam
fosfat.
2. Penggunaan akhir yang utama dari
senyawa fosforus adalah pupuk dan
detergen.
3. Fosforus merah dan senyawa fosforus
tertentu digunakan pada pembuatan
korek api.
4. Berbagai senyawa organofosfat
digunakan sebagai pestisida.
Asam fosfat digunakan untuk
membuat pupuk superfosfat
juga untuk membuat detergen,
bahan pembersih lantai,
insektisida, dan makanan
hewan.
1. Untuk pernapasan para penyelam,
angkasawan, atau penderita penyakit tertentu.
2. Sebagian besar dari produksi oksigen digunakan dalam industri baja, yaitu
mengurangi kadar karbon dalam besi gubal.
3. Bersama-sama dengan gas asetilena digunakan untuk mengelas baja.
4. Oksigen cair bersama dengan hidrogen cair digunakan sebagai bahan bakar roket untuk mendorong pesawat ruang angkasa. Oksigen juga digunakan dalam berbagai industri kimia untuk mengoksidasikan berbagai zat.
Belerang padat mempunyai dua bentuk alotropi, yaitu belerang rombik dan belerang monoklinik. Deposit belerang yang terdapat di bawah
permukaan ditambang menurut cara Frasch.
Penggunaan utama dari belerang adalah
untuk pembuatan asam sulfat.
Asam sulfat digunakan untuk:
1. industri pupuk
2. industri cat/zat warna
3. detergen
4. industri logam
Fluorin digunakan untuk membuat
senyawa klorofuorokarbon (CFC) yang
dikenal dengan nama dagang
freon
.
Freon digunakan sebagai cairan
pendingin pada mesin-mesin pendingin
seperti AC dan lemari es.
1. Bromin digunakan terutama untuk
membuat etilenbromida, C
2H
4Br
2,
suatu aditif yang dicampurkan ke
dalam bensin bertimbel untuk
mengikat timbel sehingga tidak
melekat pada silinder atau piston.
2. Bromin juga digunakan untuk
membuat AgBr.
1. Iodin digunakan dalam obat-obatan.
2. Iodoform digunakan sebagai
antiseptik.
3. Iodin juga digunakan untuk membuat
perak iodida yang digunakan
bersama-sama dengan AgBr dalam
flm fotograf.
4. Natrium iodat atau natrium iodida
dicampurkan ke dalam garam dapur.
Iodin dan
Sinar-sinar radioaktif. Zat radioaktif alami dapat memancarkan tiga jenis sinar, yaitu sinar α, β, γ. Sinar α dan β terdiri atas partikel bermuatan listrik, sedangkan sinar γ merupakan gelombang
elektromagnet. Sinar β bermuatan positif sehingga dibelokkan ke kutup negatif; sinar bermuatan negatif sehingga dibelokkan ke kutup positif. Sinar γ tidak bermuatan, sehingga tidak dipengaruhi medan magnet atau medan listrik. Partikel sinar β lebih ringan
daripada partikel sinar α, oleh karena itu sinar β mengalami pembelokan yang lebih besar.
Daya tembus sinar alfa, beta, dan gamma.
Misalnya, peluruhan uranium yang disertai pemancaran partikel alfa dipaparkan dengan persamaan inti sebagai berikut.
Persamaan
Inti
Persamaan inti juga mengikuti azas kesetaraan.
Suatu persamaan inti dikatakan setara jika muatan (nomor atom) dan massa di ruas kiri sama dengan di ruas kanan.
Untuk contoh di atas:
Jumlah muatan di ruas kiri = 92; di ruas kanan = 90 + 2 = 92.
Reaksi transmutasi biasanya diringkaskan
dengan notasi sebagai berikut.
Transmutasi
Buatan
dengan,
T
= inti sasaran (target)
x
= partikel yang ditembakkan
y
= partikel hasil
Secara matematis, laju peluruhan dinyatakan dengan persamaan sebagai berikut.
Laju
Peluruhan
dengan, v = laju peluruhan (keaktifan), yaitu
banyaknya peluruhan dalam satu satuan waktu.
λ = tetapan peluruhan (serupa dengan k dalam persamaan laju reaksi), nilainya
bergantung pada jenis radioisotop.
Oleh karena keaktifan sebanding
dengan jumlah atom radioaktif,
maka:
A
t= keaktifan pada
waktu t
a. Bidang Kedokteran
Berbagai jenis radioisotop digunakan sebagai perunut untuk mendeteksi (diagnosis)
berbagai jenis penyakit antara lain teknesium-99, talium-201, iodin-131, natrium-24, xenon-133, fosforus-32, dan besi-59.
Radioisotop Sebagai
Perunut
b. Bidang Kimia dan Biologi
Dalam ilmu kimia, perunut radioaktif digunakan untuk mempelajari mekanisme reaksi dan proses biologis.
1. Mempelajari Kesetimbangan Dinamis 2. Mempelajari Reaksi Pengesteran