2.
TINJAUAN PUSTAKA
2.1. Ekosistem Danau Lido
Danau Lido terletak pada koordinat 106°48’26”-106°48’50” BT dan 6°44”30”-6°44’58” LS, Desa Tugujaya, Kecamatan Cigombong, Bogor, Jawa Barat. Danau Lido berbentuk tidak beraturan dengan luas 198.750 m2 dan panjang garis tepi sebesar 5.630 m (Tambunan 2010). Danau Lido mempunyai satu inlet dan dua outlet. Air Danau Lido berasal dari aliran sungai Ciletuk, air permukaan, dan air dalam tanah (ground water) (Amalia 2010).
Danau Lido dimanfaatkan untuk kegiatan wisata, kepentingan rumah tangga, serta kegiatan perikanan berupa budidaya ikan di KJA (Keramba Jaring Apung). Lokasi penempatan KJA berada pada bagian barat Danau Lido dekat dengan kedua outlet Danau. Sekitar 5% dari luas permukaan Danau Lido digunakan untuk KJA, terdiri dari 14 KJA aktif milik petani dan satu KJA aktif milik Badan Riset Kelautan dan Perikanan (BRKP). Komoditas ikan yang dibudidayakan dalam KJA adalah ikan mas (Cyprinus carpio) dan ikan nila (Oreochromis niloticus) dengan pakan berupa pelet untuk mempercepat pertumbuhan ikan. Selain terdapat KJA, pada bagian barat danau juga terdapat restoran terapung serta hotel dan wisma pada tepian danau (Amalia 2010).
2.2. Lapisan Hipolimnion Danau
Berdasarkan perbedaan nilai pada setiap kedalaman, stratifikasi suhu secara vertikal kolom air (thermal stratification) pada perairan tergenang dapat dibagi menjadi tiga, yaitu epilimnion, metalimnion, dan hipolimnion. Menurut Birge (1897) in Cole (1983), lapisan hipolimnion merupakan lapisan di bawah metalimnion, lebih dingin, perbedaan suhu secara vertikal relatif kecil. Metalimnion merupakan lapisan air yang mengalami penurunan suhu cukup besar (lebih dari 1 °C/m) yang mengarah ke dasar danau/waduk. Akan tetapi, pada danau yang memiliki kedalaman rata-rata kurang dari 10 m, umumnya tidak mempunyai perbedaan suhu yang nyata. Selain itu, lapisan hipolimnion umumnya relatif stagnan (tidak ada pergerakan), dan tidak dipengaruhi oleh angin (Wetzel 2001). Daerah tropis memiliki variasi suhu air yang kecil antara suhu permukaan dan suhu
dasar (Ruttner 1975 in Sudaryanti 1990). Radiasi cahaya di daerah tropis yang hampir sama sepanjang tahun dan dengan penurunan suhu yang kecil dapat menyebabkan pengadukan karena tipisnya metalimnion (Seller & Markland 1987 in
Sudaryanti 1990).
Kondisi anoksik pada lapisan hipolimnion dan deplesi oksigen pada dasar perairan danau merupakan fenomena umum yang sering dijumpai pada danau yang produktif (Beutel 2006). Lapisan hipolimnion beberapa perairan memiliki kisaran konsentrasi oksigen terlarut yang kecil, seperti pada Situ Bojongsari (0,08-0,13 mg/l) (Hartoto & Fakhrudin 1990 in Hartoto 1993), Danau Black (0,2 mg/l) (Ashley 1981), Waduk Ir. H. Juanda (0,06-1,06 mg/l) (Simarmata 2007).
Konsentrasi oksigen pada lapisan hipolimnion danau eutrofik (subur) berkurang sangat cepat oleh proses oksidasi biologis bahan organik. Meskipun tanaman dan hewan akuatik juga memanfaatkan oksigen untuk respirasi, namun konsumsi oksigen tersebut tidak sebesar kebutuhan oksigen untuk proses dekomposisi bahan organik terlarut dan tersuspensi (Seto et al. 1982 in Wetzel 2001).
2.3. Bentuk dan Sumber Amonia (NH3-N) di Perairan
Amonia (NH3-N) dan garam-garamnya bersifat mudah larut dalam air. Terdapat dua bentuk amonia di perairan, yaitu amonium yang dapat terionisasi (NH4+) dan amonia bebas yang tidak dapat terionisasi (NH3). Amonia bebas (NH3) yang tidak terionisasi (unionized) bersifat toksik bagi organisme akuatik. Kesetimbangan reaksi kimia antara keduanya tergantung pada kondisi pH (keasaman dan alkalinitas) serta temperatur (Lloyd 1992).
NH4+ + OH- ↔ NH3 + H2O
Amonia di perairan bersumber dari hasil metabolisme organisme akuatik dan dekomposisi bahan organik oleh bakteri (Boyd 1989). Selain itu, amonia dapat berasal dari nitrogen organik yang masuk ke perairan (urea), respirasi bakteri, organisme mati, dan sel yang pecah (Painter 1970 in Novotny & Olem 1994). Meskipun amonia bersumber dari hasil ekskresi hewan akuatik, namun proporsinya terhitung kecil jika dibandingkan dengan pembentukan amonia dari dekomposisi oleh bakteri (Wetzel 2001).
Pakan ikan yang terbuang ke perairan banyak mengandung nitrogen. Jumlah penambahan nutrien ke badan air dari keramba jaring apung tergantung pada densitas ikan dalam keramba (Ryding & Rast 1989). Hasil ekskresi ikan akan disebarkan ke kolom air oleh arus, sedangkan padatan (pakan yang tidak termakan dan feses) akan jatuh ke bawah atau dasar danau (Beveridge 1996). Berdasarkan hasil penelitian Amalia (2010), konsentrasi amonia pada KJA di Danau Lido sebesar 0,354 mg/l pada lapisan permukaan dan 0,706 mg/l pada lapisan kompensasi (4,3-7,4 m).
2.4. Faktor yang Mempengaruhi Keberadaan Amonia di Perairan 2.4.1.pH dan suhu
Komposisi amonia di perairan bergantung pada parameter pH dan suhu. Proporsi amonia yang tidak terionisasi (NH3) lebih besar dibandingkan dengan amonium (NH4+) saat pH meningkat (Boyd 1989). Peningkatan suhu perairan juga berperan serta meningkatkan proporsi NH3, tetapi pengaruhnya lebih rendah dibandingkan pengaruh pH (Llyod 1992).
2.4.2.Oksigen terlarut (O2)
Keberadaan oksigen terlarut juga mempengaruhi keberadaan amonia di perairan. Konsentrasi amonia lebih besar pada kedalaman perairan yang lebih dalam. Hal ini terjadi berkaitan dengan konsentrasi oksigen terlarut yang berkurang seiring dengan bertambahnya kedalaman, sehingga proses oksidasi amonia atau proses dekomposisi bahan organik akan terhambat dan mengakibatkan akumulasi amonia (Simarmata 2007).
Berdasarkan hasil penelitian Amalia (2010), lokasi KJA dan non KJA Danau Lido memiliki kesuburan eutrofik. Perairan yang memiliki kesuburan eutrofik ditandai dengan terjadinya penurunan kecerahan, meningkatnya tanaman air, dan munculnya kondisi oksigen terlarut yang sangat rendah bahkan mencapai nol di daerah hipolimnion (Suryono et al. 2006 in Amalia 2010). Aerasi hipolimnion yang dilakukan oleh Nursandi (2011) di Danau Lido mampu meningkatkan konsentrasi oksigen terlarut. Akan tetapi, distribusinya tergantung dari jaraknya dari titik outlet aerasi. Semakin dekat dengan titik outlet aerasi, konsentrasi oksigen terlarut di perairan akan semakin tinggi.
2.4.3.Bahan organik
Jumlah bahan organik yang masuk ke perairan turut mempengaruhi keberadaan amonia. Peningkatan sisa pakan yang jatuh ke dasar danau, akan berpotensi meningkatkan konsentrasi amonia. Hal ini dapat diketahui dengan mengukur nilai COD (Chemical Oxygen Demand), yaitu jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan organik secara kimiawi, baik yang dapat didegradasi secara biologis (biodegradable) maupun yang sukar didegradasi secara biologis (non biodegradable) (Boyd 1979).
Keberadaan bahan organik dapat diindikasikan melalui kekeruhan perairan. Kekeruhan di Danau Lido meningkat seiring dengan bertambahnya kedalaman. Kekeruhan yang tinggi diakibatkan oleh partikel-partikel tersuspensi yang masuk ke dalam perairan. Partikel tersebut memiliki massa jenis yang lebih besar dari air, sehingga akan menuju kolom air yang lebih dalam dan mengendap di dasar perairan. Kekeruhan pada lokasi KJA Danau Lido di kedalaman kompensasi lebih besar dibanding lokasi non KJA (Amalia 2010). Hal ini mengindikasikan tingginya kandungan bahan organik di lapisan kompensasi KJA Danau Lido yang bersumber dari sisa pakan budidaya ikan.
Tingginya kandungan bahan organik di lapisan kompensasi tanpa disertai keberadaan oksigen terlarut mampu memicu proses dekomposisi bahan organik secara anaerob menghasilkan bahan toksik. Kandungan bahan organik di perairan dapat dikurangi dengan menerapkan aerasi pada lapisan hipolimnion seperti yang terjadi pada Situ Bojongsari (Hartoto 1995). Penurunan konsentrasi COD mengindikasikan telah terjadinya proses perombakan bahan organik secara aerob oleh mikroba dekomposer akibat peningkatkan konsentrasi oksigen terlarut (Uhlmann 1977 in Sudaryanti 1991).
2.4.4.Nitrit (NO2-N)
Keberadaan nitrit di perairan sangat sedikit dibandingkan nitrat. Nitrit bersifat tidak stabil, berkaitan dengan keberadaan oksigen. Nitrit mudah dioksidasi menjadi nitrat saat kondisi aerob. Pada air limbah, konsentrasi nitrit jarang melebihi 1,0 mg/l dan pada perairan alami jarang melebihi 0,1 mg/l (Irfim et al. 2008).
Berdasarkan hasil penelitian Amalia (2010), konsentrasi nitrit pada KJA Danau Lido sebesar 0,032 mg/l pada lapisan permukaan dan 0,021 mg/l pada lapisan
kompensasi (4,3-7,4 m). Konsentrasi nitrit meningkat pada lapisan hipolimnion yang anaerob serta pada danau yang menerima beban pencemaran bahan organik berat (Brezonik & Lee 1968; Overbeck 1968 in Wetzel 2001). Konsentrasi nitrit umumnya rendah pada kondisi perairan yang teroksigenasi, maksimum sebesar 10 µg/L pada bagian atas hipolimnion (Mortonson & Brooks 1980 in Wetzel 2001).
2.4.5.Nitrat (NO3-N)
Nitrat merupakan bentuk utama nitrogen di perairan alami dan merupakan nutrien utama bagi fotosintesis oleh organisme autotrof di perairan. Nitrat nitrogen sangat mudah larut dalam air dan bersifat stabil. Senyawa ini dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Kadar nitrat di perairan yang tidak tercemar biasanya lebih tinggi daripada kadar amonium. Kadar nitrat di perairan alami hampir tidak pernah lebih dari 0,1 mg/l. Kadar nitrat yang lebih dari 0,2 mg/l dapat mengakibatkan terjadinya eutrofikasi perairan, yang selanjutnya menstimulir pertumbuhan algae dan tumbuhan air secara pesat (blooming). Konsentrasi nitrat akan mengalami penurunan sejalan dengan bertambahnya kedalaman, karena tidak tersedianya oksigen terlarut di dasar perairan yang menyebabkan nitrifikasi tidak berjalan dengan baik (Simarmata 2007).
2.5. Proses Pembentukan Amonia di Perairan 2.5.1.Amonifikasi
Keberadaan amonia di perairan, selain bersumber dari ekskresi biota akuatik, juga terbentuk melalui proses amonifikasi. Amonifikasi merupakan proses pemecahan nitrogen organik (protein dan urea) dan nitrogen anorganik yang terdapat di dalam tanah dan air, yang berasal dari dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah mati) oleh mikroba dan jamur (Uhlmann 1977 in Sudaryanti 1990). Reaksi perubahan nitrogen organik menjadi amonia anorganik dalam proses amonifikasi berlangsung sebagai berikut:
CH2NH2COOH
-2H + H2O
NH3 + CHOCOOH
glisin amonia asam glioxylat
Tidak semua organisme autotrof mampu memfiksasi nitrogen secara langsung, sehingga nitrogen harus dikonversi menjadi amonia. Pada perairan yang aerob
banyak ditemui nitrat dan pada lokasi anaerob akan dijumpai akumulasi amonia (Novotny & Olem 1994). Amonifikasi terjadi baik pada lingkungan yang anaerob maupun lingkungan aerob, hal ini dibuktikan dengan melimpahnya keberadaan bakteri amonifikasi pada air limbah yang tidak diaerasi (Wielgosz et al. 2010).
Aerasi yang dilakukan di Situ Bojongsari menyebabkan penurunan jumlah bakteri amonifikasi. Hal ini disebabkan karena ketiadaan bahan organik yang berperan sebagai substrat bagi bakteri (Hartoto et al. 1995).
2.5.2.Denitrifikasi
Amonia juga dapat terbentuk melalui proses denitrifikasi yang merupakan proses reduksi secara biologis nitrat menjadi gas nitrogen oleh bakteri heterotrof fakultatif. Pada kondisi tidak ada oksigen, beberapa mikroorganisme dapat menggunakan nitrat atau nitrogen oksida sebagai sumber oksigen dan juga sebagai elektron dan akseptor hidrogen pada respirasi. Hal ini menyebabkan dekomposisi bahan organik dapat berlanjut saat oksigen terlarut di perairan tidak tersedia (Boyd 1998). Bakteri fakultatif memperoleh oksigen dengan cara mengambil oksigen yang terikat pada molekul nitrat. Beberapa jenis bakteri anaerob fakultatif, yaitu
Psedudomonas, Achromobacter, Escherichia, Bacillus, dan Micrococcus (Alexander 1961 in Wetzel 2001).
Denitrifikasi umumnya terjadi pada perairan dengan konsentrasi oksigen rendah seperti di lapisan hipolimnion danau eutrofik, dengan sedimen bersifat anoksik akibat melimpahnya bahan organik (Wetzel 2001). Ketika di perairan terjadi deplesi oksigen, nitrat menjadi sumber oksigen utama bagi organisme. Proses ini berjalan baik di bawah kondisi anoksik, yaitu dengan konsentrasi oksigen terlarut yang kurang dari 0,5 mg/l. Aerasi yang dilakukan di Situ Bojongsari menyebabkan penurunan jumlah bakteri denitrifikasi. Hal ini disebabkan karena aerasi mampu meningkatkan konsentrasi oksigen terlarut hingga lebih dari 4 mg/l (Hartoto et al. 1995).
Saat bakteri memutus ikatan nitrat untuk mendapatkan oksigen, nitrat akan direduksi menjadi dinitrogen oksida (N2O), hingga menjadi gas nitrogen. Gas nitrogen yang dihasilkan dari proses denitrifikasi akan menjadi sumber nitrogen di atmosfer (Gambar 2). Kondisi yang mempengaruhi efisiensi denitrifikasi adalah konsentrasi nitrat, kondisi anoksik, keberadaan bahan organik, pH, suhu, dan
alkalinitas. Nilai pH optimum bagi proses denitrifikasi berkisar antara 7,0-8,5. Pertumbuhan bakteri denitrifikasi semakin cepat pada suhu tinggi. Denitrifikasi dapat terjadi pada kisaran suhu 5-30 °C.
Gambar 2. Proses denitrifikasi (Boyd 1979)
2.5.3.Pelepasan dari sedimen
Amonia di perairan juga bersumber dari pelepasan NH4-N dari sedimen. Laju difusi NH4+ menyebar di perairan dapat meningkat beberapa kali lipat oleh aktivitas avertebrata bentik seperti larva chironomida, cacing tubificida, dan moluska bivalvia (Henriksen et al. 1983; Fukuhara & Sakamoto 1997; Fukuhara & Yasuda 1989; Svensson 1997 in Wetzel 2001). Peningkatan amonium juga diakibatkan oleh ekskresi dari empat spesies chironomida dan tubificida yang berkisar dari 0,33 hingga 2,87 µg N mg D/W/hari pada suhu 15 °C. Namun, jika cahaya mencapai sedimen pada jumlah cukup untuk mendukung pertumbuhan algae bentik, Cyanobacteria dapat mengasimilasi NH4-N dan mencegah aliran NH4-N dari sedimen ke perairan (Jansson 1980; Reuter et al. 1986; Risgaard-Petersen et al. 1994; Van Luijn et al. 1995 in Wetzel 2001).
2.6. Proses Penghilangan Amonia di Perairan 2.6.1.Volatilisasi (penguapan) dan pengendapan
Penghilangan amonia dapat terjadi secara fisika dan biologi. Secara fisika, amonia lepas dari sistem melalui proses volatilisasi (penguapan). Hal ini terjadi karena tekanan parsial gas amonia di perairan melebihi tekanan amonia di udara. Proses ini optimum pada pH 9 atau lebih. Amonia juga dapat lepas ke atmosfer dengan meningkatnya kecepatan angin dan suhu (Boyd 1998). Amonia (NH3) merupakan gas terbanyak yang menguap dari perairan (Novotny & Olem 1994).
NO3- (Nitrat) NO2- (Nitrit) NH3 (gas) (Amonia) N2O (gas) (Nitrogen oksida) N2 (gas) (Nitrogen)
Selain mengalami penguapan (volatilisasi), amonia juga berkurang karena sebagian hasil dekomposisi biota dan nitrogen organik dan anorganik mengendap permanen ke dalam sedimen (Wetzel 2001). Ion amonia memiliki afinitas (daya tarik) penyerapan pada partikel tanah (utamanya tanah liat dan fraksi organik) dan juga pada sedimen. Amonia yang terserap sedimen tidak termasuk sebagai nutrien utama dalam proses poduksi bahan organik dan sifatnya tidak toksik (Novotny & Olem 1994).
2.6.2.Nitrifikasi
Secara biologis amonia hilang akibat proses perubahan bentuk (imobilisasi) amonia ke dalam biomassa dan oksidasi amonia menjadi nitrat (Subagiyo et al.
2002). Dalam kondisi aerob (oksigen tersedia), proses amonifikasi akan dilanjutkan dengan proses nitrifikasi. Nitrifikasi merupakan oksidasi amonia menjadi nitrit dan nitrat (Novotny & Olem 1994). Proses nitrifikasi ditunjukkan dalam persamaan reaksi: NH4 ++3 2O2 𝑁𝑖𝑡𝑟𝑜𝑠𝑜𝑚𝑜𝑛𝑎𝑠 NO2−+ 2H++ H2O NO2−+1 2O2 𝑁𝑖𝑡𝑟𝑜𝑏𝑎𝑐𝑡𝑒𝑟 NO3−
Nitrifikasi merupakan proses penting dalam penghilangan amonia di perairan dan ini sangat menguntungkan bagi perikanan budidaya karena amonia berpotensi beracun. Proses ini tidak dapat dilepaskan dari peran mikroorganisme. Oksidasi amonia menjadi nitrit dilakukan oleh bakteri dari genus Nitrosomonas, sedangkan oksidasi nitrit menjadi nitrat dilakukan oleh bakteri dari genus Nitrobacter. Laju oksidasi amonia menjadi nitrit lebih cepat dibanding laju oksidasi nitrit menjadi nitrat, sehingga nitrit berada dalam jumlah sedikit (Novotny & Olem 1994).
Beberapa faktor dapat mempengaruhi laju reaksi nitrifikasi (Krenkel & Novotny 1980 in Novotny & Olem 1994). Faktor tersebut adalah sebagai berikut. - Reaksi berlangsung secara aerob. Jika konsentrasi oksigen lebih rendah dari 2
mg/l, laju reaksi akan menurun dengan cepat. Menurut Ravera (1990) in
Sudaryanti (1990), peningkatan oksigen terlarut menyebabkan penurunan amonia dan peningkatan nitrat. Untuk oksidasi amonia menjadi nitrit batas minimum bakteri hidup pada konsentrasi oksigen 0,08 mg/l, sedangkan untuk
oksidasi nitrit menjadi nitrat batas minimum bakteri dapat hidup pada konsentrasi oksigen 2 mg/l (Rheinhamer 1985 in Sudaryanti 1990).
- pH optimum berkisar antara 8-9, sedangkan jika pH di bawah 6 reaksi akan seketika terhenti. Pada pH 7 oksidasi amonia menjadi nitrit meningkat, sedangkan oksidasi nitrit menjadi nitrat lebih cepat pada pH asam (Moll 1983
in Sudaryanti 1990).
- Bakteri nitrifikasi cenderung menempel ke sedimen atau permukaan keras. - Laju pertumbuhan bakteri nitrifikasi lebih rendah dibanding laju pertumbuhan
dekomposer heterotrof. Jika konsentrasi bahan organik mudah urai tinggi, bakteri heterotrof akan membatasi pertumbuhan bakteri nitrifikasi, sehingga nitrifikasi akan terhambat.
- Suhu optimum berkisar antara 20-25 °C. Laju pertumbuhan menurun jika suhu kurang atau lebih dari suhu optimum.
Faktor yang paling penting bagi proses nitrifikasi adalah keberadaan bahan organik dan amonia itu sendiri. Ketika pada suatu perairan rasio C : N besar, maka akan mengakibatkan persaingan antara bakteri heterotrof dengan bakteri nitrifikasi dalam merebutkan amonia. Hal ini dapat menurunkan laju nitrifikasi (Strauss 2000). Peristiwa nitrifikasi dicirikan dengan penghilangan secara simultan amonia dan meningkatnya konsentrasi nitrat. Namun, penurunan konsentrasi amonia saja tidak cukup menggambarkan proses nitrifikasi karena tidak semua amonia yang lepas oleh proses dekomposisi di sedimen akan dikembalikan ke badan air. Sebagian amonia akan terserap ke sedimen dan sebagian lagi akan dimanfaatkan kembali untuk pertumbuhan makrofita di perairan dangkal (cahaya melimpah) di lokasi yang sesuai bagi pertumbuhannya. Proses simultan nitrifikasi-denitrifikasi hanya dapat terjadi di permukaan sedimen air. Nitrifikasi pada air mengalir jarang sekali terjadi (Tuffey, Hunter, & Matulewich 1974 in Novotny & Olem 1994).
Bakteri nitrifikasi banyak ditemukan di lokasi yang tersedia konsentrasi oksigennya. Jumlah bakteri terbatas, tergantung dari laju pertumbuhan sel dan juga rasio BOD5/N. Jika rasio BOD5/N sebesar 3 maka persentase organisme berkisar kurang dari 0,083 sedangkan jika rasio BOD5/N sebesar 5-9 maka persentase organisme sebesar 0,029-0,054 (Metcalf & Eddy 1991 in Sotirakou 1998). Waktu yang dibutuhkan untuk generasi bakteri Nitrosomonas sekitar 7-24 jam, sedangkan
bakteri Nitrobacter membutuhkan waktu lebih lama, yaitu 10-140 jam (Bock et al. 1991 in Strauss 2000). Amonia lepas pada kondisi anoksik karena kemampuan nitrifikasi di sedimen berkurang, sehingga asimilasi amonia oleh mikroorganisme anaerob berkurang (Beutel 2006).
2.7. Aerasi Hipolimnion
Rendahnya konsentrasi oksigen terlarut sering dijumpai di lapisan hipolimnion. Menurut Novotny & Olem (1994), salah satu cara untuk mengatasi permasalahan ini adalah dengan aerasi lapisan hipolimnion secara langsung. Aerasi hipolimnion merupakan salah satu teknik restorasi untuk melancarkan aliran nutrien di danau. Aerasi ini mampu meningkatkan konsentrasi oksigen terlarut di lapisan hipolimnion yang sering mengalami deplesi oksigen. Beberapa keuntungan dari aerasi hipolimnion di danau adalah mampu menurunkan konsentrasi racun seperti amonia, hidrogen sulfida, besi, dan mangan sehingga mampu mendukung kehidupan ikan di danau. Aerasi hipolimnion dapat mengurangi keberadaan nutrien dari dasar sedimen. Pengurangan nutrien di lapisan hipolimnion diyakini mampu mengurangi eutrofikasi di danau.
Restorasi perairan dengan sistem aerasi hipolimnion pertama kali dikembangkan di Switzerland pada akhir tahun 1940, di Jerman Barat pada tahun 1967, dan di Kanada pada tahun 1981. Pada tahun 1990, Puslitbang Limnologi LIPI telah melakukan aerasi hipolimnion dengan alat Limnotek 3.1 di Situ Bojongsari, Bogor (Sudaryanti 1990). Tujuan aerasi hipolimnion adalah untuk memperbaiki dan meningkatkan kualitas perairan (Ashley & Hall 1990 in Sudaryanti 1990).
Areasi hipolimnion dapat digunakan untuk meningkatkan konsentrasi oksigen terlarut di lapisan hipolimnion tanpa merusak stratifikasi suhu di danau. Sebuah pipa digunakan untuk membawa air dari lapisan hipolimnion ke permukaan. Air tersebut melakukan kontak dengan udara luar sehingga gas-gas seperti metan, hidrogen sulfida, dan karbon dioksida yang terakumulasi saat kondisi anaerob lepas. Setelah itu, air dikembalikan ke lapisan hipolimnion. Aerator hipolimnion memerlukan lapisan hipolimnion yang luas untuk dapat bekerja dengan optimal dan umumnya tidak efektif di danau yang dangkal dan waduk (Novotny & Olem 1994).
Akumulasi amonia erat kaitannya dengan kondisi anoksik di perairan (p<0,05). Hasil penelitian Satoh et al. (2002) menunjukkan bahwa perbaikan
lapisan anoksik merupakan cara yang dinilai mampu mengontrol akumulasi amonia hipolimnetik. Oksigenasi yang dilakukan sebaiknya mampu memperbaiki konsentrasi oksigen pada permukaan sedimen air untuk memastikan bahwa oksigen dapat tembus ke sedimen dan selanjutnya menghambat akumulasi amonia di lapisan hipolimnion danau (Beutel 2006).
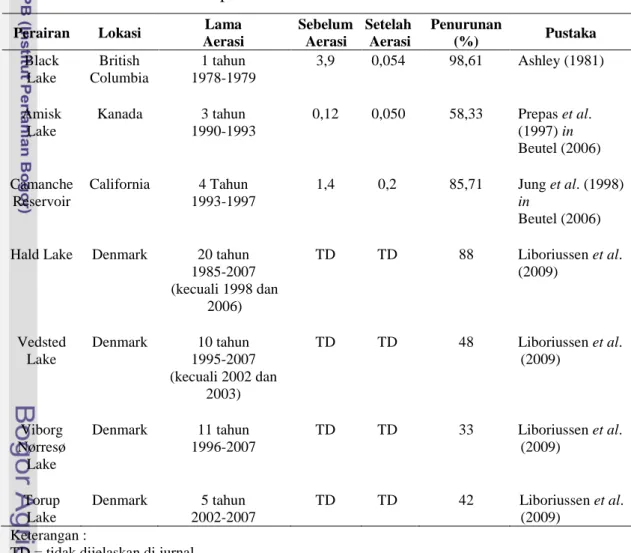
Aerasi hipolimnion yang dilakukan di beberapa perairan mampu meningkatkan konsentrasi oksigen dan berdampak pada penurunan konsentrasi amonia. Pada Tabel 1, dapat diketahui persentase penurunan konsentrasi amonia pada beberapa perairan setelah dilakukan aerasi hipolimnion (Beutel 2006).
Tabel 1. Penurunan konsentrasi amonia (mg/l) pada beberapa perairan setelah dilakukan aerasi hipolimnion
Perairan Lokasi Lama
Aerasi Sebelum Aerasi Setelah Aerasi Penurunan (%) Pustaka Black Lake British Columbia 1 tahun 1978-1979 3,9 0,054 98,61 Ashley (1981) Amisk Lake Kanada 3 tahun 1990-1993 0,12 0,050 58,33 Prepas et al. (1997) in Beutel (2006) Camanche Reservoir California 4 Tahun 1993-1997 1,4 0,2 85,71 Jung et al. (1998) in Beutel (2006) Hald Lake Denmark 20 tahun
1985-2007 (kecuali 1998 dan 2006) TD TD 88 Liboriussen et al. (2009) Vedsted Lake Denmark 10 tahun 1995-2007 (kecuali 2002 dan 2003) TD TD 48 Liboriussen et al. (2009) Viborg Nørresø Lake Denmark 11 tahun 1996-2007 TD TD 33 Liboriussen et al. (2009) Torup Lake Denmark 5 tahun 2002-2007 TD TD 42 Liboriussen et al. (2009) Keterangan :