BAB IV
PERTAHANAN TUBUH
PERTAHANAN TUBUH
PERTAHANAN TUBUH
PERTAHANAN TUBUH
Mikroorganisme yang menyebabkan penyakit pada manusia dan hewan masuk ke dalam tubuh dengan berbagai cara. Secara umum mikroorganisme yang dapat menimbulkan penyakit disebut patogen. Patogen yang telah masuk akan menimbulkan penyakit dengan pelbagai mekanisme. Segala macam mikroorganisme yang menginvasi vertebrata akan berhadapan dengan imunitas innate sebagai pertahanan pertama yang terjadi beberapa menit setelah infeksi. Imunitas adaptif akan timbul apabila pertahanan pertama ini tidak mampu mengeliminasi patogen yang masuk.
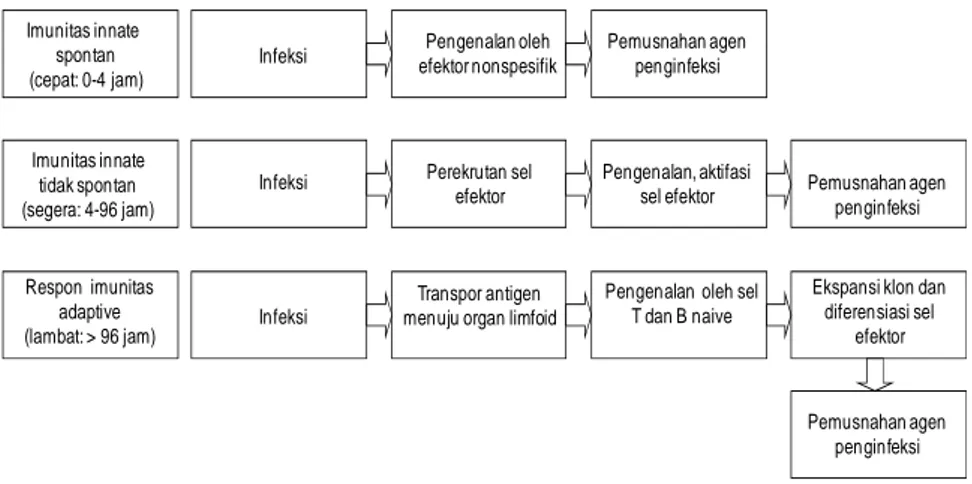
Imunitas innate spontan (cepat: 0-4 jam) Imunitas innate tidak spontan (segera: 4-96 jam) Respon imunitas adaptive (lambat: > 96 jam) Infeksi Infeksi Infeksi Pengenalan oleh efektor nonspesifik Perekrutan sel efektor Transpor antigen menuju organ limfoid
Pemusnahan agen penginfeksi
Pengenalan, aktifasi sel efektor
Pengenalan oleh sel T dan B naive
Ekspansi klon dan diferensiasi sel efektor Pemusnahan agen penginfeksi Pemusnahan agen penginfeksi
Gambar 24. Respon terhadap infeksi terdiri dari tiga fase. Fase tersebut adalah fase imunitas innate spontan, fase imunitas innate tidak spontan, dan fase imunitas adaptif. Dua fase pertama tidak memerlukan spesifikasi antigen, artinya semua antigen akan dikenali oleh sistem imun yang bekerja pada dua fase pertama ini. Fase ketiga adalah fase imunitas adaptif. Fase ini memerlukan reseptor yang spesifik yang terbentuk dari gene rearrangement. Imunitas adaptif bekerja pada fase akhir, sebab sangat sedikit sel B dan sel T yang mengenali antigen yang masuk. Sebelum sel B dan sel T berdiferensiasi menjadi sel efektor yang dapat mengeliminasi patogen, sel limfosit tersebut melakukan proliferasi.
Pertahanan pertama tidak dapat menuntaskan tugasnya antara lain karena besarnya jumlah invader yang masuk, cacat genetik, maupun lemahnya sistem pertahanan itu sendiri akibat kurang gizi. Sel-sel epitel pada permukaan tubuh mempunyai peran penting sebagai penghalang masuknya mikroorganisme dalam tubuh. Sekresi kelenjar minyak maupun keringat juga mempunyai peran dalam sistem pertahanan pertama. Makrofag dan neutrofil merupakan komponen selluler pertahanan pertama yang bersifat fagosit, sedangkan NK berperan sebagai sitotoksik pada pertahanan pertama. NK merupakan sel yang memiliki jalur sama dengan sel limfosit hanya saja tidak mempunyai antigen khusus yang dikenali pada targetnya. NK mengenali sel yang mengalami kanker dengan cara mendeteksi penurunan ekspresi molekul MHC.
Mamalia rentan terhadap infeksi patogen. Patogen pada awalnya mengadakan kontak dengan host, selanjutnya menyebabkan infeksi dan sakit pada host. Satu patogen dengan yang lain mempunyai perbedaan struktur yang sangat besar pada molekul permukaan dan cara melakukan infeksi, sehingga diperlukan strategi yang berbeda dalam tubuh host untuk melakukan sistem pertahanan. Garis pertama pertahanan tubuh telah tersedia dan siap menghalangi dan menolak invader setiap saat. Permukaan sel-sel epitel menyebabkan patogen tetap berada di luar dan sulit mengadakan penetrasi. Kulit misalnya, menghalangi penempelan patogen dengan cara menghasilkan enzim antimikrobia dan peptida. Kulit juga menghasilkan minyak yang dapat membunuh beberapa patogen. Virus, bakteri, dan parasit yang berhasil menjebolkan pertahanan pertama akan segera berhadapan dengan makrofag pada jaringan. Makrofag mempunyai reseptor permukaan yang dapat mengikat dan memfagosit bermacam-macam patogen. Peristiwa ini pada gilirannya akan menyebabkan respon inflamasi yang dapat menyebabkan terjadinya akumulasi protein plasma, termasuk komponen komplemen yang menjadi bagian humoral imunitas innate, dan aktivitas fagosit oleh neutrofil pada daerah infeksi. Imunitas innate merupakan garis pertahanan pertama yang secara langsung dapat bekerja nonspesifik jika ada patogen yang masuk. Imunitas innate ini tidak berubah kemampuannya jika pada waktu yang lain terinfeksi baik patogen yang sama maupun berbeda, karena tidak mempunyai memori setelah terjadinya infeksi. Kerja imunitas innate ini pada
innate tidak berhasil mengeliminasi agen penginfeksi, makrofag dan sel lain yang telah teraktivasi pada respon innate akan segera membantu inisiasi respon imunitas adaptif.
Pengenalan Antigen Oleh Sel B dan T.
Telah dijelaskan sebelumnya bahwa tubuh dipertahankan dengan imunitas innate, tetapi sistem tersebut hanya mengontrol patogen yang mempunyai susunan molekul tertentu atau patogen tersebut menginduksi tersintesisnya interferon atau molekul efektor lain. Imunitas innate tidak membentuk memori dan imunitas innate ini bekerja dengan reseptor yang dikode di dalam genom. Imunitas innate sangat penting untuk menjaga agar patogen tidak berkembang bebas di dalam tubuh, namun imunitas innate tidak memiliki sifat yang dimiliki inunitas adaptif. Imunitas adaptif memiliki memori yang bertahan dalam waktu sangat lama terhadap antigen spesifik. Untuk mengenali dan melawan patogen yang memiliki diversitas tinggi, limfosit sebagai komponen imunitas adaptif telah berkembang dan dapat mengenali diversitas yang tinggi dari antigen bakteri, virus, dan organisme penyebab penyakit lainnya. Molekul pengenalan sel B adalah imunoglobulin, Ig. Imunoglobulin diproduksi oleh sel B dalam keadaan yang sangat beragam sesuai dengan keragaman antigen. Setiap sel B memproduksi imunoglobulin tunggal. Imunoglobulin yang berada pada permukaan sel berfungsi sebagai reseptor sel untuk suatu antigen yang disebut B-cell receptor (BCR). Imunoglobulin disekresi dalam bentuk antibodi yang dihasilkan oleh sel plasma yaitu sel B yang teraktivasi. Sekresi antibodi yang mengikat patogen atau substansi beracun yang diproduksi patogen pada ekstraselluler, merupakan peranan utama sel B pada imunitas adaptif.
Antibodi merupakan molekul pertama yang diketahui terlibat pada pengenalan antigen secara spesifik. Molekul antibodi mempunyai dua peranan yang terpisah: pertama mengikat molekul patogen untuk meningkatkan respon imun, kedua untuk merekrut sel-sel imunokompeten dan molekul efektor lainnya ketika antibodi tersebut telah berikatan dengan targetnya. Sebagai contoh, ikatan antibodi pada virus akan memberikan reaksi netralisasi di samping memberi penanda pada virus tersebut agar mudah dikenali oleh sel fagosit dan komplemen. Dua fungsi tersebut terpisah pada molekul
antibodi, satu bagian terspesifikasi untuk mengenali dan mengikat patogen atau antigen, sedangkan bagian lain terlibat pada mekanisme efektor lain. Sisi ikatan pada molekul antigen mempunyai variasi yang sangat beragam yang selanjutnya dikenal sebagai daerah variabel. Keberagaman antibodi memungkinkan pengenalan antigen yang berbeda-beda, dan populasi keseluruhan (repertoire) antibodi yang terbuat pada setiap individu keragamannya demikian besar untuk memastikan bahwa setiap struktur antigen asing akan ada yang mengenali. Bagian antibodi yang terlibat untuk fungsi efektor pada sistem imun tidak mempunyai variasi sebagaimana bagian variabel sehingga bagian tersebut disebut bagian konstan. Bagian konstan ini memiliki lima bentuk utama, yang mana setiap bentuk berfungsi untuk mengaktifkan mekanisme efektor yang berbeda. Reseptor sel B yang berikatan dengan membran tidak mempunyai fungsi efektor, karena bagian konstan tetap berada di dalam membran sel B. Bagian konstan yang berada di dalam membran sel berfungsi mentransmisi signal yang menyebabkan sel B teraktivasi dan terjadinya ekspansi klon dan produksi antibodi spesifik, ketika variabel mengikat antigen yang spesifik. Molekul yang digunakan sel T untuk mengenal antigen merupakan protein yang terikat pada membran dan berfungsi sebagai pemberi signal pada sel T sehingga mengalami aktivasi. Molekul itu selanjutnya disebut reseptor sel T (T-cell receptor/TCR). TCR sangat dekat hubungannya dengan imunoglobulin baik pada struktur molekulnya yang mempunyai bagian variabel (V region) dan bagian konstan (C region) maupun pada mekanisme pembentukan diversitas molekul yang sangat tinggi. Namun demikian reseptor sel T mempunyai perbedaan penting dengan reseptor sel B, dimana reseptor sel T tidak dapat mengenali dan mengikat antigen secara langsung. Reseptor sel T hanya mengenali fragmen peptida pendek dari protein patogen yang terikat molekul MHC pada permukaan sel lain. Molekul MHC merupakan glikoprotein yang disandi oleh gen dalam klaster yang besar yang disebut major histocompatibility complex (MHC). Sifat khas molekul ini adalah adanya celah pada permukaan paling luar. Celah yang ada pada molekul MHC ini berfungsi untuk mengikat berbagai macam peptida. Pada suatu populasi molekul MHC mempunyai variasi genetik yang sangat tinggi. Pada setiap individu memiliki sampai 12 varian molekul MHC, sehingga
patogen. Reseptor sel T mengenali peptida patogen maupun sifat dari molekul MHC yang mengikat peptida itu. Pengenalan dengan cara ini memberikan dimensi patogen yang lebih spesifik pada TCR yang dikenal dengan istilah restriksi MHC (MHC restriction). Istilah ini sangat tepat karena semua reseptor sel T bersifat spesifik tidak saja pada peptida antigen asing, namun juga terkait kombinasi antara peptida dengan molekul MHC. Meskipun sel B dan sel T mengenali molekul asing dengan cara yang berbeda, namun kedua reseptor sel tersebut mempunyai struktur yang sama.
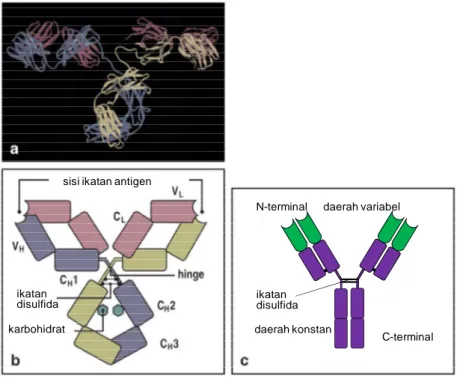
ikatan disulfida karbohidrat N-terminal C-terminal daerah variabel daerah konstan ikatan disulfida sisi ikatan antigen
Gambar 25. Struktur molekul antibodi. Panel (a) menggambarkan diagram pita yang didasarkan pada pengamatan kristallografi antibodi IgG, menunjukkan kerangka rantai polipeptida. Tiga protein globular membentuk struktur IgG menyerupai huruf Y. Dua sisi ikatan antigen terletak pada ujung kedua lengan yang diikatkan pada badan antibodi dengan ikatan yang sangat fleksibel. Panel (b) merupakan skema yang menjelaskan panel (a). Pada panel (b) ditunjukkan komposisi empat rantai dan domain yang menyususn tiap-tiap rantai. Panel (c) merupakan simplikasi skema molekul antibodi.
Struktur Molekul Antibodi.
Antibodi merupakan reseptor sel B yang disekresi, sehingga identik dengan reseptor sel B itu sendiri kecuali pada C-terminal dari bagian konstan rantai berat. Pada reseptor sel B, C-terminal pada membran berupa squence yang bersifat hidrofobik, dan pada antibodi C-terminal berupa squence yang bersifat hidrofilik yang memungkinkan terjadinya sekresi molekul tersebut. Antibodi bersifat terlarut dan disekresi dalam jumlah yang besar sehingga mudah diperoleh dan mudah dipelajari. Molekul antibodi secara garis besar digambarkan sebagi huruf ”Y”. Tiga skema struktur antibodi yang diperoleh dari sinar-X kristalografi diperlihatkan pada Gambar 21. Semua antibodi disusun dengan cara yang sama dari pasangan polipeptida rantai berat dan ringan dan secara umum protein itu dinamakan imunoglobulin. Secara umum imunoglobulin dibagi menjadi lima kelas yang berbeda yakni: IgM, IgD, IgG, IgA, dan IgE yang dapat dibedakan pada bagian konstannya (C region).
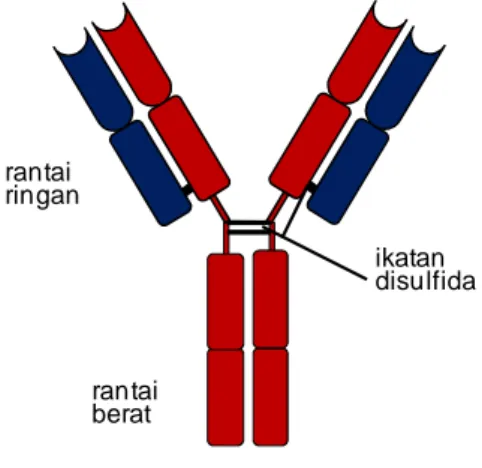
Gambar 26. Molekul
imunoglobulin terdiri dari dua tipe rantai protein yaitu rantai ringan dan rantai berat. Setiap molekul imunoglobulin tersusun atas rantai ringan dan rantai berat sebagaimana yang ditunjukkan pada gambar. Rantai ringan dan rantai berat dihubungkan dengan ikatan disulfida sehingga setiap rantai berat berikatan dengan rantai ringan dan dua rantai berat saling berikatan satu sama lain.
Antibodi IgG Terdiri Dari Empat Rantai Polipeptida.
Antibodi IgG merupakan molekul besar dengan berat molekul sekitar 150 kDa, terdiri dari dua rantai polipeptida yang berbeda. Rantai berat (rantai H) berkisar 50 kDa, sedangkan rantai
rantai ringan rantai berat ikatan disulfida
ringan (rantai L) berkisar 25 kDa. Setiap molekul IgG mempunyai dua rantai H dan dua rantai L. Dua rantai berat satu sama lain dihubungkan dengan ikatan disulfida, dan setiap rantai H dihubungkan dengan rantai L dengan ikatan disulfida. Pada setiap tipe molekul imunoglobulin, dua rantai H dan dua rantai L identik satu sama lain yang menjadikan molekul antibodi mempunyai dua sisi ikatan dengan antigen yang identik. Dua tipe rantai ringan yang dikenal dengan istilah rantai lamda (λ) dan kappa (ĸ) ditemukan pada antibodi. Imunoglobulin tertentu hanya memiliki salah satu rantai lamda (λ) atau kappa (ĸ), dan tidak pernah kedua-duanya ada bersama-sama.Tidak ditemukan perbedaan fungsi antara antibodi yang memiliki rantai lamda (λ) dan kappa (gen ĸ). Rasio rantai ringan lamda (λ) dan kappa (ĸ) berbeda-beda antara spesies satu dengan yang lain. Pada mencit rasio rantai lamda (λ) dan kappa (ĸ) 1 :20, sedangkan pada manusia 1 : 2 dan pada lembu 20:1. Rasio yang berbeda-beda ini sampai saat ini belum dapat dijelaskan. Distorsi rasio rantai lamda (λ) dan kappa (ĸ) terkadang dijadikan untuk mendeteksi adanya kelainan proliferasi klon sel B. Rantai lamda (λ) dan kappa (ĸ) diekspresikan dengan rasio identik pada semua sel B, sehingga kelebihan lamda (λ) pada manusia misalnya, menjadi indikasi adanya tumor yang bersal dari sel B yang memproduksi rantai lamda (λ). Kelas antibodi didasarkan pada struktur rantai berat. Ada lima kelas utama (isotipe) rantai berat, beberapa di antaranya mempunyai subtype, dan hal ini menentukan fungsi aktivitas molekul antibodi. Lima kelas utama imunoglobulin adalah imunoglobulin M (IgM), imunoglobulin D (IgD), imunoglobulin G (IgG), imunoglobulin A (IgA), dan imunoglobulin E (IgE). Masing-masing rantai beratnya ditandai dengan simbul berturut-turut (µ, δ, γ, α, dan ε). IgG merupakan imunoglobulin yang jumlahnya berlimpah dan mempunyai beberapa subkelas (pada manusia IgG1, 2, 3, dan 4). Fungsi yang berbeda dari imunoglobulin ditentukan oleh bagian ujung karbon rantai berat, dan sama sekali tidak terkait dengan rantai ringan. Secara umum sifat struktur dari seluruh isotipe sama, dan pada buku ini kita akan membahas IgG yang merupakan isotipe imunoglobulin paling banyak pada plasma.
Imunoglobulin Tersusun Atas Bagian Konstan dan Variabel.
Urutan asam amino rantai berat dan ringan dari suatu imunoglobulin telah diketahui dan menunjukkan dua sifat penting molekul antibodi. Pertama, masing-masing rantai terdiri dari urutan yang sama, meskipun tidak identik. Masing-masing tersusun atas 110 asam amino. Setiap pengulangan urutan asam amino berhubungan dengan kepadatan struktur protein yang menyusun setiap bagian imunoglobulin yang selanjutnya disebut domain. Rantai ringan tersusun oleh dua domain, sedangkan rantai berat IgG tersusun atas empat domain. Diduga rantai imunoglobulin berevolusi dengan mengadakan duplikasi gen yang awalnya berupa domain tunggal. Sifat penting kedua yang ditunjukkan oleh urutan asam amino terminal pada rantai ringan dan rantai berat adalah adanya perbedaan urutan asam amino yang sangat menyolok pada setiap antibodi yang dihasilkan oleh klon sel B yang berbeda. Asam amino terminal pada daerah variabel baik dari rantai ringan maupun berat (VL dan VH)
secara bersama-sama membentuk bagian V antibodi yang menentukan kemampuannya mengikat antigen spesifik. Domain konstan dari rantai ringan dan berat (CL dan CH) akan membentuk
bagian konstan (C region) antibodi.
Antibodi Dapat Dipecah Menjadi Fragmen Yang Tidak Kehilangan Fungsi.
Domain protein yang digambarkan di atas berhubungan satu sama lain membentuk domain globular. Suatu antibodi terdiri atas tiga protein globular yang mempunyai ukuran yang sama yang digabungkan oleh polipeptida yang disebut hinge region. Setiap lengan dari bentuk ”Y” dibentuk dari gabungan rantai ringan dengan amino terminal yang separuhnya berasal dari rantai berat. Badan ”Y” dibentuk dari bagian yang sama dari dua rantai berat. Gabungan rantai ringan dan berat berupa pasangan, contohnya domain VL dan
VH, demikian juga domain CH1 dan CL. Domain CH3 berpasangan
dengan domain yang sama-sama berasal dari rantai berat, sedangkan domain CH2 tidak berinteraksi satu sama lain. Pada domain CH2
dan VH pada ujung lengan ”Y”. Enzim proteolitik (protease) yang
dapat memecah urutan polipeptida digunakan untuk menganalisis molekul antibodi dan digunakan untuk menentukan fungsi bagian-bagian molekul tersebut. Pemecahan molekul antibodi dengan menggunakan protease papain akan menghasilkan tiga fragmen. Dua fragmen mempunyai sifat identik yang berfungsi sebagai sisi ikatan untuk antigen. Fragmen ini selanjutnya disebut fragmen Fab, yang menyatakan kependekan dari
F
ragmenta
ntigenb
inding. Fragmen Fab berupa dua lengan yang identik dari molekul antibodi. Fragmen Fab terdiri dari seluruh molekul rantai ringan berpasangan dengan domain VH dan CH1 dari rantai berat. Fragmen lain berupa molekul yang tidakmengandung sisi ikat terhadap antigen dan fragmen tersebut mudah menjadi kristal (crystallize readily) sehingga disebut fragmen Fc, yang menyatakan kependekan dari
F
ragmentc
rystallizable. Fragmen Fc merupakan pasangan domain CH2 dan CH3 dan merupakan bagianmolekul antibodi yang berinteraksi dengan molekul efektor dan sel. Perbedaan fungsi di antara isotipe rantai berat terletak pada fragmen Fc. Fragmen protein yang diperoleh setelah proteolisis ditentukan oleh letak pemutusan molekul antibodi oleh enzim proteolitik itu yang berhubungan dengan ikatan disulfida pada dua rantai berat. Ikatan disulfida itu terletak pada bagian hinge antara domain CH1 dan
CH2. Papain membelah molekul antibodi pada asam amino terminal
pada ikatan disulfida. Pembelahan dengan menggunakan papain akan menghasilkan dua lengan identik yang berupa fragmen Fab, sedangkan fragmen Fc carboxy-terminal dari rantai berat tetap lengket. Enzim proteolitik yang lain pepsin misalnya, mempunyai sisi pembelahan yang berbeda dari yang dilakukan papain. Secara umum pepsin melakukan pembelahan pada daerah yang sama dengan yang dilakukan papain namun bekerja pada carboxy-terminal dari ikatan disulfida. Pembelahan dengan enzim pepsin ini akan menghasilkan satu fragmen F(ab’) dimana dua lengan pengikat antigen itu tetap bersatu. Pada pembelahan dengan enzim pepsin rantai berat terbelah menjadi beberapa fragmen kecil. Fragmen F(ab’) mempunyai sifat yang sama sekali tidak berubah dengan ketika berada pada molekul antibodi yang utuh, namun tidak dapat berinteraksi dengan molekul efektor.
Pembelahan antibodi oleh enzim papain
Pembelahan antibodi oleh enzim pepsin
Fab Fab
Fc
(Fab’)2
pFc’
Gambar 27. Molekul antibodi yang berbentuk huruf Y dapat dipotong-potong dengan menggunakan enzim protease. Papain memotong molekul imunoglobulin menjadi tiga bagian: dua fragmen Fab dan satu fragmen Fc. Fragmen Fab berisi bagian V (variabel) yang berfungsi mengikat antigen. Fragmen Fc merupakan fragmen yang mudah menjadi kristal dan berisi bagian C (konstan). Pepsin memotong molekul imunoglobulin menghasilkan satu fragmen F(ab’)2 dan banyak fragmen kecil Fc. Fragmen paling besar disebut pFc’. F(ab’)2 ditulis dengan tanda kurung sebab berisi sedikit lebih banyak asam amino daripada Fab, termasuk sistein yang membentuk ikatan disulfida.
Rekayasa genetika sekarang memungkinkan membuat kontruksi bermacam-macam antibodi. Satu tipe yang penting adalah Fab yang hanya terdiri dari domain V dari rantai berat yang diikatkan dengan peptida sintetik pada domain V dari rantai ringan. Fragmen
Fragmen variabel. Molekul Fv berpotensi menjadi agen terapi karena ukurannya yang kecil sehingga memungkinkan menembus jaringan dengan mudah. Molekul semacam ini bisa digabungkan dengan protein toksin yang menghasilkan imunotoksin yang berpotensi untuk aplikasi klinik, misalnya pada terapi tumor jika molekul Fv spesifik untuk antigen tumor.
Imunoglobulin Bersifat Fleksibel Utamanya Pada Daerah Hinge.
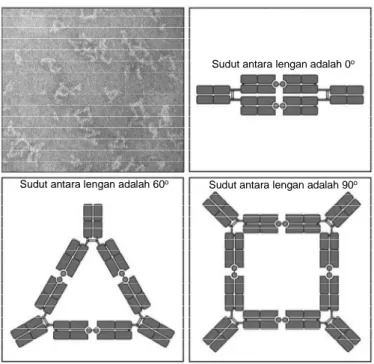
Daerah hinge yang menghubungkan fragmen Fc dan Fab pada molekul antibodi merupakan pengikat yang fleksibel, yang memungkinkan pergerakan bebas dari dua lengan Fab. Hal ini telah diperlihatkan dengan pengamatan mikroskop elektron pada pengamatan antibodi yang mengikat hapten. Hapten merupakan molekul kecil berukuran sebesar bagian khusus tirosin, yaitu sebesar sisi ikat pada rantai tirosin. Hapten dapat dikenali antibodi dan dapat menstimuli produksi antibodi antihapten jika hapten terikat pada protein besar (carrier). Antigen yang dibuat dari dua molekul hapten yang identik yang dihubungkan dengan ikatan yang pendek dan fleksibel dapat menggabungkan antibodi antihapten membentuk dimer, trimer, tetramer, dan seterusnya yang dapat diamati gengan mikroskop elektron. Bentuk susunan antibodi komplek dengan hapten yang bermacam-macam ini menunjukkan bahwa sisi hinge antibodi sangat fleksibel. Fleksibelitas juga ditemukan pada penghubung antara domain V dan C, yang memungkinkan pembengkokan dan rotasi domain V terhadap domain C. Fleksibelitas pada kedua sisi hinge dan penghubung V-C memungkinkan terjadinya ikatan dua lengan molekul antibodi terhadap targetnya dengan jarak yang bervariasi. Fleksibelitas pada daerah hinge juga memungkinkan antibodi berinteraksi dengan protein yang memediasi mekanisme kerja efektor.
Sudut antara lengan adalah 0o
Sudut antara lengan adalah 60o Sudut antara lengan adalah 90o
Gambar 28. Lengan antibodi dihubungkan dengan hinge yang fleksibel. Suatu antigen yang terdiri dari dua molekul hapten yang dapat melakukan ikatan silang (cross-link) pada sisi ikat yang terletak pada antibodi digunakan untuk membentuk komplek antigen:antibodi, dapat diamati dengan mikroskop elektron. Bentuk linier, segi tiga, dan segi empat dapat diamati. Sudut yang dibentuk antar lengan antibodi sangat bervariasi, yang menunjukkan bahwa hubungan antar lengan sangat fleksibel (sumber: Murphy, 2008)
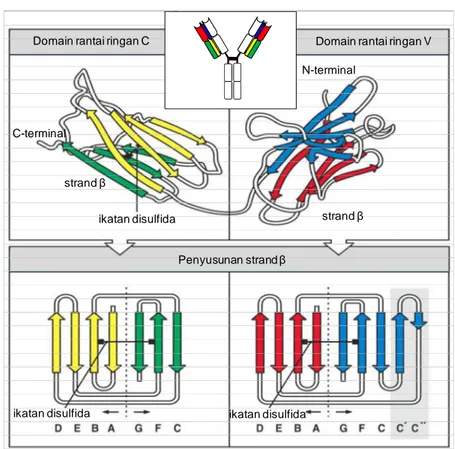
Domain Molekul Imunoglobulin Mempunyai Struktur Yang Mirip. Rantai ringan dan berat suatu imunoglobulin tersusun atas domain protein yang dapat dibedakan satu sama lain. Domain protein itu semuanya mempunyai struktur yang mirip. Didasarkan pada bentuk tiga dimensi ada perbedaan yang menyolok antara domain V dan C. Setiap domain terdiri dari dua helai β, yang merupakan elemen struktur protein yang terbentuk dari rantai polipeptida. Helai itu dilekatkan dengan jembatan disulfida yang membentuk struktur silinder, yang disebut tabung β. Perbedaan lipatan-lipatan pada struktur yang terjadi pada domain imunoglobulin diistilahkan imunoglobulin fold. Domain yang berbentuk silinder terbuka berfungsi untuk menunjukkan bagaimana rantai polipeptida melipat
untuk membentuk masing-masing helai β dan bagaimana rantai tersebut membentuk loops yang fleksibel dan dapat dengan mudah berganti arah. Perbedaan utama antara domain V dan C adalah bahwa domain V lebih besar dan mempunyai gulungan lebih banyak. Pada molekul imunoglobulin loop yang fleksibel dari domain V membentuk sisi ikatan dengan antigen. Banyak asam amino yang umumnya menyusun domain C dan V dari suatu rantai imunoglobulin menempati pusat pelipatan dan sangat penting untuk menjaga stabilitas imunoglobulin. Oleh karena itu, protein yang mempunyai urutan sama dengan yang ada pada imunoglobulin diduga membentuk domain yang sama dengan imunoglobulin. Dugaan tersebut selama ini telah dibuktikan dengan pengamatan menggunakan teknik crystallography. Domain yang mempunyai kemiripan dengan imunoglobulin itu banyak ditemukan pada protein yang terlibat pada sistem imun dan pada protein yang terlibat pada pengenalan pada sistem syaraf dan jaringan lain. Imunoglobulin dan reseptor sel T termasuk superfamili imunoglobulin. Molekul antibodi IgG tersusun atas empat macam rantai polipeptida, yang terdiri dari dari dua rantai ringan yang identik dan rantai berat yang identik pula. IgG membentuk struktur yang fleksibel menyerupai huruf “Y”. Setiap rantai dari keempat rantai yang ada mempunyai bagian variabel (V) pada ujung asam amino penyusunnya yang berfungsi sebagai sisi ikatan dengan antigen. Di samping bagian variabel pada setiap rantai ada bagian konstan (C) yang menentukan isotipe. Isotipe dari rantai berat menentukan fungsi dan sifat suatu antibodi. Rantai ringan berikatan dengan rantai berat dengan ikatan non-kovalen dan dengan ikatan disulfida. Bagian V dari rantai berat dan ringan membentuk pasangan yang menyusun kedua lengan antibodi sebagai sisi ikatan antigen yang terletak pada ujung lengan ”Y”. Dua lengan yang dimiliki molekul imunoglobulin memungkinkan terjadinya ikatan silang pada antigen (cross-link) dan dapat mengikat antigen lebih stabil. Bagian badan dari ”Y”, atau fragmen Fc tersusun atas domain carboxy-terminal dari rantai berat. Bagian lengan dan badan dari molekul imunoglobulin dihubungkan dengan bagian yang sangat fleksibel yang disebut bagian hinge. Fragmen Fc dan bagian hinge berbeda untuk setiap isotipe sehingga fungsinyapun berbeda. Namun demikian semua antibodi mempunyai kemiripan struktur, dimana setiap antibodi mempunyai bagian-bagian yang sama walaupun ada perbedaan pada beberapa urutan asam amino.
Domain rantai ringan C Domain rantai ringan V Penyusunan strand β ikatan disulfida N-terminal strand β C-terminal strand β
ikatan disulfida ikatan disulfida
Gambar 29. Domain konstan dan variabel imunoglobulin. Panel atas menunjukkan skema pelipatan struktur domain konstan (C) dan variabel (V) rantai ringan. Setiap domain berupa struktur berbentuk silinder dimana rantai polipeptida (strand β) bergerak dengan arah berlawanan (antiparallel) terpaket bersama membentuk dua lembar β (ditunjukkan dengan warna kuning dan hijau pada diagram domain C) yang dilekatkan bersama dengan ikatan disulfida. Cara rantai polipeptida melipat untuk membentuk struktur akhir dapat dilihat lebih jelas ketika lembar dibuka seperti yang terlihat pada panel bawah. Strand β diurutkan dengan abjad berdasarkan susunan urutan asam amino pada domain. Susunan setiap lembar β bersifat unik untuk setiap domain imunoglobulin. Strand β C’ dan C” ada pada domain V dan tidak ada pada domain C. Karakteristik susunan strand plus tiga-strand (tipe domain C) dan empat-strand plus lima-empat-strand (tipe domain V) merupakan model dasar pembentuk domain imunoglobulin, yang ditemukan pada seluruh protein penyusun antibodi maupun reseptor sel T.
Interaksi Antibodi Dengan Antigen.
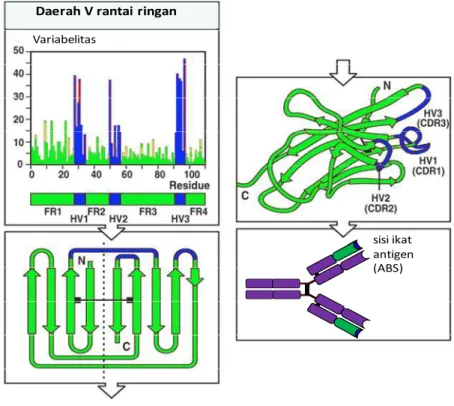
Sebelumnya telah dijelaskan struktur molekul antibodi dan bagaimana bagian V dari rantai ringan dan berat melipat dan berpasangan untuk membentuk sisi ikat antigen. Dalam bab ini akan dijelaskan berbagai macam cara antigen berikatan dengan molekul antibodi dan sekaligus menjawab pertanyaan bagaimana variasi urutan domain V dari antibodi dapat menentukan antigen spesifik. Bagian V dari molekul antibodi berbeda satu sama lain. Namun keragaman urutan asam amino dari bagian V molekul antibodi tidak terjadi pada seluruh segmen V, tetapi terfokus pada bagian tertentu dari domain itu. Distribusi asam amino pada daerah variabel dapat diamati pada
variability plot yang diilustrasikan pada Gambar 26. Pada gambar
tersebut urutan asam amino dari berbagai macam antibodi dibandingkan. Tiga segmen yang berbeda dari daerah variabel yang berasal dari domain VL dan VH dapat diidentifikasi. Segmen tersebut
ditunjukkan dengan daerah hipervariabel dan dinotasikan dengan HV1, HV2, dan HV3. Pada rantai ringan hipervariabel itu berasal dari residu urutan asam amino berturut-turut: 28-35, 49-59, dan 92-103. Bagian domain yang paling banyak berubah-ubah adalah HV3. Bagian domain V yang terletak di antara hipervariabel yang bersifat lebih permanen dan tidak banyak berubah adalah bagian kerangka (framework region). Pada setiap domain V ada empat bagian kerangka yaitu FR1, FR2, FR3, dan FR4. Bagian kerangka membentuk helaian β yang menyebabkan terbentuknya struktur rangka pada domain, dimana urutan asam amino pada hipervariabel berhubungan dengan tiga gelung pada tepi luar silinder β, yang berdampingan pada domain yang melipat. Keragaman urutan asam amino tidak saja terfokus pada tempat tertentu pada domain V, tetapi juga terlokalisasi pada tempat tertentu pada permukaan molekul. Jika domain VL dan VH berpasangan pada molekul antibodi, gulungan
hipervariabel dari masing-masing domain ikut bersama, membentuk hipervariabel tunggal pada ujung lengan molekul antibodi. Hipervariabel merupakan sisi ikat antigen (antigen-binding site/ ABS). Tiga gulungan hipervariabel menentukan spesifikasi suatu antigen pada molekul antibodi dengan cara membentuk komplementer permukaan antigen yang dikenal dengan istilah complementarity-determining region/CDR (CDR1, CDR2, dan CDR3). CDR dari domain VL dan VH berkontribusi membentuk
ABS, sehingga kombinasi rantai berat dan ringan yang menentukan spesifikasi terhadap antigen bukan salah satu rantai. Jadi, satu cara sistem imun membentuk antibodi yang mempunyai spesifikasi yang berbeda dengan cara membuat kombinasi yang berbeda pada rantai ringan dan berat pada bagian V. Cara menghasilkan keragaman ini dikenal dengan istilah combinatorial diversity.
Daerah V rantai berat Daerah V rantai ringan
V a ri a b e li ta s V a ri a b e li ta s
Gambar 30. Pada domain V terdapat daerah yang terpisah dari hipervariabel. Perbandingan urutan asam amino yang berasal dari domain rantai berat dan ringan menunjukkan adanya keragaman seperti yang terlihat pada plot. Pada setiap posisi asam amino tingkat variabelitas (keragaman) merupakan rasio perbedaan asam amino yang terlihat pada semua urutan (sequence) terhadap frekuensi asam amino yang paling sering keluar. Tiga daerah hipervariabel (HV1, HV2, dan HV3) diperlihatkan dan sering disebut complementarity-determining region (CDR1, CDR2, dan CDR3). Daerah tersebut diapit oleh daerah dengan keragaman rendah yang dikenal dengan nama framework region (FR1, FR2, FR3, dan FR4).
Ikatan Antibodi:Antigen Melalui Kontak Dengan Asam Amino Pada CDR, dan Tergantung Bentuk dan Ukuran Antigen.
Pada penemuan awal adanya ikatan antigen dengan antibodi, satu-satunya sumber antibodi monoklonal adalah sel tumor yang mensekresi antibodi. Antigen yang menyebabkan sel tumor mensekresi monoklonal antibodi masih belum diketahui, sehingga banyak sekali senyawa yang harus disekrining untuk mengidentifikasi ligan yang dapat digunakan untuk mempelajari ikatan antigen. Secara umum substansi yang ditemukan berikatan dengan antibodi adalah hapten seperti fosforilkolin atau vitamin K1. Analisis struktur antara
ikatan komplek antibodi dengan ligan hapten menjadi bukti langsung yang pertama bahwa hipervariabel membentuk antigen binding site (ABS), dan menunjukkan dasar struktural adanya spesifikasi antara antibodi dengan hapten-nya. Setelah penemuan pembuatan monoklonal antibodi, sekarang memungkinkan membuat monoklonal antibodi dengan berbagai macam spesifikasi untuk suatu antigen. Penemuan-penemuan itu dapat menjelaskan dengan detail bagaimana antibodi berinteraksi dengan antigen. Permukaan molekul antibodi yang terbentuk dari CDR rantai ringan dan berat yang berdampingan memunculkan terjadinya ABS. Urutan asam amino pada CDR berbeda pada antibodi yang berbeda, sehingga struktur ABS pun berbeda pada setiap antibodi yang berbeda. Secara umum diketahui bahwa antibodi akan mengikat ligan yang mempunyai permukaan komplementer dengan molekul antibodi itu, khususnya dengan ABS. Antigen kecil seperti hapten atau peptida pendek umumnya menempati celah antara domain V dari rantai ringan dan berat pada molekul antibodi. Antigen lain contohnya molekul protein yang ukurannya sama atau lebih besar dari antibodi itu sendiri tidak dapat menempati celah yang ada pada ABS. Dalam hal ini molekul pembentuk ABS yaitu VL dan VH memperluas permukaan melibatkan
Daerah V rantai ringan
sisi ikat antigen (ABS) Variabelitas
Gambar 31. Hipervariabel terletak terpisah pada struktur daerah V. Daerah hipervariabel yang berada pada struktur domain V dapat dilihat bahwa hipervariabel terletak pada suatu tempat dengan struktur yang terlipat. Pada molekul antibodi, pasangan rantai ringan dan berat masing-masing membawa hipervariabel dan membentuk hipervariabel tunggal. Hipervariabel tunggal inilah yang menyusun terjadinya antigen-binding site (ABS, sisi ikat antigen) yang terletak pada ujung lengan molekul antibodi.
Antibodi Mengikat Permukaan Antigen.
Fungsi biologi antibodi adalah untuk mengikat patogen dan produk yang dihasilkan patogen itu, dan untuk memfasilitasi pembuangan material tersebut dari tubuh. Antibodi secara umum mengenali bagian kecil saja dari molekul besar misalnya protein maupun polisakarida. Struktur yang dikenali antibodi ini biasanya disebut epitop atau antigenic determinant (AD). Beberapa patogen mempunyai selubung polisakarida. Pengenalan antibodi terhadap epitop yang berasal dari subunit gula sangat penting untuk melindungi
dapat membangkitkan sistem imun yang menghasilkan antibodi. Antibodi yang melawan virus mengenali protein selubung virus. Dalam hal ini, struktur yang dikenali antibodi itu terletak pada permukaan protein. Sisi yang dikenali antibodi itu tersusun dari asam amino dari bagian yang berbeda pada rantai polipeptida itu. AD seperti yang disebut di atas dikenal dengan istilah conformational atau
epitop diskontinyu, sebab struktur yang dikenali tersusun atas segmen protein yang diskontinyu dalam urutan asam amino antigen namun berada bersama pada struktur tiga dimensi. Sebaliknya epitop yang tersusun oleh segmen tunggal rantai polipeptida disebut kontinyu atau epitop liniar. Meskipun kebanyakan antibodi bekerja mengenali antigen secara utuh, dan merupakan protein yang mengenali epitop diskontinyu, namun beberapa hanya mengenali fragmen peptida protein. Sebaliknya, antibodi yang bekerja pada peptida suatu protein atau peptida sintetik yang mempunyai hubungan komplementer dengan antibodi itu biasanya dapat berikatan dengan protein alami. Sekarang telah mampu dibuat antibodi yang dibangkitkan dari peptida sintetik dengan tujuan membuat vaksin untuk melawan patogen.
Gambar 32. Antigen dapat berikatan dengan antibodi pada lekuk atau pada permukaan yang cukup luas pada ABS. Panel pada baris atas menunjukkan skematik yang mewakili sisi ikat pada fragmen Fab suatu
antibodi: kiri berbentuk kantung, tengah berbentuk lekukan, dan kanan berbentuk permukaan luas. Di bawahnya merupakan contoh masing-masing tipe. Panel a: mewakili interaksi antigen peptida kecil dengan komplementer-nya (CDR) yang ada pada fragmen Fab yang terlihat masuk pada ABS. ABS dilihat dari posisi atas dan samping. Panel b: komplek antibodi:HIV, peptida berikatan pada lekukan yang tersusun atas domain V dari rantai ringan dan berat. Panel c: komplek antibodi HyHe15:lisozim putih telur. Permukaan molekul lisozim dilapisi pada ABS. Secara keseluruhan enam CDR antibodi terlibat pada ikatan komplek HyHe15:lisozim (sumber: Murphy, 2008).
Interaksi Antigen-Antibodi Melibatkan Banyak Energi.
Interaksi antara antibodi dengan antigennya dapat diganggu dengan konsentrasi asam yang tinggi, pH ekstrim, detergen, dan juga oleh kompetisi epitopnya sendiri. Ikatan antibodi dengan antigen bersifat reversibel dan ikatannya berbentuk non-kovalen. Interaksi elektrostatik terjadi antara rantai asam amino bermuatan, sebagai bentuk jembatan garam. Interaksi juga terjadi antara muatan listrik yang mempunyai dua kutup berbeda, seperti pada ikatan hidrogen, atau dapat melibatkan ikatan van der Waals. Konsentrasi garam yang tinggi dan pH yang ekstrim dapat mengganggu ikatan antigen-antibodi dengan cara melemahkan interaksi elektrostatik dan atau melemahkan ikatan hidrogen. Pengetahuan ini diperoleh pada pemurnian antigen menggunakan antibodi yang diikat pada kolom, atau sebaliknya pemurnian antibodi. Interaksi hidrofobik terjadi ketika dua permukaan hidrofobik ada secara bersama-sama untuk menghindari air. Kekuatan interaksi hidrofobik sebanding dengan daerah permukaan yang tersembunyi dari air. Untuk beberapa antigen, interaksi hidrofobik dapat menggambarkan besarnya energi ikatan. Dalam suatu hal, molekul air terperangkap pada kantung-kantung pada bidang pemisah antara antigen dan antibodi. Molekul air yang terperangkap itu berkontribusi pada terjadinya ikatan antigen-antibodi, terutama antara kutup residu asam amino. Kontribusi energi pada keseluruhan interaksi sangat tergantung dengan antibodi dan antigen yang terlibat. Perbedaan yang menyolok antara interaksi antibodi:antigen dan interaksi protein:protein yang lain adalah bahwa antibodi mempunyai banyak asam amino aromatik pada ABS-nya, sedangkan pada interaksi protein:protein yang lain tidak demikian. Asam amino aromatik ini terutama berperan pada interaksi van der
Secara umum, ikatan van der Waals dan hidrofobik bekerja pada kisaran yang sangat pendek dan berperan untuk menarik secara bersama dua permukaan molekul yang saling komplementer satu sama lain. Jika yang satu merupakan celah yang lain harus bentukan pengisi celah itu agar terjadi ikatan yang cocok. Sebaliknya, interaksi elektrostatik antara sisi rantai yang bermuatan, dan ikatan hidrogen yang menghubungkan atom oksigen dan atau nitrogen mengakomodasi sifat khusus atau menghasilkan gugus reaktif dan menguatkan interaksi antigen:antibodi.
Ikatan non-kovalen
Asal
Gaya elektrostatik
Gaya tarik antar muatan yang berbeda
Ikatan hidrogen Hidrogen dipakai bersama
di antara atom
elektronegatif (N, O)
Gaya van der Waals
Fluktuasi awan elektron di
sekitar molekul
mempolarisasi atom-atom di dekatnya pada arah yang berlawanan
Gaya hidrofobik Golongan hidrofobik berinteraksi sangat lemah dengan air dan cenderung untuk mengumpul dan menolak molekul air. Gaya tarik guga melibatkan gaya van der Waals.
Gambar 33. Ikatan non-kovalen yang menggabungkan komplek antigen:antibodi. Sebagian besar ikatan antigen:antibodi menggunakan tenaga van der Waals. Ikatan kovalen tidak pernah terjadi antara antigen dengan antibodi alami. Ikatan kovalen antigen:antibodi hanya terbentuk setelah adanya modifikasi molekul antibodi.
Pada peristiwa ikatan lisozim dari putih telur dengan antibodi D1.3, ikatan hidrogen yang kuat terbentuk antara antibodi dan glutamin yang menjulur antara domain VH dan VL. Lisozim dari ayam
hutan dan burung kalkun mempunyai asam amino pada glutamin dengan tempat yang berbeda dan tidak dapat berikatan dengan antibodi D1.3. Pada komplek lisozim putih telur dengan antibodi HyHe15, dua jembatan garam antara dua basa arginin pada permukaan lisozim berinteraksi dengan asam glutamat, salah satu asam glutamat itu berasal dari gulungan VHCDR1 dan CDR2.
Lisozim yang tidak mempunyai satu dari dua macam arginin menunjukkan afinitas 1000 kali lebih rendah dari lisozim yang mempunyai kedua-nya. Meskipun adanya komplementer memegang peranan sangat penting pada interaksi antigen:antibodi, interaksi elekstrostatik dan ikatan hidrogen nampaknya menjadi penentu afinitas antibodi. Pada antibodi yang telah dipelajari dengan seksama menunjukkan bahwa hanya sedikit residu yang dapat memberikan kontribusi utama pada energi ikatan.
Gambar 34. Komplek lisozim dengan antibodi D1.3. Interaksi fragmen Fab D1.3 dengan lisozim putih telur ayam. Masing-masing bagian ditunjukkan pada gambar. Residu glutamin menonjol antara dua domain V dari ABS dan membuat ikatan hidrogen yang penting untuk terjadinya ikatan antigen-antibodi (sumber: Murphy, 2008). rantai ringan lisozim rantai berat residu glutamin
Analisis pada komplek antigen:antibodi menggunakan sinar X –kristalografi menunjukkan bahwa bagian hipervariabel (complementarity-determining regions) dari bagian V suatu imunoglobulin menentukan spesifikasi antibodi. Molekul antibodi melakukan kontak dengan antigen pada permukaan antigen yang membawa komplementer antibodi itu. Interaksi elektrostatik, ikatan hidrogen, gaya van der Waals, dan interaksi hidrofobik secara keseluruhan dapat mendukung terjadinya ikatan antigen dan antibodi. Rantai asam amino pada sebagian besar atau seluruh hipervariabel melakukan kontak dengan antigen dan menentukan baik spesifikasi maupun afinitas interaksi. Bagian lain dari V region memainkan peranan kecil pada kontak langsung dengan antigen namun memberi kontribusi atas stabilnya struktur kerangka hipervariabel di samping membantu penentuan posisi dan konformasi hipervariabel itu. Antibodi mengikat protein antigen pada permukaan protein melalui kontak dengan residu yang diskontinyu pada struktur molekul protein antigen itu. Antibodi juga dapat mengikat fragmen peptida yang berasal dari digesti protein, sehingga dapat digunakan untuk mendeteksi asal-usul protein. Peptida yang berikatan dengan antibodi menempati celah di antara bagian V rantai ringan dan berat, dimana peptida itu melakukan kontak dengan sebagian hipervariabel dan tidak perlu seluruh hipervariabel terlibat. Model di atas juga berlaku untuk mengikat antigen yang berupa karbohidrat dan molekul kecil seperti hapten. Ikatan antibodi dengan antigen pada aspek biologi mahluk hidup ditujukan untuk membantu eliminasi patogen yang menginfeksi.
Pengenalan Antigen oleh Sel T.
Tidak seperti imunoglobulin yang dapat berinteraksi dengan patogen dan juga bahan toksik yang dihasilkannya pada daerah ekstraselluler, sel T hanya dapat mengenali antigen asing yang telah dipresentasikan pada permukaan sel. Antigen itu dapat berasal dari virus patogen atau bakteri intraselluler yang melakukan replikasi di dalam sel. Antigen juga dapat berasal dari patogen atau produk dari potogen yang telah diinternalisasi sel dengan mekanisme endositosis.
Sel T dapat mendeteksi adanya patogen intraselluler setelah sel yang terinfeksi mempresentasikan fragmen peptida asing yang berasal dari protein patogen. Peptida asing ini diangkat ke permukaan sel oleh glikoprotein yang merupakan molekul khusus pada host yang fungsinya telah terspesialisasi. Glikoprotein ini disandi oleh gen yang sangat panjang yang pertama kali teridentifiaksi pada transplantasi organ. Glikoprotein ini mempunyai efek sangat kuat pada reaksi imunitas pada kasus transplantasi organ. Oleh karena itulah gen penyandi itu dinamakan major histocompatibility complex (MHC), dan glikoprotein yang mengikat peptida itu disebut molekul MHC. Pengenalan antigen dalam bentuk fragmen peptida kecil yang terikat oleh molekul MHC dan dipresentasikan pada permukaan sel merupakan ciri khusus yang dimiliki sel T dan tidak pada sel B. Sel T mempunyai reseptor (TCR~T cell receptor) yang sangat besar variasinya sehingga sel T dapat diandalkan perannya dalam membantu eliminasi berbagai macam patogen. Struktur gen yang menyandi TCR mempunyai hubungan yang sangat dekat dengan gen yang menyandi molekul antibodi. Namun demikian ada perbedaan yang sangat penting antara TCR dan imunogobulin yang terefleksi pada cara pengenalan antigen oleh TCR, dan TCR tidak pernah menjadi molekul efektor sebagaimana yang terjadi pada molekul imunoglobulin.
Reseptor Antigen Sel T Mirip Fragmen Fab Pada Imunoglobulin. Reseptor sel T pertama kali diidentifikasi dengan antibodi monoklonal yang mengikat satu macam klon sel T dan tidak mengikat klon yang lain. Antibodi itu dapat menghambat secara spesifik pengenalan antigen oleh klon itu, atau antibodi itu secara spesifik mengaktifkan klon tersebut. Antibodi dapat digunakan untuk menentukan fungsi protein tertentu yang telah dibentuk dari hasil ekspresi suatu gen. Dalam hal ini diketahui bahwa beberapa antibodi dapat bersifat sebagai agonist, artinya ketika antibodi berikatan dengan molekul targetnya akan terjadi perubahan konformasi pada ikatan itu sehingga terbentuk signal transduksi yang mengaktifkan gen
sehingga terjadi transkripsi dan selanjutnya translasi. Contoh antibodi agonist ini adalah anti-CD3. Ikatan anti-CD3 terhadap molekul CD3 dapat digunakan untuk mengaktifkan sel T, yaitu berperan mengganti interaksi TCR dengan MHC:peptida, apabila peptida spesifik itu tidak diketahui. Sebaliknya, antibodi dapat bersifat sebagai antagonist, yaitu menghambat terjadinya ikatan reseptor dengan ligannya, karena reseptor yang pada keadaan normal akan berikatan dengan ligannya telah diblok oleh antibodi itu dengan ikatan yang spesifik. Ikatan antibodi pada reseptor ini dapat menghambat fungsi alami ligan:reseptor. Antibodi dengan berbagai macam sifat ini (clonotypic) akhirnya dapat digunakan untuk menunjukkan bahwa setiap sel T mempunyai TCR kurang lebih sebanyak 30.000 molekul yang presis sama pada permukaan sel. Setiap reseptor terdiri dari dua rantai polipeptida yang berbeda yakni T-cell receptor α (TCRα) dan β (TCRβ) yang dihubungkan dengan ikatan disulfida. Heterodimer α:β mempunyai struktur yang sangat mirip dengan fragmen Fab molekul imunoglobulin dan berperanan sebagai molekul pengenalan antigen pada sebagian besar sel T. Ada grup kecil sel T yang memiliki reseptor dengan rantai yang berbeda dengan heterodimer α:β. Rantai tersebut berupa polipeptida yang ditandai dengan γ dan δ. Reseptor sel T yang berupa γ:δ mempunyai sifat pengenalan antigen yang berbeda dengan TCR α:β, dan fungsi sel T yang membawa reseptor γ:δ belum semuanya diketahui. Pada buku ini istilah TCR terkait dengan heterodimer α:β, kecuali secara khusus disebutkan γ:δ. TCR mempunyai perbedaan dengan imunoglobulin yang ada pada membran sel B. TCR hanya memiliki satu sisi ikat antigen, sedangkan reseptor sel B (BCR, B-cell receptor) mempunyai dua sisi ikat antigen. Perbedaan lain adalah bahwa TCR tidak pernah disekresikan sedangkan BCR disekresikan dalam bentuk antibodi. Pengkajian struktur dan fungsi TCR α:β berasal dari studi cDNA yang menyandi rantai TCR α:β. Urutan asam amino yang diprediksi dari cDNA yang menyandi TCR α:β menunjukkan dengan jelas bahwa kedua rantai α dan β mempunyai bagian variabel (V) yang homolog dengan domain V yang ada pada rantai imunoglobulin. Rantai α:β juga mempunyai daerah konstan (C) yang homolog dengan domain C yang ada pada
rantai imunoglobulin di samping terdapat bagian hinge pendek yang terdiri dari residu sistein penyusun ikatan disulfida. Setiap rantai α:β menancap pada lipid bilayer dengan domain protein transmembran yang bersifat hidrofobik dan rantai (ekor) yang menembus sampai sitoplasma. TCR dalam bentuk tiga dimensi telah ditemukan. Struktur TCR pada dasarnya sama dengan fragmen Fab pada molekul antibodi. Lipatan rantai TCR mempunyai pola yang sama dengan fragmen Fab pada imunoglobulin meskipun pada akhirnya strukturnya nampak lebih pendek dan lebih luas. Namun ada perbedaan pada TCR dengan fragmen Fab. Perbedaan yang paling jelas antara keduanya bahwa pada TCR domain Cα tidak melipat sebagaimana yang terjadi pada rantai imunoglobulin. Separuh domain yang sejajar dengan domain Cβ membentuk alas β sama seperti yang terdapat pada imunoglobulin, namun separuh domain yang lain terbentuk dari gulungan yang renggang dan segmen α heliks yang pendek. Ikatan disulfida intramolekul yang pada imunoglobulin normalnya menggabungkan dua strand β, pada domain Cα menggabungkan strand β pada segmen α heliks.
Infeksi.
Penyakit infeksi hanya akan terjadi apabila pertahanan pertama (pertahanan innate) tidak dapat mengatasi patogen yang masuk. Tubuh kita selalu terpapar oleh mikroorganisme yang berada pada lingkungan kita di samping patogen yang telah ada di dalam tubuh akibat infeksi sebelumnya. Sel-sel epitel baik eksternal maupun internal merupakan tempat bertemunya agen penginfeksi pada tubuh kita. Mukosa sepanjang saluran pernafasan merupakan jalan masuk mikroorganisme akibat adanya kontaminasi udara yang kita hirup. Mukosa pada saluran pencernakan merupakan jalan masuk mikroorganisme yang berada pada makanan maupun air yang kita minum. Adanya luka dan gigitan serangga memungkinkan terjadinya penetrasi mikroorganisme melalui kulit. Demikian juga sentuhan langsung antar individu juga memberikan peluang terjadinya infeksi melalui kulit maupun alat reproduksi.
Rute Infeksi Patogen
Rute masuk Cara
penyebaran Patogen Penyakit Permukaan Mukosa Lintasan Udara Partikel terhidup oleh pernafasan Virus Influenza Neisseria miningitidis Influenza Meningococca l meningitis Sistem pencernakan
Air atau makanan yang terkontaminasi Salmonela typhi Rotavirus Tipus Diarrhea
Sistem reproduksi Kontak fisik Treponema palium
Syphilis
Epitel eksternal
Permukaan luar Kontak fisik Tinea pedis Athlete’s foot
Luka dan lecet
Lecet kecil kulit Luka tertusuk Menangani hewan terinfeksi Bacillus anthracis Clostridium tetani Pasteurella tularensis Anthrax Tetanus Tularemia Gigitan serangga Gigitan nyamuk (Aedes aegypti) Gigitan serangga Gigitan nyamuk (Anopheles) Flavivirus Borrelia burgdorferi Plamodium spp Demam kuning Penyakit lyme Malaria
Gambar 35. Patogen dapat menginfeksi melalui berbagai macam rute.
Pada kenyataannya walaupun tubuh kita selalu terpapar oleh berbagai macam mikroorganisme kejadian infeksi sangat jarang. Hal ini menunjukkan bahwa sel-sel epitel tubuh merupakan penghalang yang efektif terhadap masuknya mikroorganisme. Apabila sel-sel epitel mengalami luka, sel-sel tersebut akan segera terganti dengan
cepat. Faktor lain yang menyebabkan rendahnya terjadi penyakit infeksi adalah berjalannya imunitas innate jika invader berhasil menerobos masuk jaringan. Rendahnya terjadinya infeksi ini menunjukkan betapa besar jumlah patogen yang tereliminasi setiap saat pada tubuh kita. Apabila patogen yang berhasil masuk pada tubuh kita sangat kuat atau sangat banyak akan memungkinkan patahnya pertahanan innate dan akan terjadi infeksi yang bersifat lokal dan selanjutnya bisa menyebar ke tempat lain. Penyebaran patogen selalu menimbulkan respon inflamasi yang disertai perekrutan sel-sel imunokompeten di samping molekul-molekul efektor yang berguna untuk tujuan eliminasi patogen itu. Imunitas innate yang diinduksi oleh suatu patogen akan berlangsung selama beberapa hari dan dapat mulai bekerja beberapa menit setelah patogen masuk, sedangkan imunitas adaptif akan dimulai saat antigen dipresentasikan pada daerah limfoid periferal misalnya pada lymph node dan spleen. Imunitas adaptif bersifat spesifik, artinya setiap klone sel tertentu hanya bertanggung jawab pada satu macam antigen. Imunitas adaptif merupakan pertahanan yang sangat penting karena menyisakan sel-sel memori yang sangat berguna apabila pada waktu yang berbeda terjadi infeksi lagi oleh patogen yang sama. Sel-sel memori mempunyai respon yang sangat kuat dan cepat terhadap invader yang pernah datang sebelumnya, sehingga mampu mengatasi invader dalam jumlah yang besar.
PELEKATAN PADAEPITEL INFEKSI LOKAL, PENETRASI PADA EPITEL
INFEKSI LOKAL PADA JARINGAN
IMUNITAS ADAPTIF
PERLINDUNGAN TERHADAP INFEKSI
Agen penginfeksi dibersihkan oleh antibodi spesifik, aktivasi makrofag oleh pengaruh sel T dan
sel T killer Komplemen
Fagosit, sitokin, sel NK Aktivasi makrofag Sel dendritik bermigrasi ke
lymph node untuk memulai imunitas adaptif Flora normal
Faktor kimia lokal Fagosit (terutama pada paru)
Penyembuhan luka diinduksi Protein dan peptida antimikrobia, fagosit, dan komplemen menghancurkan
mikroorganisme yang menginfeksi Aktivasi sel T
Gambar 36. Infeksi dan responnya dapat dibagi menjadi beberapa tahapan. Pada gambar ini diilustrasikan mikroorganisme penginfeksi yang masuk melalui luka pada kulit. Agen penginfeksi pertama kali harus melekat pada sel epitel dan menembus sel itu. Sistem imun innate lokal dapat mencegah invader menetap ditempat itu dengan cara mengeliminasi. Imunitas innate juga dapat menahan penginfeksi. Imunitas innate dapat membawa agen penginfeksi menggunakan sel dendritik dan masuk pada lymph node terdekat. Sesampainya sel dendritik yang membawa agen penginfeksi pada lymph node, akan terjadi inisiasi imunitas adaptif yang berakhir dengan pembersihan host dari agen penginfeksi. Peranan sel T γδ pada mekanisme ini belum terjelaskan.
Garis Pertahan Pertama.
Sel-sel epitel yang melapisi tubuh kita baik eksternal maupun internal merupakan bagian yang sangat penting sebagai garis pertahanan pertama. Sel-sel tersebut sebagai penghalang antara lingkungan yang banyak mengandung patogen dengan jaringan yang berada di bawah epitel itu. Sel-sel epitel satu dengan yang lain dihubungkan oleh pengikat ”tight junction’ yang sangat kuat dan rapat sehingga berfungsi sebagai penghalang yang kedap terhadap lingkungan di luarnya. Sel epitel menyusun kulit dan seluruh organ yang berongga (tubular), misalnya saluran pencernakan, saluran pernafasan, dan saluran reproduksi. Infeksi hanya akan terjadi apabila pertahanan pertama ini berhasil dipatahkan oleh agen patogen. Kulit kita berupa permukaan yang kering dan memiliki keratin yang kedap sehingga relatif kuat menghalangi masuknya agen-agen patogen. Pada umumnya agen-agen patogen masuk dan menginfeksi tubuh melewati
epitel internal dan luka pada permukaan kulit. Pentingnya epitel sebagai sistem pertahanan dapat dilihat dari kejadian luka bakar dan luka operasi. Pada dua kejadian ini infeksi bahkan sepsis menjadi penyebab utama mortalitas dan morbiditas (kematian dan penderitaan). Dalam keadaan normal tanpa luka, pada umumnya patogen menembus sel epitel dengan berikatan dengan molekul di permukaan sel epitel internal. Ikatan yang spesifik antara patogen dengan molekul yang ada di permukaan sel epitel internal memungkinkan patogen menginfeksi sel epitel itu bahkan merusaknya sehingga sel-sel epitel sebagai pertahanan pertama dapat dijebol. Pada patogen yang telah membuat koloni, ikatan patogen dengan molekul permukaan sel epitel mencegah tersapunya patogen baik oleh udara maupun cairan yang melewati permukaan epitel itu. Sel-sel epitel internal dikenal dengan dengan sebutan mucosal epitelia sebab sel-sel tersebut mensekresikan mucus yaitu suatu cairan yang kental dan lengket. Mucus mengandung bermacam-macam glikoprotein yang disebut mucin. Pada dasarnya kesempatan mikroorganisme untuk mengadakan penetrasi pada epitel internal ini sangat kecil karena mucus akan menyelubungi mikroorganisme itu, dan pada saluran pernafasan mikroorganisme dapat disapu oleh mucus yang digerakkan dengan kuat oleh silia sel epitel. Diri kita telah didesain sangat sempurna oleh Allah, Tuhan seluruh makhluk. Hanya orang yang paling celaka yang mengingkari desain yang teramat sempurna ini. Bersin merupakan satu contoh agar mikroorganisme yang berada di permukaan epitel internal tidak berhasil mengadakan penetrasi melalui ikatan molekul permukaan. Kontraksi mendadak pada proses bersin akan memukul keluar atau melepaskan mikroorganisme yang berusaha mengadakan ikatan dengan sel epitel internal. Pentingnya cairan mucus dalam membersihkan agen-agen penginfeksi dapat diketahui pada individu yang kehilangan kemampuan memproduksi mucus maupun lemahnya pergerakan silia. Individu semacam itu akan menunjukkan fakta mudahnya terjadi infeksi pada paru-paru oleh bakteri yang mengadakan koloni pada permukaan sel-sel epitel. Pada usus gerakan peristaltik tidak saja penting untuk menggerakkan makanan namun juga untuk menghindari ikatan mikroorganisme secara konstan dan bahkan
ini sangat lemah bakteri pada daerah lumen akan mengalami perkembangan sangat pesat dan memperbesar peluang terjadinya infeksi pada saluran pencernakan. Permukaan sel epitel tidak saja merupakan penghalang fisik bagi agen-agen penginfeksi, namun sel-sel tersebut juga mensekresi substansi kimia yang bersifat antimikrobia atau mampu menghambat perkembangan bakteri. Enzim lisosom merupakan enzim antibakteri yang disekresi oleh kelenjar salifa dan kelenjar air mata. Lambung yang mempunyai kondisi keasaman dengan pH yang sangat rendah demikian juga alat pencernakan bagian atas dapat dijadikan penghalang terjadinya suatu infeksi. Sel Paneth yang terletak pada dasar crypt pada usus halus menghasilkan antibakteri dan anti jamur yaitu cryptidin atau α-defensin. Sel Paneth tepatnya berada di bawah epithelial stem cells. Antimikrobia lain yang berupa peptida, β-defensins, dibuat pada epitel lain, terutama pada kulit dan sepanjang saluran pernafasan. Peptida antimikrobia mempunyai peranan pada sistem pertahanan, termasuk imunitas pada gigitan serangga. Peptida-peptida yang disebut di atas umumnya bersifat kation yang dapat membunuh bakteri dengan merusak membran sel. Tipe antimikrobia lain dapat berupa protein yang disekresi ke dalam cairan yang melapisi permukaan epitel pada paru-paru. Cairan tersebut berisi dua macam protein yakni protein A dan D yang mampu berikatan dan melingkupi patogen. Pengikatan dan pelingkupan patogen tersebut memudahkan kerja makrofag untuk memfagositnya. Makrofag umumnya meninggalkan jaringan subepitelial dan masuk alveoli paru-paru. Penyelubungan partikel dengan protein untuk memfasilitasi proses fagositosis disebut opsonisasi. Selain pertahanan yang telah disebutkan sebelumnya, kebanyakan permukaan epitelial bersentuhan dengan flora non-patogen yang berkompetisi dengan mikroorganisme patogen dalam perolehan nutrisi maupun domisili pada permukaan sel. Flora normal dapat menghasilkan zat antimikrobia seperti colicins berupa protein yang diproduksi oleh Escherichia coli. Colicins melindungi permukaan sel dari pembentukan koloni oleh bakteri lain. Apabila bakteri non-patogen mati akibat pengaruh antibiotika, maka bakteri patogen akan menggantikan posisinya dan menimbulkan penyakit.
Peranan Epitel Sebagai Penghalang Infeksi Mekanik Sel epitel disatukan dengan tight juction
Aliran udara dan cairan menembus epitel Pergerakan mukus oleh silia
Kimia Asam lemak (kulit)
Enzim: Lisosom (saliva, keringat, air mata) pepsin (usus)
Peptida antibakteri; defensin (kulit, usus); cryptidins (intestin)
Mikrobiologi Flora normal berkompetisi dengan bakteri patogen untuk memperoleh makanan dan melekat pada epitel dan dapat menghasilkan substansi antibakteri
Gambar 37. Permukaan epitel merupakan pelindung mekanik, kimia, dan penghalang langsung bagi agen penginfeksi.
Fagositosis.
Makrofag akan segera mengenali mikroorganisme yang berhasil menembus epitel. Makrofag umumnya menempati jaringan-jaringan dan segera mengeliminasi mikroorganisme yang berusaha mengadakan penggandaan. Makrofag merupakan bentuk dewasa monosit yang meninggalkan sirkulasi darah dan menempati jaringan-jaringan di seluruh tubuh. Makrofag ditemukan dalam jumlah yang banyak pada jaringan-jaringan pengikat, terutama pada alat pencernakan, interstitium dan alveoli paru-paru, sepanjang pembuluh darah tertentu pada hati yang dikenal dengan nama sel Kupffer, pada seluruh jaringan limpa yang berperan untuk menghancurkan sel darah yang sudah tua. Makrofag dikenal sebagai fagosit mononuklear. Fagosit kedua yang sangat penting adalah neutrofil. Neutrofil merupakan fagosit polimorfonuklear yang mempunyai umur pendek dan sangat besar jumlahnya pada darah namun tidak ditemukan pada jaringan individu normal. Baik makrofag maupun neutrofil kedua-duanya sangat penting pada imunitas innate karena kekedua-duanya dapat melakukan pengenalan nonspesifik, menelan, dan menghancurkan patogen tanpa memerlukan bantuan sistem imunitas adaptif. Makrofag merupakan sel pertahanan yang pertama kali bertemu antigen pada suatu jaringan namun segera diperkuat dengan rekrutmen neutrofil dalam jumlah besar pada sisi infeksi.
Makrofag dan neutrofil mengenali patogen dengan menggunakan reseptor pada permukaan sel yang dapat membedakan antara antigen asing dan self-antigen. Reseptor mannosa yang terdapat pada makrofag tidak terdapat pada monosit atau neutrofil. Reseptor scavenger yang mengikat ligan-ligan bermuatan dan CD14 yang merupakan reseptor lipopolysacharide (LPS) bakteri ditemukan baik pada makrofag maupun monosit. Patogen dapat berinteraksi dengan makrofag dan neutrofil melalui reseptor komplemen yang berada pada kedua sel tersebut. Sistem komplemen dapat teraktivasi dengan cepat oleh adanya infeksi dan membentuk protein komplemen yang berfungsi mengopsonisasi patogen yang masuk jaringan. Ligasi reseptor permukaan yang berada pada permukaan sel fogosit dengan patogen menyebabkan terjadinya proses fagositosis yang diikuti kematian patogen akibat reaksi enzim proteolitik. Fagositosis merupakan proses aktif, dimana patogen yang terikat segera dikelilingi oleh membran sel fagosit dengan penjuluran sitoplasma dan segera diinternalisasi ke dalam vesikel bermembran yang disebut fagosom. Di samping bersifat fagosit makrofag dan neutrofil mempunyai granula lisosom yang berisi enzim, protein, dan peptida yang memperantarai respon antimikrobia intraselluler. Fagosom dapat mengadakan fusi dengan beberapa lisosom membentuk fagolisosom. Pada fagolisosom ini kandungan lisosom dikeluarkan untuk menghancurkan patogen. Selama proses fagositosis, makrofag dan neutrofil menghasilkan molekul toksik untuk membantu pembunuhan mikroorganisme yang ditelan oleh sel-sel tersebut. Molekul toksik yang paling penting adalah hidrogen peroksida (H2O2), anion superoxide (O2
-), dan nitric oxide (NO), yang
langsung meracuni bakteri. Produk-produk toksik tersebut dihasilkan oleh oksidasi NADPH yang berada pada lisosom dan enzim lain melalui proses yang disebut respiratory burst. Peristiwa ini diikuti dengan melonjaknya konsumsi oksigen. Neutrofil merupakan sel yang mempunyai umur pendek, dan segera mati setelah melakukan fagositosis. Neutrofil yang mati ini merupakan bagian terbesar pada nanah yang terbentuk selama infeksi. Sebaliknya makrofag, merupakan sel yang mempunyai masa hidup panjang dan selalu membentuk lisosom baru setelah menyelesaikan fagositosis. Seseorang yang cacat genetik dimana tidak mempunyai kemampuan mengoksidasi NADPH maka sel fagosit orang tersebut tidak dapat membentuk zat toksik/racun yang berasal dari modifikasi oksigen.
Sebagai konsekuensinya sel fagosit tidak mampu membunuh mikroorganisme yang ditelan dan tidak dapat mengeliminasi patogen. Seseorang dengan kondisi genetik tersebut sangat rentan pada infeksi baik bakteri maupun jamur, terutama pada bayi. Makrofag dapat merespon dengan cepat mikroorganisme yang masuk, dan hal ini sangat penting untuk menghindari menetapnya patogen. Sejak awal perkembangan imunologi para ilmuwan percaya bahwa makrofag berperan pada setiap sitem pertahanan. Saat ini lebih jelas bahwa invertebrata seperti bintang laut hanya menggunakan makrofag sebagai sistem pertahanan untuk melawan infeksi. Walaupun kejadian yang ada pada invertebrata bukan permasalahan pada manusia maupun vertebrata lain, namun membuktikan bahwa makrofag merupakan respon innate yang menjadi pertahanan paling depan untuk mengatasi invasi mikroorganisme pada suatu individu.
Makrofag mngekspresikan reseptor untuk berbagai
konstituen bakteri reseptor manosa reseptor glukan reseptor scavenger TLR-4 reseptor LPS (CD14)
Ikatan bakteri pada reseptor makrofag menginisiasi sekresi sitokin dan
lipid yang memediasi inflamasi mediator Inflamasi (lipid) sitokin lisosom fagolisosom fagosom
Makrofag menelan dan mencerna bakteri
kemokin
Gambar 38. Makrofag yang menelan patogen dapat menginisiasi reaksi inflamasi. Makrofag membawa bermacam-macam reseptor yang cocok untuk berbagai komponen bakteri termasuk reseptor untuk karbohidrat yang dibawa bakteri (reseptor manosa dan glukan), reseptor LPS (lipida), reseptor Toll (TLR), dan reseptor scavenger. Ikatan bakteri dengan reseptor yang ada menyebabkan terjadinya fagositosis. Signal dari reseptor Toll menyebabkan tersekresinya sitokin proinflamasi seperti IL-1β, IL-6, dan TNF-α.
Mekanisme Produk spesifik
Asidifikasi pH= ~3.5 -4.0, bakteriostatik atau bakteriosida
Produk toksik yang berasal dari oksigen
Superoksida O2 -, hidrogen peroksida H 2O2, oksigen singlet • 2 1 O , radikal hidroksil OH•, OCl hipohalit Nitrogen oksida toksik Oksida nitrit NO
Peptida antimikrobia Protein defensin dan kationik
Enzimatis Lisozime yang melarutkan dinding sel beberapa bakteri gram positif. Asam hidrolase, menghancurkan bakteri
Kompetitor Lactoferrin (mengikat Fe) dan protein yang mengikat vitamin B12
Gambar 39. Agen anti bakteri (bakteriosida) diproduksi atau dilepaskan oleh sel fagosit pada waktu mencerna mikroorganisme. Sebagian besar agen bakteriosida dihasilkan oleh makrofag dan neutrofil. Beberapa agen bakteriosida bersifat toksik, sedangkan yang lain contohnya lactoferrin, bekerja dengan cara mengikat nutrisi essensial dan mencegah nutrien itu dikonsumsi bakteri. Beberapa substansi dapat dilepaskan sel fagosit dan berinteraksi dengan larva cacing parasit yang telah diselubungi antibodi dan juga berinteraksi dengan jaringan host. Karena agen tersebut mampu berinteraksi dengan sel host dan juga memberi efek toksik pada jaringan host, aktivasi sel fagosit dapat menimbulkan kerusakan pada jaringan host selama proses infeksi.
Sifat utama yang membedakan mikroorganisme patogen dengan non-patogen adalah kemampuannya menghadapi pertahanan
innate. Mikroorganisme patogen telah mengembangkan strategi untuk
menghindari penghancuran oleh makrofag. Banyak bakteri patogen melindungi dirinya dengan kapsul tebal berupa polisakarida yang tidak dikenal oleh reseptor fagosit. Mycobacteria mempunyai strategi untuk hidup di dalam fagosom makrofag dengan cara menghalangi fusi fagosom-lisosom. Apabila strategi untuk menghindari imunitas inate tidak dimiliki oleh bakteri maka bakteri harus masuk ke dalam tubuh dalam jumlah yang banyak untuk terjadinya infeksi. Hal yang sangat penting jika terjadi interaksi makrofag dengan bakteri adalah terjadinya aktivasi makrofag untuk mensekresi sitokin dan mediator lain yang menginisiasi proses inflamasi. Patogen menjadi penyebab
terjadinya sekresi sitokin dengan adanya signal yang merambat dari ikatan reseptor pada sel fagosit dengan antigen. Reseptor yang memberikan signal adanya antigen dan menyebabkan sekresi sitokin itu juga penting untuk membangkitkan ekspresi molekul kostimulator pada makrofag dan sel dendritik. Sel dendritik termasuk sel fagosit yang berada pada jaringan. Terekspresinya molekul kostimulator memudahkan inisiasi imunitas adaptif. Sitokin yang dihasilkan makrofag mempunyai kontribusi penting pada inflamasi lokal dan respon imun non-adaptif beberapa hari setelah terjadinya infeksi.
Inflamasi.
Inflamasi merupakan kejadian penting pada sistem pertahanan tubuh. Inflamasi mempunyai tiga peranan penting untuk melawan infeksi. Pertama, inflamasi membantu rekrutmen molekul-molekul efektor dan sel-sel imunokompeten pada daerah yang terinfeksi, sehingga memperbesar daya bunuh makrofag terhadap mikroorganisme invader. Molekul efektor dapat berupa sitokin, komplemen, maupun antibodi. Adanya molekul efektor terutama antibodi dan komplemen akan mengefektifkan kerja sel fagosit khususnya makrofag. Kedua, sebagai penghalang penyebaran infeksi, dan ketiga untuk memacu perbaikan jaringan yang luka. Inflamasi pada daerah infeksi dimulai dengan adanya respon makrofag terhadap patogen. Inflamasi mempunyai ciri-cri antara lain: rasa sakit, kemerahan, panas, dan membengkak pada daerah infeksi. Kejadian tersebut merupakan refleksi tiga perubahan pembuluh darah pada daerah yang terinfeksi itu. Pertama, bertambah besarnya diameter vascular, sehingga meningkatkan aliran darah di daerah itu. Berhubungan dengan membesarnya diameter vaskuler dan aliran darah yang cepat menyebabkan panas dan kemerahan. Kejadian ini akan menurunkan kecepatan aliran darah pada pembuluh darah kecil. Kedua meningkatnya ekspresi molekul adhesi pada sel endotel pembuluh darah. Peningkatan ekspresi molekul adhesi pada sel-sel endotel memudahkan melekatnya sel-sel leukosit menempel pada dinding-dinding endotel. Kombinasi antara ekspresi molekul adhesi dan lambatnya aliran darah pada pembuluh kecil memberi kesempatan leukosit menempel pada sel endotel dan bermigrasi masuk jaringan yang terinfeksi, proses ini dikenal dengan extravasation. Semua perubahan tersebut dimulai oleh sitokin yang diproduksi oleh