RPS PIF 2017
1
RENCANA PEMBELAJARAN SEMESTER (RPS)
CPOB
PAF 000 (2 sks) Semester VII
Pengampu mata kuliah
Dr. Muslim Suardi, MS, Apt
Syofyan, S.Si., M. Farm, Apt
Dr. Erizal, M.Si, Apt
Program Studi S1 Farmasi
Fakultas Farmasi
Universitas Andalas
Padang, Tahun 2017
RPS PIF 2017
2
A.
LATAR BELAKANG
Matakuliah Cara Pembuatan Obat Yang Baik (CPOB) atau Good Manufacturing Practise (GMP) merupakan matakuliah wajib yang diberikan pada tahun akhir di semester ganjil yaitu semester VII dan termasuk ke dalam kelompok IPTEKS pendukung. CPOB ini terkait dengan matakuliah bidang teknologi farmasi seperti teknologi sediaan padat, semipadat dan cair serta teknologi sediaan steril. Matakuliah ini memberikan gambaran kepada mahasiswa tentang aspek yang terkait dengan pembuatan obat termasuk aspek produksi dan pemastian mutu. Karena terkait dengan kegiatan farmasi industri, maka moteode pembelajaran yang dikembangkan adalah dengan metode SCL berbasis Small Group Discussion. Dengan metode ini mahasiswa dituntut untuk aktif belajar mandiri sebelum memulai perkuliahan seperti pengisian lembaran kerja mahasiswa (LKM) dan penyiapan bahan kuliah yang berisi topik perkuliahan yang dilakukan di rumah sehingga pada saat diskusi mahasiswa dapat berkontribusi secara aktif. Selain itu mahasiswa juga melakukan field trip ke industri farmasi sehingga akan memperkaya pengalaman dan pemahaman mahasiswa dalam implementasi CPOB di industri farmasi.
B.
PERENCANAAN PEMBELAJARAN
1.
Deskripsi Singkat Matakuliah
Secara keseluruhan dalam mata kuliah ini akan dibahas mengenai CPOB sediaan farmasi ang meliputi 12 aspek CPOB berisi materi Hakekat CPOB, Aspek umum CPOB, Produksi dan Pengawasan Mutu, Program stabilitas dan analisis sediaan, Penanganan keluhatan terhadap produk, Inspeksi diri dan audit mutu, Dokumetasi dan Kualifikasi dan penjaminan mutu sediaan farmasi. Untuk memberikan gambaran lebih dini yang dikenal dengan early exposure terkait mata kuliah ini, maka mahasiswa diharapkan dapat mengunjungi (fied trip) ke beberapa industri farmasi, makanan dan minuman.
2.
Tujuan Pembelajaran
Setelah mengikuti perkuliahan ini mahasiswa mampu menjelaskan tentang pentingnya pengawasan dan penjaminan mutu dalam penerapan CPOB di industri farmasi dalam menghasilkan obat jadi yang memenuhi syarat, efektif dan aman.
3.
Capaian Pembelajaran (
Learning Outcomes
) dan Kemampuan Akhir yang
Diharapkan
Setelah mengikuti kuliah ini mahasiswa diharapkan mampu : a. Menjelaskan hakekat CPOB
b. Menjelaskan aspek umum CPOB.
c. Menjelaskan aspek produksi dan pengawasan mutu obat. d. Menjelaskan program stabilitas dan analisis sediaan e. Menjelaskan penanganan keluhan terhadap produk f. Menjelaskan inspeksi diri dan audit mutu
g. Menjelaskan sistem dokumentasi h. Menjelaskan kualifikasi dan validasi i. Menggunakan buku Farmakope Indoensia
j. Melaksanakan cara berkomunikasi yang baik dan benar
4.
Bahan Kajian (Materi Ajar) dan Daftar Referensi
Bahan kajian kuliah ini adalah:
a. Hakekat CPOBb. Aspek umum CPOB.
c. Aspek produksi dan pengawasan mutu obat. d. Program stabilitas dan analisis sediaan
RPS PIF 2017
3
e. Penanganan keluhan terhadap produk f. Inspeksi diri dan audit mutu
g. Sistem dokumentasi h. Kualifikasi dan validasi
Daftar Referensi:
Anonim, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan RI, Jakarta. Anonim, 2013, Farmakope Indonesia, Edisi V, Kemenkes RI, Jakarta
Anonim, 2012, Peraturan Badan POM No.
HK.03.1.33.12.12.8195 Tahun 2012
tentang Penerapan Pedoman CPOBAnonim, 2013, Petunjuk Operasional Penerapan Pedoman CPOB 2012 Jilid 1, Badan POM RI
Anonim, 2014, Petunjuk Operasional Penerapan Pedoman CPOB 2012 Jilid 2, Badan POM RI
5.
Metode Pembelajaran dan Alokasi Waktu
Metode pembelajaran:
Met
ode pembelajaran yang dikembangkan adalah dengan metode SCL berbasis Collaborative Leraning. Dengan metode ini mahasiswa dituntut untuk aktif belajar mandiri sebelum memulai perkuliahan seperti pengisian lembaran kerja mahasiswa (LKM) yang berisi topik perkuliahan yang dilakukan di rumah sehingga pada saat diskusi mahasiswa dapat berkontribusi secara aktif.
Alokasi waktu
Pelaksanaan pembelajaran selama 14 minggu tatap muka dan 1 kali UTS dan 1
kali UAS
Tiap tatap muka berlangsung selama 2 x 50 menit
6.
Pengalaman Belajar Mahasisiwa
Dalam mata kuliah ini, pengalaman belajar mahasiswa diwujudkan dalam
deskripsi tugas yang harus dikerjakan oleh mahasiswa selama satu semester,
agar mahasiswa mampu mencapai kemampuan yang diharapkan di setiap
tahapan pembelajaran. Proses ini termasuk di dalamnya kegiatan asesmen
proses dan hasil belajar mahasiswa.
7.
Kriteria (Indikator) Penilaian
Penilaian mencakup prinsip edukatif, otentik, objektif, akuntabel, dan
transparan yang dilakukan secara terintegrasi. Kriteria menunjuk pada standar
keberhasilan mahasiswa dalam sebuah tahapan pembelajaran, sedangkan
unsur-unsur yang menunjukkan kualitas kinerja mahasiswa.
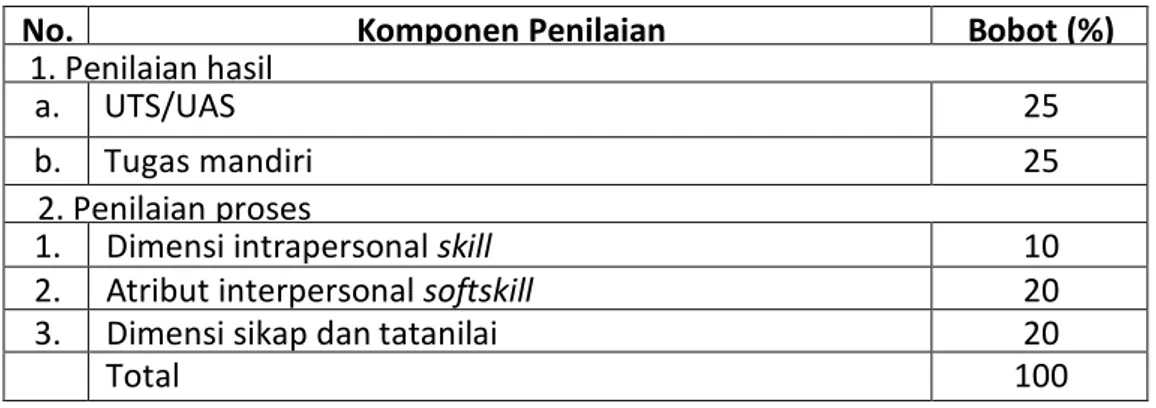
Adapun kriteria penilaian meliputi penilaian hasil (UTS/UAS, tugas mandiri) dan
penilaian proses yag meliputi: dimensi intrapersonal skill, atribut interpersonal
softskill dan dimensi sikap / tatanilai.
RPS PIF 2017
4
8.
Bobot Penilaian
Bobot penilaian merupakan ukuran dalam prosen (%) yang menunjukkan
prosentase keberhasilan satu tahap penilaian terhadap nilai keberhasilan
keseluruhan dalam mata kuliah.
Kriteria penilaian terdiri atas penilaian hasil dan proses sesuai dengan capaian
pembelajaran, adalah sebagai berikut:
Tabel 1. Kriteria (indikator) dan bobot penilain
No.
Komponen Penilaian
Bobot (%)
1. Penilaian hasil
a. UTS/UAS
25
b. Tugas mandiri
25
2. Penilaian proses
1.
Dimensi intrapersonal
skill
10
2.
Atribut interpersonal
softskill
20
3.
Dimensi sikap dan tatanilai
20
Total
100
9.
Norma Akademik
a. Kehadiran mahasiswa dalam pembelajaran minimal 75% dari total pertemuan kuliah yang terlaksana.
b. Kegiatan pembelajaran sesuai jadwal resmi dan jika terjadi perubahan ditetapkan bersama antara dosen dan mahasiswa.
c. Toleransi keterlambatan 15 menit.
d. Selama proses pembelajaran berlangsung HP dimatikan. e. Pengumpulan tugas ditetapkan sesuai jadwal
f. Yang berhalangan hadir karena sakit (harus ada keterangan sakit/surat pemberitahuan sakit) dan halangan lainnya harus menghubungi dosen sebelum perkuliahan.
g. Berpakaian sopan dan bersepatu dalam perkuliahan.
h. Pakai baju/kameja putih dan celana hitam untuk pria dan rok hitam bagi perempuan pada saat UTS dan UAS.
i. Kecurangan dalam ujian, nilai mata kuliah yang bersangkutan nol.
j. Mahasiswa yang menjadi penanggungjawab matakuliah diharapkan menghubungi dosen sehari sebelum kuliah untuk mengingatkan jadwal kuliah
k. Membawa dan telah mengisi Lembaran Kerja Mahasiswa (LKM) yang terdapat pada buku pegangan sesuai topik perkuliahan sebelum kuliah dilaksanakan
10.
Rancangan Tugas Mahasiswa
Mahasiswa diberikan tugas dalam bentuk lembaran kerja mahasiswa dan
wajib dikerjakan secara perorangan. Tugas tersebut akan dibahas secara
bersama dikelas
RPS PIF 2017
5
RENCANA PEMBELAJARAN SEMESTER (RPS)
PROGRAM STUDI : S1 FARMASI
FAKULTAS /PPs: FARMASI
UNIVERSITAS ANDALAS
MATA KULIAH
KODE
Rumpun MK
BOBOT (sks)
SEMESTER
Tgl Penyusunan
CPOB
PAF 000
Matakuliah Inti
2
7
27-01-2017
OTORISASI
Dosen Pengembang RPS
Koordinator Rumpun MK
Ka Program Studi
Dr. Muslim Suardi, MS,
Apt
Syofyan
Erizal
Dr. Muslim Suardi, MS, Apt
Dr. Fatma Sri Wahyuni, Apt
Capaian Pembelajaran
(CP)
Catatan :
S : Sikat
P : Pengetahuan
KU : Keterampilan Umum
KK : Keterampilan Khusus
CP Program Studi
S8
Menunjukkan sikap bertanggung jawab atas pekerjaan di bidang keahliannya secara mandiri
S9
Menginternalisasi semangat kemandirian, kejuangan, dan kewirausahaan.
S10
Menggunakan dan mengembangkan kreativitas dan inovasi secara saintifik dalam memecahkan masalah
kefarmasian.
KU1
Merencanakan, mengembangkan, menyediakan dan mengendalikan mutu sediaan farmasi serta memahami
manfaat klinisnya
KU3
Memahami konsep management dalam pengelolaan bahan baku sampai menjadi sediaan farmasi
P01
Dasar-dasar keilmuan yang cukup untuk melanjutkan ke tingkat pendidikan yang lebih tinggi..
CP Mata Kuliah
1
Memahami aspek CPOB2
Mengimplementasikan prinsip CPOB dalam produksi obatDeskripsi Singkat
Mata Kuliah
Secara keseluruhan dalam mata kuliah ini akan dibahas mengenai CPOB sediaan farmasi ang meliputi 12 aspek CPOB berisi materi Hakekat CPOB, Aspek umum CPOB, Produksi dan Pengawasan Mutu, Program stabilitas dan analisis sediaan, Penanganan keluhatan terhadap produk, Inspeksi diri dan audit mutu, Dokumetasi dan Kualifikasi dan penjaminan mutu sediaan farmasi. Untuk memberikan gambaran lebih dini yang dikenal dengan early exposure terkait mata kuliah ini, maka mahasiswa diharapkan dapat mengunjungi (fied trip) ke beberapa industri farmasi, makanan dan minuman
RPS PIF 2017
6
Materi Pembelajaran/
Pokok Bahasan
1. Hakekat CPOB 2. Aspek umum CPOB.
3. Aspek produksi dan pengawasan mutu obat. 4. Program stabilitas dan analisis sediaan 5. Penanganan keluhan terhadap produk 6. Inspeksi diri dan audit mutu
7. Sistem dokumentasi 8. Kualifikasi dan validasi
Pustaka
Utama :
Anonim, 2013, Farmakope Indonesia, Edisi V, Kemenkes RI, Jakarta
Anonim, 2012, Peraturan Badan POM No.
HK.03.1.33.12.12.8195 Tahun 2012
tentang Penerapan Pedoman CPOB Anonim, 2013, Petunjuk Operasional Penerapan Pedoman CPOB 2012 Jilid 1, Badan POM RIAnonim, 2014, Petunjuk Operasional Penerapan Pedoman CPOB 2012 Jilid 2, Badan POM RI
Pendukung :
Anonim, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan RI, Jakarta.
Media Pembelajaran
Perangkat lunak :
Perangkat keras :
-
LCD & Projector
Team Teaching
Dr. Muslim Suardi, MS, Apt
Syofyan
Erizal
Assessment
RPS PIF 2017
7
Pelaksanaan Perkuliahan 2 SKS
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
(1)
(2)
(3)
(4)
(5)
(6)
(7)
1
1.Mahasiswa mampu menjelaskan tujuan dan kontrak perkuliahan, serta pesan moral. 2.Mahasiswa mampu menjelaskan industri farmasi dan hakekat CPOB.1. Tujuan, kontrak perkuliahan dan pesan moral 3.Hakekat CPOB -Sejarah CPOB -Landasan hukum -Tujuan CPOB -Sistem mutu -Istilah-istilah penting
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawabIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
2
Mahasiswa mampu mendeskripsikan aspek umum CPOBAspek Umum CPOB 1. Personalia 2. Bangunan-Peralatan-Sanitasi Higiene 3. Sertifikat CPOB
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yangIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
RPS PIF 2017
8
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelas3
Mahasiswa mampu menjelaskan produksi dan QC sediaan non sterilProduksi – QC sediaan non steril 1.Pegolahan 2.Pengemasan 3.IPC 4.QC
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelasIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
RPS PIF 2017
9
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
4
Mahasiswa mampu menjelaskan produksi dan QC sediaan non sterilProduksi – QC sediaan steril 1.Pegolahan 2.Pengemasan 3.IPC 4.QC
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelasIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
5
Mahasiswa dapat menjelaskan program stabilitas dan analisis sediaanProgram stabilitas dan analisis sediaan 1. Uji stabilitas 2. Analisis sediaan menurut FI
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawabIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
RPS PIF 2017
10
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelas
Isi LKM
Keaktifan dalam
diskusi
6
Mahasiswa mampu menjelaskan penanganan keluhan terhadap produk Penanganan keluhan terhadap produk 1. Defenisi2. Tata cara penangan keluhan
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihanIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
RPS PIF 2017
11
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
dengan menulis dan menjelaskannya kembali pada white board di depan kelas7
Mahasiswa mampu menjelaskan penanganan keluhan terhadap produk Produk kembalian 1. Defenisi2. Tata cara penangan produk kembalian
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelasIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
8
UTSRPS PIF 2017
12
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
menjelaskan i inspeksidiri dan audit mutu 1.2. Inspeksi diri Audit mutu mendengar paparan dosen secara seksama 2.Mahasiswa
memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelas
Indikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
10
Mahasiswa mampu menjelaskan sistem dokumentasi di industri farmasi Dokumentasi 1.Dokumentasi 2.Pentingnya dokumentasi 3.Dokumentasi proses produksi 4. Dokumentasi pengemasan 5. dokumentasi pengawasan mutu 6. Dokumentasi penjaminanDiskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.MahasiswaIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
RPS PIF 2017
13
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
mutu mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelas
Keaktifan dalam
diskusi
11
Mahasiswa mampu menjelaskan kualifikasi dan kualifikasi alatKualifikasi disain dan instalasi 1.Definisi kualifikasi 2.Kualifikasi Disain 3.Kualifikasi Instalasi 4.Kualifikasi Operasional 5.Kualifikasi Kinerja 6.Proses Monitoring
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulisIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
RPS PIF 2017
14
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
dan menjelaskannya kembali pada white board di depan kelas12
Mahasiswa mampu menjelaskan kualifikasi operasional dan kinerjaKualifikasi operasional dan kinerja 1. Defenisi 2. Metode kualifikasi
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelasIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
13
Mahasiswa mampu menjelaskan validasi proses Validasi proses 1. Validasi prospektif 2. Validasi konkuren 3. Validasi retospektifDiskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksamaIndikator
Kesempurnaan isi LKM
RPS PIF 2017
15
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara perorangan dalam LKM 4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menulis dan menjelaskannya kembali pada white board di depan kelas
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
14
Mahasiswa mampu menjelaskan validasi metode analisisValidasi metode analisis 1.Deefenisi 2.Metode validasi
Diskusi (TM;2x(2x50”)
1.Mahasiswa mendengar paparan dosen secara seksama 2.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 3.Mahasiswa mengerjakan latihan secara peroranganIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
RPS PIF 2017
16
Mg
Ke-
Kemampuan akhir yg
diharapkan
Bahan Kajian
(Materi Ajar)
Dan Referensi
Metode Pembelajaran dan
Alokasi Waktu
Pengalaman
Belajar
Mahasiswa
Kreteria (Indikator)
Penilaian
Bobot
Penilan
(%)
4.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menjelaskannya kembali di depan kelas15
Mahasiswa melihat langsung aplikasi CPOB di industri farmasi Kunjungan lapangan ke industri farmasiDiskusi (TM;2x(2x50”)
5.Mahasiswa mendengar paparan dosen secara seksama 6.Mahasiswa memberikan pertanyaan saat diskusi atau tanya jawab 7.Mahasiswa mengerjakan latihan secara perorangan 8.Mahasiswa yang ditunjuk menyampaikan hasil latihan dengan menjelaskannya kembali di depan kelasIndikator
Kesempurnaan isi LKM
Ketepatan menjelaskan
konsep
Bentuk non-test;
Isi LKM
Keaktifan dalam
diskusi
1
IDENTITAS
Pertemuan
Ke
1
Hari/Tanggal
Topik
Hakekat CPOB
A PETA KONSEP
B NARASI
Dua Pasien RS Meninggal Setelah Disuntik Obat Bius
Dua pasien di Rumah Sakit Siloam Karawaci, Tangerang, meninggal dunia setelah pemberian obat anastesi Buvanest Spinal. Obat produksi PT Kalbe Farma ini diduga bukan berisi bupivacaine atau untuk pembiusan, melainkan asam traneksamat yang bekerja untuk mengurangi pendarahan. Kasus ini terjadi terhadap pasien yang melakukan operasi caesar dan urologi. Kedua pasien meninggal dalam waktu
berdekatan pada tanggal 12 Februari 2015.
LEMBARAN KERJA MAHASISWA
(LKM)
MATA KULIAH
CARA PEMBUATAN OBAT YANG BAIK
(CPOB)
FAKULTAS FARMASI, UNIVERSITAS ANDALAS
Topik
1
HAKEKAT
CARA PEMBUATAN OBAT YANG BAIK (CPOB) Current Good Manufacturing Practice
Sejarah CPOB
Tujuan CPOB
Istilah-istilah penting
2
Kepala Hubungan Masyarakat RS Siloam Heppi Nurfianto mengungkapkan, bahwa pihak rumah sakit telah melakukan tindakan sesuai dengan prosedur. Begitu juga menurut Ketua Umum Perhimpunan Dokter Spesialis Anestesiologi dan Terapi Intensif Indonesia (Perdatin) Andi Wahyuningsih yang mengatakan bahwa hasil investigasi tim yang terdiri atas Kementerian Kesehatan, Badan Pengawas Obat dan Makanan (BPOM), serta Perdatin, memeriksa lebih dalam RS Siloam Lippo Village, dokter anestesi, dokter ahli urologi, serta dokter ahli kebidanan dan kandungan di RS itu menunjukkan hasilnya, tak ada masalah dari sisi legalitas izin dan prosedur operasi standar.
Lebih lanjut Heppi menjelaskan kronologisnya bahwa obat bius jenis Buvanest yang diterimanya dari produsen PT Kalbe Farma awalnya telah disuntikkan seperti biasa ke spinal atau tulang belakang pasien. Namun, setelah disuntikkan, terjadi gejala yang tidak wajar. Pasien merasa gatal-gatal dan mengalami kejang-kejang. Melihat hal tersebut, tim operasi langsung membawa kedua pasien yang dioperasi dalam waktu yang berdekatan ke ruang ICU. Gejala tersebut mulai muncul beberapa jam setelah anestesi atau obat bius itu disuntikkan. "Kita masukkan ke ICU, disayangkan, belum ada 24 jam, pasien sudah meninggal dunia di ICU," ucap Heppi. Dia mengungkapkan, seorang pasien operasi caesar yang tidak selamat melahirkan seorang anak yang
selamat, sedangkan satu pasien lagi yang dioperasi urologi juga tidak bisa diselamatkan. Dokter yang menangani gejala tak lazim dari pasien tersebut, ucap Heppi, juga sempat merasa aneh. Padahal, pasien lain yang juga menggunakan obat bius dengan jenis dan keluaran yang sama diketahui normal-normal saja. Ketika dicek, ternyata memang bungkusan pada kemasan obat bius itu tertukar.
Meninggalnya dua pasien di Rumah Sakit (RS) Siloam Karawaci, Tangerang, diduga karena kelalaian dari pihak produsen obat bius, yakni PT Kalbe Farma. Etiket atau bungkusan pada obat bius Buvanest Spiral itu diduga tertukar sehingga
kandungan di dalamnya bukan untuk obat bius pada umumnya. Obat bius tersebut, yang bungkusannya tertukar, menyebabkan kandungan di dalam obat bekerja untuk mengurangi pendarahan, sedangkan kandungan yang seharusnya untuk obat bius adalah bupivacaine atau untuk pembiusan.
Untuk tindak lanjut dari persoalan ini, Heppi telah menyerahkannya kepada Badan Pengawas Obat dan Makanan (BPOM). BPOM sendiri sudah melarang peredaran obat keluaran Kalbe itu sejak Minggu (15/2/2015) dan langsung membentuk tim investigasi. "Sudah diinstruksikan untuk menghentikan produksi, membekukan izin edar khusus untuk obat yang satu itu," kata Roy Sparingga, Kepala Badan Pengawas Obat dan Makanan (BPOM).
Roy juga mengungkapkan telah membentuk tim investigasi untuk mencari tahu penyebab kedua pasien meninggal, apakah memang benar karena kekeliruan pihak Kalbe atau ada faktor lain. "Balai POM akan memverifikasi dan memonitor penarikan obat bius itu, lalu Kalbe juga kita minta melakukan investigasi mengapa itu bisa terjadi. Itu tanggung jawab mereka," kata Roy.
Dugaan etiket atau bungkusan obat anestesi yang tertukar sehingga
menyebabkan pasien meninggal dunia dinilai oleh apoteker sangat tidak masuk akal. "Kalau sampai keliru itu tidak masuk akal karena semua produk farmasi memiliki standar prosedur operasi (SOP), yakni cara pembuatan obat yang baik dan benar," kata A Haditomo, Anggota Dewan Penasihat Ikatan Apoteker Indonesia. Ia mengatakan, obat anestesi bupivacaine dan juga asam traneksamat yang saling tertukar itu bukanlah obat baru.
Menurut Haditomo, setiap perusahaan farmasi sudah memiliki kontrol kualitas (QC) dalam produksinya. "Jadi waktu obat dimasukkan harus sesuai antara wadah dan isinya. Pasti ada QC sejak pembuatan sampai selesai," paparnya. Ia menambahkan, jika memang obat yang disuntikkan bukanlah obat anestesi, mengapa pasien bisa menjalani operasi dengan tenang. "Masih ada masalah yang perlu diperjelas. Ada missing link dalam kasus ini. Berarti ini bukan sekadar salah obat saja," paparnya.
Dugaan bahwa pasien memiliki alergi berat pada jenis obat yang disuntikkan juga perlu diselidiki lagi. "Kalau memang alergi, seberapa berat derajatnya," katanya. Kasus dugaan kesalahan obat ini, menurut Haditomo, harus menjadi pelajaran bagi semua pihak untuk menuruti ketentuan undang-undang kesehatan yang berlaku. "Sebenarnya semua sudah diatur dalam UU Kesehatan No 36 Tahun 2009, terutama
3
Pasal 108. Kalau semua prosedur dipatuhi, kasus seperti ini tidak perlu terjadi," katanya.
Undang-Undang Kesehatan No 36 tahun 2009 telah mengatur secara ketat prosedur pembuatan obat, pengamanan, sampai pendistribusian obat, hanya boleh dilakukan oleh tenaga kesehatan, dalam hal ini apoteker. "Obat adalah tanggung jawab apoteker, karena menurut aturan Undang-Undang, mulai dari proses produksi sampai dengan penyimpanan dan distribusi, hanya dilakukan oleh apoteker. Di rumah sakit yang memberikan kepada dokter adalah perawatnya," kata A Haditomo.
Menurut A Haditomo, proses produksi obat di Indonesia telah memiliki standar yang disebut dengan cara produksi obat yang baik dan benar. Jika prosedur ini ditaati, seharusnya kasus salah obat sampai mengakibatkan pasien meninggal seperti di RS Siloam tak terjadi. "Kalau sampai ada kesalahan, pasti ada sesuatu. Ini yang harus diselidiki oleh pihak berwenang," katanya.
PT. Kalbe Farma mengklaim selama ini telah menerapkan Cara Pembuatan Obat yang Baik (CPOB) untuk produksi seluruh obat-obatan. Belum diketahui pasti
bagaimana isi obat anestesi Buvanest Spinal dapat tertukar dengan obat lain. “Kami senantiasa menjaga kualitas produk kami, melakukan inovasi, mengutamakan keselamatan, dan perlindungan konsumen,” ujar Presiden Direktur PT Kalbe Farma Irawati Setiady. Ira mengatakan, saat ini pihaknya terus melakukan penyelidikan dengan mengecek proses produksi secara keseluruhan. Menurut Ira, produk itu telah diproduksi selama 7 tahun dan belum pernah ada masalah.
“Untuk dugaan salah label, kita sedang melakukan investigasi, mengecek ulang seluruh proses yang ada, dari bahan baku hingga pelabelan supaya kita tahu akar permasalahannya ini,” terang Ira.
Sesuai keputusan Badan Pengawas Obat dan Makanan (BPOM), Kalbe
menghentikan sementara kegiatan fasilitas produksi larutan injeksi hingga pemeriksaan selesai. Selain itu, menghentikan pemasaran serta distribusi produk Buvanest Spinal di seluruh Indonesia. Direktur PT Kalbe Farma Vidjongtius mengatakan, pihaknya memang menerima dua sampel Buvanest Spinal dari RS Siloam yang ternyata isinya tidak sesuai. Namun, pada sampel lainnya hingga kini belum ada kasus serupa.
“Sampel yang kami terima dari salah satu rumah sakit dan kami melakukan pemeriksaan memang kami menemukan ada ketidaksesuaian label. Tapi setelah kami melakukan pemeriksaan kembali sampel lain, kami tidak menemukan
ketidakkesesuaian label,” terang Vidjongtius.
Manajemen Kalbe Farma optimistis tak ada kesalahan dalam sistem produksinya karena menerapkan cara pembuatan obat yang baik dan benar (CPOB). Vidjongtius menyatakan, proses produksi obat hingga tahap pelabelan menggunakan mesin
otomatis yang secara berkala diinspeksi untuk memastikan standardisasi produk. Dari penelusuran internal terhadap retain sampel, tidak ditemukan ada kesalahan label. Jadi, pihaknya yakin Buvanest dan asam traneksamat tak tertukar di pabrik.
Badan Pengawas Obat dan Makanan (BPOM) masih melakukan investigasi terhadap kasus dugaan tertukarnya label obat anestesi Buvanest Spinal dengan asam tranexamat produksi PT Kalbe Farma. Hasil sementara, BPOM menemukan potensi tertukarnya label obat pada saat proses produksi. "Kami mendatangi sarana produksi, bagaimana penerapan cara pembuatan obat yang baik (CPOB). Di sana kami
menyampaikan terdapat potensi terjadinya mix up (tercampur) karena penerapan CPOB belum sepenuhnya seperti yang diharapkan," terang Roy Sparingga. Diduga kuat kesalahan terjadi di sarana produksi. Ia juga menyatakan, CPOB pada sarana produksi itu tak sesuai harapan
Atas kasus ini, BPOM tak hanya membekukan izin edar Buvanest Spinal dan asam tranexamat, melainkan juga menghentikan proses fasilitas produksi untuk larutan injeksi PT Kalbe Farma
Setelah tertukarnya obat anestesi Buvanest dengan asam traneksamat yang mengakibatkan dua pasien di RS Siloam Lippo Village meninggal, BPOM telah
menginstruksikan penarikan semua batch (kelompok produksi) Buvanest Spinal dan dua batch asam traneksamat, yakni batch nomor 629668 dan 630025. Sejak 12 Februari 2015 dua produk tersebut ditarik. Selain itu, izin edar Buvanest Spinal dibekukan sementara.
4
(sumber: dikutip dari http://lipsus.kompas.com tanggal 12 Agustus 2015 dengan sedikit perubahan)
C SOAL – JAWAB
1. Perhatikan kutipan kalimat berikut dari narasi di atas.
Menurut A Haditomo, proses produksi obat di Indonesia telah memiliki standar yang disebut dengan cara produksi obat yang baik dan benar. Jika prosedur ini ditaati, seharusnya kasus salah obat sampai mengakibatkan pasien meninggal seperti di RS Siloam tak terjadi. "Kalau sampai ada kesalahan, pasti ada sesuatu. Ini yang harus diselidiki oleh pihak berwenang," katanya.
PT. Kalbe Farma mengklaim selama ini telah menerapkan Cara Pembuatan Obat yang Baik (CPOB) untuk produksi seluruh obat-obatan. Belum diketahui pasti bagaimana isi obat anestesi Buvanest Spinal dapat tertukar dengan obat lain.
Hasil sementara, BPOM menemukan potensi tertukarnya label obat pada saat proses produksi. "Kami mendatangi sarana produksi, bagaimana penerapan cara pembuatan obat yang baik (CPOB). Di sana kami menyampaikan terdapat potensi terjadinya mix up (tercampur) karena penerapan CPOB belum sepenuhnya seperti yang diharapkan," terang Roy Sparingga. Diduga kuat kesalahan terjadi di sarana produksi. Ia juga menyatakan, CPOB pada sarana produksi itu tak sesuai harapan
Dari kutipan tersebut, jelaskan menurut Saudara apa pentingnya CPOB tersebut bagi industri farmasi
5
2. Dalam sistem manajemen mutu obat, terdapat 3 komponen utama yang terlibat yaitu: QA, CPOB dan QC seperti yang tertera pada kutipan paragraf berikut:
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan penggunaanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan sistem Pemastian Mutu(QA) yang didesain secara menyeluruh dan diterapkan secara benar serta menginkorporasi Cara Pembuatan Obat yang Baik (CPOB) termasuk Pengawasan Mutu(QC) dan Manajemen Risiko.
Jelaskan beda ketiga komponen tersebut dan gambarkan bagaimana hubungan ketiganya dengan menggunakan diagram
6
3. Perhatikan alur kegiatan berikut untuk sediaan injeksi secara umum:
1. Apakah alur di atas menggambarkan proses pembuatan atau produksi atau pengolahan. Jelaskan (sebaiknya dengan alur yang baru dengan cara menyempurnakan alur di atas) sehingga dapat dijawab kenapa huruf P pada CPOB merupakan singkatan dari
“pembuatan”
2. Dari alur tersebut di atas, tunjukkan dimana dugaan bisa terjadinya potensi mix up (pencampuran) produk sebagaimana kasus di atas.
7
4. Perhatikan kutipan paragraf berikut:
Menurut Haditomo, setiap perusahaan farmasi sudah memiliki kontrol kualitas (QC) dalam produksinya. "Jadi waktu obat dimasukkan harus sesuai antara wadah dan isinya. Pasti ada QC sejak pembuatan sampai selesai," paparnya
Tiap produk baik produk antara, produk ruahan ataupun obat jadi selalu melalui serangkaian pengujian, sehingga obat yang dihasilkan diharapkan betul-betul memenuhi persyaratan yang dibutuhkan.
Apakah dengan adanya bagian QC yang melakukan serangkaian pengujian sudah cukup untuk memastikan mutu obat?
5. Perhatikan kutipan paragraf berikut:
Kasus dugaan kesalahan obat ini, menurut Haditomo, harus menjadi pelajaran bagi semua pihak untuk menuruti ketentuan undang-undang kesehatan yang berlaku. "Sebenarnya semua sudah diatur dalam UU Kesehatan No 36 Tahun 2009, terutama Pasal 108. Kalau semua prosedur dipatuhi, kasus seperti ini tidak perlu terjadi," katanya. Undang-Undang Kesehatan No 36 tahun 2009 telah mengatur secara ketat prosedur pembuatan obat, pengamanan, sampai pendistribusian obat, hanya boleh dilakukan oleh tenaga kesehatan, dalam hal ini apoteker. "Obat adalah tanggung jawab apoteker, karena menurut aturan Undang-Undang, mulai dari proses produksi sampai dengan penyimpanan dan distribusi, hanya dilakukan oleh apoteker." kata A Haditomo.
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai untuk melaksanakan semua tugas. Industri farmasi harus memiliki struktur organisasi. Hendaklah aspek penerapan CPOB tidak ada yang terlewatkan ataupun tumpang tindih dalam tanggung jawab yang tercantum pada uraian tugas
8
Sebutkan isi UU Kesehatan No 36 Tahun 2009, terutama Pasal 108. Kemudian terkait dengan hal itu, CPOB juga telah mensyaratkan bagian-bagian tertentu wajib diisi oleh apoteker, sebutkan!
6. Temukan beberapa istilah penting pada dua narasi di atas, yang termuat dalam CPOB. Dari beberapa istilah tersebut, adakah yang merupakan komponen utama CPOB? Sebutkan secara lengkap termasuk bagian lampiran (aneks)-nya
9
7. Sebutkan landasan hukum yang mengatur atau memuat tentang CPOB sekarang. Sebutkan juga riwayat singkat CPOB yang pernah berlaku di Indonesia hingga sekarang. Kebijakan penerapan CPOB menjadi wajib bagi industri farmasi farmasi. Sebutkan lembaga lain yang juga diwajibkan untuk menerapkan CPOB.
10
D LATIHAN UJI KOMPETENSI
1. CPOB tahun 2012 yang berlaku sekarang adalah CPOB ke.. a. 3
b. 4 c. 5 d. 6
2. Hal yang terbaru dalam CPOB 2012 ini adalah a. Manajemen mutu
b. Manajemen risiko mutu c. Pengkajian mutu produk d. Audit mutu
3. Satu-satunya perubahan yang significant pada CPOB 2012 adalah persyaratan pembuatan produk Salep Mata (non-aseptis). Jika pada CPOB sebelumnya, proses pembuatan sediaan salep mata (non aseptis) BISA dilakukan di ruang kelas D yang kemudian dilakukan proses sterilisasi akhir (biasanya menggunakan sinar gamma), maka sesuai dengan Pedoman CPOB 2012, hanya boleh dilakukan di ruang kelas
a. A b. B c. C d. E
4. Sertifikat CPOB diberikan untuk setiap a. Unit industri
b. Unit bangunan c. Unit ruangan d. Unit sediaan
5. Pemberian sertifikat CPOB dimaksud, berdasarkan...
a. Bentuk sediaan dan aktivitas pembuatan yang dilakukan b. Bentuk sediaan dan jenis obat yang diproduksi
c. Sediaan betalaktam-nonbetalaktam dan jenis steril atau non steril d. Sediaan betalaktam-nonbetalaktam dan bentuk sediaan
6. Penerapan CPOB wajib dilaksanakan di, kecuali
a. Industri bahan baku obat
b. Lembaga yang memproduksi sediaan radiofarmaka
c. Rumah sakit yang memproduksi sediaan infus NaCl 0,9%
d. Rumah sakit yang memproduksi sediaan cairan NaCl fisiologis
7. Pelanggraran terhadap ketentuan penerapan CPOB dapat dikenakan sangksi
berupa, kecuali:
a. Peringatan lisan
b. Penghentian sementara kegiatan;
c. Pembekuan Sertifikat CPOB
d. Pencabutan Sertifikat CPOB
e. Rekomendasi pencabutan izin industri farmasi.
8. Secara prinsip CPOB bertujuan untuk menjamin obat dibuat secara konsisten untuk mencapai standar mutu yang sesuai dengan, kecuali:
11
b. persyaratan dalam izin edar c. spesifikasi produk.
d. efek yang diinginkan
9. Tidaklah cukup bila produk jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang lebih penting adalah:
a. mutu harus dibentuk ke dalam produk tersebut b. Pengawasan mutu harus bersifat menyeluruh c. Pembuatan obat harus tetap konsisten
d. Pelaksanaan CPOB harus ketat dan komitmen yang tinggi 10. Bagian yang esensial dari CPOB adalah
a. produksi
b. pengawaan mutu c. pemastian mutu d. manajemen mutu
11. Hal berikut dapat mempengaruhi mutu obat, kecuali: a. bahan awal dan bahan pengemas,
b. proses produksi dan pengendalian mutu, c. lingkungan lokasi atau tempat industri berada d. personil yang terlibat.
12. Pada pedoman ini istilah “pembuatan” mencakup seluruh kegiatan berikut, kecuali:
a. penerimaan bahan b. produksi
c. pelabelan d. pemastian mutu
e. penyimpanan dan distribusi dari obat
13. Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Untuk pencapaian tujuan mutu ini secara konsisten dan dapat diandalkan, diperlukan sistem...
a. Kebijakan Mutu b. Manajemen mutu c. Pemastian mutu d. Pengawasan mutu
14. Obat tidak dijual atau didistribusikan sebelum manajemen menyatakan bahwa tiap bets produksi dibuat dan dikendalikan sesuai dengan persyaratan yang tercantum dalam izin edar dan peraturan lain yang berkaitan dengan aspek produksi, pengawasan mutu dan pelulusan produk. Siapakah manajemen yang dimaksud
a. Kepala Pemastian Mutu b. Kepala pengawasan mutu c. Kepala produksi
d. Kepala PPIC
15. Beberapa persyaratan dasar CPOB, diantaranya kecuali:
a. semua proses pembuatan obat dijabarkan dengan jelas,
b. tahap proses yang kritis harus divalidasi;
12
d. pencatatan dilakukan secara komputer dan tiap penyimpangan dicatat secara lengkap
e. tersedia sistem penarikan kembali bets obat manapun dari peredaran;
16. Pengkajian mutu produk dilakukan terhadap semua obat terdaftar dengan tujuan untuk, kecuali:
a. membuktikan konsistensi proses,
b. membuktikan kesesuaian dari spesifikasi bahan awal dan produk jadi, c. melihat tren penjualan
d. mengidentifikasi perbaikan yang diperlukan 17. Pengkajian mutu produk dilakukan minimal tiap
a. Satu bulan b. Tiga bulan c. Enam bulan d. Setahun
18. Suatu proses sistematis untuk melakukan penilaian, pengendalian dan pengkajian risiko terhadap mutu suatu produk disebut dengan istilah...
a. Manajemen mutu b. Manajemen risiko mutu c. Manajemen audit mutu d. Manajemen pengkajian mutu
13
LEMBARAN KERJA MAHASISWA
(LKM)
MATA KULIAH
CARA PEMBUATAN OBAT YANG BAIK
(CPOB)
FAKULTAS FARMASI, UNIVERSITAS ANDALAS
Topik
2
IDENTITAS
Pertemuan
Ke
2
Hari/Tanggal
Topik
ASPEK UMUM CPOB
A PETA KONSEP
B NARASI
PT Andalas Farma, Tbk adalah industri farmasi yang sudah terdaftar di Badan POM
(nomur urut 123) sejak tahun 2000 dan memiliki struktur organisasi lengkap. Sampai
saat ini PT Andalas Farma, Tbk telah memproduksi 15 jenis obat berikut:
1.
Tablet parasetamol
2.
Sirop parasetamol
3.
Supositoria parasetamol
4.
Tablet amoksisilin
5.
Suspensi amoksisilin
6.
Injeksi amoksisilin
ASPEK UMUMCARA PEMBUATAN OBAT YANG BAIK (CPOB) Current Good Manufacturing Practice
Personalia
Sertifikat CPOB
14
7.
Kapsul khloramfenikol
8.
Sirop khloramfenikol
9.
Tablet Antasid
10.
Suspensi Antasid
11.
Tablet propranolol
12.
Tablet salut
amitripthyline HCl
13.
Krim hidrokortison
14.
Injeksi seftriakson
15.
Obat KB
Diketahui bahwa catatan produk PT Andalas Farma adalah sebagai berikut.
Produk Manhour per
bets
Ukuran bets Sediaan padat
(non salut)
50 500.000 tab
Tablet Salut 120 500.000 tab
Sediaan liquid 30 1.000 L
Salep semi solid 20 100 kg
Sediaan steril cair
40 100 L
C SOAL - JAWAB
1. Perhatikan struktur organisasi PT Andalas Farma, Tbk berikut:
Apakah struktur tersebut sudah mencerminkan manajemen yang baik menurut CPOB. Jika belum, buatlah struktur yang baik menurut CPOB
16
2. Analisislah berapa orang minimal jumlah karyawan di PT Andalas Farma, Tbk. Asumsi hari kerja efektif adalah 222 hari dan jam kerja 8 jam per hari.
17
3. PT Andalas Farma, Tbk akan melakukan tes akhir bagi calon karyawan yang akan ditempatkan di bagian produksi. Ada lima orang yang tersisa sementara yang akan direkrut adalah sebanyak 2 orang (1 orang di bagian steril dan 1 orang dibagian non steril). Adapun urutan 5 orang tersebut berdasarkan nilai ujian tertulis adalah sbb:
No Nama Keterangan
1 Najmi Berjenggot, berkacamata
2 Verina Berjilbab
3 Thoriq Memiliki bekas luka terbuka dibagian kaki
4 Shaqila Berambut panjang
5 Syadam Riwayat asma
18
4. Seorang karyawan baru yang bekerja di PT Andalas Farma, Tbk akan ditempatkan bekerja di bagian produksi sediaan steril. Untuk itu, karyawan tersebut diberikan pelatihan yang terkait dengan produksi sediaan steril. Sebagai seorang manajer, Saudara diminta oleh atasan untuk memberikan pelatihan ini. Salah satu materi yang Saudara berikan adalah tentang tata cara memasuki ruang produksi dengan menggunakan alat bantu flow chart. Buatlah flow chart dimaksud dan jelaskan tahapannya secara jelas.
19
20
21
Apa yang membedakan ruang produksi steril aseptis dengan sterilisasi akhir. Jelaskan juga beda ruang produksi sediaan steril dengan non steril
22
7. Sebutkan berapa jumlah sertifikat CPOB yang telah diterima oleh PT Andalas Farma, Tbk. Jelaskan alasannya.
23
8. Buatlah satu contoh bentuk sertifikat CPOB untuk industri PT Andalas Farma, Tbk ini dalam satu lembaran tersendiri
24
D LATIHAN UJI KOMPETENSI
1. Yang bukan merupakan personil kunci dalam industri famasi adalah a. Kepala bagian pemastian mutu
b. Kepala bagian pengawasan mutu c. Kepala bagian produksi
d. Kepala bagian pemasaran
2. Terhadap persnil kunci tersebut, berlaku aturan, kecuali: a. Dipimpin oleh seorang apoteker yang terkualifikasi b. Dipimpin oleh orang yang berbeda
c. Tidak saling bertanggungjawab
d. Mempunyai kepentingan lain diluar organisasi
3. Yang bukan merupakan tugas kepala bagian produksi adalah
a. memastikan bahwa obat diproduksi dan disimpan sesuai prosedur
b. memberikan persetujuan petunjuk kerja yang terkait dengan produksi
c. memastikan bahwa catatan produksi telah dilaksanakan
d. memastikan bahwa validasi yang sesuai telah dilaksanakan
4. Berikut ini merupakan wewenang dari kepala bagian pengawasan mutu, kecuali:
a. menyetujui atau menolak bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi
b. memastikan bahwa seluruh pengujian yang diperlukan telah dievaluasi
c. memberi persetujuan terhadap spesifikasi, petunjuk kerja pengambilan sampel, metode pengujian dan prosedur pengawasan mutu lain;
25
5. Masing-masing kepala bagian Produksi, Pengawasan Mutu dan Manajemen Mutu (Pemastian Mutu) memiliki tanggung jawab bersama dalam menerapkan semua aspek yang berkaitan dengan mutu, yang berdasarkan peraturan Badan POM mencakup, kecuali: a. higiene pabrik; b. validasi proses; c. pelatihan; d. penyimpanan catatan; e. pelulusan produk
6. Suatu industri memiliki catatan produk dan personalia sebagai berikut
Produk Manhour per
bets
Ukuran bets Produksi per
tahun
Tablet A 50 500.000 tab 50 bets
Tablet B 120 1.000.000 tab 40 bets
Sirop C 30 1000 L 144 bets
Salep D 20 100 kg 200 bets
Jika hari kerja efektif 1 tahun adalah 222 hari dan tiap hari karyawan bekerja selama 7 jam, berapa jumlah karyawan yang diperlukan..
a. 8 orang b. 10 orang c. 12 orang d. 15 orang
7. Pengunjung atau personil yang tidak mendapat pelatihan sebaiknya tidak masuk ke area tertentu dalam pabrik, yaitu area...
a. produksi dan laboratorium pengawasan mutu b. pengolahan dan pengemasan
c. produksi dan pelabelan
d. produksi dan gudang penyimpanan
8. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk tujuan, kecuali.. a. memperkecil risiko terjadi kekeliruan,
b. mencegah pencemaran silang c. memudahkan pembersihan d. memperlancar kegiatan produksi
9. Tindakan pencegahan hendaklah diambil untuk mencegah personil yang tidak berkepentingan masuk. Area yang tidak boleh digunakan sebagai jalur lalu lintas bagi personil yang tidak bekerja di area tersebut adalah, kecuali...
a. Area produksi b. area penyimpanan c. area pengawasan mutu d. area pelabelan
26
10. Penimbangan bahan awal dan perkiraan hasil nyata produk dengan cara penimbangan hendaklah dilakukan di area penimbangan terpisah yang didesain khusus untuk kegiatan tersebut. Area penimbangan dapat menjadi bagian dari
a. area penyimpanan atau area produksi b. area produksi atau pengawasan mutu c. area pengemasan atau area penyimpanan d. area pengawasan mutu atau area penyimpanan
11. Untuk memperkecil risiko bahaya medis yang serius akibat terjadi pencemaran silang, suatu sarana khusus dan self-contained harus disediakan untuk produksi obat tertentu. Contoh produk yang dimaksud adalah
a. Tablet amoksisilin b. Pil KB
c. Injeksi sefadroksil d. Suspensi klorampenikol
12. Dari beberapa produk berikut, manakah yang bisa diproduksi dalam bangunan yang sama dengan suspensi kering amoksisilin
a. Tablet metotreksat b. Pil KB
c. Injeksi sefotaksim d. Tablet ampisilin
13. Tingkat kebersihan ruang/area untuk pembuatan obat diklasifikasikan berdasarkan jumlah maksimum
a. partikulat udara b. partikel debu c. bakteri d. mikroba
14. Kelas kebersihan untuk pembuatan obat sirop parasetamol, adalah a. Kelas A
b. Kelas B c. Kelas C d. Kelas D e. Kelas E
15. Pertukaran udara yang disyaratkan untuk ruang kelas D dan E adalah a. 6-20 kali per jam
b. 20-40 kali per jam c. 40-60 kali per jam d. 80-80 kali per jam
16. Perhatikan tabel berikut yang menggambarkan 4 jenis bangunan (A, B, C, D) berdasarkan perbedaan tekanan udara
Ruangan/Bagian Tekanan Udara
Bangunan A
Bangunan B Bangunan C Bangunan D
27
koridor ++ ++ +++ +++ Pengolahan sediaan cair + +++ ++++ ++ Pengolahan sediaan padat + +++ ++ +++Ruang produksi non betalaktam, diberikan oleh bangunan a. A
b. B c. C d. D
17. Ruang produksi betalaktam, diberikan oleh bangunan a. A
b. B c. C d. D
18. Pengisian produk yang akan disterilisasi akhir hendaklah dilakukan di lingkungan minimal Kelas
a. A b. B c. C d. D
19. Penanganan dan pengisian produk yang dibuat secara aseptis hendaklah dilakukan di lingkungan Kelas
a. A b. B c. C d. D
20. Area terpisah dan terkunci hendaklah disediakan untuk penyimpanan, kecuali bahan dan produk yang:
a. diluluskan b. ditolak,
c. ditarik kembali d. dikembalikan.
21. Secara umum, bangunan di industri farmasi dikelompokkan atas area berikut, kecuali a. Area penimbangan
b. Area produksi c. Area pengemasan d. Area penyimpanan e. Area pengawasan mutu
22. Peralatan untuk mengukur, menimbang, mencatat dan mengendalikan hendaklah a. dikalibrasi
28
b. divalidasi c. distandarisasi d. dikualifikasi
23. Ruang lingkup sanitasi dan higiene meliputi, kecuali.. a. personil,
b. bangunan, c. peralatan d. produk
24. Yang tidak termasuk higiene perorangan adalah..
a. mengenakan pakaian pelindung yang sesuai
b. mengenakan pakaian pelindung yang bersih termasuk penutup rambut
c. menjalani pemeriksaan kesehatan secara berkala
d. mencuci tangan sebelum bekerja
25. Yang bukan termasuk pakaian pelindung kelas produksi sediaan non steril adalah.. a. Topi pelindung rambut
b. Masker penutup mulut dan hidung c. Sepatu dan sarung tangan karet d. Kaca mata pelindung
26. Untuk masuk ke ruang produksi steril, personil harus melakukan hal berikut kecuali.. a. Mencuci tangan dengan bersih
b. Mandi dan keramas menggunakan sabun antiseptik c. Memakai pakaian pelindung yang telah steril d. Menuju ruang antara (air shower)
27. Pemeriksaan kesehatan mata personil yang bekerja pada pemeriksaan visual produk steril, dilakukan tiap..
a. 3 bulan b. 6 bulan c. Satu tahun d. Dua tahun
28. Tiap personil yang mengidap penyakit atau menderita luka terbuka yang dapat merugikan mutu produk hendaklah dilarang menangani, kecuali...
a. bahan awal, b. bahan pengemas,
c. bahan yang sedang diproses d. obat jadi
e. alat
29. Produk yang paling terpengaruh oleh pencemaran adalah kecuali... a. sediaan parenteral
b. sediaan yang diberikan dalam dosis besar
c. sediaan yang diberikan dalam jangka waktu yang panjang d. sediaan dengan indeks terapi sempit
29
30. Pencemaran silang hendaklah dihindarkan dengan tindakan teknis atau pengaturan yang tepat, kecuali..
a. produksi di dalam ruang terpisah b. tersedia ruang penyangga udara
c. memakai pakaian pelindung yang sesuai d. menggunakan sistem self-contained;
30
LEMBARAN KERJA MAHASISWA
(LKM)
MATA KULIAH
CARA PEMBUATAN OBAT YANG BAIK
(CPOB)
FAKULTAS FARMASI, UNIVERSITAS ANDALAS
Topik
3
IDENTITAS
Pertemuan
Ke
3
Hari/Tanggal
Topik
Produksi – Pengawasan Mutu (Sediaan nonsteril)
A PETA KONSEP
B NARASI
PT Andalas Farma, Tbk terdaftar sebagai perusahaan farmasi dengan kategori
PMDN. Pada tahun 2015 ini, PT Andalas Farma, Tbk berdasarkan rencana
produksi tahunan, telah menghasilkan banyak produk dengan rata-rata 10 bets
tiap bulan untuk tiap unit sediaan. Untuk penomoran bets, dilakukan
kodefikasi sebagai berikut: digit 1 menunjukkan bentuk sediaan yang
diproduksi (1 = padat, 2 = cair berupa larutan, 3 = cair berupa dispersi kasar,
dan 4 = semi padat) digit 2 menunjukkan bulan produksi (A = Januari, B =
Februari, dst), digit 3 dan 4 menunjukkan tahun produksi (14 = 2014, 15 =
2015, dst) dan digit 5,6 dan 7 menunjukkan nomor urut produksi.
PRODUKSI - QC
Pengolahan
Produk Non Steril
Bets31
C
SOAL - JAWAB
1.
Perhatikan gambar alur produksi tablet Parasetamol (dengan vertical close
system) berikut di PT Andalas Farma, Tbk
32
Berdasarkan alur di atas, sebutkan atau jelaskan:
1) Tunjukkan mana yang merupakan tahap pembuatan, produksi, pengolahan dan pengemasan
2) Siapa yang berwenang menerbitkan surat perintah produksi 3) Kepada siapa surat perintah tersebut diberikan?
4) Dokumen apa yang harus dibawa oleh petugas produksi untuk memulai proses produksi 5) Siapa yang merancang dan menyetujui atau mensahkan dokumen tersebut?
6) Dimana penimbangan dilakukan 7) Siapa yang melakukan penimbangan 8) Berapa kg parasetamol ditimbang
9) Dimana parasetamol yang telah ditimbang disimpan 10) Apa alat yang digunakan untuk pengeringan granul
11) Apa jenis pemeriksaan yang dilakukan dalam IPC (termasuk jumlah sampel yang diambil dan persyaratan menurut FI atau non FI)
12) Siapa yang mengambil sampel untuk IPC 13) Dimana sampel IPC diambil dan diperiksa
14) Apa jenis pemeriksaan yang dilakukan dalam untuk QC (termasuk jumlah sampel yang diambil dan persyaratan menurut FI atau non FI)
15) Siapa yang mengambil sampel untuk QC 16) Dimana sampel QC diambil dan diperiksa
17) Siapa yang memutuskan produk diluluskan atau ditolak 18) Siapa yang menempel label diluluskan atau ditolak
34
2. Perhatikan kutipan paragraf berikut, dari narasi pada topik 1
Sesuai keputusan Badan Pengawas Obat dan Makanan (BPOM), Kalbe menghentikan sementara kegiatan fasilitas produksi larutan injeksi hingga
pemeriksaan selesai. Selain itu, menghentikan pemasaran serta distribusi produk Buvanest Spinal di seluruh Indonesia. Direktur PT Kalbe Farma Vidjongtius mengatakan, pihaknya memang menerima dua sampel Buvanest Spinal dari RS Siloam yang ternyata isinya tidak sesuai. Namun, pada sampel lainnya hingga kini belum ada kasus serupa.
“Sampel yang kami terima dari salah satu rumah sakit dan kami melakukan
pemeriksaan memang kami menemukan ada ketidaksesuaian label. Tapi setelah kami melakukan pemeriksaan kembali sampel lain, kami tidak menemukan
ketidakkesesuaian label,” terang Vidjongtius.
Manajemen Kalbe Farma optimistis tak ada kesalahan dalam sistem produksinya karena menerapkan cara pembuatan obat yang baik dan benar (CPOB). Vidjongtius menyatakan, proses produksi obat hingga tahap pelabelan menggunakan mesin otomatis yang secara berkala diinspeksi untuk memastikan standardisasi produk. Dari penelusuran internal terhadap retain sampel, tidak ditemukan ada kesalahan label. Jadi, pihaknya yakin Buvanest dan asam traneksamat tak tertukar di pabrik. Dari kutipan di atas, jelaskan bagaimana cara industri membuktikan bahwa tidak ada kesalahan seperti kasus di atas.
35
D LATIHAN UJI KOMPETENSI
1. Produksi sediaan betalaktam harus dilakukan pada gedung yang terpisah, karena alasan a. Sensitisasi kuat
b. Toksisitas tinggi c. Resistensi tinggi d. Bahaya yang kuat
2. Sebelum penimbangan dan penyerahan, tiap wadah bahan awal hendaklah diperiksa.. a. kebenaran penandaan dan label pelulusan
b. jumlah wadah dan alamat pemasok c. nama bahan dan jumlahnya
d. isi wadah dan labellnya
3. Sebelum dikirim ke area produksi, bahan awal, produk antara dan produk ruahan yang diserahkan hendaklah diperiksa ulang kebenarannya dan ditandatangani oleh
a. supervisor produksi
b. supervisor pengawasan mutu c. supervisor pemastian mutu d. supervisor PPIC
4. Hasil nyata tiap tahap pengolahan bets hendaklah dicatat dan diperiksa serta dibandingkan dengan hasil teoritis. Kegiatan ini disebut dengan istilah
a. Rekonstruksi b. Reevaluasi c. Rekonsiliasi d. Rekonstitusi
5. Dalam semua tahap pengolahan perhatian utama hendaklah diberikan kepada masalah a. pencemaran silang
b. pencampuran bahan c. homogenisasi produk d. penimbangan bahan
6. Parameter operasional yang kritis untuk tiap proses pencampuran, pengadukan dan pengeringan hendaklah tercantum dalam dokumen produksi induk, dan dipantau selama proses berlangsung serta dicatat dalam catatan bets. Yang bukan termasuk parameter kritis tersebut adalah..
a. Waktu b. Kecepatan c. Suhu d. Kelembaban
7. Produk cair, krim dan salep mudah terkena kontaminasi selama proses pembuatan. Sumber cemaran utama tersebut adalah...
a. Partikel b. Debu c. Udara d. Mikroba
36
8. Perintah produksi dikeluarkan oleh.. a. Manajer PPIC
b. Manajer QC c. Manajer QA d. Mnager produksi
9. Obat jadi adalah obat yang telah mengalami proses pengemasan a. Primer
b. Sekunder c. Tersier
d. Tanpa kemasan
10. Petugas yang dibutuhkan untuk penimbangan adalah berasal dari.. a. Petugas gudang dan produksi
b. Petugas gudang dan QC c. Petugas produksi dan QC d. Petugas produksi dan PPIC
11. Terjadinya kasus salah pelabelan (packaging material) dimana sediaan A diberi label yang seharusnya untuk sediaan B, disebut dengan istilah...
a. Cross contamination b. Mix-ups
c. Segregasi d. Off label
12. Kesalahan pada kasus di atas, dapat diatasi dengan cara, kecuali... a. Barcode verifiyer
b. Full segregation c. Doble check system d. Line clearance
37
LEMBARAN KERJA MAHASISWA
(LKM)
MATA KULIAH
CARA PEMBUATAN OBAT YANG BAIK
(CPOB)
FAKULTAS FARMASI, UNIVERSITAS ANDALAS
Topik
4
IDENTITAS
Pertemuan
Ke
4
Hari/Tanggal
Topik
Produksi – Pengawasan Mutu (Sediaan steril)
A PETA KONSEP
B NARASI
PT Andalas Farma, Tbk terdaftar sebagai perusahaan farmasi dengan kategori
PMDN. Pada tahun 2015 ini, PT Andalas Farma, Tbk berdasarkan rencana
produksi tahunan, telah menghasilkan banyak produk dengan rata-rata 10 bets
tiap bulan untuk tiap unit sediaan. Untuk penomoran bets, dilakukan
kodefikasi sebagai berikut: digit 1 menunjukkan bentuk sediaan yang
diproduksi (1 = padat, 2 = cair berupa larutan, 3 = cair berupa dispersi kasar,
dan 4 = semi padat) digit 2 menunjukkan bulan produksi (A = Januari, B =
Februari, dst), digit 3 dan 4 menunjukkan tahun produksi (14 = 2014, 15 =
2015, dst) dan digit 5,6 dan 7 menunjukkan nomor urut produksi.
PRODUKSI - QC
Pengolahan
Produk Steril
Bets38
C SOAL - JAWAB
1. Perhatikan gambar alur produksi injeksi Amoksisilin berikut:
Berdasarkan alur di atas, sebutkan atau jelaskan:
1) Tunjukkan mana yang merupakan tahap pembuatan, produksi, pengolahan dan pengemasan
2) Dimana penimbangan dilakukan 3) Siapa yang melakukan penimbangan 4) Berapa kg amoksisilin ditimbang
5) Dimana amoksisilin yang telah ditimbang disimpan
6) Apa jenis pemeriksaan yang dilakukan dalam IPC (termasuk jumlah sampel yang diambil dan persyaratan menurut FI atau non FI)
7) Dimana sampel IPC diambil dan diperiksa
8) Apa jenis pemeriksaan yang dilakukan dalam untuk QC (termasuk jumlah sampel yang diambil dan persyaratan menurut FI atau non FI)
9) Dimana sampel QC diambil dan diperiksa