KARAKTERISASI FENOTIPE DAN GENOTIPE CALON
VARIETAS TURUNAN ESENSIAL (VTE)
SITU PATENGGANG PLUS DI LAHAN SAWAH
SKRIPSI
Oleh:
SUNSUN SUHARTINI 14.01.021.022
PROGRAM STUDI TEKNOBIOLOGI FAKULTAS TEKNOBIOLOGI UNIVERSITAS TEKNOLOGI SUMBAWA
SUMBAWA BESAR 2018
KARAKTERISASI FENOTIPE DAN GENOTIPE CALON
VARIETAS TURUNAN ESENSIAL (VTE)
SITU PATENGGANG PLUS DI LAHAN SAWAH
SUNSUN SUHARTINI 14.01.021.022
SKRIPSI Diajukan kepada
Universitas Teknologi Sumbawa
Sebagai salah satu persyaratan menyelesaikan Program Sarjana Strata Satu (S1)
PROGRAM STUDI TEKNOBIOLOGI FAKULTAS TEKNOBIOLOGI UNIVERSITAS TEKNOLOGI SUMBAWA
SUMBAWA BESAR 2018
Skripsi ini disusun oleh : SUNSUN SUHARTINI
14.01.021.022
Telah diperiksa dan disetujui untuk diuji
Sumbawa, 10 Juli 2018
Pembimbing I : Dr. Arief Budi Witarto, M.Eng. NIDN. 0812057101
Pembimbing II : Siti Yuriyah, S.Si.
NIP. 196807131993032008
Mengetahui,
Dekan Fakultas Bioteknologi Ketua Program Studi Teknobiologi
Khotibul Umam, S.Si., M.Sc. Lili Suharli, S.Si., M.Pd. NIDN. 0809089001 NIDN.0816079002
Skripsi ini disusun oleh : SUNSUN SUHARTINI
14.01.021.022
Telah dipertahankan di depan dewan penguji skripsi Tanggal, 10 Juli 2018
Susunan Dewan Penguji
Ketua : Dr. Arief Budi Witarto, M.Eng. NIDN. 0812057101
Anggota : Siti Yuriyah, S.Si.
NIP. 196807131993032008
Anggota : Lili Suharli, S.Si., M.Pd. NIDN. 0809089001
Anggota : Khotibul Umam, S.Si., M.Sc. NIDN.0816079002
Mengetahui,
Dekan Fakultas Bioteknologi Ketua Program Studi Teknobiologi
Khotibul Umam, S.Si., M.Sc. Lili Suharli, S.Si., M.Pd. NIDN. 0809089001 NIDN.0816079002
LEMBAR PERNYATAAN
Saya yang bertanda tangan di bawah ini: Nama :Sunsun Suhartini NIM :14.01.021.022 Prodi :Bioteknologi
Skripsi berjudul :Karakterisasi Fenotipe dan Genotipe Calon Varietas Turunan Esensial Situ Patenggang Plus di Lahan Sawah
Dengan ini menyatakan bahwa:
1. Isi dari Skripsi yang saya buat adalah benar-benar karya saya sendiri dan tidak menjiplak karya orang lain, selain nama-nama yang termaktub di isi dan tertulis di daftar pustaka dalam Skripsi ini.
2. Apabila di kemudian hari ternyata Skripsi yang saya tulis terbukti hasil jiplakan, maka saya akan bersedia menanggung segala resiko yang akan saya terima.
Demikian pernyataan ini dibuat dengan segala kesadaran.
Sumbawa, 10 Juli 2018 Yang menyatakan,
Sunsun Suhartini 14.01.021.022
v ABSTRAK
SUNSUN SUHARTINI, 2018. Karakterisasi Fenotipe dan Genotipe Calon Varietas Turunan Esensial (VTE) Situ Patenggeng Plus di Lahan Sawah dibimbing oleh Arief Budi Witarto, and Siti Yuriyah
Karakterisasi baik secara fenotipe maupun genotipe merupakan salah satu cara untuk menyeleksi tanaman hasil persilangan yang memiliki karakter sesuai dengan salah satu tetuanya. Penelitian dilakukan untuk memilih tanaman pada tiga galur padi hasil persilangan antara varietas Situ Patenggang dengan galur-galur monogenik IRBL tahan penyakit blas yang memiliki karakter agronomi yang sama dengan tetua pemulihnya yaitu Situ Patenggang. Uji fenotipe dilakukan dengan cara melakukan pengamatan beberapa karakteristik pada tanaman-tanaman galur uji, sedangkan uji genotipe dilakukan dengan cara menggunakan marka molekuler SNAP agronomi untuk mendeteksi gen terkait dengan karakter agronomi. Hasil penelitian uji fenotipe menunjukan bahwa tanaman pada ketiga galur uji telah memiliki karakter agronomi yang berbeda nyata dengan galur IRBL. Berdasarkan uji genotipe menggunakan primer SNAP agronomi, semua individu tanaman pada ketiga galur uji telah memiliki gen terkait karakter agronomi yang sama dengan Situ Patenggang. Adapun rumpun yang memiliki karakter paling mendekati dengan Situ Patenggang yaitu rumpun 1. Uji asosiasi fenotipe dan genotipe masing-masing galur menunjukan terdapat lima primer yang paling signifikan menandai karakter agronomi yaitu primer JAT1 dan SNAP RS31 terkait karakter jumlah anakan; SNAP RS12 terkait karakter panjang malai; dan TT1, TT3 terkait karakter tinggi tanaman.
Kata Kunci : Ketahanan Blas, Pyricularia grisea, Marka Molekuler, SNAP, Situ Patenggang, Varietas Turunan Esensial (VTE).
vi ABSTRACT
SUNSUN SUHARTINI, 2018. Characterization of phenotype and genotype candidate of Essensial derived variety (EDV) of Situ Patenggang Plus in the wetland. Supervised by Arief Budi Witarto and Siti Yuriyah.
Phenotype and Genotype characterization is one of method for selected fields of plant breeding that have been same character with Situ Patenggang. The purpose of this research was to selected of three rice backcross populations derived Situ Patenggang as recurrent parent and IRBL as blast resistance donor parent. Phenotypic testing was carried out identification some agronomic character of plant, while genotype characterization was carried out using SNAP associated agronomic character as molecular marker. The results of statistical analysis showed that three populations were different with IRBL as donor parent. The result of genotype evaluation show that all of individual plants have been same gene associated agronomic character with Situ Patenggang. The agronomic performance evaluation of three population selected lines showed that clump 1 qualified as the essensial derived variety. Five primer i.e., JAT1, SNAP RS31, SNAP RS12, TT1 and TT3 were selected as significant marker for identified agronomic character.
Keyword : Blast Resistance, Pirycularia grisea, Molecular marker, SNAP, Situ Patenggang, Essensial derived variety (EDV)
vii
KATA PENGANTAR
Alhamdulillahirobbil‟aalamiin, puji syukur kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya serta memberikan kelancaran dalam melaksanakan penelitian Tugas Akhir yang berjudul “Karakterisasi Fenotipe dan Genotipe Calon Varietas Turunan Esensial (VTE) Situ Patenggang Plus Di Lahan Sawah”, sehingga penyusunan laporan tugas akhir ini dapat selesai tepat pada waktunya.
Dalam Laporan ini penulis tidak lepas dari bantuan banyak pihak, oleh karena itu penulis mengucapkan terimakasih kepada :
1. Dr. Arief Budi Witarto, M.Eng selaku Pembimbing I yang telah memberikan bimbingan, arahan dan motivasi untuk segera menyelesaikan tugas akhir ini. Terimakasih telah menjadi teladan terbaik untuk kami.
2. Siti Yuriyah, S.Si selaku pembimbing II lapangan dari kelti Biologi Molekuler Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sember Daya Genetika Pertanian (BB Biogen).
3. Bapak Khotibul Umam, S.Si., M.Sc. selaku pembimbing III yang telah memberikan bimbingan dan arahan selama pengerjaan tugas akhir.
4. Semua Dosen Fakultas Bioteknologi yang telah mengantarkan penulis sampai tahap ini, terimakasih untuk semua ilmu yang telah diberikan.
5. Ibunda ku yang tidak pernah berhenti mendoakan ku, terimakasih atas semua perjuanganmu, semoga Allah SWT selalu memberkahi setiap langkah mu. 6. Keluarga yang telah memberikan do‟a, semangat dan dukungan material
selama kegiatan penelitian dan peyusunan laporan tugas akhir.
7. Ily yang tidak pernah absen dan selalu setia menemani penulis dalam mengerjakan tugas akhir, terimakasih karena telah menjadi netbook terbaik. 8. Teh Neng dan Kak Amat yang telah membantu berjalannya kegiatan tugas
akhir selama di Laboratorium Biologi Molekuler BB Biogen.
9. Sahabat Wonder Woman (Saki Bioteknologi‟14, Hana Fikom‟14, Dina Fikom„14, Muna Metalurgi‟14, Eli Bioteknologi‟14 dan Teh Liya Psikologi‟14) yang selama empat tahun telah membersamai dalam suka dan duka selama penulis menempuh pendidikan di Sumbawa.
10. Keluarga “Cemara” (Puput, Khadijah, Nisa, Winda, Aul, Mila, Hanifah, dan Qonit), terimakasih atas semua keceriaan dan kebahagiaan yang kalian berikan.
11. Keluarga “Hamasah” yang telah memberikan do‟a untuk kelancaran penulis dalam menyelesaikan tugas akhir ini.
12. Sholihati Lathifa Sakina, S.Si (Mba Thifa) yang selalu memberikan semangat, saran dan nasehat terbaiknya.
viii
13. @dalang.pelo yang selalu menghibur penulis ketika jenuh, terimakasih telah membuat video-video menghibur.
14. Teman-teman Bioteknologi 2014 yang telah sama-sama berjuang untuk menyelesaikan tugas akhir ini.
15. Teman-teman penelitian terimakasih untuk kebersamaannya selama penelitian.
Penulis sadar bahwa laporan ini masih perlu penyempurnaan, oleh karena itu penulis meminta kritik dan saran guna memperbaiki laporan tugas akhir ini. Besar harapan, laporan ini bermanfaat bagi penulis maupun semua pihak yang membutuhkan.
Sumbawa, 10 Juni 2018
ix DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
LEMBAR PERNYATAAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... ix DAFTAR TABEL ... x DAFTAR GAMBAR ... xi BAB 1. PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 3
1.2 Maksud dan Tujuan ... 3
1.3 Manfaat ... 4
BAB 2. TINJAUAN PUSTAKA 2.1 Padi ... 5
2.2 Varietas Turunan Essensial ... 6
2.3 Penyakit Blas ... 6
2.4 Varietas Situ Patenggang ... 8
2.5 Varietas IRBL ... 8
2.6 Marka Molekuler ... 8
2.7 Isolasi DNA ... 9
2.8 PCR ... 11
2.9 Elektroforesis ... 13
BAB 3. METODE PENELITIAN 3.1 Waktu dan Lokasi Penelitian ... 14
3.2 Alat dan Bahan ... 14
3.3 Cara Kerja ... 15
3.4 Analisis Data ... 18
BAB 4. HASIL DAN PEMBAHASAN 4.1 Hasil dan Pembahasan Uji Fenotipe ... 19
4.2 Hasil dan Pembahasan Uji Genotipe ... 23
BAB 5. PENUTUP 4.1 Simpulan ... 32
4.2 Saran ... 32
DAFTAR PUSTAKA ... 33
x
DAFTAR TABEL
Halaman
Tabel 1. Primer SNAP terkait karakter agronomi (Biogen 2017, Unpublish) ... 15
Tabel 2. Hasil ANOVA Karakterisasi Fenotipe Galur Sta8-S15-TB16 ... 19
Tabel 3. Hasil ANOVA Karakterisasi Fenotipe Galur Si41-S15-TB16 ... 20
Tabel 4. Hasil ANOVA Karakterisasi Fenotipe Galur Sk56-S15-TB16 ... 20
Tabel 5. Uji Duncan Galur Sta8-S15-TB16 ... 21
Tabel 6. Uji Duncan Galur Si41-S15-TB16 ... 21
Tabel 7. Uji Duncan Galur Sk56-S15-TB16 ... 22
Tabel 8. Uji kuantitas DNA padi galur Sta8-S15-TB16, Si41-S15-TB16 danSk56-S16-TB16 ... 23
Tabel 9. Hasil analisis asosiasi fenotipe dan genotipe padi galur Si41-S15-TB16. ... 31
Tabel 10. Hasil analisis asosiasi fenotipe dan genotipe padi galur Sk56-S15-TB16. ... 31
xi
DAFTAR GAMBAR
Halaman
Gambar 1.Tanaman Padi ... 5
Gambar 2.Penyakit blas daun dan leher ... 7
Gambar 3. Siklus Infeksi Pyricularia grisea ... 8
Gambar 4. Proses Amplifikasi pada PCR ... 12
Gambar 5. Elektroforegram Uji Kualitas DNA padi galur Sta8-S15-TB16 dan Si41-S15-TB16.. ... 25
Gambar 6. Elektroforegram Uji Kualitas DNA padi galur Sk56-S15-TB16.. ... 25
Gambar 7. Optimasi polimorfisme primer SNAP agronomi SNAP rs6, SNAP rs24 dan SNAP rs31 ... 26
Gambar 8. Optimasi polimorfisme primer SNAP agronomi SNAP rs12, SNAP rs21, SNAP rs26 dan SNAP rs32 ... 26
Gambar 9. Hasil Elektroforegram uji genotipe galur Sta8-S15-TB16 menggunakan primer SNAP RS7 ... 27
Gambar 10. Hasil Elektroforegram uji genotipe galur Si41-S15-TB16 menggunakan primer SNAP RS12 ... 28
Gambar 11. Hasil Elektroforegram uji genotipe galur Sk56-S15-TB16 menggunakan primer TT1 ... 29
Gambar 12. Dendogram galur Sta8-S15-TB16 ... 29
Gambar 13. Dendogram galur Si41-S15-TB16 ... 30
1 BAB I
PENDAHULUAN
1.1 Latar Belakang Masalah
Padi (Oriza sativa L) merupakan tanaman pangan yang menjadi bahan makanan pokok bagi setengah penduduk dunia (Pazuki & Sohani, 2013). Indonesia merupakan Negara yang memiliki persentase penduduk dengan konsumsi beras cukup tinggi yaitu sekitar 90%. Pesatnya peningkatan jumlah penduduk di Indonesia menjadikan kebutuhan beras juga semakin meningkat. Kelebihan beras dijadikan sebagai makanan pokok dikarenakan kandungan karbohidrat yang cukup tinggi. Kandungan karbohidrat dalam beras yaitu sekitar 78,9 g, dan kandungan gizi lainnya seperti 13 g air; 6,8 g protein; 0,7 g lemak; 6 mg kalsium, dan 140 mg posfor (Badan Ketahanan Pangan dan Penyuluhan Provinsi DIY, 2014).
Menurut data BPS (2017) produksi padi di Indonesia tahun 2015 mencapai 75,4 juta ton gabah kering giling (GKG), sedangkan jumlah penduduk pada tahun tersebut mencapai 252,2 juta jiwa. Angka tersebut masih belum dapat memenuhi kebutuhan beras nasional, terbukti dengan adanya impor beras sebanyak 1,2 juta ton pada tahun tersebut. Kurang tercukupinya kebutuhan beras nasional, salah satunya disebabkan oleh adanya gangguan organisme pengganggu tanaman seperti penyakit blas. Pada tahun 2016 sebanyak 145.009 ha terkena serangan organisme pengganggu tanaman dan 833 ha mengalami gagal panen (Ditjentan, 2016). Salah satu serangan organisme pengganggu tanaman yang cukup luas dan mengakibatkan turunnya produksi beras adalah penyakit blas dan serangan blas pada tahun 2016 mencapai 49.354 ha.
Penyakit blas disebabkan oleh cendawan Pyricularia grisea (Balitbangtan, 2015). Serangan blas terhadap padi lahan sawah cukup merugikan karena produksi beras terbanyak dihasilkan dari tanaman padi lahan sawah. Penyakit blas yang menyerang padi dapat menimbulkan banyak kerugian seperti matinya tanaman padi saat penyakit blas menyerang tanaman pada fase vegetatif dan pada fase generatif menyebabkan patahnya batang padi dan gabah menjadi hampa (Yuliani dan Maryana, 2014). Penggunaan pupuk sesuai dosis anjuran, pemakaian
2 fungisida pada benih, dan penyemprotan tanaman dengan fungisida dapat dilakukan untuk mengurangi atau mengendalikan serangan blas (Balitbangtan, 2011). Akan tetapi, penggunaan pupuk dan fungisida tidak efektif karena memerlukan biaya yang cukup besar sehingga mengurangi pendapatan petani. Upaya peningkatan stabilitas hasil panen dapat dilakukan dengan cara penggunaan varietas tahan yang dapat menjadi solusi yang efektif, murah dan ramah lingkungan untuk pengendalian penyakit blas (Santoso dan Nasution, 2008).
Varietas tahan merupakan varietas hasil perakitan yang dapat diperoleh dengan cara menyilangkan tanaman yang mengadung gen ketahanan penyakit blas dengan tanaman yang akan dikembangkan untuk dibudidaya. Salah satu varietas padi yang tahan terhadap penyakit blas adalah varietas Situ Patenggang. Varietas Situ Patenggang merupakan salah satu varietas unggul nasional yang bersifat adaptif terhadap kekeringan serta memiliki sifat amfibi, yaitu dapat bertahan pada dua kondisi lahan kering maupun lahan tergenang (Yuriyah et al, 2015). Namun demikian, varietas Situ Patenggang masih perlu ditingkatkan karakter ketahananya terhadap penyakit blas dengan cara menyilangkan (Backcross) antara varietas Situ Patenggang dengan galur-galur monogenik tahan blas yang telah dikembangkan oleh IRRI (International Rice Reasearch Institute). Galur-galur hasil persilangan tersebut telah dikembangkan dari beberapa tahun yang lalu dan telah dilakukan perbanyakan sebanyak enam kali. Hal ini bertujuan untuk mendapatkan tanaman yang memiliki karakteristik agronomi yang sama dengan tetua pemulih Situ Patenggang.
Oleh karenanya diperlukan karakterisasi secara fenotipe dan genotipe untuk melihat keseragaman karakter tanaman hasil persilangan yang sesuai dengan tetua pemulihnya (Situ Patenggang). Karakterisasi fenotipe dan genotipe merupakan salah satu cara untuk menyeleksi tanaman yang bertujuan untuk menghasilkan varietas berdaya hasil tinggi. Selain itu, karakterisasi fenotipe dan genotipe juga dapat dilakukan untuk memilih karakter tanaman yang masih mungkin untuk diperbaiki (Wirnas et al., 2012). Penampilan fenotipe suatu tanaman merupakan interaksi antara faktor genetik dan faktor lingkungan, sehingga keragaman fenotipe tanaman didapat dari keragaman genotipe yang dipengaruhi oleh lingkungan tumbuhnya. Karakterisasi genotipe dilakukan untuk
3 melihat karakter suatu tanaman berdasarkan komponen-komponen genetiknya (Oktaviana, 2016).
Analisis fenotipe dilakukan dengan cara mengukur beberapa karakter agronomi seperti tinggi tanaman, jumlah anakan, jumlah gabah, dll, sedangkan analisis genotipe dilakukan dengan memanfaatkan marka molekuler. Penggunaan marka molekuler dapat membantu menandai gen-gen yang mengontrol karakter yang diinginkan serta memiliki tingkat akurasi yang tinggi dalam mengidentifikasi karakter tanaman secara genotipe (Reflinur & Lestari, 2015). Pada penelitian ini, analisis molekuler uji keseragaman calon VTE Situ Patenggang plus dilakukan menggunakan marka SNAP agronomi. Dengan demikian, uji keseragaman ini dilakukan untuk memilih tanaman yang memiliki karakter agronomi yang sama dengan varietas Situ Patenggang baik secara fenotipe maupun genotipe.
1.2 Rumusan Masalah
1. Bagaimana karakterisasi fenotipe pada tanaman galur uji calon Varietas Turunan Esensial (VTE) Situ Patenggang Plus di lahan sawah?
2. Bagaimana karakterisasi genotipe pada tanaman galur uji calon Varietas Turunan Esensial (VTE) Situ Patenggang Plus di lahan sawah?
3. Apakah terdapat marka molekuler yang signifikan dapat berasosiasi dengan karakter agronomi padi galur-galur uji?
1.3 Maksud dan Tujuan
Maksud dan tujuan penelitian ini adalah sebagai berikut :
1. Melakukan uji karakterisasi fenotipe pada tanaman galur uji calon varietas turunan esensial (VTE) Situ Patenggang Plus di lahan sawah.
2. Melakukan uji karakterisasi genotipe menggunakan marka molekuler terkait dengan gen-gen penanda karakter agronomi. Analisis ini dilakukan untuk uji keseragaman individu tanaman galur-galur uji sehingga diketahui sumber benih yang homozigot dari calon galur turunan esensial.
3. Menseleksi marka molekuler yang paling signifikan untuk menandai karakter fenotipe padi.
4 1.4 Manfaat
Manfaat dari penelitian tugas akhir ini adalah :
1. Mendapatkan informasi keragaman karakter komponen hasil dari individu tanaman galur turunan esensial Situ Patenggang dari lahan sawah.
2. Mendapatkan informasi keragaman genotipe dari individu tanaman galur turunan esensial Situ Patenggang dari lahan sawah menggunakan marka molekuler terkait gen-gen penanda karakter morfo-agronomi.
3. Mendapatkan marka molekuler yang paling signifikan untuk menandai karakter fenotipe padi.
5 BAB II
TINJAUAN PUSTAKA 2.1 Padi
Padi termasuk dalam genus Oryza L yang memiliki 25 spesies yang tersebar di daerah tropik dan sub tropik seperti Asia, Afrika, Amerika dan Australia (Hanum, 2008). Tanaman padi memiliki adaptasi lingkungan yang luas, sehingga dapat tumbuh baik meliputi daerah kering sampai genangan dengan kedalaman 1-5 m dari dataran rendah sampai dengan ketinggian 2000 di atas permukaan laut (Daradjat et al., 2008). Menurut Grist (1960) tanaman padi dapat diklasifikasikan sebagai berikut:
Kingdom : Plantae Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Monocotyledoneae Ordo : Poales Family : Poaceae Genus : Oryza
Spesies : Oryza Sativa L.
Bagian-bagian tanaman padi yaitu sebagai berikut: 1) Akar yang berfungsi sebagai penunjang tanaman untuk tetap tegak. Akar padi terdiri dari akar radikula yang tumbuh sewaktu berkecambah bersama akar-akar lain. 2) Batang yang tersusun atas ruas-ruas dan dipisahkan oleh buku. 3) Daun yang terdiri dari helai daun yang berbentuk memanjang seperti pita dan pelepah daun yang menyelubungi batang. 4) Gabah terdiri atas biji yang terbungkus oleh sekam. Biji disebut juga dengan kariopsis yang terdiri atas embrio dan endosperma yang diselimuti oleh lapisan aleuron dan lapisan terluar yang disebut perikarp (Norsalis, 2011).
Pertumbuhan tanaman padi dibagi menjadi tiga jenis yaitu : fase vegetatif, fase reproduktif dan fase pematangan. Fase vegetatif merupakan fase pertumbuhan organ-organ vegetatif seperti pertumbuhan jumlah anakan, tinggi tanaman, jumlah bobot, dan luas daun. Fase reproduktif ditandai dengan memanjangnya beberapa ruas teratas batang tanaman, berkurangnya jumlah
Gambar 1. Tanaman Padi Sumber : Balitbangtan, 2014
6 anakan, munculnya daun bendera, mulai berisinya butir padi dan pembungaan. Sedangkan fase pamatangan ditandai butir padi yang semakin berisi, fase pematangan biasanya memerlukan waktu 30 hari (Makarin & Suhartatik, 2008).
2.2 Varietas Turunan Essensial (VTE)
Varietas turunan essensial merupakan hasil dari perakitan suatu varietas asal menjadi varietas unggul dengan cara meningkatkan nilai tambah dari varietas asal dengan penambahan satu atau beberapa sifat unggul melalui mutasi alami, mutasi induksi, variasi somaklonal, seleksi individu tanaman, silang balik, dan transformasi dengan rekayasa genetik dari varietas asal (Balitbangtan, 1994). Menurut Peraturan Pemerintah Nomor 13 Tahun 2004 tentang penamaan, pendaftaran dan penggunaan varietas asal untuk pembuatan varietas turunan essensial untuk dapat berupa varietas yang mendapat perlindungan varietas tanaman (PVT) dan varietas yang tidak mendapat PVT tetapi telah diberi nama dan didaftar oleh Pemerintah. Varietas yang tidak mendapat PVT dapat berupa Varietas Lokal dan Varietas Hasil Pemuliaan.
2.3 Penyakit Blas
Penyakit blas merupakan penyakit yang menyerang padi yang disebabkan oleh cendawan Pyricularia grisea (Pyricularia orizae) (Rossman et al., 1990). P. grisea mempunyai konidiafor panjang bersekat-sekat, berwarna kelabu, membentuk konidium pada ujungnya. Konidiumnya berbentuk seperti buah alpokat dan bersel tiga. (Sijabat, 2007). Awalnya penyakit ini berkembang di pertanian padi gogo, tetapi akhir-akhir ini sudah menyebar di lahan sawah irigasi (Balitbangtan, 2015). Hal tersebut disebabkan karena kandungan silikat pada tanaman padi lahan gogo lebih rendah dibandingkan kandungan silikat pada padi di lahan sawah. Silikat diketahui berperan peting dalam ketahanan penyakit blas (Makarim et al., 2007). P. grisea dapat menghasilkan enzim kutinase yang dapat menembus kutikula dan menghasilkan enzim proteolitik yang dapat menembus dinding sel tanaman (Gilbert et al., 1996).
Penyakit blas dapat membentuk bercak pada daun padi, buku batang, leher malai, cabang malai, dan kolar daun (Wilson & Talbot 2009). Penyakit blas
7 menimbulkan dua gejala khas yaitu blas daun yang menyerang tanaman padi pada vase vegetatif dan blas leher yang menyerang pada awal pembungaan (Yuliani & Maryana 2014). Serangan serius pada fase vegetatif dapat menyebabkan matinya tanaman padi dan serangan pada fase generatif dapat menyebabkan patahnya leher malai dan meyebaban bulir padi menjadi hampa (Indrayani et al., 2013). Bentuk khas dari bercak daun adalah belah ketupat, awalnya bercak berukuran kecil berwarna hijau gelap, abu-abu dan sedikit kebiruan. Bercak ini terus membesar pada varietas yang rentan, terutama jika kondisi lingkungan dalam keadaan lembab (Enggarini, 2012).
Gambar 2. Penyakit blas daun (kiri), Penyakit blas leher (kanan) Sumber : Yuliani & Maryana 2014
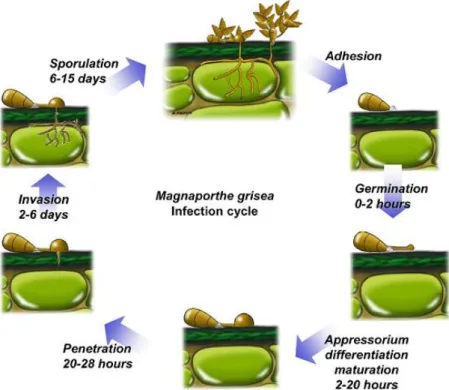
Daerah endemik penyakit blas di Indonesia meliputi Lampung, Sumatra selatan, Jambi, Sumatra barat, Sulawesi tengah, Sulawesi tenggara, dan Jawa Barat. Daur penyakit blas meliputi tiga fase yaitu infeksi, penetrasi dan kolonisasi (Cheul & Hwan 1998). Fase infeksi diawali dengan pembentukan konidia bersepta tiga yang dilepaskan oleh konidiafor. Konidia berpindah kepermukaan daun yang tidak terinfeksi melalui percikan air atau bantuan angin. Konidia menempel pada daun karena adanya perekat atau getah diujungnya (Barnita, 2010). Konidia akan berkecambah pada kondisi optimum dengan cara membentuk buluh-buluh perkecambahan yang selanjutnya menjadi appresoria (Marcel et al., 2010). Appresoria akan menembus kutikula daun dengan bantuan melanin yang ada pada dinding appresoria (Ebbole, 2007). Proses penetrasi appresoria pada kondisi optimum berlangsung 8-10 jam. Pertumbuhan hifa yang terus terjadi menyebabkan terbentuknya bercak. Pada kelembaban yang tinggi, bercak pada tanaman yang rentan menghasilkan konidia selama 3-4 hari. Konidia ini sangat
8 mudah tersebar dan merupakan inokulum untuk infeksi selanjutnya (Sudir et al., 2014). Berikut merupakan tahapan infeksi dari Pyriclaria grisea;
Gambar 3. Siklus hidup Pyricularia grisea Sumber : Ribot et al., 2009
2.4 Varietas Situ Patenggang
Varietas padi Situ Patenggang merupakan varietas padi yang dapat ditanam di sawah maupun gogo, varietas ini pertama kali dilepas pada tahun 2003. Padi varietas Situ Patenggang memiliki ciri-ciri diantaranya: memiliki bentuk gabah agak gemuk, gabah berwarna krem tua, memiliki tekstur nasi yang sedang, memiliki kadar amilosa sebanyak 23,93 %. Tanaman ini memiliki sifat khusus yaitu termasuk ke dalam beras aromatik dan rata-rata hasil panen sebanyak 3,6 - 5,6 ton per hektar. Varietas ini juga memiliki keunggulan tahan penyakit blas dan tidak mudah rebah (Balitbangtan, 2015).
2.5 Varietas IRBL
Varietas IRBL merupakan varietas padi galur-galur monogenik yang mengandung 24 jenis gen ketahanan terhadap penyakit blas yang dikembangkan oleh IRRI (International Rice Research Intitute) dan telah dikembangkan dan digunakan luas di berbagai negara. Galur-galur monogenik tersebut dapat
9 digunakan sebagai sumber gen dalam perakitan varietas tahan blas. Adapun 24 jenis gen yang terdapat pada varietas IRBL yaitu :Pia, Pib, Pii, Pik, Pik-h, Pik-m, Pik-s, Pish, Pit, Pita-2, Piz, Piz5, Piz-t, Pil, Pi3, Pi(5)t, Pi7, Pi9, Pi(11) t, Pil(2) t, dan Pi20.
2.6 Marka Molekuler
Marka molekuler merupakan penanda genetik yang bertujuan untuk mendeteksi genotipe pada suatu individu tertentu. Marka molekuler menggambarkan perbedaan genetik diantara individu-individu dalam suatu organisme atau spesies (Afifah, 2012). Terdapat tiga jenis marka molekuler yaitu marka yang berdasarkan pada hibridisasi DNA seperti Restriction Fragment Polymorphysm (RFLP), marka yang berdasarkan pada reaksi Polymerase chain reaction (PCR) dengan menggunakan sekuen nukleotida sebagai primer seperti RAPD dan AFLP dan marka yang berdasarkan pada PCR dengan menggunakan primer yang menggabungkan sekuen komplementer spesifik dalam DNA sasaran seperti STS, SSR, SCARS, dan SNPs (Mulsanti et al., 2013). RAPD merupakan penanda molekuler yang banyak digunakan dalam analisis keragaman genetik tumbuhan. Teknik ini memiliki kelebihan seperti tidak membutuhkan informasi awal dari urutan basa suatu spesies dan hanya memerlukan DNA yang relatif kecil (Langga et al., 2012)
Marka yang saat ini banyak dikembangkan salah satunya adalah marka SNAP. Marka SNAP merupakan marka hasil modifikasi dari marka SNP, modifikasi tersebut bertujuan untuk menyederhanakan teknik pembacaan hasil PCR. SNPs (Single Nucleotide Polymorhism) merupakan marka yang memiliki perbedaan satu basa pada urutan nukleotida tertentu yang muncul secara signifikan (Chrisnawati, 2016). Keunggulan marka SNAP adalah lebih mudah diaplikasikan dibandingkan dengan teknik SSR atau AFLP dan pada proses ruuning gel nya dapat menggunakan agarose, sehingga penggunaan marka SNAP tidak memerlukan biaya yang cukup besar (Lestari & Koh 2013). Akan tetapi SNAP memiliki kelemahan berupa memerlukan informasi sekuen untuk suatu gen yang menjadi target analisis dan tidak dapat membedakan antara heterozigot dan homozigot (Azrai, 2005).
10 Beberapa metode identifikasi SNP yang sering digunakan adalah Cleaved Amplified Polymorphic Sequence (CAPS), derived CAPS (dCAPS) dan Single Nucleotide Amplified Polymorphism (SNAP). Dalam aplikasinya marka CAPS dan dCAPS mempunyai keterbatasan yaitu memerlukan enzim nuklease sehingga memerlukan biaya yang masih relatif tinggi, sedangkan marka SNAP hanya memerlukan pasangan primer dan teknik PCR dan elektroforesis gel agarose standar (Neff et al., 1998). Marka SNAP (Single Nucleotide Alignmet Polimorphysm) merupakan pengembangan dari marka SNP (Single Nucletide Polymorphysm) dimana terdapat modifikasi ujung 3 OH pada salah satu dari tiga nukleotida SNP (Lestari et al., 2011). Pemilihan primer untuk marka SNAP dapat dilakukan dengan menganalisis setiap lokus. Analisis setiap lokus ini bertujuan untuk mendapatkan gambaran kemampuan setiap situs SNP dalam mengelompokan kultivar yang diuji berdasarkan sifat ketahanan terhadap penyakit Blas (Anonim, 2012).
2.7 Isolasi DNA
Isolasi DNA merupakan langkah awal yang harus dikerjakan dalam proses identifikasi keragaman genotipe tanaman secara molekuler. Prinsip dasar isolasi total DNA dari jaringan adalah dengan memecah dan mengekstraksi jaringan tersebut sehingga akan terbentuk ekstrak sel yang terdiri DNA, RNA dan substansi dasar lainnya. Ekstrak sel kemudian dipurifikasi sehingga dihasilkan pelet sel yang mengandung DNA total. Tahapan isolasi DNA terdiri tiga tahap yaitu penghancuran jaringan (lisis); ektraksi atau pemisahan DNA dari senyawa kontaminan seperti protein, selulosa, dll; dan tahapan akhir yaitu purifikasi atau proses pemurnian DNA (Vibhuti et al., 2015) .
Tahapan utama dalam proses isolasi DNA adalah lisis atau perusakan dinding sel tanpa harus merusak DNA yang dibutuhkan. Penghancuran sel atau jaringan dapat dilakukan dengan cara menggerus sampel menggunakan mortar ataupun eppendorf menggunakan sumpit atau juga dapat menggunakan alat seperti tissuelyser. Perusakan dinding sel umumnya dilakukan dengan cara menambahkan buffer lisis pada sampel yang telah digerus (Handoyo & Rudiretna, 2008). Buffer lisis yang biasa digunakan untuk memecah sel untuk isolasi DNA jaringan
11 tanaman adalah CTAB (Cetyl Trimethyl Ammonium Bromide). Buffer CTAB berfungsi untuk melarutkan membran dan memecah lipid yang terdapat pada jaringan tanaman. Penggunaan konsentrasi yang tepat pada buffer tersebut dapat meningkatkan efisiensi pemisahan kontaminasi protein pada ektraksi DNA (Borse et al., 2011).
Pemisahan DNA dilakukan dengan cara setrifugasi yaitu memisahkan seyawa berdasarkan berat jenis molekul. Sentrifugasi dilakukan di dalam sebuah mesin sentrifugasi dengan kecepatan bervariasi antara 12000 rpm – 15000 rpm. Penambahan kloroform-isoamil sebelum sentrifugasi dilakukan untuk memisahkan larutan menjadi fase cair dan padat, dimana fase cair merupakan DNA dan fase padat merupakan campuran ampas sampel yang telah diisolasi (Faatih, 2009). Proses purifikasi DNA dilakukan dengan mencuci DNA menggunakan etanol 90% untuk menghilangkan kontaminan yang masih tersisa. Pengunaan RNAse juga digunakan untuk menghasilkan DNA yang murni tanpa kontaminasi RNA. RNAse biasanya ditambah pada akhir proses isolasi setelah penambahan TE 50x, kemudian diinkubasi pada suhu 37o C untuk mengaktifkan enzim RNAse tersebut.
Hal yang harus diperhatikan dalam isolasi DNA adalah menghasilkan DNA tanpa adanya kontaminan seperti protein dan RNA ataupun senyawa polisakarida dan fenol yang dapat menghambat kerja enzim saat proses PCR (Allen et al., 2014). Selain itu, hal lain yang harus diperhatikan adalah metode yang digunakan harus efektif dan tidak boleh mengubah struktur dan fungsi DNA, metode yang digunakan juga harus sederhana dan cepat (Nurazzizah, 2014). Saat ini telah dikembangkan metode isolasi dan pemurnian DNA dari berbagai macam sel. Salah satunya adalah penggunaan kit yang dapat menghasilkan DNA yang murni tanpa kontaminan seperti protein, RNA dan senyawa lainnya. Akan tetapi penggunaan kit dalam isolasi DNA memerlukan biaya yang cukup mahal terlebih jika jumlah sampel yang digunakan banyak (Healey et al., 2014)
2.8 PCR (Polimerase Chain Reaction)
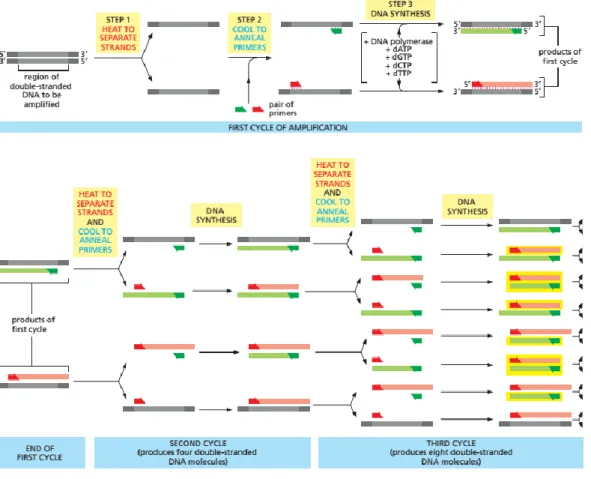
PCR merupakan suatu metode enzimatis untuk amplifikasi DNA secara in vitro. PCR dapat meningkatkan jumlah urutan DNA sebanyak ribuan bahkan
12 jutaan kali dari jumlah semula, sekitar 106 -107 kali. Setiap urutan basa nukleotida yang diamplifikasi akan menjadi dua kali jumlahnya (Fatchiyah et al., 2011). Pada proses PCR diperlukan beberapa komponen utama, yaitu DNA cetakan, Oligonukleotida primer, deoksiribonukelotida trifosfat (dNTP), Enzim DNA Polimerase, dan komponen pendukung lain adalah senyawa buffer. Pada proses PCR menggunakan alat termosiklus, sebuah mesin yang memiliki kemampuan untuk memanaskan sekaligus mendinginkan tabung reaksi dan mengatur temperatur untuk tiap tahapan reaksi. Keberhasilan PCR bergantung pada pemilihan DNA hibridisasi dan kemampuan DNA polymerase untuk menyalin DNA (Alberts et al., 2008). Berikut (Gambar 3) merupakan proses amplifikasi DNA dengan menggunakan PCR;
Gambar 4. Proses amplifikasi pada PCR Sumber : Alberts et al., 2008
13 Ada tiga tahapan penting dalam proses PCR yang selalu terulang dalam 30-40 siklus dan berlangsung sangat cepat. Tahapan pertama yaitu tahapan denaturasi. Denaturasi merupakan tahapan pembukaan DNA dari untai tunggal menjadi untai ganda. Tahapan ini biasanya berlangsung selama 3 menit. Tahapan kedua yaitu tahapan annealing atau penempelan primer, suhu optimal annealing pada setiap primer berbeda. Suhu annealing berkisar 36o C sampai dengan 72o C dan waktu yang digunakan sekitar 30-45 detik. Tahapan ketiga yaitu tahapan extention atau pemanjangan primer, tahapan extention biasa dilakukan pada suhu 72o C dan waktu yang digunakan kisaran 1 menit. Reaksi-reaksi tersebut di atas diulangi lagi dari 25 – 30 kali (siklus) sehingga pada akhir siklus akan diperoleh molekul-molekul DNA rantai ganda yang baru yang merupakan hasil polimerasi dalam jumlah yang jauh lebih banyak dibandingkan dengan jumlah DNA cetakan yang digunakan. Banyaknya siklus amplifikasi tergantung pada konsentrasi DNA target dalam campuran reaksi (Yusuf, 2010).
2.9 Elektroforesis
Elektroforesis merupakan suatu metode untuk memisahkan fraksi-fraksi molekul berdasarkan ukuran, bentuk dan kecepatan migrasi suatu molekul yang memanfaatkan pengaruh medan listrik. Elektroforesis juga dapat digunakan untuk memisahkan RNA, DNA dan Protein, dimana molekul DNA memiliki muatan negatif (-). Pemisahan DNA tersebut didasarkan pada ukuran ukuran molekul DNA yang bermigrasi dari katoda ke anoda, dengan kata lain molekul yang lebih kecil akan bermigrasi lebih cepat melalui pori-pori pada gel dibandingkan molekul yang besar (Kreuzer & Massey 2005). Cara elektroforesis telah digunakan untuk analisa virus, asam nukleat, enzim, dan protein lain, serta molekul-molekul organik dengan berat molekul rendah seperti asam amino (Saputra, 2014).
Teknik elektroforesis digunakan untuk memisahkan atau mempurifikasi makromolekul. Makromolekul yang dijadikan objek elektroforesis adalah protein dan asam nukleat yang memiliki perbedaan ukuran, kadar ion, dan molekul-molekul penyusunnya. Molekul-molekul-molekul tersebut diletakan dalam medan listrik sehingga akan bermigrasi karena adanya perbedaan muatan. Molekul protein dan
14 asam nukleat yang bermuatan negative akan bergerak dari kutub negatif munuju kutub positif dari gel elektroforesis. Kecepatan molekul yang bergerak pada medan lisrtik tergantung pada muatan, bentuk dan ukuran. Posisi molekul yang terseparasi pada gel dapat dideteksi dengan pewarnaan atau autoradiografi, atau pun dilakukan kuantifikasi dengan densitometer (Arif, 2012).
Pemisahan makro molekul seperti DNA biasanya menggunakan gel agarose yang merupakan gel yang lebih berpori dibandingkan poliakrilamide dan memiliki ukuran pori yang relatif lebih besar. Agarose merupakan primer linear dari D-galaktosa dan 3,6-anhidro-L-galaktose yang diekstraksi dari rumput laut. Kerapatan pori pada agarose dapat ditentukan dari jumlah konsentrasi agarose yang digunakan (Kreuzer & Massey 2005).
15 BAB III
METODE PENELITIAN 3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan selama 5 bulan pada tanggal 15 Mei 2017 sampai dengan 15 September 2017. Penelitian ini bertempat di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB BIOGEN), Jalan Tentara Pelajar No. 3A, Bogor 16114, Jawa Barat.
3.2 Alat dan Bahan
Alat yang digunakan pada penelitian yaitu counter, baki dan penggaris digunakan untuk karakterisasi fenotipe padi. Adapun alat-alat yang digunakan untuk isolasi DNA, PCR dan elektroforesis diantaranya : eppendorf, mikropipet (1000p, 200p, 20p, 2p), tip berbagai ukuran, cool box, sumpit, waterbath, sentrifus beckman mikrofuge, tisu, incubation shaker, plastik, vortex maxi mix II, vortex spin down, mesin PCR tetrad PTC-225, Erlenmeyer, microwave, gelas ukur, neraca analitik, parafilm, plat tetes, cetakan gel, seperangkat elektroforesis agarose, Gel DocTMImager E.
Material genetik yang digunakan pada penelitian yaitu rumpun dan daun padi galur Sta8-S15-TB16, Si41-S15-TB16, dan Sk56-S15-TB16 tahan blas. Total rumpun yang dianalisis sebanyak lima rumpun, masing-masing rumpun diambil tiga malai (Lampiran 1). Marka molekuler yang digunakan sebagai primer berupa primer SNAP (Single Nucleotide Amplified Polymorphism) terkait dengan gen-gen pengatur karakter morfo-agronomi (Tabel 1). Bahan lain yang digunakan pada penelitian ini yaitu nitrogen cair, buffer Cetyl Trimethyl Ammonium Brommide (CTAB), natrium disulfit, chloroform–isoamilalcohol (24:1) atau chisam, natrium asetat 3 M, isopropanol, etanol 70%, tris-EDTA (TE), tris-borat-EDTA (TBE) 0.5x, RNAse, Ultrapure Water, Agarose, lamda DNA, loading dye, ddH2O,
16 Tabel 1. Primer SNAP terkait karakter agronomi (Biogen 2017, Unpublished)
Kode
Primer Krom Sekuen
Panjang primer Suhu Annealing TT1 1 F: 5'CCTCAGACAAGAATGGCATGTCAAATGTATATCTA-3’ 35 bp 62o C R: 5’CGATGGTAACACAATAAAGCAGCATTTTGAA-3’ 32 bp TT3 6 F: R: 5’CCATCAAGGCCGTACCTGGAGGAT-3’ 5’CAAAATGCTATAGTAGAGCCTCATTGACCATATTTT-3’ 24 bp 62o C 36 bp JAT1 1 F: 5’ATTTAATAGCTTAAAATTCAGGAGGGATGTTACTT-3’ 35 bp 62o C R: 5’CATATTCATAAAAGAGGAATATATCATCAGATTGCA-3’ 36 bp SNAP RS7 1 F: 5’GATCAGAGATCAATCAGCACCGGTCAA-3’ 27 bp 62o C R: 5’CCATCCTCACATCCTTTCCCTTCAGAA-3’ 27 bp SNAP RS12 12 F: 5’TTGCCAAACCACAATTGAGGCAAGTAA-3’ 27 bp 62o C R: 5’TTTAAATAAGACAAACGGTCAAACGTTAGACATGAA-3’ 36 bp SNAP RS21 2 F: 5’GGTGATTTGATAATCTCACGCTACCTCTTTCA-3’ 32 bp 62o C R: 5’GGTGACCTTAATGAAGATATGATAAAATGCACTAGA-3’ 36 bp SNAP RS31 1 F: 5’CAAAACAGCATGGCATCATGGATATGTC-3’ 28 bp 61o C R: 5’CCACAATGTGAAACCTGGACGGTGT-3’ 25 bp
Ket: Krom = Kromosom; F = Forward; R=Reverse; TT = Tinggi tanaman; JAT = Jumlah Anakan Total; RS = Refference Sequence,
RS6, RS12 = Panjang malai; RS7 = Umur berbunga; RS21 = Sudut daun bendera; RS31 = Jumlah anakan produktif
3.3 Cara Kerja
1. Karakterisasi Fenotipe
Karakterisasi Fenotipe dilakukan dengan cara mengukur panjang malai padi setiap malai dari beberapa rumpun, setelah itu dilakukan penghitungan jumlah gabah padi total, jumlah gabah hampa dan jumlah gabah padi yang berisi. Untuk karakterisasi fenotipe pada penelitian ini terdapat lima rumpun pada setiap galur, dari lima rumpun tersebut diambil tiga malai padi untuk mengetahui panjang malai, jumlah gabah hampa dan jumlah gabah isi pada setiap malai, selanjutnya dari galur tersebut diambil 100 biji gabah isi untuk ditimbang beratnya menggunakan neraca digital. Data hasil karakterisasi fenotipe kemudian dianalisis menggunakan SAS untuk mengetahui persentase beberapa karakter padi yang memiliki karakteristik fenotipe yang sama dengan Situ Patenggang.
17 2. Isolasi DNA
Isolasi DNA dimulai menyiapkan eppendorf yang telah diberi nama sesuai dengan nama sampel tanaman sebanyak 70 sampel. Daun padi lahan sawah yang telah disemai selama dua minggu lalu dipindahkan ke tanah selama satu minggu, kemudian dipotong lalu dimasukan ke dalam eppendorf. Eppendorf yang telah berisi sampel dimasukan kedalam coolbox yang berisi nitrogen cair, kemudian daun padi pada eppendorf digerus menggunakan sumpit. Penggerusan daun harus dilakukan secara cepat agar jaringan daun yang digerus tetap dalam keadaan beku dan tidak merusak jaringan. Penambahan buffer CTAB sebanyak 750 µl dilakukan segera sampel selesai digerus. Sampel kemudian diinkubasi dalam waterbath selama 20 menit dengan suhu 65oC, setiap lima menit sampel dibolak-balik sebanyak 20 kali. Kloroform–isoamil alkohol (24 :1) kemudian dimasukan sebanyak 750 µl lalu dibolak-balik sebanyak 20 kali, lalu disentrifuse dengan kecepatan 12.000 rpm selama 15 menit.
Hasil sentrifuse berupa supernatant dipindahkan ke eppendorf yang baru, kemudian ditambahkan 60 µl Na-asetat 3 M kedalam eppendorf yang berisi supernatant tersebut lalu dibolak-balik pelan selama 10 kali. Selanjutnya ditambahkan isopropanol dingin sebanyak 50 µl kemudian sampel disimpan di freezer selama 2 jam/overnight. Setelah dua jam kemudian sampel dibolak-balik selama 20 kali kemudian disentrifuse selama 10 menit. Cairan hasil sentrifuse kemudian dibuang dan ditambahkan etanol 70% sebanyak 200 µl dan sentrifuse kembali selama 10 menit. Cairan hasil sentrifuse dibuang dan eppendorf yang berisi DNA (pellet) dikering-anginkan (suhu ruang) selama 1 hari. DNA yang telah menjadi pellet larutkan dengan 50 µl buffer TE dan 1 µl RNAse lalu diinkubasi selama 1 jam dengan suhu 37o C. DNA yang telah diinkubasi selanjutnya dapat digunakan untuk melakukan pengujian kuantitas dan kualitas DNA.
3. Uji Kuantitas DNA
Kuantitas DNA diukur dengan menggunakan spektofotometer nanodrop, diawali dengan memasukan 1 µL Ultrapure Water ke dalam lubang optik spektrofotometer nanodrop untuk membilas nanodrop,
18 kemudian Buffer TE pH 8 sebanyak 1 µL, selanjutnya DNA padi sebanyak 1 µL dimasukan kedalam lubang optik spektrofotometer dan setiap mengganti DNA dikeringkan dengan tisu. Hasil pengukuran nanodrop seperti konsentrasi DNA dan kemurnian DNA dapat dilihat dapat dilihat pada program komputer.
4. Uji Kualitas DNA
Uji kualitas DNA dengan membuat gel dengan menggunakan agarose 1% dengan 50 ml TBE pada tabung Erlenmeyer. Campuran kemudian dipanaskan dalam microwave selama 2 menit sampai agarose larut, kemudian didinginkan sebentar di air yang mengalir lalu dituangkan ke dalam cetakan gel elektroforesis kemudian didiamkan selama 15 menit. Gel yang terbentuk kemudian dimasukan ke dalam elektroforesis yang telah berisi TBE 0.5x. Plat tetes yang dilapisi parafilm disiapkan untuk mencampurkan 1µl loading dye dengan 3 µl DNA selain itu digunakan marka lamda (λ) 100 ng dan 50 ng sebanyak 3 µl dan loading dye 1 µl yang akan menjadi acuan ukuran DNA dalam nanogram. Kedua campuran kemudian dimasukan ke dalam sumur gel agarose untuk dilakukan elektroforesis dengan voltase 100 volt selama 30 menit. Gel hasil elektroforesis kemudian dimasukan ke dalam Gel Doc imagertm untuk melihat pita DNA yang dihasilkan.
5. Analisis PCR untuk seleksi Polimorfisme Primer
Reaksi PCR untuk optimasi primer ini diawali dengan melakukan pengenceran pada primer yang akan digunakan. Primer yang digunakan pada penelitian ini yaitu primer SNAP agronomi. Pengenceran dilakukan dengan menambahkan ddH2O sebanyak 180 µL untuk masing-masing
primer dan 10 µL untuk setiap primer forward dan reverse. Campuran lalu di-vortex dan di-spindown. Setelah melakukan pengenceran primer selanjutnya membuat mix PCR dengan menambahkan KAPA, primer dan ddH2O sebanyak sampel yang dibutuhkan. DNA sebanyak 2 µL dan
KAPA yang telah dicampurkan, dimasukan ke dalam eppendorf. Campuran lalu di-spindown dan kemudian masukan pada mesin PCR selanjutnya hasil PCR dapat dianalisis dengan melakukan elektroforesis.
19 3.4 Analisis Data
Data yang didapat dari hasil penelitian berupa data kuantitatif yang terdiri dari data karakterisasi fenotipe dan genotipe padi galur-galur uji. Adapun analisis data yang digunakan untuk karakterisasi fenotipe yaitu ANOVA (Analysis of variance) dengan menggunakan aplikasi SAS. Analisis data hasil karakterisasi genotipe dilakukan dengan menggunakan aplikasi Tasel 3.0 untuk melihat kekerabatan padi galur-galur uji dengan tetua pemulihnya (Situ Patenggang) dan analisis asosiasi fenotipe dan genotipe padi galur-galur uji untuk melihat marka molekuler yang paling signifikan sebagai penanda yang kuat untuk karakter agronomi padi.
20 BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil dan Pembahasan Uji Fenotipe
Analisis karakterisasi fenotipe padi dilakukan pada saat pertumbuhan padi masih dalam fase vegetatif, generatif dan setelah panen. Beberapa karakteristik fenotipe padi yang diamati pada masa pertumbuhan berupa tinggi tanaman fase vegetatif, tinggi tanaman fase generatif , jumlah anakan fase vegetatif, dan jumlah anakan fase generatif. Adapun beberapa karakteristik yang diamati setelah panen berupa panjang malai, jumlah gabah hampa, jumlah gabah isi dan jumlah gabah total. Hasil pengamatan tersebut kemudian dianalisis menggunakan SAS untuk mengetahui nilai signifikansi masing-masing karakter agronomi yang telah sama dengan tetua pemulihnya yaitu Situ Patenggang. Berikut merupakan hasil analisis uji fenotipe tiga galur padi menggunakan SAS dari beberapa karakteristik padi. Tabel 2. Hasil Analisis Karakterisasi Fenotipe Galur Sta8-S15-TB16
Karakter Panjang Malai Jumlah Gabah Hampa Jumlah Gabah Isi Jumlah Gabah Total TT fase vegetatif TT fase generative JAT fase vegetatif JAT fase generatif p-value <,0001* 0,13 0,0002* 0,0013* 0,3051 <,0001* 0,2405 0,7713
Ket : p-value <0,05 = berbeda nyata dengan IRBLta2-Re, p-value > 0,05 = tidak berbeda nyata dengan IRBLta2-Re, TT=tinggi tanaman, JAT=jumlah anakan
Uji ANOVA bertujuan untuk melihat perbandingan karakter agronomi antara tanaman galur uji dengan kedua tetua yaitu Situ Patenggang dan IRBL. Berdasarkan hasil ANOVA galur Sta8-S15-TB16 (Tabel 2) nilai signifikansi (p-value) menunjukan bahwa karakter jumlah gabah hampa, tinggi tanaman fase vegetatif, jumlah anakan fase vegetatif dan generatif memiliki genotipe yang tidak berbeda nyata dengan IRBLta2-Re sebagai tetua donor. Hal tersebut menunjukan bahwa ketiga karakter tersebut memiliki karakter agronomi yang sama dengan IRBLta2-Re.
21 Tabel 3. Hasil Analisis Karakterisasi Fenotipe Galur Si41-S15-TB16
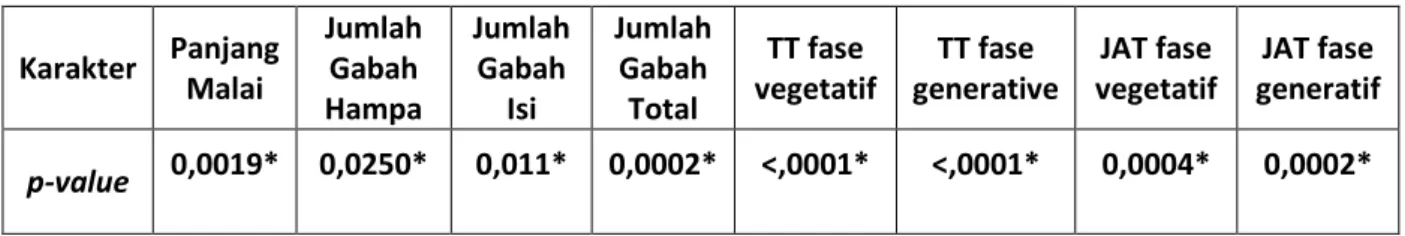
Karakter Panjang Malai Jumlah Gabah Hampa Jumlah Gabah Isi Jumlah Gabah Total TT fase vegetatif TT fase generative JAT fase vegetatif JAT fase generatif p-value 0,0019* 0,0250* 0,011* 0,0002* <,0001* <,0001* 0,0004* 0,0002*
Ket : p-value <0,05 = berbeda nyata dengan IRBLi-F5, p-value > 0,05 =
tidak berbeda nyata dengan IRBLi-F5, TT=tinggi tanaman, JAT=jumlah anakan
Hasil ANOVA galur Si41-T15-TB16 (Tabel 3) nilai signifikansi (p-value) menunjukan bahwa semua karakter yaitu panjang malai, jumlah gabah hampa, jumlah gabah isi, jumlah gabah total, tinggi tanaman fase vegetatif, tinggi tanaman fase generatif, jumlah anakan fase vegetatif dan jumlah anakan fase generatif memiliki genotipe yang berbeda nyata dengan tetua donornya (IRBLi-F5). Hal tersebut menunjukan bahwa semua karakter yang diamati pada galur tersebut telah memiliki karakter agronomi yang berbeda dengan tetua donornya yaitu IRBLi-F5.
Tabel 4. Hasil Analisis Karakterisasi Fenotipe Galur Sk56-S15-TB16
Karakter Panjang Malai Jumlah Gabah Hampa Jumlah Gabah Isi Jumlah Gabah Total TT fase vegetatif TT fase generative JAT fase vegetatif JAT fase generatif p-value 0,0019* 0,0250* 0,011* 0,0002* <,0001* <,0001* 0,0004* 0,0002*
Ket : p-value <0,05 = berbeda nyata dengan IRBLkp-k60, p-value > 0,05 = tidak berbeda nyata dengan IRBLkp-k60, TT=tinggi tanaman, JAT=jumlah anakan
Hasil ANOVA galur Sk56-S15-TB16 (Tabel 4) nilai signifikansi (p-value) menunjukan bahwa beberapa karakter seperti panjang malai, jumlah gabah isi, jumlah gabah total, tinggi tanaman fase vegetatif, tinggi tanaman fase generatif, jumlah anakan fase vegetatif dan jumlah anakan fase generatif memiliki nilai signifikansi (p-value) yang berbeda nyata dengan tetua donornya IRBLkp-k60. Hal tersebut menunjukan bahwa galur Sk56-S15-TB16 memiliki karakter agronomi yang berbeda dengan tetua donornya (IRBLkp-k60). Pada karaketer jumlah gabah hampa, menunjukan nilai (p-value) yang tidak berbeda nyata dengan IRBLkp-k60 yang menunjukan bahwa karakter jumlah hampa pada galur
22 uji masih memiliki kesamaan dengan tetua donornya yaitu IRBLkp-k60. Uji lanjutan perlu dilakukan untuk memastikan keragaman galur-galur yang diuji dengan analisis Duncan, hasil analisis ini seperti ditampilkan pada Tabel 5.
Tabel 5. Uji Duncan Individu Tanaman Galur Sta8-S15-TB16
Karakter Sampel
Situ Patenggang IRBLta2-Re Sta8-S15-TB16
Panjang Malai 24,1c 19,4d 26,9c
Jumlah Gabah Hampa 52ab 24b 42ab
Jumlah Gabah Isi 155b 103c 168b
Jumlah Gabah Total 207abc 127d 210ab
Tinggi Tanaman Fase Vegetatif 88,7a 76,2a 85,4a Tinggi Tanaman Fase Generatif 125,8ab 74,9c 128,6ab
Jumlah Anakan Fase Vegetatif 12a 12a 15a
Jumlah Anakan Fase Generatif 8a 10a 9a
Ket : Angka-angka yang diikuti dengan huruf yang sama pada baris yang sama menunjukan karakter yang tidak berbeda nyata.
Uji Duncan dilakukan bertujuan untuk melihat perbandingan antara galur uji terhadap kedua tetua yaitu Situ Patenggang dan IRBL. Berdasarkan hasil uji Duncan galur Sta8-S15-TB16 menunjukan bahwa semua karakter agronomi yang diuji pada galur tersebut telah memiliki karakter yang sama atau mendekati dengan tetua pemulihnya yaitu Situ Patenggang. Hal tersebut dapat dilihat pada angka-angka yang diikuti huruf yang sama pada masing-masing galur.
Tabel 6. Uji Duncan Individu Tanaman Galur Si41-S15-TB16
Karakter Sampel
Situ Patenggang IRBLi-F5 Si41-S15-TB16
Panjang Malai 24,1a 16,4c 21,6ab
Jumlah Gabah Hampa 52abc 18c 53abc
Jumlah Gabah Isi 155ab 65c 146ab
Jumlah Gabah Total 207b 65c 199b
Tinggi Tanaman Fase Vegetatif 88,7a 164,1c 82,1ab Tinggi Tanaman Fase Generatif 125,8a 138,1b 118,1a
Jumlah Anakan Fase Vegetatif 12 b 7a 13b
Jumlah Anakan Fase Generatif 8b 7a 9b
Ket : Angka-angka yang diikuti dengan huruf yang sama pada baris yang sama menunjukan karakter yang tidak berbeda nyata.
23 Uji Duncan galur Si41-S15-TB16 (Tabel 6), menunjukan hasil yang sama dengan uji Duncan pada galur Sta8-S15-TB16 dimana semua karakter agronomi yang diuji pada galur tersebut telah memiliki karakter yang sama atau mendekati dengan tetua pemulihnya yaitu Situ Patenggang.
Tabel 7. Uji Duncan Individu Tanaman Galur Sk56-S15-TB16
Karakter Sampel
Situ Patenggang IRBL-ta Sk56-S15-TB16
Panjang Malai 24,1d 20,1e 29,1ab
Jumlah Gabah Hampa 52ab 21c 40bc
Jumlah Gabah Isi 155a 87b 132a
Jumlah Gabah Total 207a 87c 172ab
Tinggi Tanaman Fase Vegetatif 88,7ab 20,7c 87,7ab Tinggi Tanaman Fase Generatif 125,8b 210,7c 136,1ab
Jumlah Anakan Fase Vegetatif 12b 9a 13b
Jumlah Anakan Fase Generatif 8b 9b 10b
Ket : Angka-angka yang diikuti dengan huruf yang sama pada baris yang sama menunjukan karakter yang tidak berbeda nyata.
Pada uji Duncan galur Sk56-S15-TB16 (Tabel 7), terdapat satu karakter yang berbeda nyata dengan Situ Patenggang yaitu karakter panjang malai, akan tetapi pada galur uji tersebut memiliki malai yang lebih panjang dibandingkan dengan malai pada Situ Patenggang, sehingga dapat dikatakan bahwa galur Sk56-S15-TB16 memiliki panjang malai yang lebih baik dibandingkan dengan Situ Patenggang. Panjang malai pada tanaman padi akan mempengaruhi banyak jumlah gabah sehingga semakin panjang suatu malai maka jumlah gabah total pada tanaman tersebut lebih banyak dan dapat mempengaruhi produksi jumlah gabah. Hal tersebut sesuai dengan hasil penelitian Ichsan et al. (2017), bahwa karakter agronomi seperti ukuran biji, panjang malai, jumlah bulir per malai dan jumlah malai perumpun dapat mempengaruhi rata-rata hasil panen. Pada penelitian tersebut menunjukan bahwa varietas Situ Patenggang memiliki karakter agronomi yang lebih bagus sehingga memiliki rata-rata hasil panen yang lebih tinggi dibandingkan varietas lokal sipulo dan sanbei yang memiliki karakter agronomi dibawah Situ Patenggang.
24 4.2 Hasil dan Pembahasan Uji Genotipe
4.2.1 Uji Kuantitas dan Kualitas DNA
Hasil Isolasi DNA padi pada penelitian ini dilakukan pengujian kuantitas dan kualitas DNA, hasil uji kuantitas menunjukan DNA padi telah terisolasi. Uji kuantitas DNA dilakukan untuk mengetahui konsentrasi dan kemurnian dari DNA yang telah terisolasi. Nilai konsentrasi dan kemurnian diperoleh secara otomatis menggunakan spektrofotometer nanodrop. Spektrofotometer ini menggunakan sistem retensi sample menggunakan 1µl DNA tanpa harus menggunakan kuvet atau kapiler. Dari hasil spektrofotometer, DNA dari galur Sta8-S15-TB16, Si41- S15-TB16, dan Sk56-S15-TB16 memiliki konsentrasi tinggi sehingga dapat dilakukan pengujian PCR. Selain itu, DNA secara keseluruhan memiliki kemurnian yang baik (Tabel 6). Hal ini karena DNA memiliki nilai A260/280 kisaran antara 1.8 sampai 2.0 (Healey et al., 2014).
Tabel 8. Uji kuantitas beberapa DNA padi galur Sta8-S15-TB16, Si41-S15-TB16, dan Sk56-S15-TB16,
No Sampel Konsentrasi DNA (ng/µL) A260/280
1 Sta8-S15-TB16-A 295.7 1.83 2 Sta8-S15-TB16-B 303.1 1.89 3 Sta8-S15-TB16-C 329.8 1.88 4 Sta8-S15-TB16-D 255.0 1.88 5 Sta8-S15-TB16-E 195.6 1.80 6 Si41-S15-TB16-A 727.47 1.96 7 Si41-S15-TB16-B 208.31 1.77 8 Si41-S15-TB16-C 422.09 1.86 9 Si41-S15-TB16-D 409.24 1.86 10 Si41-S15-TB16-E 266.14 1.88 11 Sk56-S15-TB16-A 608.4 1.96 12 Sk56-S15-TB16-B 1203.6 1.97 13 Sk56-S15-TB16-C 340.8 1.92 14 Sk56-S15-TB16-D 1488.6 1.96 15 Sk56-S15-TB16-E 1182.9 1.98
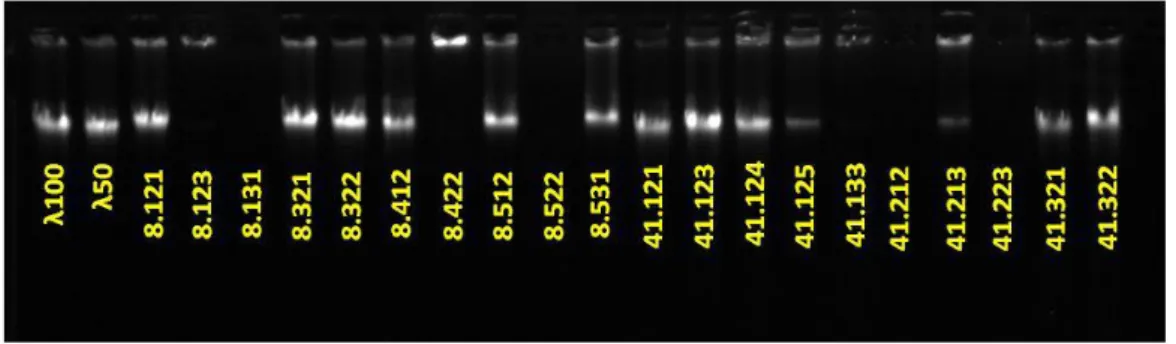
Uji kualitas DNA dilakukan dengan menggunakan agarose 1%, uji kualitas DNA dilakukan pada beberapa sampel DNA. Pada uji kualitas DNA ini tidak semua sampel memunculkan pita DNA (Gambar 5). Hal tersebut menunjukan bahwa terdapat sampel dengan konsentrasi DNA yang rendah (Harahap, 2017). DNA yang memiliki konsentrasi tinggi dan kemurnian yang baik dari setiap
25 sampel dipilih untuk dilakukan uji kualitas DNA. Uji kualitas dilakukan untuk mengetahui DNA yang berhasil diisolasi. Elektroforegram menunjukan bahwa sampel pada padi galur Sta8-S15-TB16, Si41-S15-TB16 dan Sk56-S15-TB16 memiliki konsentrasi DNA yang tinggi. Hal ini ditandai dengan ketebalan pita pada tiap sampel DNA yang hampir sama dengan lamda yang memiliki konsentrasi 50 ng/µl dan 100 ng/µl. Pita DNA sampel menunjukan bahwa DNA tidak berbeda nyata dengan lamda.
Gambar 5. Elektroforegram Uji Kualitas beberapa DNA padi galur Sta8-S15-TB16 dan Si41-S15-TB16.
Ket : Standar DNA konsentrasi 100 dan 50 ng/µL
Gambar 6. Elektroforegram Uji Kualitas beberapa DNA padi galur Sk56-S15-TB16..
Ket : Standar DNA konsentrasi 100 dan 50 ng;
4.2.2 Optimasi Primer
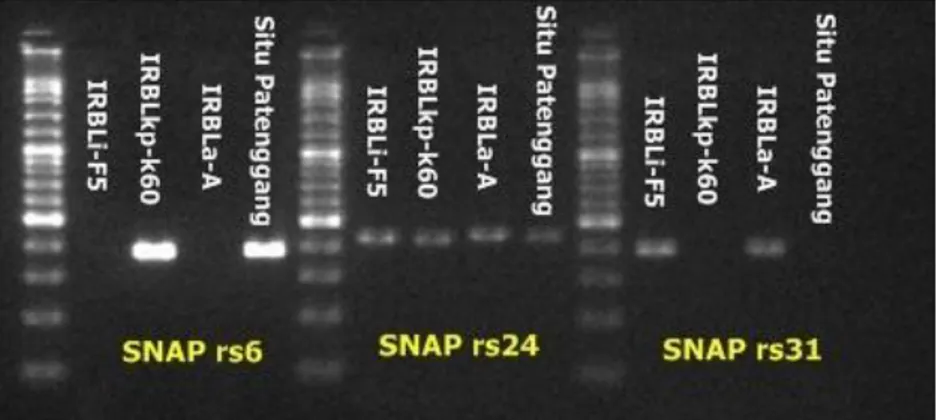
Sebelum melakukan PCR perlu dilakukan beberapa tahapan seperti optimasi polimorfisme pada primer untuk melihat primer apa saja yang dapat digunakan. Adapun hasil optimasi terhadap beberapa primer SNAP RS agronomi yaitu seperti terlihat pada gambar di bawah :
26 Gambar 7. Optimasi polimorfisme primer SNAP agronomi
SNAP rs6, SNAP rs24 dan SNAP rs31
Gambar 8. Optimasi polimorfisme primer SNAP agronomi SNAP rs12, SNAP rs21, SNAP rs26 dan SNAP rs32
Hasil optimasi polimorfisme menunjukan bahwa tidak semua primer SNAP agronomi dapat digunakan sebagai penanda karakter agronomi untuk galur-galur uji turunan essensial. Pada (Gambar 7) menunjukan primer yang dapat digunakan terdiri dari SNAP RS6, SNAP RS31, SNAP RS12, SNAP RS21, dan SNAP RS32 yang polimorfis untuk galur Si41-S15-TB16. Primer-primer yang bersifat polimorfisme selanjutnya akan digunakan untuk seleksi secara genotipe, sedangkan primer-primer yang tidak polimorfis selanjutnya tidak akan digunakan untuk analisis selanjutnya.
4.2.3 Uji Keseragaman Genotipe Menggunakan Marka SNAP Terkait Karakter Agronomi
Uji genotipe galur padi Sta8-S15-TB16, Si41-S15-TB16, dan Sk56-S15-TB16 dilakukan dengan metode PCR menggunakan sembilan primer SNAP agronomi (Tabel 2) terkait tinggi tanaman, jumlah anakan, sudut bendera, panjang malai, dan umur berbunga. Adapun pada galur Sta8-S15-TB16 menggunakan
27 primer SNAP RS7, galur Si41-S15-TB16 menggunakan primer JAT1, SNAP RS6, SNAP RS12, SNAP RS21, SNAP RS 31, dan galur Sk56-S15-TB16 menggunakan primer TT1, TT3, JAT1 dan JAT5. PCR diawali dengan membuat mix PCR sebanyak 10 µl untuk setiap sampel. Komposisi mix PCR terdiri dari Kapa sebanyak 5 µl, ddH2O sebanyak 2 µl, dan primer sebanyak 1 µl. Mix PCR
kemudian dimasukan ke dalam plat yang masing-masing berisi 2 µl DNA sampel, selanjutnya sampel di-vorteks kemudian dimasukan kedalam mesin PCR. Adapun salah satu contoh hasil visualisasi PCR pada galur Sta8-S15-TB16 dengan menggunakan primer SNAP RS7 terkait jumlah anakan dapat dilihat pada gambar dibawah (Gambar 9).
Gambar 9. Salah satu hasil elektroforegram galur Sta8-S15-TB16 menggunakan primer SNAP RS7
Ket : STP = Situ Patenggang; 8225,…,8533 = Nomor sampel tanaman galur Sta-8-S15-TB16; IRBL-Ta = IRBLta2-Re
Hasil elektroforegram (Gambar 9) menunjukan terdapat pita DNA tidak muncul pada sampel Situ Patenggang dan terdapat pita DNA muncul pada sampel IRBLta2-Re. Hal tersebut menunjukan bahwa kedua sampel memiliki karakter agronomi yang berbeda. Primer SNAP merupakan primer dominan, dimana untuk melihat perbedaan masing-masing sampel dilakukan dengan cara melihat muncul atau tidaknya pita DNA pada sampel (Drenkard et al., 2000). Uji genotipe galur Sta8-S15-TB16 menggunakan primer SNAP RS7 terkait karakter umur berbunga menunjukan bahwa semua sampel tanaman pada galur Sta8-S15-TB16 memiliki
28 pita DNA tidak muncul sama dengan Situ Patenggang. Hal tersebut menunjukan bahwa semua sampel tanaman galur uji Sta8-S15-TB16 memiliki gen terkait karakter umur berbunga yang sama dengan Situ Patenggang. Hasil yang sama juga ditunjukan pada penelitian Patay (2017), dimana galur Sta8-S15-TB16 telah memiliki karakter agronomi yang sama dengan tetua pemulihnya yaitu Situ Patenggang.
Gambar 10. Salah satu hasil elektroforegram galur Si41-S15-TB16 menggunakan primer SNAP RS12
Ket : STP = Situ Patenggang; 41.115, …, 41.424 = Nomor sampel tanaman galur Si41-S15-TB16; IRBL-i = IRBLi-F5
Berdasarkan uji genotipe galur Si41-S15-TB16 menggunakan primer SNAP RS12 terkait karakter panjang malai (Gambar 10) menunjukan terdapat pita DNA tidak muncul pada sampel Situ Patenggang dan terdapat pita DNA muncul pada sampel IRBLi-F5. Hasil PCR pada uji genotipe tersebut menunjukan semua sampel tanaman pada galur Si41-S15-TB16 memiliki pita DNA tidak muncul mengikuti tetua pemulih Situ Patenggang. Hal tersebut menunjukan bahwa semua sampel tanaman galur uji Si41-S15-TB16 memiliki gen terkait karakter panjang malai yang sama dengan Situ Patenggang.
29 Gambar 11. Elektroforegram galur Sk56-S15-TB16 menggunakan primer TT1
Ket : STP = Situ Patenggang; 41.115, …, 41.424 = Nomor sampel tanaman galur Si41-S15-TB16; IRBL-i = IRBLi-F5
Berdasarkan uji genotipe galur Sk56-S15-TB16 menggunakan primer TT1 terkait karakter tinggi tanaman (Gambar 11) menunjukan terdapat pita DNA tidak muncul pada sampel Situ Patenggang dan terdapat pita DNA muncul pada sampel IRBLkp-k60. Hasil PCR pada uji genotipe tersebut menunjukan semua sampel tanaman pada galur Sk56-S15-TB16 memiliki pita DNA tidak muncul sama dengan Situ Patenggang. Hal tersebut menunjukan bahwa semua sampel tanaman galur uji Sk56-S15-TB16 memiliki gen terkait karakter tinggi tanaman yang sama dengan Situ Patenggang.
Hasil uji genotipe yang telah dilakukan terhadap tiga galur uji hasil persilangan antara Situ Patenggang dengan IRBL telah sesuai dengan penelitian yang dilakukan Pinandhita (2017) pada hasil persilangan BC3F5. Pada penelitian tersebut didapat individu-indiidu pada tanaman galur uji telah memiliki karakter agronomi yang dominan sama dengan varietas Situ Patenggang. Adapun untuk melihat hasil analisis genotipe pengelompokan masing-masing rumpun terhadap tetua pemulihnya dapat dilihat pada hasil dendogram menggunakan analisis Tasel 3.0 dibawah ini ;
30 Gambar 12. Dendogram galur Sta8-S15-TB16
31 Gambar 14. Dendogram galur Sk56-S15-TB16
Berdasarkan dendogram hasil uji genotipe galur Sta8-S15-TB16 (Gambar 12), semua rumpun pada galur Sta8-S15-TB16 telah satu kelompok dengan Situ Patenggang. Hal tersebut menunjukan bahwa karakteristik agronomi pada masing-masing rumpun tersebut telah sama dengan situ patengang. Adapun rumpun yang memiliki karakteristik yang paling mendekati Situ Patenggang adalah rumpun 1. Hasil yang sama juga ditunjukan pada hasil dendogram uji genotipe galur Si41-T15-TB16 (Gambar 13) dan hasil dendogram uji genotipe galur Sk56-T15-TB16 (Gambar 14), dimana rumpun 1 merupakan rumpun yang memiliki karakteristik agronomi yang paling mendekati Situ Patenggang.
4.2.4 Analisis Asosiasi Fenotipe dan Genotipe Galur Uji
Analisis asosiasi antara fenotipe dan genotipe bertujuan untuk memvalidasi marka molekuler (primer) yang digunakan yang dapat berasosiasi dengan karakter fenotipe padi yang mirip dengan Situ Patenggang. Hasil analisis asosiasi fenotipe dan genotipe galur Si41-S15-TB16 (Tabel 9), menunjukan terdapat tiga primer yang signifikan sebagai penanda (marka) yang kuat untuk mendeteksi karakter fenotipe padi. Primer tersebut yaitu RS12 yang berasosiasi
32 dengan karakter panjang malai, JAT1 dan RS31 yang berasosiasi dengan karakter jumlah anakan fase vegetatif dan jumlah anakan fase generatif.
Tabel 9. Hasil analisis asosiasi fenotipe dan genotipe padi galur Si41-S15-TB16.
Marka Karakter Kromosom
SNAP RS12 Panjang Malai 12
JAT1 Jumlah anakan fase vegetatif 1
Jumlah anakan fase generatif 1 SNAP RS31 Jumlah anakan fase vegetatif 1 Jumlah anakan fase generatif 1
Tabel 10. Hasil analisis asosiasi fenotipe dan genotipe padi galur Sk60-S15-TB16.
Marka Karakter Kromosom
JAT1 Jumlah anakan fase vegetative 1
Jumlah anakan fase generatif 1
TT1 Tinggi tanaman fase vegetative 1
Tinggi tanaman fase generatif 1
TT3 Tinggi tanaman fase vegetative 6
Tinggi tanaman fase generatif 6
Analisis asosiasi antara fenotipe dan genotipe galur Sk56-S15-TB16 (Tabel.10) menunjukan terdapat tiga primer yang signifikan sebagai penanda (marka) yang kuat untuk mendeteksi katakter fenotipe padi. Primer terdiri dari JAT1 yang signifikan menandai karakter jumlah anakan fase vegetatif dan fase generatif, TT1 dan TT3 yang signifikan menandai karakter tinggi tanaman fase vegetatif dan generatif. Marka yang telah signifikan menandai karakter agronomi tersebut akan digunakan sebagai kandidat marka yang dapat digunakan untuk analisis agronomi selanjutnya.
33 BAB V
PENUTUP 5.1 Simpulan
1. Hasil uji fenotipe pada galur Sta8-S15-TB16, Si41-S15-TB16 dan Sk-60-S15-TB16, ketiga galur tersebut telah memiliki kesamaan karakter agronomi dengan tetua pemulihnya Situ Patenggang. Adapun karakter yang diuji diantaranya panjang malai, jumlah gabah hampa, jumlah gabah isi, jumlah gabah total, tinggi tanaman fase vegetatif, tinggi tanaman fase generatif, jumlah anakan fase vegetatif, dan jumlah anakan fase vegetatif.
2. Berdasarkan uji genotipe menggunakan primer SNAP agronomi, semua individu tanaman pada ketiga galur uji telah memiliki gen terkait karakter agronomi yang sama dengan Situ Patenggang. Adapun rumpun yang memiliki karakter paling mendekati dengan Situ Patenggang yaitu rumpun 1.
3. Uji asosiasi fenotipe dan genotipe masing-masing galur menunjukan terdapat lima primer yang paling signifikan menandai karakter agronomi yaitu primer JAT1 dan SNAP RS31 terkait karakter jumlah anakan; SNAP RS12 terkait karakter panjang malai; dan TT1, TT3 terkait karakter tinggi tanaman.
5.2 Saran
Perlu dilakukan analisis yang lebih lanjut terkait beberapa rumpun yang dapat dijadikan sebagai sumber benih calon varietas turunan essensial Situ Patenggang lahan sawah dan marka yang dapat digunakan untuk mengidentifikasi karakter fenotipe padi.
34 DAFTAR PUSTAKA
Afiah, M. (2017). Evaluasi Marka Molekuler untuk seleksi mutu beras pada galur-galur harapan padi (oriza sativa) tahan penyakit blas (Pyricularia grisea). Tesis. Institut Pertanian Bogor, Bogor.
Alberts, B., Lewis, J., Morgan, D., Raff, M., Roberts, K., et al. (2008). Moleculer Biology of the cell Sixth Edition. New York: Garland Science.
Alberts, B., Bray, D., Hopkins, K., Johnson, A., Lewis, J., Raff, M., et al. (2014). Essential Cell Biology. New York: Garland Science.
Allen, G., Flores-Vergara, M., Krasnyanski, S., Kumar, S., & Thompson, W. (2006). A modified protocol for rapid DNA isolation from plant tissues using cetyl trimethyl ammonium bromide. Nature Protocols , 2320-2325. Anonim. (2012). Pengembangan marka SNAP berbasis RGA dan DGA untuk
ketahanan terhadap layu fusarium pada tanaman pisang. Jurnal Holtikultura. 107-128.
Arif, M. (2012). Profil SDS-Page outer membrane protein Porphyromonas gingivalis. Skripsi. Universitas Jember, Jember.
Azrai, M. (2005). Pemanfaatan Marka Molekuler dalam proses seleksi pemuliaan tanaman. Jurnal Agrobiogen , 26-37.
Badan Pusat Statistik. (2017) Produksi padi nasional. Badan Pusat Statistik. https://www.bps.go.id/linkTableDinamis/view/id/866/ Tanggal akses 12 April 2017.
Badan Pusat Statistik. (2017). Jumlah Penduduk Tahun 2015. Badan Pusat Statistik. https://www.bps.go.id/linkTableDinamis/view/id/866/ Tanggal akses 12 April 2017.
Badan Pusat Statistik. (2017). Impor Bahan Pangan. Badan Pusat Statistik. https://www.bps.go.id/linkTableDinamis/view/id/866/ Tanggal akses 12 April 2017.
Balitbangtan. (1994). Pembuatan Varietas turunan essensial. Balitbangtan. http://.litbang.pertanian.go.id/index.php/Pembuatan Varietas turunan essensial. Tanggal Akses 15 April 2017.
Balitbangtan. (2011). Penyakit Blas Pada Tanaman Padi Dan Cara Pengendaliannya. Balitbangtan. http://bbpadi.litbang.pertanian.go.id/ . Tanggal Akses 12 April 2017.