PROFIL LEUKOSIT SAPI FRIESIAN HOLSTEIN (FH) BUNTING
YANG DIVAKSIN DENGAN VAKSIN AVIAN INFLUENZA (AI)
INAKTIF SUBTIPE H5N1
FAISAL MUHAMAD NU’MAN SUMANTRI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi “Profil Leukosit Sapi Friesian Holstein (FH) Bunting yang Divaksin dengan Vaksin Avian Influenza (AI) Inaktif Subtipe H5N1” adalah karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2009
Faisal Muhamad Nu’man Sumantri NRP B04104032
ABSTRAK
FAISAL MUHAMAD NU’MAN SUMANTRI. Profil Leukosit Sapi Friesian Holstein (FH) Bunting yang Divaksin dengan Vaksin Avian Influenza (AI) Inaktif Subtipe H5N1. Dibimbing oleh ANITA ESFANDIARI dan SRI MURTINI.
Penelitian ini bertujuan untuk mengetahui gambaran leukosit sapi Friesian Holstein (FH) bunting yang divaksin dengan vaksin Avian Influenza (AI) inaktif subtipe H5N1. Tiga ekor induk sapi FH bunting digunakan dalam penelitian ini. Induk sapi divaksin sebanyak 3 kali menggunakan vaksin AI inaktif subtipe H5N1 pada 8, 6, dan 4 minggu sebelum diperkirakan melahirkan. Sampel darah diambil sebelum induk sapi divaksin, yaitu pada minggu ke-8 sebelum melahirkan dan setiap minggu selama 6 minggu. Parameter leukosit yang diamati meliputi jumlah leukosit total dan diferensiasi leukosit. Hasil pengamatan menunjukkan bahwa jumlah leukosit total meningkat pada 1 minggu setelah vaksinasi I, II, dan III. Jumlah limfosit juga meningkat pada 1 minggu setelah vaksinasi I dan II, sedangkan setelah vaksinasi III jumlah limfosit relatif konstan. Jumlah monosit mengalami penurunan setelah vaksinasi I dan III, dan meningkat setelah vaksinasi II. Jumlah neutrofil meningkat 2 minggu setelah vaksinasi I serta pada 1 dan 2 minggu setelah vaksinasi III, dan menurun setelah vaksinasi II. Jumlah eosinofil menurun setelah vaksinasi I dan III, meningkat setelah vaksinasi II. Basofil tidak ditemukan di dalam pemeriksaan preparat ulas darah. Namun demikian peningkatan dan penurunan semua parameter leukosit ini masih berada dalam kisaran normal. Berdasarkan hasil pengamatan dapat disimpulkan bahwa vaksinasi AI inaktif subtipe H5N1 pada sapi perah FH bunting tidak mengakibatkan perubahan gambaran leukosit di dalam sirkulasi darah.
PROFIL LEUKOSIT SAPI FRIESIAN HOLSTEIN (FH) BUNTING
YANG DIVAKSIN DENGAN VAKSIN AVIAN INFLUENZA (AI)
INAKTIF SUBTIPE H5N1
FAISAL MUHAMAD NU’MAN SUMANTRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul Skripsi : Profil Leukosit Sapi Friesian Holstein (FH) Bunting yang Divaksin dengan Vaksin Avian Influenza (AI) Inaktif Subtipe H5N1
Nama : Faisal Muhamad Nu’man Sumantri
NRP : B04104032
Disetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Drh. Anita Esfandiari, MSi Dr. Drh. Sri Murtini, MSi
NIP : 131 841 741 NIP :132 133 967
Diketahui,
Wakil Dekan
Fakultas Kedokteran Hewan
Dr. Nastiti Kusumorini NIP. 131 669 942
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT, atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan salam kita curahkan kepada Nabi akhirul zaman Muhammad SAW, yang menjadi suri teladan untuk umatnya untuk melakukan yang terbaik dalam hidup ini.
Terima kasih penulis ucapkan kepada Dr. drh. Anita Esfandiari, M.Si dan Dr. drh. Sri Murtini, M.Si selaku pembimbing, dan Dr. drh. Aryani Sismin Satyaningtijas, M.Sc selaku penguji yang telah banyak memberikan saran. Ungkapan terima kasih juga disampaikan kepada Ayah dan Ibu serta seluruh keluarga yang senantiasa memberikan doa restu, teman-teman sekelompok penelitian (Hasan, Icha, Novi, Winda, Tresna dan Ita), Pak Ngkos, Pak Dahlan dan Pak Djadjat, teman-teman Asteroidea (angkatan 41) untuk semua kebersamaannya dalam angkatan yang terbaik dan teristimewa, teman-teman Goblet (angkatan 42) dan Aesculapius (angkatan 43), Keluarga Besar Orenz (Andika, Zein, Kiki, Abi, Casnan, Okoy, Eko Bumen, Bama, dan Kukuh Galih), Keluarga Besar Sunrise dan Sekret ’41 (Budi, Nanang, Dwimas, Eki, dan Uloh), Bg Uus, dan Novi Handayani Setia Mareta untuk semua bantuan, do’a, perhatian, kasih sayang, semangat, serta kesediaanya menjadi tempat berbagi penulis untuk senantiasa menjadi lebih baik, serta kepada seluruh penguat, pemotivasi dan pendukung jiwa ini disaat semangat telah turun, dan untuk semua penginspirasi yang telah banyak memberikan pelajaran berharga bagi penulis untuk lebih menghargai hidup ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Faisal Muhamad Nu’man Sumantri lahir pada 11 Desember 1986 di Sukabumi, Jawa Barat dari pasangan Bapak H. Imam Syamsudin dan Ibu Hj. Neneng Maria Ulfa. Penulis merupakan anak pertama dari enam bersaudara.
Penulis lulus dari SMA Al-Masthuriyah Cisaat Sukabumi Jawa Barat pada tahun 2004, dan pada tahun yang sama melanjutkan pendidikan di Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB).
Selama mengikuti masa perkuliahan penulis aktif dalam organisasi intra dan ekstra kampus. Penulis pernah aktif di Dewan Keluarga Musholla (DKM) An-nahl FKH IPB 2005-2006, Forum Ilmiah Mahasiswa (FIM) 2005-2006, menjadi Kepala Departemen Pendidikan BEM FKH IPB 2006-2007, Sekretaris Umum Himpunan Mahasiswa Islam (HMI) Komisariat FKH IPB 2007-2008, dan Dewan Perwakilan Mahasiswa (DPM) FKH IPB 2008-2009.
Penulis juga aktif dalam berbagai kegiatan kampus. Penulis pernah ikut menjadi Tim Penilai Kebersihan Kampus IPB 2005, peserta Pembuatan Lubang Biopori se-Kota Bogor 2007, Peserta Pengobatan Massal Filariasis di-Kota Bogor 2007, dan sebagai Koordinator Kabupaten Pinrang dalam kegiatan Pengabdian Masyarakat Veteriner BEM FKH IPB di Kawasan Sulawesi Selatan 2007.
DAFTAR ISI
Halaman DAFTAR GAMBAR ... ix I. PENDAHULUAN 1.1. Latar belakang .………..………... 1 1.2. Tujuan ………... 2 1.3. Manfaat ………….………... 2II. TINJAUAN PUSTAKA 2.1. Sapi perah FH ... 3
2.2. Kebuntingan ….………... 3
2.3. Avian Influenza ……….... 4
2.4. Vaksinasi Avian Influenza ...………... 6
2.5. Leukopoiesis ……….…... 8 2.6. Leukosit ..………... 11 2.6.1. Limfosit ………... 12 2.6.2. Monosit ………..…... 12 2.6.3. Neutrofil ………..…... 13 2.6.4. Eosinofil ……….... 14 2.6.5. Basofil ………... 14
III. BAHAN DAN METODE 3.1. Waktu dan Tempat Penelitian ….………... 16
3.2. Alat dan Bahan ………... 16
3.3. Metode Penelitian ……….………... 16
3.3.1. Hewan Percobaan ... 16
3.3.2. Persiapan dan Pemeliharaan Hewan Coba ... 16
3.3.3. Vaksinasi ... 17
3.3.4. Pengambilan Darah ... 17
3.3.5. Pemeriksaan Darah ... 18
3.3.5.1. Menghitung Jumlah Leukosit Total ... 18
3.3.5.2. Diferensiasi Leukosit ... 18
IV. HASIL DAN PEMBAHASAN 4.1. Jumlah Leukosit Total ………... 20
4.2. Limfosit ... 23
4.3. Monosit …...………... 26
4.4. Neutrofil ... 28
4.5. Eosinofil ... 30
4.6. Basofil ... 31
V. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 32
5.2. Saran ... 32
DAFTAR GAMBAR
Halaman
1. Sapi Friesian Holstein ... 3
2. Struktur Virus AI ... 5
3. Tahap pembentukan sel-sel darah ... 9
4. Berbagai jenis sel darah putih ... 11
5. Sistematika jadwal vaksinasi AI dan pengambilan darah pada hewan coba ... 17
6. Rataan jumlah leukosit total pada induk sapi bunting sebelum dan setelah vaksinasi ... 21
7. Rataan jumlah limfosit pada induk sapi bunting sebelum dan setelah vaksinasi ... 23
8. Rataan jumlah monosit pada induk sapi bunting sebelum dan setelah vaksinasi ... 27
9. Rataan jumlah neutrofil pada induk sapi bunting sebelum dan setelah vaksinasi ... 29
10. Rataan jumlah eosinofil pada induk sapi bunting sebelum dan setelah vaksinasi... 30
I. PENDAHULUAN
1.1. Latar Belakang
Virus influenza tipe A subtipe H5N1 menyerang ternak ayam di Indonesia sejak bulan Oktober 2003, yang mengakibatkan kematian lebih dari 14,7 juta ekor ayam. Virus influenza tipe A merupakan famili orthomixoviridae. Avian Influenza (AI/ flu burung) adalah penyakit menular yang menyebabkan kematian tinggi pada unggas yaitu 40-100 %. Virus ini dapat menyerang semua jenis unggas seperti ayam, kalkun, itik. Data terakhir menyebutkan bahwa selain unggas, hewan lain seperti kucing, harimau dan babi dapat pula terserang (Soejoedono & Handaryani 2005). Di beberapa negara di Eropa dan Asia telah dilaporkan bahwa flu burung menyerang hewan mamalia (Asmara 2007).
Kasus flu burung dalam perkembangannya tidak hanya menyerang unggas saja, tetapi juga manusia. Kasus flu burung strain H5N1 pada manusia pertama kali terjadi pada tahun 1997 di Hongkong, dari 18 kasus 6 orang diantaranya meninggal dunia (Chan 2002). Tahun 2003 virus H5N1 kembali menyerang wilayah Hongkong dan Guandong serta menyebabkan seorang penderita meninggal dunia. Virus juga menyerang Vietnam dan Thailand dengan jumlah kasus 34 orang dan 23 diantaranya meninggal dunia. Pada pertengahan tahun 2004, H5N1 menyerang lagi Vietnam dengan tiga kasus seluruhnya meninggal dunia. Data WHO menunjukkan hingga 10 September 2008 jumlah kumulatif kasus H5N1 pada manusia yang sudah dikonfirmasi laboratorium 387 orang, dengan 245 orang diantaranya meninggal dunia (WHO 2008). Kejadian penyakit flu burung yang menyerang manusia di Indonesia dilaporkan pertama kali pada pertengahan Juli 2005 (Infovet 2005). Jumlah korban flu burung pada manusia di Indonesia dari tahun 2005-2008 sampai dengan Oktober 2008, sebanyak 137 kasus dengan 113 orang meninggal dunia (WHO 2008).
Dewasa ini terdapat 4 jenis obat antiviral untuk pengobatan ataupun pencegahan terhadap influenza pada manusia, yaitu amantadine, rimantadine, zanamivir, dan oseltamivir (tamiflu). Amantadine dan rimantadine sudah tidak efektif lagi untuk membunuh virus H5N1 yang saat ini beredar luas (Beigel et al. 2005). Zanamivir dan oseltamivir merupakan inhibitor neuraminidase. Neuraminidase diperlukan oleh virus H5N1 untuk lepas dari sel hospes pada fase budding dan membentuk virion yang
infektif. Bila neuraminidase ini dihambat oleh oseltamivir atau zanamivir, maka replikasi virus tersebut dapat dihentikan. Namun demikian belum ada uji klinik pada manusia yang secara resmi dilakukan untuk mengevaluasi efektifitas dari zanamivir dan oseltamivir untuk pengobatan Avian Influenza A (H5N1) (Herman & Strorck 2005). Penelitian terakhir menyebutkan bahwa Virus H5N1 yang diisolasi dari beberapa kasus penderita flu burung telah resisten terhadap oseltamivir (Gupta et al. 2006).
Alternatif pencegahan dan penanggulangan kasus flu burung hingga saat ini masih dicari. Salah satu alternatif adalah melalui imunisasi pasif yaitu melalui pemanfaatan kolostrum yang berasal dari induk sapi bunting yang divaksin dengan vaksin AI. Produksi kolostrum yang mengandung Imunoglobulin anti AI dilakukan dengan pemberian vaksin kepada sapi bunting dengan vaksin AI. Vaksin AI untuk manusia hingga saat ini belum tersedia. Vaksin AI subtipe H5N1 saat ini yang tersedia hanya untuk unggas.
Penelitian ini menggunakan vaksin unggas untuk menginduksi kekebalan pada sapi yang bunting sehingga dihasilkan kolostrum yang mengandung antibodi terhadap AI. Efek fisiologis vaksinasi AI pada sapi bunting belum pernah diamati sebelumnya, untuk itu perlu diketahui pengaruh vaksin terhadap gambaran leukosit pada sapi bunting yang divaksin dengan vaksin AI inaktif.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui profil leukosit pada sapi Friesian Holstein (FH) bunting yang divaksin dengan vaksin AI inaktif subtipe H5N1.
1.3. Manfaat
Hasil penelitian ini diharapkan dapat memberikan informasi tentang profil leukosit pada sapi FH bunting yang divaksin dengan vaksin AI inaktif subtipe H5N1.
2.1. Sapi Perah Friesia
Sapi FH pada awalnya berkembang biak di Propinsi Friesland, Belanda. Diantara ras sapi perah yang ada, Friesi
memproduksi susu tertinggi (Siregar 19
yang paling cocok dan menguntungkan untuk dibudidayakan di Indonesia, karena dapat menyesuaikan dengan kondisi dan keadaan alam Indonesia. Selain sebagai penghasil susu, sapi perah juga dapat menjadi penghasil daging da
Kemampuan memproduksi susu sapi dengan kadar lemak susu rata
antara 570 - 730 kg, sedangkan jantan dewasa 800
dara mulai dapat dikawinkan pertama kali pada umur 15 bulan, ketika berat badannya mencapai 800 pon. Walaupun sapi FH dapat hidup lebih lama, tetapi umur produktif sapi FH hanya sampai 6 tahun (Okstate 2008).
Seluruh jenis sapi perah berasal dari genus dan spesies yang sama, yaitu taurus. Menurut Linnaeus (1758) dalam Wikipedia (2008), klasifikasi ilmiah sapi perah adalah sebagai berikut :
Kingdom : Animalia Filum : Chordata Kelas : Mamalia Ordo : Artiodactyla Subordo : Ruminansia Famili : Bovidae Subfamili : Bovinae Genus : Bos Spesies : Bos taurus
2.2. Kebuntingan
Kebuntingan adalah su
janin yang sedang berkembang di dalam uterusnya. Suatu interval waktu yang disebut periode kebuntingan (gestasi) terentang dari saat pembuahan (fertilisasi) ovum sampai lahirnya anak. Hal ini mencakup fert
II. TINJAUAN PUSTAKA
2.1. Sapi Perah Friesian Holstein (FH)
pada awalnya berkembang biak di Propinsi Friesland, Belanda. Diantara ras sapi perah yang ada, Friesian Holstein mempunyai kemampuan tertinggi (Siregar 1990). Sapi FH merupakan bangsa sapi perah yang paling cocok dan menguntungkan untuk dibudidayakan di Indonesia, karena dapat menyesuaikan dengan kondisi dan keadaan alam Indonesia. Selain sebagai penghasil susu, sapi perah juga dapat menjadi penghasil daging dan kulit (Prihatman 2000). produksi susu sapi FH dapat mencapai lebih dari 6.000 kg per laktasi dengan kadar lemak susu rata-rata 3,6 %. Standar bobot badan betina dewasa
730 kg, sedangkan jantan dewasa 800 - 1000 kg (Sire
dara mulai dapat dikawinkan pertama kali pada umur 15 bulan, ketika berat badannya mencapai 800 pon. Walaupun sapi FH dapat hidup lebih lama, tetapi umur produktif
FH hanya sampai 6 tahun (Okstate 2008).
Seluruh jenis sapi perah berasal dari genus dan spesies yang sama, yaitu Menurut Linnaeus (1758) dalam Wikipedia (2008), klasifikasi ilmiah sapi perah adalah sebagai berikut :
: Animalia : Chordata : Mamalia : Artiodactyla : Ruminansia : Bovidae : Bovinae Bos taurus
Kebuntingan adalah suatu keadaan pada seekor hewan betina yang memiliki janin yang sedang berkembang di dalam uterusnya. Suatu interval waktu yang disebut periode kebuntingan (gestasi) terentang dari saat pembuahan (fertilisasi) ovum sampai lahirnya anak. Hal ini mencakup fertilisasi, nidasi atau implantasi, perkembangan fetus
Gambar 1 Sapi Friesian Holstein (Wikipedia 2008)
pada awalnya berkembang biak di Propinsi Friesland, Belanda. Holstein mempunyai kemampuan Sapi FH merupakan bangsa sapi perah yang paling cocok dan menguntungkan untuk dibudidayakan di Indonesia, karena dapat menyesuaikan dengan kondisi dan keadaan alam Indonesia. Selain sebagai penghasil n kulit (Prihatman 2000). dapat mencapai lebih dari 6.000 kg per laktasi Standar bobot badan betina dewasa berkisar 1000 kg (Siregar 1990). Sapi FH dara mulai dapat dikawinkan pertama kali pada umur 15 bulan, ketika berat badannya mencapai 800 pon. Walaupun sapi FH dapat hidup lebih lama, tetapi umur produktif
Seluruh jenis sapi perah berasal dari genus dan spesies yang sama, yaitu Bos Menurut Linnaeus (1758) dalam Wikipedia (2008), klasifikasi ilmiah sapi perah
atu keadaan pada seekor hewan betina yang memiliki janin yang sedang berkembang di dalam uterusnya. Suatu interval waktu yang disebut periode kebuntingan (gestasi) terentang dari saat pembuahan (fertilisasi) ovum sampai ilisasi, nidasi atau implantasi, perkembangan fetus
dan pertumbuhan fetus (Frandson 1992). Menurut Salisbury & VanDemark (1985), kebuntingan terdiri dari 3 tahap, yaitu periode ovum, periode embrio, dan periode fetus. Periode ovum pada sapi merupakan interval antara pembuahan sampai kira-kira hari ke-12 masa kebuntingan. Periode embrio dimulai pada kebuntingan dengan umur 13 hari sampai 45 hari. Periode fetus, interval antara umur kebuntingan 46 hari sampai saat lahir.
Periode kebuntingan dan partus dilaporkan dapat menyebabkan munculnya stres fisiologis (Azab & Maksoud 1999 dalam Widhyari 2005). Dalam kondisi stres terjadi realokasi energi metabolik dari aktifitas investasi (seperti pertumbuhan dan reproduksi) menjadi aktifitas untuk memperbaiki homeostasis (Wendelaar 1997 dalam Widhyari 2005). Munculnya stres dapat dipicu oleh beberapa faktor seperti trauma, rasa sakit, emosi, depresi, perubahan lingkungan, pakan, perubahan fisiologis. Stres fisiologis sering terjadi pada periode sekitar partus (Wallar 2000). Perbedaan musim tidak mempengaruhi masa kebuntingan sapi perah. Periode kebuntingan sapi perah FH rata-rata 279 hari dari kisaran 262-359 hari (Toelihere 1979). Akhir kebuntingan merupakan masa transisi antara masa kebuntingan dengan laktasi (Hill & Andrews 2000), sehingga kelenjar mammae pada sapi perah memerlukan periode kering yaitu periode dimana tidak dilakukan pemerahan susu, untuk mempersiapkan kelahiran supaya produksi susu optimal pada periode laktasi berikutnya. Periode kering ini pada umumnya sekitar 60 hari (Smith 2000).
2.3. Avian Influenza (AI)
Virus influenza merupakan virus yang berbentuk bundar atau bulat panjang, memiliki genom RNA utas tunggal, bersegmen yang terdiri dari delapan segmen dan berpolaritas negatif (Harder & Ortrud 2006). Virus influenza dikelompokkan ke dalam famili orthomyxoviridae dan memiliki tiga tipe, yaitu tipe A, B, dan C. Virus influenza yang menyerang unggas adalah tipe A. Virus influenza tipe B dan C hanya ditemukan pada manusia. Saat ini diketahui bahwa virus tipe A juga menyerang manusia, babi, dan kuda (Iswandari 2007).
Flu burung atau avian influenza adalah penyakit menular yang menyebabkan kematian tinggi pada unggas, yaitu berkisar antara 40-100%. Penyakit ini disebabkan oleh virus influenza tipe A. Virus ini menyerang semua jenis unggas seperti ayam,
kalkun, itik. Selain unggas, hewan lain seperti kucing, harimau dan babi dapat pula terserang (Soejoedono & Handaryani 2005).
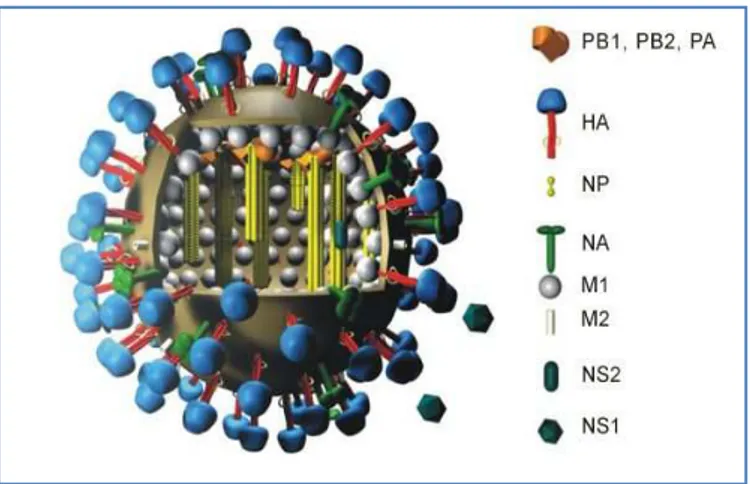
Gambar 2 Struktur Virus AI (Wikipedia 2008)
Determinan antigenik utama virus influenza A dan B adalah glikoprotein transmembran hemaglutinin (H atau HA) dan neuraminidase (N atau NA). Kedua glikoprotein tersebut mampu memicu terbentuknya respon imun spesifik terhadap subtipe virus (Harder & Ortrud 2006). Virus tipe A memiliki 16 antigen H (haemaglutinin; HA) yaitu H1-H16 dan 9 antigen N (neuraminidase), yaitu N1-N9. Kombinasi antigen H dan N menghasilkan lebih dari 144 kombinasi sub tipe virus flu burung, seperti H5N1, H5N2, H7N1, H7N7, dan kombinasi lainnya (Wong & Yuen 2006).
Komposisi kimiawi virus flu burung adalah 0,8-1,1 % RNA, 70-75 % protein, 20-24 % lemak, dan 5-8 % karbohidrat (Iswandari 2007). Delapan segmen RNA dari virus influenza tipe A menyandikan 11 protein viral. Termasuk ke dalam protein viral tersebut adalah protein polimerase (PB1, PB2, PA, PB1-F2), protein nukleokapsid, hemaglutinin, neuraminidase, protein matriks (M1, M2) dan protein nonstruktural (NS1, NS2). Hemaglutinin dan neuraminidase adalah determinan antigenik utama pada virus influenza tipe A dan berfungsi sebagai dasar bagi pengklasifikasian subtipenya (Wong & Yuen 2006).
Hemaglutinin berperan dalam perlekatan dan masuknya virus ke dalam sel inang dengan cara berikatan pada reseptor asam sialat (sialic acid) di permukaan sel. Neuraminidase berperan dalam memfasilitasi penyebaran virion pada inang dengan cara membelah ikatan glikosida terhadap asam sialat pada sel inang dan permukaan partikel
virus dan merupakan target dari zat-zat yang bersifat neuraminidase inhibitor seperti oseltamivir dan zanamivir (Wong & Yuen 2006).
Subtipe yang ditemukan mewabah dan menyebabkan terjadinya flu burung di negara Asia adalah H5N1. Subtipe H5N1 pertama kali ditemukan di Italia pada tahun 1878 pada unggas dan sangat menular serta menyebabkan kematian (Soejodono dan Handaryani 2005). Berdasarkan tingkat keganasannya, virus flu burung memiliki dua bentuk, yaitu virus dengan tingkat keganasan rendah (Low pathogenic) dan virus dengan tingkat keganasan tinggi (highly pathogenic). Virus dengan keganasan rendah atau low pathogenic avian influenza (LPAI) menyebabkan sakit ringan, yang kadang-kadang hanya ditunjukkan dengan bulu kusut atau produksi telur berkurang. Sedangkan highly pathogenic avian influenza (HPAI) sangat mudah menular dan cepat mendatangkan kematian (mortalitas 100%) (Iswandari 2007).
2.4. Vaksinasi Avian Influenza
Vaksinasi adalah pemberian antigen yang merupakan agen suatu penyakit tertentu sehingga terbentuk tanggap kebal yang dapat mencegah infeksi terhadap agen penyakit tersebut (Tizard 1982). Kemampuan tubuh untuk menahan serangan infeksi maupun menetralkan racun dan meniadakan faktor virulen yang bersifat antigenik maupun imunogenik disebut dengan imunitas. Antigen atau yang biasa disebut dengan benda asing berasal dari kata antibody generating substance yaitu suatu senyawa yang dapat merangsang pembentukan antibodi. Sedangkan imunogen berasal dari kata immunolity generating substance, senyawa yang dapat menggertak pembentukan antibodi spesifik protektif dan peningkatan kekebalan seluler, atau dengan kata lain mampu merangsang pembentukan imunitas atau kekebalan (Wibawan et al. 2003).
Vaksinasi dalam dunia kedokteran hewan ditujukan untuk mencapai empat sasaran, yaitu perlindungan terhadap timbulnya penyakit secara klinis, perlindungan terhadap serangan virus yang virulen, perlindungan terhadap ekskresi virus, dan pembedaan secara serologik antara hewan yang terinfeksi dari hewan yang divaksinasi (dikenal sebagai differentiation of infected from vaccinated animals, atau prinsip DIVA) (Harder & Ortrud 2006).
Vaksin merupakan senyawa yang mempunyai sifat sebagai imunogen. Secara umum vaksin adalah bahan yang berasal dari mikroorganisme atau parasit yang sifat
patogenitasnya dihilangkan terlebih dahulu serta digunakan untuk merangsang pembentukan sistem kekebalan (Renald 1998). Vaksin virus dapat dibedakan menjadi dua, yaitu vaksin aktif (hidup) yang mengandung partikel virus hidup tapi sudah dilemahkan sehingga tidak virulen, dan vaksin inaktif (killed vaccine) yaitu vaksin dengan kandungan partikel virus yang sudah dimatikan tetapi tidak kehilangan imunogenitasnya (Tizard 1982).
Virus pada vaksin inaktif berasal dari virus aktif (hidup) yang diinaktifkan dengan bahan kimia, seperti formaldehida, beta propiolaktin, asetilatilinemi (AEI), etilektilemi (EEI) (Edington 1986 dalam Mulia 2005). Imunogenitas vaksin dapat ditingkatkan dengan penambahan adjuvant. Adjuvant merupakan bahan yang dicampurkan ke dalam vaksin untuk meningkatkan respon imun, baik humoral maupun seluler. Mekanisme kerja dari adjuvant meliputi retensi antigen yang lebih lama dan pelepasannya lambat. Adjuvant juga meningkatkan pengaktifan makrofag yang menyebabkan sekresi limfokin dan tertariknya limfosit, dan mitogenisitas bagi limfosit. Adjuvant yang paling umum digunakan untuk vaksin hewan adalah minyak mineral (Fenner et al.1995).
Jenis vaksin AI yang diijinkan untuk dipergunakan pada hewan adalah vaksin rekombinan dan vaksin inaktif (killed), sedangkan vaksin hidup tidak diijinkan. Vaksin rekombinan virus AI diproduksi dengan cara memasukkan kode gen hemaglutinin virus ke dalam vektor virus hidup dan menggunakan virus rekombinan ini untuk mengimunisasi unggas. Bentuk vaksin lainnya yang telah dikembangkan adalah sistem baculovirus-expression untuk memproduksi antigen H5 dan H7 rekombinan untuk digabungkan ke dalam vaksin. DNA yang mengkode hemaglutinin H5 telah dievaluasi sebagai vaksin yang potensial bagi unggas. Vaksin inaktif diperoleh dari cairan allantois yang diinfeksi dan diinaktivasi dengan beta-propiolactone atau formalin dan diemulsi dengan minyak mineral (OIE 2004).
Antibodi bertiter tinggi dapat terbentuk di dalam serum hewan melalui vaksinasi berulang. Antibodi di dalam serum induk dapat dipindahkan ke dalam kolostrum sehingga dapat diperoleh antibodi kolostrum dengan titer tinggi (Fenner et al. 1995).
2.5. Leukopoiesis
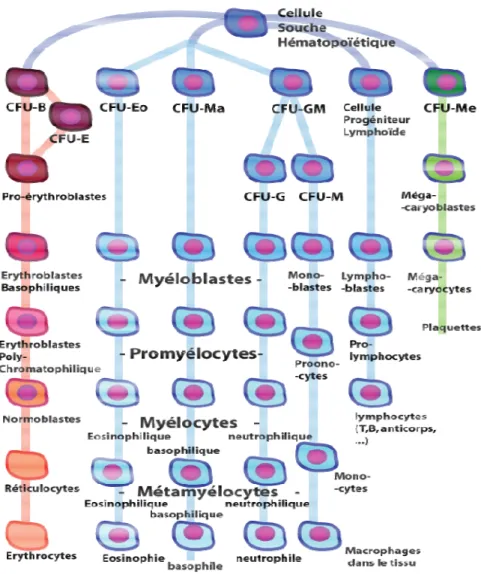
Sel-sel darah dibentuk dari sel stem hematopoietik yang berasal dari kantung kuning telur, hati fetus, limpa, serta sumsum tulang. Granulopoiesis atau granulocytopoiesis meliputi produksi neutrofil, eosinofil dan basofil, dibawah pengaruh interleukin-3 (IL-3) dan granulocyte-macrophage colony-stimulating factor (GM-CSF), untuk menghasilkan colony forming units neutrofil dan monosit (CFU-GM), eosinofil (CFU-eos) dan basofil (CFU-bas) (Jain 1993).
Berbagai faktor yang mempengaruhi diferensiasi dan maturasi sel progenitor granulosit diantaranya IL-3 dan berbagai colony stimulating factors (CSFs). CSFs mempunyai tiga jenis yaitu GM-CSF, granuloycte colony stimulating factor (G-CSF) dan macrophag colony stimulating factor (M-CSF). IL-3 merupakan suatu faktor pertumbuhan multispesifik (multi-CSF). GM-CSF mempunyai spesifikasi yang lebih besar, sedangkan G-CSF merangsang produksi granulosit dan M-CSF merangsang produksi monosit. CSFs dihasilkan oleh berbagai sel diantaranya limfosit T aktif, makrofag, sel endotel dan sel stroma sumsum. Produksi mereka meningkat mengikuti adanya keterpaparan terhadap antigen, infeksi bakteri, endotoksemia, dan kemoterapi sitotoksik (Jain 1993).
Gambar 3 Tahap pembentukan sel
CSFs adalah glikoprotein yang mempunyai berat molekul rendah. Mekanisme yang tepat pada aksi CSFs pada sel hematopoietik atau pematangan leukosit tidak diketahui, tetapi reseptor permukaan sel spesifik pada berbagai sitokin ditemukan pada sel yang responsive (Jain 1993).
Sel-sel pluripotent
progenitor granulosit. Sel yang menghasilkan neutrofil dan monosit diketahui sebagai colony forming unit granulocyte
yang dapat berdiferensiasi menjadi sel yang unipotensial CFU
masing-masing akan menjadi neutrofil atau monosit. Dengan cara yang sama, sel stem pluripotent juga akan berkembang dan berdiferensiasi menjadi sel progenitor untuk eosinofil (CFU-Eos) dan basofil (CFU
Gambar 3 Tahap pembentukan sel-sel darah (Anonim 2008
CSFs adalah glikoprotein yang mempunyai berat molekul rendah. Mekanisme yang tepat pada aksi CSFs pada sel hematopoietik atau pematangan leukosit tidak diketahui, tetapi reseptor permukaan sel spesifik pada berbagai sitokin ditemukan pada
(Jain 1993).
pluripotent di dalam sumsum tulang berkembang menjadi sel progenitor granulosit. Sel yang menghasilkan neutrofil dan monosit diketahui sebagai colony forming unit granulocyte-monocyte (CFU-GM). CFU GM adalah sel bipotensial
g dapat berdiferensiasi menjadi sel yang unipotensial
CFU-masing akan menjadi neutrofil atau monosit. Dengan cara yang sama, sel stem juga akan berkembang dan berdiferensiasi menjadi sel progenitor untuk
Eos) dan basofil (CFU-bas) (Jain 1993).
(Anonim 2008a)
CSFs adalah glikoprotein yang mempunyai berat molekul rendah. Mekanisme yang tepat pada aksi CSFs pada sel hematopoietik atau pematangan leukosit tidak diketahui, tetapi reseptor permukaan sel spesifik pada berbagai sitokin ditemukan pada
di dalam sumsum tulang berkembang menjadi sel-sel progenitor granulosit. Sel yang menghasilkan neutrofil dan monosit diketahui sebagai GM). CFU GM adalah sel bipotensial -G dan CFU-M, yang masing akan menjadi neutrofil atau monosit. Dengan cara yang sama, sel stem juga akan berkembang dan berdiferensiasi menjadi sel progenitor untuk
Sel unipotensial granulosit selanjutnya berkembang menjadi prekursor yang dapat diidentifikasi sebagai mieloblas, kemudian berkembang lagi menjadi promielosit, mielosit, metamielosit, sel muda dan kemudian neutrofil yang bersegmen (dewasa). Proses pembentukan neutrofil di dalam sumsum tulang membutuhkan waktu pada manusia sekitar 7-11 hari, pada anjing 3-5 hari, dan pada sapi 4-6 hari, sedangkan masa hidup neutrofil di dalam sirkulasi berkisar 7-14 jam (Jain 1993). Beberapa faktor pertumbuhan leukosit yang paling banyak adalah interleukin. Produksi dan maturasi sel T dipengaruhi oleh interaksi kompleks IL-1, IL-2, IL-4, IL-5, IL-7, IL-12, tumor necrosis factor-α, T-cell growth factor-β, dan interferon-α. Begitu juga jumlah faktor pertumbuhan sel B telah diidentifikasi diantaranya 1, 2, 4, 5, 6, IL7, IL-11, tumor necrosis factor-α, T-cell growth factor-β, dan interferon-α (Jain 1993).
Eosinofil dihasilkan di dalam sumsum tulang yang diturunkan dari sel pluripotent yang berdiferensiasi menjadi CFU-eos, kemudian menjadi mieloblas, dan promielosit, dan akhirnya menjadi eosinofil. Proses mitosis, pematangan, dan tahap-tahap perkembangan eosinofil analog dengan perkembangan pada neutrofil (Jain 1993). Basofil dihasilkan di dalam sumsum tulang dan pola perkembanganya sama dengan granulosit yang lain. Basofil-spesifik mieloblas dan promielosit berkembang dari sel progenitor CFU-bas dan terus berkembang bentuknya hingga dapat diidentifikasi sebagai basofil (Jain 1993). Granula sitoplasma dihasilkan pada akhir pembentukan mieloblas atau diawal promielosit dan secara spesifik sintesis granula terjadi pada tahap mielosit (Meyer & Harvey 2004)
Limfosit berasal dari stem sel dalam folikel limfatik pada nodus limfe, tonsil, limpa, timus dan daun peyer pada usus, kemudian berkembang menjadi limfoblas, prolimfosit hingga tahap limfosit (Kelly 1984). Faktor yang meregulasi produksi, diferensiasi, dan multiplikasi sel progenitor limfoid sangat kompleks, diantaranya adalah pengaruh microenvironmental sekitar, interleukin, dan antigen (Jain 1993).
Monosit adalah turunan dari sel progenitor bipotensial CFU-GM yang dapat menghasilkan neutrofil dan monosit (Jain 1993). Monosit dihasilkan oleh pengaruh kombinasi dari IL-3, GM-CSF dan M-CSF pada proliferasi dan diferensiasi pada sel progenitor sumsum tulang. Monosit bukan merupakan produksi akhir, karena di dalam jaringan monosit berubah menjadi makrofag (Meyer & Harvey 2004). Diferensiasi CFU-GM ke CFU-M dan proliferasi prekursor monosit dipengaruhi oleh
monocyte-specific colony stimulating factor dengan berat molekul 45.000
monosit yang aktif, makrofag, limfosit T dan sel monosit selanjutnya setelah CFU
monosit, dan selanjutnya akan menjadi makrofag di
2.6. Leukosit
Leukosit merupakan unit yang aktif dari sistem pertahanan tubuh dengan menyediakan pertahanan terhadap setiap agen infeksi. Berdasarkan keberadaan granulanya, sel darah putih (leukosit) dibagi menjadi dua yaitu leukosit granular dan leukosit agranular. Leu
sedangkan leukosit agranular terdiri dari limfosit dan monosit (Ganong 1995).
Leukosit mempunyai peranan dalam pertahanan seluler dan humoral terhadap zat-zat asing. Leukosit dapat melakukan gerakan amuboid
leukosit dapat meninggalkan kapiler dengan menerobos sel
Leukosit ini sebagian dibentuk di sumsum tulang dan sebagian lagi di jaringan limfe (Guyton & Hall 1997).
2.6.1. Limfosit
Limfosit merupakan leukosit agranulosit, mempunyai bentuk bulat dengan sitoplasma bersifat basofilik yang lemah. Sel ini dibentuk di dalam limpa, kelenjar limfe, timus, sumsum tulang belakang, tonsil dan bursa fabrisius (Sturkie 1976).
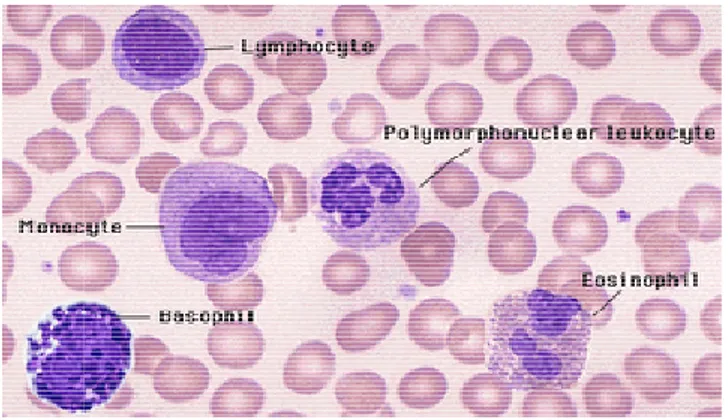
Gambar 4 Berbagai jenis sel darah putih
specific colony stimulating factor (M-CSF). CSF ini merupakan sebuah glikoprotein dengan berat molekul 45.000-70.000 dan dihasilkan oleh berbagai sel diantaranya monosit yang aktif, makrofag, limfosit T dan sel-sel endotel. Tahap perkembangan monosit selanjutnya setelah CFU-M kemudian menjadi monoblas, promonosit, monosit, dan selanjutnya akan menjadi makrofag di dalam jaringan (Jain 1993).
Leukosit merupakan unit yang aktif dari sistem pertahanan tubuh dengan menyediakan pertahanan terhadap setiap agen infeksi. Berdasarkan keberadaan granulanya, sel darah putih (leukosit) dibagi menjadi dua yaitu leukosit granular dan leukosit agranular. Leukosit granular terdiri dari neutrofil, eosinofil dan basofil sedangkan leukosit agranular terdiri dari limfosit dan monosit (Ganong 1995).
Leukosit mempunyai peranan dalam pertahanan seluler dan humoral terhadap zat asing. Leukosit dapat melakukan gerakan amuboid. Melalui proses diapedesis leukosit dapat meninggalkan kapiler dengan menerobos sel-sel endotel (Zukesti 2003).
eukosit ini sebagian dibentuk di sumsum tulang dan sebagian lagi di jaringan limfe Hall 1997).
Limfosit merupakan leukosit agranulosit, mempunyai bentuk bulat dengan sitoplasma bersifat basofilik yang lemah. Sel ini dibentuk di dalam limpa, kelenjar limfe, timus, sumsum tulang belakang, tonsil dan bursa fabrisius (Sturkie 1976).
Gambar 4 Berbagai jenis sel darah putih (Anonim 2008b)
CSF). CSF ini merupakan sebuah glikoprotein 70.000 dan dihasilkan oleh berbagai sel diantaranya el. Tahap perkembangan M kemudian menjadi monoblas, promonosit,
dalam jaringan (Jain 1993).
Leukosit merupakan unit yang aktif dari sistem pertahanan tubuh dengan menyediakan pertahanan terhadap setiap agen infeksi. Berdasarkan keberadaan granulanya, sel darah putih (leukosit) dibagi menjadi dua yaitu leukosit granular dan kosit granular terdiri dari neutrofil, eosinofil dan basofil sedangkan leukosit agranular terdiri dari limfosit dan monosit (Ganong 1995).
Leukosit mempunyai peranan dalam pertahanan seluler dan humoral terhadap elalui proses diapedesis, sel endotel (Zukesti 2003). eukosit ini sebagian dibentuk di sumsum tulang dan sebagian lagi di jaringan limfe
Limfosit merupakan leukosit agranulosit, mempunyai bentuk bulat dengan sitoplasma bersifat basofilik yang lemah. Sel ini dibentuk di dalam limpa, kelenjar limfe, timus, sumsum tulang belakang, tonsil dan bursa fabrisius (Sturkie 1976).
Persentase jumlah limfosit pada sapi berkisar antara 60-65 % dari total leukosit (Frandson1992). Menurut Jain (1993), jumlah limfosit pada sapi berkisar antara 2.500-7.500/µ L. Limfosit dapat dikategorikan berdasarkan ukurannya, yaitu limfosit kecil dan limfosit besar. Limfosit kecil memiliki ukuran 6-9 µm dan limfosit besar berukuran 9-15 µm (Delmann & Eurell 1998). Berdasarkan perbedaan fungsi di dalam respon imun pada banyak spesies, limfosit diklasifikasikan sebagai sel T dan sel B (Jain 1993). Inti limfosit relatif besar, bulat dengan sedikit cekungan pada satu sisi, dan kromatin inti padat. Sitoplasma sangat sedikit, sedikit basofilik, mengandung granula-granula azurofilik yang berwarna ungu dengan pewarnaan Romanowsky, mengandung ribosom bebas dan poliribosom. Klasifikasi limfosit yang lain yaitu adanya tanda-tanda molekuler khusus pada permukaan membran sel-sel tersebut. Beberapa diantaranya membawa reseptor seperti imunoglobulin yang mengikat antigen spesifik pada membrannya (Zukesti 2003).
Limfosit berperan dalam produksi antibodi atau sebagai sel efektor khusus untuk menanggapi antigen yang terikat pada makrofag (Tizard 1982). Limfosit B berperan dalam respon kekebalan berperantara humoral dengan memproduksi antibodi dan sel memori. Limfosit T membentuk respon kekebalan berperantara seluler (Ganong 1995).
2.6.2. Monosit
Monosit merupakan sel makrofag yang belum matang dan mempunyai sedikit kemampuan untuk melawan agen-agen penyebab infeksi. Monosit dapat membesar sampai 5 kali lipat saat masuk ke dalam jaringan. Sitoplasma mengandung banyak lisosom dan mitokondria, dan disebut makrofag yang sangat mampu menyerang agen penyakit (Guyton & Hall 1997).
Monosit disebut juga makrofag muda dan terdapat di dalam sirkulasi darah (Tizard 1982). Persentase monosit sapi di dalam darah sebesar 5 % dari total leukosit (Frandson 1992). Menurut Jain (1993), jumlah monosit pada sapi berkisar antara 25-840/µ L. Sel monosit pada umumnya berbentuk bundar, diameternya berkisar antara 14-20 µm. Sel ini memiliki sitoplasma yang banyak, di tengah terletak nukleus yang kebulat-bulatan, berbentuk kacang, atau melekuk. Sitoplasma perinuklear mengandung mitokondria, aparat golgi, sejumlah besar lisosom dan beberapa reticulum endoplasmic kasar yang menunjukkan kemampuannya dalam membuat protein (Tizard 1982).
Peran utama sel sistem fagositik mononuklear adalah melakukan fagositosis dan menghancurkan partikel asing dan jaringan mati, dan mengolah bahan asing sedemikian rupa sehingga bahan asing itu dapat membangkitkan tanggap kebal. Fagositosis oleh makrofag merupakan proses yang sama dengan neutrofil (Tizard 1982).
2.6.3. Neutrofil
Neutrofil dibentuk di dalam sumsum tulang, masuk ke dalam peredaran darah, dan tinggal di dalam peredaran darah selama sekitar 12 jam sebelum bermigrasi ke dalam jaringan. Masa hidup neutrofil hanya beberapa hari. Neutrofil merupakan bagian terbesar dari jenis leukosit pada manusia dan karnivora tetapi hanya merupakan 20-30 % dari total leukosit pada ruminansia (Tizard 1982). Menurut Jain (1993), jumlah neutrofil pada sapi berkisar antara 600-4.000/µ L.
Granula pada neutrofil ada dua yaitu azurofilik yang mengandung enzim lisozom dan peroksidase, dan granul spesifik lebih kecil mengandung fosfatase alkali dan zat-zat bakterisidal (protein kationik) yang dinamakan fagositin. Neutrofil jarang mengandung retikulum endoplasma granuler, sedikit mitokondria, apparatus Golgi rudimenter dan sedikit granula glikogen (Zukesti 2003). Neutrofil yang matang memiliki diameter 12-15 µm, nukleusnya bersegmen 3-4 lobus (Dellman & Eurell 1998).
Fungsi utama neutrofl adalah menghancurkan bahan asing melalui proses fagositosis (Tizard 1982). Neutrofil merupakan garis depan pertahanan seluler terhadap invasi jasad renik, memfagosit partikel kecil dengan aktif. Selama proses fagositosis dibentuk peroksidase. Mieloperoksidase yang terdapat dalam neutrofil berikatan dengan peroksida dan halida bekerja pada molekul tirosin dinding sel bakteri dan menghancurkannya (Zukesti 2003).
Jumlah neutrofil di dalam darah meningkat cepat tatkala terjadi infeksi akut dan kerusakan jaringan. Secara fisiologis neutrofil meningkat pada saat-saat latihan fisik karena meningkatnya arus darah yang menurunkan marginasi neutrofil disepanjang bagian dalam pembuluh darah. Peningkatan jumlah neutrofil disebut neutrofilia (Frandson 1992).
2.6.4. Eosinofil
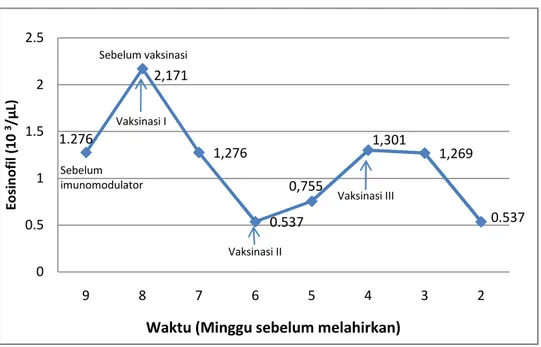
Eosinofil merupakan sel leukosit yang mengandung granula sitoplasma berwarna merah. Eosinofil berasal dari sumsum tulang, sangat motil dan sedikit fagositik. Eosinofil mempunyai garis tengah 10-15 µm (Dellman & Eurell 1998). Inti biasanya berlobus dua. Retikulum endoplasma mitokondria dan apparatus Golgi kurang berkembang (Zukesti 2003). Persentase eosinofil dalam keadaan normal berkisar antara 2-3% dari seluruh jumlah sel darah putih yang terdapat dalam darah (Guyton & Hall 1997). Menurut Frandson (1992), persentase eosinofil pada sapi berkisar antara 2-5%. Menurut Jain (1993), jumlah eosinofil pada sapi berkisar antara 0-2.400/µL.
Eosinofil seringkali diproduksi dalam jumlah besar pada penderita infeksi oleh parasit. Eosinofil ini kemudian bermigrasi ke dalam jaringan yang menderita infeki parasit tersebut (Guyton & Hall 1997). Mekanismenya adalah dengan melekatkan diri terhadap parasit dan kemudian melepaskan bahan-bahan yang dapat membunuh parasit tersebut (Tizard 1982).
Sel eosinofil ini daya fagositosisnya lemah dan dapat menunjukkan kemotaksis. Hal ini disebabkan eosinofil tidak mempunyai ribosom maka kemampuan untuk melakukan fagosistosis relatif lebih terbatas dibandingkan makrofag (Tizard 1982).
2.6.5. Basofil
Basofil merupakan sel yang sangat jarang ditemukan di dalam sirkulasi darah normal (Dellman & Eurell 1998). Menurut Frandson (1992), persentase basofil pada sapi berkisar antara 0-1%. Menurut Jain (1993), jumlah basofil pada sapi di dalam sirkulasi darah normal berkisar antara 0-200/µ L.
Basofil mempunyai granula sitoplasma yang berwarna kuat dengan zat warna juga bersifat basofilik seperti hematoksilin (Tizard 1982). Basofil mempunyai dua inti bergelambir dengan bentuk tidak teratur. Butirnya berwarna biru tua sampai ungu yang sering menutup inti yang berwarna agak cerah. Butir basofil mengandung heparin, histamin, asam hialuronat, serotonin dan beberapa faktor kemotaksis. Bahan-bahan ini selanjutnya akan menyebabkan timbulnya gejala alergi (Guyton & Hall 1997).
Basofil mempunyai garis tengah 10-15µm (Dellman & Eurell 1998). Basofil memiliki inti yang bersegmen atau ireguler. Sitoplasma basofil terisi granul yang lebih besar, dan seringkali granul menutupi inti. Granul berbentuk irreguler, berwarna
metakromatik, dengan campuran jenis Romanowsky tampak lembayung. Granula basofil metakromatik dan mensekresi histamin dan heparin (Zukesti 2003).
Basofil dan sel mast berperan penting dalam menjalankan reaksi inflamasi (Dellman & Eurell 1998) sebab tipe antibodi yang menyebabkan alergi yaitu tipe IgE mempunyai kecenderungan khusus untuk melekat pada sel mast dan basofil (Guyton & Hall 1997).
III. MATERI DAN METODE
3.1. Waktu dan Tempat
Penelitian ini berlangsung dari bulan Februari-April 2008. Penelitian ini dilakukan di Laboratorium Patologi Klinik Departemen Klinik, Reproduksi, dan Patologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB), dan di Kawasan Usaha Peternakan (KUNAK) Sapi Perah Cibungbulang-Bogor.
3.2. Alat dan Bahan
Alat-alat yang digunakan untuk penelitian ini adalah, syringe, gelas obyek, mikroskop, kamar hitung, pipet leukosit, counter, bak pewarnaan, tabung darah, label, kapas, tissu, pipet, venoject berantikoagulan pottasium ethylene diamine tetra-acetic acid (K3 EDTA) dan Ice Box. Bahan-bahan yang digunakan untuk penelitian ini adalah
air, pakan sapi (konsentrat, hijauan, ampas tahu), vaksin AI inaktif subtipe H5N1, antigen AI inaktif tanpa adjuvant, Imunomodulator, alkohol 70%, metanol, pewarna Giemsa 10%, aquades, larutan Turk.
3.3. Metode Penelitian 3.3.1. Hewan Percobaan
Hewan percobaan yang digunakan untuk penelitian ini adalah 3 ekor induk sapi betina jenis FH yang sedang bunting 7 bulan (masa kering kandang). Induk sapi dipilih yang sehat secara klinis, dengan kisaran umur 3–4 tahun (laktasi 2-3).
3.3.2. Persiapan dan Pemeliharaan Hewan Coba
Sapi yang sedang dalam masa kering kandang dipelihara di kandang di Kawasan Usaha Peternakan (KUNAK) Sapi Perah Cibungbulang-Bogor. Pakan yang diberikan berupa hijauan, konsentrat dan ampas tahu pada pagi dan sore hari, serta pemberian air minum ad libitum. Sebelum dilakukan vaksinasi, induk sapi diberi obat cacing dan multivitamin.
3.3.3. Vaksinasi
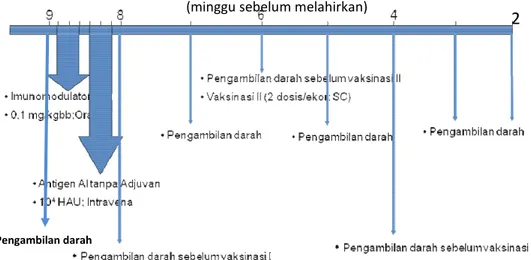
Tiga ekor induk sapi bunting 7 bulan divaksin menggunakan vaksin AI H5N1 inaktif sebanyak tiga kali pada umur 8, 6, dan 4 minggu sebelum induk sapi diperkirakan melahirkan. Sebelum vaksinasi pertama, induk sapi diberi imunomodulator peroral setiap hari selama 3 hari berturut-turut dengan dosis 0,1 mg/kgbb dan setelah itu selama 3 hari berturut-turut induk sapi disuntik setiap hari dengan antigen (Ag) H5N1 in aktif tanpa adjuvant secara intravena dengan dosis 104 HAU. Induk sapi kemudian divaksin menggunakan vaksin AI H5N1 inaktif komersial sebanyak 2 dosis/ekor secara subkutan.
3.3.4. Pengambilan Darah
Pengambilan sampel darah dilakukan melalui vena jugularis. Pengambilan darah pertama kali dilakukan pada saat sebelum induk sapi diberikan imunomodulator, kemudian pada saat sebelum divaksin yaitu pada minggu ke-8 sebelum melahirkan. Selanjutnya pengambilan darah dilakukan setiap minggu selama 6 minggu. Sampel darah diambil sebanyak 2 ml, kemudian segera dimasukkan ke dalam venoject berantikoagulan K3 EDTA untuk memperoleh whole blood. Sampel darah dibawa ke
laboratorium dengan menggunakan ice box. Selanjutnya sampel darah yang terkumpul dalam bentuk whole blood digunakan untuk analisis jumlah leukosit total dan diferensiasi leukosit.
Gambar 5 Sistematika jadwal vaksinasi AI dan pengambilan darah pada hewan coba
Pengambilan darah
(minggu sebelum melahirkan)
3.3.5. Pemeriksaan Darah
Penghitungan jumlah leukosit total dilakukan dengan metode hemocytometer. Penentuan diferensiasi leukosit menggunakan pewarnaan Giemsa dengan menghitung jenis leukosit sampai dengan jumlah 100. Nilai absolut masing-masing jenis leukosit didapat dari hasil perkalian persentase masing-masing jenis leukosit dengan jumlah leukosit total.
3.3.5.1. Menghitung Jumlah Leukosit Total
Sampel darah dihisap dengan pipet leukosit sampai angka 0,5, kemudian ujung pipet dibersihkan dari sisa-sisa darah. Kemudian dihisap larutan Turk ke dalamnya hingga angka 11, lalu ujung kedua pipet tersebut ditutup dan pipet dikocok membentuk angka delapan agar darah homogen secara sempurna. Cairan pada ujung pipet dibuang, lalu cairan yang homogen dimasukkan sebanyak satu tetes ke dalam kamar hitung dengan menempelkan ujung pipet pada pertemuan antara dasar kamar hitung dan cover glass. Penghitungan dilakukan menggunakan mikroskop dengan pembesaran 40 x 10 kali. Penghitungan dilakukan pada empat bujur sangkar luar kamar hitung. Volume ruangan = dalam x luas = 1/10 mm x 1mm2 = 1/10 mm3. Total volume ruangan yang dipakai 4 x 1/10 mm3 = 4/10 mm3. Bila jumlah sel darah putih didalam ruangan tersebut = b butir, maka 1 mm3 = 10/4 x b butir. Jumlah ini harus dikoreksi dengan faktor pengenceran dimana darah 0,5 larutan pengencer sampai 11, dikurangi 1 bagian yang tidak ikut tercampur, sehingga pengencerannya 20 kali. Jadi jumlah sel darah putih per mm3 darah adalah 10/4 x 20 x b butir = b x 50 butir (Kelly 1984)
3.3.5.2. Diferensiasi Leukosit
Diferensiasi leukosit dilakukan dengan cara membuat preparat ulas darah. Sediaan apus darah pada gelas objek dikeringkan, lalu difiksasi dengan larutan metanol selama 5 menit, kemudian dikeringkan, lalu dimasukkan ke dalam larutan pewarna Giemsa selama 30 menit, selanjutnya dikeringkan di udara. Kemudian sediaan ulas darah diamati di bawah mikroskop dengan pembesaran 100 x 10, pemeriksaan memakai minyak emersi, dan ditentukan masing-masing jenis leukosit hingga jumlahnya mencapai 100. Nilai absolut didapatkan dari hasil kali diferensiasi leukosit dengan jumlah leukosit total (Kelly 1984).
IV. HASIL DAN PEMBAHASAN
Pemberian imunomodulator pada hewan coba sebelum vaksinasi ditujukan untuk merangsang sistem pertahanan tubuh induk sapi. Gambar 6 memperlihatkan bahwa setelah pemberian imunomodulator jumlah leukosit menurun. Penurunan jumlah leukosit ini diduga disebabkan oleh menurunnya salah satu jenis leukosit di dalam darah yaitu jumlah limfosit (Gambar 7). Menurut Tizard (2000), pemberian imunomodulator akan meningkatkan pembentukan antibodi, yang berasal dari diferensiasi limfosit sehingga limfosit dimobilisasi ke jaringan limfoid (Anderson & Lorraine 2006) dan jumlah limfosit di dalam darah menurun. Selanjutnya pada Gambar 8, 9, dan 10 dapat dilihat bahwa setelah pemberian imunomodulator jumlah monosit, neutrofil dan eosinofil meningkat. Menurut Widianto (1987), pemberian imunomodulator akan meningkatkan proliferasi sel yang berperan pada imunitas seperti makrofag, granulosit, limfosit T dan B. Pemberian imunomodulator juga merangsang sintesis sitokin dan dapat meningkatkan kemampuan fagositik dengan mengaktifkan makrofag. Prinsip imunomodulator yaitu suatu zat yang berasal dari bahan biologic atau sintetik yang merangsang sistem pertahanan tubuh non spesifik (Tizard 2000).
4.1. Jumlah Leukosit Total
Fungsi leukosit adalah untuk mempertahankan tubuh melawan serangan benda asing (Colville & Bassert 2002). Leukosit mempunyai peranan dalam pertahanan seluler dan humoral terhadap organisme asing. Leukosit dapat melakukan gerakan amuboid dan melalui proses diapedesis, leukosit dapat meninggalkan kapiler dengan menerobos sel-sel endotel (Zukesti 2003).
Gambar 6 memperlihatkan rataan jumlah leukosit induk sapi FH bunting pada saat sebelum dan setelah divaksin AI H5N1 inaktif. Hasil pengamatan menunjukkan bahwa jumlah leukosit total sapi FH bunting setelah divaksin AI H5N1 inaktif mengalami peningkatan berturut-turut dari minggu ke-7 hingga minggu ke-5 sebelum melahirkan. Peningkatan leukosit ini diduga disebabkan karena vaksin AI yang masuk ke dalam tubuh sapi telah memicu peningkatan salah satu jenis leukosit di dalam darah. Menurut Coles (1986), sumsum tulang akan memproduksi dan memobilisasi leukosit ke peredaran darah sebagai respon terhadap vaksinasi.
7.983 7.55 7,983 8,117 8,667 7,633 8.15 8,117 6.8 7 7.2 7.4 7.6 7.8 8 8.2 8.4 8.6 8.8 9 8 7 6 5 4 3 2 Le u k o si t (1 0 3/µ L)
Waktu (Minggu sebelum melahirkan)
Sebelum imunomodulator Sebelum vaksinasi Vaksinasi I Vaksinasi II Vaksinasi III 0
Gambar 6 Rataan jumlah leukosit total pada induk sapi bunting sebelum dan setelah vaksinasi
Puncak peningkatan jumlah leukosit total terjadi pada minggu ke-5. Hal ini diduga disebabkan oleh pemberian vaksin kedua (booster) yang merangsang pembentukan respon imun sekunder sehingga jumlah leukosit total meningkat lebih banyak pada 1 minggu setelah vaksinasi kedua. Respon imun sekunder ini berlangsung lebih cepat dibandingkan dengan respon imun primer karena adanya sel-sel pengingat (sel memory) dari kontak pertama dengan imunogen, sehingga sel-sel pengingat berproliferasi untuk membentuk klona sel dalam jumlah yang besar (Anderson & Lorraine 2006). Menurut Conner et al. (1967), jumlah leukosit pada minggu ke-5 ini (8,667x103 / µL) masih berada di dalam kisaran normal (7,646±1,636)x103 /µL.
Jumlah leukosit total selanjutnya mengalami penurunan pada minggu ke-4. Penurunan ini diakibatkan oleh adanya penurunan salah satu jenis leukosit di dalam darah. Penurunan jumlah leukosit ini pada banyak spesies menurut Jain (1993) berasal dari penurunan jumlah neutrofil dan/atau penurunan jumlah limfosit. Pada minggu ke-4 ini terjadi penurunan jumlah limfosit (Gambar 7), yang diduga disebabkan oleh adanya diferensiasi limfosit menjadi sel-plasma untuk menghasilkan antibodi (Tizard 1982). Menurut Jain (1993), pembentukan antibodi seringkali tidak ditunjukkan oleh tingginya jumlah limfosit di peredaran darah.
Jumlah leukosit total kemudian mengalami peningkatan kembali pada minggu ke-3 dan relatif konstan hingga minggu ke-2 sebelum induk sapi melahirkan. Hal ini dapat disebabkan oleh adanya ulangan penambahan antigen asing melalui pemberian
vaksin AI yang ketiga, yang dapat memicu peningkatan jumlah leukosit total di dalam darah. Peningkatan jumlah leukosit total ini merupakan respon fisiologis untuk melindungi tubuh dari serangan mikroorganisme (Anderson & Lorraine 2006). Menurut Meyer & Harvey (2004), peningkatan jumlah leukosit total dalam darah terjadi karena adanya peningkatan salah satu jenis leukosit di dalam darah yang pada umumnya disebabkan oleh meningkatnya jumlah neutrofil dan/atau limfosit. Peningkatan pada minggu ke-3 dan minggu ke-2 mungkin juga merupakan respons fisiologis induk sapi menjelang kelahiran. Mallard et al. (1997) melaporkan bahwa selama periode peripartum terjadi stres yang melepaskan hormon glukokortikoid. Menurut Colville & Bassert (2002), stres akan menyebabkan peningkatan sekresi ACTH yang mengakibatkan peningkatan glukokortikoid di dalam darah. Mehzard et al. (2002) juga melaporkan bahwa sebelum dan setelah partus jumlah leukosit dan neutrofil meningkat sebagai respons terhadap meningkatnya kadar kortisol. Menurut Nazifi et al. (2008), peningkatan jumlah leukosit secara bertahap terjadi ketika mendekati partus. Secara umum Gambar 6 memperlihatkan bahwa jumlah leukosit total setelah vaksinasi berada di atas jumlah leukosit total sebelum vaksinasi, namun demikian jumlahnya masih berada dalam kisaran normal menurut Conner et al (1967) untuk umur kebuntingan 8 dan 9 bulan masing-masing yaitu (7,646±1,636)x103 /µ L dan (7,640±2,446)x103 /µ L.
Jumlah leukosit total meningkat pada keadaan fisiologis dan sebagai respon terhadap adanya penyakit. Leukositosis fisiologis sering terjadi pada hewan stres. Stres ini dapat berupa stres fisik, emosi atau stres yang diinduksi oleh penyakit. Perubahan jumlah leukosit total pada keadaan ini diperantarai oleh pelepasan epinefrin dan kortikosteroid. Perbedaan utama pada respons yang diperantarai hormon-hormon ini adalah 1) pada sekresi epinefrin terjadi leukositosis yang bersifat sementara dan sangat singkat muncul dalam sirkulasi darah. Pelepasan epinefrin ini mengakibatkan mobilisasi neutrofil dan limfosit dari pool marginal ke dalam sirkulasi darah, sehingga terjadi neutrofilia dan limfositosis yang bersifat sementara, 2) pada kortikosteroid leukositosis berlangsung lebih lama di dalam sirkulasi. Pelepasan kortikosteroid ini mengakibatkan kondisi neutrofilia dan limfopenia, yaitu dengan cara meningkatkan pelepasan neutrofil dari sumsum tulang dan menurunkan mobilisasi neutrofil ke jaringan. Pada limfosit mengalami limfolisis di dalam darah dan membawa limfosit ke dalam jaringan limfoid (Jain 1993).
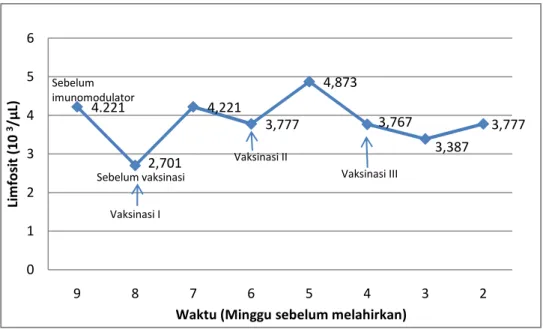
4.221 2,701 4,221 3,777 4,873 3,767 3,387 3,777 0 1 2 3 4 5 6 9 8 7 6 5 4 3 2 Li m fo si t (1 0 3/µ L)
Waktu (Minggu sebelum melahirkan)
Sebelum imunomodulator Sebelum vaksinasi Vaksinasi I Vaksinasi II Vaksinasi III 4.2. Limfosit
Limfosit berperan penting dalam menghasilkan kekebalan humoral dan kekebalan seluler (Jain 1993). Limfosit meninggalkan sumsum tulang dan tinggal di dalam berbagai organ limfoid. Terdapat dua populasi utama limfosit yaitu limfosit B (sel B) dan limfosit T (Sel T) (Kuby et al. 2007). Limfosit berperan penting dalam mendapatkan kekebalan dapatan (adaptive immunity) (Kuby et al. 2007).
Gambar 7 Rataan jumlah limfosit pada induk sapi bunting sebelum dan setelah vaksinasi
Gambar 7 memperlihatkan rataan jumlah limfosit induk sapi FH bunting pada saat sebelum dan setelah divaksin AI H5N1 inaktif. Hasil pengamatan menunjukkan bahwa jumlah limfosit pada induk sapi FH bunting setelah divaksin AI H5N1 mengalami peningkatan pada 1 minggu setelah vaksinasi pertama dan menurun pada 2 minggu setelah vaksinasi pertama. Kemudian jumlah limfosit meningkat kembali pada 1 minggu setelah vaksinasi kedua. Peningkatan jumlah limfosit ini merupakan salah satu bentuk respon individu sapi terhadap adanya paparan antigen asing yaitu vaksin AI. Vaksin AI ini diduga telah merangsang peningkatan jumlah limfosit di dalam darah. Menurut Tizard (1982), bila antigen disuntikkan ke dalam jaringan, sedikit kerusakan jaringan akan merangsang sel fagositik dibawah faktor kemotaktik bermigrasi ke tempat suntikan. Mula-mula neutrofil dan kemudian makrofag. Antigen ini selanjutnya diolah dan akhirnya merangsang tanggap kebal. Menurut Wibawan et al. (2003), antigen yang berhasil melewati sistem pertahanan non spesifik akan berhadapan dengan makrofag yang berfungsi sebagai Antigen Precenting Cell (APC) yang memfragmentasi antigen
tersebut dan akan mempresentasikannya kepada sel limfosit T. Interaksi APC dan sel T ini akan menginduksi limfosit B menjadi sel plasma yang menghasilkan antibodi. Menurut Ganong (1995), pada keadaan ini sel dirangsang untuk membelah, membentuk klona sel yang berespon terhadap antigen tersebut. Menurut Jain (1993), lymphokine dari sel T yang distimulasi antigen akan meningkatkan limfopoiesis. Menurut Coles (1986), peningkatan jumlah limfosit terjadi karena vaksinasi dan pada infeksi kronis ketika ada rangsangan antigen yang konstan yang menghasilkan peningkatan jumlah limfosit T. Anderson & Lorraine (2006) melaporkan bahwa sel limfosit B berperan dalam imunitas humoral sedangkan sel limfosit T berperan dalam imunitas seluler.
Puncak peningkatan jumlah limfosit terjadi pada minggu ke-5 (1 minggu setelah divaksinasi II). Hal ini merupakan bentuk respon imun sekunder setelah sebelumnya terpapar oleh vaksin AI yang pertama. Setelah keterpaparan terhadap antigen tertentu, sejumlah kecil sel B dan sel T aktif tetap bertahan sebagai sel memory B dan sel memory T, sel-sel ini diubah menjadi sel efektor pada paparan berikutnya terhadap antigen yang sama. Menurut Tizard (1982), limfosit berperan dalam memproduksi antibodi atau sebagai sel efektor khusus untuk menanggapi antigen yang terikat pada makrofag. Menurut Conner et al. (1967), jumlah limfosit pada minggu ke-5 ini (4,873x103 / µL) masih berada di dalam kisaran normal (4,721±1,383)x103 /µL.
Penurunan jumlah limfosit pada minggu ke-6 (2 minggu setelah vaksinasi I) dan minggu ke-4 (2 minggu setelah vaksinasi II) diduga disebabkan karena adanya diferensiasi sel-sel limfosit menjadi sel plasma yang menghasilkan antibodi. Antigen menginduksi proliferasi limfosit B menjadi sel plasma yang menghasilkan antibodi dan sel memory B (Kuby et al. 2007). Pembentukan antibodi terjadi di dalam organ-organ limfoid sekunder. Saat tubuh terpapar oleh suatu imunogen, maka kelompok (folikel limfoid) di dalam korteks kelenjar getah bening akan membentuk sentrum germinativum sebagai pusat yang aktif untuk pembelahan sel B, yang berproliferasi dan mengalami pematangan pesat menjadi sel-sel yang menghasilkan imunoglobulin (Anderson & Lorraine 2006). Sintesis antibodi terutama terjadi di dalam limfonodus dan sisanya terjadi di dalam limpa, dan sumsum tulang, termasuk juga di dalam peyer peches. Jain (1993) melaporkan bahwa respon imun yang mengarah pada pembentukan antibodi seringkali tidak ditunjukkan oleh tingginya jumlah limfosit di peredaran darah.
Tizard (2000) melaporkan bahwa pemberian antigen menyebabkan tubuh hewan akan menjalankan respon kekebalan selular dan humoral. Limfosit berperan dalam mempresentasikan antigen yang akan menginduksi pembentukan antibodi di limfonodus dan limpa. Studi yang dilakukan oleh Noviyanti (2008) membuktikan bahwa antibodi terhadap AI terdeteksi di dalam darah sapi FH bunting yang divaksin dengan vaksin AI. Penurunan jumlah limfosit pada minggu ke-6 ini, juga diduga disebabkan oleh adanya faktor stres yang menurunkan jumlah limfosit di dalam darah. Seperti yang dijelaskan oleh Colville & Bassert (2002) bahwa stres akan menyebabkan peningkatan sekresi ACTH yang mengakibatkan peningkatan glukokortikoid di dalam darah. Menurut Jain (1993), efek kortikosteroid terhadap limfosit adalah limfolisis dan limfosit diasingkan di dalam jaringan limfoid (Duncan & Keith 1986). Hal ini diikuti dengan tingginya jumlah neutrofil dan rendahnya jumlah eosinofil di dalam darah (Jain 1993).
Secara umum jumlah limfosit relatif konstan pada minggu ke-4, ke-3 sampai dengan minggu ke-2 sebelum induk sapi melahirkan, namun jumlahnya masih lebih tinggi dibandingkan dengan sebelum vaksinasi. Hal ini dapat disebabkan oleh antigen yang muncul telah dikenali oleh tubuh sehingga direspon lebih cepat. Menurut Tizard (2000), pemberian dosis antigen ketiga ditunjukkan oleh respon imun yang lebih cepat dan respon antibodi yang tinggi. Gambar 7 memperlihatkan bahwa jumlah limfosit setelah vaksinasi I, II, dan III berada di atas jumlah limfosit sebelum vaksinasi, namun jumlahnya masih berada dalam kisaran normal untuk umur kebuntingan 8 dan 9 bulan, masing-masing yaitu (4,721±1,383)x103 /µL dan (4,573±1,358)x103 /µL (Conner et al. 1967). Peningkatan jumlah limfosit ini menjadi salah satu penyebab terjadinya peningkatan jumlah leukosit total. Limfositosis terjadi pada hewan yang mengalami peradangan kronis (Meyer & Harvey 2004) dan pada tahap penyembuhan infeksi tertentu (Coles 1986). Limfosit sangat berperan penting dalam regulasi respon kekebalan dapatan, kekebalan bawaan, kekebalan humoral, kekebalan seluler, dan reaksi hipersensitivitas (Haen 1995). Peningkatan jumlah limfosit juga terjadi akibat respon epinefrin, tetapi peningkatan ini bersifat sementara (Jain 1993).
4.3. Monosit
Monosit merupakan sel makrofag yang belum matang dan mempunyai sedikit kemampuan untuk melawan agen-agen penyebab infeksi. Namun saat monosit masuk
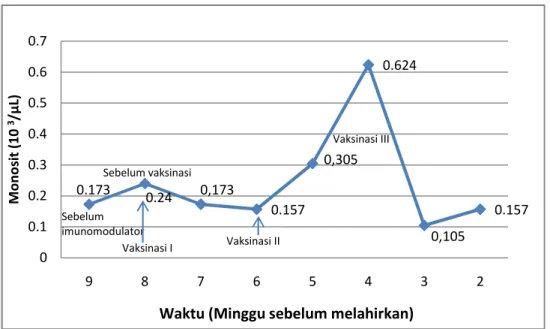
0.173 0.24 0,173 0.157 0,305 0.624 0,105 0.157 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 9 8 7 6 5 4 3 2 M o n o si t (1 0 3/µ L) Sebelum imunomodulator Sebelum vaksinasi Vaksinasi I Vaksinasi II Vaksinasi III
Waktu (Minggu sebelum melahirkan)
ke jaringan, ukuran sel dapat membesar sampai 5 kali lipat dan di dalam sitoplasmanya berkembang begitu banyak lisosom dan mitokondria, dan disebut makrofag yang sangat mampu menyerang agen penyakit (Guyton & Hall 1997). Makrofag berperan untuk melakukan proses fagositosis dan menghacurkan partikel asing dan jaringan mati serta mengolah bahan asing tersebut sehingga membangkitkan tanggap kebal (Tizard 1982).
Gambar 8 memperlihatkan rataan jumlah monosit induk sapi FH bunting pada saat sebelum dan setelah divaksin AI H5N1 inaktif. Hasil pengamatan menunjukkan bahwa jumlah monosit pada sapi FH bunting setelah vaksinasi pertama mengalami penurunan pada minggu ke-7 dan minggu ke-6 sebelum induk sapi melahirkan. Kemudian jumlah monosit mulai mengalami peningkatan pada minggu ke-5 dan mencapai jumlah tertinggi pada minggu ke-4, atau pada 1 dan 2 minggu setelah vaksinasi kedua. Penurunan jumlah monosit pada minggu ke-7 dan minggu ke-6 ini dapat disebabkan oleh keterpaparan antigen pada vaksinasi AI pertama sebagai bentuk respon imun primer, yaitu dengan cara segera memobilisasi sel-sel monosit yang ada di dalam darah ke dalam jaringan untuk menjadi makrofag dan memfagositosis antigen asing. Peran utama sel sistem fagositik mononuklear ini adalah melakukan fagositosis dan menghancurkan partikel asing dan jaringan mati, dan mengolah bahan asing sedemikian rupa sehingga bahan asing itu dapat membangkitkan tanggap kebal. Fagositosis oleh makrofag merupakan proses yang sama dengan neutrofil (Tizard 1982).
Jumlah monosit pada minggu ke-5 (1 minggu setelah vaksinasi II) dan ke-4 (2 minggu setelah vaksinasi II) meningkat lebih tajam. Hal ini diduga disebabkan oleh respon imun sekunder sehingga jumlah monosit di dalam darah ditingkatkan untuk segera masuk ke dalam jaringan. Menurut Jain (1993), sebagai respon terhadap adanya penyakit, jumlah produksi dan pelepasan monosit ditingkatkan dari sumsum tulang ke dalam darah. Kuby et al. (2007) melaporkan bahwa monosit bersirkulasi di dalam darah dan akan bermigrasi ke dalam jaringan dan berdiferensiasi menjadi makrofag jaringan yang spesifik.
Jumlah monosit mengalami penurunan pada minggu ke-3 (1 minggu setelah vaksinasi III) dan sedikit meningkat pada minggu ke-2 (2 minggu setelah vaksinasi III). Penurunan ini dapat terjadi karena antigen yang sama telah dikenali oleh tubuh dan direspon lebih cepat oleh sistem imun tubuh. Di dalam jaringan, monosit berubah menjadi makrofag yang berperan penting dalam peradangan yang kronis. Monosit berkumpul di daerah yang mengalami peradangan dan jaringan yang rusak dalam merespon faktor-faktor kemotaktik (Jain 1993). Pengaruh kemotaktik ini akan merangsang makrofag untuk memfagosit sel-sel yang mati (Meyer & Harvey 2004). Gambar 8 menunjukkan bahwa jumlah monosit setelah vaksinasi pertama dan ketiga lebih rendah dibandingkan dengan jumlah monosit pada saat sebelum vaksinasi. Sedangkan jumlah monosit setelah vaksinasi kedua lebih tinggi dibandingkan dengan jumlah monosit pada saat sebelum vaksinasi. Jumlah monosit tertinggi dicapai pada minggu ke-4 yaitu pada 2 minggu setelah vaksinasi kedua. Namun demikian jumlah ini masih berada dalam kisaran normal (25-840/µ L) (Jain 1993).
Monosit memfagosit dan memproses antigen sebelum limfosit memicu respon antibodi atau kekebalan seluler. Monosit berperan penting dalam pertahanan tubuh melawan invasi organisme patogen dengan penelanan dan fagositosis serta berperan dalam aktivasi respon imun dapatan (Jain 1993). Peningkatan jumlah monosit menurut Jain (1993) dapat terjadi pada respon peradangan yang kronis. Menurut Duncan & Keith (1986), peningkatan monosit dapat terjadi pada keadaan neutrofilia, termasuk terhadap respon epinefrin dan kortikosteroid.
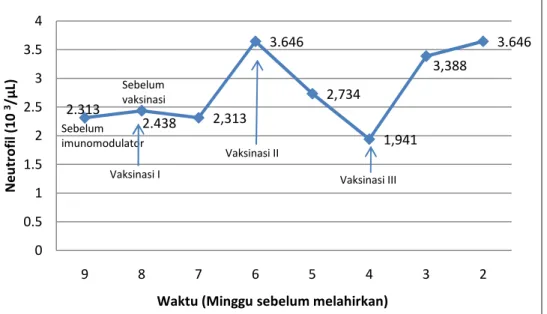
2.313 2.438 2,313 3.646 2,734 1,941 3,388 3.646 0 0.5 1 1.5 2 2.5 3 3.5 4 9 8 7 6 5 4 3 2 N e u tr o fi l (1 0 3/µ L) Sebelum imunomodulator Sebelum vaksinasi Vaksinasi I Vaksinasi II Vaksinasi III
Waktu (Minggu sebelum melahirkan) 4.4. Neutrofil
Jumlah neutrofil di dalam darah meningkat cepat pada keadaan infeksi akut dan kerusakan jaringan (Frandson 1992). Neutrofil merupakan garis depan pertahanan seluler terhadap invasi jasad renik, memfagosit partikel kecil dengan aktif (Zukesti 2003).
Gambar 9 memperlihatkan rataan jumlah neutrofil induk sapi FH bunting pada saat sebelum dan setelah divaksin AI H5N1 inaktif. Hasil pengamatan menunjukkan bahwa jumlah neutrofil sapi FH bunting setelah divaksin AI H5N1 mengalami peningkatan pada 2 minggu setelah vaksinasi pertama menjadi 3,646x103 /µ L, dan pada minggu ke-3 dan ke-2 sebelum induk melahirkan atau 1 dan 2 minggu setelah vaksinasi ketiga, masing-masing menjadi 3,388x103 /µL dan 3,646x103 /µL. Menurut Conner et al. (1967), nilai ini masih berada di dalam kisaran normal induk sapi umur kebuntingan 8 dan 9 bulan, masing-masing yaitu (2,318±1,999)x103 /µL dan 2,578±1,072x103 /µ L.
Gambar 9 Rataan jumlah neutrofil pada induk sapi bunting sebelum dan setelah vaksinasi
Peningkatan jumlah neutrofil pada minggu ke-6, ke-3 dan ke-2 diduga disebabkan oleh adanya faktor stres. Stres dapat berupa stres fisik, emosi atau stres yang diinduksi oleh penyakit (Jain 1993). Menurut Wallar (2000), stres fisiologis juga sering terjadi pada periode sekitar partus. Menurut Coles (1986), jumlah leukosit meningkat pada usia kebuntingan lanjut dan tipe sel darah putih yang meningkat adalah neutrofil. Menurut Colville & Bassert (2002), kondisi stres akan menyebabkan peningkatan sekresi ACTH yang mengakibatkan pelepasan glukokortikoid di dalam darah. Kondisi