KAJIAN JENIS LIMBAH, SUHU, DAN LAMA PENYIMPANAN
TERHADAP DAYA TAHAN DAN POTENSI ANTAGONISME
Pseudomonas fluorescens
ANNISA KUSUMOWARDANI
JURUSAN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
ABSTRAK
ANNISA KUSUMOWARDANI. Kajian Jenis Limbah, Suhu, dan Lama Penyimpanan terhadap Daya Tahan dan Potensi Antagonisme Pseudomonas
fluorescens. Dibimbing oleh Giyanto.
Penggunaan agens hayati merupakan salah satu alternatif pengendalian hama dan penyakit tumbuhan. Salah satu agens hayati yang umum digunakan yaitu P.
fluorescens. Aplikasi di lapangan dihadapkan pada kendala dalam perbanyakan masal
yang memerlukan media alternatif untuk pertumbuhan P. fluorescens, karena jika menggunakan media Luria Broth (LB) biaya yang digunakan tidak efisien. P.
fluorescens bersifat saprofit, yaitu dapat hidup pada sisa-sisa bahan organik.
Penelitian terdahulu telah membuktikan bahwa P. fluorescens dapat hidup dan berkembang biak pada limbah organik cair. Dalam rangka aplikasi di lapang, diperlukan informasi tentang daya tahan dan keefektifan antagonisme P. fluorescens dalam jangka waktu dan suhu tertentu. Penelitian ini dilakukan untuk mengetahui pengaruh lama dan temperatur penyimpanan terhadap daya tahan P. fluorescens serta mengetahui potensi antagonisme P. fluorescens yang dibiakan pada media limbah organik cair terhadap S. rolfsii. Manfaat dari penelitian ini yaitu pemanfaatan limbah organik cair sebagai media alternatif bagi P. fluorescens. Selain itu, pemanfaatan limbah organik cair juga memberikan nilai tambah yang baik terhadap limbah organik cair dan dapat mengurangi pencemaran lingkungan. Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Dalam penelitian ini dilakukan pengujian daya tahan P. fluorescens yang dibiakan pada media limbah organik cair terhadap lama dan suhu penyimpanan serta menguji potensi antagonisme
P. fluorescens terhadap S. rolfsii pada media limbah organik cair terhadap lama dan
suhu penyimpanan. Media alternatif yang digunakan yaitu air kelapa, limbah tahu dan tetes tebu. Sebagai kontrol digunakan media LB. Hasil penelitian menunjukkan bahwa P. fluorescens yang dibiakkan pada media limbah organik cair, yaitu air kelapa, limbah tahu, dan tetes tebu dapat bertahan dalam jangka waktu sebelas minggu. Diantara berbagai media alternatif, media air kelapa merupakan media yang paling baik untuk pertumbuhan P. fluorescens. Jumlah populasi P. fluorescens yang stabil pada minggu akhir penyimpanan, juga menyebabkan P. fluorescens yang dibiakkan pada media air kelapa mampu menekan pertumbuhan S. rolfsii pada minggu akhir penyimpanan. Terdapat perbedaan kualitas potensi antagonisme P.
fluorescens yang dibiakkan pada berbagai media, suhu, dan lama penyimpanan
terhadap S. rolfsii. Pada penyimpanan suhu dingin (4 °C), jumlah populasi P.
fluorescens lebih stabil daripada penyimpanan suhu ruang. Bakteri berkembang biak
secara optimum pada suhu 20-30 °C. Selain itu, P. fluorescens yang dibiakan pada media limbah organik cair, secara in vivo berpotensi menghambat pertumbuhan S.
Kajian Jenis Limbah, Suhu, dan Lama Penyimpanan
Terhadap Daya Tahan dan Potensi Antagonisme
Pseudomonas fluorescens
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Pertanian pada
Jurusan Hama dan Penyakit Tumbuhan
ANNISA KUSUMOWARDANI
JURUSAN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
Judul Skripsi : KAJIAN JENIS LIMBAH, SUHU, DAN LAMA PENYIMPANAN TERHADAP DAYA TAHAN DAN POTENSI ANTAGONISME Pseudomonas fluorescens Nama Mahasiswa : Annisa Kusumowardani
NRP : A44104042
Program Studi : Hama dan Penyakit Tumbuhan
Menyetujui, Pembimbing
Dr. Ir. Giyanto, MSi NIP. 132 055 227
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. Didy Sopandie, MAgr NIP. 131 124 019
RIWAYAT HIDUP
Penulis dilahirkan di Manokwari, Papua pada tanggal 31 Januari 1987 dari pasangan Bambang Herman Sutjipto (Alm) dan Budi Nurrini sebagai anak ke dua dari dua bersaudara.
Pendidikan penulis dimulai dari SDN Pengadilan 3 Bogor, kemudian dilanjutkan di SLTPN 1 Bogor pada tahun 1998, dan lulus dari SMUN 5 Bogor pada tahun 2004. Penulis menjadi mahasiswa Departemen Proteksi, Tanaman Institut Pertanian Bogor pada tahun 2004 melalui jalur SPMB. Selama menjadi mahasiswa, penulis aktif dalam organisasi kemahasiswaan diantaranya dalam klub fotografi, UKM (Unit Kreativitas Mahasiswa) basket, dan menjadi pengurus HIMASITA (Himpunan Mahasiswa Proteksi Tanaman) sebagai anggota Departemen Luar Negeri pada periode 2006-2007.
PRAKATA
Bismillaahirrahmaanirrahiim
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan tugas akhir yang berjudul Kajian Jenis Limbah, Suhu, dan Lama Penyimpanan terhadap Daya Tahan dan Potensi Antagonisme Pseudomonas
fluorescens.
Penulis mengucapkan terimakasih kepada:
• Ibunda tercinta, yang selalu memberikan kasih sayang dan doanya di setiap waktu, kasih sayangmu yang tulus tidak akan pernah tergantikan, serta kakakku
bungky yang selalu memberikan dukungan dan semangat.
• Dr. Ir Giyanto, M.Si sebagai dosen pembimbing tugas akhir yang telah memberikan arahan, dorongan serta ilmunya kepada penulis.
• Dr. Ir Yayi Munara Kusumah, M.Si sebagai dosen penguji tamu yang telah memberikan saran untuk perbaikan skripsi ini.
• Dr. Ir. Kikin Hamzah Mutaqien, M.Si sebagai dosen pembimbing akademik yang selalu memberikan saran dan nasehat kepada penulis.
• Teman-teman bactery crew mbak Didi, mbak Santi, mbak Winda, kak Deden dan Andes yang telah membantu penulis dalam melakukan penelitian.
• Semua teman-teman angkatan 41, kebersamaan dan keceriaan bersama kalian telah memberikan warna yang baru.
• Prakarsa Sitepu, SP yang telah membantu dan memberikan semangat serta dorongan kepada penulis dalam menyelesaikan penulisan skripsi ini.
Penulis menyadari dalam penulisan skripsi ini masih banyak kekurangan. Penulis berharap semoga skripsi ini dapat berguna dan bermanfaat.
Bogor, Agustus 2008
DAFTAR ISI
Halaman DAFTAR GAMBAR ... ix PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 2 Manfaat ... 2 TINJAUAN PUSTAKA ... 3 Pengendalian Hayati ... 3 Pseudomonas fluorescens ... 4 Sclerotium rolfsii ... 5Limbah Organik Cair ... 6
Air Kelapa ... 6
Limbah Tahu ... 7
Tetes Tebu ... 7
BAHAN DAN METODE ... 8
Tempat dan Waktu ... 8
Metode Penelitian ... 8
Pembiakan P. fluorescens ... 8
Persiapan Limbah Organik Cair Sebagai Media Alternatif untuk P. fluorescens ... 8
Pembiakan dan Penyimpanan P. fluorescens pada Media Limbah Organik Cair ... 9
Uji Daya Tahan P. fluorescens pada Media Limbah Organik Cair ... 9
Uji potensi antagonis P. fluorescens terhadap S. rolfsii pada media limbah organik cair ... 10
HASIL DAN PEMBAHASAN ... 12 Pengaruh Jenis Media, Lama, dan Temperatur
Penyimpanan terhadap Daya Tahan P. fluorescens ... 12 Uji Potensi Antagonis P. fluorescens terhadap S. rolfsii
pada Media Limbah Organik Cair yang Disimpan pada
Suhu Ruang dan Suhu Dingin (40C) ... 17 Perbandingan Kualitas Potensi Antagonisme P. fluorescens
terhadap S. rolfsii pada Media Limbah Organik Cair ... 22 KESIMPULAN DAN SARAN ... 25 DAFTAR PUSTAKA ... 26
DAFTAR GAMBAR
Halaman Gambar 1 Tabung penyimpanan media limbah organik cair ... 9 Gambar 2 Uji antagonis P. fluorscens terhadap S. rolfsii dengan
metode dual culture ... 11 Gambar 3 Kurva rata-rata populasi P. fluorscens pada media limbah
cair organik pada penyimpanan suhu ruang ... 12 Gambar 4 Kurva rata-rata populasi P. fluorscens pada media limbah
cair organik pada penyimpanan suhu dingin (4 °C) ... 13 Gambar 5 Kurva rata-rata populasi P. fluorescens pada media Luria
Broth dan air kelapa ... 14 Gambar 6 Kurva rata-rata populasi P. fluorescens pada media Luria
Broth dan limbah tahu ... 14 Gambar 7 Kurva rata-rata populasi P. fluorescens pada media Luria
Broth dan tetes tebu ... 15 Gambar 8 Grafik rata-rata persentase hambatan maksimum
P. fluorscens terhadap S. rolfsii pada media limbah organik
cair dengan suhu ruang ... 16 Gambar 9 Grafik rata-rata persentase hambatan maksimum
P. fluorscens terhadap S. rolfsii pada media limbah organik
cair dengan dingin (4 °C) ... 18 Gambar 10 Grafik rata-rata persentase hambatan P. fluorscens
terhadap S. rolfsii pada media Luria Broth dan air kelapa .. 18 Gambar 11 Grafik rata-rata persentase hambatan P. fluorscens
terhadap S. rolfsii pada media Luria Broth dan limbah
tahu ... 19 Gambar 12 Grafik rata-rata persentase hambatan P. fluorscens
terhadap S. rolfsii pada media Luria Broth dan tetes tebu ... 20 Gambar 13 Reaksi antagonisme P. fluorscens yang dibiakkan pada
berbagai media pada penyimpanan suhu dingin terhadap
S. rolfsii ... 21
Gambar 14 Reaksi antagonisme P. fluorscens yang dibiakkan pada berbagai media pada penyimpanan suhu dingin terhadap
PENDAHULUAN
Latar belakang
Penggunaan pestisida merupakan alternatif terakhir dalam teknik pengendalian hama dan penyakit menurut prinsip PHT. Penggunaan pestisida secara terus-menerus dapat berbahaya bagi keseimbangan lingkungan, ekosistem dan kesehatan manusia. Dampak negatif yang ditimbulkan oleh pestisida yaitu resistensi hama, resurgensi hama, musnahnya musuh alami, munculnya hama sekunder, pencemaran lingkungan, serta gangguan kesehatan bagi manusia. Oleh karena itu diperlukan alternatif cara pengendalian lain yang lebih ramah lingkungan.
Pengendalian hayati adalah setiap kondisi yang menyebabkan daya tahan atau aktivitas patogen menurun karena adanya aktivitas mikroorganisme lain, sehingga serangan patogen berkurang. Pemanfaatan agens pengendali hayati ini diharapkan dapat membantu pengendalian penyakit tanpa mengganggu kondisi lingkungan.
Pseudomonas fluorescens sebagai agens hayati telah benyak digunakan untuk
mengendalikan penyakit, misalnya P. fluorescens A506 telah dijual dengan nama dagang BlightBan A506 untuk mengendalikan Erwinia amylovora penyebab fire
blight pada apel pear, tomat, dan strawberry, P. fluorescens dengan nama dagang
Conquer dan Victus untuk mengendalikan P. tolassii pada jamur (Nakkeeran
et al. 2005). Selain itu, P. fluorescens juga dapat mengendalikan penyakit yang
disebabkan oleh cendawan, virus, dan nematoda.
Penggunaan P. fluorescens di Indonesia saat ini belum dilakukan dalam aplikasi lapang yang luas. Hal ini disebabkan oleh kendala dalam memproduksi bakteri ini secara massal. Selama ini produksi P. fluorensens dilakukan dengan menggunakan media standar laboratorium seperti Luria Broth dan King s B. Sementara itu jika dalam memproduksi massal tetap menggunakan media tersebut, maka akan membutuhkan biaya yang sangat besar dan tidak ekonomis. Oleh karena itu diperlukan media alternatif untuk memproduksi P. fluorescens secara masal.
P. fluorescens bersifat saprofit, yaitu dapat hidup dan berkembang pada
limbah organik cair. Kelimpahan limbah organik dapat mencemari lingkungan, hanya sebagian kecil yang sudah dapat diolah dan dimanfaatkan, seperti nata de coco yang terbuat dari limbah air kelapa, dan nata de soya dari limbah cair tahu. Selain itu limbah tebu yang berupa blotong, ampas tebu dan tetes tebu juga dapat dimanfaatkan yaitu sebagai pakan ternak (Syukur 2006). Limbah cair peternakan dapat dijadikan media untuk pertumbuhan bakteri P. fluorescens (Ratdiana 2007), limbah air beras dapat dijadikan media alternatif bagi Bacillus subtillis B12 (Ahmadi 2007), selain itu guano yang merupakan feses dari kelelawar juga dapat digunakan sebagai agens antagonis terhadap penyakit bercak coklat oleh Alternaria solani (Sari 2007).
Dalam rangka aplikasi di lapang, diperlukan informasi tentang daya tahan dan keefektifan antagonisme P. fluorescens yang dibiakan pada limbah organik cair dalam jangka waktu dan suhu tertentu.
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh lama dan temperatur penyimpanan terhadap daya tahan P. fluorescens serta potensi antagonisme P. fluorescens yang dibiakan pada media limbah organik cair terhadap S. rolfsii.
Manfaat Penelitian
Limbah organik cair dapat digunakan sebagai media alternatif bagi pertumbuhan P. fluorescens. Pemanfaatan limbah organik tersebut juga akan memberikan nilai tambah yang baik terhadap limbah organik cair dan dapat mengurangi pencemaran lingkungan. Selain itu, penelitian ini juga bermanfaat untuk mendapatkan formulasi penggunaan limbah organik cair sebagai media alternatif P.
TINJAUAN PUSTAKA
Pengendalian Hayati
Pengendalian hayati merupakan salah satu cara pengendalian penyakit yang menitikberatkan terhadap pengunaan mikroorganisme, yaitu usaha memanipulasi lingkungan yang dapat menguntungkan tanaman inang dan agens biokontrol atau dengan cara mengintroduksi agens biokontrol sehingga kepadatan inokulum patogen berkurang. Pemanfaatan agens hayati untuk mengendalikan patogen telah banyak dilakukan. Pengertian agens hayati menurut Peraturan Menteri Pertanian Nomor 411 tahun 1995 yaitu setiap organisme yang meliputi spesies, subspesies, varietas dan semua jenis serangga, nematoda, protozoa, cendawan (fungi), bakteri, virus, mikoplasma, serta semua mikroorganisme lainnya dalam semua tahap perkembangannya yang dapat dipergunakan untuk keperluan pengendalian hama dan penyakit atau organisme pengganggu, proses produksi, pengolahan hasil pertanian, dan berbagai keperluan lainnya (Supriadi 2006).
Mekanisme antagonisme antara agens antagonis dengan patogen dikenal dalam tiga bentuk yaitu kompetisi, antibiosis dan hiperparasitisme. Kompetisi dapat berupa persaingan dalam memperoleh zat-zat makanan dan ruang tumbuh (Baker and Cook 1974). Mikroba antagonis dapat berupa bakteri, cendawan, actiomycetes, atau virus. Berbagai spesies mikroba antagonis telah berhasil diisolasi dan dievalusi keefektifannya sebagai agens antagonis.
Penggunaan plant growth promoting rhizobacteria (PGPR) merupakan salah satu contoh dalam pengendalian hayati. PGPR dapat meningkatkan perkecambahan benih dan perkembangan akar pada tanaman. Menurut Siddiqui 2005, rhizobakteri ini dapat membantu pertumbuhan tanaman dengan menghasilkan hormon pertumbuhan. Selain itu PGPR juga melindungi tanaman dari penyakit yang disebabkan oleh bakteri, cendawan, dan nematoda. PGPR mempengaruhi pertumbuhan tanaman dengan cara fiksasi nitrogen, sintesis hormon, pelarutan zat-zat mineral dan sintesis enzim yang dapat mengatur homon pada tanaman (Siddiqui 2005).
Rhizobakteri yang telah umum digunakan yaitu Bacillus subtilis dan
Pseudomonas fluorescens. B. subtilis efektif mengendalikan penyakit yang
disebabkan oleh Rhizoctonia sp., Pythium sp., Fusarium sp., dan Phytophthora sp. pada tanaman hortikultura sedangkan Pseudomonas fluorescens efektif untuk Erwinia
amylovora penyebab fire blight pada apel pear, tomat, dan strawberry (Nakkeeran et al. 2005). Selain itu, P. fluorescens juga dapat mengendalikan penyakit akar gada
yang disebabkan oleh Plasmodiophora brassicae pada caisin (Hanudin et al. 2005).
Pseudomonas fluorescens
Ciri-ciri bakteri genus Pseudomonas antara lain berbentuk bulat panjang atau batang, sebagian besar bersifat mobil dengan flagella monotrikus, politrikus atau lopotrikus dan hampir semuanya gram negatif dan bersifat aerobik (Bucharan & Gibbons 1974 dalam Suharno 2001).
Menurut Anas (1989), Pseudomonas fluorescens mempunyai kemampuan untuk membebaskan pigmen yang berfluoresensi kuning sampai hijau. Pigmen berwarna hijau tersebut digunakan sebagai pedoman para ahli mikrobiologi karena biasanya pigmen tersebut hanya dikeluarkan oleh spesies-spesies Pseudomonas penghasil antibiotika. Pseudomonas kelompok fluorescens ini dapat mengeluarkan pigmen phenazine yang dapat menekan pertumbuhan patogen (Brock & Madigan 1988 dalam Hasanuddin 2003).
Pseudomonas fluorescens juga dapat menghasilkan metabolit seperti
siderofor, hidrogen sianida, antibiotik, atau enzim ekstraselluler yang bersifat antagonis melawan patogen. Metabolit-metabolit tersebut berguna untuk menginduksi pertumbuhan tanaman (Hasanuddin 2003). Siderofor dapat menekan perkembangan patogen secara aktif dalam persaingan besi (Fe) karena senyawa ini memiliki berat molekul rendah dengan affinitas yang sangat kuat terhadap Fe (III). Beberapa penelitian menunjukkan bahwa siderofor berpendarfluor kuning-kehijauan yang dihasilkan oleh pseudomonad pendarfluor disebut sebagai pseudobactin bermanfaat untuk pertumbuhan tanaman (Neilands & Leong 1986; Leong 1986 dalam Hasanuddin 2003)
P. fluorescens merupakan salah satu golongan PGPR yang memiliki
mekanisme biokontrol yang melibatkan produksi antibiotik berupa phenazine-1-carboxyclic acid, 2,4-diacetyl phloroglucinol, oomycin, pyoluteorin, pyrrolnitrin, kanosamine, zwittermycin-A, dan pantocin A (Fernando et al. 2005).
P. fluorescens dapat menekan perkembangan Pseudomonas solanacearum
karena uji antagonisme P. fluorescens terhadap P. solanacearum menunjukkan adanya zona perubahan warna di sekeliling benih yang dilumuri agens antagonis. Antagonisme bersifat kompetisi dan lisis. Kompetisi terjadi dalam pemanfaatan nutrisi dan ruang tumbuh, sedangkan lisis ditunjukkan dengan pecahnya koloni P.
solanacearum yang berada di dalam zona (Anik 2001). Beberapa strain dari P. fluorescens dapat menekan penyakit pada tanaman serta melindungi benih dan akar
dari serangan cendawan tular tanah dan bekteri patogen (Défago & Haas 1990, Sullivan & O Gara 1992 dalam Corbell & Loper 1995).
P. fluorescens memiliki kelebihan dibanding bakteri lain, karena bakteri ini
memiliki proses metabolisme yang sederhana sehingga dapat langsung menuju substrat yang dikeluarkan oleh tanaman dan memiliki siklus hidup yang pendek. Sifat-sifat yang dimiliki oleh P. fluorescens diantaranya adalah mampu mendominasi pemanfaatan eksudat yang dikeluarkan oleh akar, dapat berkembang biak dengan cepat, dan mampu mengkoloni daerah perakaran (Schippers et al. 1987 dalam Suharno 2001).
Sclerotium rolfsii
Sclerotium rolfsii mempunyai miselium bercabang seperti kapas, berwarna
putih dan tidak memproduksi spora (Agrios 1997). Untuk mempertahankan diri dan pemencaran, cendawan ini membentuk sklerotium yang semula berwarna putih kemudian menjadi coklat dengan diameter sekitar 1 mm (Semangun 2004). S. Rolfsii berkembang optimal pada kelembaban tanah yang tinggi (Okereke & Wokocha 2007).
S. Rolfsii dapat menyerang berbagai tanaman untuk dijadikan sebagai inang,
(Lycopersicon esculentum), wortel (Daucus carota), jagung (Zea mays) dan padi (Oryza sativa) (CPC 2005). Pada umumnya tanaman yang terserang S. Rolfsii menunjukkan gejala busuk pada batang dan akar. Pada bagian yang terserang terdapat miselium cendawan berwarna putih. Pada daun-daun yang letaknya dekat dengan tanah, cendawan membentuk bercak-bercak berwarna coklat muda dan diameternya mencapai 2 cm dengan cincin sepusat berwarna gelap. Di bagian tengah bercak, pada sisi bawah daun biasanya terdapat sklerotium berwarna coklat muda (Semangun 2004).
Limbah Organik Cair
Produksi agens antagonis seperti P. fluorescens dan B. subtilis tidak hanya dapat dilakukan pada media laboratium saja. Sifat saprofitik yang dimiliki agens antagonis tersebut memungkinkan penggunaan media alternatif dari limbah organik cair.
Limbah organik cair banyak yang dapat dimanfaatkan sebagai media alternatif seperti limbah cair peternakan dapat dijadikan media untuk pertumbuhan bakteri P.
fluorescens (Ratdiana 2007), limbah air beras dapat dijadikan media alternatif bagi Bacillus subtillis B12 (Ahmadi 2007), selain itu guano yang merupakan feses dari
kelelawar juga dapat digunakan sebagai agens antagonis terhadap penyakit bercak coklat oleh Alternaria solani (Sari 2007).
Air Kelapa
Pemanfaatan limbah organik cair sebagai media tumbuh bakteri tertentu telah dilakukan sejak lama. Hal ini dibuktikan dengan adanya nata de coco yang terbuat dari limah air kelapa dengan penambahan bekteri Acetobacter xylinum.
Air kelapa mempunyai komposisi nutrisi yang lengkap, yaitu 95,5% air, 4% karbohidrat, 0,1% lemak, 0,02% kalsium, 0,01% fosfor, 0,5% besi, asam amino, vitamin C, vitamin B kompleks, dan garam-garam mineral (Vigliar et al. 2006). Semakin tua umur buah kelapa, maka semakin baik nutrisinya.
Limbah Tahu
Pembuatan nata de soya merupakan salah satu pemanfaatan limbah tahu yang telah dilakukan. Pengolahan tersebut melibatkan bakteri Acetobacter xylinum, yang memanfaatkan protein dan karbohidrat dalam limbah itu sebagai sumber energi untuk hidup dan berkembang biak (Anonim, 1997). Hariyadi et al. (2002) mengemukakan bahwa limbah cair tahu mengandung kadar air 99,28%, kadar abu 0,06%, total padatan 0,67%, protein 0,17%, lemak 0,09%, karbohidrat 0,35%, dan pH 4,27. Dari analisis tersebut menunjukkan bahwa limbah cair tahu merupakan sumber media yang baik untuk pertumbuhan mikroba, termasuk bakteri antagonis, tetapi untuk memperoleh hasil pertumbuhan yang optimal diperlukan tambahan nutrisi berupa sumber karbon dan sumber nitrogen
Tetes Tebu
Tebu merupakan salah satu tanaman perkebunan yang bernilai tinggi. Pabrik pengolahan tebu menghasilkan limbah yang cukup besar bagi lingkungan, namun banyak yang dapat dimanfaatkan seperti pucuk tebu, blotong, ampas tebu dan tetes tebu.
Tetes tebu dapat digunakan sebagai pakan ternak secara langsung atau melalui proses pengolahan menjadi protein sel tunggal dan asam amino (Rudiono 2003 dalam Syukur 2006). Menurut Syukur (2006), komposisi nutrisi yang terkandung dalam tetes tebu meliputi 58 % karbohidrat, 20 % air, 2,5 % protein kasar, 10, 5 % mineral, 0,8 % kalsium, dan 0,1% fosfor. Selain itu tetes tebu juga mengandung tiamin 0,8 (mg/kg), riboflafin 3 (mg/kg), niacin 28 (mg/kg), dan asam panthotenet 35 (mg/kg).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bakteriologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, di mulai pada bulan Januari sampai dengan Mei 2008.
Metode Penelitian Pembiakan P. fluorescens
Isolat P. fluorescens yang dibiakan yaitu dari kultur stok koleksi Laboratorium Bakteriologi Tumbuhan Proteksi Tanaman. Sebanyak satu lup P.
fluorescens diambil dari kultur stok dan digoreskan pada cawan petri steril yang
berisi media King s B padat dan diinkubasi pada suhu ruang. Pembiakan P.
fluorescens ini dilakukan secara aseptik.
Persiapan Limbah Organik Cair Sebagai Media Alternatif untuk P. fluorescens Penelitian ini menggunakan empat macam media yang berbeda, yaitu tiga macam media alternatif, dan satu media laboratorium sebagai kontrol. Media alternatif yang digunakan yaitu air kelapa, limbah tahu, dan tetes tebu, sedangkan media laboratorium yang digunakan sebagai kontrol adalah LB (Luria Broth).
Media air kelapa diperoleh dari buah kelapa yang sudah tua, dan diambil airnya. Air kelapa yang diperoleh kemudian disaring menggunakan kertas saring dan disesuaikan pH-nya menjadi 7 dengan menambahkan NaOH 0,1 M. Kemudian disterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit.
Limbah tahu yang digunakan sebagai media alternatif yaitu limbah cair hasil dari proses pembuatan tahu. Limbah tersebut disaring dengan menggunakan kertas saring. Kemudian dimodifikasi dengan komposisi akhir 1,25 % glukosa; 10% ekstrak usus ayam; 10 % aquades; dan 80 % limbah tahu dengan pH 7.
Tetes tebu merupakan salah satu limbah yang dihasilkan dari pabrik pengolahan tebu. Tetes tebu yang digunakan memiliki konsentrasi 50 % dan dimodifikasi dengan penambahan 2,5 % glukosa; 10 % ekstrak usus ayam; dan 40 % aquades dengan pH 7.
Pembiakan dan Penyimpanan P. fluorescens pada Media Limbah Organik Cair Isolat P. fluorescens yang telah ditumbuhkan pada media King s B selama 24 jam diambil sebanyak satu lup dan dimasukkan ke dalam 20 ml media LB (10 g tryptone, 5 g yeast ekstrak, 5 g NaCl, dan 1 l aquades). Kemudian diinkubasi dengan menggunakan shaker selama 13 jam dengan kecepatan 100 rpm.
Suspensi P. fluorescens diinokulasikan ke dalam masing-masing media alternatif dan LB sebagai control dengan perbandingan 1:100 ml. Media disimpan pada suhu ruang dan suhu dingin (4 °C). Pada proses penyimpanan, media yang telah ditambahkan P. fluorescens ditempatkan pada tabung plastik untuk penyimpanan selama sebelas minggu yang kemudian akan diuji daya tahan dan potensi antagonismenya pada minggu ke-0, 1, 3, 5, 7, 9, 11. Masing-masing tabung plastik berisi 25 ml media.
Gambar 2 Tabung penyimpanan media limbah organik cair
Uji Daya Tahan P. fluorescens pada Media Limbah Organik Cair
Metode pengenceran berseri dilakukan untuk uji daya tahan atau kepadatan populasi. Sebanyak 1 ml P. fluorescens yang dibiakan pada media limbah organik cair diinokulasikan ke dalam 9 ml aquades steril lalu dicampur secara merata dengan
menggunakan vorteks, maka didapatkan pengenceran 10-1. Dari pengenceran 10-1 diambil 1 ml kemudian dimasukkan ke dalam 9 ml aquades steril dan dicampur kembali dengan menggunakan vorteks, dan seterusnya hingga pengenceran 10-8.
Plating hanya dilakukan pada pengenceran 10-6, 10-7 dan 10-8 yaitu dengan cara menyebar 100 l suspensi yang telah diencerkan ke dalam cawan dengan media King s B padat. Pengujian ini dilakukan dengan dua kali ulangan. Pengamatan yaitu dengan menghitung jumlah koloni yang tumbuh setelah 24 jam. Jumlah koloni yang tumbuh selanjutnya dikonversikan ke bentuk cfu/ml dengan rumus
populasi = jumlah koloni pada pengenceran
faktor pengenceran x volume suspensi yang disebar (ml)
Uji potensi antagonis P. fluorescens terhadap S. rolfsii pada media limbah organik cair
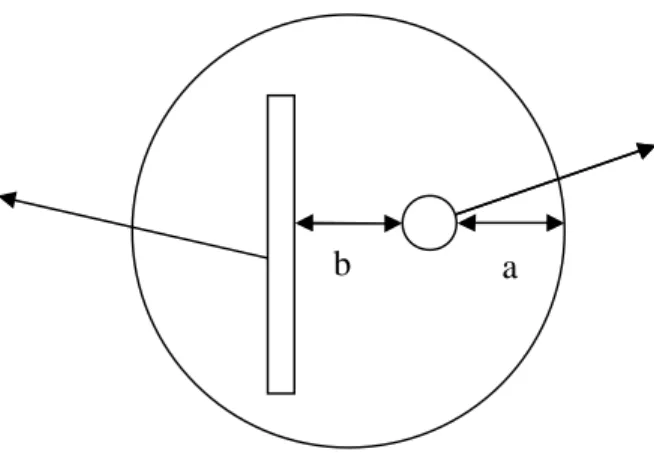
Potensi antagonis P. fluorescens terhadap S. rolfsii diuji dengan menggunakan metode dual culture atau koloni ganda. Kertas saring dengan ukuran 0,5 x 4,5 cm diletakkan pada cawan yang berisi media NA (3 g beef extract, 5 g pepton, 2,5 g glukosa, 15 g agar, dan 1 l aquades), kemudian ditetesi P. fluorescens yang dibiakan pada media limbah organik cair. Pada sisi kertas saring dengan jarak 2,4 cm, diletakkan S. rolfsii yang telah dipotong dengan menggunakan cork borrer. Pengamatan dilakukan dengan mengukur persentase hambatan pada jari-jari miselium
S. rolfsii. Persentase hambatan dapat diukur dengan rumus
(a b) x 100% a
Keterangan: a = jari-jari miselium yang menjauhi agens antagonis b = jari-jari miselium yang mendekati agens antagonis
Keterangan: a = jari-jari miselium yang menjauhi agens antagonis b = jari-jari miselium yang mendekati agens antagonis
Gambar 2. Uji antagonis dengan metode dual culture terhadap cendawan
Analisa Data
Data rata-rata jumlah populasi bakteri P. fluorescens dan rata-rata persentase hambatan P. fluorescens terhadap S. rolfsii yang dibiakkan pada media limbah organik cair diolah dengan menggunakan program Microsoft Exel 2003.
Agens antagonis
Patogen
HASIL DAN PEMBAHASAN
Pengaruh Lama dan Temperatur Penyimpanan Terhadap Daya Tahan P. fluorescens
Populasi P. fluorescens pada penyimpanan suhu ruang berbeda-beda pada berbagai macam limbah organik cair (Gambar 3).
Gambar 3 Rata-rata populasi P. fluorescens pada media air kelapa (AK), limbah tahu (TH), tetes tebu (TB), dan luria broth (LB) pada beberapa minggu penyimpanan suhu ruang.
Pengaruh lama dan suhu penyimpanan P. fluorescens pada setiap media menunjukkan hasil yang berbeda-beda terhadap kontrol (LB) (Gambar 3). Pada minggu ke-0 sampai dengan minggu ke-5 rata-rata populasi tertinggi yaitu pada media limbah tahu penyimpanan minggu ke-1 dengan 9,11 log cfu/ml, namun pada minggu ke-7 sampai dengan minggu ke-11 media air kelapa menunjukkan rata-rata populasi yang tertinggi yaitu 9,0 log cfu/ml pada minggu ke-7. Secara keseluruhan, P.
fluorescens yang dibiakan pada media LB sebagai kontrol, menunjukkan daya tahan
yang paling tinggi diantara media lainnya. Sedangkan daya tahan yang paling rendah yaitu P. fluorescens yang dibiakkan pada media tetes tebu dengan populasi 7,12 log cfu/ml pada minggu ke-7.
Pada penyimpanan suhu dingin (4 0C) minggu ke-0 sampai dengan minggu ke-3 rata-rata populasi P. fluorescens tertinggi yaitu media limbah tahu dengan
7.00 8.00 9.00 10.00 11.00 12.00 0 1 3 5 7 9 11 lo g cf u/m l
Pengujian minggu
ke-AK TH TB LB
jumlah populasi 9,11 log cfu/ml pada minggu ke-1. Sedangkan pada minggu ke-5 sampai dengan minggu ke-11 media air kelapa menunjukkan rata-rata populasi tertinggi yaitu 10,20 log cfu/ml pada minggu ke-5 (Gambar 4). Pertumbuhan populasi pada media LB sebagai kontrol lebih stabil dibandingkan dengan media alternatif lainnya, karena media ini mengandung banyak nutrisi yang dapat mendukung pertumbuhan P. fluorescens. Pertumbuhan P. fluorescens pada media air kelapa dan limbah tahu terlihat tidak stabil, sedangkan pada media tetes tebu, pertumbuhan P.
fluorescens tetap paling rendah.
Gambar 4 Rata-rata populasi P. fluorescens pada media air kelapa (AK), limbah tahu (TH), tetes tebu (TB), dan luria broth (LB) pada beberapa minggu penyimpanan suhu dingin (4 °C).
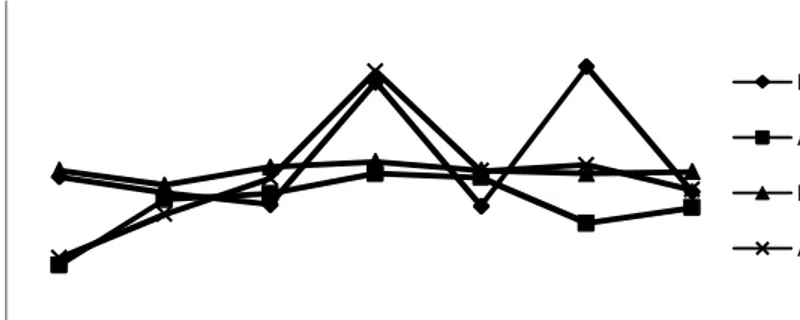
Gambar 5 menunjukkan hasil perbandingan rata-rata populasi P. fluorescens pada media LB dan air kelapa suhu ruang dan suhu 40C. Ketahanan P. fluorescens lebih baik pada suhu 4 0C daripada suhu ruang, baik pada media air kelapa maupun pada LB. Menurut Vigliar et al. (2006) air kelapa mempunyai komposisi nutrisi berupa 95,5% air, 4% karbohidrat, 0,1% lemak, 0,02% kalsium, 0,01% fosfor, 0,5% besi, asam amino, vitamin C, vitamin B kompleks, dan garam-garam mineral. Kandungan nutrisi yang lengkap pada air kelapa menyebabkan jumlah populasi P.
fluorescens cukup stabil selama dalam proses penyimpanan.
7.00 8.00 9.00 10.00 11.00 0 1 3 5 7 9 11 lo g cf u/m l
Pengujian minggu
ke-AK
TH
TB
Gambar 5. Rata-rata populasi P. fluorescens pada media LB yang disimpan pada suhu ruang (LB RT), LB yang disimpan pada suhu dingin (LB 4C), air kelapa yang disimpan pada suhu ruang (AK RT), dan air kelapa yang disimpan pada suhu dingin (AK 4C) pada beberapa minggu.
Gambar 6. Rata-rata populasi P. fluorescens pada media LB yang disimpan pada suhu ruang (LB RT), LB yang disimpan pada suhu dingin (LB 4C), limbah tahu yang disimpan pada suhu ruang (TH RT), dan limbah tahu yang disimpan pada suhu dingin (TH 4C) pada beberapa minggu.
Populasi P. fluorescens pada limbah tahu pada awal penyimpanan sampai dengan minggu ke 7 menunjukkan jumlah yang stabil, namun pada minggu ke-9 jumlah populasi P. fluorescens menurun. Hal ini ditunjukkan dengan jumlah populasi yang lebih rendah daripada minggu sebelumnya (Gambar 6). Pada LB di suhu ruang jumlah populasi P. fluorescens tertinggi yaitu pada minggu ke-9 dengan jumlah
7.00 8.00 9.00 10.00 11.00 0 1 3 5 7 9 11 lo g cf u/m l
Pengujian minggu
ke-LB RT AK RT LB 4C AK 4C 7.00 8.00 9.00 10.00 11.00 0 1 3 5 7 9 11 lo g cf u/m l
Pengujian minggu
ke-LB RT
TH RT
LB 4C
populasi 10,26 log cfu/ml dan yang terendah yaitu pada minggu ke-7 dengan jumlah populasi 8,67 log cfu/ml. Namun pada suhu dingin daya tahan P. fluorescens lebih stabil dengan jumlah populasi tertinggi 9,18 log cfu/ml pada minggu ke-5 dan yang terendah 8,91 log cfu/ml pada minggu ke-1.
Hariyadi et al. (2002) mengemukakan bahwa limbah cair tahu mengandung kadar air 99,28%, kadar abu 0,06%, total padatan 0,67%, protein 0,17%, lemak 0,09%, karbohidrat 0,35%, dan pH 4,27. Pertumbuhan bakteri dipengaruhi oleh berbagai macam nutrisi seperti nitrogen (N), karbon (C), fosfat (P) dan lainnya (Pelczar dan Chan 1986 dalam Ratdiana 2007). Sumber karbon yang terdapat pada limbah tahu yaitu berupa karbohidrat yang merupakan senyawa kompleks yang tidak dapat langsung digunakan, oleh karena itu pada media limbah tahu ini dilakukan modifikasi dengan penambahan sukrosa sebagai sumber karbon yang dapat langsung digunakan.
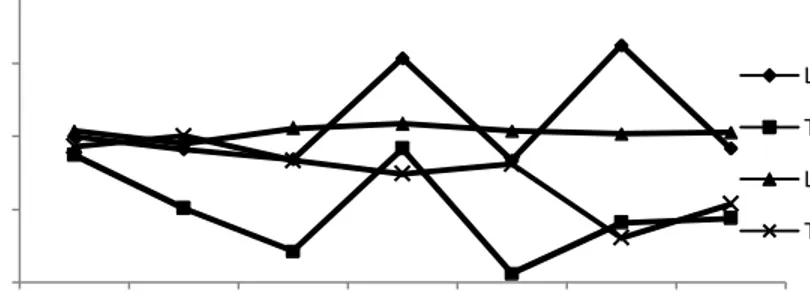
Gambar 7. Rata-rata populasi P. fluorescens pada media LB yang disimpan pada suhu ruang (LB RT), LB yang disimpan pada suhu dingin (LB 4C), tetes tebu yang disimpan pada suhu ruang (TB RT), dan tetes tebu yang disimpan pada suhu dingin (TB 4C) pada beberapa minggu.
Pada Gambar 7 terlihat bahwa populasi P. fluorescens pada tetes tebu penyimpanan suhu ruang menurun pada minggu pertama, namun pada minggu ke-5 populasi terlihat tinggi dan kembali menurun pada minggu ke-7. Sedangkan pada penyimpanan suhu dingin populasi P. fluorescens menurun dari minggu pertama hingga populasi terendah yaitu 7,61 log cfu/ml pada minggu ke-9. Berbeda dengan
7.00 8.00 9.00 10.00 11.00 0 1 3 5 7 9 11 lo g cf u/m l
Pengujian minggu
ke-LB RT
TB RT
LB 4C
media tetes tebu, pada media LB jumlah populasi P. fluorescens lebih tinggi dan cenderung stabil, baik pada suhu ruang maupun pada suhu dingin.
Menurut Syukur (2006), komposisi nutrisi yang terkandung dalam tetes tebu meliputi 58 % karbohidrat, 20 % air, 2,5 % protein kasar, 10, 5 % mineral, 0,8 % kalsium, dan 0,1% fosfor. Selain itu tetes tebu juga mengandung tiamin 0,8 (mg/kg), riboflafin 3 (mg/kg), niacin 28 (mg/kg), dan asam panthotenet 35 (mg/kg). Pada media ini tersedia sumber karbon yang cukup banyak, yaitu karbohidrat sebesar 58%. Namun senyawa tersebut tidak dapat langsung digunakan sehingga pertumbuhan P.
fluorescens pada media ini tidak maksimal.
Uji Potensi Antagonis P. fluorescens Terhadap S. rolfsii Pada Media Limbah Organik Cair
Kemampuan agen antagonis P. fluorescens yang dibiakan pada media limbah organik cair terhadap S. rolfsii berbeda-beda pada tiap minggunya (Gambar 10 dan 11).
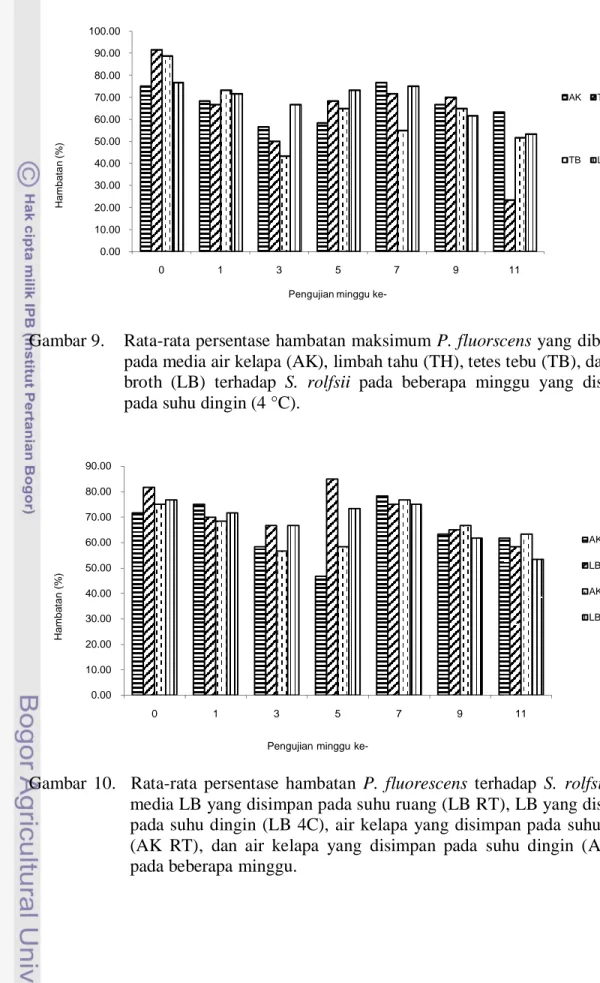
Gambar 8. Rata-rata persentase hambatan maksimum P. fluorscens yang dibiakkan pada media air kelapa (AK), limbah tahu (TH), tetes tebu (TB), dan luria broth (LB) terhadap S. rolfsii pada beberapa minggu yang disimpan pada suhu ruang.
Pada suhu ruang, P. fluorescens yang dibiakan pada air kelapa mampu menekan pertumbuhan S. rolfsii secara maksimum hingga minggu ke-3. Namun, pada
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 0 1 3 5 7 9 11 Hambatan (%)
Pengujian minggu
ke-AK TH
minggu ke-5, kemampuan antagonismenya mulai menurun. Pada minggu ke-11, P.
fluorescens yang dibiakan pada media air kelapa memiliki sifat antagonisme yang
paling tinggi yaitu 61,67 % dibandingkan P. fluorescens yang dibiakan pada media limbah lainnya, yaitu limbah tahu dengan persen hambatan 23,33 % dan tetes tebu dengan persen hambatan 15,28 % (Gambar 8).
Pada suhu dingin, P. fluorescens yang dibiakkan pada media limbah tahu menunjukkan sifat antagonis yang maksimum terhadap S. rofsii di minggu ke-0 dan minggu ke-9. Di minggu ke-7 dan ke-11 P. fluorescens pada air kelapa dapat menghambat pertumbuhan S. rolfsii dengan persentase yang hambatan maksimum. Sedangkan persentase hambatan maksimum P. fluoresecens terhadap S. rolfsii pada media tetes tebu terjadi pada minggu ke-1 yaitu 88,79 %. LB sebagai kontrol memiliki persentase hambatan maksimum pada minggu ke-3 dan ke-5. Pada minggu ke-11 persentase hambatan P. fluorescens pada media limbah tahu dan tetes tebu sangat menurun dibandingkan pada minggu sebelumnya (Gambar 9).
Gambar 8 dan 9 menunjukkan bahwa baik pada suhu ruang maupun suhu dingin, sifat antagonis P. fluorescens terhdap S. rolfsii pada media LB sebagai kontrol bersifat stabil diantara media air kelapa, limbah tahu dan tetes tebu. Namun pada media alternatif, P. fluorescens pada air kelapa yang paling baik sifat
antagonismenya.
Mineral dan karbon merupakan sumber penting yang mempengaruhi produksi antibiotik pada P. fluorescens (Duffy & Défago 1999). Kandungan mineral dan karbon yang tinggi pada air kelapa menyebabkan produksi antibiotik yang dihasilkan
P. fluorescens menjadi tinggi dibandingkan dengan media alternatif lainnya. Selain
itu, faktor yang mempengaruhi produksi antibiotik pada P. fluorescens adalah pertumbuhan populasinya (Nielsen et al. 1998). Jumlah populasi bakteri berbending lurus dengan produksi antibiotik yang dihasilkan.
Gambar 9. Rata-rata persentase hambatan maksimum P. fluorscens yang dibiakkan pada media air kelapa (AK), limbah tahu (TH), tetes tebu (TB), dan luria broth (LB) terhadap S. rolfsii pada beberapa minggu yang disimpan pada suhu dingin (4 °C).
Gambar 10. Rata-rata persentase hambatan P. fluorescens terhadap S. rolfsii pada media LB yang disimpan pada suhu ruang (LB RT), LB yang disimpan pada suhu dingin (LB 4C), air kelapa yang disimpan pada suhu ruang (AK RT), dan air kelapa yang disimpan pada suhu dingin (AK 4C) pada beberapa minggu.
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00 0 1 3 5 7 9 11 Hambata n (%)
Pengujian minggu
ke-AK TH TB LB 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 0 1 3 5 7 9 11 Hamba tan (%)
Pengujian minggu
ke-AK RT LB RT AK 4C LB 4C
Persentase hambatan P. fluorescens yang dibiakkan pada media air kelapa terhadap S. rolfsii terlihat fluktuatif (Gambar 10). Di suhu ruang, persentase hambatan paling rendah terjadi pada minggu ke-5 yaitu 46,67 % dan yang paling tinggi yaitu pada minggu ke-7 sebesar 78,33 %. Sedangkan di suhu dingin persentase hambatan P. fluorescens juga tidak terlalu berbeda dengan persentase hambatan di suhu ruang. Pada media LB, persentase hambatan lebih stabil baik pada suhu ruang maupun pada suhu dingin.
P. fluorescens merupakan salah satu golongan PGPR yang memiliki
mekanisme biokontrol yang melibatkan produksi antibiotik berupa phenazine-1-carboxyclic acid, 2,4-diacetyl phloroglucinol, oomycin, pyoluteorin, pyrrolnitrin, kanosamine, zwittermycin-A, dan pantocin A (Fernando et al. 2005).
Gambar 11. Rata-rata persentase hambatan P. fluorscens terhadap S. rolfsii pada media LB yang disimpan pada suhu ruang (LB RT), LB yang disimpan pada suhu dingin (LB 4C), limbah tahu yang disimpan pada suhu ruang (TH RT), dan limbah tahu yang disimpan pada suhu dingin (TH 4C) pada beberapa minggu.
Pada media limbah tahu, persentase hambatan P. fluorescens terhadap S.
rolfsii terlihat fluktuatif (Gambar 11) baik di suhu ruang maupun di suhu dingin.
Faktor lamanya penyimpanan mempengaruhi kemampuan antagonisme P. fluorescens terhadap S. rolfsii. Hal ini dapat dilihat pada minggu ke-11 persentase
hambatan sangat menurun dibandingkan dari minggu sebelumnya. Hal ini disebabkan 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00 0 1 3 5 7 9 11 Ham batan (% )
Pengujian minggu
ke-TH RT
LB RT TH 4C LB 4C
jumlah populasi P. fluorescens yang dibiakkan pada media limbah tahu di minggu ke-11 juga menurun sehingga produksi antibiotik yang dihasilkan juga akan menurun.
Selain menghasilkan senyawa metabolit sekunder seperti antibiotik, P.
fluorescens juga menghasilkan siderofor yang dapat mengkelat zat besi, sehingga
patogen dalam tanah tidak memperoleh zat besi untuk pertumbuhannya. Zat besi sangat penting sebagai mikronutrisi yang digunakan bakteri untuk melakukan metabolisme (Rachid & Ahmed 2005). Siderofor juga merangsang pertumbuhan pada tanaman, karena sifatnya yang dapat mengkelat zat besi sehingga kebutuhan zat besi terpenuhi untuk pertumbuhannya (Glick et al. 1999)
Gambar 12. Rata-rata persentase hambatan P. fluorescens terhadap S. rolfsii pada media LB yang disimpan pada suhu ruang (LB RT), LB yang disimpan pada suhu dingin (LB 4C), tetes tebu yang disimpan pada suhu ruang (TB RT), dan tetes tebu yang disimpan pada suhu dingin (TB 4C) pada beberapa minggu.
Kemampuan antagonisme P. fluorescens terhadap S. rolfsii pada media tetes tebu di suhu dingin lebih baik daripada di suhu ruang. Pada suhu ruang minggu ke-11 persentase hambatan sangat menurun dibanding minggu sebelumnya. Namun pada suhu dingin persentase hambatan terlihat lebih stabil (Gambar 12).
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00 0 1 3 5 7 9 11 Ham batan (% )
Pengujian minggu
ke-TB RT
LB RT
TB 4C
Perbandingan Kualitas Potensi Antagonis P. fluorescens terhadap S. rolfsii pada Media Limbah Organik Cair
Gambar 13. Uji antagonisme P. fluorescens yang dibiakkan pada berbagai media pada suhu dingin terhadap S. rolfsii setelah 5 hari A. LB minggu ke-7, B. Air kelapa minggu ke-7, C. Limbah tahu minggu ke-7, D. Tetes tebu minggu ke-5.
Pada uji antagonisme yang dilakukan terlihat perbedaan antara miselium yang tumbuh berdekatan dengan agens antagonis dengan miselium yang tidak berdekatan dengan agen antagonis. Pertumbuhan miselium yang berdekatan dengan agen antagonis terlihat lebih tipis dibandingkan dengan miselium yang tidak berdekatan dengan agen antagonis (Gambar 13). Selain itu, pertumbuhan miselium juga terlihat berbeda dari masing-masing media. P. fluorescens yang dibiakkan pada media LB (Gambar 13A) terlihat lebih menekan pertumbuhan S. rolfsii sehingga miselium terlihat lebih tipis daripada pada media lainnya. Hal ini menunjukkan bahwa agen antagonis P. fluorescens menghasilkan antibiotik yang dapat menghambat
pertumbuhan patogen S. rolfsii. Beberapa strain dari P. fluorescens dapat menekan
A B
penyakit pada tanaman serta melindungi benih dan akar dari serangan cendawan tular tanah dan bekteri patogen (Défago & Haas 1990, O Sullivan & O Gara 1992 dalam Corbell & Loper 1995).
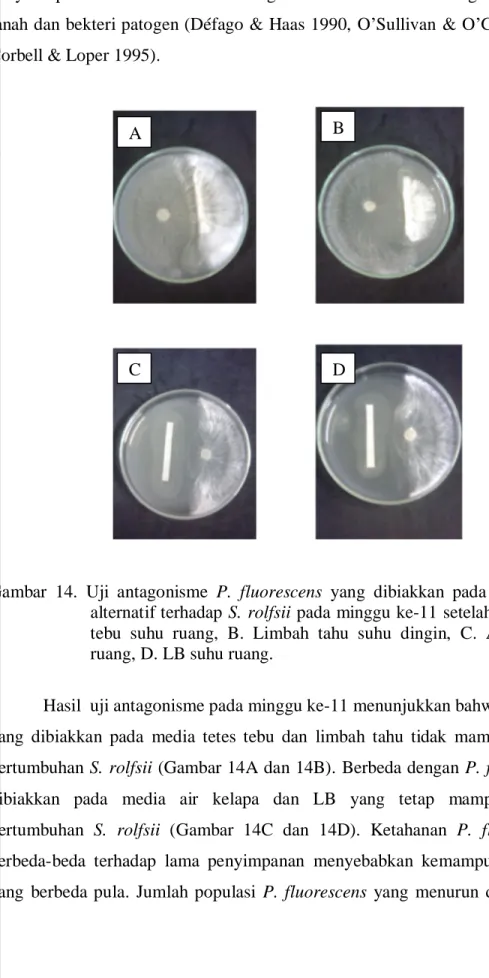
Gambar 14. Uji antagonisme P. fluorescens yang dibiakkan pada berbagai media alternatif terhadap S. rolfsii pada minggu ke-11 setelah 5 hari A. Tetes tebu suhu ruang, B. Limbah tahu suhu dingin, C. Air kelapa suhu ruang, D. LB suhu ruang.
Hasil uji antagonisme pada minggu ke-11 menunjukkan bahwa P. fluorescens yang dibiakkan pada media tetes tebu dan limbah tahu tidak mampu menghambat pertumbuhan S. rolfsii (Gambar 14A dan 14B). Berbeda dengan P. fluorescens yang dibiakkan pada media air kelapa dan LB yang tetap mampu menghambat pertumbuhan S. rolfsii (Gambar 14C dan 14D). Ketahanan P. fluorescens yang berbeda-beda terhadap lama penyimpanan menyebabkan kemampuan antagonisme yang berbeda pula. Jumlah populasi P. fluorescens yang menurun di minggu ke-11
A B
pada media limbah tahu dan tetes tebu mengakibatkan menurunnya kemampuan antagonisme bakteri tersebut terhadap S. rolfsii.
KESIMPULAN DAN SARAN
Kesimpulan
Daya tahan P. fluorescens yang dibiakkan pada berbagai limbah organik cair pada penyimpanan selama sebelas minggu berbeda-beda, baik pada suhu ruang maupun pada suhu dingin. P. fluorescens yang dibiakkan pada media air kelapa memiliki daya tahan yang lebih baik daripada P. fluorescens yang dibiakkan pada media limbah tahu dan tetes tebu. Kepadatan populasi P. fluorescens yang dibiakkan pada penyimpanan suhu dingin (4 °C) lebih stabil dibandingkan pada penyimpanan suhu ruang.
P. fluorescens yang dibiakan pada media limbah organik cair berpotensi
menghambat pertumbuhan S. rolfsii penyebab penyakit busuk batang. Namun,
terdapat perbedaan kualitas potensi antagonis P. fluorescens yang dibiakkan pada media limbah organik cair terhadap S. rolfsii . Potensi antagonisme P. fluorescens yang dibiakkan pada berbagai limbah organik cair terhadap S. rolfsii dipengaruhi oleh lama penyimpanan. P. fluorescens yang dibiakkan pada media air kelapa memiliki potensi antagonisme yang lebih baik daripada P. fluorescens yang dibiakkan pada media limbah tahu dan tetes tebu.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui ketahanan maksimum
P. fluorescens yang dibiakkan pada media limbah organik cair serta keefektifan
antagonisme P. fluorerscens yang dibiakkan pada media air kelapa, limbah tahu dan tetes tebu terhadap S. rolfsii di lapangan.
DAFTAR PUSTAKA
[CAB International] Commonwealth Agricultural Beraux International. 2005. Crop Protection Compendium. Wallingford, UK: CAB International. Disajikan dalam 2 compact disc dengan penuntun didalamnya.
Anas I. 1989. Biologi Tanah dalam Praktek. PAU Biotek. Bogor: Institut Pertanian Bogor. 161 hal.
Anik S. 2001. Uji antagonisme Bacillus sp., Pseudomonas fluorescens B29, dan
Trichoderma harzianum terhadap bakteri Pseudomonas Solanacearum E.F.
Smith pada benih kacang tanah [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Anonim. 1997. Nata Dibuat, Lingkungan Sehat. http://www.indomedia.com/intisari/1997/mei/natasoya.htm [13 Mei 1997]. Ahmadi, Heri. 2007. Skrining, Pembiakan masal, dan induksi sporulasi agens
antagonis penyakit kudis (Streptomyces scabies) pada kentang [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Agrios GN. 2005. Plant Pathology. Ed ke-5. San Diego: Academic Press
Baker KF & Cook RJ. 1974. Biological Control of Plant Pathogens. WH Freeman and Company, San Fransisco.
Corbell N & Loper JE. 1995. Global regulator of secondary metabolite production in
Pseudomonas fluorescens Pf-5. Journal of Bacteriology 177(21):6230-6236
Duffy BK & Défago G. 199. Environmental factor modulating antibiotic and siderophore biosynthesis by Pseudomonas fluorescens biocontrol strain.
Applied and Environmental Microbiology 65(6):2429-2438.
Fernando DWG, Nakkeeran S, & Zhang Y. 2005. Biosynthesis of antibiotics by PGPR and its relation in biocontrol of plant disease. Di dalam: Siddiqui ZA, editor. PGPR: Biocontrol and Biofertilization. Aligarh: Springer. Hlm 67-109. Glick BR, Patten CL, Holguin G, & Penrose DM. 1999. Biochemical and Genetic
Mechanism Used by Plant Growth Promoting Bacteria. London: Imperial
Collage Press.
Hanudin, Sutarya E, Mihardja S, & Sanusie I. 2005. Mikroba Antagonis sebagai Agen Hayati Pengendali Penyakit Tanaman. Cianjur: Balai Penelitian Tanaman Hias.
Hariyadi P, Budijanto S, & Permana AW. 2002. Pemanfaatan limbah cair tahu untuk memproduksi ingredient pangan fungsional [LP]. Bogor: Lembaga Penelitian, Institut Pertanian Bogor.
Hasanuddin. 2003. Peningkatan Peranan Mikroorganisme dalam Sistem Pengendalian Tumbuhan Secara Terpadu. USU digital library 1. http//library.usu.ac.id/download/fp/fp-hasanuddin.pdf [22 Nov 2006].
Nakkeeran S, Fernando WGD, & Siddiqui ZA. 2005. Plant promoting rhizobacteria formulations and its scope in commercialization for the management of pests and disease. Di dalam: Siddiqui ZA, editor. PGPR: Biocontrol and
Biofertilization. Aligarh: Springer. Hlm 257-296.
Nielsen MN, Sørensen J, & Pedersen JC. 1998. Secondary metabolite- and endochitinase- dependent antagonism toward plant-pathogenic microfungi of Pseudomonas fluorescens isolates from sugar beet rhizosfer. Applied and
Environmental Microbiology 65(10):3563-3569.
Okereke VC & Wokocha RC. 2007. In vitro growth of four isolates Sclerotium
rolfsii Sacc in the humid tropics. African Journal of Biotechnologi 6
(16):1879-1881.
Purwanto S. 2001. Pengamatan Penyakit Layu Bakteri pada Tomat (Lycopersicon
esculentum Mill.) di Greenhouse dan Pengujian Agens Antagonis [Skripsi].
Bogor: Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Rachid D & Ahmed B. 2005. Effect of iron and growth inhibitors on siderophores production by Pseudomonas fluorescens. African Journal of Biotechnology 4(7):697-702.
Ratdiana. 2007. Kajian pemanfatan air kelapa dan limbah cair peternakan sebagai media alternatif perbanyakan Pseudomonas fluorescens serta uji potensi antagonismenya terhadap Ralstonia solanacearum [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Semangun H. 2004. Penyakit-penyakit Tanaman Pangan di Indonesia. Ed ke-3. Yogyakarta:Gadjah Mada University Press.
Siddiqui ZA. 2005. PGPR: Prospective biocontrol agents of plant pathogens. Di dalam: Siddiqui ZA, editor. PGPR: Biocontrol and Biofertilization. Aligarh: Springer. Hlm 111-142.
Suharno. 2001. Pengujian keefektifan Pseudomonas fluorescens B29 dan Bacillus sp. dalam menekan penyakit hawar daun bakteri pada padi varietas IR-64 [Tesis]. Bogor: Institut Pertanian Bogor.
Supriadi. 2006. Analisis Resiko Agens Hayati untuk Pengendalian Patogen pada Tanaman. Jurnal Litbang Pertanian 25(3).
Syukur DA. 2006. Integrasi Usaha Peternakan Sapi pada Perkebunan Tebu. Disnakkeswan Provinsi Lampung. http://www.disnakkeswan-lampung.go.id/index.php?option=com_content&task=blogcategory&id=41&It emid=107 [24 Juli 2006]
Sari, Winda Wulan. 2007. Pengunaan guano kelelawar pemakan serangga untuk mengendalikan penyakit bercak coklat (Alternaria solani) pada tanaman tomat [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Vigliar R, Sdepanian VL, & Neto UF. 2006. Boichemical profile of coconut water from coconut palms planted in an inland region. Journal de Pediatria 82(4): 308-312.