RENCANA PELAKSANAAN PEMBELAJARAN (Sesuai Standar Proses Permendiknas No. 69/2013)
Mata Pelajaran : Kimia
Kelas/Semester : XI/Satu
Peminatan : M-IPA
Alokasi Waktu : 1 x 30 menit
Tanggal : 8 Agustus 2014
I. Kompetensi Inti
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya. KI 2 : Mengembangkan perilaku (jujur, disiplin, tanggungjawab, peduli,
santun, ramah lingkungan, gotong royong, kerjasama, cinta damai, responsif dan pro-aktif) dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan bangsa dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI 3 : Memahami dan menerapkan pengetahuan faktual, konseptual, prosedural dalam ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
KI 4 : Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan.
II. Kompetensi Dasar
3.4 Membedakan reaksi eksoterm dan reaksi endoterm berdasarkan hasil percobaan dan diagram tingkat energi.
III. Indikator
1. Menuliskan perbedaan reaksi eksoterm dan reaksi endoterm dari kegiatan praktikum
IV. Tujuan
Setelah pembelajaran siswa diharapkan mampu:
1. Membedakan reaksi yang melepaskan kalor (eksoterm) dan reaksi yang menerima kalor (endoterm) dari kegiatan praktikum
V. Materi Ajar
Termokimia (Energi dan Entalpi)
Sistem dan Lingkungan
Entalpi dan Perubahan Entalpi
Reaksi Eksoterm dan Reaksi Endoterm
VI. Metode Pembelajaran
1. Strategi : Pembelajaran Aktif
2. Model : Project Based Learning
3. Pendekatan : Scientific
4. Metode : Diskusi kelompok
VII. Media Pembelajaran Media : Papan tulis
LKS
VIII. Sumber Belajar
Sudarmo, Unggul. 2014. Kimia untuk SMA/MA Kelas XI. Jakarta:
Erlangga.
IX. Langkah-Langkah Pembelajaran
Tahapan Kegiatan Waktu
Kegiatan Awal 1. Guru mengucapkan salam kepada siswa. 2. Guru mengajak berdoa dan memeriksa
kahadiran siswa, kebersihan kelas dan kerapihan siswa.
2 menit
a. Apersepsi Guru menguji persiapan siswa di awal pertemuan dengan bertanya mengenai Hukum Kekekalan Energi
c. Motivasi Guru memberikan pertanyaan kepada siswa: Mengapa kita ikut merasa panas jika berada di depan tungku api? mendiskusikan hasil pengamatannya
bersama anggota kelompoknya. Siswa saling bertukar pikiran dalam kelompok untuk menemukan perbedaan reaksi eksoterm dan reaksi endoterm jika dikaitkan dengan perpindahan energinya antara sistem dan lingkungan serta diagram energinya.
Siswa mempresentasikan hasil diskusinya. Kelompok lain boleh menanggapi.
Kegiatan Akhir 1. Guru menyimpulkan pembelajaran mengenai materi yang dipelajari hari ini. 2. Guru memberikan soal untuk menguji
pemahaman siswa akan materi hari ini. 3. Menyampaikan rencana pembelajaran
berikutnya sehingga siswa diharapkan mempelajari buku Kimia yang ada dan mempersiapkan diri untuk praktikum di pertemuan selanjutnya.
4. Mengakhiri pembelajaran dengan memberikan salam.
8 menit
X. Penilaian
1. Penilaian kognitif (kelompok)
2. Penilaian Keterampilan Berdiskusi Kelompok 3. Pengamatan Sikap Peserta Didik
Inderalaya, ... Agustus 2014
Mengetahui,
Kepala Sekolah Guru Kimia
(_______________) (_______________)
A. Aspek Kognitif
Jawablah dengan singkat dan jelas!
1. Apa pengertian sistem dan lingkungan?
Jawaban:... ... ... ...
2. Apa yang dimaksud dengan perubahan entalpi?
Jawaban:... ... ... ...
3. Apa perbedaan reaksi eksoterm dan reaksi endoterm!
Jawaban:... ... ... ...
4. Berdasarkan harga perubahan entalpi, reaksi manakah dibawah ini yang merupakan reaksi endoterm dan eksoterm?
HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq) ∆H = -56
N2O(g) → 2NO2(g) ∆H = +58
Jawaban:... ... ... ...
No Soal Skor (1-5)
1 2 3 4 Total
Nilai=Total20 x100=…
B. Aspek psikomotor
No Aspek yang dinilai Skor
1 Mengocok tabung reaksi
2 Menggunakan thermometer
3 Mengidentifikasi terjadinya reaksi kimia
1= Kurang baik 2= Baik
3= Sangat baik
C. Aspek afektif
No Aspek yang dinilai Skor
1 2 3
2 Bertanggung jawab
3 Siswa berpendapat
5 Bekerjasama
1= Kurang baik 2= Baik
3= Sangat baik
LEMBAR KERJA SISWA (LKS) KIMIA
Kelas :
Reaksi Eksoterm dan Reaksi Endoterm Tujuan
Membedakan reaksi eksoterm dan reaksi endoterm
Alat dan Bahan a) Alat
- Tabung reaksi
- Thermometer
- Spatula
- Rak tabung reaksi
b) Bahan
- Larutan HCl 1 M
- Aquades
- Padatan NaOH
- Padatan Urea
- Padatan CaCO3
Prosedur
1. Isilah tabung reaksi A dengan 5 mL aquades, ukurlah suhunya (sebagai T0). Kemudian tambahkan satu spatula padatan NaOH kemudian
dikocok. Setelah larut ukur kembali suhunya (sebagai T1), catat perubahan
suhunya sebagai data pengamatan.
2. Isilah tabung reaksi B dengan 5 mL aquades, ukurlah suhunya (sebagai T0). Kemudian tambahkan satu spatula padatan Urea kemudian dikocok.
Setelah larut ukur kembali suhunya (sebagai T1), catat perubahan suhunya
3. Masukkan 5 mL larutan HCL 1M ke dalam tabung reaksi C, ukurlah suhunya(sebagai T0). Tambahkan satu spatula CaCO3, ukurlah suhunya
(sebagai T1).Catat perubahan suhunya sebagai data pengamatan.
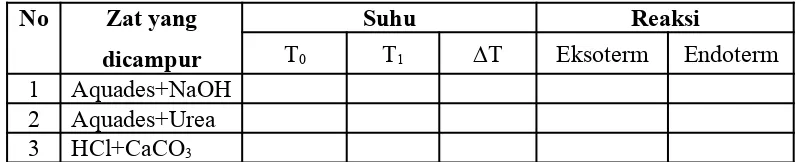
Tabel Pengamatan
No Zat yang
dicampur
Suhu Reaksi
T0 T1 ∆T Eksoterm Endoterm
1 Aquades+NaOH
2 Aquades+Urea
3 HCl+CaCO3
Pertanyaan
1. Berdasarkan hasil pengamatan, kelompokkan mana saja yang mengalami reaksi
eksoterm dan yang mengalami reaksi endoterm, berikan alasannya!
... ... ...
2. Apa kesimpulan dari hasil pengamatan tersebut serta gambarkan diagram
perubahan energinya?
……... ... ...
BAHAN AJAR
Hukum Termodinamika 1 menyatakan bahwa “Energi tidak dapat diciptakan maupun dimusnakan tetapi dapat diubah dari suatu bentuk ke bentuk lain”
B. Sistem dan Lingkungan
Dalam termokimia ada dua hal yang perlu diperhatikan yang menyangkut perpindahan energi, yaitu Sistem dan Lingkungan.
Sistem merupakan Pusat fokus perhatian yang diamati dalam suatu percobaan.
Lingkungan merupakan hal-hal diluar sistem yang membatasi sistem dan dapat mempengaruhi sistem.
Berdasarkan interaksinya dengan lingkungan, Sistem dibedakan menjadi 3 macam:
1. Sistem Terbuka
Memungkinkan terjadinya perpindahan energi dan Zat antara sistem dengan lingkungan.
2. Sistem Tertutup
Memungkinkan terjadinya perpindahan energi tetapi, tidak dapat terjadi pertukaran materi antara sistem dan lingkungan
3. Sistem terisolasi
Tidak memungkinkan terjadinya perpindahan energi dan Zat antara sistem dengan lingkungan.
C. Entalpi dan Perubahan Entalpi
Dilambangkan dengan “H” (berasal dari kata Heat yang berarti Panas).
Entalpi suatu zat tidak bisa diukur besarannya, tetapi perubahan entalpinya (δh) dapat diukur.
Perubahan Entalpi diperoleh dari Selieih entalpi produk dengan entalpi reaktan.
ΔH = Hp – Hr
Perubahan entalpi zat sama dengan harga kalor reaksinya
ΔH = q
Dalam hal tanda positif atau negatif harus diperhatikan. Jika Jika sistem melepaskan kalor, dapat dituliskan ΔH = -q. Sebaliknya, jika sistem menyerap kalor, dapat dituliskan ΔH = q.
C. Reaksi Eksoterm dan Reaksi Endoterm
Reaksi eksoterm adalah reaksi yang menghasilkan kalor sedangkan reaksi endoterm adalah reaksi yang menyerap atau menerima kalor. Adapun contoh reaksi eksoterm :
1. Reaksi – reaksi pembakaran, seperti pembakaran kayu, pembakaran metana, dan pembakaran propana.
2. Reaksi antara karbit dan air untuk proses las.
3. Reaksi antara kapur (CaO) dan air untuk melapisi tembok. Reaksi ini menghasilkan Ca(OH)2 melalui persamaan reaksi berikut:
CaO(S) + H2O(l) Ca(OH)2(aq) + panas
Sedangkan contoh reaksi endoterm antara lain:
1. Reaksi antara barium hidroksida (Ba(OH)2) dan kristal amonium klorida
(NH4Cl) dengan penambahan beberapa tetes air. Reaksi yang berlangsung
sistem
sistem
Ba(OH)2(aq) + 2NH4Cl(s) + H2O(l) BaCl2(aq) + 2NH4OH(aq) + H2O(l)
2. Peristiwa pembekuan es.
3. Reaksi antara amonium tiosianat (NH4SCN) dan barium hidroksida
dekahidrat (Ba(OH)2.10H2O).
Pada reaksi endoterm, terjadi perpindahan kalor dari lingkungan ke sistem sehingga suhu lingkungan turun dan menjadi lebih dingin. Reaksi endoterm menyerap sejumlah energi sehingga energi sistem bertambah, artinya entalpi produk (HP) lebih besar daripada entalpi pereaksi (HR). Akibatnya perubahan
entalpi (∆H), yaitu selisih antara entalpi produk dengan entalpi pereaksi (HP – HR)
bertanda positif.
(bertanda positif)
Pada reaksi eksoterm, terjadi perpindahan kalor dari sistem ke lingkungan sehingga lingkungan menjadi panas. Reaksi eksoterm akan membebaskan energi sehingga entalpi sistem berkurang, artinya entalpi produk lebih kecil daripada entalpi pereaksi. Oleh karena itu perubahan entalpinya bertanda negatif.
(bertanda negatif)
Interaksi antara sistem dan lingkungan pada reaksi eksoterm dan endoterm ditunjukkan gambar 1 berikut.
kalor kalor kalor kalor
LINGKUNGAN
Reaksi endoterm: ∆H = HP – HR > 0
P
R
R
P
kalor kalor kalor kalor
Gambar 1. Aliran kalor pada reaksi eksoterm dan endoterm
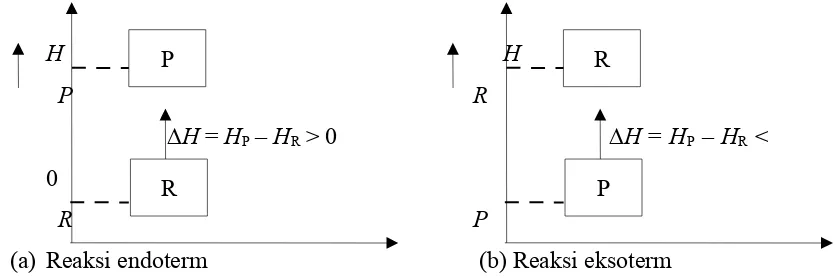
Perubahan entalpi pada reaksi eksoterm dan endoterm dinyatakan dengan diagram tingkat energi. Sebagaimana ditunjukkkan dalam gambar 2 berikut.
H H
P R
∆H = HP – HR > 0 ∆H = HP – HR <
0
R P
(a) Reaksi endoterm (b) Reaksi eksoterm