UJI KUALITATIF KARBOHIDRAT (UJI BARFOED DAN UJI SELLIWANOF)
Asri Oktavianti Rahayu (1305365)1, Siti Karlina (1307576)2 1,2)
Jurusan/Prodi Pendidikan Teknologi Agroindustri, Fakultas Pendidikan Teknologi dan Kejuruan, Universitas Pendidikan Indonesia
ABSTRACK
Carbohydrates are chemical compounds commonly found in foods and the main source of calories. Carbohydrates are classified into several types based on certain aspects. To distinguish the types of carbohydrates can be done with some testing in accordance with the desired classification. In this experience, conducted two tests, Barfoed test for determine the monosaccharide reducing sugars and Selliwanof test for the presence of sugars ketoses on carbohydrates. From the results of tests on several samples that starch and lactose on Barfoed test give the results (-) means it does not contain a reducing sugar and monosaccharide glucose on Selliwanof test give the results (-) means it does not contain sugar ketoses. Keywords: carbohydrates, Barfoed Test, Test Selliwanof.
ABSTRAK
Karbohidrat merupakan kandungan kimia yang umum terdapat pada bahan makanan dan merupakan sumber kalori yang paling utama. Karbohidrat digolongkan ke dalam beberapa jenis berdasarkan aspek-aspek tertentu. Untuk membedakan antara satu jenis karbohidrat dengan karbohidrat yang lainnya dapat dilakukan dengan beberapa pengujian sesuai dengan klasifikasi yang diinginkan. Pada praktikum ini, dilakukan dua pengujian yaitu Uji Barfoed untuk mengetahui adanya gula monosakarida pereduksi dan Uji Selliwanof untuk mengetahui adanya gula ketosa pada karbohidrat. Dari hasil pengujian pada beberapa sampel karbohidrat didapati bahwa Uji Barfoed pada amilum dan laktosa memberikan hasil (-) yang berarti tidak mengandung gula monosakarida pereduksi dan Uji Selliwanof pada glukosa pun memberikan hasil (-) yang berarti tidak mengandung gula ketosa.
Kata kunci: karbohidrat, Uji Barfoed, Uji Selliwanof.
PENDAHULUAN
Karbohidrat merupakan sumber kalori utama bagi hampir seluruh penduduk dunia, khususnya bagi penduduk negara yang sedang berkembang. Walaupun jumlah kalori yang dapat dihasilkan oleh 1
gram karbohidrat hanya 4 kal (kkal) bila di banding protein dan lemak,
Karbohidrat juga mempunyai peranan penting dalam menentukan karakteristik bahan makanan, misalnya rasa, warna, tekstur dan lain-lain. Sedangkan dalam tubuh, karbohidrat berguna untuk mencegah timbulnya ketosis, pemecahan protein tubuh yang berlebihan, kehilangan mineral, dan berguna untuk membantu metabolisme lemak dan protein.
Jenis-jenis Karbohidrat
Secara alami, ada tiga jenis karbohidrat yang terpenting yaitu monosakarida, oligosakarida dan
polisakarida. Polisakarida merupakan kelompok karbohidrat yang paling banyak terdapat di alam. Polisakarida
merupakan senyawa makromolekul yang terbentuk dari banyak sekali satuan (unit) monosakarida. Jumlah polisakarida ini terdapat jauh lebih banyak daripada oligo maupun monoakarida.
Karbohidrat dalam Bahan Makanan
Karbohidrat banyak terdapat pada bahan nabati, baik berupa gula sederhana, heksosa, pentosa, maupun karbohirat dengan berat molekul
yang tinggi seperti pati, pektin, selulosa, dan lignin. Selulosa dan lignin berperan sebagai penyusun dinding sel tanaman. Pada umumnya buah-buahan mengandung monosakarida seperti glikosa dan fruktosa. Disakarida seperti gula tebu (sukrosa atau sakarosa) banyak terkandung dalam batang tebu; di dalam air susu terdapa laktosa atau gula susu. Beberapa oligosakarida seperti dekstrin terdapat dalam sirup pati, banyak terdapat dalam serelia dan umbi-umbian; seluloa dan pektin banyak terdapat dalam buah-buahan. Selama proses pematangan,
kandungan pati dalam buah-buahan beruah menjai gula-gula pereduksi yang akan menimbulkan rasa manis.
Sifat- sifat Karbohidrat
(gliserol) dan polihidroksi lain juga berasa manis. Namun demikian masih banyak senyawa lain yang strukturnya bukan polihidroksi dan tidak mirip struktur gula, juga terasa manis. Sedangkan polisakarida tidak terasa manis karena molekulnya sedemikian besarnya sehingga tidak dapat masuk ke dalam sel-sel kuncup rasa (taste bud) yang terdapat dalam permukaan lidah.
Banyak cara untuk mengetahui adanya karbohidrat dalam suatu bahan antara lain dengan uji kualitatif adan uji kuantitatif. Uji kualitatif karbohirat diantaranya
yaitu: Uji Molisch, Uji Iod, uji Fehling, Uji Seliwanoff, Uji Bial, Uji Antron, Uji pembentukan osazon, uji
pembentukan CO2 karena fermentasi atau uji asam mukat. Pada praktikum kali ini akan dilakukan uji kualitatif dengan menggunakan uji Barfoed dan uji Selliwanof.
Tujuan Umum
1. Mengidentifikasi adanya karbohidrat dalam suatu bahan.
2. Mengetahui beberapa sifat kimia karbohidrat.
Tujuan Khusus Uji Berfoed
Untuk menguji adanya gula
monosakarida pereduksi.
Uji Selliwanof
Untuk menguji adanya gula
ketosa. Manfaat
1. Dapat membedakan jenis-jenis karbohidrat.
2. Menambah pengetahuan mengenai sifat kimia yang berada di dalam karbohidrat.
METODA
Alat dan Bahan
Sampel yang digunakan dalam kegiatan ini terdiri dari Larutan glukosa, fruktosa,amilum, laktosa, sukrosa, dan maltose. Bahan untuk keperluan analisis itu sendiri, terdiri dari larutan Barfoed dan Larutan Selliwanof.
Peralatan yang digunakan dalam kegiatan ini meliputi labu
Skema Kerja Uji Barfoed
Meneteskan 2 ml larutan
karbohidrat di dalam tabung reaksi
Menambahkan 3 ml tetesan larutan barfoed.
Memanaskan tabung dalam
penangas air selama 15 menit.
Mengamati larutan yang menglami pengendapan.
Uji Selliwanof
Meneteskan 2 ml larutan
karbohidrat di dalam tabung reaksi
Menambahkan 2 ml tetesan larutan selliwanof.
Memanaskan tabung dalam
penangas air, hingga larutan berubah menjadi warna merah.
Mengamati larutan yang
mengalami perubahan warna.
HASIL DAN PEMBAHASAN
Uji Barfoed
Uji Barfoed ini dilakukan untuk membedakan sampel yang termasuk jenis karbohidrat
monosakarida dan disakarida. Barfoed merupakan pereaksi yang bersifat asam lemah.
Uji Barfoed memiliki prinsip berupa mekanisme Cu2+ dari pereaksi Barfoed dalam suasana asam akan direduksi lebih cepat oleh gula reduksi monosakarida dari pada disakarida dan menghasilkan Cu2O (kupro oksida) berwarna merah bata. Sampel monosakarida mempunyai waktu yang lebih cepat membentuk warna merah bata pada uji Barfoed (Sumardjo 2006).
Warna Biru Pada Larutan Uji Barfoed
Berdasarkan hail
pengamatan, jika dalam segi warna
larutan yang dihasilkan, untuk glukosa dan fruktosa membentuk warna biru yang lebih pekat dari pada larutan amilum, sukrosa, maltosa dan laktosa.
polisakarida dan monosakarida. Monomer gula dalam hal ini bereaksi dengan asam asetat glacial dan Cu-asetat membentuk senyawa berwarna biru. Dibanding dengan monosakarida, disakarida dan polisakarida yang terhidrolisis oleh asam mempunyai kadar yang lebih kecil, sehingga intensitas warna biru yang dihasilkan lebih kecil dibandingkan dengan larutan monosakarida. Tetapi perbedaan warna yang dihailkan antara kerbohdrat jenis monosakarida, disakarida dan polisakarida, tidak memeberikan perbedaan warna yang
terlalu signifikan.
Karbohidrat yang termasuk monosakarida adalah glukosa dan
fruktosa, sedangkan maltosa, laktosa, dan sukrosa termasuk disakarida, kemudian amilum adalah jenis polisakarida (Barus Pina 2005). Jika berkaitan warna yang dihasilkan data dari percobaan bahwa semua reaksi positif berwarna biru gelap, kecuali amilum yang berwarna biru terang. Hasil negatif menunjukkan bahwa sampel yang diuji merupakan bagian dari polisakarida. Amilum setelah hidrolisis Pada uji barfoed pada amilum sebelum hidrolisis secara
teori, pada amilum sekalipun terdapat glukosa rantai terbuka pada ujung rantai polimer, namun konsentrasinya sangatlah kecil, sehingga warna hasil uji barfoed tidak tampak terlalu pekat oleh penglihatan. Sebenarnya untuk larutan maltosa, laktosa, dan sukrosa harusnya bereaksi negatif terkait dengan hal warna, karena larutan tersebut termasuk disakarida yang tidak akan bereaksi dengan pereaksi Barfoed. Pemanasan yang tidak merata dimungkinkan menjadi penyebab hasil reaksi tidak sesuai dengan literatur yang ada. Selain
pemanasan yang tidak merata, penggunaan waktu pemansan waktu yang trlalu lama, menyebabkan
sehingga dapat dilihat perubahan yang terjadi pada larutan uji tersebut, sehingga tidak membutuhkan waktu pemanasan yang terlalu lama.
Endapan Pada Uji Barfoed
Sesuai dengan yang tertera pada modul praktikum bahwa dikatakan (+) jika dalam larutan tersebut setelah dilakukan pemanasan terjadi endapan, kemudian tanda (-) yang diberikan, jika seandainya dalam larutan tersebut tidak terjadi endapan.
Saat larutan dipanaskan di dalam penangas air, ada perubahan
warna yang terjadi. Urutan warna yang terjadi dimulai dari pembentukan warna, dari biru lalu
menjadi hijau, kemudian berwarna kuning, lalu warna kuning menjadi kemerahan sehingga akhirnya terbentuk endapan merah bata. Sebelum terjadinya endapan, muncul gelembung-gelembung yang kemudian menghasilkan endapan.
Yang termasuk karbohidrat monosakarida, dibagian tepi bawah larutan akan berubah warna menjadi merah bata hal ini diakibatkan karena gugus aldehid ketonnya lebih banyak. Pada sampel yang diujikan,
yaitu amilum, glukosa, sukrosa, fruktosa, maltosa dan laktosa, yang menunjukkan hasil (+) yaitu hanya glukosa, sukrosa, fruktosa, dan maltosa. Hai ini menandakan bahwa keempat sampel tersebut terdapat gula pereduksi, sedangkan pada amilum dan laktosa tidak terdapat gula pereduksi.
Secara teori, sukrosa sebelum terhidrolisis tidak memiliki gula pereduksi. Walupun sukrosa tersusun oleh glukosa dan fruktosa, namun atom karbon anomerik keduanya saling terikat, sehingga pada setiap unit monosakarida tidak lagi terdapat
gugus aldehid atau keton yang dapat berotasi menjadi rantai terbuka. Hal ini menyebabkan sukrosa tidak dapat
menghasilkan endapan yang berwarna merah bata.
Sementara amilum termasuk dalam polisakarida dimana pada amilum tersebut tidak terjadi endapan karena tidak adannya sifat mereduksi pada amilum. Hal ini menyebabkan amilum tak dapat mereduksi ion Cu2+ menjadi Cu2O sangatlah kecil. Setelah dilkukan pemanasan, sesuai dengan teori bahwa amilum memberikan hasil yang negatif, hal ini memberikan tanda bahwa dalam larutan amilum tidak terdapat endapan. Hal ini dikarenakan adanya kemungkinan
pati tidak terhidrolisis sempurna sehingga hidrolisis pati hanya menghasilkan disakarida dan tidak
menjadi monosakarida, sehingga tidak memiliki gugus aldehid dan tidak membentuk endapan Cu2O. Sama halnya dengan amilum, larutan laktosa pun tidak menunjukkan adanya endapan karena gugus aldehid ketonnya lebih sedikit dibanding monosakarida (fruktosa dan glukosa).
Uji Selliwanof
Uji Selliwanof ini dilakukan untuk mengetahui adanya gula ketosa
pada karbohidrat. Jenis karbohidrat yang diujikan sama dengan jenis karbohidrat yang diujikan pada uji barfoed.
Pengujian hampir sama dengan uji barfoed hanya penambahan larutan indikatornya saja yang berbeda. Pada uji selliwanof digunakan larutan selliwanof sebagai larutan indikatornya. Larutan yang telah dicampurkan dipanaskan pada penangas untuk melihat hasil atau perubahan yang terjadi. Setelah 15 menit terdapat perubahan pada sampel yang diujikan.
Dari hasil pengujian yang dilakukan pada semua sampel karbohidrat yang ada, hanya glukosa
yang menunjukkan hasil yang negatif. Berdasarkan teori, glukosa tidak memiliki gugus keton namun glukosa mengandung empat atom karbon osimetrik sehingga glukosa tidak tergolong ke dalam karbohidrat jenis ketosa. Sesuai dengan hasil uji Selliwanof, glukosa tidak mengandung gula ketosa.
diantaranya amilum, sukrosa, frukstosa, maltosa, dan laktosa. Hal tersebut menunjukkan bahwa sampel-sampel tersebut mengandung gugus ketosa. Meskipun pada sukrosa alaminya merupakan disakarida, dengan pemanasan sukrosa akan terurai menjadi glukosa dan fruktosa. Sehingga saat sukrosa terurai menjadi glukosa dan fruktosa, fruktosa akan bereaksi dengan larutan Selliwanof dan akhirnya menunjukkan hasil yang positif dan menghasilkan endapan yang berwarna merah orange.
KESIMPULAN DAN SARAN Kesimpulan
Karbohidrat dapat dibedakan
berdasarkan gugus fungsi yang terdapat pada senyawa karbohidrat itu sendiri. Selain itu karbohidrat pun dapat dibedakan berdasarkan jumlah
sakaridanya. Untuk
mengidentifikasikan jenis karbohidrat, dapat dilakukan beberapa pengujian diantaranya Uji Barfoed dan Uji Selliwanof. Uji Barfoed dilakukan untuk mengetahui adanya monosakarida pereduksi, sedangkan Uji Selliwanof dilakukan untuk mengetahui ada atau tidaknya
gula ketosa pada suatu karbohidrat. Dari pengujian yang dilakukan, dapat diketahui bahwa amilum dan laktosa bertanda (-) pada Uji Barfoed dan glukosa pun bertanda (-) pada Uji Selliwanof. Hal ini menunjukkan bahwa amilum dan laktosa tidak mengandung gula monosakarida pereduksi dan glukosa tidak mengandung gugus fungsi keton/tidak adanya gula ketosa.
Saran
Pengujian harus dilakukan dengan waktu yang tepat. Sedikit saja waktu bergeser maka kemungkinan besar
hasilnya pun akan berbeda. Perlakuan terhadap sampel yang diujikan pun harus sesuai. Ketika
sampel diberi perlakuan yang tidak seharusnya, bisa jadi sampel yang diujikan gagal dan hasilnya pun tidak sesuai.
DAFTAR PUSTAKA
Almatsier, Sunita. (2001). Prinsip Dasar Ilmu Gizi. Jakarta: Gramedia Pustaka Utama. Haryono, Bambang, dkk. (1996).
Analisa Bahan Makanan dan
Maligan, Jaya Mahar. (2014). Analisis Karbohidrat. [online]. Tersedia di: http://maharajay.lecture.ub.ac .id/files/2014/02/Analisis-Karbohidrat.pdf. Diakses pada tanggal 02 Oktober 2014.
Sumardjo, Damin. (2006). Pengantar Kimia: Buku Panduan Kuliah
Mahasiswa Kedokteran
Dan Program Strata 1
Fakultas Bioeksakta. Jakarta: EGC.
LAMPIRAN
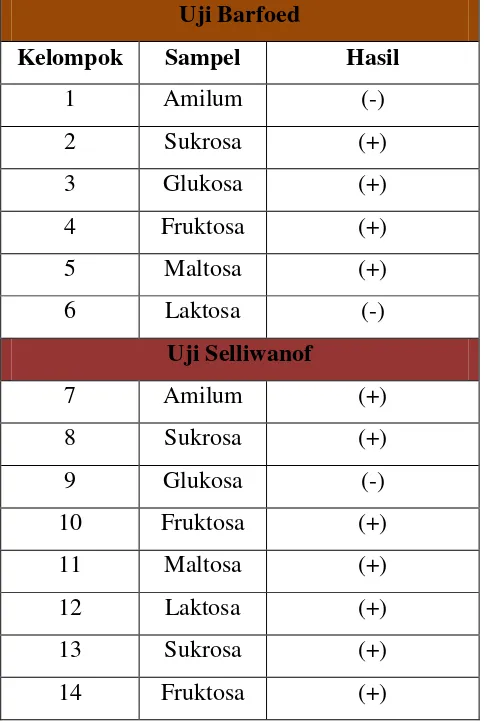
Tabel 1. Data Hasil Uji Barfoed dan Uji Selliwanof Uji Barfoed
Kelompok Sampel Hasil
1 Amilum (-)
2 Sukrosa (+)
3 Glukosa (+)
4 Fruktosa (+)
5 Maltosa (+)
6 Laktosa (-)
Uji Selliwanof
7 Amilum (+)
8 Sukrosa (+)
9 Glukosa (-)
10 Fruktosa (+)
11 Maltosa (+)
12 Laktosa (+)
13 Sukrosa (+)