Teori Tumbukan
Tumbukan yang menghasilkan reaksi hanyalah tumbukan yang efektif. Tumbukan efektif harus memenuhi dua syarat, yaitu posisinya tepat dan energinya cukup. Bagaimanakah posisi tumbukan yang efektif? Dalam wadahnya, molekul-molekul pereaksi selalu bergerak ke segala arah dan sangat mungkin bertumbukan satu sama lain. Baik dengan molekul yang sama maupun dengan molekul berbeda. Tumbukan tersebut dapat memutuskan ikatan dalam molekul pereaksi dan kemudian membentuk ikatan baru yang menghasilkan molekul hasil reaksi.
Contoh tumbukan antarmolekul yang sama terjadi pada pereaksi hidrogen iodida berikut.
HI(g) + HI(g) → H2(g) + I2(g)
Secara umum, dituliskan:
AB + AB → A2 + B2
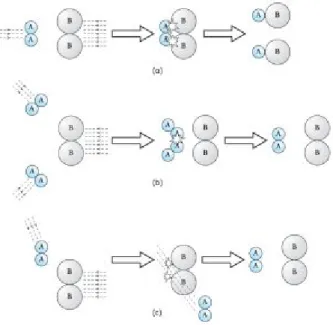
Tumbukan yang efektif terjadi bila keadaan molekul sedemikian rupa sehingga antara A dan B saling bertabrakan (Gambar 1(a)).
Jika yang bertabrakan adalah atom yang sama, yaitu antara A dan A (Gambar 1(b)) atau atom A dan B namun hanya bersenggolan saja (Gambar 1(c)), maka tumbukan tersebut merupakan tumbukan yang tidak efektif.
Gambar 1. (a) tumbukan yang efektif karena posisi tumbukan tepat, (b) tumbukan tidak efektif karena molekul yang bertabrakan sama (c) tumbukan tidak efektif karena posisinya
tidak tepat.
Selanjutnya apa yang dimaksud energi tumbukan harus cukup?
Jika kalian melemparkan batu pada kaca dan kacanya tidak pecah, berarti energi kinetik batu tidak cukup untuk memecahkan kaca. Demikian juga tumbukan antarmolekul pereaksi, meskipun sudah terjadi tumbukan dengan posisi tepat, namun apabila energinya kurang, maka reaksi tidak akan terjadi.
Dalam hal ini diperlukan energi minimum tertentu yang harus dipunyai molekul-molekul pereaksi untuk dapat menghasilkan reaksi. Energi tersebut dinamakan energi aktivasi atau energi pengaktifan (Ea). Perhatikan Gambar 2. tentang tumbukan dengan energi yang cukup dan tidak cukup.
Gambar 2. (a) energi cukup menghasilkan reaksi dan (b) energi tidak cukup tidak menghasilkan reaksi.
Bila gerakan molekul AB dan C lambat, maka tidak akan terjadi ikatan antara B dan C saat bertumbukan. Akibatnya, keduanya terpental tanpa ada perubahan (Gambar 2(a)). Dengan mempercepat gerakan molekul, maka akan membuat tumpang tindih B dan C serta membuat ikatan, dan akhirnya terjadi ikatan kimia (Gambar 2(b)).
Dalam suatu reaksi terdapat tiga keadaan yaitu keadaan awal (pereaksi), keadaan transisi, dan keadaan akhir (hasil reaksi). Keadaan transisi disebut juga komplek teraktivasi.
Pada keadaan ini ikatan baru sudah terbentuk namun ikatan lama belum putus. Keadaan tersebut hanya berlangsung sesaat dan tidak stabil. Keadaan transisi ini selalu mempunyai energi lebih tinggi daripada keadaan awal dan akhir, sedangkan energi keadaan awal dapat lebih tinggi atau lebih rendah daripada energi keadaan akhir.
Bila keadaan awal lebih tinggi energinya, reaksi mcnghasilkan kalor atau dinamakan reaksi eksoterm, dan bila yang terjadi adalah sebaliknya, dinamakan reaksi endoterm. Perhatikan Gambar 3. yang menggambarkan tentang energi aktivasi pada reaksi eksoterm dan reaksi endoterm.
Gambar 3. (a) Diagram potensial reaksi eksoterm dan, (b) Diagram potensial reaksi endoterm.
Dengan mengetahui teori tumbukan ini, kalian akan lebih mudah memahami penjelasan tentang faktor-faktor yang memengaruhi laju reaksi. Percepatan gerakan molekul akan memperbesar kemungkinan tumbukan efektif karena percepatan gerakan memberikan energi lebih besar. Percepatan gerakan molekul berarti percepatan laju reaksi. Dengan dipercepatnya laju
reaksi menggunakan salah satu faktor-faktor berikut, diharapkan energi yang dibutuhkan untuk tumbukan dapat tercukupi sehingga bisa menghasilkan tumbukan yang efektif.
Faktor-faktor yang Mempengaruhi Laju Reaksi
Faktor yang mempengaruhi laju reaksi adalah sebagai berikut.
Konsentrasi 1.
Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel semakin banyak sehingga partikel-partikel tersebut akan tersusun lebih rapat dibandingkan larutan yang konsentrasinya lebih rendah.
Susunan partikel yang lebih rapat memungkinkan terjadinya tumbukan semakin banyak dan kemungkinan terjadi reaksi lebih besar. Makin besar konsentrasi zat, makin cepat laju reaksinya. Perhatikan Gambar 1. tentang pengaruh konsentrasi berikut.
Gambar 1. (a) tumbukan yang terjadi pada konsentrasi kecil, (b) tumbukan yang terjadi pada konsentrasi besar.
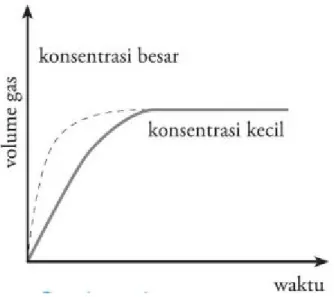
Apabila dibuat sebuah grafik yang menunjukkan hubungan antara konsentrasi dengan laju reaksi, maka dihasilkan grafik seperti pada Gambar 2. Grafik menunjukkan bahwa semakin besar konsentrasi, semakin cepat pula laju
reaksinya.
Gambar 2. Grafik pengaruh konsentrasi terhadap laju reaksi.
Luas Permukaan 1.
Pada saat zat-zat pereaksi bercampur, maka akan terjadi tumbukan antar partikel pereaksi di permukaan zat. Laju reaksi dapat diperbesar dengan memperluas permukaan bidang sentuh zat yang dilakukan dengan cara memperkecil ukuran zat pereaksi. Perhatikan Gambar 3.
Gambar 3. Tumbukan antar partikel pada (a) permukaan kecil dan (b) permukaan besar.
Semakin luas permukaan bidang sentuh zat, semakin besar laju reaksinya, seperti yang ditunjukkan oleh grafik hubungan luas permukaan dengan laju reaksi pada Gambar 4.
Gambar 4. Grafik pengaruh luas permukaan terhadap laju reaksi.
Suhu 1.
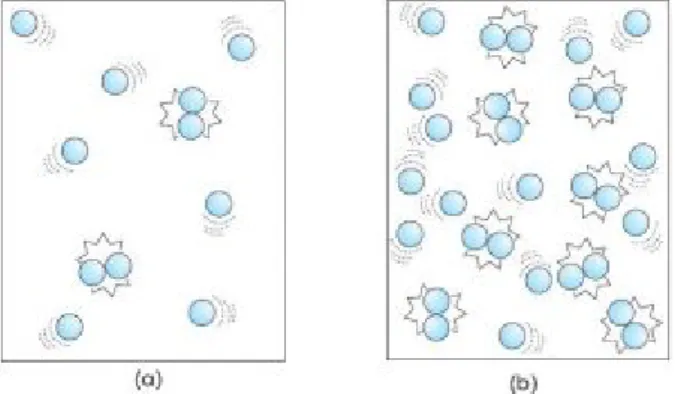
Partikel-partikel dalam zat selalu bergerak. Jika suhu zat dinaikkan, maka energi kinetik partikel-partikel akan bertambah sehingga tumbukan antar partikel akan mempunyai energi yang cukup untuk melampaui energi pengaktifan. Hal ini akan menyebabkan lebih banyak terjadi tumbukan yang efektif dan menghasilkan reaksi (Gambar 5).
Gambar 5. (a) tumbukan antarpartikel pada suhu rendah, (b) tumbukan antarpartikel pada suhu tinggi.
Apabila pengaruh suhu terhadap laju reaksi ini dibuat grafik, akan tampak seperti pada Gambar 6. Dari grafik tersebut dapat disimpulkan bahwa makin tinggi suhu, laju reaksi semakin besar.
Gambar 6. Grafik perubahan suhu terhadap laju reaksi.
Katalis 1.
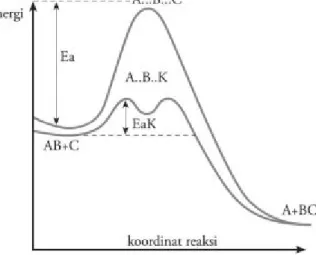
Reaksi yang berlangsung lambat dapat dipercepat dengan memberi zat lain tanpa menambah konsentrasi atau suhu reaksi. Zat tersebut disebut katalis. Katalis dapat mempercepat laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Fungsi katalis dalam reaksi adalah menurunkan energi aktivasi sehingga jumlah molekul yang dapat melampaui energi aktivasi menjadi lebih besar. Gambar 7 menunjukkan peranan katalis dalam menurunkan energi aktivasi.
Gambar 14. Diagram energi potensial reaksi tanpa katalis dan dengan katalis. Energi aktivasi reaksi dengan katalis
(EaK) lebih kecil dari reaksi tanpa katalis.
Katalis memiliki beberapa sifat, di antaranya:
Katalis tidak bereaksi secara permanen.
a.
Jumlah katalis yang diperlukan dalam reaksi sangat b.
sedikit.
Katalis tidak mempengaruhi hasil reaksi.
c.
Katalis tidak memulai suatu reaksi, tetapi hanya d.
mempengaruhi lajunya.
Katalis hanya bekerja efektif pada suhu optimum, artinya e.
di atas atau di bawah suhu tersebut kerja katalis berkurang.
Suatu katalis hanya mempengaruhi laju reaksi secara f.
spesifik, artinya suatu katalis hanya mempengaruhi laju satu jenis reaksi dan tidak dapat untuk reaksi yang lain.
Keaktifan katalis dapat diperbesar oleh zat lain yang g.
disebut promotor.
Hasil suatu reaksi dapat bertindak sebagai katalis, h.
sehingga zat tersebut disebut autokatalis.
Katalis dalam senyawa organik disebut enzim.
i.
Terdapat katalis yang dapat memperlambat suatu reaksi, j.
sehingga katalis itu disebut katalis negatif atau inhibitor.
Kelas XII
Kelas XI
Kelas X
Kelas XII
Kelas X
Avogadro
Avogadro adalah software kimia gratis, open source, tersedia dalam berbagai paltform sistem operasi merupakan editor molekul yang dirancang untuk digunakan secara fleksibel dalam kimia komputasi, pemodelan molekul, bioinformatika, ilmu material, dan bidang terkait lainnya. Avogadro yang tersedia dapat dijalankan pada sistem Windows, Linux, dan Mac OS X.
Kode sumber sumber tersedia di bawah GPL GNU. Aplikasi Avogadro dapat dengan mudah membuat animasi senyawa tertentu seperti yang kita inginkan serta melakukan editing dari senyawa yang telah kita rancang.
Manfaat Avogadro adalah sebagai berikut.
Inovatif “auto-optimation”, alat yang memungkinkan Anda untuk terus membangun dan memodifikasi, selama optimasi mekanika molekular.
Antarmuka untuk banyak paket komputasi umum.
Plugin yang memungkinkan Avogadro untuk diperpanjang dan disesuaikan.
Embedded interpreter Python.
Terjemahan tersedia dalam 19 bahasa lebih, termasuk antar muka juga sudah bisa berbahasa Indonesia, tersisa hanya beberapa bagian saja yang belum dialihbahasakan.
Cross-Platform: Molekul pembangun / editor untuk Windows, Linux, dan Mac OS X.
Intuitif: Dibangun untuk dapat digunakan dengan mudah bagi mahasiswa dan peneliti lebih lanjut.
Cepat: Mendukung multi-threaded rendering dan komputasi.
Extensible: Plugin arsitektur bagi pengembang, termasuk rendering, tool interaktif, perintah, dan skrip Python.
Fleksibel: Fitur OpenBable yang dapat digunakan untuk impor file-file kimia lain, input untuk beberapa paket kimia komputasi, kristalografi, dan biomolekul.
So, Avogadro adalah aplikasi khusus kimia yang memungkinkan kita untuk membuat animasi senyawa kimia. Aplikasi ini sangat bermanfaat bagi pendidik maupun siswa ataupun kalangan umum untuk mempermudah dalam pembelajaran kimia yang dianggap
sangat rumit. Berikut ini adalah langkah-langkah sederhana untuk membuat senyawa menggunakan aplikasi Avogadro.
Buka aplikasi Avogadro. Pastikan aplikasi ini sudah 1.
terinstal di laptop/komputer anda.
Pilih senyawa yang ingin anda buat, misalnya saya ingin 2.
membuat senyawa arginin, caraya klik ikon Build > Insert
> peptide > pilih “Arg” > klik Insert Peptide seperti gambar berikut ini.
Kemudian akan mucul senyawa pada layar yang merupakan 1.
senyawa arginin. Seperti yang terlihat pada gambar berikut.
Untuk membuat gambar berputar dapat dilakukan dengan 1.
mengklik ikon Auto Rotate yang berada pada atas lembar
kerja, seperti pada gambar berikut.
Untuk mengatur cepat lamat perputaran dapat diatur 1.
pada Auto Rotate Setting yang berada pada bagian kiri lembar kerja, seperti pada gambar berikut.
Demikian sedikit ilmu cara menggunakan aplikasi Avogadro. Anda tentu dapat mengembangkan sendiri aplikasi ini untuk media pembelajaran. Semoga bermanfaat.
Untuk lebih jelas tutorialnya, bisa dilihat di video berikut.
https://www.youtube.com/watch?v=bZ0BsZMTGwU
ChemSketch
Chemsketch adalah software yang digunakan untuk menggambarkan dan memodelkan struktur molekul kimia. Software chemsketch dapat menggambarkan struktur kimia dalam bentuk 2D dan 3D.
Software ini sangat mudah digunakan hanya dengan mengklik dan mendrag tool-tool yang tersedia untuk menggambar struktur yang diinginkan. Program ini juga menyediakan struktur asam amino, alkaloid, karbohidrat, asam nukleat, DNA/RNA, peralatan laboratorium yang berupa gelas, orbital, steroid, terpen dan lain-lain yang tersimpan dalam menu templates. Software ini juga menyediakan penggambaran kurva dan grafik. Chemsketch dikeluarkan oleh ACD/Labs.com yang dapat diunduh secara gratis (Anonim, 2008).
Salah satu kentungan menggunakan aplikasi Chemsketch yaitu memudahkan kita dalam menggambarkan stuktur Lewis. Struktur Lewis memang mudah jika digambarkan secra manual, namun akan sangat menyulitkan jika harus dibuat menggunakan program olah kata melalui PC. Berikt ini langkah sederhana untuk menggambarkan struktur Lewis, saya ambil contoh CH4+. Pertama, buka aplikasi Chemsketch. Pastikan aplikasi ini telah terinstal di PC Anda. Tampilan default awal akan seperti ini.
Kemudian klik menu Template > Template Windows, dan akan muncul berbagai macam penggambaran senyawa kimia. Klik pada bagian Struktur Lewis dan pilih struktur CH4+.
Kemudian klik pada area kerja seperti ini.
Untuk mengkopi struktur yang telah dibuat ke Microsoft Word, klik ikon Select/Move pada bagian toolbar kiri atas > blok struktur lewis > Ctrl+C > buka Microsoft Word > Ctrl+V.
Untuk tutorial chemsketch yang lan bisa dilihat pada video berikut ini.
https://www.youtube.com/watch?v=lpLLkK-L18o
ChemDraw
ChemDraw merupakan salah satu program aplikasi dari Chem Office, untuk menggambar struktur 2D dalam bidang ilmu kimia, terutama kimia organik, biokimia, dan polimer. Software ini dapat membantu kita dalam menggambar struktur kimia dengan berbagai fasilitasnya. Sofware ini banyak memilki kelebihan untuk mempermudah kita menggambar rumus kimia. Untuk menggambar rumus molekul kimia Chem Office menyertakan Chem Draw dan Chem 3D.
C h e m d r a w m e r u p a k a n s o f t w a r e k i m i a d a r i produk CambridgeSoft.com. ChemDraw memiliki banyak fungsi, diantaranya membuat nama dan struktur senyawa, membuat struktur streokimia dengan benar dari nama kimia, menghitung rumus molekul dan berat molekul, dan mendapatkan nama IUPAC dengan akurat dari struktur. Perkiraan spektra NMR dari struktur suatu senyawa dengan atom langsung dengan korelasi spektral. Selain itu, ChemDraw dilengkapi dengan peringatan jika terjadi kesalahan dalam pembuatan struktur kimia.
Peringatan tersebut biasanya berwarna merah dan mengelilingi bagian struktur yang salah.
Berikut ini saya akan menjelaskan bagaimana untuk membuat reaksi kimia menggunakan ChemDraw. Kali ini saya akan membuat sebuah reaksi antara benzena dan HBr, dengan langkah-langkah sebagai berikut:
Buka aplikasi ChemDraw. Sebelumnya pastikan aplikasi ini 1.
sudah terinstal di PC anda. Kemudian akan muncul tampilan default seperti ini.
Pilih struktur benzena pada bagian toolbar dengan cara 1.
megkliknya. Maka tampilannya akan seperti ini.
Kemudian untuk menambahkan symbol “+” klik ikon Chemycal 1.
Symbol.
Kemudian tuliskan senyawa “HBr” ,yaitu dengan mengunakan 1.
toolbar seperti pada gambar berikut.
Selanjutnya beri tanda panah yang tersedia pada bagian 1.
toolbar.
Kemudian gambarkan kembali struktur benzena dengan cara 2.
yang sama, namun dengan menghapus salah satu ikatan menjadi tunggal.
Selanjutnya sesuaikan reaksi yang terjadi seperti gambar 3.
berikut.
Tutorial lainnya dapat dilihat di video berikut ini.
https://youtu.be/6ZGxfDTkH00