Bab 4 Hukum Dasar Kimia
Teks penuh
Gambar
Garis besar
Dokumen terkait
dalam senyawa Rumus Empiris dan Rumus Molekul Rumus Empiris dan Rumus Molekul Stoikiometri Reaksi Stoikiometri Reaksi Koefisien sebagai Dasar Reaksi Koefisien sebagai Dasar
Perhitungan Kimia Perhitungan Massa Massa Molar Massa Atom Relatif Massa Molekul Relatif Massa Rumus Relatif Mol Persamaan Reaksi Pereaksi Pembatas Kondisi Gas Keadaan Standar
- Semakin besar massa molekul relatif alkana (makin panjang rantai karbon), semakin tinggi titik leleh, titik didih dan massa jenisnya. - Antara alkana dengan isomernya,
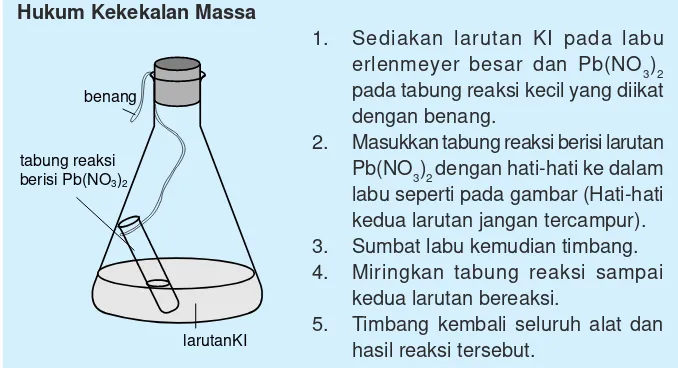
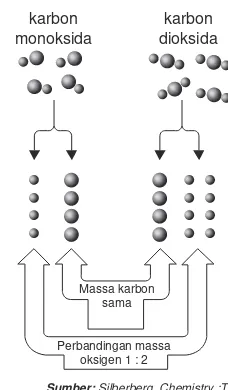
Hukum kekekalan massa atau dikenal juga sebagai hukum Lomonosov-Lavoisier juga sebagai hukum Lomonosov-Lavoisier adalah suatu hukum yang menyatakan massa dari suatu sistem
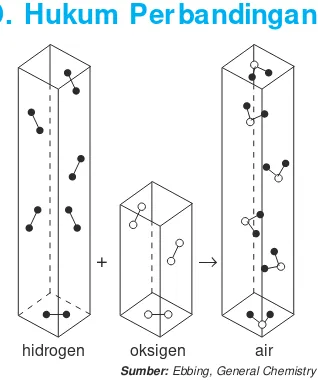
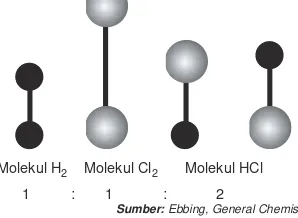
Koefisien reaksi dalam suatu persamaan reaksi kimia, selain menunjukkan perbandingan volume dan jumlah partikel yang bereaksi juga menyatakan perbandingan mol zat-zat yang
perubahan kalor yang menyertai reaksi kimia... Sistem adalah bagian tertentu dr alam yg menjadi perhatian kita. terbuka massa ) energi Perpindahan: tertutup energi terisolasi
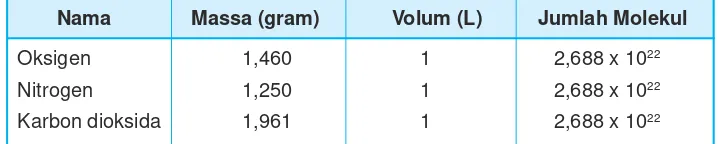
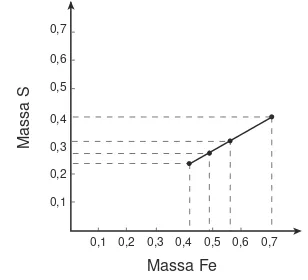
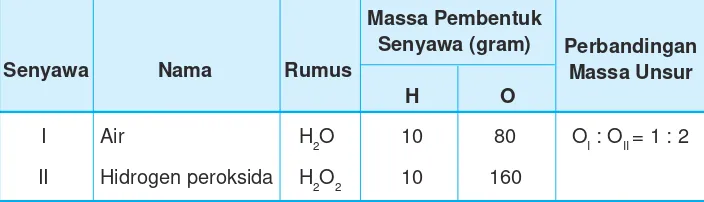
Indikator pencapaian kompetensi dasar pertama yang harus dicapai oleh siswa adalah mengidentifikasi konsep hukum kekekalan massa pada reaksi kimia.. Tabel 2 menunjukkan
Tabung reaksi Sebagai tempat untuk mereaksikan bahan kimia, dalam skala kecil dan dapat digunakan sebagai wadah untuk perkembangbiakkan mikroba.. Rak tabung reaksi Tempat meletakkan