SKRIPSI
EFEK PERENDAMAN EKSTRAK Spirulina platensis SEBAGAI IMUNOSTIMULAN TERHADAP JUMLAH LEUKOSIT DAN HITUNG JENIS LEUKOSIT
IKAN GURAME (Osphronemus goramy) YANG DIINFEKSI BAKTERI Aeromonas hydrophila
Oleh :
LITTA LASYA EMANINTA SITEPU NIM 061211133106
FAKULTAS KEDOKTERAN HEWAN UNIVERSITAS AIRLANGGA
HALAMAN PENGESAHAN .
EFEK PERENDAMAN EKSTRAK Spirulina platensis SEBAGAI IMUNOSTIMULAN TERHADAP JUMLAH LEUKOSIT DAN HITUNG JENIS
LEUKOSIT IKAN GURAME (Osphronemus goramy) YANG DIINFEKSI BAKTERI Aeromonas hydrophila
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan Universitas Airlangga
Oleh
LITTA LASYA EMANINTA SITEPU NIM 061211133106
Menyetujui Komisi Pembimbing,
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
EFEK PERENDAMAN EKSTRAK Spirulina platensis SEBAGAI IMUNOSTIMULAN TERHADAP JUMLAH LEUKOSIT DAN HITUNG
JENIS LEUKOSIT IKAN GURAME (Osphronemus goramy) YANG DIINFEKSI BAKTERI Aeromonas hydrophila
Tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surabaya, 6 Juni 2016
Telah dinilai pada Seminar Hasil Penelitian Tanggal : 20 Juli 2016
KOMOSI PENILAI SEMINAR HASIL PENELITIAN Ketua : Setya Budhy, drh., M.Si
Sekretaris : Emy Koestanti Sabdoningrum, drh., M.Kes. Anggota : Suryanie Sarudji, drh., M.Kes.
Telah diuji pada
Tanggal : 02 Agustus 2016
KOMISI PENGUJI SKRIPSI
Ketua : Setya Budhy, drh., M.Si
Anggota : Emy Koestanti Sabdoningrum, drh., M.Kes Suryanie Sarudji, drh., M.Kes
Arimbi, drh., M.Kes
Dr. Budi Utomo, drh., M.Si
Surabaya,
Fakultas Kedokteran Hewan Universitas Airlangga
Dekan,
DIPPING EFFECT OF Spirulina platensis EXTRACT AS IMUNOSTIMULANT TO THE AMOUNT OF LEUCOCYTES AND TYPE
COUNT OF LEUCOCYTE GURAME FISH (Osphronemus goramy) INFECTED WITH Aeromonas hydrophila
LITTA LASYA EMANINTA SITEPU ABSTRACT
The Purpose of this research was to find out the potency of the extract of
Spirulina platensis as immunostimulant on the amount of leucocyte and numbered kind of leucocyte of gurame fish that infected by Aeromonas hydrophila bacteria. Twenty gurame fish wis weight of 20 grams and length of 9 – 10 cm randomly divided into 5 groups. P0(-) as negative control was not submerged by the extract of Spirulina platensis and was out infected of Aeromonas hydrophila bacteria. P0(+) as positive control was not submerged in extract of Spirulina platensis but infected by aeromonas hydrophila 106 cell/ml. The first submersion was done on the first day for three hours, and the second submersion was done on 7th day for three hours, and then after 24 hours infected by Aeromonas hydrophila 106cell/ml. The blood of fish were taken on 4th day after infected, to examine the blood using calculation room and blood smear. Data would be analyzed by using analysis of variant (ANOVA). If there were any significant different between the treatment, analysis continued by using computer software SPSS 18 for windows. The result of the research showed that the extract of Spiruliana platensis could increase the amount of leucocyte, neutrophil, and monocyte of gurame fish.
UCAPAN TERIMA KASIH
Puji syukur Kepada Tuhan Yesus Kristus karna Anugrahnya saya dapat melaksanakan penelitian dan menyelesaikan skripsi mengenai EFEK PERENDAMAN EKSTRAK Spirulina platensis SEBAGAI IMUNOSTIMULAN TERHADAP JUMLAH LEUKOSIT DAN GAMBARAN JUMLAH LEUKOSIT PADA IKAN GURAME (Osphronemus gouramy) YANG DIINFEKSI BAKTERI Aeromonas hydrophila.
Penulis juga menyampaikan terima kasih kepada semua pihak yang telah membantu secara langsung maupun tidak langsung dalam penyusunan skripsi ini, antara lain:
Kepada Dekan Fakultas Kedokteran Hewan Universitas Airlangga, Prof. Dr. Pudji Srianto, drh., M.Kes. atas kesempatan mengikuti pendidikan di Fakultas Kedokteran Hewan Universitas Airlangga.
Ibu Arimbi, drh., M.Kes selaku dosen pembimbing utama dan Dr. Budi Utomo, drh., M. Si selaku dosen pembimbing serta atas segala arahan, informasi, bimbingan, dan kesabarannya sampai dengan selesainya penelitian ini.
Setya Budhi, drh., M.Si selaku ketua penilai, Emy Koestanti Sabdoningrum, drh., M.Kes selaku sekretaris penilai dan Suryanie Sarudji, drh., M.Kes selaku anggota penilai atas segala saran dan arahan yang telah diberikan kepada penulis dalam menyelesaikan skripsi ini.
yang bermanfaat bagi penulis selama menempuh S1 di Fakultas Kedokteran Hewan Universitas Airlangga.
Seluruh Bapak Ibu Dosen atau Staf Pengajar yang telah banyak memberi ilmu dan pengalaman selama menempuh kegiatan perkuliahan di Fakultas Kedokteran Hewan Universitas Airlangga.
Seluruh Bapak Ibu Staf Kependidikan, Bagian Kemahasiswaan, Bagian Akademik, Bagian Keuangan, Bagian Tata Usaha, dan Bagian Sistem Informasi yang telah banyak membantu selama penulis menempuh pendidikan di Fakultas Kedokteran Hewan Universitas Airlangga.
Kepada Kedua orangtua: Ita Sry Ulina Kembaren, Alm. Jhonson Sitepu, Nenek Karo Sinuhaji, kedua adik : Jeremy dan Jericho, dan Bg Hiskia atas limpahan doa dan pengorbanan yang tak henti-hentinya, kasih sayang, ketulusan cinta, kepercayaan, semangat serta kebahagiaan selama hidup penulis.
Staf laboratorium Patologi Klinik Bapak Endis dan Mas Rizky serta Ibu Siti dan Bapak Jum dari Laboratorium Patologi Anatomi di Fakultas Kedokteran Hewan Universitas Airlangga dan Bapak Yusuf yang selalu membantu saya dalam pengambilan darah Ikan gurame.
angkatan 2010, 2011, 2013, 2014, dan 2015 yang tidak bisa disebutkan satu persatu yang telah memberikan dukungan dan motivasinya.
Penulis menyadari bahwa masih terdapat kesalahan dan kekurangan pada skripsi ini, untuk itu mohon kritik dan saran yang membangun demi perbaikan di masa mendatang. Semoga skripsi ini dapat bermanfaat bagi penulis khususnya semua pihak yang membutuhkan.
Surabaya, 06 Juni 2016
DAFTAR ISI
UCAPAN TERIMA KASIH ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR... xiii
DAFTAR LAMPIRAN ... xiv
SINGKATAN DAN ARTI LAMBANG... xv
BAB 1 PENDAHULUAN ... 1
2.1.2 Habitat Ikan gurame... 8
2.2 Spirulina platensis ... 8
2.2.1 Klasifikasi ... 8
2.2.2 Kandungan Nutrisi Spirulina platensis ... 9
2.2.3 Sistem Imun Ikan ... 10
2.3 Aeromonas hydrophila ... 11
2.3.1 Karaterisktik Aeromonas hydrophila ... 13
2.3.2 Patogenesis dan Gejala Klinis ... 14
2.4 Komponen Darah Ikan ... 15
2.4.1 Leukosit Ikan ... 15
2.4.1.1 Granulosit... 15
2.4.1.2 Agranulosit... 17
2.4.2 Tinjaun Nilai Normal Gambaran Darah Ikan ... 19
BAB 3 MATERI DAN METODE PENELITIAN ... 20
3.5.1 Penentuan Dosis Spirulina platensis ... 22
3.5.2 Penentuan Jumlah Sampel ... 22
3.5.3 Perlakuan Penelitian ... 22
3.6 Pengambilan Darah untuk Pemeriksaan Jumlah Leukosit dan Hitung Jenis Sel Leukosit ... 23
3.6.1 Punksi Pembuluh Darah Bagian Caudal ... 23
3.6.2 Pemeriksaan Jumlah Leukosit dan Hitung Jenis Sel Leukosit ... 24
3.6.2.1 Pemeriksaan Jumlah Sel Leukosit ... 24
3.6.2.2 Menghitung Jumlah Sel Leukosit ... 24
3.6.2.3 Pemeriksaan Hitung Jenis Sel Leukosit ... 25
3.7 Variabel Penelitian ... 25
3.8 Rancangan Penelitian dan Analisis Data ... 26
3.9 Diagram Alur Penelitian ... 27
BAB 4 HASIL PENELITIAN ... 28
4.1 Pengamatan Gejala Klinis ... 28
4.2 Gambaran Jumlah Leukosit ... 28
4.3 Hitung Jenis Leukosit... 31
BAB 5 PEMBAHASAN ... 33
5.1 Gambaran Pengamatan Gejala Klinis ... 33
DAFTAR TABEL
Tabel Halaman
2.1 Nilai normal gambaran darah ikan air tawar secara umum
4.1 Rata-rata dan Simpangan Baku Jumlah Leukosit ... 28 4.2 Rata-rata dan Simpangan Baku Jenis Leukosit ... 30
DAFTAR GAMBAR
Gambar Halaman
2.1 Ikan Gurame ... 7
2.2 Spirulina platensis ... 9
2.3 Aeromonas hydrophila ... 12
2.4 Ikan Gurame yang terserang bakteri Aeromonas hydrophila ... 14
2.5 Sel Leukosit Silurus glanis L ... 17
3.1 Diagram Alir Penelitian ... 26
4.1 Data gambar Ikan Gurame terserang bakteri Aeromonas hydrophila ... 27
4.2 Hasil Pemeriksaan Jumlah Leukosit Ikan Gurame ... 28
4.3 Pemeriksaan jumlah leukosit ... 29
4.4 Hasil Pemeriksaan Jenis Leukosit Ikan Gurame ... 31
4.5 Pemeriksaan Darah Ikan Gurame... 31
DAFTAR LAMPIRAN
Lampiran Halaman
1. Perhitungan Dosis ekstrak Spirulina platensis ... 48
2. Metode Pengambilan Darah Ikan Gurame ... 49
3. Pemeriksaan Jumlah Sel Leukosit ... 50
4. Pemeriksaan Hitung Jenis Sel Leukosit ... 51
5. Data Jumlah Leukosit Ikan Gurame ... 52
6. Data Jenis Leukosit Ikan Gurame ... 53
7 Data Jenis Leukosit Dalam Bentuk Absolut ... 54
8. Laporan hasil uji bakteri Aeromonas hydrophila ... 55
9. Analisa Statistik Jumlah Leukosit ... 56
10. Analisa Statistik Jenis Leukosit ... 57
11 Gambar Peralatan dan Bahan Penelitian ... 62
SINGKATAN DAN ARTI LAMBANG
LPS : Lipopolisakarida
MAS : Motile Aeromonas Septicemia
BAB 1 PENDAHULUAN
1.1Latar Belakang
Ikan gurame (Osphronemus gouramy L.) merupakan ikan air tawar yang memiliki nilai gizi tinggi dan ekonomi penting serta banyak digemari oleh masyarakat Indonesia. Ikan gurame banyak terdapat di Jawa Barat, Jawa Tengah, Sumatra Barat, dan Sulawesi Utara. Saat ini ikan gurame adalah salah satu dari lima belas jenis komoditas ikan untuk peningkatan produksi dan pendapatan petani. Ikan gurame tidak memerlukan air mengalir sebagai tempat hidupnya (Tarwiyah, 2001). Ikan gurame termasuk dari dua belas jenis komoditas untuk pemenuhan gizi masyarakat (Rukmana, 2005).
Budidaya ikan gurame mudah diusahakan dan hasilnya dapat mencapai 8 ton per hekter (Taufik, 2010). Salah satu kendala yang dihadapi dalam budidaya intensif adalah penyakit dengan menimbulkan kerugian ekonomi bagi para pembudidayaan ikan. Salah satu jenis penyakit yang sering dijumpai pada organisme budidaya adalah penyakit bakterial yang disebabkan oleh bakteri
Aeromonas hydrophila, termasuk bakteri patogen sebagai penyebab penyakit “Motil Aeromonas Septicemia” (MAS), Bakteri Aeromonas hydrophila sebagai penyebab penyakit MAS sangat berpengaruh dalam budidaya ikan air tawar dan sering menimbulkan wabah penyakit dengan tingkat kematian tinggi (80-100%) dan dalam waktu yg relatif singkat, yakni 1 – 2 minggu (Triyaningsih dkk 2014).
kondisi ikan menjadi lemah dalam waktu singkat. Ikan sering muncul ke permukaan, lalu mati. Serangan penyakit ini perlu di waspadai sebab tak jarang menimbulkan kematian masal (Sutanto, 2011).
Gambaran darah adalah salah satu indikator dari adanya infeksi (Nuryati dkk, 2006). Dalam bidang perikanan analisa hematologi bisa diterapkan sebagai
early detection system untuk mencegah terjadinya kematian masal dalam pembudidayaan ikan (Noercholis, 2013). Manfaat permeriksaan darah antara lain untuk membantu mendiagnosis suatu penyakit, mengetahui jalan nya suatu penyakit, menentukan prognosa, mengetahui efek suatu pengobatan, meneliti sistem imun dan untuk mengetahui status kesehatan hewan (Harvey, 2012).
Upaya pencegahan penyakit Aeromonas pada ikan telah dilakukan oleh Ravi et al., (2010) dengan menggunakan Spirulina platensis yang merupakan bahan alami dan aman. Spirulina platensis adalah mikroalga hijau kebiruan, sel berkoloni dan membentuk filamen terpilih yang menyerupai spiral. Alga ini mengandung berbagai zat gizi seperti protein dapat mencapai 72 %, lipid 8%, karbohidrat 16%, vitamin B1, B2, B6, B12, C, niasin, β karotin dan kandungan asam amino yang seimbang. Spirulina platensis juga mengandung lipopolisakarida sebesar 1,5% bobot keringnya, kandungan lipopolisakarida inilah yang menjadikan Spirulina platensis digunakan sebagai immunostimulan yang potensial dalam meningkatkan respon kekebalan tubuh pada ikan. (Pelizer et al., 2002).
3
polisakarida. Lipid A bertanggung jawab terhadap keracunan primer dan bersifat toksik, sedangkan polisakarida O dan inti polisakarida merupakan antigen permukaan yang dapat menginduksi kekebalan spesifik dan non spesifik (Jawetz
et al. 1982).
Dari penelitian yang dilakukan oleh Tayag et al., (2010) diketahui bahwa kandungan senyawa dari ekstrak air panas Spirulina platensis yaitu polisakarida, dimana polisakarida dapat merangsang kekebalan tubuh pada ikan dan udang. Selain itu, ekstrak Spirulina plantensis yang diaplikasikan melalui metode injeksi dan perendaman menunjukkan peningkatan resistensi terhadap bakteri.
Sampai saat ini belum ada informasi tentang pemanfaatan perendaman ekstrak Spirulina platensis terhadap ikan gurame yang diinfeksi bakteri
Aeromonas hydophila. Hal ini mendorong peneliti untuk melakukan penelitian tentang efek perendaman ekstrak spirulina plantensis terhadap jumlah leukosit ikan gurame (Osphronemus goramy Lac.) yang diinfeksi Aeromonas hydrophila
Hasilnya diharapkan dapat memberikan informasi kepada dunia perikanan.
1.2Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas, maka dapat dirumuskan permasalahan yaitu apakah perendaman ekstrak Spirulina platensis
1.3 Landasan Teori
Aeromonas hydrophila menyebabkan penyakit pada ikan yang dikenal sebagai Motile Aeromonas hydrophila (MAS). Kemampuan bakteri menyebar melalui peredaran darah atau septikemia menyebabkan kerusakan di berbagai organ tubuh ikan. Kerusakan tersebut antara lain: ulcer pada organ kulit, kerusakan mata, lesi pada sirip dan insang, pengelupasan sisik dan hemoragik septikemia. Penyakit yang disebabkan oleh bakteri ini terutama mempengaruhi ikan air tawar (Kumar and Ramalu, 2013).
Adanya gangguan kesehatan akibat infeksi ataupun perubahan status fisiologi hewan sering dapat diketahui melalui perubahan yang terjadi pada komponen darahnya (Meyer and Harvey, 1998). Reaksi imunitas ditunjukkan dengan adanya kelainan jumlah leukosit dan dapat diketahui melalui pemeriksaan jumlah total leukosit dan distribusi masing-masing jenis leukosit (differential counting) yang merupakan bagian dari pemeriksaan fisik rutin pada hewan sakit. Melalui kedua pemeriksaan tersebut dapat diperoleh gambaran mengenai kepekaan hewan, pemberian terapi yang tepat dan prognosa dari penyakit (Bijanti dkk, 2010).
Pemeriksaan jumlah leukosit dan jenis leukosit yang terdiri dari neutrofil, eosinofil, basofil, monosit, dan limfosit menjadi parameter yang penting untuk dilakukan karena leukosit berperan penting dalam sistem kekebalan tubuh dan berhubungan dengan proses infeksi bakteri. Pada infeksi bakteri terjadi perubahan yaitu berupa peningkatan jumlah leukosit dalam darah (Chairlan, 2011).
5
terhadap resiko Aeromonas hydrophila (Ragap et al., 2002). Spirulina platensis
adalah mikroalga hijau-biru. Spirulina platensis mengandung beberapa Vitamin, seperti vitamin B, vitamin E, vitamin K, phenolic acids, tocopherols, g-linolenic acid, asam folat; pigmen, seperti b-carotenes, chlorophyll a dan phycocyanin; dan mineral, teruama zat besi. Spirulina mempunyai fungsi sebagai antioksidan, antiviral, imunomodulator, meningkatkan hemoglobin, leukosit dan trombosit serta mampu menstimuasi stem sel di sumsum tulang (Simanjuntak et al., 2004).
Menurut Grzanna et al., (2006) menyatakan bahwa Spirulina platensis
mempunyai efek imunostimulator. Simanjuntak et al., (2004) menunjukkan bahwa pemberian Spirulina platensis dalam pakan ikan dapat meningkatkan jumlah eretrosit, total leukosit, dan kadar hemoglobin ikan nilem.
1.4Tujuan Penelitian
Tujuan penelitian ini untuk mengetahui pengaruh ekstrak Spirulina platensis sebagai imunostimulan terhadap jumlah leukosit dan hitung jenis leukosit ikan gurame yang diinfeksi Aeromonas hydophila.
1.5Manfaat Hasil Penelitian
Hasil penelitian ini diharapkan dapat dikembangkan dan diaplikasikan pada dunia perikanan sebagai alternatif pencegahan maupun pengobatan
1.6Hipotesis
BAB II TINJAUAN PUSTAKA
2.1Ikan Gurame 2.1.1 Klasifikasi
Menurut Ardianto (2012). Ikan gurame dapat diklasifikasikan sebagai berikut :
Kingdom : Animalia Filum : Chordata Subfilum : Vertebrata
Kelas : Pisces
Sub Kelas : Teleostei
Ordo : Perciformes
Sub ordo : Belontiidae Famili : Osphronemidae Genus : Osphronemus
Spesies : Osphronemus gourami
Ikan gurame termasuk golongan ikan Labyrinthici, yaitu ikan yang memiliki alat pernafasan tambahan yaitu berupa selaput tambahan berbentuk tonjolan pada tepi atau lapisan insang pertama yang biasa disebut labyrinth. Gurame mempunyai bentuk badan agak panjang, pipih, dan tertutup sisik yang berukuran besar serta terlihat kasar dan kuat (Romero, 2002).
2.1.2 Habitat Ikan gurame
Habitat ikan gurame merupakan air tawar sampai sedikit payau, berair jernih dan dasar kolam yang kurang lumpurnya. Lokasi pemeliharaan yang cocok ialah pada kebuntingan 50- 400m di atas permukaan laut, dengan suhu 24-28oC, sekurang-kurangnya 75 cm. Ikan ini sangat baik di pelihara, walaupun pertumbuhannya lambat. Untuk pertumbuhan pH-nya berkisar antara 7-8 (Dinas Perikanan 1997 dalam Sutrisno 2011).
2.2 Spirulina platensis 2.2.1 Klasifikasi
Klasifikasi Spirulina menurut Bold & Wyne (1978) dalam Pamungkas (2005) adalah sebagai berikut :
Kingdom : Protista Divisi : Cyanophyta Kelas : Cyanophyceae Ordo : Nostocales Famili : Oscilatoriaceae Genus : Spirulina
9
Gambar 2.2 Spirulina sp.
(Sumber: R. Locci dalam Cifferi, 1983 dan Henrickson, 1989)
Spirulina sp. merupakan mikroalga yang menyebar secara luas, dapat ditemukan di berbagai tipe lingkungan, baik di perairan payau, laut dan tawar (Ciferri, 1983). Ciri-ciri morfologinya yaitu filament yang tesusun di trikoma multiseluler berbentuk spiral yang bergabung menjadi satu, tidak seimbang, tidak bercabang, autrotof, dan berwarna biru kehijauan (Gambar 2.2).
2.2.2 Kandungan Nutrisi Spirulina platensis
Analisis kimia Spirulina sp. dimulai pada tahun 1970 yang menunjukkan
Komposisi pigmen pada Spirulina sp. merupakan komposisi pigmen yang kompleks dan umum ditemukan pada alga biru hijau. Kompisisi tersebut diantaranya adalah klorofil- a, xanthophyll, fikosianin dan zeaxanthin
(Christwardana dan Hadiyanto, 2012). Spirulina mengandung fikosianin tinggi sehingga warna cenderung hijau biru (Kebede and Ahlgren, 1996 dalam
Christwardana et al., 2009). Penilitian yang dilakukan Woro dkk., (2014) menjelaskan bahwa pemberian fikosianin spirulina dapat meningkatkan leukosit, aktivitas fagositosis dan pertumbuhan pada ikan kerapu bebek juvenil. Abdel et al., (2008) juga pernah melaporkan bahwa penambahan spirulina pada pakan meningkatkan jumlah total eritrosit dan leukosit ikan tilapia (Oreochromis niloticus).
El-Sabagh et al., (2014) dalam penelitiannya melaporkan bahwa
Spirulina platensis dapat meningkatkan konsentrasi Hb dan sel darah putih pada domba. Peningkatan produksi sel darah putih dikarenakan adanya phycocyanin dan polisakarida yang terkandung dalam spirulina (Zhang, 1994 dalam El-Sabagh
et al., 2014).
2.2.3 Sistem Imun Ikan
Menurut Rombout et. al. (2005), sistem kekebalan tubuh ikan secara fisiologis mirip dengan vertebrata yang lebih tinggi, meskipun ada perbedaan tertentu. Berbeda dengan vertebrata yang lebih tinggi, ikan merupakan organisme hidup bebas dari tahap embrionik awal kehidupan yang bergantung pada sistem kekebalan tubuh bawaan mereka untuk bertahan hidup.
11
kekebalan yang diperoleh dan homeostasis melalui sistem protein reseptor. Protein reseptor mengidentifikasi pola-pola molekuler yang khas dari mikroorganisme patogen termasuk polisakarida, lipopolisakarida (LPS), DNA bakteri peptidoglikan, RNA virus, dan molekul lain yang tidak normal pada permukaan organisme multi seluler. Tanggapan ini dibagi menjadi hambatan fisik dan respon kekebalan seluler dan humoral. Parameter immunological terdiri dari inhibitor pertumbuhan, enzim litik, jalur komplemen klasik, alternatif dan jalur lektin, aglutinin dan precipitin (opsonin dan lektin primer), antibodi, sitokin, kemokin, dan peptida antibakteri. Berbagai faktor internal dan eksternal dapat mempengaruhi parameter respon kekebalan bawaan. Perubahan suhu, manajemen stres, dan kepadatan memiliki efek penekanan pada jenis respon, sedangkan beberapa aditif makanan dan imunostimulan dapat meningkatkan efisiensi mereka. Peningkatan sel eritrosit sangat berhubungan dengan pengangkutan oksigen keseluruh tubuh dan peningkatan leukosit sangat berhubungan dengan sistem kekebalan tubuh ikan. Leukosit berperan penting dalam imunitas non-spesifik atau jumlahnya di jadikan sebagai indikator kerentanan terhadap penyakit (Matanovic et al., 2007).
2.3 Aeromonas hydrophila
inti ditemukan pada jaringan termasuk insang, jantung, hepatopankreas dan sistem peredaran darah (Pathol et al., 2009)
Kelompok Bakteri dari genus Aeromonas merupakan bakteri yang dapat ditemukan di daerah perairan tawar, Gram Negatif dan berbentuk batang (Gardenia dkk., 2010). (Gambar 2.3) Morfologi batang pendek dengan ukuran bervariasi antara leber 0,8 sampai 1,0 mikron dengan panjang 1,0 sampai 3,5 mikron, tidak memiliki spora, bakteri bersifat motil karena mempunyai flagella monotrichous. (Herupradoto dan Yuliani, 2010).
Pertumbuhan optimal terjadi setelah 24 jam pada suhu 28oC pada media TSA (Tripticase Soya Agar). Pada pewarnaan gram menunjukkan warna merah, tidak menunjukkan reaksi positif pada pewarnaan Ziel dan Nelsen dan Giemsa. Tumbuh pada blood agar pada suhu 37oC selama 18 jam menunjukkan zona beta hemolysis 4 mm, tidak berwarna hingga keabu-abuan. Media MCA suhu 37oC selama 24 jam menunjukkan koloni berwarna pink ( Akkoc et al., 2008).
13
Gambar 2.3 Aeromonas hydrophila dengan Pewarnaan Gram dan perbesaran 1000x (Park, 2011)
2.3.1 Karaterisktik Aeromonas hydrophila
Salah satu bakteri yang umum dijumpai pada ekosistem perairan dan mempunyai peranan sebagai microbial flora bagi organisme air pada kondisi lingkungan yang stabil yaitu bakteri Aeromonas hydrophila. Dimana bakteri tersebut bersifat patogen pada ikan air tawar seperti ikan nila pada kondisi kualitas air yang buruk. Selain itu bakteri Aeromonas hydrophila memiliki kemampuan osmoregulasi yang tinggi dimana mampu bertahan hidup pada perairan tawar, perairan payau dan laut yang memiliki kadar garam tinggi dengan penyebaran melalui air, kotoran burung, saluran pencernaan hewan darat dan hewan amfibi serta reptil (Mangunwardoyo et al., 2010).
Jika kualitas lingkungan air terus menurun, kematian yang ditimbulkan bisa mencapai 100% (Bachtiar 2010).
Aeromonas hydrophila menyebabkan penyakit Motile Aeromonas Septicemia (MAS) atau penyakit bercak merah. Bakteri ini menyerang berbagai jenis ikan air tawar seperti lele dumbo (Clarius gariepinus), ikan mas (Cyprinus carpio), gurame (Osphronemus gouramy) dan udang galah (Macrobrachium rosenbergii). Pengendalian bakteri ini sulit karena memiliki banyak strain dan selalu ada di air serta dapat menjadi resisten terhadap obat-obatan (Kamiso dan Triyanto 1993).
2.3.2 Patogenesis dan Gejala Klinis
Proses invasi bakteri patogen ke dalam tubuh di awali dengan melekatnya bakteri pada permukaan kulit. Flagella yang dimiliki oleh bakteri digunakan untuk bergerak, sedangkan pili digunakan untuk melekat kuat pada lapisan terluar tubuh ikan yaitu sisik yang dilindungi oleh zat khitin. Jika organisme melekat pada reseptor spesifik akan membentuk koloni, meluas membentuk toksin yang membantu dalam proses penetrasi sehingga timbul penyakit. (Lee et al., 2000).
15
hati, ginjal dan limfa saat dilakukan pembedahan. seperti yang terlihat pada gambar 2.4
Gambar 2.4. Terdapat bentukan-bentukan lesi dan terdapat pendarahan pada kulit ikan gurame (Osphronemus goramy Lec.) yan terserang bakteri
Aeromonas hydrophila (Tanjung dkk., 2011).
2.4Komponen Darah Ikan 2.4.1 Leukosit Ikan
Ikan mempunyai sel darah putih (leukosit) yang cukup banyak antara 137.000/mm3– 798.000/mm3. Leukosit ikan dibagi menjadi 2 bagian besar yaitu Granulosit dan Agranulosit (Bijanti, 2005).
2.4.1.1 Granulosit
a. Neutrofil
Neutrofil merupakan fagositas kuat. Fagositosis neutrofil dilakukan dengan cara mendekati partikel asing/bakteri dan mengeluarkan pseudopodi ke segala arah sekitar partikel, satu neutrofil dapat memfagosit 5-20 bakteri sebelum neutrofil tersebut menjadi tidak aktif (Bijanti, 2005).
Neutrofil ikan berbentuk bulat sampai oval dengan eksentrik. Homogen. Nukleus neutrofil yang matang mempunyai bermacam bentuk, butir kromatinnya memadat dan pewarnaannya lebih basofilik. Neutrofil beberapa jenis ikan seperti ikan Mas, mempunyai granulosit dengan granula sitoplasma yang lebih asidofilik, sitoplasma tidak berwarna dan inti eksentrik dan selnya lebih digolongkan sebagai heterofil. Diameter berukuran kurang lebih 10 µm (Bijanti dkk., 2010).
b. Eosinofil dan Basofil
Eosinofil pada hapusan jarang dijumpai pada ulasan darah ikan. Eosinofil hanya dijumpai pada beberapa spesies ikan misalnya ikan Mas. Eosinofil dijumpai sebagai granulosit yang berukuran sedang sampai besar dengan granula eosinofilik. Nukleus bervariasi mulai dari yang bulat sampai segmented dan letaknya eksentrik. Eosinofil ikan Mas berukuran kurang lebih 7,5 µm. peningkatan jumlah eosinophil pada ikan akan mengindikasikan adanya respon inflamasi yang dikaitkan dengan infeksi parasit atau stimulasi antigenik (Bijanti dkk., 2010).
17
2.4.1.2 Agranulosit
Kelompok leukosit agranulosit terdiri dari limfosit dan monosit. Pada ikan limfosit didapatkan dalam jumlah yang paling banyak diantara jenis leukosit yang lainnya (Bijanti, 2005).
a. Limfosit
Limfosit memiliki jumlah sekitar 20-35% dari sel darah putih yang beredar (Tambayong, 2002). Limfosit banyak ditemukan pada hapusan darah ikan, ukuran diameternya berkisar antara 5-8 µm. limfosit berbentuk bulat dengan inti yang besar dan sitoplasma yang sedikit (Bijanti dkk., 2010).
Limfosit tidak bersifat fagosit tetapi memegang peranan penting dalam pembentukkan atibodi. Fungsi limfosit sendiri adalah sebagai mediator respon imun humoral dan seluler. Penurunan jumlah limfosit dapat menurunkan konsentrasi antibody dan menyebabkan penurunan pertahanan tubuh terhadap serangan penyakit (Bijanti, 2005).
b. Monosit
Monosit merupakan sel darah yang terbesar dengan diameter kurang lebih 12-15 µm, dan bahkan kadang-kadang mencapai 20 µm. Jumlahnya terdiri 2-8 % dari seluruh jumlah leukosit (Amindariati, 2005).
lebih bergranuler dan kurang memadat jika dibandingkan inti limfosit (Bijanti
dkk., 2010).
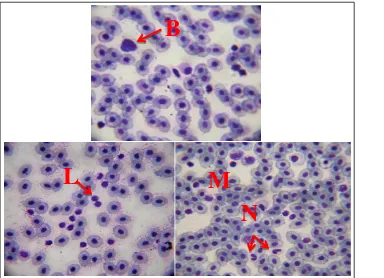
Monosit bersifat fagositosis yang lebih kuat dibandingkan dengan neutrofil dan dapat memfagosit partikel yang lebih besar. Oleh sebab itu monosit yang matang disebut makrofag dan beredar pada jaringan (Bijanti, 2010). seperti yang terlihat pada gambar 2.5
Gambar 2.5. Sel Leukosit (1000x,MGG). Limfosit (L), Neutrofil (N), Monosit (M), Basofil (B)
(Doncan et al., 2010).
L
B
19
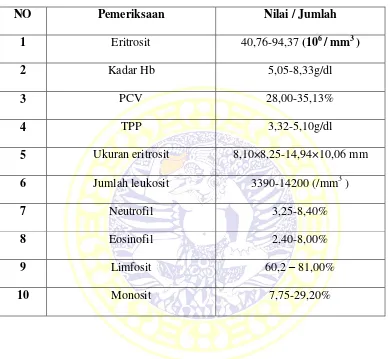
2.4.2 Tinjaun Nilai Normal Gambaran Darah Ikan
Menurut Salsia dkk (2011), hasil pemeriksaan nilai normal gambaran darah ikan secara umum ditunjukkan dalam tabel di bawah ini :
Tabel 2.1. Nilai normal gambaran darah ikan air tawar secara umum.
NO Pemeriksaan Nilai / Jumlah
1 Eritrosit 40,76-94,37 (106 / mm3 )
2 Kadar Hb 5,05-8,33g/dl
3 PCV 28,00-35,13%
4 TPP 3,32-5,10g/dl
5 Ukuran eritrosit 8,10×8,25-14,94×10,06 mm
6 Jumlah leukosit 3390-14200 (/mm3 )
7 Neutrofil 3,25-8,40%
8 Eosinofil 2,40-8,00%
9 Limfosit 60,2 – 81,00%
BAB 3 MATERI DAN METODE PENELITIAN
3.1Tempat dan Waktu Penelitian
Tempat penelitian dilaksanakan di Fakultas Perikanan dan Kelautan Universitas Airlangga. Pembuatan ekstrak Spirulina platensis dilakukan di Laboratorium Farmakologi, Fakultas Kedokteran Hewan, Universitas Airlangga. Proses pembuatan hapusan darah, penghitungan jumlah leukosit di Laboratorium Patologi Klinik Veteriner Fakultas Kedokteran Hewan Universitas Airlangga Surabaya.
3.2Waktu Penelitian
Waktu Penelitian berlangsung selama satu bulan Bulan April sampai Bulan Mei 2016
3.3Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorium. Pada penelitian ini variable yang diamati adalah jumlah leukosit ikan gurame. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL), karena kondisi lingkungan dan berat badan yang bersifat homogen, serta sampel dilakukan secara acak dengan empat macam kelompok perlakuan.
3.4Materi Penelitian 3.4.1 Hewan Coba
21
dan panjang tubuh 9-10 cm dari kolam yang sama. Hewan coba diperoleh dari Kolam Minazas, Desa bakung, Kecamatan Udan Awu, Blitar.
3.4.2 Bahan Penelitian
Bahan-bahan yang diperlukan antara lain pakan ikan standar berbentuk pellet (Takari®_PT. Central Proteinaprima., Tbk, kode produksi PCP401), air Sumur, Ekstrak Spirulina platensis, bakteri Aeromonas hydrophila yang berjumlah 106 CFU/ml didapat dari Balai Karantina Perikanan Surabaya, dengan pengenceran 100 ml. Bahan untuk pembuatan ekstrak Spirulina platensis adalah tepung Spirulina platensis yang di dapat dari Balai Besar Pengembangan Budidaya Air Payau Jepara.
Bahan-bahan untuk pengambilan darah, pembuatan hapusan darah, dan penghitungan jumlah leukosit pada ikan gurame adalah Heparin, larutan Dacies, methanol 95%, zat warna Giemsa beserta Larutan Buffer Pro Giemsa, dan minyak emersi.
3.4.3 Alat Penelitian
Peralatan yang digunakan untuk penelitian ini adalah akuarium (ukuran volume 5 L) sebanyak 5 buah, mesin aerator, selang aerator, filter pembersih air, batu zeloit, timbangan milligram digital, dan jaring ikan kecil. Peralatan untuk Pengambilan darah diperlukan spuit insulin 1 ml dengan jarumnya, tabung ependorf. pembuatan hapusan darah diperlukan glas obyek, dan rak tempat pemulas glas obyek. Penghitungan jumlah leukosit dan hitung jenis leukosit pada ikan gurame diperlukan kamar hitung Improved Neubauer, Pipet Pasteur,, counter, gelas penutup, mikroskop, gelas obyek, rak tempat pemulas gelas obyek.
3.5.1 Penentuan Dosis Spirulina platensis
Penentuan dosis berdasarkan penelitian pendahuluan yang telah dilakukan yaitu dengan bentuk ekstrak air panas Spirulina plantensis. Dosis penelitian tersebut adalah 200 mg/L, 400 mgL, 600 mg/L. Tayag et al., (2010) Perhitungan dosis Spirulina platensis di uraikan pada Lampiran 1.
3.5.2 Penentuan Jumlah Sampel
Rumus besaran sampel adalah t(n-1)> 15, dimana t adalah banyaknya perlakuan dan n adalah banyaknya ulangan (Kusriningrum, 2010). Dalam penelitian ini digunakan 5 perlakuan. Dari rumus tersebut maka ulangan terkecil yang digunakan adalah 4 ekor ikan dalam setiap perlakuan. Untuk menghindari bias maka ditambah 1 ekor pada setiap kelompok perlakuan, sehingga seluruh ulangan tiap perlakuan 5 ekor ikan gurame.
3.5.3 Perlakuan Penelitian
Setelah adaptasi selama satu minggu, semua kelompok perlakuan dari hewan coba di Dipping ekstrak spirulina dengan dosis disetiap perlakuan dan diinfeksi bakteri Aeromonas hydrophila, kecuali PO(-)
P0- : Kelompok perlakuan kontrol negatif
Ikan tanpadirendam ektrak Spirulina platensis dan tanpa diinfeksi bakteri Aeromonas hydrophila.
P0+ : Kelompok perlakuan kontrol positif
23 pada hari ke tujuh, selanjutnya diinfeksi Aeromonas hydrophila
106 sel/ml pada hari ke-15
Pada hari ke-3 setelah perlakuan, darah ikan diambil sesuai proses kemudian diamati gambaran jumlah leukosit dan hitung jenis leukosit.
3.6Pengambilan Darah untuk Pemeriksaan Jumlah Leukosit dan Hitung Jumlah Sel Leukosit
3.6.1 Punksi Pembuluh Darah Bagian Caudal
dalam spuit. Pengambilan darah ikan dengan memposisikan jarum pada garis tengah tubuh belakang sirip anal kemudian memasukkan jarum kedalam musculus sampai mencapai tulang belakang (columna spinalis) dengan memastikan tidak terdapat gelembung air yang masuk dalam spuit. Kemudian ditarik perlahan-lahan sampai darah masuk ke dalam spuit (Bijanti, 2010).
3.6.2 Pemeriksaan Jumlah Leukosit dan Hitung Jenis Sel Leukosit 3.6.2.1 Pemeriksaan Jumlah Sel Leukosit
Menurut Bijanti (2010), metode pemeriksaan jumlah leukosit yaitu sampel darah diencerkan dengan perbandingan 1:50 menggunakan larutan Dacies yang telah disaring. Pencampuran darah dengan larutan Dacies secara perlahan agar tidak merusak sel darah. Ambil sedikit campuran darah dan larutan Dacies dengan menggunakan pipet Pasteur, kemudian teteskan dalam kamar hitung Improved Neubauer. Letakkan cover glass di atas kamar hitung Improved Neubauer. Kemudian hitung jumlah leukosit yang terdapat pada semua kotak leukosit dengan menggunakan mikroskop.
3.6.2.2 Menghitung Jumlah Sel Leukosit
25
menyinggung garis batas sebelah kanan atau garis bawah tidak boleh dihitung (Bijanti, 2010).
3.6.2.3 Pemeriksaan Hitung Jenis Sel Leukosit
Menurut Bijanti (2010), metode pemeriksaan jumlah leukosit yaitu satu tetes sampel darah diletakkan pada slide yang kering dan bersih kemudian buat hapusan darah yang tipis. Keringkan hapusan darah, kemudian hapusan darah yang telah difiksasi dengan metanol 95% selama 1-2 menit, menggunakan pengecatan Giemsa atau May Grunwald ditunggu selama ± 5 menit. Kemudian bilas slide dengan menggunakan air mengalir dan keringkan. Periksa hapusan darah di bawah mikroskop menggunakan emersi (obyektif 1000x) (Bijanti, 2010).
Perhitungan dilakukan pada daerah penghitung (Counting Area) dengan memilih bagian dari sediaan yang cukup tipis dengan penyebaran leukosit merata. Perhitungan dimulai dari bagian pinggir atas sediaan kemudian berpindah ke arah pinggir bawah dengan menggunakan mikro manipulator mikroskop. Pada daerah bawah pinggir mulai digeser ke lapangan bagian kanan lebih banyak dari lebarnya emersi, kemudian ke arah pinggir atas lagi. Pada bagian atas geser ke kanan lagi dan kemudian diarahkan ke bagian bawah. Perhitungan ini dilakukan terus-menerus sampai 100 sel (Bijanti dkk., 2014).
3.7Variabel Penelitian
Beberapa peubah yang diamati dalam penelitian ini meliputi:
Variabel bebas : Dosis ekstrak Spirulina platensis 200 mg/L, 400 mg/L, 600 mg/L dan Bakteri Aeromonas
Variabel tergantung : Jumlah Leukosit dan hitung jenis Leukosit ikan
Gurame
Variabel kendali : ikan gurame, berat badan ikan, kolam, jumlah
pakan.
3.8Rancangan Penelitian dan Analisis Data
27
3.9 Diagram Alur Penelitian
20 Ikan Gurame Ikan diadaptasikan selama 1 minggu
P0 (-) : tanpa
24 jam setelah perendaman kedua ekstrak Spirulina Dipindahkan kembali ke akuarium pemeliharaan P0 (-) : tanpa
3 hari setelah infeksi
Analisis data Pengambilan sampel darah, pemeriksaan jumlah leukosit, dan
pemeriksaan hitung jenis leukosit
BAB 4 HASIL PENELITIAN
4.1Pengamatan Gejala Klinis
Proses infeksi bakteri Aeromonas hydrophila dengan konsentrasi 106 sel/ml sebanyak 1ml dalam 3 L air rendaman. Infeksi Bakteri Aeromonas hydrophila menimbulkan perubahan patologi anatomi pada ikan gurame. Perubahan tersebut diantaranya warna kulit ikan gurame terlihat pucat, hemoraghi, ekor mengalami nekrosis, exophthalmia dan terdapat ascites pada rongga abdomen seperti yang terlihat pada gambar 4.1
Gambar 4.1 : Perubahan patologi anatomi. Keterangan : (A) exophthalmia, (B) ekor mengalami nekrosis, (C) warna kulit tampak pucat, (D) ascites pada rongga abdomen ikan yang terinfeksi Aeromonas hydrophila (dokumentasi pribadi, 2016).
4.2Gambaran Jumlah Leukosit
29
antara perlakuan P0(+) dengan P3 menunjukkan hasil berbeda sangat nyata (p<0,05). Perlakuan P3 menunjukkan hasil berbeda sangat nyata dengan P0(-). Tetapi perlakuan kontrol P0(-) dengan P1 dan P2 tidak menunjukkan berbeda nyata (p>0,05).
Tabel 4.1 Rata-rata dan Simpanan Baku jumlah leukosit ikan Gurame pada akhir penelitian.
Perlakuan Jumlah Leukosit (sel / mm3 )
PO(-) 9162.50a ± 849. 877
PO(+) 29212.50c ± 5341. 563
P1 11875.00ab ± 1564. 981
P2 12875.00ab ± 723. 994
P3 13975.00b ± 504. 149
Keterangan : Superskrip yang berbeda pada kolom yang berbeda menunjukkan adanya perbedaan yang sangat nyata. seperti yang terlihat pada gambar grafik 4.2
Gambar 4.2. Jumlah leukosit ikan Gurame
0 10000 20000 30000 40000
P0(-) P0(+) P1 P2 P3
31
4.3Hitung Jenis Leukosit
Hasil hitung jenis leukosit pada ikan gurame setelah diberikan perlakuan adalah sebagai berikut:
Tabel 4.2 Rata-rata dan Simpangan Baku Jenis Leukosit
Perlakuan Neutrofil Eosinofil Basofil Limfosit Monosit
P0(-) 29.50b ± 6.952 2.50a ± 0.577 1.50a ± 0.577 54.25a ± 3.775 9.25ab ± 5.058 P0(+) 21.00a ± 6.976 3.75b ± 0,957 1.00a ± 0.816 67.50b ± 1.291 5.50a ± 1.915
P1 35.25bc ± 4.992 2.25a ± 0.500 1.25a ± 0.957 50.75a ± 1,258 12.00b ± 1.826 P2 40.00c ± 2.160 1.75a ± 0.957 1.50a ± 0.577 50.25a ± 3.403 14.00bc ± 2.944 P3 45.75d ± 2.500 1.50a ± 0.577 2.00a ± 0.816 50.75a ± 2.217 17.25c ± 3.096
Hasil penelitian menunjukkan terdapat perbedaan yang nyata pada jumlah neutrofil, eosinofil, limfosit dan monosit di antara perlakuan. Setelah diuji dengan Uji Jarak Berganda Duncan diperoleh hasil adanya peningkatan jumlah neutrofil, monosit yang berbeda nyata (P<0,05) bila dibandingkan dengan kontrol P0(+) dan penurunan jumlah limfosit dan eosinofil yang berbeda nyata (P<0.05) bila dibandingkan dengan kontrol P0(+) .
Gambar 4.4 . Hitung Jenis Leukosit Ikan Gurame
Gambar 4.5. Pemeriksaan Darah Ikan Gurame (A) Neutrofil (B) Eosinofil (C) Basofil (D) Limfosit (E) Monosit (dokumentasi pribadi, 2016).
0 20 40 60 80
P0(-) P0(+) P1 P2 P3
Neutrofil
Eosinofil
Basofil
Limfosit
BAB 5 PEMBAHASAN 5.1Gambaran Pengamatan Gejala Klinis
Proses infeksi bakteri Aeromonas hydrophila dengan konsentrasi 106 sel/ml sebanyak perendaman 1 ml dalam 3 L air rendaman. Perubahan gejala klinis terjadi 3 hari setelah infeksi. Perubahan tersebut meliputi tubuh ikan berwarna lebih gelap, timbul luka di permukaan tubuh, hemoraghi lokal pada bagian caudal tubuh dan insang, exophtalmia, terkelupasnya sebagian sisik, sirip ekor lepas, hingga kematian mendadak.
Ikan gurame yang diinfeksi bakteri Aeromonas hydrophila sebelum dilakukan pengambilan darah menunjukkan beberapa perubahan pada permukaan tubuh ikan. Perubahan tersebut berupa bercak merah pada permukaan kulit. Bercak merah disebabkan oleh toksin Aeromonas hydrophila yang merusak jaringan tubuh ikan. Menurut Chopra et all (2000) Aeromonas hydrophila
menghasilkan hemosilin yang bekerja memecah dan melisiskan sel-sel darah merah, sehingga sel darah merah keluar dari pembuluh darah dan menimbulkan warna kemerahan pada permukaan kulit.
Lipopolisakarida (LPS) dari alga biru-hijau Spirulina platensis
respon seluler ditunjukkan oleh aktivitas fagositik yang diukur melalui uji nitro blue tetrazolium (NBT) (Andreson and Siwicki, 1993).
5.2Gambaran Jumlah Leukosit
Berdasarkan hasil penelitian bahwa dengan P0(+) dengan P3 menunjukkan hasil berbeda sangat nyata yaitu P0(+) jumlah leukosit lebih tinggi dari P3. Perlakuan P0(+) memiliki jumlah leukosit tinggi. Peningkatan jumlah leukosit (leukositosis) sebagai respon fisiologis untuk melindungi tubuh dari serangan mikroorganisme. Peningkatan sel darah putih merupakan respon dalam bentuk proteksi terhadap adanya sel asing termasuk adanya infeksi bakteri yang masuk ke tubuh ikan. Hasil produksi leukosit akan diarahkan menuju daerah terinfeksi sebagai pertahanan ikan. Naiknya jumlah leukosit merupakan indikator adanya infeksi yang mengakibatkan terjadinya inflamasi (Akhmad, 2011). Terjadinya infeksi yang berkepanjangan menyebabkan jumlah leukosit meningkat dari nilai normal. Hal ini merupakan mobilisasi cadangan dan pembentukan leukosit berjumlah besar selama beberapa hari atau minggu (Tambayong, 2002). Penurunan P3 terjadi disebabkan oleh leukosit yang ada pada pembuluh darah sangat berkurang (menurun) karena sebagian besar leukosit bergerak menuju jaringan-jaringan yang terinfeksi. Hal ini sependapat dengan Nuryati et al., (2010) bahwa penurunan jumlah leukosit setelah uji tantang disebabkan karena leukosit tersebut aktif dan keluar dari pembuluh darah menuju jaringan yang terinfeksi.
35
meningkatkan produksi leukosit ikan gurame. Leukosit merupakan salah satu sel darah yang mempunyai peranan penting dalam sistem imun ikan. Imunostimulan memiliki fungsi meningkatkan sistem imun non spesifik sehingga dapat melindungi ikan dari infeksi penyakit. (Duncan dan Klesius 1996). Penelitian
Harikrishnan et al., (2003) menyatakan terjadi peningkatan jumlah leukosit ikan
mas yang ditretmen ekstrak herbal kemudian diinfeksi bakteri Aeromonas
hydrophila.
5.3Gambaran Hitung Jenis Leukosit 5.3.1 Neutrofil
Hasil penelitian menunjukkan P0(+) berbeda sangat nyata (p<0,05) dengan P3 yaitu P0(+) lebih rendah neutrofilnya. Hal tersebut dikarenakan proses fagositosis jarang terjadi di dalam aliran darah teteapi terjadi di jaringan misalkan di daerah luka, maka sel neutrofil akan tertarik ke daerah tersebut (Bijanti, 2010). Infeksi bakteri Aeromonas hydrophila menyebabkan banyak luka di daerah tubuh ikan sehingga menimbulkan reaksi radang. Neutrofil adalah sel radang yang pertama kali ditemukan di tempat jejas dan masuk ke jaringan sehingga di dalam darah jumlah nya menurun (McGavin and Zachary, 2006).
akan meningkat jika terjadi infeksi dan berperan sebagai pertahanan pertama dalam tubuh (Harikrishnan et al., 2010).
5.3.2 Eosinofil
Hasil penelitian menunujukkan P0(+) berbeda sangat nyata dengan P0(-), P1, P2 dan P3 dan memiliki eosinofil yang lebih rendah dibandingkan P0(+), hal ini menunjukkan Penurunan eosinofil (eosinopenia) dikarenakan adanya reaksi stress. Penurunan eosinofil dapat juga disebabkan oleh keradangan akut dan kronis, intoksikasi, dan trauma. Peningkatan Eosinofil sebagai respon imun terhadap toksik dan enzim ekstraseluler yang dihasilkan Aeromonas hydrophila
(Patrick et al., 2002). 5.3.3 Basofil
Perlakuan P0(+), P0(-), P1, P2 dan P3 tidak berbeda nyata (p>0,05). Peningkatan basofil terjadi akibat adanya proses inflamasi (radang), leukemia, dan fase penyembuhan infeksi. Basofil jarang ditemukan ke di dalam hapusan darah ikan (Bijanti, 2010).
5.3.4 Limfosit
37
Perlakuan P0(-), P1, P2 dan P3 terjadi penurunan limfosit. Bijanti (2005) menjelaskan penurunan sel limfosit dipengaruhi adanya antigen asing sehingga zat kebal terganggu oleh masuknya infeksi yang menyebabkan jumlah limfosit menurun. Kono et al., (2002) sel limfosit yang teraktivasi oleh imunostimulan dapat meningkatkan aktivitas mitogenik yang diinduksi oleh lipopolisakarida dan menghasilkan macrophage activating factors. Tizard (1982) menyatakan penurunan limfosit disebabkan di darah perifer ditarik dari sirkulasi kedalam jaringan yang mengalami peradangan, adanya stres berkepanjangan akan meningkatkan kadar kartisol dalam darah sehingga menyebabkan hilangnya limfosit dalam sirkulasi darah dan organ limfoid.
5.3.5 Monosit
Hasil penelitian pada perlakuan P0(+)berbeda nyata dengan P0(-), P1, P2 dan P3 yang memiliki jumlah monosit tinggi , hal ini terkait dengan peran monosit untuk menghancurkan benda asing yang masuk yaitu bakteri. Monosit merupakan sel dalam aliran darah dan berkembang menjadi makrofag. Ketika mengalami aktivitas, makrofag memiliki kapasitas fagosit lebih kuat dari pada neutrofil meskipun granulosit mempunyai jumlah lebih besar (Irianto, 2005). Peningkatan jumlah monosit terjadi selama kebutuhan jaringan untuk proses fagositosis makromolekuler dan dapat ditemukan pada fase penyembuhan infeksi (Bijanti, 2010).
BAB 6 KESIMPULAN DAN SARAN
6.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat diambil kesimpulan bahwa pemberian ekstrak Spirulina platensis secara perendaman 2 kali selama 3 jam pada hari pertama dan ketujuh dengan dengan dosis 600mg/ L pada ikan gurame yang diinfeksi bakteri Aeromonas hydrophila mampu meningkatkan aktifitas fagosit melalui sistem pertahanan non spesifik dan pertahanan seluler (sel makrofag, jumlah leukosit, jenis leukosit seperti neutrofil dan monosit).
6.2Saran
RINGKASAN
LITTA LASYA EMANINTA SITEPU. Motile Aeromonas Septicaemia
adalah penyakit yang sering menyerang ikan. Penyakit ini disebabkan oleh bakteri patogen oportunistik yaitu Aeromonas hydrophila. Penyakit ini dapat menimbulkan kematian pada ikan budidaya sehingga merugikan petani ikan dengan tingkat kematian cukup tinggi (80-100%) dalam waktu 1-2 minggu Upaya pencegahan penyakit Aeromonas pada ikan telah dilakukan dengan menggunakan
Spirulina platensis yang merupakan bahan alami dan aman. Spirulina platensis
salah satu jenis mikroalga dari kelompok Cyanophyceae dapat digunakan sebagai imunostimulan.
Penelitian ini bertujuan untuk melihat efek ekstrak Spirulina platensis
sebagai imunostimulan terhadap jumlah leukosit dan hitung jenis leukosit ikan gurame (Osphronemus goramy) yang diinfeksi bakteri Aeromonas hydrophila.
Metode penelitian menggunakan lima perlakuan atau lima kelompok (n = 5) dan empat ulangan. Dua puluh ikan gurami dengan berat rata-rata sebesar 20
gram dan panjang 9 – 10 cm secara acak dibagi menjadi lima kelompok, Termasuk P0-, P0+, P1, P2 dan P3 masing-masing untuk kontrol (P0-), kelompok
yang terinfeksi dengan 106 sel/ml Aeromonas hydrophila (P0+) dan kelompok-kelompok yang direndam dengan ekstrak Spirulina platensis pada 200, 400 dan 600 mg/L dan terinfeksi 106 sel/ml Aeromonas hydrophila. Setelah satu minggu adaptasi, P1, P2 dan P3 kelompok direndam dengan ekstrak Spirulina platensis
41
terinfeksi dengan 106 sel/ml. Aeromonas hydrophila. Setelah 4 hari infeksi, semua ikan di panen untuk pengumpulan data.
DAFTAR PUSTAKA
Abdel-Daim M.M., S. M. M. Abuzead, S.M. Halawa. 2008. Protective Role of
Spirulina platensis against Acute Deltamethrin-Induces Toxicity in Rats. J. Plosone. 8(9).
Akkoc, A., A. L. Kocabiyik, M. O. Ozyigit, I. T. Cangul, R. Yilmaz and C. Ozakin. 2008. Burkholderia cepacia and Aeromonas hydrophila
Septicaemia in an African Grey Parrot (Psittacus erithacus). Turk. J. Vet. Anim. Sci. 32(3): 233-236.
Austin, B. and Dawn A. 2007. Bacterial Fish Pathogens Diseases of Farmed and Wild Fish. Fourth Edition. Springer Praxis Publishing: Chichester, UK Bijanti, R. 2010. Hematologi Ikan (Teknik Pengambilan Darah dan Pemeriksaan
Hematologi Ikan). Edisis 2. Fakultas Kedokteran Hewan. Universitas Airlangga. Surabaya: Pt Revkapetra Media. ISBN: 978602798231-4
Bijanti, R., M. Gandul A. Y., Retno S. W., R. Budi U. 2010. Patologi Klinik Veteriner. Edisi Pertama. Surabaya: Pusat Penerbitan dan Percetakan Unair. ISBN: 978-979-1330-71-8
Bijanti, R., M. Gandul A. Y., Wiwik T. 2011. Antigenesity protein of Aeromonas hydrophila caused ulcer disease on Goldfish (Cyprinus carpio linn) using indirect ELISA technique. Veterinary Basic Science Departement, Microbiology Department Faculty of Veterinary Medicine, Airlangga University. Surabaya
Bijanti, R., R. Budi U., Retno S. W., Setya B., M. Gandul A. Y. 2014. Patologi Klinik Veteriner. Penuntun Praktika. Surabaya: Laboratorium Patologi Klinik Veteriner. Departemen Kedokteran Dasar Veteriner. Fakultas Kedokteran Hewan. Universitas Airlangga. Surabaya
Belay, A., Ota, Y., Miyakawa, K., Shimamatsu, H., 1993. Current knowledge on potential health benefits of Spirulina. J. Appl. Phycol. 5, 235 – 241.
Boajiang G. 1994. Study on Effect and Mechanism of Polysaccharida of Spirulina platensis on Body Immune Function Improvement. South China Normal Univ. China. Pub. in Proc. of Second Asia Pasific Conf. on Algal Biotechnol. Univ. of Malaysia. pp: 33-38.
43
by cyanobacteria. Journal Applied and Environmental Microbiology. 76(19): 6455-6462.
Chairlan., M. Biomed., Estu Lestari. 2011. Pedoman Tekiik dasar Untuk Laboratorium Kesehatan (Manual of Basic Techniques for A Health Laboratory) Edisi 2.Jakarta: Penerbit Buku Kedokteran Egc. Hal. 278 Christwardana, M., M. M. A. Nur, dan Hadiyanto. 2009. Spirulina platensis:
Potensinya Sebagai Bahan Pangan Fungsional. Jurnal Aplikasi Teknologi Pangan. 2(1).
Christwardana, M., Nur, M.M.A. dan Hadiyanto. 2012. Spirulina platensis
potensinya sebagai bahan pangan fungsional. Jurnal Aplikasi Teknologi Pangan. 2 (1): 1-4.
Chopra A.K, Xu, D. Ribardo, M. Gonzalez, K. Kuhi, J.W. Peterson, and C.W. Houston. 2000. The Cytotoxic Enterotoxin of Aeromonas hydrophila
Induces Proinflammatory Cytokine and Activites Arachidonic Acid Metabolism in Macrophages. J. Infection and Immunity. Departement of Microbiologi and Immunology, University of Texas Medical Branch. Galveston, Texas. P: 2808-2818.
Docan, A., Cristea, V., Dediu, L., and Grecu, I. 2010. Studies Of European Catfish (Silurus Glanis L.) Leukocytes Reaction In The Condition Of Rearing In ”Flow-through” Aquaculture Systems. “Lucrări Ştiinţifice, Seria Zootehnie”. Universitatea de Ştiinţe Agricole şi Medicină Veterinară Iaşi. Vol. 53 (15)
Duncan PL. Klesius PH. 1996. Effects of feeding Spirulina on specific and nonspecific immune responsses of channel catfish. Journal of Aquatic Animal Health 8 : 308 – 313.
El-Sabagh, M.R., Eldaim, M. A. A., D.H. Mahboub, and Abdel-Daim, M. 2014. Effects of Spirulina platensis Algae on Growth Performance, Antioxidative Status and Blood Metabolites in Fattening Lambs. Journal of Agricultural Science. 6(3): 92-98.
Harikrishnan, R., C. Balasundaram. MS. Heo. 2010. Herbal supplementation diets on hematology and innate immunity in goldfish against Aeromonas hydrophila, Fish & Shellfish Immunology 28 P : 354-361.
Haryani, A. 2012. Uji Efektifitas Daun Pepaya (Carica papaya) untuk pengobatan Infeksi Bakteri Aeromonas hydrophila Pada Ikan Mas Koki (Carassius auratus). Skripsi. Program Program Studi Sarjana Perikanan. Universitas Padjadjaran.
pada ikan mas koki (Carassius auratus). Jurnal Perikanan dan Kelautan
3(3): 213-220.
Harvey, J. W. 2012. Veterinary Hematology A Diagnostic Guide and Color Atlas. Missouri United State: Elsevier Saunders
http://www.merckmanuals.com/home/blood_disorders/white_blood_cell_dis orders/monocyte_disorders.html [19 Desember 2014].
Herupradoto, B. A. dan Yuliani, G. A. 2010. Karakterisasi Protein Spesifik
Aeromonas hydrophila Penyebab Penyakit Ulser Pada Ikan Mas. 11 (3): 158 – 162.
Irianto, A. 2003. Probiotik Akuakultur. Gajah Mada University Press. Yogyakarta.
Kono, Tomoyo, Aranya Ponpornpisit. Masahiro Sakai. 2003. The analysis of expressed genes in head kidney of common carp (Cyprinus carpio L.) Stimulated with peptidoglycan. Aquaculture Vol. 25. P: 37-52.
Kusriningrum, P.S. 2010. Perancangan Percobaan. Cetakan Kedua. Airlangga University Press. 44-51.
Lee S, Kim S, Oh Y, Lee Y (2000). Characterization of Aeromonas hydrophila Lubis, Y. P. P.; Yunasfi dan R. Leidonald. 2014. Jenis-jenis bakteri pada luka ikan
patin Jurnal Aquacostamarine 2(1): 66-77.
Magnadottir, B., 2006. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137 151.
McGavin, M. D., and Zachary, J. F. 2006. Pathologic Basis of Veterinary Disease 4 edition, Mosby.
Metanovic, K., Severin, K., Martinkovic, F., Simpraga, M. Janicki, Z., and Barisic, J. 2007. Hematological and Biochemical Changes in Organically Farmed Sheep Naturally Infected with Fasciola hepatica. J. Parasitol. Res. 101: 1657-1661.
Noercholis, A., M. Aziz M., Maftuch. 2013. Ekstraksi Fitur Roundness untuk Menghitung Jumlah Leukosit dalam Citra Sel Darah Ikan. Jurnal EECCIS. Volume 7 Nomor 1.
45
Pamungkas Estiamboro. 2005. Pengolahan Limbah Cair PT. Pupuk Kujan dengan
Spirulina sp. pada Reaktor Curah (Batch). [Skripsi]. Bogor: Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB.
Pathol, J., Roos S., Edsman L., Liu H., Söderhäll K. 2009. A Highly Virulent Pathogen, Aeromonas Hydrophila, From The Freshwater Crayfish Pacifastacus Leniusculus.Elsevier. PubMed – NCBI.
Patrick, T. K. W., D. W. Bruno, and L. H. Susan Lim. 2002. Diseases and Disorders of Finish in Cage Culture. CABI Publishing. London. 126-127. Park, S. Y., Hyun M. N., Kun P., Seok D. P. 2011. Aeromonas hydrophila Sepsis
Mimicking Vibrio vulnificus Infection. Department of Dermatology and Institute of Wonkwang Medical Science. Wonkwang University School of Medicine. Iksan-Korea. Vol. 23
Pingstone, A. 2005.
https://commons.wikimedia.org/wiki/Osphronemus_goramy#/media/File:Gi ant.gourami.arp.jpg. Diakses pada tanggal 3 Juli 2015.
Price & Wilson. (2005). Patofisiologi: Konsep Klinis Proses-Proses Penyakit. Edisi 6. Jakarta: EGC
Ragap, H. M., Khall, H. R., Mutawie, H.H. 2012. Immunostimulant effects of dietary Spirulina platensis on tilapia Oreochromis niloticus. Jurnal of Apllied Pharmaceutical Science, 02: 26-31.
Rahmaningsih, S. 2012. Pengaruh Ekstrak Sidawayah dengan Konsentrasi yang Berbeda untuk Mengatasi Infeksi Bakteri Aeromonas hydrophyla pada ikan Nila
Ravi, M., De, S. L., Azharuddin, S. and Paul, S.F.D. 2010. The beneficial effects of Spirulina focusing on its immunomodulatory and antioxidant properties. Nutrition and Dietary Supplements. 2: 73-83.
Romero, P. 2002. An Etymological Dictionary of Taxonomy. Madrid. Spain. Rosidah dan Wila M. A. 2012. Potensi ekstrak daun jambu biji sebagai
antibacterial untuk menanggulangi serangan bakteri Aeromonas hydrophila pada ikan gurame (Osphronemus gourami Lacepede). Jurnal Akuatika 3(1): 19-27.
Salasia, S.I.O., D. Sulanjari, dan A. Ratnawati. 2001. Studi Hematologi Ikan Air Tawar. Biologi. Universitas Gadjah Mada. Yogyakarta.
Sakai, M.,1999. Current Research Status of Fis Immunostimulants Aquaculture 172 : 63-92
Sari, I.W. 2006. Perbandingan Daya Antibakteria Gerusan Bawang Putih dengan Serbuk Bawang Putih Paten pade Ikan Maskoki yang Diinfeksi Aeromonas hydrophila. [Skripsi]. Fakultas Perikanan dan Kelautan. Universitas Airlangga.
Setiaji, A. 2009. Efektifitas Ekstrak Daun Pepaya Carica papaya L. Untuk Pencegahan dan Pengobatan Ikan lele dumbo Clarias sp. yang Diinfeksi Bakteri Aeromonas hydrophila [Skripsi]. Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Siegel, L., Lewis, T.L., Tripati, N.k., Burnley, V.V., & Latimer, K.S. (2002).
UlcerativeBacterial Dermatitis of Koi (Cyprinus carpio) and Ornamental Goldfish (Carassius auratus auratus). Pathology Undergradute & DVM Student Research Program.
Simanjuntak, S. B. I. 2002. Histologi Organ Limphoid Ikan Patin Jambal (Pangasius djambal Bleeker) yang Diberi Immunostimulan Spirulina. Thesis. Program Pascasarjana. Institut Pertanian Bogor. Bogor, 62 p. Supriyadi, H. dan A. Rukyani 1990. Imunoprofilaksis Dengan Cara Vaksinasi
Pada Usaha Budidaya Ikan. Hal 64-70. Prosiding Seminar Nasional II Penyakit Ikan Dan Udang. Balai Penelitian Perikanan Air Tawar. Bogor. Sutanto, D. 2011. Sukses Budi Daya Gurami. Pustaka Baru. Jakarta/
Tambayong, J. 2002. Buku Ajar Histologi. Jakarta: Buku Kedokteran EGC
Tayag, C.M., Y. Yong-Chin Lin, Chang-Che Li, Chyng-Hwa Liou, and Jiann-Chu Chen. 2010. Administration of the Hot Water Extract of Spirulina platensis Enchanced the Immune Response of White Shrimp Litopenaeus vannamei and Its Resistance againts Vibrio alginolyticus. J. Fish and Shellfish Immunology. Elsevier. 28: 764-773.
Tarwiyah, 2001. Tehnoik Budidaya Ikan Gurame (Osphronemus gouramy). Dinas perikanan, Daerah khusus Ibukota Jakarta.
Taufik, M. (2010). Cirebon Galakkan Budidaya Lele dan Gurame.
47
seperti yang terlihat pada gambar 4.1seperti yang terlihat pada gambar 4.1William & Wilkins.
Tizard, I.R.. 1982. An Introduction of Veterinary Immunology. W. B. Saunders Company. P.254-257.
Tokusoglu O. and M.K. Unal. 2003. Biomass Nutrient Profiles of Three Microalgae: Spirulina platensis, Cholorella vulgaris, and Isochrisis falbana. J. Food Sci. 68: 1144-1148.
Triyaningsih, Sarjito, Slamet B. P. 2014. Patogenisitas Aeromonas hydrophila
yang Diisolasi dari Lele Dumbo (Clarias Gariepinus) yang Berasal dari Boyolali. Journal of Aquaculture Management and Technology. Volume 3, Nomor 2. 11-17
Yogananth, R. Bhakyaraj, A. Chanturu, T. Anbalagan and K. M. Nila. 2009. Detection of Virulence Gene in Aeromonas hydrophila Isolated from Fish Samples Using PCR Technique. J. Glob. Biotech. 4(1): 51-53.
Winarni, E.T. 2014. Potensi Spirulina platensis Dalam Meningktakan Kekebalan Tubuh Ikan Air Tawar. Fakultas Biologi Universitas Jendral Soedirman. Puworkerto. 7 hal.
Lampiran 1. Perhitungan Dosis Ekstrak Spirulina Platensis
Sebanyak 100% infusum platensis mengandung 50% bahan kering Spirulina platensis. Penentuan dosis berdasarkan pada penelitian Tayag et al., (2010) yaitu 200mg/l, 400mg/l, dan 600 mg/l. Perhitungan untuk perlakuan dalam 5 liter air Akuarium diantaranya
Lampiran 2. Metode Pengambilan Darah Ikan gurame .
Pengambilan darah ikan dengan memposisikan jarum pada garis tengah tubuh belakang sirip anal kemudian masukkan jarum kedalam musculus hingga mencapai tulang belakang (columna spinalis). Kemudian ditarik perlahan-lahan sampai darah masuk ke dalam spuit.
Pertama sediakan spuit lengkap dengan jarumnya
Lalu dilakukan Pengambilan larutan heparin sampai memenuhi dinding
syringe dan disisakan sebanyak ± 50µl
Dalam pengambilan darah ikan. Pastikan tidak terdapat
Lampiran 3. Pemeriksaan Jumlah Sel Leukosit
Perhitungan jumlah sel seukosit menggunakan mikroskop dengan pembesaran 10x (lensa obyektif). Hitung leukosit di 4 kotak (berwarna hijau) yang terletak pada keempat sudut kamar hitung, seperti pada gambar di bawah ini:
Pengenceran darah menggunakan larutan Dacies dengan
perbandingan 1:50
Setelah itu darah dicampur dengan
Lampiran 4. Pemeriksaan Hitung Jenis Sel Leukosit
Perhitungan ini dilakukan terus-menerus sampai 100 sel leukosit terhitung menurut jenisnya dengan menggunakan alat Blood Cell Counter.
Satu tetes sampel darah diletakkan pada slide
Setelah itu buat hapusan darah yang tipis
Setelah hapusan darah kering, dilakukan pengecatan Giemsa pada hapusan darah yang telah difiksasi dengan metanol 95%
selama 1-2 menit
Lampiran 5. Data Jumlah Leukosit Ikan gurame
Perlakuan N Jumlah Leukosit = N x 50 (sel/mm3)
P0(-) 1 192 9600
P0(-) 2 199 9950
P0(-) 3 160 8000
P0(-) 4 182 9100
P0(+) 1 542 27100
P0(+) 2 459 22950
P0(+) 3 705 35250
P0(+) 4 631 31550
P1 1 275 13750
P1 2 243 12150
P1 3 233 11650
P1 4 199 9950
P2 1 279 13950
P2 2 248 12400
P2 3 250 12500
P2 4 253 12650
P3 1 285 14250
P3 2 278 13900
P3 3 266 13300
Lampiran 6. Data Jenis Leukosit Ikan gurame
Hasil Pemeriksaan Jenis Leukosit dalam bentuk persentase (Relatif)
Perlakuan Jenis Leukosit (%)
Neutrofil Eosinofil Basofil Limfosit Monosit
Lampiran 7 Hasil Pemeriksaan Jenis Leukosit dalam bentuk Absolut
Perlakuan
Jenis Leukosit (sel/mm3)
Lampiran 8. Analisa Statistik Jumlah Leukosit
ANOVA
Jumlah leukosit dalam satuan sel/mm3
Sum of Squares df Mean Square F Sig.
Between Groups 1002085750.000 4 250521437.500 38.563 .000 Within Groups 97446250.000 15 6496416.667
Total 1099532000.000 19
Dalam bentuk persentase Leukosit
Duncana
Kelompok N Subset for alpha = 0.05
1 2 3
P0(-) 4 9162.50
P1 4 11875.00 11875.00
P2 4 12875.00 12875.00
P3 4 13975.00
P0(+) 4 29212.50
Sig.
.068 .286 1.000
Means for groups in homogeneous subsets are displayed.
Lampiran 9. Analisa Statistik Jenis Leukosit
Means for groups in homogeneous subsets are displayed.
Eosinofil
ANOVA Dalam bentuk persentase
Sum of Squares df Mean Square F Sig.
Between Groups 12.300 4 3.075 5.591 .006
Within Groups 8.250 15 .550
Total
20.550 19
Dalam bentuk persentase Eosinofil
Duncana
Kelompok N Subset for alpha = 0.05
1 2
P3 4 1.50
P2 4 1.75
P1 4 2.25
P0(-) 4 2.50
P0(+) 4 3.75
Sig.
.098 1.000
Means for groups in homogeneous subsets are displayed.
Basofil
Means for groups in homogeneous subsets are displayed.
Limfosit
Means for groups in homogeneous subsets are displayed.
Monosit
ANOVA Dalam bentuk persentase
Sum of Squares df Mean Square F Sig.
Between Groups
322.300 4 80.575 7.925 .001
Within Groups
152.500 15 10.167
Total 474.800 19
Dalam bentuk persentase Monosit
Duncana
Kelompok N Subset for alpha = 0.05
1 2 3
P0(+) 4 5.50
P0(-) 4 9.25 9.25
P1 4 12.00
P2 4 14.00 14.00
P3 4 17.25
Sig.
.117 .063 .170
Means for groups in homogeneous subsets are displayed.
Lampiran 10 Gambar Penelitian
ember yang berisi ikan gurame
Pembuatan ekstrak air panas Evaporasi dengan freeze dryer. Spirulina platensis.
perendaman ikan gurame dengan ekstrak Spirulina platensis
pengambilan darah ikan gurame 200 mg/l
400 mg/l