i SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Ni Nyoman Manik Uliani NIM : 068114091
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PERBANDINGAN DAYA ANTIOKSIDAN SARI SAWI CAISIM (Brassica rapa subsp.parachinensis) DENGAN SARI SAWI PAKCOY (Brassica rapa subsp.chinensis) SECARA IN VITRO MENGGUNAKAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Ni Nyoman Manik Uliani NIM : 068114091
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
$
%
& # #
#
'
(
)
#
# * ' ' + % ' +
* %*
' '
,
- *
' '
' *)))
#
#
#
# !
#
# !
#
# #
!
#
))))))
! # # #(# # # !
## !
$ . $ #
!
(
#
# #
#
# !
vii
penulis dapat menyelesaikan skripsi yang berjudul ” Perbandingan Daya Antioksidan Sari Sawi Caisim (Brassica rapa subsp.parachinensis) dengan Sari Sawi Pakcoy (Brassica rapa subsp.chinensis) Secara In Vitro Menggunakan Metode DPPH” sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Selama perkuliahan, penelitian, dan penyusunan skripsi ini, penulis telah banyak mendapat bantuan dari berbagai pihak berupa bimbingan, nasehat, dorongan, pengarahan, kritik, saran, dan sarana. Pada kesempatan ini penulis ingin menyampaikan penghargaan dan ucapan terima kasih kepada :
1. Yohanes Dwiatmaka, M.Si, selaku dosen pembimbing yang telah menyediakan waktu dan tenaga untuk mengarahkan dan memberikan saran dalam penyusunan skripsi ini.
2. Lucia Wiwid Wijayanti, M.Si. selaku dosen pembimbing yang telah menyediakan waktu dan tenaga untuk mengarahkan dan memberikan saran dalam penyusunan skripsi ini.
3. Erna Tri Wulandari, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik dan sarannya untuk skripsi ini.
viii
5. Prof. Dr. Sri Noegrohati, Apt., Dr. Pudjono, SU., Apt, Jeffry Julianus, M.Si., atas waktu dan diskusinya kepada penulis untuk penyelesaian skripsi ini. 6. Bapak, Ibu, bli odik, bli ade, ketut adikku, dan Mbok Erna, untuk kasih
sayang dan perhatiannya.
7. Gesi, teman seperjuanganku, terimakasih untuk kebersamaan yang penuh suka dan duka.
8. Para laboran yang telah banyak membantu dalam menjalankan penelitian. 9. Sahabat-sahabatku di Bali: Ana, Intan, Ami, Indah, Ika, Diara, anak-anak
Tribal, buat semangat dan doa yang diberikan selama ini di tengah kesibukan masing-masing.
10.Teman-teman di kelas FKK: Vero, Mei, Ana, Reni, Chibi, Pok Atik, Valida, Ayu, Ari, dan semua yang tidak bisa disebutkan satu-satu, untuk pengalaman tak terlupakan, disaat sibuk membuat tugas dan laporan maupun disaat menyenangkan yang penuh canda.
11.Saudara-saudara KKNku, Endy, Riri, Wulan, Theo, Keke, Yuni, Kaka, Acid, terima kasih untuk waktu sejenak yang amat berarti.
12.Saudara-saudara perantauan di kost Putri Puri Sekar Negari, yang masih ada maupun yang sudah melanjutkan hidup masing-masing, serta Bapak dan Ibu kost, untuk banyak pelajaran hidup yang berharga.
13.Nyame KMHD, terima kasih untuk rasa kekeluargaannya di negeri rantau. 14.Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah
ix perkembangan ilmu pengetahuan.
Yogyakarta, 2009
xi
radikal bebas yang dikenal dengan istilah antioksidan. Berbagai antioksidan telah terdapat secara alamiah di alam terutama dalam sayuran dan buah-buahan. Sawi merupakan salah satu jenis sayuran yang sering dijumpai di masyarakat dan secara umum mengandung vitamin C, E, dan beta karoten yang diketahui merupakan antioksidan.
Terdapat berbagai “varietas” sawi antara lain sawi caisim (Brassica rapa subsp.parachinensis) dan sawi pakcoy (Brassica rapa subsp.chinensis). Perbedaan “varietas” dapat memungkinkan adanya perbedaan daya antioksidan yang dimiliki. Penelitian ini bertujuan untuk membandingkan daya antioksidan antara sari sawi caisim dan sari sawi pakcoy secara in vitro dengan menggunakan metode DPPH (2,2-diphenyl-1-picrylhydrazyl). Penetapan aktivitas antioksidan dilakukan dengan mengukur penurunan serapan DPPH karena pemberian berbagai konsentrasi sari sawi caisim dan sari sawi pakcoy. Efektivitas penangkapan radikal bebas sebesar 50 % (IC50) ditentukan dengan menggunakan persamaan regresi linier antara konsentrasi sari sawi (x) dengan % inhibisi (y).
Hasil penelitian menunjukkan bahwa sari sawi caisim memiliki aktivitas antioksidan lebih besar yang ditunjukkan oleh nilai IC50 sebesar 5,226 mg/ml sedangkan sari sawi pakcoy memiliki IC50 sebesar 8,148 mg/ml. Melalui uji statistik diketahui nilai IC50 keduanya berbeda bermakna.
xii ABSTRACT
Free radical is an atom or molecule which has unpaired electron that potentially destroy the important cells in the body. A compound which can prevent the negative effect of free radical called antioxidant is needed. Many kinds of antioxidant are available in the nature such as in vegetables and fruits. Mustard is one kind of vegetables which is often see and generally contains vitamin C, E, and beta carothene which known has potentially compound as antioxidant.
There are many kinds of mustard for example caisim (Brassica rapa subsp.parachinensis) and pakcoy (Brassica rapa subsp.chinensis). The difference of variety may cause different capacity of the antioxidant. This research is aimed to compare the antioxidant capacity of caisim essence and pakcoy essence in vitro using DPPH (2,2-diphenyl-1-picrylhydrazyl) method. The determination of antioxidant activity through measuring DPPH absorption by giving various concentrations of caisim essence and pakcoy essence. The free radical suizure activity parameter from antioxidant compound which are used IC50. The 50% (IC50) free radical seizure effectivitier is determined using liner regression equality between caisim essence concentration (x) with % inhibisi (y).
The results showed that caisim has more antioxidant activity shown by the IC50 value of 5,226 mg/ml while pakcoy has IC50 of 8,148 mg/ml. Through statistical tests it is known that the IC50 between them is different and significant.
xiii
HALAMAN JUDUL………..……..………... ii
HALAMAN PERSETUJUAN PEMBIMBING……….…………...iii
HALAMAN PENGESAHAN……….………...…..iv
HALAMAN PERSEMBAHAN……….………….……...v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS…………...………...vi
KATA PENGANTAR...vii
PERNYATAAN KEASLIAN KARYA...x
INTISARI...xi
ABSTRACT ...xii
DAFTAR ISI...xiii
DAFTAR GAMBAR...xiv
DAFTAR TABEL...xv
DAFTAR LAMPIRAN………..…xvi
BAB I. PENGANTAR...1
A. Latar Belakang...1
B. Perumusan Masalah...5
C. Keaslian Penelitian...5
xiv
1. Manfaat teoritis...6
2. Manfaat praktis...6
E. Tujuan Penelitian...6
BAB II. PENELAAHAN PUSTAKA...7
A. Uraian sawi caisim dan sawi pakcoy ...7
1. Morfologi...7
2. Ekologi dan penyebaran...8
3. Kandungan kimia dan pemanfaatan sawi ...8
B. Radikal Bebas……….10
1. Pengertian...10
2. Pembentukan radikal bebas………..………...…10
3. Metode untuk mendeteksi………..………...…..12
C. Antioksidan……….…………...……13
1. Pengertian dan fungsi antioksidan………..……..13
2. Mekanisme………..……..14
D. Metode DPPH (2,2-diphenyl-1-picrylhydrazyl) ….….…………..……...15
E. Spektrofotometri Visibel...16
F. Landasan Teori………...20
G. Hipotesis………...21
BAB III. METODOLOGI PENELITIAN...22
A. Jenis Rancangan Penelitian...22
xv
2. Alat...24
E. Tata Cara Penelitian...24
1. Pengambilan sampel………...24
2. Penyiapan bahan uji………... 24
i. Pembersihan dan Sortasi Basah ………...24
ii. Persiapan uji penangkapan radikal DPPH.... ...24
3. Pengujian dengan metode DPPH………..25
i. Penentuan operating time……….…....………25
ii. Penentuan panjang gelombang maksimum ...26
iii. Pembuatan larutan kontrol…..………..………..26
iv. Uji penangkapan radikal bebas sawi caisim dan sawi pakcoy………...26
F. Analisis Data...27
BAB IV. PEMBAHASAN...28
A.Hasil Pengumpulan Bahan………..28
B.Hasil Pembuatan Sari Sawi Caisim dan Sawi Pakcoy...29
C.Optimasi Metode DPPH………...………….………..32
1. Penentuan Operating Time………...33
xvi
D.Hasil Penentuan Aktivitas Antioksidan dengan Metode DPPH…….……36
BAB V. KESIMPULAN DAN SARAN...44
A. Kesimpulan...44
B. Saran...44
DAFTAR PUSTAKA...45
LAMPIRAN...50
xvii
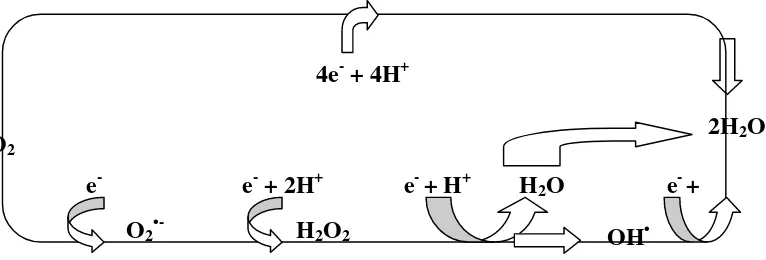
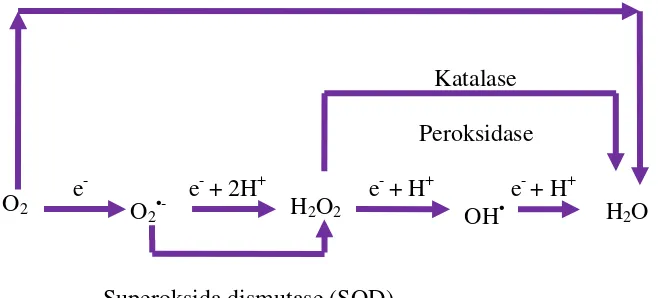
Gambar 1. Sawi pakcoy (a) dan sawi caisim (b)...8 Gambar 2. Produksi radikal bebas pada reaksi reduksi oksigen menjadi air...10 Gambar 3. Mekanisme enzim menetralkan pembentukan atau efek radikal bebas
selama proses metabolisme normal dalam tubuh...14 Gambar 4. Reaksi penghambatan antioksidan primer terhadap radikal lipida...15 Gambar 5. Instrumen spektrofotometer...19 Gambar 6. Pengendapan senyawa penyusun dinding sel
(selulosa, protein, dan pektin)……….……….…..32 Gambar 7. Spektra Operating Time...34 Gambar 8. Spektra panjang gelombang maksimum DPPH pada tiga konsentrasi
berbeda………...36 Gambar 9. Donasi proton dari antioksidan ke radikal DPPH ………..…..39 Gambar 10. Penurunan intensitas warna DPPH pada pemberian berbagai
xviii
DAFTAR TABEL
Halaman
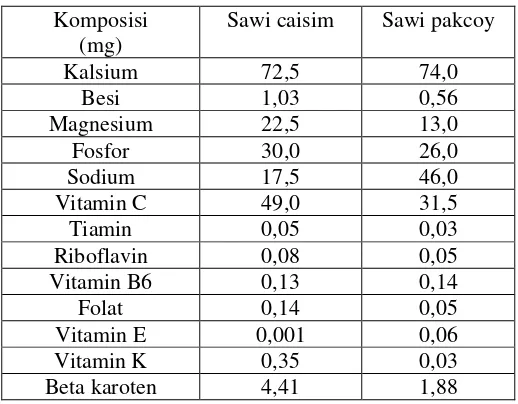
Tabel 1. Komposisi sawi caisim dan sawi pakcoy...3
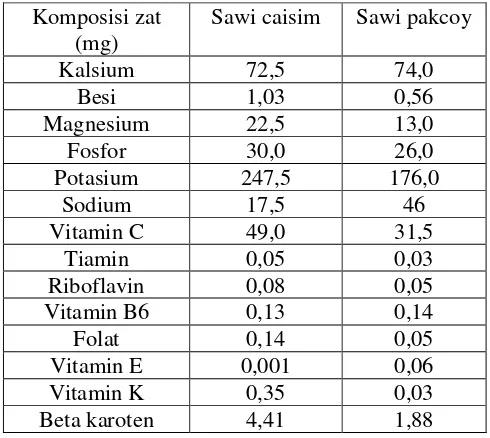
Tabel 2. Komposisi sawi caisim dan sawi pakcoy...9
Tabel 3. Kekuatan antioksidan dengan metode DPPH……...………...……….…..16
Tabel 4. Volume sari caisim dan sawi pakcoy...31
Tabel 5. Data penurunan absorbansi DPPH pada penambahan berbagai konsentrasi sari caisim……….……….37
Tabel 5. Data penurunan absorbansi DPPH pada penambahan berbagai konsentrasi sari pakcoy………..…..……..38
xix
Lampiran 2. Foto Juice Extractor...51
Lampiran 3. Data Penimbangan Bahan...52
Lampiran 4. Data Perolehan Sari Sawi ...54
Lampiran 5. Data Perhitungan Konsentrasi DPPH dan Sari Sampel...55
Lampiran 6. Perhitungan Konsentrasi DPPH Pada Penetapan Operating Time (OT) dan Panjang Gelombang Maksimum...57
Lampiran 7. Scanning Operating Time (OT)...58
Lampiran 8. Scanning Sari Sawi Pada Panjang Gelombang 400-600 nm...60
Lampiran 9. Scanning Metanol Pada Panjang Gelombang 400-600 nm...62
Lampran 10. Uji Penangkapan Radikal Bebas...63
1 BAB I
PENGANTAR
A. Latar Belakang
Pada saat ini dengan adanya kemajuan teknologi di segala bidang dan
berubahnya pola hidup masyarakat terutama pola makan dan kebiasaan buruk seperti
merokok menyebabkan tubuh semakin rentan terserang penyakit yang berhubungan
dengan radikal bebas. Radikal bebas adalah atom atau molekul yang mempunyai
elektron yang tidak berpasangan pada orbital terluarnya (Husaeni, 1991; Langseth,
1995; Vaya dan Aviram, 2001; Bagchi dan Puri, 1998). Secara kimia, radikal bebas
yang tidak berpasangan ini cenderung dapat bereaksi dan menyerang molekul stabil
yang terdekat dan mengambil elektron. Zat yang terambil elektronnya juga akan
menjadi radikal bebas sehingga akan memulai suatu reaksi berantai yang akhirnya
menimbulkan senyawa tidak normal (Wijaya, 1996; Percival, 1998; dan Winarsi,
2007).
Menurut Wijaya (1996) dan Padayatty, dkk. (2003), radikal bebas dapat
menimbulkan perubahan kimiawi dan merusak berbagai komponen sel hidup seperti
protein, lipid, dan nukleotida. Kerusakan sel-sel tersebut dapat menumpuk selama
bertahun-tahun sehingga timbul penyakit-penyakit yang disebabkan karena
ketidakmampuan sel untuk tetap hidup dan berfungsi normal. Beberapa radikal
radikal superoksida (O2•-), radikal nitrit oksida (NO•), dan radikal lemak peroksil
(LOO•) (Langseth, 1995; Vaya dan Aviram, 2001). Radikal hidroksil merupakan jenis
yang paling reaktif diantara berbagai jenis radikal bebas tersebut (Suyatna, 1989;
Gitawati, 1995; Halliwell dan Gutteridge, 1999).
Untuk mencegah efek negatif radikal bebas terhadap tubuh diperlukan
senyawa yang disebut antioksidan. Antioksidan memiliki kemampuan memberikan
elektron, mengikat dan mengakhiri reaksi berantai radikal bebas (Rohdiana, 2001;
Vaya dan Aviram, 2001; Meronda, 2008). Secara alami, tubuh mampu menghasilkan
antioksidan namun ada batasannya, tidak semua radikal bebas mampu untuk
dinetralisasi. Jika jumlah radikal bebas melebihi kapasitas kemampuan netralisasi
antioksidan maka terjadilah kerusakan atau disebut dengan stres oksidatif (Trilaksani,
2003). Antioksidan eksternal diperlukan untuk membantu kerja antioksidan internal
yang dihasilkan dalam tubuh. Berbagai antioksidan eksternal telah terdapat secara
alamiah di alam terutama dalam sayur-sayuran dan buah buahan (Booth, Cao,
Sadowski, dan Prior, 1998; Percival, 1998; Yee, Ikram, Jalil, dan Ismail, 2007).
Percival (1998), Tuminah (1999), dan Koswara (2004) menyampaikan bahwa
masyarakat yang mengkonsumsi banyak sayur dan buah ternyata lebih sehat dengan
risiko yang rendah terkena penyakit degeneratif termasuk kanker.
Sawi merupakan salah satu jenis sayuran yang digemari di Indonesia.
Konsumennya mulai dari golongan masyarakat kelas bawah hingga atas. Di Indonesia
sendiri banyak jenis masakan yang menggunakan sayur sawi, baik sebagai bahan
3
Menurut Dwiari (2008) dan Ide (2006), di dalam sawi terdapat vitamin E, vitamin C
dan beta karoten yang diketahui berperan sebagai antioksidan. Dapat disimpulkan
bahwa selain nikmat dikonsumsi sawi juga memiliki efek yang baik bagi kesehatan.
Sawi caisim atau sawi bakso merupakan “varietas” sawi yang paling banyak
dijual di pasaran (Margiyanto, 2008). Sawi pakcoy juga merupakan salah satu
”varietas” sawi yang akhir-akhir ini mulai dibudidayakan di Indonesia. Baik sawi
caisim maupun sawi pakcoy memiliki rasa yang tidak jauh berbeda (Haryanto,
Suhartini, dan Rahayu, 2006), namun karena adanya perbedaan “varietas”
memungkinkan besar komposisi zatnya juga berbeda sehingga berpengaruh pada
khasiat yang dimiliki. Seperti yang disampaikan Jegtvig (2004), terdapat perbedaan
besar komposisi zat yang terkandung pada sawi caisim dan sawi pakcoy (Tabel 1).
Tabel I. Komposisi sawi caisim dan sawi pakcoy
Komposisi (mg)
Berdasarkan perbedaan besarnya komposisi zat tersebut maka memungkinan
daya antioksidan yang dimiliki oleh sawi caisim dan sawi pakcoy juga berbeda. Oleh
karena itu dilakukan penelitian untuk mengetahui perbandingan daya antioksidannya.
Diharapkan nantinya masyarakat dapat mengetahui ada atau tidaknya perbedaan
antioksidan antara sawi caisim dan sawi pakcoy sehingga dapat dijadikan
pertimbangan pemilihan dalam mengkonsumsi. Penelitian ini difokuskan hanya untuk
menguji daya antioksidan masing-masing sari sawi caisim dan sawi pakcoy, tidak
dilakukan uji kualitatif maupun pemisahan senyawa tunggal yang bertanggung jawab
sebagai antioksidan.
Metode yang digunakan untuk mengukur aktivitas antioksidan sari sawi
caisim dan sari sawi pakcoy ini adalah metode DPPH (
2,2-diphenyl-1-picrylhydrazyl). Dipilih metode ini karena akurat dalam mengukur aktivitas
antioksidan pada buah dan ekstrak sayur (Antolovich cit Kwok, 2003) dan relatif
sederhana (Hanani, 2005). Prinsip metode ini didasarkan pada kemampuan suatu antioksidan untuk mengurangi intensitas warna ungu radikal DPPH. Dalam metode
DPPH, penangkapan radikal DPPH oleh suatu senyawa antioksidan diikuti dengan
penurunan absorbansi yang terjadi pada panjang gelombang 515 nm sebagai akibat
direduksinya radikal tersebut oleh antioksidan (Pokorny, Yanishlieva, Gordon, 2001).
Aktivitas antioksidan dinyatakan dengan IC50 ( Inhibitor Concentration 50 ) yaitu
5
B. Perumusan Masalah
1. Apakah sari sawi caisim dan sawi pakcoy memiliki aktivitas sebagai
antioksidan yang terukur dengan metode DPPH?
2. Bagaimanakah perbandingan daya antioksidan sari sawi caisim dengan
sari sawi pakcoy menggunakan metode DPPH yang dinyatakan sebagai
IC50(Inhibitor Concentration 50)?
C. Keaslian Karya
Sejauh pengetahuan penulis, penelitian tentang potensi antioksidan sawi telah
dilakukan, diantaranya:
a. Effects of Nitrogen and Sulfur on Total Phenolics and Antioxidant Activity in Two
Genotypes of Leaf Mustard oleh Li, Zhu, dan Gerendas (2008).
b. In Vitro and In Vivo Antioxidant Effects of Mustard leaf (Brassica juncea) oleh
Kim, Yokozawa, Cho, Cheigh, Choi, dan Chung (2003).
Perbedaan dengan penelitian sebelumnya adalah bahwa pada penelitian ini akan
dilakukan uji daya antioksidan pada “varietas” sawi yang berbeda yaitu Sawi Caisim
(Brassica rapa sups. parachinensis) dan Sawi Pakcoy (Brassica rapa
D. Manfaat Penelitian
1. Manfaat teoritis
Mengetahui perbandingan daya antioksidan sari sawi caisim dan
sari sawi pakcoy dengan metode DPPH yang dinyatakan dengan IC50
(Inhibitor Concentration 50).
2. Manfaat Praktis
Penelitian ini dapat memberikan informasi tentang daya
antioksidan sawi caisim dan sawi pakcoy sehingga nantinya dapat
dijadikan pertimbangan pemilihan dalam mengkonsumsi oleh masyarakat.
E. Tujuan Penelitian
1. Mengetahui adanya aktivitas antioksidan pada sari sawi caisim dan sari
sawi pakcoy dengan menggunakan metode DPPH.
2. Mengetahui perbandingan daya antioksidan sari sawi caisim dengan sari
sawi pakcoy menggunakan metode DPPH yang dinyatakan sebagai IC50
7
BAB II
PENELAAHAN PUSTAKA
A. Sawi Caisim dan Sawi Pakcoy
1. Morfologi
Secara umum sawi memiliki daun yang lonjong, halus, dan tidak berbulu (Ide,
2006), sedangkan sistem perakarannya yaitu memiliki akar tunggang dan
cabang-cabang akar yang bentuknya bulat panjang serta silindris menyebar ke semua arah
(Rukmana, 1994). Sawi caisim (Brassica rapa subsp.parachinensis) dan sawi pakcoy
(Brassica rapa subsp.chinensis) merupakan salah satu subspesies sawi. Keduanya
termasuk familia Brassicaceae (suku sawi-sawian). Secara morfologi sawi caisim dan
sawi pakcoy bisa dibedakan dengan jelas (Gambar 1). Sawi pakcoy mempunyai daun
tangkai yang lebar, kokoh, dan tanamannya lebih pendek daripada sawi caisim
(Haryanto, dkk., 2006), sedangkan sawi caisim memiliki tangkai daun
memanjang tipis dan lansing (Ide, 2006).
Ditambahkan Yamaguchi dan Rubatzky (1997), sawi pakcoy umumnya
memiliki tinggi maksimum hanya 15-30 cm sedangkan sawi caisim dapat
mencapai tinggi 20-60 cm setelah berumur 5-6 minggu. Walaupun secara morfologi
keduanya berbeda, dari segi rasa baik sawi pakcoy maupun sawi caisim memiliki rasa
(a) (b)
Gambar 1. Sawi pakcoy (a) dan sawi caisim (b)
2. Ekologi dan penyebaran
Pada mulanya sawi diduga berasal dari Cina dan Asia timur lalu menyebar ke belahan dunia lain termasuk ke Indonesia (Rukmana, 1994). Indonesia mempunyai kecocokan terhadap iklim, cuaca, dan tanahnya sehingga sawi dapat dikembangkan hingga sekarang. Sawi dapat ditanam di dataran tinggi maupun di dataran rendah, namun umumnya diusahakan di dataran rendah yaitu di pekarangan, di ladang, atau di sawah. Sawi merupakan tanaman sayuran yang tahan terhadap hujan sehingga dapat ditanam sepanjang tahun, namun pada saat musim kemarau perlu disediakan air yang cukup untuk penyiraman (Margiyanto, 2008). Tanah yang cocok untuk ditanami sawi adalah tanah gembur, banyak mengandung humus, subur, serta pengairannya baik.
3. Kandungan kimia dan pemanfaatan sawi
9
Tabel II. Komposisi zat sawi caisim dan sawi pakcoy
Komposisi zat (mg)
Sawi caisim Sawi pakcoy
Kalsium 72,5 74,0
B. Radikal Bebas 1. Pengertian
Menurut Gitawati (1995), Tilarso (2003), dan Hadi (2009), radikal bebas
adalah atom atau molekul yang memiliki elektron tidak berpasangan sehingga
menjadi komponen yang tidak stabil dan sangat reaktif. Karena sifat reaktifnya ini
radikal bebas berpotensi merusak dinding sel yang terdiri dari lemak dan juga
merusak protein sel dan DNA (Suyatna, 1989; Harnita, 2002). Beberapa jenis
radikal bebas yang terdapat pada makhluk hidup antara lain radikal hidroksil
(OH•), radikal superoksid (O2•-), radikal nitrit oksida (NO•), dan radikal lemak
peroksil (LOO•) ( Langseth, 1995; Bagchi dan Puri, 1998). Diantara jenis radikal
bebas, radikal hidroksil merupakan jenis yang paling reaktif dan bereaksi sangat
cepat dengan hampir semua tipe molekul dalam sel hidup (Halliwell dan
Gutteridge, 1999).
2. Pembentukan radikal bebas
Radikal bebas dapat dihasilkan dari metabolisme normal tubuh. Salah
satunya adalah menjadi produk antara pada proses reduksi oksigen menjadi air
(Gambar 2).
11
Dalam proses reduksi oksigen menjadi air akan terbentuk radikal bebas
sebagai produk antara atau intermedier namun kemungkinannya hanya 5 % dari
keseluruhan proses. Jika menerima 1 elektron pertama akan terbentuk O2
•-(superoksida). Setelah menerima elektron kedua akan terbentuk H2O2. Hidrogen
peroksida (H2O2) juga dapat terbentuk bila terdapat ion-ion logam (seperti Fe2+)
melalui reaksi Fenton. Selanjutnya apabila menerima 1 elektron lagi maka akan
terbentuk radikal hidroksil (OH•) (Suyatna, 1989; Lautan, 1997).
Adanya radikal bebas yang bersifat reaktif dan dapat menyerang molekul
stabil terdekatnya ini dapat menyebabkan kerusakan berbagai komponen sel hidup
antara lain:
a) Asam lemak, terutama asam lemak tidak jenuh jamak atau PUFA (Poly Unsaturated Fatty Acid) yang merupakan komponen penting fosfolipid
penyusun membran sel.
b) DNA, terkait dengan genetik.
c) Protein, yang memegang peranan penting sebagai enzim, reseptor, dan
antibodi (Wijaya, 1996).
Keberadaan radikal bebas dalam tubuh tidak selalu berbahaya. Sel darah
putih mengeluarkan radikal bebas untuk menghancurkan dan melawan mikroba
patogen dan merupakan bagian dari sistem pertahanan tubuh terhadap serangan
penyakit (Bagchi dan Puri, 1998). Komponen yang berperan di dalamnya adalah
NADPH oksidase dan sitokrom tipe b. Adanya pengaruh oksidase dan sitokrom
tersebut menyebabkan terbentuknya superoksida (O2•-) akibat direduksinya
atau ke dalam fagolisosom dan bersama-sama dengan protein dan beberapa derivat
oksigen lain akan berperan sebagai bakterisida (Lautan, 1997).
3.Metode untuk mendeteksi
Untuk mendeteksi radikal bebas terdapat beberapa metode yang bisa digunakan,
antara lain:
a) Pengujian dengan cara mengukur penangkapan radikal sintetik seperti
DPPH dalam pelarut organik polar (metanol atau etanol) pada suhu kamar.
Penangkapan radikal DPPH oleh suatu senyawa diikuti dengan penurunan
absorbansi pada 515 nm.
b) Pengujian aktivitas antioksidan dengan sistem linoleat-tiosianat. Asam
linoleat merupakan asam lemak tidak jenuh dengan 2 buah ikatan rangkap yang
mudah mengalami oksidasi membentuk radikal peroksida. Senyawa antioksidan
akan berperan dalam mengkelat logam fero dan menangkap radikal peroksida.
c) Pengujian dengan asam tiobarbiturat atau TBA (Thio Barbituric Acid).
Pengujian ini berdasarkan adanya pembentukan radikal hidroksil yang
dihasilkan oleh pereaksi fenton, kemudian radikal ini akan mengoksidasi
deoksiribosa menjadi malonaldehid (MDA). MDA akan bereaksi dengan TBA
membentuk kromogen yang berwarna merah muda yang dapat diukur
aborbansinya dengan panjang gelombang 532 nm (Pokorny, dkk., 2001).
Ditambahkan Halliwell dan Gutteridge (1999) selain metode diatas terdapat juga
metode triptofan dan metode dimetilsulfoksida (DMSO). Triptofan akan bereaksi
13
dimetilsulfoksida (DMSO) radikal hidroksil bereaksi dengan dimetilsulfoksida
dimana produk perubahannya antara lain menghasilkan gas metan yang dapat
dideteksi dengan Gas Liquid Chromatograph.
B. Antioksidan 1. Pengertian dan jenis antioksidan
Antioksidan adalah senyawa yang memiliki kemampuan dalam memberikan
elektron, mengikat dan mengakhiri reaksi berantai radikal bebas (Rohdiana, 2001;
Vaya dan Aviram, 2001; Meronda, 2008). Secara garis besar menurut sumbernya,
antioksidan dapat dibedakan menjadi antioksidan internal dan antioksidan eksternal.
a. Antioksidan internal
Antioksidan internal yaitu antioksidan yang diproduksi oleh tubuh sendiri,
disebut pula sebagai antioksidan primer (Hadi, 2009). Sejumlah enzim dalam tubuh
dapat menetralkan radikal bebas antara lain, SOD (superoxide dismutase), katalase,
dan glutation peroksidase (Gambar 3). Enzim SOD berfungsi mempercepat reaksi
perubahan superoksida menjadi H2O2 yang kurang toksik sehingga tidak bereaksi
untuk menimbulkan efek atau radikal yang lebih reaktif. Enzim katalase yang
terdapat dalam peroksisom dan sitosol berfungsi menetralkan H2O2 menjadi O2 dan
H2O. Enzim lain yang berfungsi sama seperti katalase adalah glutation peroksidase
Katalase
Peroksidase
e- e-+ 2H+ e-+ H+ e-+ H+
Superoksida dismutase (SOD)
Gambar 3. Mekanisme enzim menetralkan pembentukan atau efek radikal bebas selama proses metabolisme normal dalam tubuh (Gitawati, 1995).
b) Antioksidan eksternal
Antioksidan eksternal disebut juga antioksidan enzimatis atau antioksidan
sekunder. Antioksidan eksternal tidak dihasilkan oleh tubuh tetapi berasal dari
makanan (Winarsi, 2007). Peningkatan jumlah radikal bebas yang terbentuk
menyebabkan sistem pertahanan tubuh yang ada tidak memadai lagi sehingga
tubuh memerlukan tambahan antioksidan dari luar yang dapat melindungi tubuh
dari serangan radikal bebas. Dengan adanya senyawa antioksidan tersebut maka
proses oksidasi yang berlebihan dapat dihambat (Halliwell dan Gutteridge 1999).
Contoh antioksidan eksternal yaitu beta karoten, vitamin C, vitamin E, selenium,
dan flavonoid (Prakash, Suri, Upadhyay, dan Singh, 2007).
2. Mekanisme
Antioksidan mampu menghambat reaksi oksidasi melalui mekanisme
penangkapan radikal dengan cara menyumbangkan atau melengkapi elektron yang
tidak berpasangan pada radikal bebas sehingga menghambat terjadinya reaksi
berantai dari pembentukan radikal bebas. Penambahan antioksidan (AH) primer
15
dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi
autooksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi
oksidasi pada tahap inisiasi maupun propagasi. Radikal-radikal antioksidan (A•)
yang terbentuk pada reaksi tersebut relatif stabil (Gordon, 1990).
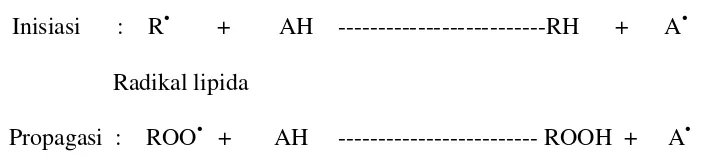
Inisiasi : R• + AH ---RH + A•
Radikal lipida
Propagasi : ROO• + AH --- ROOH + A•
Gambar 4. Reaksi Penghambatan antioksidan primer terhadap radikal lipida (Gordon 1990)
C. Metode DPPH (2,2-diphenyl-1-picrylhydrazyl)
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering
digunakan untuk mengetahui aktivitas antioksidan beberapa senyawa (Orhan,
Ergun, Yesilada, Tsuchiya, Takaishi, dan Kawazoe, 2007) . Metode DPPH dapat
digunakan untuk menguji aktivitas antioksidan dari senyawa dalam bentuk aslinya
ataupun dalam campuran (Vaya dan Aviram, 2001). Pengukuran aktivitas
antioksidan pada metode ini didasarkan pada kemampuan suatu antioksidan untuk
mengurangi intensitas warna ungu radikal DPPH. Interaksi antioksidan dengan
DPPH adalah dengan adanya donasi elektron atau atom hidrogen pada DPPH akan
menetralkan karakter radikal bebas dari DPPH. Jika semua elektron pada radikal
bebas DPPH menjadi berpasangan, maka warna larutan berubah dari ungu tua
menjadi kuning terang ( Molyneux, 2004). Absorbansi sampel diukur pada
menggunakan spektrofotometer visibel. Metode DPPH merupakan salah satu
metode yang akurat untuk mengukur aktivitas antioksidan pada buah dan ekstrak
sayur (AntolovichcitKwok, 2003).
Data absorbansi yang diperoleh pada pengukuran menggunakan
spektrofotometer visibel dibuat persamaan regresi linear yang menyatakan
hubungan antara konsentrasi bahan uji (x) dengan % inhibisi (y) dari suatu seri replikasi pengukuran. NilaiIC50yaitu konsentrasi bahan uji yang diperlukan untuk
menangkap 50% radikal DPPH dapat ditentukan menggunakan persamaan regresi
linear tersebut. Semakin kecil nilai IC50, semakin tinggi daya antioksidan suatu
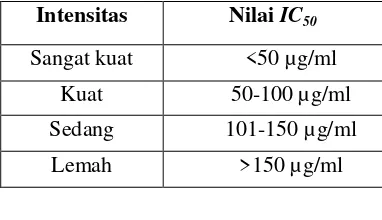
senyawa, demikian sebaliknya. Menurut Ariyanto cit Nusarini (2007), tingkat kekuatan antioksidan senyawa uji menggunakan metode DPPH dapat digolongkan
menurut nilaiIC50(Tabel 3) sebagai berikut :
Tabel III. Tingkat kekuatan antioksidan dengan metode DPPH Intensitas NilaiIC50
Spektrofotometri adalah suatu metode analisis yang berhubungan dengan
pengukuran absorbansi atau transmitansi yang dapat digunakan untuk analisis
kualitatif dan kuantitatif suatu bahan kimia (Khopkar, 1990). Pada analisis
17
dihasilkan dalam pelarut tertentu (Martono, 2007). Penggunaan untuk analisis
kuantitatif berkaitan dengan jumlah radiasi elektromagnetik yang diserap dengan
jumlah molekul penyerap, seperti yang terlihat pada Hukum Lambert-Beer
dibawah ini.
Io = intensitas radiasi yang datang It = intensitas radiasi yang
diteruskan
A = absorbansi molar b = tebal kuvet c = konsentrasi analit
(Mulja dan Suharman, 1995)
Spektrofotometri yang menggunakan radiasi dengan panjang gelombang
380 nm sampai 780 nm disebut spektrofotometri cahaya tampak (Anonim, 1995).
Menurut Fessenden dan Fessenden (1994), panjang gelombang cahaya tampak
bergantung pada mudahnya promosi elektron. Molekul yang memerlukan energi
lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang.
Senyawa yang menyerap cahaya dalam daerah tampak mempunyai elektron yang
lebih mudah dipromosikan daripada senyawa yang menyerap pada gelombang UV
yang lebih pendek.
Bila suatu molekul senyawa organik menyerap sinar tampak maka didalam
molekul tersebut terjadi perpindahan atau transisi elektron dari berbagai jenis
tingkat energi orbital dari molekul tersebut. Transisi yang mungkin terjadi pada
a. Transisi σ → σ*
Transisi jenis ini terjadi pada orbital ikatan sigma. Energi yang
dibutuhkan untuk transisi ini sangat besar.
b. Transisi n→ σ*
Jenis transisi ini terjadi pada orbital bukan ikatan (n). Energi
yang diperlukan untuk transisi ini lebih kecil dibandingkan dengan transisi σ → σ*
sehingga sinar yang diserap memiliki panjang
gelombang lebih besar dari 200 nm.
c. Transisi n→ π* dan π → π*
Jenis transisi ini memiliki absorbansi pada 200-700 nm
sehingga panjang gelombang ini secara teknis dapat diaplikasikan pada
spektrofotometer (Sastrohamidjojo, 1991).
Sebagai pelarut spektrofotometri dapat digunakan semua cairan yang dapat
melarutkan senyawa yang akan diuji serta yang tidak atau hanya sedikit
menunjukkan absorpsi sendiri. Pelarut yang biasanya digunakan adalah air,
metanol, asetonitril, sikloheksan, dan heksana (Roth, 1994). Suatu medium
tampak berwarna oleh pengamat karena adanya pengaruh cahaya yang diserap dan
dipantulkan. Cahaya yang berisi seluruh spektrum sebagian akan diserap oleh
medium tersebut namun ada juga yang dipantulkan atau diteruskan. Cahaya yang
diteruskan inilah yang tampak berwarna bagi pengamat (Sastrohamidjojo, 1991).
Spektrofotometer adalah alat yang digunakan untuk mengukur energi yang diserap oleh suatu molekul. Suatu spektrofotometer terdiri dari beberapa komponen penting penyusunnya, yaitu:
19
Sumber spektrum yang biasa digunakan adalah sumber spektrum tampak yang kontinyu, yaitu lampu tungsten.
2. Monokromator
Monokromator digunakan untuk memperoleh sumber sinar yang monokromatis (Mulja dan Suharman, 1995).
3. Tempat sampel 4. Detektor
Detektor adalah suatu alat untuk mengukur perbedaan absorbsi antara sampel dan blanko ataupun pembanding dengan cara merubah energi cahaya menjadi isyarat listrik. Isyarat listrik ini dapat dibaca dengan bantuanamplifier(Day dan Underwood , 1966).
E. Landasan Teori
Berkembangnya penyakit yang disebabkan oleh radikal bebas menyebabkan
semakin diperlukannya tambahan antioksidan dari luar. Sawi merupakan jenis
sayuran yang mengandung vitamin E, vitamin C, dan beta karoten yang merupakan
antioksidan alami sehingga berpotensi untuk mencegah efek buruk yang ditimbulkan
oleh radikal bebas. Sawi caisim dan sawi pakcoy merupakan salah satu “varietas”
sawi yang dijual di pasaran. Adanya perbedaan ”varietas” memungkinkan kandungan
zatnya juga berbeda sehingga berpengaruh pada besarnya khasiat yang dimiliki.
Jegtvig (2004) menyampaikan terdapat perbedaan besarnya komposisi zat sebagai
antioksidan alami yang terdapat pada 70 g sawi caisim dan sawi pakcoy yaitu vitamin
E, dan beta karoten. Pada sawi caisim terkandung sebesar 0,001 mg vitamin E dan
4,41 mg beta karoten, sedangkan pada sawi pakcoy terdapat 0,06 vitamin E dan 1,88
mg beta karoten.
Berdasarkan perbedaan besarnya komposisi zat tersebut, maka dilakukan
penelitian untuk mengetahui perbandingan daya antioksidan sawi caisim dan sawi
pakcoy. Diharapkan nantinya masyarakat dapat mengetahui ada atau tidaknya
perbedaan antioksidan antara sawi caisim dan sawi pakcoy sehingga dapat dijadikan
pertimbangan pemilihan dalam mengkonsumsi. Penelitian ini difokuskan hanya untuk
menguji daya antioksidan masing-masing sari sawi caisim dan sawi pakcoy, tidak
dilakukan uji kualitatif maupun pemisahan senyawa tunggal yang bertanggung jawab
21
Daya antioksidan sawi caisim dan sawi pakcoy dapat diukur dengan metode
DPPH (2,2-diphenyl-1-picrylhydrazyl). Metode ini akurat dalam mengukur aktivitas
antioksidan pada buah dan ekstrak sayur (Antolovich cit Kwok, 2003) dan relatif
sederhana (Hanani, 2005). Prinsip metode ini didasarkan pada kemampuan suatu
antioksidan untuk mengurangi intensitas warna ungu radikal DPPH pada panjang
gelombang 515 nm. Aktivitas antioksidan dinyatakan dengan IC50yaitu konsentrasi
bahan uji yang diperlukan untuk menangkap 50% radikal DPPH. Semakin kecil nilai
IC50 maka daya antioksidan yang dimiliki semakin besar, demikian sebaliknya
(Rohman dan Riyanto, 2005).
F. Hipotesis
Berdasarkan landasan teori diatas dapat dihipotesiskan bahwa antara sawi
pakcoy dan sawi caisim yang berbeda ‘varietas” memiliki aktivitas antioksidan yang
juga berbeda diukur dengan menggunakan metode DPPH yang dinyatakan dengan
22
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan menggunakan rancangan acak pola searah.
B. Variabel Penelitian
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah konsentrasi sari sawi caisim dan sari sawi pakcoy.
2. Variabel tergantung
Variabel tergantung adalah %inhibisi yaitu persen yang menyatakan kemampuan suatu senyawa dalam menangkap radikal bebas.
3. Variabel pengacau
Variabel pengacau pada penelitian ini ada dua jenis, yaitu :
a. Variabel pengacau terkendali, termasuk di dalamnya adalah umur sawi, bahan kimia, alat, dan waktu inkubasi yang digunakan dalam penelitian.
23
C. Definisi Operasional
1. Sari sawi caisim dan sawi pakcoy, diperoleh dengan menghancurkan daun
yang masih segar menggunakan juice extractor kemudian disaring
menggunakan penyaring vakum.
2. % inhibisi adalah persen yang menyatakan kemampuan suatu senyawa
dalam menangkap radikal bebas.
% inhibisi =
3. IC50, yaitu konsentrasi larutan sampel yang dibutuhkan untuk menangkap
50 % radikal bebas DPPH.
4. Larutan kontrol merupakan larutan yang terdiri dari 3,8 ml DPPH dan 0,2
ml metanol.
5. Larutan sampel merupakan larutan kontrol yang telah ditambah sari sawi
caisim maupun sari sawi pakcoy.
D. Bahan- bahan Penelitian
Bahan uji berupa sawi caisim dan sawi pakcoy, diperoleh dari petani sawi di
Perkebunan Tani Organik Merapi (TOM); 2,2-diphenyl-1-picrylhydrazyl (DPPH),
E. Alat- alat Penelitian
Spektrofotometer UV-Vis Perkin Elmer Lambda 20; timbangan SBC 22
(Scaltec) dan precision balance model GB-3002 (Mettler Toledo); mikropipet 50
µl-200 µl , 200-1000 µl (Socorex); tabung reaksi (Pyrex-Germany); flakon bertutup,
juice extractor; penyaring vakum, kipas angin, hair dryer, kertas aluminium foil, kain
tetron, dan alat-alat gelas yang lazim.
F. Tata Cara Penelitian
1. Pengambilan sampel
Sampel dibeli langsung dari petani sawi di Perkebunan Tani Organik Merapi
(TOM), Kaliurang, Yogyakarta. Pengambilan sawi caisim dan sawi pakcoy dilakukan
pada sore hari, di bulan Oktober. Dipilih yang berwarna hijau, masih segar, dan
masing-masing berumur sama yaitu 25 hari.
2. Penyiapan Bahan Uji
i. Pembersihan dan Sortasi Basah
Sawi caisim dan sawi pakcoy yang akan diteliti harus bebas dari
debu, kotoran, atau tanah. Oleh karena itu sawi caisim dan sawi pakcoy
dicuci dengan aquadest secara berulang-ulang kemudian ditiriskan.
Aquadest yang digunakan adalah aquadest yang dialirkan atau dituang.
ii. Persiapan uji penangkapan radikal DPPH
25
Sebanyak masing-masing 50 g sawi caisim dan sawi pakcoy
dihancurkan dengan juice extractor. Sari yang didapat kemudian
disaring menggunakan penyaring vakum dengan dilapisi kain
tetron. Dilakukan pengenceran sari dengan mengambil sebanyak
0,5 ml sari dan dimasukkan ke dalam labu ukur 10,0 ml kemudian
ditambahkan metanol hingga tanda. Dilakukan replikasi sebanyak
5x untuk masing-masing sampel yang dimulai dari tahap
penimbangan.
2. Pembuatan sari uji sawi caisim dan sawi pakcoy
Sari yang telah diencerkan digojog selama 30 detik dan
didiamkan 15 menit hingga terbentuk endapan dengan sempurna.
Dipipet cairan metanolik (bagian atas) sebanyak 100 µL, 300 µL,
500 µL, 700 µL, dan 900 µL dan ditambahkan lagi dengan metanol
hingga volume akhir 1,0 ml.
3. Pembuatan Larutan DPPH
Larutan DPPH (2,2-diphenyl-1-picrylhydrazyl) ditimbang
sebanyak 5,600 mg DPPH dan dilarutkan dengan metanol di dalam
labu ukur sampai 250,0 ml. Didapat larutan DPPH dengan
konsentrasi 56,70 µM.
3. Pengujian dengan Metode DPPH
Dipipet sebanyak 0,95 ml larutan DPPH dan ditambah metanol
hingga volume akhir 4,0 ml. Larutan dikocok selama 30 detik dan
dibiarkan selama 30 menit di tempat gelap (Soebagio, Rusdiana, dan
Risnawati, 2007) . Serapan kemudian diukur dengan spektrofotometer UV
- Vis pada panjang gelombang 515 nm selama 60 menit. Dilakukan juga
penentuan operating time sampel caisim dan sampel pakcoy dengan
memipet sebanyak 0,95 ml larutan DPPH dan 900 µL sari uji caisim dan
pakcoy lalu ditambah metanol hingga volume akhir 4,0 ml.
ii) Penentuan panjang gelombang maksimum
Dipipet sebanyak 0,95 ; 1,9 ; dan 3,8 ml larutan DPPH dan
ditambah metanol hingga volume akhir 4,0 ml. Larutan dikocok selama
30 detik kemudian dibiarkan selama 30 menit ditempat gelap. Serapan
larutan diukur dengan spektrofotometer UV-Vis pada panjang gelombang
400 - 600 nm.
iv) Pembuatan larutan kontrol
Dipipet sebanyak 0,2 ml metanol dan dimasukan ke dalam vial.
Ditambahkan 3,8 ml larutan DPPH 57,62 µM dan dikocok selama 30
detik. Setelah itu larutan dibiarkan selama 30 menit ditempat gelap,
serapan diukur dengan spektrofotometer UV - Vis pada panjang
gelombang 515 nm.
27
Masing-masing seri konsentrasi sari uji sawi diambil sebanyak 0,2
ml dan ditambah dengan 3,8 ml larutan DPPH 57,62 µM. Campuran
dikocok selama 30 detik dan dibiarkan selama 30 menit ditempat gelap,
serapan diukur dengan spektrofotometer visibel pada panjang gelombang
515 nm.
G. Analisis Data
Data yang diperoleh adalah absorbansi senyawa larutan DPPH yang berwarna
ungu dalam pelarut metanol. Besarnya aktivitas antioksidan dihitung dengan
menggunakan rumus :
Data absorbansi senyawa uji dan senyawa kontrol digunakan untuk
menghitung IC50, yaitu konsentrasi larutan sampel yang dibutuhkan untuk
menghambat 50 % radikal bebas DPPH dengan menggunakan persamaan garis
regresi linier antara masing-masing konsentrasi sari sawi caisim atau sari sawi pakcoy
(sumbu x) dengan % inhibisi (sumbu y).
Selanjutnya dilakukan uji statistika menggunakan uji T tidak berpasangan untuk
menentukan signifikansi perbedaan nilai IC50 sawi caisim dan sawi pakcoy yang
28 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Pengumpulan Bahan
Sawi caisim dan sawi pakcoy yang digunakan pada penelitian ini diperoleh
di perkebunan Tani Organik Merapi (TOM), Kaliurang, Yogyakarta. Sawi dipilih
yang masih segar dan diambil pada sore hari karena diperkirakan fotosintesis
sudah berlangsung sempurna. Hal ini sesuai dengan yang disampaikan oleh Albert
(2007) apabila fotosintesis sudah berlangsung sempurna maka diharapkan tersedia
energi yang optimal untuk menghasilkan metabolit, baik yang berguna untuk
tumbuhan sendiri ataupun dimanfaatkan oleh makhluk hidup lain.
Menurut Yamaguchi dan Rubatzky (2007) dan Syarifuddin (2008), faktor
lingkungan termasuk di dalamnya kondisi tanah, iklim, dan umur dapat
mempengaruhi kandungan zat pada tumbuhan. Berdasarkan hal tersebut maka
variabel pengacau tersebut harus dikendalikan untuk meminimalkan kesalahan
dalam analisis. Selain diperoleh di tempat penanaman yang sama, sawi caisim dan
sawi pakcoy yang diteliti juga memiliki umur dan cara penanaman yang sama.
Pada saat pengambilan sampel, umur sawi caisim dan sawi pakcoy adalah 25 hari.
Cara penanaman yang digunakan di tempat pengambilan sawi adalah secara
organik dengan kondisi tanah yang berpasir.
Identitas tanaman yang diteliti harus jelas untuk menghindari kesalahan
dalam analisis. Pada penelitian ini dapat dipastikan bahwa sampel yang digunakan
”varietas” sawi. Kebenaran identitas tanaman yaitu sawi caisim dan sawi pakcoy
diketahui dari ciri fisik, keterangan dari petani, dan kemasan bibit yang digunakan
(Lampiran 1).
B. Hasil Pembuatan Sari Sawi Caisim dan Sari Sawi Pakcoy
Bahan utama yang digunakan dalam penelitian adalah sari daun segar sawi
caisim dan sawi pakcoy. Penelitian ini tidak menggunakan simplisia kering karena
zat yang berpotensi sebagai antioksidan dikhawatirkan dapat terdegradasi selama
proses pengeringan. Baik simplisia segar maupun yang sudah dikeringkan apabila
disimpan terlalu lama kemungkinan zat yang terkandung di dalamnya akan hilang
atau rusak. Hal ini akan berakibat pada khasiat yang dimiliki. Lina (2008)
menyampaikan bahwa terjadi penurunan aktivitas antioksidan alga coklat
(Sargassum hystrix v. buxifolium (Chauvin) J. Agardh) akibat teroksidasinya folifenol florotanin selama masa penyimpanan. Berdasarkan hal tersebut maka
sawi yang digunakan pada penelitian ini adalah sawi segar dan baru dipetik. Ini
dilakukan untuk mencegah kemungkinan rusaknya zat yang berperan sebagai
antioksidan selama masa penyimpanan sehingga didapatkan daya antioksidan
sawi caisim dan sawi pakcoy yang optimal.
Tanaman sawi caisim dan pakcoy disortasi, dicuci hingga bersih
menggunakan aquadest yang dituang lalu dikeringkan dengan kipas angin hingga
air bekas cucian benar-benar hilang. Adanya air bekas cucian dapat
mempengaruhi jumlah sari yang didapat. Selanjutnya bagian yang digunakan dari
30
merupakan bagian yang umum dikonsumsi masyarakat. Daun sawi caisim dan
sawi pakcoy ditimbang seberat 50 g dan dilakukan replikasi sebanyak 5x.
Menurut Anonim (1986), proses pembebasan sari pada simplisia segar
dapat berjalan jika tidak ada dinding sel yang menghalangi, maka sawi yang sudah
ditimbang kemudian dibuat jus untuk memperoleh sarinya. Alat yang bisa
digunakan untuk membuat sari adalah juice extractor (Lampiran 2). Juice extractor mampu menghancurkan dinding sel pada simplisia segar dan
menghasilkan sari asli tanpa ampas sehingga tepat digunakan untuk memperoleh
keseluruhan sari yang terkandung didalam suatu bahan. Dalam pembebasan sari
sawi caisim dan sawi pakcoy ini tidak ditambahkan pelarut apapun karena
diharapkan yang didapat adalah murni sari caisim dan sawi pakcoy. Juice extractor yang digunakan dipastikan kering sebelum digunakan kembali. Pada
penelitian ini digunakanhair dryeruntuk mempercepat pengeringannya.
Sari yang diperoleh disaring menggunakan kain tetron untuk
menghilangkan serat atau ampas yang kemungkinan terbawa pada sari. Kain
tetron dipilih karena jenis kain ini hanya sedikit menyerap sari sawi pada saat
penyaringan sehingga volume sari yang didapat berkurang secara tidak signifikan
dan untuk mempercepat penyaringannya digunakan penyaring vakum. Terdapat
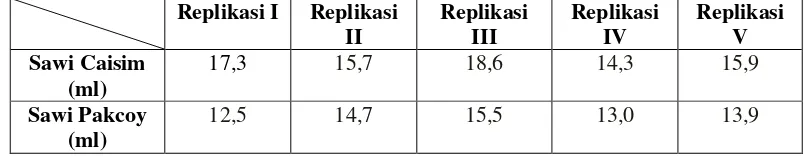
perbedaan perolehan sari pada sawi caisim dan sawi pakcoy (Tabel 4). Sari
diperoleh lebih banyak pada sawi casim daripada sawi pakcoy. Hal ini disebabkan
pada sawi pakcoy komponen dinding sel seperti pektin dan selulosa berkontribusi
Tabel IV. Volume sari caisim dan sawi pakcoy
17,3 15,7 18,6 14,3 15,9
Sawi Pakcoy (ml)
12,5 14,7 15,5 13,0 13,9
Sari yang didapat ini diasumsikan merupakan berat sawi sewaktu
penimbangan yaitu 50 g. Perhitungan ini berguna untuk menentukan konsentrasi
sari yang digunakan pada tahap selanjutnya. Pada penelitian ini sari awal atau sari
induk diencerkan terlebih dahulu agar sewaktu direaksikan dengan DPPH
memiliki absorbansi 0,2 - 0,8. Pengenceran dilakukan dengan memasukkan 0,5 ml
sari sawi pakcoy atau sari sawi caisim ke dalam labu ukur 10,0 ml kemudian
ditambahkan metanol hingga tanda. Sari yang sudah diencerkan ini selanjutnya
digunakan sebagai sari uji.
Pada saat penambahan metanol terbentuk 2 lapisan. Lapisan atas berupa
cairan dan lapisan bawah yang berupa endapan. Bagian yang selanjutnya
digunakan pada penelitian ini adalah pada bagian atas (Gambar 6). Menurut
Pratama (2009), bagian yang mengendap kemungkinan adalah selulosa, protein,
dan pektin yang merupakan senyawa penyusun dinding sel tumbuhan. Tanpa
penambahan metanol sekalipun senyawa tersebut tetap akan mengendap namun
secara perlahan. Dapat dikatakan bahwa metanol dalam penelitian ini selain
digunakan sebagai pelarut untuk mengencerkan sari juga berperan dalam
mempercepat pengendapan selulosa, protein, pektin, dan komponen dinding sel
32
jernih. Keruhnya sari yang diukur dapat mengganggu absorbansi menggunakan
spektrofotometer visibel.
Gambar 6. Pengendapan senyawa penyusun dinding sel (selulosa, protein, dan pektin)
C. Optimasi Metode DDPH
DPPH adalah suatu radikal sintetik yang larut dalam pelarut organik polar
seperti metanol atau etanol pada suhu kamar. Pada metode ini absorbansi yang
diukur adalah absorbansi larutan DPPH sisa yang tidak bereaksi dengan senyawa
antioksidan, yaitu pada panjang gelombang 515 nm (Andayani, Lisawati, dan
Maimunah, 2003; Hanani, Mun’im, dan Sekarini, 2005; Rohman dan Riyanto,
2005). Berdasarkan hal tersebut maka sebelumnya dilakukan orientasi terlebih
dahulu untuk mengetahui serapan atau absorbansi sari caisim dan sari pakcoy
pada panjang gelombang 515 nm. Adanya serapan sari sawi caisim dan sari sawi
pakcoy pada panjang gelombang tersebut dapat menyebabkan serapan yang
terukur tidak hanya DPPH tetapi juga sampel sehingga pengukuran menjadi tidak
Hasil orientasi yang dilakukan menunjukkan hasil bahwa pada panjang
gelombang 515 nm tidak terdapat serapan sari sawi caisim dan sari sawi pakcoy
(Lampiran 8). Pengukuran adanya serapan pada panjang gelombang 515 nm juga
dilakukan pada metanol yang dalam penelitian ini digunakan sebagai pelarut
(Lampiran 9). Sebelum dilakukan penentuan daya antioksidan sari sawi caisim
dan sari sawi pakcoy dengan metode DPPH dilakukan optimasi metode DPPH
terlebih dahulu untuk menentukan operating time (OT) dan panjang gelombang
maksimum yang akan digunakan dalam penelitian ini.
1. Penentuanoperating time(OT)
Pada metode DPPH, operating time didapatkan saat bahan uji sudah mereduksi radikal DPPH dengan sempurna sehingga didapat nilai absorbansi yang
stabil. Pengukuran pada operating time diharapkan memiliki tingkat
reprodusibilitas yang tinggi sehingga dapat meminimalkan kesalahan dalam setiap
pengukuran serapan. Dalam penelitian ini pengukuranoperating time tidak hanya
dilakukan pada larutan DPPH, melainkan juga larutan sampel sari sawi pakcoy
dan larutan sampel sari sawi caisim. Pengukuran operating time dilakukan pada
panjang gelombang 515 nm (Pokorny, dkk., 2001; Huang, dkk., 2005) selama 60
menit.
Melalui penelitian ini diketahui ternyata larutan DPPH menghasilkan
operating time setelah menit ke 5 dihitung dari waktu inkubasi selama 30 menit (Lampiran 7). Rentang waktu ini lebih singkat dibandingkan pada larutan sampel
sari pakcoy dan sari caisim. Larutan sampel sari caisim menghasilkan operating
34
membutuhkan waktu diatas 8 menit untuk bereaksi sempurna dengan DPPH
(Gambar 7).Operating time yang digunakan pada pengukuran selanjutnya adalah
yang menunjukkan rentang waktu terlama yaitu diatas 8 menit yang dihitung
setelah inkubasi selama 30 menit pada suhu kamar. Jika yang digunakan hanya
operating time larutan DPPH maka dikhawatirkan pada saat ditambahkan sari caisim maupun sari pakcoy, dalam selang waktu tersebut reaksi yang terjadi
belum sempurna. Ketidaksempurnaan reaksi yang terjadi dapat mempengaruhi
absorbansi pada saat pengukuran. Dari hasil penelitian diketahui bahwa larutan
DPPH tanpa sampel, larutan sampel sari pakcoy dan larutan sampel sari caisim
masih stabil hingga menit ke 60.
2. Penentuan panjang gelombang maksimum (λ maks)
Tujuan dari penentuan panjang gelombang maksimum adalah untuk
mencari panjang gelombang saat kompleks yang terbentuk dapat memberikan
serapan yang optimum. Panjang gelombang maksimum memiliki kepekaan yang
juga maksimum karena perubahan serapan untuk setiap konsentrasi paling besar.
Hal ini penting diperhatikan dalam analisis menggunakan spektrofotometri
visibel.
Pada penelitian ini ditentukan panjang gelombang maksimum yang akan
digunakan. Hal ini dilakukan karena kondisi percobaan dan alat yang digunakan
tidak selalu sama sehingga panjang gelombang maksimum yang dihasilkan pada
setiap penelitian kemungkinan berbeda. Dilakukan penentuan panjang gelombang
maksimum pada berbagai konsentrasi dan dipilih yang mendekati panjang
gelombang maksimum teoritis. Menurut Pokorny, dkk. (2001), panjang gelombang maksimum DPPH adalah 515 nm.
Scanning panjang gelombang dilakukan pada rentang panjang gelombang 400-600 nm. Rentang ini dipilih karena DPPH yang berwana ungu berada pada
rentang panjang gelombang 500-560 nm (Day dan Underwood, 1966).
Konsentrasi DPPH yang digunakan pada penelitian ini adalah 54,739 µM; 27,370
µM; dan 13,685 µM. Dari ketiga seri larutan DPPH tersebut diperoleh panjang
36
Gambar 8. Spektra panjang gelombang maksimumDPPHpada tiga konsentrasi (A = 54,739 µM ; B = 27,370 µM; C = 13,685 µM
D. Hasil Penentuan Aktivitas Antioksidan dengan Metode DPPH
Pada metode DPPH, aktivitas antioksidan penangkap radikal dapat
diketahui dengan cara menghitung rasio penurunan absorbansi radikal DPPH
dibandingkan dengan absorbansi kontrol yang tidak diberi senyawa uji yang
diduga mempunyai aktivitas antioksidan (Molyneux, 2004). Pengukuran aktivitas
antioksidan sari sawi caisim dan sari sawi pakcoy pada penelitian ini dilakukan
pada berbagai konsentrasi. Hal ini dilakukan untuk melihat pengaruh konsentrasi
sampel terhadap daya antioksidan yang dimiliki. Semakin banyak sari caisim dan
pakcoy yang ditambahkan maka semakin banyak proton yang didonasikan ke A
B
radikal DPPH sehingga terjadi penurunan absorbansi DPPH pada panjang
gelombang 515,2 nm.
38
Tabel 4. Data penurunan absorbansi DPPH pada penambahan berbagai konsentrasi sari pakcoy.
% Inhibisi Persamaan Regresi
Terlihat pada tabel 3 dan 4 bahwa larutan kontrol memiliki absorbansi
yang lebih tinggi dibandingkan larutan sampel. Hal ini disebabkan karena pada
larutan kontrol tidak terdapat senyawa yang berperan sebagai antioksidan. Sawi
caisim maupun sawi pakcoy keduanya mempunyai aktivitas antioksidan yang
dapat dilihat dari terjadinya penurunan absorbansi DPPH. Pada larutan sampel,
DPPH ditangkap oleh antioksidan yang terdapat pada sampel sebagai pendonor
hidrogen sehingga terbentuk DPPH-H tereduksi (Gambar 9).
O2N
N-N(C6H5)2
NO2
NO2
+ AH
O2N
N-N(C6H5)2
NO2
NO2 H
+ A
diphenylpicrylhydrazyl (radikal bebas) diphenylpicrylhydrazine (non radikal)
Gambar 9. Donasi proton dari antioksidan ke radikal DPPH (Molyneux, 2004).
Semakin banyak hidrogen yang didonorkan maka intensitas warna ungu
40
Gambar 10. Penurunan intensitas warna larutan DPPH pada pemberian berbagai konsentrasi sampel (sari sawi)
Salah satu parameter hasil dari metode DPPH adalah IC50 yaitu konsentrasi
antioksidan yang diperlukan untuk menangkap 50% radikal DPPH. Nilai IC50
diperoleh dari regresi linier antara konsentrasi sari caisim dan sari sawi pakcoy
(sumbu x) vs % inhibisi (sumbu y) (Lampiran 10). Nilai IC50 digunakan untuk
membandingkan besarnya daya antioksidan satu sampel dengan sampel lain.
Semakin kecil nilai IC50 menandakan semakin sedikit konsentrasi yang
dibutuhkan untuk menangkap 50 % radikal bebas yang berarti daya antioksidan
yang dimiliki juga semakin besar. Besarnya nilai IC50 dapat dihitung dengan
menggunakan persamaan regresi antara konsentrasi dengan nilai % inhibisi.
Untuk mengetahui hubungan linieritas antara konsentrasi sampel dengan
daya antioksidan yang dinyatakan dengan % inhibisi dapat dilihat dari nilai
koefisien korelasi (r) masing-masing replikasi yang mendekati satu (Tabel 3 dan
4). Dipilih satu replikasi yang memiliki linieritas yang paling baik (Purwantoko,
2006). Pada penelitian ini dipilih replikasi pertama dengan nilai r yaitu 0,9938
untuk sari sawi caisim dan 0,9944 untuk sari sawi pakcoy.
Hubungan Konsentrasi Sampel vs % Inhibisi
Gambar 11. Hubungan konsentrasi sampel vs % inhibisi
Dari grafik diatas terlihat bahwa terdapat hubungan linier antara konsentrasi
sari sawi caisim atau sari sawi pakcoy yang ditambah DPPH pada panjang gelombang
515,2 nm. Semakin besar konsentrasi sari caisim dan pakcoy yang ditambahkan
maka semakin besar % inhibisi yang dimiliki. Berdasarkan persamaan regresi linier
antara masing-masing konsentrasi sari sawi caisim dan sari sawi pakcoy (sumbu
x) dengan aktivitas % inhibisi dapat diketahui nilai IC50 (Tabel 7).
Tabel 7. Nilai IC50Sawi caisim dan sawi pakcoy pada 5 replikasi
42
Diketahui bahwa sari sawi caisim memiliki IC50 rata-rata sebesar 5,226
mg/ml sedangkan sari sawi pakcoy sebesar 8,148 mg/ml. Semakin kecil nilai IC50
maka sampel uji memiliki nilai keefektivan sebagai antioksidan lebih baik. Untuk
mengetahui secara pasti perbedaan niai IC50 digunakan Uji T tidak berpasangan.
Digunakan uji ini karena data (IC50) berasal dari sampel yang berbeda (Lampiran
11). Syarat suatu data dapat diuji dengan Uji T adalah bahwa data harus
terdistribusi normal. Digunakan uji Shapiro-Wilk karena jumlah sampel pada
penelitian ini adalah 50 sampel. Hasil perhitungan menunjukkan nilai p sebesar
0,362 untuk sari sawi caisim dan 0,126 untuk sari sawi pakcoy. Dapat
disimpulkan nilai IC50 sawi caisim dan sawi pakcoy mengikuti distribusi normal
karena nilai p lebih besar dari 0,05 (taraf kepercayaan 95%).
Selanjutnya dapat dilakukan analisis untuk melihat signifikansi nilai IC50
antara sari sawi caisim dan sari sawi pakcoy menggunakan uji T tidak
berpasangan. Hasil pengujian menggunakan uji T tidak berpasangan memperoleh
nilai signifikansi 0,000 antara IC50 sawi caisim dan sawi pakcoy. Bila
dibandingkan dengan signifikansi yang dipilih ( = 0,05) maka H0 ditolak karena
0,000 < 0,05. Dapat disimpulkan bahwa terdapat perbedaan nilai IC50 daya
antioksidan yang signifikan atau bermakna antara sawi caisim dan sawi pakcoy.
Melihat nilai IC50 sawi caisim sebesar 5,226 mg/ml sedangkan sawi
pakcoy sebesar 8,148 mg/ml dapat dikatakan keduanya memiliki aktivitas
antioksidan yang lemah karena mempunyai IC50 >150 µg/ml (Ariyanto cit
Nusarini 2007). Hal tersebut juga bisa dilihat dengan membandingkan dengan
dikonsumsi oleh masyarakat dalam berbagai produk, memiliki IC50sebesar 12,53
µg/ ml (Ainy, 2008), namun demikian konsumsi sawi bukan semata-mata untuk
memperoleh aktivitas antioksidannya sehingga pernyataan nilai daya antioksidan
ini bukan satu-satunya alasan pemilihan untuk konsumsi sawi. Dilihat dari
proporsi kandungan zat pada sawi caisim dan sawi pakcoy kemungkinan yang
memiliki peranan paling besar pada aktivitas antioksidannya adalah vitamin E dan
44 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Dari hasil penelitian ini diketahui bahwa sari sawi caisim dan sari sawi pakcoy mempunyai aktifitas sebagai penangkap radikal DPPH atau sebagai antioksidan. 2. Sari sawi caisim (IC50= 5,226 mg/ml) memiliki daya antioksidan yang lebih besar
daripada sari sawi pakcoy (IC50= 8,148 mg/ml).
B. Saran
DAFTAR PUSTAKA
Ainy, N.F., 2008, Uji Aktivitas Antioksidan Brokoli, Skripsi, Fakultas Farmasi, Universitas Gadjah Mada, Yogyakarta.
Albert, 2007, (Lycopersicon esculentum Mill.), http://koranplus.com/forum/show, diakses tanggal 10 November 2009.
Andayani, R., Lisawati, Y., dan Maimunah, 2003, Penentuan Aktivitas Antioksidan, Kadar Fenolat Total dan Likopen Pada Buah Tomat (Solanum Lycopersium L.), Jurnal Sains dan Teknologi Farmasi, Vol.13 (1), 1-11
Anonim, 1986,Sediaan Galenik 1, 8-28, Depkes RI, Jakarta.
Anonim, 1995, Farmakope Indonesia, edisi 4, 1061, Depatemen Kesehatan Republik Indonesia, Jakarta.
Bagchi, K., dan Puri, S., 1998, Free Radicals and Antioxidants in Health and Disease,Eastern Mediterranean Health Journal, Vol. 4 (2), 350-360.
Booth, S.L., Cao, G., Sadowski, J.A, dan Prior, R.L., 1998, Increases in human plasma antioxidant capacity following consumption of controlled diets high in fruits and vegetables,Am. J. Clin Nutr.,Vol. 68 (1), 1081-1087.
Day, R.A., dan Underwood, A.L., 1966, Analisis Kimia Kuantitatif, edisi kelima, Penerbit Erlangga, Jakarta.
Darmawan, A., Sundowo, A., Fajriah, S., dan Artanti N., 2006, Uji Aktivitas Antioksidan Dan Toksisitas Ekstrak Metanol Beberapa Jenis Benalu, Jurnal Kimia Indonesia, Vol. 1 (1), 1-4.
Dwiari, S.,R., 2008, Teknologi Pangan Untuk Sekolah Menengah Kejuruan Kelompok Teknologi Industri, 12, Departemen Pendidikan Nasional, Jakarta. Fessenden, R.J. dan Fessenden, J.S., 1994, Kimia Organik Jilid II, diterjemahkan
oleh Pudjaatmaka, A.H., Edisi ketiga, 436-444, Penerbit Erlangga, Jakarta.
Gitawati, R., 1995, Radikal Bebas, Sifat dan Peran Dalam Menimbulkan Kerusakan dan Kematian Sel,Cermin Dunia Kedokteran, No.102, 336.
Gordon, M.H., 1990, The Mechanism of Antioxidants Action in Vitro, Di dalam: Hudson, J,F., editor. Food Antioxidants, Elsivier Applied Science, London.
Hadi, S., 2009, Antioksidan Menangkal Radikal Bebas, sadhonohadi.com/ content&do_pdf=1&id=170, diakses tanggal 1 April 2009.
46
Halliwell, B. dan Gutteridge, J.M.C., 1999, Free Radicals in Biology and Medicine, third edition, 368-369, Oxford University Press, New York.
Hanani, E., Mun’im, R., Sekarini, 2005, Identifikasi Senyawa Antioksidan Dalam Spons Callyspongia SP Dari Kepulauan Seribu, Majalah Ilmu Kefarmasian, Vol. 2 (3), 127-133.
Harnita, A., Uji Penangkapan Radikal Hidroksil Oleh Air dari Sari Teh Hitam dan Vitamin C Secara In Vitro Dengan Metode DPPH ( 2,2-diphenyl-1-picrylhydrazyl), Skripsi, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Haryanto, E., Suhartini, T., Rahayu, E., 2006, Sawi dan Selada, 12-15, PT.Niaga Swadaya, Jakarta.
Huang, D., Ou, B., Prior, R. L., 2005, The Chemistry Behind Antioxidant Capacity Assays,Journal of Agricultural and Food Chemistry, No.53, 1841-1856.
Husaini, 1991, Gizi, Proses Penuaan dan Umur Panjang,Cermin Dunia Kedokteran, No.73, 25.
Ide, P., 2006,Diet Cabbage Soup, 107-110, Elex Media Computindo, Jakarta. Irwan, A.W., Wahyudin, A., dan Farida, 2005, Pengaruh dosis kascing dan
bioaktivator terhadap pertumbuhan dan hasil tanaman Sawi (Brassica junceaL.) yang dibudidayakan secara organik,Jurnal Kultivasi,Vol. 4 (2), 136-140
Jegtvig, S., 2004, Bok Choy, Nutrition Guide, Health's Disease and Condition About.com, diakses tanggal 2 April 2009.
Khopkar, S.M., 1990, Basic Concepts of Analitycal Chemistry, diterjemahkan oleh Saptohardjo, A., 85-86, Universitas Indonesia Press, Jakarta.
Kim, H.Y, Yokozawa. T, Cho, E.J., Cheigh, H.S., Choi, J.S., dan Chung, H.Y., 2003, In vitro and in vivo antioxidant effects of mustard leaf (Brassica juncea), Phytother Res., Vol. 17 (5), 465-71.
Koswara, S., 2004, Konsumsi Lemak Yang Ideal Bagi Kesehatan, Ebookpangan.com, diakses tanggal 8 Juni 2009.
Langseth, L., 1995, Antioxidants, and Disease Prevention, I.L.S.I. Europe Concise Monograph Serie, International Life Sciences Institute.
Lautan, J., 1997, Radikal Bebas Pada Eritrosit dan Leukosit, Cermin Dunia Kedokteran, No. 116, 50.
Li, J., Zhu, Z., and Gerendas, J., 2008, Effects of Nitrogen and Sulfur on Total Phenolics and Antioxidant Activity in Two Genotypes of Leaf Mustard, Journal of Plant Nutrition, No. 31, 1642 – 1655.
Lina, 2008, Uji Aktivitas Penangkapan Radikal Hidroksil Oleh Fraksi Etil Asetat Ekstrak Metanolik Alga Coklat (Sargassum hystrix v. buxifolium (Chauvin) J. Agardh) Dengan Metode Deoksiribosa, Skripsi, Fakultas Farmasi, Universitas Sanata Dharma.
Mateljan, G., 2009, Flowering Cabbage / Choy Sum / Yu Choy 1000 Fresh Seeds Vegetable,http://cgi.ebay.com.my/Flower-Cabbage-Choy-Sum-Yu-Choi
1000SdsVegetable_W0QQitemZ400033278934QQcmdZViewItemQQptZLH, diakses tanggal 2 April 2009.
Margiyanto, E., 2008, Budidaya Tanaman Sawi, http://zuldesains.wordpress.com, diakses tanggal 1 April 2009.
Martono, S., 2007, Pelatihan Instrumentasi Dalam Rangka Hibah A3, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Meronda, R.G., 2008, Bahan Tambahan Makanan Antioksidan dan Sekuesteran, Fakultas Farmasi Universitas Hasanuddin, Makasar.
Molyneux, P., 2004, The use of the stable free radical diphenylpicryl-hydrazyl (DPPH) for estimating antioxidant activity, J. Sci. Technol., Vol. 26 (2), 211-219.
Mulja, M., dan Suharman, 1995, Analisis Intrumental, 26-32, Airlangga University Press, Surabaya.
Nusarini, R., 2007, Uji Aktivitas Antioksidan Fraksi Etil Asetat Ekstrak Metanolik Herba Ketul (Bidens pilosaL. ), Skripsi,Universitas Gadjah Mada, Yogyakarta. Orhan, D.D., Ergun, F., Yesilada, E., Tsuchiya, K., Takaishi, Y., dan Kawazoe, K.,