GAMBARAN MORFOLOGI DAN FREKUENSI TAHAPAN
SPERMATOGENESIS PADA DOMBA GARUT
BASRIZAL B04103026
DEPARTEMEN ANATOMI, FISIOLOGI, DAN FARMAKOLOGI FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR BOGOR
GAMBARAN MORFOLOGI DAN FREKUENSI TAHAPAN
SPERMATOGENESIS PADA DOMBA GARUT
BASRIZAL
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan Pada
Fakultas Kedokteran Hewan
DEPARTEMEN ANATOMI, FISIOLOGI, DAN FARMAKOLOGI FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR BOGOR
LEMBAR PENGESAHAN
Judul : Gambaran Morfologi dan Frekuensi Tahapan Spermatogenesis pada Domba Garut.
Nama : Basrizal NIM : B04103026
Disetujui,
Pembimbing I Pembimbing II
Drh. Srihadi Agungpriyono, Ph.D Drh. Wahono Esthi Prasetyaningtyas, MSi NIP. 131 664 403 NIP. 132 321 567
Diketahui,
Wakil Dekan FKH IPB
Dr.drh. I Wayan Teguh Wibawan, MS NIP. 131 129 090
“Sang pemenang tidak pernah menyerah, dan orang yang menyerah tidak akan pernah menang”
Masalahnya bukanlah apakah anda dijatuhkan, tetapi apakah anda bangkit kembali (Vince Lombardi)
“Dimano Bumi Dipijak, Disinan Langik Dijunjuang” (Minang)
PRAKATA
Alhamdulillah, penulis panjatkan kehadirat Allah SWT sehingga dapat menyelesaikan skripsi dengan judul ”Gambaran Morfologi dan Frekuensi Tahapan Spermatogenesis pada Domba Garut”. Penelitian ini merupakan penelitian dasar untuk mengetahui sistem reproduksi domba garut jantan.
Dengan selesainya penulisan skripsi ini penulis mengucapkan terima kasih kepada:
1. Allah SWT dan Nabi besar Muhammad SAW yang telah membawa kita dari alam kegelapan menuju alam yang terang benderang, damai, dan sentosa.
2. Kedua orang tua, kakak serta keluarga besar di rumah atas doa, cinta, dukungan, semangat, kehangatan dan pengorbanannya.
3. Drh. Srihadi Agungpriyono, Ph.D dan drh. Wahono Esthi Prasetyaningtyas, MSi. sebagai dosen pembimbing skripsi yang tiada lelah memberikan bimbingan, nasehat, dukungan dan bantuan mulai dari awal penelitian hingga skripsi ini selesai dikerjakan.
4. Dr. drh. Arief Boediono dan Dr. R. Iis Arifiantini, MSi sebagai dosen penilai dan penguji yang banyak memberikan masukan dan saran pada skripsi ini.
5. Drh. Bambang Pontjo Priyosoeryanto, MS, Ph.D sebagai dosen pembimbing akademik yang telah banyak memberi nasehat selama penulis dibangku kuliah.
6. Gymnolaemata 40, atas kebersamaannya.
7. Kepada seluruh pihak yang tidak bisa disebutkan satu persatu yang turut membantu penulis selama menyelesaikan skripsi ini.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari kesempurnaan. Kritik dan saran sangat diharapkan untuk penyempurnaan skripsi ini, semoga karya ilmiah ini bermanfaat.
Bogor, September 2007 Penulis
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 1 Maret 1984 di Solok, Sumatera Barat. Penulis adalah anak kedua dari dua bersaudara, dari pasangan Idrus dan Zurni.
Pendidikan formal dimulai dari pendidikan dasar yang diselesaikan pada tahun 1997 di SDN 1 Tanam Batu. Kemudian pendidikan lanjutan menengah pertama diselesaikan pada tahun 2000 di SMPN 4 Lembah Gumanti dan pendidikan lanjutan atas diselesaikan pada tahun 2003 di SMUN 1 Lembah Gumanti.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor pada Fakultas Kedokteran Hewan melalui jalur USMI pada tahun 2003. Selama perkuliahan penulis aktif dalam organisasi mahasiswa daerah (IPMM Bogor) dan menjadi ketua IPMM Bogor periode 2005-2007.
DAFTAR ISI
Halaman
DAFTAR ISI……….……….…... i
DAFTAR GAMBAR……… ii
DAFTAR TABEL……… iii
ABSTRAK……… iv ABSTRACT……….……... v PENDAHULUAN Latar belakang ……….………..…….. 1 Tujuan ………..…….... 1 Manfaat ………...………. 2 TINJAUAN PUSTAKA Tinjauan umum domba………..…………. 3
Testis……….……..………. 4
Proses pembentukan spermatozoa……… 5
MATERI DAN METODE Waktu dan tempat ………...………... 9
Bahan dan sampel yang digunakan………. 9
Metode ………...……….. 9
HASIL DAN PEMBAHASAN Tahapan spermatogenesis domba garut……….. 13
Frekuensi tahapan spermatogenesis………... 17
KESIMPULAN DAN SARAN Kesimpulan ………..……… 20
Saran ……… 20
DAFTAR PUSTAKA ………..……… 21
DAFTAR GAMBAR
Halaman
Gambar 1 Domba garut………. 4
Gambar 2 Proses spermatogenesis………. 7
Gambar 3 Tahapan spermatogenesis domba garut 1-4………... 15
Gambar 4 Tahapan spermatogenesis domba garut 5-8... 16
Gambar 5 Frekuensi relatif tahapan spermatogenesi domba garut…... 18
Gambar 6 Durasi masing-masing tahapan spermatogenesis domba garut ... 19
DAFTAR TABEL
Halaman Tabel 1 Frekuensi dan durasi spermatogenesis pada domba garut ... 17
PENDAHULUAN
Latar BelakangDomba Priangan atau yang dikenal dengan domba garut merupakan domba asli Garut, Jawa Barat. Domba garut merupakan hasil persilangan segitiga antara domba asli Indonesia, domba Merino dari Asia Kecil dan domba ekor gemuk dari Afrika. Sebagai plasma nutfah unggul Indonesia, domba garut merupakan salah satu spesies yang wajib kita lestarikan keberadaannya. Untuk itu, usaha peningkatan reproduksi perlu dilakukan. Salah satu faktor utama yang penting dalam mempelajari fisiologi reproduksi adalah proses pembentukan gamet jantan melalui spermatogenesis.
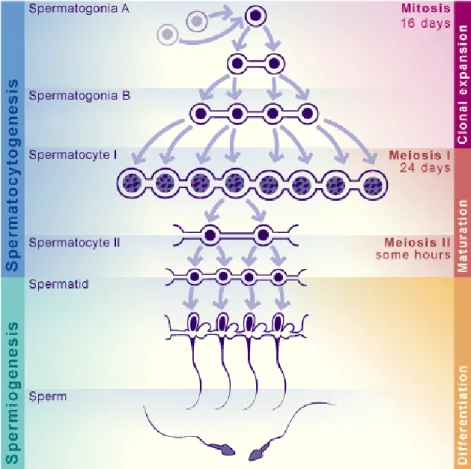
Menurut O’day (2002), spermatogenesis adalah proses perkembangan dari sel germinatif yaitu sel spermatogonia menjadi spermatozoa. Proses spermatogenesis terjadi di dalam testis tepatnya di dalam tubuli seminiferi. Spermatogenesis dibagi ke dalam tiga fase : (1) spermatositogenesis, yaitu proses perubahan spermatogonia menjadi spermatosit, (2) meiosis, tahap masak dari spermatosit yang menghasilkan spermatid dengan jumlah kromosom yang berkurang (haploid), dan (3) spermiogenesis, proses perubahan spermatid menjadi spermatozoa (Dellman & Brown 1976; Ownby 1999).
Proses spermatogenesis terjadi secara berkesinambungan dan terus menerus. Tahapan spermatogenesis ini dapat teridentifikasi secara mikroskopis. Beberapa penelitian menggolongkan tahapan spermatogenesis secara morfologis pada manusia dan beberapa spesies hewan (Kerr & Kretser 1988), misalnya pada manusia terdiri dari 6 tahap, pada kera 12 tahap, tikus 14 tahap, dan babi 8 tahap. Namun demikian sampai saat ini informasi mengenai tahapan spermatogenesis dandurasinya pada domba garut belum terlaporkan.
Tujuan
Penelitian ini bertujuan untuk menerangkan morfologi dan frekuensi tahapan spermatogenesis pada domba garut.
Manfaat
Penelitian ini dapat memberikan pengetahuan dasar tentang siklus dan proses spermatogenesis pada domba garut jantan.
TINJAUAN PUSTAKA
Tinjauan Umum DombaDomba diklasifikasikan menjadi subfamili Caprinae dan semua jenis domba yang diternakkan (domestikasi) termasuk spesies Ovis aries. Ada empat spesies domba yaitu : domba Moufflon (O. musimon) terdapat di Eropa dan Asia Barat, domba Urial (O. orientalis, O. vignei) terdapat mulai dari Afganistan sampai Asia Barat, domba Argali (O. ammon) terdapat di Asia Tengah, dan domba Bighorn (O. canodensis ) terdapat di Asia Utara dan Amerika Utara. Tiga jenis yang pertama diatas merupakan domba-domba yang membentuk basis genetik dari domba-domba modern sekarang (Payne & Williamson 1993).
Menurut Gatenby (1986), ada tiga bangsa domba Indonesia, diantaranya adalah domba ekor tipis (the Javanese thin tailed sheep), domba Priangan (domba garut), dan domba ekor gemuk (the Javanese fat tailed sheep). Domba ekor tipis yang merupakan domba asli Indonesia, mempunyai tubuh kecil, ekor relatif kecil dan tipis, domba betina umumnya tidak bertanduk sedangkan domba jantan bertanduk kecil dan melingkar (Mulyono 2000). Domba ekor gemuk yang ada di Indonesia kemungkinan berasal dari India atau Asia Barat (Payne & Williamson, 1993). Domba ini mempunyai bentuk ekor yang panjang, lebar, besar, dan semakin keujung semakin mengecil. Ekor ini digunakan sebagai tempat menimbun lemak untuk cadangan energi (Mulyono 2000), domba ekor gemuk mempunyai bentuk badan sedikit lebih besar dari pada domba asli Indonesia, yang jantan bertanduk kecil sedangkan betinanya tidak bertanduk (Dwiyanto 1999).
Domba Priangan merupakan domba asli dari Garut Jawa Barat, yang berasal dari persilangan segitiga antara domba lokal, domba Merino dan domba Cape (Afrika Selatan). Persilangan diperkirakan terjadi mulai tahun 1864 ketika pemerintah Hindia Belanda memasukkan domba Merino ke Indonesia (Hardjosubroto & Astuti 1979). Domba Priangan (Gambar 1) mempunyai pangkal ekor lebih lebar dengan ujung ekor yang runcing dan pendek, domba Priangan betina tidak bertanduk sedangkan domba jantannya bertanduk. Domba ini memiliki tanda lain seperti daun telinga relatif kecil dan kokoh, berbadan besar dan lebar serta kuat, domba jantan bertanduk cukup besar yang melengkung kebelakang berbentuk spiral, pangkal tanduk kanan dan kiri hampir bersatu serta
memiliki rambut lebih panjang dan halus dari pada domba asli Indonesia. Domba garut ini biasa digunakan untuk aduan (Mulyono 2000; Sugeng 2000).
Gambar 1 Domba Garut Jantan
(Sumber http://www.dombagarut.com/bigger1.html)
Testis
Testis pada hewan mamalia ada sepasang, bentuknya bulat telur atau lonjong, berada di dalam rongga skrotum dan digantung oleh funikulus spermatikus yang terletak di daerah preoubicus. Testis terdiri dari jaringan tubuli seminiferi, sel stroma, sel interstisial dan sel-sel Leydig. Tubuli seminiferi terdiri dari dua macam epitel yang berbeda yaitu : (1) sel germinatif adalah sel yang akan mengalami perubahan selama proses spermatogenesis, sebelum mereka siap untuk mengadakan fertilisasi. (2) sel Sertoli adalah sel yang berbentuk panjang dan kadang-kadang seperti piramid, terletak dekat atau diantara sel-sel germinatif. Fungsi sel ini memberi makan kepada spermatozoa yang masih muda selain itu juga memfagosit sel-sel spermatozoa yang telah mati atau telah mengalami degenerasi. Pada jaringan ini terdapat pembuluh darah, limfe serta saraf dan sel makrofag. Selain itu juga terdapat sel interstitial atau sel Leydig yang menghasilkan hormon testosteron, hormon juga dihasilkan oleh spermatozoa dan kelenjar adrenal (Tomaszewska et al. 1991).
Testis sebagai organ kelamin primer mempunyai dua fungsi, yaitu (1) Fungsi reproduksi menghasilkan spermatozoa atau sel kelamin jantan (2) Fungsi endokrin mensekresikan hormon kelamin jantan, testosteron. Fungsi reproduksi
testis adalah produksi spermatozoa atau sel mani yang dihasilkan di tubuli seminiferi. Bila dibentangkan saluran tubuli seminiferi mempunyai panjang beberapa kilometer. Spermatozoa adalah bentuk akhir sel jantan setelah mengalami proses perkembangan (spermatogenesis).
Proses Pembentukan Spermatozoa
Proses spermatogenesis secara sempurna baru dimulai setelah hewan mencapai dewasa kelamin (pubertas). Produksi spermatozoa akan bertambah bersamaan dengan meningkatnya umur hewan jantan tersebut. Spermatozoa diproduksi dalam tubuli seminiferi testis. Spermatozoa berasal dari sel spermatogonia pada epitel germinatif dari tubuli seminiferi dengan cara pembelahan. Proses spermatogenesis pada hewan dibagi menjadi empat tahap (Ownby 1999) yaitu :
1. Tahap proliferasi, tahap ini dimulai sejak sebelum lahir sampai beberapa saat setelah lahir. Bakal sel kelamin yang ada pada lapisan basal dari tubuli seminiferi melepaskan diri dan membelah secara mitosis sampai dihasilkan banyak sel spermatogonia.
2. Tahap tumbuh, pada tahap ini spermatogonia membagi diri secara mitosis sebanyak empat kali sehingga dihasilkan 16 sel spermatogonia.
3. Tahap menjadi masak, yaitu sel spermatogonia menjadi sel spematosit. Pada tahap ini terjadi pembelahan meiosis sehingga sel spermatosit primer berubah menjadi sel spermatosit sekunder. Kemudian spermatosit sekunder akan berubah menjadi spermatid bersamaan dengan pengurangan jumlah kromosom dari diploid (2n) menjadi haploid (n).
4. Tahap transformasi, pada tahap ini terjadi proses metamorfosa seluler dari sel spermatid sehingga terbentuk sel spermatozoa.
Sedangkan menurut Djuwita et al. (2000), proses spermatogenesis dibagi menjadi dua tahap yaitu: spermatositogenesis adalah pertumbuhan jaringan spermatogenik dengan pembelahan mitosis yang diikuti dengan pembelahan reduksi (meiosis). Pada pembelahan meiosis jumlah kromosom dibagi dua sama banyak yaitu dari diploid (2n) menjadi haploid (1n). Sehingga pada saat yang bersamaan sel benih primordial juga berkembang menjadi spermatogonia yang
selanjutnya akan berdiferensiasi menjadi spermatosit primer. Spermatosit primer akan berkembang menjadi spermatosit sekunder. Spermatosit sekunder melalui pembelahan meiosis akan menghasilkan spermatid.
Tahap berikutnya adalah spermiogenesis. Pada fase ini sel spermatid akan mengalami metamorfosa dan membentuk spermatozoa secara sempurna. Perubahan proses metamorfosa ini meliputi pembentukan akrosom, kepala, badan dan ekor dari spermatozoa. Spermiogenesis dibagi dalam tahap Golgi, tahap tudung (cap phase), tahap akrosom, dan tahap pemasakan. Selama fase Golgi, butir-butir praakrosom muncul pada gelembung Golgi dan akan bergabung membentuk butir akrosom tunggal. Pada fase tudung, butir akrosom bergerak ke kutup anterior inti, difase ini butir-butir akrosom memipih dan intinya memadat. Selama transisi dari fase tudung ke fase akrosom, kepala spermatid menempel pada sel Sertoli dan mengarah ke lumen. Pada fase akhir yaitu fase pemasakan terjadi diferensiasi spermatid, pengeluaran sitoplasma dihentikan. Sitoplasma yang keluar disebut dengan badan residual kemudian difagosit oleh sel Sertoli (Dellman & Brown 1976). Selama pertumbuhannya, spermatozoa selalu melekat pada sel Sertoli dan bergerak dari dinding tubulus semineferus. Dalam perlekatannya dengan sel Sertoli ini, spermatozoa menerima makanan sampai saat melepaskan diri ke lumen tubulus. Kemudian spermatozoa meninggalkan tubuli seminiferi menuju epididimis dan akan disimpan beberapa waktu sampai saat diejakulasikan. Proses spermatogenesis secara skematis dapat dilihat pada Gambar 2.
Gambar 2 Proses Spermatogenesis (Sumber : http://images.google.co.id) Spermatogenesis adalah suatu siklus yang teratur dimana spermatogonia diploid akan berkembang menjadi spermatozoa haploid dewasa. Proses ini terdiri atas tahapan-tahapan yang berbeda (Leblond & Clermont 1952). Menurut Franca
et al. (1999), untuk mengetahui tahapan siklus epitel seminiferus dapat dilihat dari keadaan tubuli seminiferi antara lain melalui ukuran inti spermatid, kehadiran pembelahan meiosis dan komposisi epitel seminiferus secara keseluruhan. Pada kambing tahapan spematogenesis sebanyak delapan tahap, dengan frekuensi masing-masing tahapan sebagai berikut: tahap 1 15.8%, tahap 2 12.8%, tahap 3 20.5%, tahap 4 10,7%, tahap 5 11.6%, tahap 6 9.3%, tahap 7 7.6%, tahap 8 11.7%. Sedangkan durasi tiap siklus spermatogenesis adalah 10.6 hari. Dengan total waktu siklus spermatogenesis adalah 4.5 siklus.
Pada babi, satu siklus spermatogenesis berlangsung 9 + 0.2 hari. Total durasi spermatogenesis diperkirakan 4.5 siklus epitel seminiferus, sehingga spermatogenesis diperkirakan mencapai + 40.6 hari. Tahapan spermatogenesis pada babi berlangsung sebanyak delapan tahap. Tahap 1 11.7%, tahap 2 14.3%,
tahap 3 5.4%, tahap 4 12.1% tahap 5 5.9%, tahap 6 17.2%, tahap 7 15.4%, tahap 8 14.3% (Franca & Cardoso 1998).
Sementara itu pada puma, siklus epitel seminiferus terjadi sebanyak delapan tahap. Durasi siklus epitel seminiferus adalah 9.89 hari, sehingga diperkirakan membutuhkan waktu 44.5 hari untuk perkembangan spermatogonia menjadi spermatozoa (Leite et al. 2006). Pada musang, tahapan spermatogenesis juga berlangsung sebanyak delapan tahap. Tahap 1 sampai tahap 8 secara berurutan adalah 10.6%, 2.2%, 7.9%, 13.1%, 22.3%, 21.9%, 14.0%, dan 8.0%. Durasi satu siklus diperkirakan mencapai 13.0 hari. Ini sama dengan karnivora lain ( Nakai et al. 2004).
Pada gerbil mongolia, tahapan spermatogenesis dibagi menjadi 15 tahap. Tahap I adalah frekuensi tertinggi sementara tahap 5 paling rendah dari 12 tahap. Pola spermatogenesisnya sama dengan rodensia lain yang digunakan sebagai hewan laboratorium (Segatelli et al. 2002).
MATERI DAN METODE
Waktu dan TempatPenelitian ini dilakukan di laboratorium Riset Anatomi, Bagian Anatomi, Histologi dan Embriologi, Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dari bulan Februari 2007 sampai dengan Agustus 2007.
Bahan
Bahan kimia yang digunakan dalam penelitian ini adalah larutan NaCl fisiologis, larutan pengawet Bouin, alkohol 70%, 80%, 90%, 95%, 100%, Xylol, Parafin p.a (56-58%), zat-zat warna Hematoksilin Eosin (HE), dan Entellan®.
Sedangkan alat yang dipakai, antara lain : pisau, skalpel, gunting, label, gelas piala, botol-botol dehidrasi, kertas foto, styrofoam, blok kayu, pinset, bunsen, tutup pagoda, gelas objek, mikrotom dengan pisaunya, kuas bulu kuda, spatula, hot plate.
Sampel yang digunakan
Penelitian ini dilakukan dengan menggunakan sampel organ testis yang berasal dari tiga ekor domba garut jantan dewasa dan sehat yang berumur + 2 tahun. Pengambilan sediaan organ testis dilakukan sesaat setelah domba dipotong di rumah potong hewan (RPH) kabupaten Garut.
Metode
Metode yang digunakan dalam penelitian ini adalah pengamatan preparat histologi, dengan cara membuat preparat histologi yang diwarnai dengan pewarnaan Hematoksilin Eosin (HE).
◦ Pembuatan preparat histologi
Proses pembuatan preparat histologi terdiri dari fiksasi jaringan. Sediaan jaringan testis dipotong dengan ukuran 0,5 cm X 0,8 cm, kemudian dilakukan proses rutin histologi yang meliputi (dehidrasi, clearing, infiltrasi, dan embedding), sectioning (pemotongan jaringan), dan staining (pewarnaan).
Dehidrasi adalah proses penarikan air dari jaringan dan mencegah pengerutan sel yang diperiksa. Dehidrasi dilakukan dengan cara merendam di dalam alkohol bertingkat (Alkohol 70%, 80%, 90%,95%, dan alkohol absolut). Untuk alkohol dengan konsentrasi 70% sebagai stoping point maka waktu perendaman bisa lama, namun untuk alkohol dengan konsentrasi 80% - 95% lama perendaman adalah 24 jam. Sedangkan untuk alkohol absolut dilakukan sebanyak tiga kali dengan masing-masing waktu perendaman selama satu jam.
Clearing (penjernihan) adalah proses intermediet antara proses dehidrasi dan proses embedding dengan parafin. Tujuan dari clearing adalah menghilangkan sisa alkohol dalam jaringan agar parafin dapat berpenetrasi ke dalam jaringan. Penghilangan sisa alkohol didalam jaringan dilakukan dengan menggunakan xylol. Proses dilakukan sebanyak tiga kali masing-masing selama satu jam.
Infiltrasi parafin dilakukan secara bertahap dan semua proses dilakukan dalam inkubator yang bersuhu 60 – 70 oC (karena bahan yang digunakan adalah parafin cair). Perendaman dilakukan sebanyak tiga kali dengan waktu perendaman masing-masing selama satu jam.
Embedding adalah penanaman jaringan ke dalam blok parafin. Pertama-tama disiapkan wadah kaleng yang sesuai yang telah diolesi gliserin dan tetap dalam kondisi hangat, kemudian parafin cair dituangkan ke dalam pagoda secara perlahan-lahan sampai permukaannya menggembung. Jaringan secara hati-hati diletakkan ke dalam parafin dengan menggunakan pinset. Kemudian letaknya diatur pada posisi yang diinginkan. Selanjutnya wadah dipindahkan kebagian yang dingin untuk beberapa saat agar membeku, lalu dipindahkan ke dalam air agar parafin membeku secara sempurna. Parafin dikeluarkan dari wadah dengan menggunakan pisau kecil. Setelah parafin terlepas, dipisahkan berdasarkan jaringan yang ditanam. Potongan parafin yang terdapat jaringan ditrimming sampai membentuk kotak dengan ukuran sesuai lalu ditempelkan pada blok kayu. Penempelan dilakukan dengan menggunakan sisa parafin yang diencerkan sebagai perekatnya. Parafin yang telah menempel kemudian dibentuk supaya mudah dipotong.
Sectioning atau pemotongan jaringan dilakukan dengan alat khusus, yaitu mikrotom. Blok parafin yang telah dipotong hingga berupa lembaran-lembaran jaringan setebal 5µm, dan ditempatkan pada gelas obyek, kemudian disimpan dalam inkubator pada suhu 37 oC selama 24 jam sampai jaringan menempel sempurna pada gelas obyek.
Staining atau pewarnaan dilakukan dengan pewarnaan Hematoksilin Eosin (HE). Staining dilakukan untuk mempermudah pengamatan jaringan dibawah mikroskop. Setelah pewarnaan selesai dilakukan, maka dilakukan mounting dengan cara menempatkan gelas obyek pada kertas tissue di tempat datar, tetesi gelas obyek dengan bahan mounting yang sudah diencerkan dengan xylol, kemudian menutupnya dengan gelas penutup dengan hati-hati agar tidak terbentuk gelembung udara.
Pengamatan dan pemotretan sediaan dilakukan dengan menggunakan mikroskop cahaya yang dilengkapi kamera (Nikon E600, Japan) dengan lensa obyektif 40X. Pengamatan dititikberatkan pada perubahan morfologi sel germinatif dalam tubuli seminiferi sehingga dapat dibedakan masing-masing tahapan spermatogenesis yang terjadi pada domba garut. Selanjutnya masing-masing tahapan dihitung pada 400 tubuli seminiferi dari setiap sampel. Total yang diamati berjumlah 1200 tubuli. Dari semua tubuli yang diamati, dibedakan tahapan-tahapan spermatogenesis. Jumlah tiap tahapan dipersentasekan, kemudian untuk mengetahui durasi tiap tahapan, hasil persentase dikalikan dengan durasi total spermatogenesis domba yaitu 10,6 hari (Franca et al. 1999; Franca & Cardoso 1998).
Frekuensi Tahapan dan Durasi Siklus Tahapan Spermatogenesis 1. Frekuensi tahapan (%)
= Jumlah tubuli pada masing-masing tahapan X 100 Jumlah total tubuli
2. Durasi siklus spermatogenesis
◦ Rancangan Percobaan dan Evaluasi Data
Penelitian ini menggunakan desain percobaan eksploratif. Data yang dikoleksi dipaparkan secara deskriptif dan dikomparasikan dengan data dari hewan lain yang pernah dilaporkan.
HASIL DAN PEMBAHASAN
Tahapan Spermatogenesis Domba GarutUntuk melihat tahapan spermatogenesis, jaringan testis domba garut diwarnai dengan pewarnaan Hematoxylin Eosin (HE). Pada pewarnaan HE unsur yang bersifat asam akan menyerap warna biru sampai ungu, sedangkan unsur yang bersifat basa akan mengambil warna merah muda (Humason 1972; Kiernan 1990). Dengan terwarnainya inti dan sitoplasma sel akan memberikan bentuk yang jelas pada sel Sertoli dan sel germinatif sehingga mempermudah untuk mempelajari morfologinya. Penentuan tahapan-tahapan spermatogenesis berdasarkan pada perubahan morfologi dan komposisi sel-sel spermatogenik. Dengan pengamatan menggunakan mikroskop cahaya akan didapatkan gambaran mikroskopik dari tahapan spermatogenesis pada domba garut.
Secara umum proses spermatogenesis sama pada semua hewan mamalia (Sharpe 1994). Tahapan spermatogenesis dapat dibedakan berdasarkan, ciri khas dari perkembangan spermatogonia dan aspek morfologi dari sel germinatif setiap tahap spermatogenesis. Selain itu, kriteria utama untuk membedakan tahapan spermatogenesis terletak pada karekteristik morfologi spermatid, letak inti dan sistem akrosomik (Russel et al. 1990). Walaupun menggunakan metode yang sama dalam menentukan tahapan spermatogenesis, jumlah tahapan yang ditemukan dapat berbeda-beda antara peneliti.
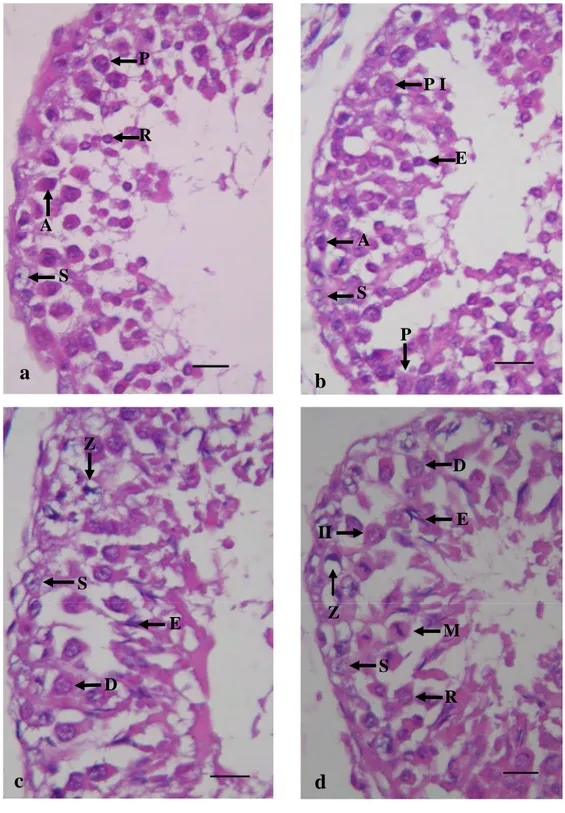
Pada penelitian ini perubahan bentuk sel germinatif atau tahapan spermatogenesis pada domba garut dapat digolongkan dalam 8 tahap (Gambar 3 dan 4). Tahapan ini berdasarkan morfologi spermatogonia, spermatosit, ukuran dan lokasi dari inti spermatid, adanya tanda pembelahan meiosis, dan komposisi sel-sel epitel tubuli seminiferi secara keseluruhan. Frekuensi tahapan ditentukan dari total 1200 tubuli seminiferus ( Nakai et al. 2004).
Tahap 1 dicirikan dengan adanya spermatogonia tipe A yang berada di lamina basalis. Spermatid yang berinti bulat terdapat dibagian dalam epitel seminiferus yang terdiri dari beberapa lapis. Sementara itu spermatosit primer berada di dekat sel Sertoli. Tahap 2 dicirikan dengan terjadinya perubahan bentuk pada spermatid, yaitu spermatid yang awalnya berbentuk bulat berubah menjadi agak lonjong (pemanjangan). Pada tahap ini juga ditemukan spermatosit
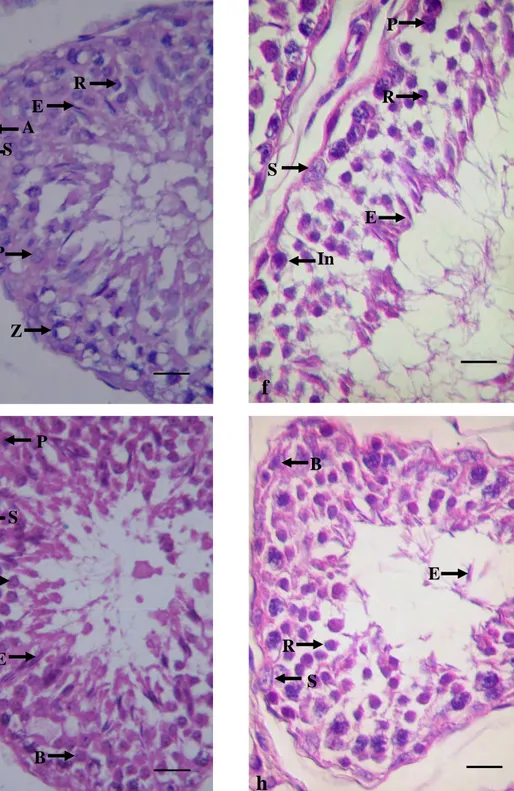
preleptoten. Inti spermatosit preleptoten kelihatan lebih jelas dan besar dibanding pada tahap sebelumnya. Sel Sertoli dan spermatogonia tipe A juga ditemukan serupa dengan tahap 1. Tahap 3 dicirikan dengan adanya dua bentuk spermatosit, yaitu spermatosit zigoten dan spermatosit diploten. Pada tahap ini pemanjangan spermatid (spermatid elongated) sudah semakin jelas. Sel Sertoli terletak di lamina basalis. Tahap 4 dicirikan oleh adanya spermatosit sekunder. Hal ini menandakan bahwa pada tahap ini terjadi pembelahan meiosis pada spermatosit diploten menjadi spermatosit sekunder yang kemudian akan menjadi spermatid yang haploid. Karakteristik utama dari tahap ini yaitu ditemukannya meiotic figures. Sementara itu spermatid yang memanjang (elongated) ditemukan berjajar di daerah permukaan tubuli seminiferi. Tahap 5 dicirikan oleh spermatogonia intermediet, spermatosit zigoten serta spermatid berinti bulat. Spermatid elongated hampir menyerupai sebuah garis yang berjajar di permukaan tubuli seminiferi. Tahap 6 dicirikan oleh spermatosit pakiten dan spermatid bulat. Spermatid panjang (elongated) sudah mengarah ke lumen tubulus seminiferus. Sel Sertoli juga ditemukan seperti tahap sebelumnya. Tahap 7 dicirikan oleh spermatogonia tipe B dan spermatosit pakiten serta terdapat spermatid bulat. Sementara itu, spermatid elongated sudah semakin dekat ke lumen tubulus seminiferus. Tahap 8 dicirikan oleh spermatid elongated sudah meninggalkan epitel seminiferus, juga terlihat spermatogonia tipe B, spermatid bulat dan badan residual. Spermatid panjang (elongated) sudah berada di lumen tubulus seminiferus. Proses selanjutnya adalah transformasi spermatid elongated menjadi spermatozoa.
P
b
P I S E P A R A Sa
Z S II Z M D R E S E Dc
d
Gambar 3 Tahapan 1 sampai tahapan 4. Tahap 1 (a) Spermatogonia tipe A; Spermatosit primer
(P); Spermatid bulat (R); Sel sertoli (S). Tahap 2 (b) Spermatogonia tipe A (A); Spermatosit preleptoten (P I); Spermatosit primer pakiten (P); Spermatid panjang/elongated (E); Sel Sertoli (S). Tahap 3 (c) Spermatosit zigoten (Z); Spermatosit diploten (D); Spermatid panjang/ elongated (E); Sel Sertoli (S). Tahap 4 (d) Spermatosit zigoten (Z); Spermatosit diploten (D); Spermatosit sekunder (II); Spermatid bulat (R); Spermatid panjang (E); Sel Sertoli (S). Pewarnaan HE. Garis Skala a-d = 3 μm
S P R E
f
In E B S Rh
R A E S P Ze
P S R E Bg
Gambar 4 Tahapan 5 sampai tahapan 8. Tahap 5 (e) Spermatosit zigoten (Z); Spermatosit primer
(P); Spermatid bulat (R); Spermatid panjang/ elongated (E); Sel sertoli (S). Tahap 6 (f) Spermatogonia intermediet (In); Spermatosit primer (P); Spermatid bulat (R); Spermatid panjang (E); Sel Sertoli (S). Tahap7 (g) Spermatogonia tipe B (B); Spermatid bulat (R); Spermatid
panjang (E); Sel Sertoli (S). Tahap 8 (h) Spermatogonia tipe B (B); Spermatid panjang di lumen
Pada domba garut spermatogenesis dapat dibagi menjadi 8 tahap. Hal ini sama dengan yang telah dilaporkan pada kambing (Franca et al. 1999). Namun ada juga beberapa spesies lain yang memiliki tahap spermatogenesis yang berbeda seperti dilaporkan. Misalnya pada monyet 12 tahap, babi 8 tahap, sapi 12 tahap, dan tikus 14 tahap (Ross et al. 1995; Kerr & Krestser 1988). Perbedaan dari tahapan spermatogenesis disebabkan oleh perbedaan spesies, karakteristik fisilogi reproduksi masing-masing hewan dan perbedaan pola perkawinan.
Frekuensi Tahapan Spermatogenesis Domba Garut
Frekuensi relatif masing-masing tahapan spermatogenesis ditunjukkan pada Gambar 3. Tahapan frekuensi yang paling tinggi terdapat pada tahap 3 (19.58%), sedangkan tahapan frekuensi yang paling rendah terdapat pada tahap 4 (7.58). Perbedaan tinggi atau rendahnya frekuensi ini disebabkan oleh lamanya waktu sebuah sel dalam membelah. Misalnya terjadi pada tahap 4, sel spermatosit sekunder akan segera membelah setelah pembentukannya sehingga jarang dapat dilihat. Tahapan pre-meiosis terjadi pada tahap 1 sampai tahap 3 dengan jumlah total 47.83%, pembelahan meiosis ditunjukkan oleh tahap 4 dengan frekuensi 7.58%. Tahapan post-meiosis terjadi pada tahap 5 sampai tahap 8 dengan total frekuensi 44.58%.
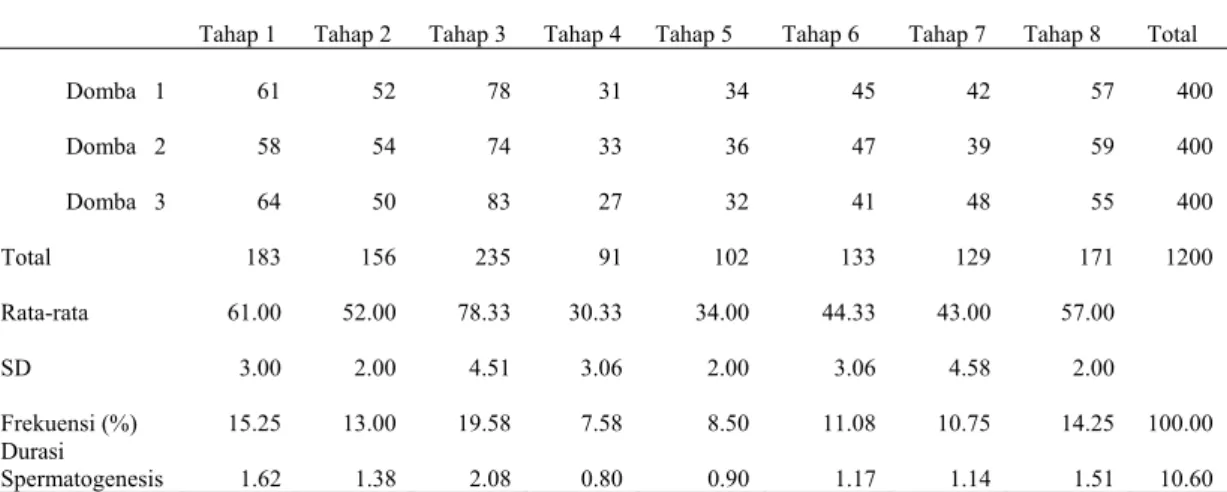
Hasil perhitungan frekuensi dan durasi tahapan spermatogenesis domba garut disajikan dalam Tabel 1.
Tabel 1 Frekuensi dan Durasi Tahapan Spermatogenesis pada domba garut
Tahap 1 Tahap 2 Tahap 3 Tahap 4 Tahap 5 Tahap 6 Tahap 7 Tahap 8 Total
Domba 1 61 52 78 31 34 45 42 57 400 Domba 2 58 54 74 33 36 47 39 59 400 Domba 3 64 50 83 27 32 41 48 55 400 Total 183 156 235 91 102 133 129 171 1200 Rata-rata 61.00 52.00 78.33 30.33 34.00 44.33 43.00 57.00 SD 3.00 2.00 4.51 3.06 2.00 3.06 4.58 2.00 Frekuensi (%) 15.25 13.00 19.58 7.58 8.50 11.08 10.75 14.25 100.00 Durasi Spermatogenesis 1.62 1.38 2.08 0.80 0.90 1.17 1.14 1.51 10.60
Dari Tabel 1, frekuensi tahapan spermatogenesis domba garut dapat disajikan dalam bentuk grafik dan diperoleh gambaran sebagai berikut:
15.25 13.00 19.58 7.58 8.50 11.08 10.75 14.25 0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 Frekuensi (%)
Tahap 1 Tahap 2 Tahap 3 Tahap 4 Tahap 5 Tahap 6 Tahap 7 Tahap 8
Tahapan Spermatogenesis
Gambar 5 Frekuensi relatif tahapan spermatogenesis domba garut
Jangka waktu dari satu siklus spermatogenesis adalah waktu total dari seluruh tahap spermatogenesis. Pada babi jantan (Franca & Cardoso 1998) satu siklus spermatogenesis membutuhkan waktu selama + 9 hari dan terjadi 4.5 siklus dalam keseluruhan spermatogenesis, sehingga lamanya spermatogenesis diperkirakan selama + 40.6 hari. Sementara itu pada kambing jangka waktu setiap siklus spermatogenesis adalah 10.6 + 0.5 hari dengan 4.5 siklus, sehingga spermatogenesis diperkirakan membutuhkan waktu 47.7 hari (Franca et al. 1999).
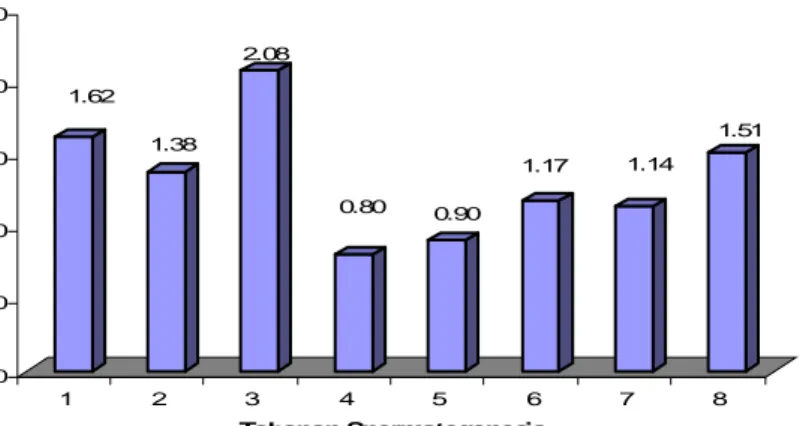
Jika data penelitian Franca et al. (1999) tersebut diaplikasikan pada penelitian ini, maka berdasarkan hasil perhitungan persentase yang diperoleh untuk tiap tahapan, maka pada domba garut waktu yang diperlukan untuk masing-masing tahapan spermatogenesis adalah : tahap1, 1.62 hari; tahap 2, 1.38 hari; tahap 3, 2.08 hari; tahap 4, 0.80 hari; tahap 5, 0.90 hari; tahap 6, 1.17 hari; tahap 7, 1.14 hari; tahap 8, 1.51 hari (Gambar 6).
1.62 1.38 2.08 0.80 0.90 1.17 1.14 1.51 0.00 0.50 1.00 1.50 2.00 2.50 Lamanya Tahapan Spermatogenesis (Hari) 1 2 3 4 5 6 7 8 Tahapan Spermatogenesis
Gambar 6 Durasi masing-masing tahapan spermatogenesis pada domba garut Pengaturan spermatogenesis dilakukan oleh hormon. Hormon-hormon yang penting untuk spermatogenesis adalah, Folicle Stimulating Hormon (FSH), Luteinizing Hormon (LH) yang disekresikan oleh hipofise dan hormon testosteron yang dihasilkan oleh sel-sel Leydig. Hormon-hormon ini berpengaruh pada sel sel spermatogenik dan sel Sertoli dalam tubuli seminiferi maupun sel-sel Leydig di daerah interstitial dan menstimulasi terjadinya spermatogenesis. Sel-sel Leydig distimulasi oleh LH akan menghasilkan testosteron dan memicu munculnya tanda kelamin sekunder pada organ lain. Sementara itu sel-sel Sertoli distimulasi oleh FSH untuk menghasilkan androgen binding protein (ABP) yang berfungsi mengikat dan mengkonsentrasikan testosteron. Kedua hormon inilah yang menginisiasi proses spermatogenesis pada testis. Jika terjadi peningkatan jumlah spermatozoa maka sel Sertoli memproduksi inhibin yang bersama dengan testosteron berperan sebagai negatif feedback pada sekresi gonadotropin releasing hormone (GnRH) dari hipotalamus (Tomaszewska et al. 1991). Perbedaan frekuensi dan lamanya waktu yang dibutuhkan pada masing-masing tahap spermatogenesis kemungkinan dapat disebabkan oleh beberapa faktor, antara lain spesies hewan, fisiologi reproduksi, kesuburan hewan, lamanya waktu yang dibutuhkan hewan dalam mencapai dewasa kelamin serta pola perkawinan. Dewasa kelamin dan proses spermatogenesis pada hewan jantan adalah dua hal yang berlangsung hampir bersamaan (Toelihere 1979).
KESIMPULAN
KesimpulanBerdasarkan perubahan bentuk sel germinatif, spermatogenesis pada domba garut dapat digolongkan dalam delapan tahap. Tahapan frekuensi yang paling tinggi terdapat pada tahap 3 (19.58%), sedangkan tahapan frekuensi yang paling rendah terdapat pada tahap 4 (7.58%).
Saran
1. Perlu dilakukan penelitian lanjutan dengan menggunakan berbagai pewarnaan yang lebih spesifik untuk mengetahui karakteristik sel-sel germinatif dan sel pendukung serta peranannya dalam proses spermatogenesis pada domba garut.
2. Perlu dilakukan penelitian lebih lanjut mengenai lamanya proses spermatogenesis pada domba garut.
DAFTAR PUSTAKA
Anonimous. 2007. Developmental stages of spermatogenesis.http://images.google.co.id.
_________ 2007. Domba Garut. http://www.dombagarut.com/bigger1.html. Dellman HD, Brown EM. 1976. Textbok of Veterinary Histology. Lea and Fibiger.
Philadelphia.
Djuwita I, Boediono A, Mohamad K. 2000. Bahan Kuliah Embriologi. Laboratorium Embriologi. Bagian Anatomi. Fakultas kedokteran Hewan. Institut pertanian Bogor. Bogor.
Dwiyanto M. 1999. Penanganan Domba dan Kambing. Cetakan Ke-3. Penerbit Penebar Swadaya. Jakarta. 83 Hal.
Franca LR, Silva SCB, Garcia HC. 1999. The length of the cycle of seminiferous epithelium in goats (Capra hircus). Tissue & Cell 31 (3) 274-280.
Franca LR, Cardoso FM. 1998. Duration of spermatogenesis and sperm transit time through the epididymis in the piau boar. Tissue & Cell 30 (5) 573-582.
Gatenby RM. 1986. Sheep Reproduction in The Tropics. Longman. London and New York.
Hardjosubroto W, Astuti M. 1979. Animal Genetics Resources in Indonesia Workshop on Animal Genetics Resources. Tsukuba. Japan.
Humason GL. 1972. Animal Tissue Techniques. Ed ke-3. San Fransisco : WH Freeman & Company.
Kerr JB, Kretser DM. 1988. The Cytology of The Testis. The Physiology of Reproduction. Raven Press. New York.
Kiernan JA. 1990. Histological and Histochemicals Methods: Theory and Practice. Ed ke-2. Departement of Anatomy, The University of Western Ontario. Pergamon Press, Canada. Pp: 96-186.
Leblond CP, Clermont Y. 1952. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Ann NY Acad Sci 55: 548–573.
Leite FLG. 2006. Cycle and duration of the seminiferous epitheliumin puma (Puma concolor).Anim Rep Sci 91: 307–316.
Mulyono S. 2000. Teknik Pembibitan Kambing dan Domba. Cetakan ke-3. Penerbit Penebar Swadaya. Jakarta. 88 Hal.
Nakai M, Van Cleeff JK, Bahr JM. 2004. Stages and duration of spermatogenesis in the domestic ferret (Mustela putorius furo). Tissue and Cell 36 (2004) 439–446.
O’Day DH. 2002. Formation of Male Sex Cells : Spermatogenesis. University of Toronto. Mississauga.
Ownby C. 1999. Spermatogenesis [media onlline]. http://www.cvm.okstate.edu/ intruction/mm_curr/histology/mR/HimRP4.htm.[28 Maret 2007].
Payne WJA, Williamson G. 1993. An Introduction to Animal Husbandary in The In reply Tropics. Edisi Indonesia : Pengantar Peternakan di Daerah Tropis. Ed ke-3. Gajah Mada University Press. Yogyakarta.
Ross HM, Romrell LJ, Kaye GI. 1995. Histology: A Text and Atlas 3th. Williams and Wilkins. Maryland. USA.
Russell LD, Ettlin RA, Hikim SAP, Clegg ED. 1990. Histological and Histopathological Evaluation of The Testis. Cache River Press, Clearwater Florida.
Segatelli TM et al. 2002. Kinetics of spermatogenesis in the mongolian gerbil (Meriones unguiculatus). Tissue & Cell 34 (1) 7-13.
Sharpe RM. 1994. Regulation of spermatogenesis. In: Knobil, E. and Neil, J.D. (eds), The physiology of reproduction. Raven Press. New York. Pp: 1363– 1434.
Sugeng B. 2000. Beternak Domba. Cetakan ke-13. Penerbit Penebar Swadaya. Jakarta. 72 Hal.
Toelihere MR 1979. Fisiologi Reproduksi Pada Ternak. Angkasa. Bandung. Tomaszewska MW, Sutama IK, Putu IG, Chaniago TD. 1991. Reproduksi
Tingkah Laku dan Produksi Ternak Di Indonesia. Gramedia Pustaka Utama. Jakarta. Pp: 4-38.
Lampiran 1 Pewarnaan Hematoksilin Eosin (HE) Xylol I, 2 menit
Xylol II, 2 menit
Xylol III, 2 menit
Alkohol absolut, 2 menit
Alkohol bertingkat (95%-70%), 2 menit
Cuci dengan air kran dan akuades, @ 5menit
Mayer`s Haematoksilin, 8 detik
Cuci dengan air kran, 3 menit
Cuci dengan air akuades, 5 menit Eosin 2-3 menit
Cuci dengan akuades, 5 menit
Alkohol bertingkat (95%-70%), @10 celupan
Alkohol absolut, @ 2 menit
Xylol I, II dan III, @ 5 menit
Lampiran 2 Komposisi Larutan Bouin Lamanya fiksasi 24 jam (sehari)
- Larutan asam pikrat jenuh (1 liter air + 20 gr pikrat) 75 ml (15) - Formalin (37/39 – 40%) 25 ml (5) - Acetic acid glacial 100% 5 ml (1) (dicampur dalam keadaan segar – fresh prior to use)