RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
Sekolah : SMAS ADHYAKSA 1 JAMBI
MataPelajaran : Kimia
Kelas/Semester : X-IPA / Genap MateriPokok : Stoikiometri AlokasiWaktu : 2 x 45Menit A. TujuanPembelajaran
Melalui pendekatan kontekstual dan konstruktivisme menggunakan model pembelajaran Problem Based Learning peserta didik dapat memahami konsep massa atom relatif dan molekul relatif, menghitung massa atom relatif dan molekul relatif serta menyelesaikan perhitungan massa atom dan massa molekul relatif dengan disiplin dan penuh tanggung jawab.
B. Kegiatan Pembelajaran
PENDAHULUAN
• Peserta didik memberi salam dan berdoa sebelum memulai pembelajaran (Religius)
• Mengecek kehadiran peserta didik sebagai wujud disiplin (Karakter Kemandirian)
• Peserta didik mengingat kembali materi struktur atom dan sistem periodik yang telah dipelajari sebelumnya (Apersepsi)
• Peserta didik mengamati dan menjawab pertanyaan yang diajukan oleh guru tentang massa suatu zat (Motivasi)
• Peserta didik menyimak guru menyampaikan tujuan dan penilaian yang akan dilakukan pada pembelajaran ini (Tujuan dan Penilaian)
KEGIATAN INTI
Orientasi Masalah • Peserta didik mendownload LKPD yang telah ditautkan di Google Classroom
• Peserta didik menjawab pertanyaan terkait analogi massa atom relative
Mengorganisasikan Peserta didik berdiskusi dan bekerjasama untuk menyelesaikan masalah yang terdapat dalam LKPD
Membimbing Penyelidikan
• Peserta didik dengan teliti mencari dan mengumpulkan data/informasi mengenai massa atom relatif dan molekul relatif
• Peserta didik berperan aktif dalam diskusi Mengembangkan dan
Menyajikan
Peserta didik menyelesaikan dan mempersentasikan hasil diskusi kelompok
Menganalisis dan Mengevaluasi
• Peserta didik menanggapi hasil diskusi kelompok lain dengan bahasa yang sopan dan santun
• Peserta didik merekonstruksi hasil diskusi kelompok yang telah disajikan
PENUTUP
• Peserta didik menyimak penguatan yang disampaikan oleh guru
• Peserta didik menyimpulkan pembelajaran yang telah dilakukan
• Melaksanakan penilaian untuk mengetahui ketercapaian indikator
• Peserta didik merefleksikan pembelajaran yang telah dilakukan
• Peserta didik menyimak guru terkait rencana pembelajaaran pertemuan berikutnya
• Berdoa dan memberi salam C. Penilaian
Jenis dan Teknik Penilaian
1. Penilaian Pengetahuan : Tes tertulis dan Penugasan Bentuk Instrumen : Soal uraian dan LKPD 2. Penilaian Keterampilan : Lembar Observasi 3. Penilaian Sikap : Jurnal dan Observasi
Mengetahui, Jambi, 21 April 2022
Plt. Kepala SMA Adhyaksa 1Jambi Guru Kimia
Juhaldi, S.Pd Sri Mulyani, S.Pd
Pembina
NIP.1972031419980 1 001
Instrumen Penilaian Observasi (Sikap) NamaSekolah : SMAS ADHYAKSA 1 JAMBI
TahunPelajaran : 2021/2022 Kelas/Semester : X/GENAP MataPelajaran : KIMIA
Topik : Massa Atom Relatif dan Massa Molekul Relatif
Indikator : Peserta didik menunjukkan perilaku disiplin, kerjasama, rasa ingin tahu, dan bertanggung jawab sebagai wujud kemampuan memecahkan masalah dan membuatkeputusan
No Nama Siswa
Perilaku Kerjasama Disiplin Rasa Ingin Ket
Tahu
Bertanggung Jawab 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
Cara pengisian lembar penilaian sikap adalah dengan memberikan skor pada kolom sesuai hasil pengamatan terhadap peserta didik selama kegiatan dengan mengisi angka yang sesuai kriteria berikut ini:
1 =Kurang 2 = Cukup 3 = Baik
4 = Sangat Baik
Dengan Nilai = Jumlah Skor perolehan / Skor total x 4
INSTRUMEN PENILAIAN SIKAP SPRITUAL DAN SOSIAL JURNAL PENILAIAN SIKAP
Nama Peserta Didik :
Kelas :
Aspek yang diamati :
No Hari/Tanggal Kejadian Keterangan/ Tindak Lanjut
1 2 3 4 5 dst
Petunjuk pengisian jurnal (diisi oleh guru)
• Tulislah identitas peserta didik yang diamati, tanggal pengamatan dan aspek yang diamati oleh guru
• Tuliskan kejadian-kejadian yang dialami oleh peserta didik baik yang merupakan kekuatan maupun kelemahan peserta didik sesuai dengan pengamatan guru terkait kompetensi inti
• Simpanlah kartu tersebut di dalam folder masing-masing peserta didik
LEMBAR PENILAIAN KETERAMPILAN
Mengkomunikasikan secara lisan dan tulisan hasil penyelesaian LKPD NamaSekolah : SMAS ADHYAKSA 1 JAMBI
MataPelajaran : Kimia
Materi :Stoikiometri
Kelas : X IPA
No. Nama Peserta Didik
Menjawab Pertanyaan
Jumlah Skor
Nilai
1 2 3 4
1.
2.
3.
Rubrik Penilaian:
Menjawab Pertanyaan:
1 = tidak dapat menjawabpertanyaan.
2 = mampu menjawab pertanyaan dengan alasan yang kurangbenar.
3 = mampu menjawab pertanyaan dengan alasan yang benar tetapi tidak didukungreferensi 4 = mampu menjawab pertanyaan dengan alasan yang benar dan didukungreferensi.
Pedoman Penskoran : Nilai = 𝑺𝒌𝒐𝒓 𝑺𝒊𝒔𝒘𝒂
𝑺𝒌𝒐𝒓 𝑴𝒂𝒌𝒔𝒊𝒎𝒂𝒍 x 100
LEMBAR PENILAIAN PENGETAHUAN NamaSekolah : SMAS ADHYAKSA 1 JAMBI
MataPelajaran : Kimia
Materi :Stoikiometri
Kelas : X IPA
NO NAMA SISWA NILAI KET
1 2 3 4 dst
Soal Tes Tertulis
1. Jika diketahui massa atom unsur Fe = 55,847 sma dan massa 1 atom C-12 = 12,000 sma. Hitunglah massa atom relatif Fe ?
2. Oksigen di alam terdiri dari 3 isotop dengan kelimpahan berikut:
16
O
17O
18O 99,76 % 0,04 % 0,20 %
Hitunglah massa atom rata-rata (Ar) dari unsur Oksigen tersebut ?
3. Hitunglah nilai yang terkandung dalam massa molekul relatif (Mr) dari senyawa Ca(OH)2 (Ar Ca =40, Ar O = 16, Ar H = 1) ?
4. Hitunglah nilai yang terkadandung dalam massa molekul relatif (Mr) dari senyawa Aluminium Sulfat Al2(SO4)3 (Ar Al = 27, Ar S = 32, Ar O = 16 ) ?
5. Hitunglah Mr dari CuSO4.5H2O (Ar Cu = 64, Ar S = 32, Ar O = 16, Ar H = 1)
Kunci Jawaban 1. Ar X = 𝑴𝒂𝒔𝒔𝒂 𝒓𝒂𝒕𝒂−𝒓𝒂𝒕𝒂 𝟏 𝒂𝒕𝒐𝒎 𝑿
𝟏
𝟏𝟐 𝒙 𝒎𝒂𝒔𝒔𝒂 𝟏 𝒂𝒕𝒐𝒎 𝑪𝟏𝟐 Ar Fe = 𝟓𝟓,𝟖𝟒𝟕 𝒔𝒎𝒂𝟏
𝟏𝟐𝒙 𝟏𝟐 𝒔𝒎𝒂 = 55, 847 Skor: 5
2. Ar X = (% 𝑿𝟏 𝒙 𝑴𝒂𝒔𝒔𝒂 𝑿𝟐)+ (%𝑿𝟐 𝒙 𝒎𝒂𝒔𝒔𝒂 𝑿𝟐)+ ( % 𝑿𝟑 𝒙 𝑴𝒂𝒔𝒔𝒂 𝑿𝟑)
% 𝑿𝟏+% 𝑿𝟐+% 𝑿𝟑
Ar Oksigen = (𝟗𝟗,𝟕𝟔 𝒙 𝟏𝟔)+ (𝟎,𝟎𝟒 𝒙 𝟏𝟕)+ (𝟎,𝟐𝟎 𝒙 𝟏𝟖)
𝟏𝟎𝟎 = 16 Skor: 5
3. Mr Ca(OH)2 = ( 1 x Ar Ca) + (2 x Ar O) + (2 x Ar H) = ( 1 x 40 ) + (2 x 16) + ( 2 x 1 )
= 40 + 32 + 2 = 74 Skor: 5
4. Mr Al2(SO4)3 = (2 x Ar Al) + (3 x Ar S) + (12 x Ar O) = ( 2 x 27) + (3 x 32) + (12 x 16)
= 54 +96 + 192 = 342 Skor: 5
Lembar Penilaian LKPD
No Pertanyaan Jawaban Skor
1 Kalsium atau zat kapur adalah
sebuah elemen kimiadengan simbol Ca.
Massa rata – rata satu atom Ca adalah 40 sma. Berapa massa atom relatif (Ar) Ca ?
Ar Ca = 𝑚𝑎𝑠𝑠𝑎 𝑟𝑎𝑡𝑎−𝑟𝑎𝑡𝑎 1 𝑎𝑡𝑜𝑚 𝐶𝑎 1
12 𝑥 𝑚𝑎𝑠𝑠𝑎 𝑎𝑡𝑜𝑚 𝐶−12
Ar Ca = 140 𝑠𝑚𝑎 12 𝑥 12 𝑠𝑚𝑎
= 40 sma
5
2 Perhatikan data spektrometer isotop - Ar Ne 5
isotop berikut ini :
= (90,9% x 20) + (0,2% x 21) + (8,9% x 22)
= 18,18 + 0,042 + 1,958
= 20,18 Tentukan Massa atom relatif (Ar) Ne.
3 Atom klorin di alam terdapat dalam dua isotop. Perhatikan tabel data massa atom dua isotop Klorin berikut ini :
Isotop Kelimpahan Massa (amu)
Cl-35 75,53% 34,969
Cl-37 24,47% 36,966
Berapakah massa atom relative (Ar Cl)?
Ar Cl 5
= (34,969 x 75,53%) + (36,966 x 24,47%)
= 26,412 + 9,045
= 35,45
4 Magnesium sulfat adalah senyawa kimia Mr MgSO4.7H2O 5 garam anorganik yang mengandung
magnesium, sulfur dan oksigen,dengan = Ar Mg + Ar S + (11 x Ar O) + (14 x Ar H) rumus kimia MgSO4. Di alam, terdapat = 24 + 32+ (11 x 16) + (14 x 1)
dalam bentuk mineral sulfatheptahidrat
epsomit (MgSO4.7H2O), atau umumnya = 24 + 32 + 176 + 14 disebut garam Epsom. Nama inidiambil = 246
dari sebuah air terjun mengandung saline yang terdapat di kota Epsom diSurrey, Inggris. Berapa massa molekul relatif (Mr) dari garam Epsom jika diketahui Ar Mg = 24, H = 1, S = 32, O = 16 ?
5 Tembaga adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cu;
nomor atom 29; dan massa atom relatifnya 63,5. Hitung mol dan jumlah atom Cu pada 14,605 gram Cu dengan menggunakan faktorkonversi.
a. 14,605 g Cu → ? molCu
1 mol Cu = 63,5 gram
14,605 g x = 0,23 mol Cu b. 14,605 g Cu → ? mol Cu → ?
atom Cu 1 mol Cu = 63,5gram 1 mol Cu = 6,02 x 1023 atom Cu
= 14,605 g x 1 𝑚𝑜𝑙 𝐶𝑢
63,5 𝑔 x6,02𝑥1023𝑎𝑡𝑜𝑚 𝐶𝑢 1 𝑚𝑜𝑙 𝐶𝑢
= 1,38 x 1023 atom Cu
10
Pedoman Penskoran : Nilai = 𝑆𝑘𝑜𝑟 𝑆𝑖𝑠𝑤𝑎
𝑆𝑘𝑜𝑟 𝑀𝑎𝑘𝑠𝑖𝑚𝑎𝑙 x 100
LEMBAR KERJA PESERTA DIDIK1
MASSA ATOM RELATIF (Ar) DAN MASSA MOLEKUL RELATIF (Mr)
3.
LEMBAR KERJA PESERTA DIDIK
MASSA ATOM RELATIF (Ar) DAN MASSA MOLEKULRELATIF (Mr)
Nama :
Kelas :
.
PETUNJUK:
Bacalah dengan teliti masalah yang telah disajikan.
Jawablah pertanyaan yang ada di LKPD dengan mandiri
Bahaslah soal yang telah dikerjakan
KOMPETENSI DASAR DAN INDIKATOR PENCAPAIAN KOMPETENSI
KOMPETENSI DASAR INDIKATOR PENCAPAIAN KOMPETENSI
3.10 Menerapkan hukum-hukum dasar kimia, konsep massa molekul relatif, persamaan kimia, konsep mol, dan kadar zat untuk menyelesaikan perhitungan kimia.
3.10.1 Memahami konsep massa atom relatif 3.10.2 Memahami konsep massa molekul relatif
3.10.3 Menghitung massa atom relatif 3.10.4 Menghitung massa molekul relatif
4.10 Menganalisis data hasil percobaan menggunakan hukum- hukum dasar kimia kuantitatif.
4.10.1 Menyelesaikan perhitungan massa atom relatif dan massa molekul relatif
TUJUAN PEMBELAJARAN
Melalui pendekatan kontekstual dan konstruktivisme menggunakan model pembelajaran Problem Based Learning peserta didik dapat memahami konsep massa atom relatif dan molekul relatif, menghitung massa atom relatif dan molekul relatif serta menyelesaikan perhitungan massa atom dan massa molekul relatif dengan disiplin dan penuh tanggung jawab.
12grCarbon = 6,022 x 1023atomCarbon Massa Atom Relatif (Ar)
Fenomena
Bagaimana cara menentukan berapa buah biji kacang hijau jika anda membeli kacang hijau yang massanya 1 kg? (masyarakat lebih sering memakai istilah berat dibandingkan massa, yang betulnya massa)? Berapa jumlah butir beras dalam I kg beras? Berapa jumlah butir wijen dalam I kg? Pertanyaan ini analog dengan berapa jumlah atom pada isotop C- 12 jika massanya 12 g? Anda tidak mungkin menimbang secara langsung satu atom, bukan? Anda tidak mungkin bisa memegang dan menimbang secara langsung 1 atom, tetapi anda bisa memegang dan menimbang satu biji kacang hijau. Tidak ada timbangan untuk menimbang 1 atom!. Bagaimana ilmuwan menggunakan akalnya untuk menentukan massa 1 atom?
Massa sebuah atom sangat kecil. Bagaimana ilmuwan memperoleh datanya? Sebuah atom isotop Carbon-12 mempunyai massa 12 amu (atomic mass unit). Data ini diperoleh dari spektroskopi massa. Massa molar karbon-12 adalah 12 g (mengandung 6,02 x 1023 atom karbon-12). Seberat apakah 12 amu? Berapa gramkah 1 amu?
Timbangan yang tersedia di laboratorium dalam satuan mg atau g. Kita bekerja di laboratorium dalam skala g atau mg bahkan dalam skala ton dalam industri, bukan dalam skala amu. Bagaimana hubungan satuan “amu” dengan satuan “g”?
Massa atom relatif (Ar) menyatakan perbandingan massa rata-rata suatu atom dengan massa atom pembanding (massa atom standar). Para ahli kimia sepakat bahwa massa atom standar yang digunakanadalah massa 1 atom C-12. Massa 1 atom C- 12 yaitu sebesar 12sma.
Sebagai contoh, untuk N-14 dengan massa 14 sma
Ar N= =14
Ar O = =16 ;Ar C=12,ArP=31,Ar K= 39,ArNa=23, dan lain-lain.
Massa suatu atom dapat ditentukan berdasarkan massa rata-rata dari seluruh isotop atom tersebut. Perhatikan analogi berikut ini :
Massa laki-laki (massa isotop) 70 kg
70 kg 70 kg
Jumlah laki-laki 30% (kelimpahan isotop) Massa perempuan (massa isotop)
50 kg 50 kg 50 kg 50 kg 50 kg
50 kg 50 kg
Jumlah perempuan 70% (kelimpahan isotop) Jadi rata-rata massa = (3x70) + (7x50)
10 = 56 kg Ar X = (30% x 70) + (70% x 50)
1
12 . 12 = 56
Silahkan klik link berikut untuk mempelajari lebih lanjut contoh soalnya!https://www.youtube.com/watch?v=Y7QY6sWteIk
Mr senyawa =
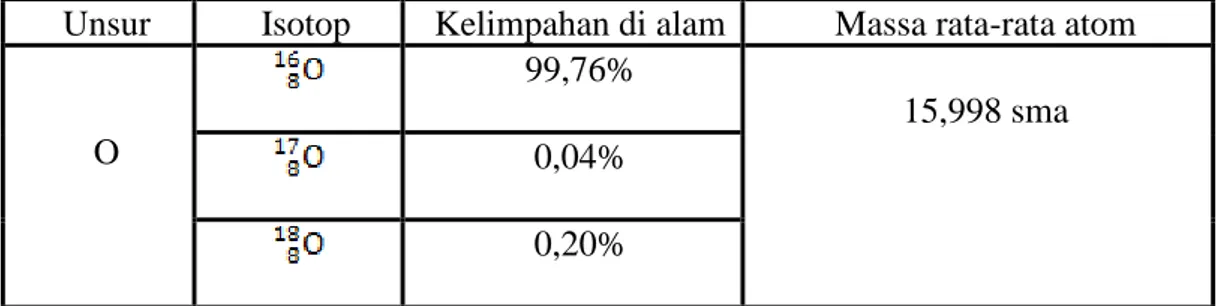
Setelah itu, perhatikan perhitungan massa rata-rata atom O berdasarkan tabelberikut.
Tabel 1. Hasil pengukuran menggunakan spektrometer massa beberapa isotop atom di alam.
Unsur Isotop Kelimpahan di alam Massa rata-rata atom
O
99,76%
15,998 sma 0,04%
0,20%
Massa rata-rata satu atom O dapat ditentukan dengan cara sebagai berikut :
Massa rata-rata atom O = (99,76% x 16) sma + (0,04% x 17) sma + (0,20% x 18) sma
= 15,954 sma+ 0,007 sma + 0,036 sma
= 15,998 sma
Hubungan Bilangan Avogadro dan Massa Molar (Ar)
Dalam kehidupan sehari-hari, kita selalu menggunakan satuan. Sebagai contoh 1 pasang (2 item), 1 lusin (12 item), 1 gross (144 item), 1 kodi (20 item) dan 1 rim (500 item).
Semua satuan ini sangat kita kenal. Apakah satuan dalam kimia? Pada ilmu kimia satuan yang berkaitan dengan jumlah atom, ion atau molekul pada suatu zat dikenal dengan mole. Mole disingkat dengan “mol” yang merupakan satuan SI untuk jumlah zat. Definisi SI mol merujuk ke sejumlah atom yang terdapat tepat pada 12 g isotop 12C (Carbon-12).
Berapakah angkanya? Telah banyak eksperimen yang dilakukan untuk menentukan angka tersebut. Angka yang baru-baru ini diterima adalah 6,0221415 x 1023. Ilmuwan menamakan angka ini dengan bilangan Avogadro, penghargaan terhadap ilmuwan Italia, Amedeo Avogadro (1776-1856). Bilangan Avogadro umumnya dibulatkan menjadi 6,022 x 1023. Dengan demikian, 1 mol atom, 1 mol molekul atau 1 mol ion, jumlahnya sebanyak bilangan Avogadro.
Notasi bilangan Avogadro (1 mol X = 6,022 x 1023 atom X) dan massa molar (1 mol X = massa molar X) dapat digunakan sebagai faktor konversi.
1 𝑚𝑜𝑙 𝑥
𝑚𝑎𝑠𝑠𝑎 𝑚𝑜𝑙𝑎𝑟 𝑥 = 1 dan 1 𝑚𝑜𝑙 𝑥
6,022 𝑥 1023 = 1
Massa Molekul Relatif (Mr)
Massa molekul relatif (Mr) adalah perbandingan massa molekul dengan massa atom standar.
Hubungan Massa Molekul dan Massa Molar (Mr)
Massa molekul adalah jumlah massa atom pada molekul tersebut. Massa molar molekul merupakan massa 1 mol molekul tersebut.
Mr = ∑ Ar atom penyusun
Contoh : Hitung berapa massa 1 molekul H2O? Hitung juga massa 1 mol air ? 1 molekul H2O = 2 atom H + 1 atom O
1 mol H2O = 6,022 x 1023 molekul H2O
MakaMassa 1 molekul H2O = massa 2 atom H + massa 1 atom O
= (2 x 1,008 amu) + (16,00 amu) = 18,02 amu Massa 1 mol H2O = 6,022x1023 x 16,02 amu x 1 𝑔𝑟𝑎𝑚
(6,022 𝑥 1023)𝑎𝑚𝑢 = 18,02 gram
Molekul adalah gabungan dari atom-atom. Oleh karena itu, massa molekul relatif (Mr) sama dengan jumlah dari massa atom relatif semua atom penyusun molekul. Jadi,
Contoh: Mr NaCl = Ar Na+Ar Cl = 23 + 35,5 = 58,5
Sederhana Kannn
KEGIATAN
Jawablah soal-soal berikut dengan tepat dan benar!
1. Kalsium atau zat kapur adalah sebuah elemen kimia dengan simbol Ca. Massa rata – rata satu atom Ca adalah 40sma. Berapa massa atom relatif (Ar) Ca ?
2. Perhatikan data spektrometer isotop-isotop ini :
Tentukan Massa Atom Relatif (Ar) Ne.
3. Atom klorin di alam terdapat dalam dua isotop. Perhatikan tabel data massa atom dua isotop Klorin berikut ini :
Berapakah massa atom relative (Ar Cl)?
4. Magnesium sulfat adalah senyawa kimia garam anorganik yang mengandung magnesium, sulfur dan oksigen, dengan rumus kimia MgSO4. Di alam, terdapat dalam bentuk mineral sulfat heptahidrat epsomit (MgSO4.7H2O), atau umumnya disebut garam Epsom. Nama ini diambil dari sebuah air terjun mengandung saline yang terdapat di kota Epsom di Surrey, Inggris. Berapamassa molekul relatif (Mr) darigaram Epsom jika diketahui Ar Mg = 24, H = 1, S = 32, O =16 ?
Isotop Kelimpahan Massa (amu) Cl-35 75,53% 34,969 Cl-37 24,47% 36,966
5. Tembaga adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cu; nomor atom 29; dan massa atom relatifnya 63,5. Hitung mol dan jumlah atom Cu pada 14,605 gram Cu dengan menggunakan faktor konversi.
\
:
KESIMPULAN
Apa yang bisa kalian simpulkan mengenai materi Massa Atom relatif dan Massa Molekul Relatif ? Tuliskan kesimpulanmu dibawah ini!