BAB 8
KONSEP PARTIKEL
KONSEP PARTIKEL
MATERI
MATERI
Standar Kompetensi:
Menjelaskan Konsep Partikel Materi.
Kompetensi Dasar:
Menjelaskan konsep atom, ion, dan molekul.
Menghubungkan konsep atom, ion, dan molekul dengan produk kimia sehari-hari.
Membandingkan molekul unsur dan molekul senyawa.
KONSEP
PARTIKEL MATERI
atom ion
produk kimia
teori atom
model atom
ion positif
ion negatif
molekul
molekul unsur
Materi di alam jenisnya sangat banyak, untuk mempermudah mempelajarinya perlu dikelompok-kelompokkan menjadi zat tunggal (unsur dan senyawa) dan campuran (homogen dan heterogen). Unsur, senyawa, maupun campuran tersusun oleh partikel dasar yang sama disebut atom. Atom adalah bagian terkecil dari unsur yang masih memiliki sifat sama seperti unsur tersebut. Para ahli kimia berusaha mencari cara untuk mempelajari unsur yang jenisnya kian bertambah.
A. ATOM
1. Teori Atom
Para ahli filsafat Yunani sejak 2000 tahun yang lampau merumuskan gagasan bahwa zat itu tidak dapat dihancurkan atau dibagi secara terus menerus.
Partikel adalah zat terkecil yang tidak dapat dipecahkan lagi. Hal ini, oleh Demokritos dinamakan atom. Atomosberarti tidak dapat dibagi lagi. Konsep tentang atom tidak dilandasi eksperimen, tetapi menurut hasil pemikiran.
Awal abad 19 gagasan tentang atom dan bagian terkecil daripada zat dipelajari oleh John Daltonyang menggunakan teorinya sebagai berikut.
a. Atom adalah partikel terkecil dari suatu materi yang sudah tidak dapat dibagi-bagi.
b. Atom suatu unsur tidak dapat berubah menjadi atom unsur lain. c. Atom-atom dapat membentuk molekul.
d. Atom-atom suatu unsur mempunyai sifat-sifat dan massa yang sama.
e. Pada reaksi kimia atom bergabung menurut perbandingan tertentu yang sederhana.
Teori ini terutama memuaskan sekali dalam menerangkan percobaan-percobaan reaksi kimia. Meskipun dengan kemajuan teknologi, di mana atom diketahui masih mempunyai bagian-bagian, namun hal ini tidak mempengaruhi nilai teori Dalton. Bagaimanapun juga teori Dalton merupakan sumbangan besar terhadap perkembangan ilmu pengetahuan pada saat itu.
2. Model Atom
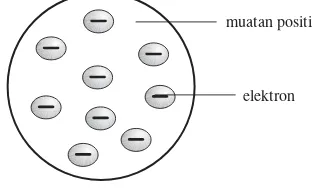
a. Model Atom J.J Thomson
Bila John Dalton mengemukakan teorinya seperti di atas, bahwa atom tidak dapat dibagi lagi, ternyata bertentangan dengan eksperimen-eksperimen.
Gambar 8.1 Model atom J.J. Thomson
Partikel-partikel yang lebih kecil, yang membentuk atom-atom sekarang banyak kita kenal. Sehubungan dengan penemuan elektron yang menjadi bagian dari atom maka J.J. Thomsonmenyarankan untuk pertama kali suatu model atom.
Teori atom menurut J.J. Thomson.
1) Atom berbentuk bola pejal yang bermuatan positif dan mengandung sejumlah elektron bermuatan negatif yang tersebar di seluruh zat atom.
2) Jumlah muatan positif dalam atom sama dengan jumlah muatan negatif elektron sehingga secara keseluruhan muatan atom adalah netral.
Model atom ini tidak dikembangkan secara terperinci, karena ternyata tidak cocok dengan percobaan-percobaan Rutherford.
b. Model Atom Rutherford
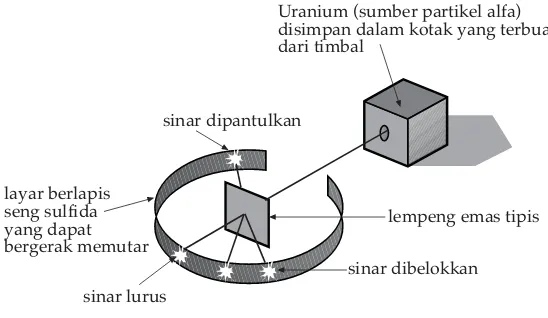
Ernest Rutherford pada tahun 1911 mengemukakan teorinya tentang susunan
atom. Untuk membuktikan teorinya di dalam laboratorium Rutherford, Geoger, dan Marsder mengadakan suatu percobaan dengan menembakkan partikel-partikel alpa pada suatu lempengan emas yang sangat tipis, yaitu setebal 0,01 mm atau kira-kira setebal 200 atom. Apabila model atom Thomson itu benar, maka partikel-partikel alpa tidak akan dihamburkan pada saat mengenai lempengan emas.
Partikel alpa dengan energi yang sangat besar dan massa elektron diharapkan akan bergerak lurus, tak terganggu oleh elektron dan muatan positif atom emas yang menyebar di sekitar elektron.
Gambar 8.2
Percobaan Rutherford menggunakan partikel alfa
Ternyata partikel-partikel alpa yang digunakan dalam percobaan itu tidak seluruhnya dapat menembus lempengan emas secara lurus, tetapi beberapa di antaranya ada yang dibelokkan, bahkan ada yang dikembalikan dengan membentuk sudut antara 90osampai 120o. Hal ini menunjukkan bahwa muatan positif dari atom
tidak menyebar, tetapi mengumpul pada suatu tempat dalam tiap-tiap atom, sehingga dapat menghamburkan partikel-partikel alpa pada saat menumbuk atom-atom tersebut. Percobaan inilah yang mendorong Rutherford pada tahun 1911 untuk menyusun model atom yang baru.
layar berlapis seng sulfida yang dapat bergerak memutar
Uranium (sumber partikel alfa) disimpan dalam kotak yang terbuat dari timbal
sinar dipantulkan
lempeng emas tipis
Menurut Rutherford
Atom tersusun dari inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif bergerak mengelilingi inti tersebut
Gambar 8.3 Model atom Rutherford
c. Model Atom Bohr
Niels Bohrmenyusun model atom berdasarkan model atom Rutherford dan teori kuantum. Model atom Bohr berdasarkan postulat-postulat berikut.
1) Elektron tidak dapat berputar mengelilingi inti pada setiap lintasan, tetapi hanya melalui lintasan tertentu tanpa membebaskan energi. Lintasan ini disebut lintasan stasioner.
2) Jika elektron berpindah dari salah satu lintasan ke lintasan lain yang terhadapnya lebih dalam, akan dipancarkan energi dan bila berpindah ke lintasan yang letaknya lebih luar, akan diserap energi.
Model atom Bohr digambarkan sebagai berikut.
Kelebihan atom Bohr adalah bahwa atom terdiri atas beberapa kulit untuk tempat berpin-dahnya elektron.
Kelemahan model atom ini adalah tidak dapat menjelaskan spektrum warna dari atom berelek-tron banyak. Dengan demikian diperlukan model atom yang lebih sempurna dari model atom Bohr. Berdasarkan uraian di atas ternyata masing-masing model atom mempunyai kelebihan dan
kelemahan.
Tabel 8.1 Kelebihan dan Kelemahan model atom
Model Atom
Menurut Thomson seperti roti kismis
Kelebihan
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur. Selain itu juga memas-tikan bahwa atom tersusun dari partikel yang bermuatan positif dan negatif untuk membentuk atom netral. positif dalam bola dan jumlah elektron.
3. Ion
Dalam perkembangan teori atom di dapat bahwa inti atom tersusun atas partikel proton yang bermuatan positif dan partikel netron yang bermuatan netral.
Di dalam atom netral jumlah proton sama dengan jumlah elektron.
Karena suatu sebab elektron dari suatu atom dapat keluar dari atomnya dan karena sesuatu sebab pula sebuah atom dapat menangkap elektron dari luar.
Atom yang kehilangan elektron menjadi ion positif dan atom yang mendapat tambahan elektron menjadi ion negatif.
Contoh, dalam ikatan antara atom hidrogen (H) dan atom klorida (Cl) membentuk asam klorida (HCl), maka atom hidrogen kehilangan satu elektron menjadi ion positif hidrogen (H+) dan atom klorida menangkap satu elektron menjadi ion negatif klorida
(Cl-).
4. Molekul Unsur dan Molekul Senyawa
Bila kita merebus air dalam panci secara terus-menerus, maka air dalam panci akhirnya dapat habis berubah menjadi uap air di udara. Kita tidak dapat melihat uap air itu. Partikel-partikel air itu terlalu kecil untuk dilihat, walaupun menggunakan mikroskop.
Partikel yang kecil itu disebut molekul air.
Molekul adalah bagian terkecil dari suatu zat yang masih mempunyai sifat zat itu. Molekul-molekul tersebut ada yang tersusun dari atom-atom yang sejenis ada juga yang tersusun dari beberapa jenis atom.
Molekul yang tersusun dari atom-atom sejenis disebut molekul unsur, misalnya molekul oksigen (O2), molekul hidrogen (H2), dan molekul nitrogen (N2).
Oksigen dari atas dari samping fosfor Sulfur (belereng)
Gambar 8.5 Molekul Unsur
Model Atom
Menurut Rutherford seperti planet bumi mengelilingi matahari
Menurut Neils Bohr seperti bola, dengan inti atom yang dikelilingi sejumlah elektron
Kelebihan
Membuat hipotesa bahwa atom tersusun atas inti atom dan elektron yang me-ngelilingi inti.
Mampu membuktikan adanya lintasan elektron untuk atom hidrogen.
Kelemahan
Model tersebut tidak dapat menerangkan mengapa elektron tidak pernah jatuh ke dalam inti sesuai dengan teori fisika klasik.
Molekul yang tersusun dari beberapa jenis atom disebut molekul senyawa, misal-nya molekul asam sulfat (H2SO4), molekul air (H2O) dan molekul karbondioksida (CO2).
Asam Sulfat (asam belereng)
H = Hidrogen S = belereng
O = Oksigen C = karbon
Gambar 8.6 Molekul senyawa
UJI PEMAHAMAN
Kerjakan soal di bawah ini dengan benar!
1. Berasal dari kata apakah atom itu? Dan apa arti kata tersebut?
2. Apa yang mendasari Rutherford menggambarkan model atom yang tidak sama dengan model atom J.J. Thomson?
3. Bilamana sebuah atom berubah menjadi ion positif?
4. a. Apa sajakah contoh molekul unsur selain O2, H2, dan N2? (Dua contoh saja) b. Apa sajakah contoh molekul senyawa selain H2SO4, H2O dan CO2? (Dua saja)
B. HUBUNGAN ATOM, ION, DAN MOLEKUL DENGAN PRODUK
KIMIA
Perhatikan gambar di antara produk kimia yang tersaji pada penjual bakso di bawah ini.
Sumber: Doc Mefi
Gambar 8.7 Penjual Bakso Mi Ayam
Bila kita membeli bakso, di depan kita sering tersaji berbagai macam sajian untuk menambah selera makan, misalnya garam dapur, saos, kecap, sambal, dan cuka. Garam dapur biasa digunakan untuk menambah rasa asin, sedang cuka digunakan untuk menambah rasa asam.
S
O
O O
H
O
H
O
Garam dapur yang dalam bahasa kimianya natrium klorida memiliki rumus NaCl. Garam dapur (NaCl) tersusun atas ion-ion, yaitu ion positif yang berasal dari natrium (Na+) dan ion klorida (Cl-) sebagai ion negatif.
Adapun pada cuka (Asam Asetat) memiliki rumus molekul CH3COOH. Asam asetat tersusun atas dua atom C (karbon), empat atom H (hidrogen), dan dua atom O (oksigen). Semua atom dalam asam asetat bersatu membentuk senyawa dengan per-bandingan tertentu.
Kadang kita juga sering melihat tulisan dalam label cuka yaitu 25%. Hal ini menunjukkan bahwa dalam 100 mL larutan cuka, 25 mL adalah cuka dan 75 mL adalah pelarut/pengencer yang biasanya menggunakan air.
Dari uraian di atas jelas bahwa ada kaitan erat antara produk kimia dengan konsep atom, ion, atau molekul.
Tugas
1. Cari lima produk kimia yang ada di sekitar kalian dan catat unsur-unsur yang menyusun produk kimia tersebut!
2. Jika pada botol alkohol tertulis label 70% apa arti tulisan tersebut?
ANGKUMAN
1. Atom : bagian terkecil dari sutau partikel yang tidak dapat dibagi-bagi lagi. 2. Ion : atom yang jumlah proton yang tidak sama dengan jumlah elektronnya. 3. Ion positif : ion yang jumlah proton lebih banyak dari jumlah elektron. 4. Ion negatif : ion yang jumlah elektron lebih banyak dari jumlah proton. 5. Molekul : bagian terkecil dari suatu zat yang mempunyai sifat sama dengan
zatnya.
6. Molekul unsur : molekul yang tersusun dari atom-atom sejenis.
I. Pilihlah salah satu jawaban yang paling benar!
1. Bagian terkecil suatu zat yang masih memiliki sifat zat itu disebut ....
a. atom c. senyawa
b. molekul d. unsur 2. Partikel penyusun atom yang
bermuatan positif disebut .... a. proton c. netron b. elektron d. positron 3. Parikel terkecil dari suatu unsur
yang tidak dapat dibagi-bagi lagi menjadi zat lain disebut ....
a. unsur c. molekul b. senyawa d. atom 4. Di bawah ini yang tergolong
molekul senyawa adalah .... a. gas karbondioksida b. gas oksigen
c. gas nitrogen d. gas helium
5. Zat tunggal yang tidak dapat di-uraikan lagi secara kimia biasa disebut ....
a. senyawa c. larutan b. campuran d. unsur 6. Dalam molekul senyawa terdiri
atas unsur ....
a. sejenis
b. berlainan jenis c. logam
d. bukan logam
7. Dalam sebuah atom di dapat jumlah proton lebih banyak dari jumlah elektron, maka atom tersebut dinamakan ....
a. ion positif b. senyawa positif c. ion negatif d. senyawa negatif
8. Sebatang kaca setelah digosok dengan kain sutera menjadi bermuatan positif, hal ini terjadi karena atom kaca ....
a. kehilangan elektron b. kehilangan proton c. ketambahan elektron d. ketambahan proton
9. perbandingan atom-atom H, S, dan O dalam molekul H2SO4adalah .... a. 1 : 2 : 4 c. 2 : 1 : 4 b. 2 : 4 : 1 d. 1 : 4 : 2 10. Molekul NH3termasuk molekul ....
a. unsur c. negatif b. postif d. senyawa
JI KOMPETENSI
U
II. Kerjakan soal-soal di bawah ini!
1. Apa yang dimaksud dengan:
a. Atom b. Ion c. molekul
2. Bilamana elektron dalam sebuah atom dalam pindah lintasan: a. menyerap energi dari luar
b. melepaskan energi
3. Batang ebonit setelah digosok dengan kain wool ternyata batang ebonit bermuatan negatif dan kain wool bermuatan positif. Jelaskan proses terjadinya hal tersebut!
4. Sebutkan persamaan dan perbedaan antara molekul unsur dan molekul senyawa!