PADA PEMISAHAN KLORAMFENIKOL DAN LIDOKAIN HCl SEBAGAI ZAT AKTIF DALAM SEDIAAN OBAT TETES TELINGA
COLME®
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Felicia Putri Hernat
NIM : 088114007
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PADA PEMISAHAN KLORAMFENIKOL DAN LIDOKAIN HCl SEBAGAI ZAT AKTIF DALAM SEDIAAN OBAT TETES TELINGA
COLME®
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Felicia Putri Hernat
NIM : 088114007
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
Halaman Persembahan
“Success is going from failure to failure without losing enthusiasm.”
Winston Churchill
“Inaction breeds doubt and fear. Action breeds confidence and courage. If you want to conquer fear, do not sit home and think about it.Go out and get
busy!”
Dale Carnegie
Twenty years from now you will be more disappointed by the things
that you didn’t
do than by the ones you did so. So throw off the
bowlines. Sail away from the safe harbor. Catch the trade winds in
your sails.
EXPLORE. DREAM. DISCOVER!
This is a tribute,
my
unpretentious
dedication.
I dedicated this
to Papi and
Mami.
I’d
like to share
this bliss with
vii
Puji dan syukur kepada Tuhan Yang Maha Esa atas rahmat, berkat, cinta, ijin dan penyertaanNya yang begitu besar, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi berjudul “Optimasi Metode Kromatografi Lapis
Tipis Densitometri pada Pemisahan Kloramfenikol dan Lidokain HCl sebagai Zat Aktif dalam Sediaan Obat Tetes Telinga Colme®”.
Penulis menyadari bahwa penelitian dan penyusunan skripsi ini dapat terselesaikan oleh karena kritikan, saran, diskusi, arahan, dan bimbingan dari berbagai pihak. Penulis mengucapkan terima kasih kepada :
1. Rita Suhadi, M.Sc., Apt selaku dekan Fakultas Farmasi Universitas Sanata Dharma periode 2006-2010 yang memberikan kesempatan kepada saya untuk menuntut ilmu di fakultas ini.
2. Ipang Djunarko, M.Sc., Apt selaku dekan Fakultas Farmasi Universitas Sanata Dharma periode 2010-2014 atas teladan dan dedikasi yang diberikan. 3. Christine Patramurti, M.Si., Apt selaku dosen pembimbing atas kesabaran dan
waktunya dalam memberikan arahan, kritik, saran, dan kesediaan beliau membuka wawasan saya. Terima kasih atas pendampingannya dari awal sampai akhir penelitian dan penyusunan penulisan skipsi.
4. Jeffry Julianus, M.Si. selaku dosen penguji atas bimbingan, diskusi, semangatnya.
viii
atas waktu yang diluangkan untuk memberikan masukan selama penulisan ini.
7. Siswanto Tanuatmojo atas waktu luang yang disediakan untuk berdiskusi via internet dan terima kasih atas keterbukaan, keramahan bapak yang mengiringi langkah penelitian ini.
8. dr. Fenty selaku dosen pendamping akademik atas pendampingan dan perhatiannya terhadap perkembangan saya selama masa perkuliahan ini. 9. Semua dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma atas
ilmu, pengalaman, semangat dan persahabatan berharga yang dibagikan. 10. Prasilya dan Regina Clarissa sebagai rekan kerja dalam penelitian ini. Terima
kasih atas kesabaran, kerjasama, persahabatan, canda, dan semangat selama ini.
11. Sari Tambunan, Theresia Wijayanti, Winarti H. Wibowo, Novi Chairio, Helena Angelina Kurniawan, Citra Dewi Aryani, Ayesa Syenina, Dina Christiana Dewi, Amelia Ernesta, Agnes Susianti, Florentina Sunaryo, Sandra Ruby sebagai teman seperjuangan dalam satu lantai laboratorium Analisis Instrumental. Terima kasih atas diskusi, semangat, dan keceriaan selama kita bekerja bersama-sama.
ix
kasih atas semua kebersamaan, dan bantuan selama perkuliahan.
14. Teman-teman kost Gracia, Lia, Fenny, Puji dan teman-teman UKM Kempo yang selalu memberikan kepada saya limpahan saran, semangat, kasih, dan kebersamaan.
15. Semua pihak yang tidak dapat disebutkan satu persatu, atas segala bantuan, semangat, dan doa yang menyertai penulis dari awal penelitian sampai akhir terselesaikannya penulisan skripsi.
Penulis menyadari adanya kekurangan dalam penyusunan skripsi oleh karena keterbatasan wawasan dan kemampuan. Penulis membuka diri untuk menerima saran yang membangun dari semua pihak. Penulis dengan segala kerendahan hati mengharapkan skripsi ini memberi manfaat bagi para pembaca. Akhir kata, penulis mempersembahkan skripsi ini dengan demi majunya ilmu pengetahuan farmasi.
x
HALAMAN JUDUL………... i
HALAMAN PERSETUJUAN PEMBIMBING……….. ii
HALAMAN PENGESAHAN………. iii
HALAMAN PERSEMBAHAN ………. iv
PERNYATAAN KEASLIAN KARYA ………. v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ……….. vi
PRAKATA………... vii
DAFTAR ISI……… x
DAFTAR TABEL……… xiv
DAFTAR GAMBAR………... xv
DAFTAR LAMPIRAN……… xvii
INTISARI………. xix
ABSTRACT………... xx
BAB I PENDAHULUAN……… 1
A. Latar Belakang………. 1
1. Permasalahan……… 3
2. Keaslian penelitian………...……… 3
3. Manfaat penelitian……… 4
B. Tujuan………...………... 4
BAB II PENELAAHAN PUSTAKA……….. 5
A. Kloramfenikol………...………... 5
xi
………...………
D. Colme® Ear Drop………...………….. 7
E. Kromatografi Lapis Tipis (KLT) ………...……….. 8
1. Tinjauan umum………...………. 8
2. Sistem KLT………...………... 9
3. Aplikasi penotolan sampel………..……… 11
4. Penilaian kromatogram………...………. 11
F. Densitometri………...……….. 16
G. Landasan Teori………...……….. 17
H. Hipotesis………...………... 18
BAB III METODE PENELITIAN……….. 20
A. Jenis dan Rancangan Penelitian………...……… 20
B. Variabel Penelitian………...……… 20
C. Definisi Operasional………. 21
D. Bahan Penelitian………...……... 21
E. Alat penelitian………...…………... 22
F. Tata Cara Penelitian………...………... 22
1. Pembuatan larutan baku kloramfenikol………...…….…… 22
2. Pembuatan larutan baku lidokain HCl……….…………...……….… 22
3. Pembuatan larutan campuran baku kloramfenikol dan lidokain HCl…….. 23
4. Preparasi sampel………...……… 23
xii
………..………...
G. Analisis Hasil………... 25
1. Bentuk puncak………... 25
2. Faktor retardasi………...….. 26
3. Resolusi………... 26
4. Koefisien variansi ……… 26
BAB IV HASIL DAN PEMBAHASAN………. 28
A. Jenis dan Komposisi Fase Gerak………. 28
B. Pembuatan Larutan Baku………. 29
C. Optimasi Metode Pemisahan Kloramfenikol dan Lidokain HCl dalam Sediaan Obat Tetes Telinga Colme® dengan KLT Densitometri………. 30
1. Penentuan panjang gelombang pengamatan kloramfenikol dan lidokain HCl……..………. 30
2. Optimasi fase gerak untuk pemisahan kloramfenikol dan lidokain HCl dalam sediaan obat tetes telinga Colme® dengan KLT densitometri………... 34
a. Hasil elusi kloramfenikol dan lidokain HCl dengan fase gerak n-heksana:etilasetat (8,75:16,75) ………... 36
b. Hasil elusi kloramfenikol dan lidokain HCl dengan fase gerak n-heksana:toluena:dietilamin (3,75:19,75:1,5)………. 38
xiii
….
BAB V KESIMPULAN DAN SARAN………... 51
A. Kesimpulan………... 51
B. Saran………... 51
DAFTAR PUSTAKA………... 52
LAMPIRAN……….. 56
xiv
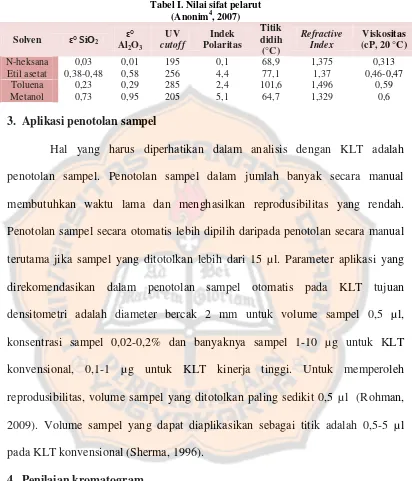
Tabel I. Nilai sifat pelarut………... 11 Tabel II. Jenis dan perbandingan komposisi fase gerak dan nilai indeks
polaritas fase gerak ………...……… 24 Tabel III. Data pengukuran panjang gelombang pengamatan
kloramfenikol dan lidokain HCl……… 33 Tabel IV. Tabel nilai Rf dan As larutan baku kloramfenikol dan lidokain
HCl pada berbagai komposisi fase gerak………... 35 Tabel V. Tabel nilai Rf, As, Rs dan AUC larutan baku campuran
xv
Gambar 1. Struktur kloramfenikol (D-treo-(-)-2,2-dikloro-N-(β
-hidroksi-α-(hidroksimetil)-p)nitrofenetilasetamida)……. 5 Gambar 2. Struktur lidokain hidroklorida (2-(dietilamino)-2’,6’
-asetoksilidida monohidroklorida………... 6
Gambar 3. Struktur gel silika……….. 10
Gambar 4. Ilustrasi pengaruh difusi Eddy pada pelebaran puncak…. 13 Gambar 5. Ilustrasi pengaruh difusi longitudinal pada pelebaran
puncak………... 13
Gambar 6. Ilustrasi pengaruh transfer massa pada pelebaran
puncak………... 13
Gambar 7. Isoterm sorpsi dan profil puncak………... 14 Gambar 8. Menentukan puncak asimetris dan faktor pengekoran….. 14
Gambar 9. Pemisahan dua senyawa……… 15
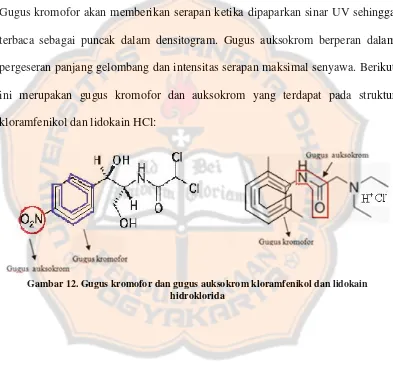
Gambar 10. Ilustrasi skematis model deteksi………... 17 Gambar 11. Menentukan puncak asimetris dan faktor pengekoran….. 26 Gambar 12. Gugus kromofor dan auksokrom kloramfenikol dan
lidokain hidroklorida………... 31 Gambar 13. Pola spektra absorbsi seri larutan baku kloramfenikol
dan lidokain HCl pada panjang gelombang 200-400 nm.. 32 Gambar 14. Pola spektra absorbsi larutan baku kloramfenikol 600 ng
dan lidokain 6000 ng pada pengukuran panjang
xvi
lidokain HCl 6000 ng dengan fase gerak n-heksana:etil
asetat (8,75:16,75) ……… 37
Gambar 16. Puncak baku kloramfenikol 600 ng dan puncak baku lidokain HCl 6000 ng dengan fase gerak
n-heksana:toluena:dietilamin (3,75:19,75:1,5)...………... 38 Gambar 17. Puncakbaku kloramfenikol 300 ng, 600 ng dan puncak
baku lidokain HCl 6000 ng dengan fase gerak
n-heksana:toluena:metanol:dietilamin (3,75:19,75:6:1,5)… 40 Gambar 18. Puncak baku kloramfenikol 600 ng dan puncak baku
lidokain HCl 6000 ng dengan fase gerak
n-heksana:toluena:metanol:dietilamin(3,75:19,75:5:1,5)… 42 Gambar 19. Interaksi kloramfenikol dengan fase diam……… 43 Gambar 20. Interaksi lidokain dengan fase diam……….. 43 Gambar 21. Interaksi kloramfenikol dengan fase gerak
n-heksana:toluena:metanol:dietilamin(3,75:19,75:5:1,5).... 44 Gambar 22. Reaksi asam basa antara lidokain HCl dengan dietilamin
dan interaksi lidokain dengan fase gerak
n-heksana:toluena: metanol:dietilamin (3,75:19,75:5:1,5)... 45 Gambar 23. Hasil pemisahan baku campuran kloramfenikol 600 ng
dan lidokain HCl 6000 ng, serta pemisahan sampel obat tetes telinga Colme® dengan fase gerak
xvii
Lampiran I. Sertifikat Analisis Baku Kloramfenikol ..………... 57 Lampiran II. Sertifikat Analisis Baku Lidokain Hidroklorida ...………. 58 Lampiran III. Spektrum Baku Kloramfenikol dan Lidokain HCl pada
200-400 nm…….……….. 59 Lampiran IV. Perhitungan Kepolaran Fase Gerak ………..………..……….. 62 Lampiran V. Data Penimbangan Bahan...….……..………..………..…...…. 63 Lampiran VI. Sistem Kromatografi Lapis Tipis Densitometri yang
Digunakan ……....….……..………..………..…….……….… 65 Lampiran VII. Densitogram Hasil Elusi Kloramfenikol dan Lidokain HCl
dengan Fase Gerak N-heksana:Etilasetat (8,75:16,75)…………...…...………..……….... 66 Lampiran VIII. Densitogram Hasil Elusi Kloramfenikol dan Lidokain HCl
dengan Fase Gerak N-heksana:Toluena:Dietilamin (3,75:19,75:1,5)………....…...………...
69
Lampiran IX. Densitogram Hasil Elusi Kloramfenikol dan Lidokain HCl dengan Fase Gerak N-heksana:Toluena:Metanol:Dietilamin (3,75:19,75:6:1,5)………..……….……... 72 Lampiran X. Densitogram Hasil Elusi Kloramfenikol dan Lidokain HCl
dengan Fase Gerak N-heksana:Toluena:Metanol:Dietilamin (3,75:19,75:5:1,5)………...……….…… 75 Lampiran XI. Densitogram Hasil Elusi Baku Campuran Kloramfenikol dan
N-xviii
…...
Lampiran XII. Densitogram Hasil Elusi dan Pemisahan Sampel Sediaan Obat Tetes Telinga Colme® dengan Fase Gerak Optimum N-heksan:Toluena:Metanol:Dietilamin (3,75:19,75:5:1,5)………. 81 Lampiran XIII. Perhitungan Peak Asymmetry Factor (As), Resolusi (Rs), Nilai
xix
Kombinasi kloramfenikol dan lidokain hidroklorida terdapat dalam obat tetes telinga Colme®. Penjaminan mutu obat menjadi perhatian penting agar pasien mendapatkan manfaat dari pengobatan yang aman. Salah satu usaha penjaminan mutu adalah penetapan kadar zat aktif berhubungan dengan aktivitas farmakologi. Pada penelitian ini digunakan metode kromatografi lapis tipis (KLT) densitometri untuk pemisahan, analisis kualitatif, dan analisis kuantitatif kloramfenikol dan lidokain HCl dalam waktu yang bersamaan.
Tujuan penelitian ini adalah untuk mengetahui kondisi optimum dari KLT densitometri sehingga dapat menghasilkan pemisahan optimal dari campuran dan penetapan kadar kloramfenikol dan lidokain hidroklorida dalam sediaan obat tetes telinga Colme®. Penelitian ini merupakan jenis rancangan penelitian eksperimental analitik yang pada subjek uji diberikan perlakuan yaitu jenis dan komposisi fase gerak. Sistem KLT yang digunakan adalah fase normal menggunakan fase diam silika gel dan fase gerak n-heksana:etil asetat, n-heksana: toluena:dietilamin, dan n-heksana:toluena:metanol:dietilamin dengan variasi komposisi. Pembacaan dilakukan pada panjang gelombang 242 nm.
Hasil penelitian menunjukkan kondisi yang optimum adalah fase gerak n-heksana:toluena:metanol:dietilamin (3,75:19,75:5:1,5) dengan jarak elusi 10 cm. Kondisi tersebut memberikan parameter pemisahan yang baik yakni bentuk puncak simetris, sempit, dan runcing (nilai As 1), nilai Rf puncak kloramfenikol dan lidokain HCl adalah 0,23 dan 0,48, nilai Rs 2,83, dan KV dari nilai Rf, As, dan
Rs 0%.
xx
Combinations of chloramphenicol and lidocaine hydrochloride exist in
Colme® ear drop. Quality assurance becomes an essence since patient have to get the benefit of the safe medication. One kind of quality assurance involves the active substances quantification related to the pharmacological effect. The quantification of active substances in mixture requires the separation of the substance from others. Thin layer chromatography (TLC) densitometry is method used for separation and also for qualitative and quantitative analysis of substances in simultant.
The objective of this study is to determine optimal condition to produce the optimal separation and determination between chloramphenicol and lidocaine hydrochloride in Colme® ear drop. This study is an analytical experimental study in which the test subjects are subjected by treatments consisted of different types and compositions of mobile phase. The optimization of TLC-UV densitometric method was performed on normal phase silica gel plate using n-hexane:ethyl acetate, n-hexane:toluene:diethylamine, n-hexane:toluene:methanol:dietihyamine with various compositions as the developing solvent. Detection was carried out at 242 nm.
The optimum system was confirmed by
n-hexane:toluene:methanol:dietihyamine (3,75:19,75:5:1,5) as developing solvent with 10 cm elution distance. The system gives symmetry, narrow, and pointed shaped peak (As1), Rf for chloramphenicol is 0,23, Rf for lidoacine HCl is 0,48, Rs 2,83, and CV of As, Rf, and Rs 0%.
1
PENDAHULUAN
A. Latar Belakang
Salah satu obat yang digunakan untuk mengobati infeksi bakteri otitis eksterna dan media adalah kombinasi kloramfenikol dan lidokain HCl dalam sediaan obat tetes telinga Colme® (Anonim5, 2009). Prevalensi otitis eksterna dan media relatif banyak di Indonesia oleh karenanya penjaminan mutu obat menjadi perhatian penting agar pasien mendapatkan manfaat dari pengobatan yang aman.
Kloramfenikol dalam tetes telinga mengandung tidak kurang dari 90,0% dan tidak lebih dari 130,0% C11H12Cl2N2O5 dari jumlah yang tertera pada etiket. Kloramfenikol sukar larut dalam air, mudah larut dalam etanol, aseton dan dalam etil asetat (United States Pharmacopeial Convention, 1995). Kloramfenikol dalam air memiliki λmaks 278 nm, 1%
1cm
E 298 dan dalam natrium hidroksida memiliki λmaks 276 nm, 1%
1cm
E 200 (Clarke, 1986). Larutan topikal lidokain hidroklorida mengandung lidokain hidroklorida C14H22N2O.HCl tidak kurang dari 95,0% dan tidak lebih dari 105,0% dari jumlah yang tertera pada etiket. Lidokain HCl bersifat sangat mudah larut dalam air dan dalam etanol (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995). Lidokain dalam etanol memiliki λmaks 263 nm, 1%
1cm
E 13,5 dan λmaks 278 nm, 1% 1cm
E 2,2 (Clarke, 1986).
280 nm. Penelitian mengenai lidokain dilakukan oleh Kiszka dan Madro (2002) dalam mengembangkan metode KLT untuk pemisahan dan identifikasi lidokain, kokain, dan benzoilecgonine. Penelitian yang akan dilakukan adalah optimasi metode pemisahan campuran kloramfenikol dan lidokain HCl sebagai zat aktif dalam sediaan obat tetes telinga Colme®. Dalam sediaan ini terkandung 2 zat aktif sehingga digunakan metode KLT densitometri untuk pemisahan dan penetapan kadar zat. Metode KLT densitometri digunakan untuk analisis kualitatif dan kuantitatif dalam waktu yang bersamaan dan dapat mengukur beberapa senyawa tidak hanya senyawa tunggal (Martono, 1996). Hal ini menjadi alasan penulis untuk mencari metode analisis alternatif agar dapat digunakan secara regular dalam uji kualitas obat tetes telinga yang mengandung kloramfenikol dan lidokain HCl. Terdapat perbedaan analit dan perbedaan instrumen analisis yang dilakukan dibandingkan penelitian terdahulu menyebabkan perlu dilakukan optimasi metode analisis baru sehingga memungkinkan penetapan kadar dengan baik. Sebelum diadakan analisis diperlukan optimasi kondisi atau sistem analisis agar tercapai pemisahan optimal dari campuran kloramfenikol dan lidokain HCl sehingga dapat dilanjutkan tahap analisis kuantitatif dengan densitometri.
Nilai Rf solut terletak antara 0,2-0,8 akan memaksimalkan pemisahan (Rohman, 2009). Nilai resolusi harus bernilai lebih besar sama dengan 1,5, reprodusibilitas nilai As, Rf, dan Rs yang diperoleh dari pemisahan ditunjukkan dengan KV ≤ 2% (Snyder, Kirkland dan Glajch, 1997).
1. Permasalahan
Bagaimanakah jenis dan komposisi fase gerak yang dapat memberikan bentuk puncak simetris, sempit, dan runcing (nilai As berada dalam kisaran 0,95-1,10), nilai Rf antara 0,2-0,8, nilai Rs ≥ 1,5, dan KV dari nilai As, Rf, dan Rs ≤ 2 % dalam pemisahan campuran kloramfenikol dan lidokain HCl sebagai zat aktif dalam sediaan obat tetes telinga Colme® menggunakan metode KLT densitometri fase diam silika gel 60 F254?
2. Keaslian penelitian
Penelitian pengembangan dan validasi metode kuantifikasi residu kloramfenikol dilakukan oleh Vovk dan Simonovska (2005) dalam penelitiannya
“Development and Validation of A Thin Layer Chromatographic Method for
Determination of Chloramphenicol Residues on Pharmaceutical Equipment
Surfaces” dengan metode KLT densitometri. Plat dikembangkan horizontal dengan menggunakan fase gerak n-heksana:etil asetat (35:65 v/v). Penelitian pengembangan metode identifikasi lidokain, kokain, dan benzoilecgonine dilakukan oleh Kiszka dan Madro (2002) dalam penelitiannya “The Usefulness of The Thin Layer Chromatography Method in The Identification of Cocaine and
Penelitian yang akan dilakukan adalah optimasi pemisahan campuran baku kloramfenikol dan lidokain HCl sebagai zat aktif di dalam obat tetes telinga Colme® dengan menggunakan metode KLT densitometri. Belum adanya sistem KLT densitometri untuk pemisahan dan kuantifikasi kloramfenikol dan lidokain HCl yang tercantum dalam Farmakope Indonesia.
3. Manfaat penelitian
a. Manfaat metodologis. Hasil penelitian diharapkan memberikan sumbangan bagi pengembangan ilmu pengetahuan dan teknologi KLT densitometri mengenai jenis dan komposisi fase gerak yang optimum sebagai metode alternatif pemisahan kloramfenikol dan lidokain HCl dalam sediaan obat tetes telinga Colme®.
b. Manfaat praktis. Hasil penelitian diharapkan memberikan informasi kondisi pemisahan kloramfenikol dan lidokain HCl yang optimal agar mampu menetapkan kadarnya sehingga menjamin keamanan pemakaian sediaan obat tetes telinga Colme®.
B. Tujuan
5
BAB II
PENELAAHAN PUSTAKA
A. Kloramfenikol
Kloramfenikol (D-treo-(-)-2,2-Dikloro-N-(β-hidroksi-α -(hidroksimetil)-p)nitrofenetilasetamida) dalam tetes telinga adalah larutan steril kloramfenikol dalam pelarut yang sesuai. Kloramfenikol mengandung tidak kurang dari 90,0% dan tidak lebih dari 130,0% C11H12Cl2N2O5 dari jumlah yang tertera pada etiket. Kloramfenikol memiliki berat molekul 323,13 g/mol. Pemerian hablur halus berbentuk jarum atau lempeng memanjang, putih hingga putih kelabu atau putih kekuningan. Kloramfenikol sukar larut dalam air, mudah larut dalam etanol, dalam propilen glikol, dalam aseton dan dalam etil asetat (Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995).
Kloramfenikol dalam air memiliki λmaks 278 nm, 1% 1cm
E 298 dan dalam natrium hidroksida memiliki λmaks 276 nm, 1%
1cm
E 200 (Clarke, 1986). Kloramfenikol memiliki nilai momen dipol 5,804 (Bartzatt, 2003). Kloramfenikol adalah antibiotik yang mengikat subunit ribosom 50S sehingga efek primernya adalah inhibisi pembentukan ikatan peptida (Anonim1, 1986).
B. Lidokain Hidroklorida
Larutan oral topikal lidokain hidroklorida (2-(Dietilamino)-2ꞌ,6ꞌ -asetoksilidida monohidroklorida) mengandung lidokain hidroklorida C14H22N2O.HCl tidak kurang dari 95,0% dan tidak lebih dari 105,0% dari jumlah yang tertera pada etiket. Lidokain HCl memiliki berat molekul 207,80 g/mol. Pemerian serbuk hablur putih, tidak berbau dan sedikit pahit. Lidokain HCl memiliki kelarutan sangat mudah larut dalam air dan dalam etanol, larut dalam kloroform, tidak larut dalam eter (Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995).
Lidokain dalam etanol memiliki λmaks 263 nm, 1% 1cm
E 13,5 dan λmaks 278 nm, 1%
1cm
E 2,2 (Clarke, 1986). Lidokain adalah senyawa basa lemah dengan nilai pKa 7,86 yang bersifat polar (Malenović, Ivanović, Medenica, dan Jančić, 2004).
Lidokain Hidroklorida (lidokain HCl atau otopain) adalah anestetik lokal tipe amida yang menghalangi rasa nyeri, gatal, terbakar pada kulit dan selaput lendir (Tan, 2010). Anestetik lokal memiliki mekanisme aksi blokade konduksi saraf impuls pada tempat aplikasi sehingga menghasilkan mati rasa (Anonim2, 2002).
C. Obat Tetes Telinga
Tetesan (guttae) adalah sediaan cair yang mengandung bahan obat atau sediaan obat atau bahan obat dan sediaan obat terlarut, teremulsi, atau tersuspensi, ditakar berdasar jumlah tetesan, digunakan untuk diminum dan diisikan ke dalam wadah bertakaran ganda. Untuk tetesan tertentu yang digunakan di telinga, dinamakan tetes telinga (otoguttae) (Voigt, 1994).
Menurut Farmakope Indonesia (1995), obat tetes telinga (guttae auriculares) adalah obat tetes yang digunakan dengan cara meneteskan ke dalam telinga. Kecuali dinyatakan lain, dibuat dengan menggunakan pembawa bukan air. Pembawa dalam obat tetets telinga harus mempunyai kekentalan yang cocok hingga obat mudah menempel. Pada umumnya digunakan gliseril dan propilenglikol sebagai pembawa dalam obat tetes telinga, juga dapat digunakan etanol, heksilenglikol, dan minyak lemak nabati.
D. Colme Ear Drop®
Kloramfenikol dan lidokain HCL terdapat dalam Colme® volume 8 ml produksi Interbat (Anonim5, 2009). Tetes telinga Colme® mengandung kloramfenikol 10% dan lidokain HCl 4%. Penggunaannya yakni 1 sampai 2 tetes, 3 sampai 4 kali sehari. Obat ini termasuk kategori obat telinga antiinfeksi dan antiseptik untuk indikasi otitis ekserna dan media (Anonim3, 2006).
gangguan pendengaran (Subarkah, 2010). Otitis media adalah inflamasi telinga tengah yang dapat bersifat akut ataupun kronik. Penyakit ini diawali dengan infeksi akibat sakit tenggorokan, flu, atau masalah pernafasan lain yang menyebar ke telinga tengah (Perlstein, 2011). Menurut National Institute on Deafness and Other Communication Disorders (2010), penyakit ini umumnya disebabkan oleh bakteri yang terjadi ketika sejumlah cairan terperangkap di belakang gendang telinga.
E. Kromatografi Lapis Tipis (KLT)
1. Tinjuan umum
Di tahun 1903, Tswett menemukan teknik kromatografi untuk menguraikan suatu campuran (Khopkar, 1990). Kromatografi adalah metode penentuan macam komponen terpisah (analisa kualitatif) dan menentukan jumlah komponen-komponen tersebut (analisa kuantitatif) (Harjadi, 1986). Pengembangan kromatogram terjadi ketika fase gerak melewati lokasi bercak dan fase diam (permukaan partikel-partikel atau di dalam pori-pori partikel maupun terbagi ke dalam sejumlah cairan yang terikat pada permukaan atau suatu pori). Sampel melintasi plat dengan bantuan aksi kapilaritas fase gerak (Dean, 1995).
Adsorpsi merupakan penyerapan pada permukaan yang melibatkan interaksi-interaksi elektrostatik seperti ikatan hidrogen, penarikan dipol-dipol, dan penarikan yang diinduksi oleh dipol (Rohman, 2009). Pada adsorben polar, pelarut yang polar diadsorbsi lebih kuat dibanding yang kurang polar. Hal ini berlaku sebaliknya pada adsorben non polar. Kompetisi terjadi antara substansi yang dikromatografi dan pelarut pada permukaan adsorben. Semakin polar substansi yang dikromatografi dibanding pelarut, semakin kuat substansi diadsorbsi dibanding fase gerak. Hal sebaliknya, jika fase gerak lebih kuat diadsorbsi maka fase gerak akan menggantikan molekul yang dikromatografi sehingga dapat dielusi bersama fase gerak (Gasparic, 1978).
Kecepatan migrasi solut melalui fase diam ditentukan oleh perbandingan distribusinya (D) dan besarnya D ditentukan afinitas relatif solut pada kedua fase. Nilai D adalah perbandingan konsentrasi solut dalam fase diam (Cs) dan dalam fase gerak (Cm). Semakin besar nilai D maka migrasi solut semakin lambat dan sebaliknya. Jika perbedaan perbandingan distribusi solut cukup besar maka campuran-campuran solut akan mudah dan cepat dipisahkan (Rohman, 2009).
2. Sistem KLT
Gambar 3. Struktur gel silika (Habtemariam, 2006)
b. Fase Gerak. Sistem paling sederhana dari fase gerak KLT adalah campuran 2 pelarut organik yang diatur komposisinya sehingga memiliki daya elusi tertentu agar pemisahan optimal. Berikut adalah petunjuk dalam memilih dan mengoptimasi fase gerak:
1) fase gerak harus mempunyai kemurnian yang sangat tinggi,
2) daya elusi fase gerak harus diatur sedemikian rupa sehingga nilai Rf solut terletak antara 0,2-0,8 untuk memaksimalkan pemisahan,
3) pemisahan dengan fase diam polar seperti silika gel akan ditentukan pula oleh polaritas fase gerak yang menentukan kecepatan migrasi solut (Rohman, 2009). Untuk pemilihan fase gerak dalam kromatografi lapis tipis adsorbsi harus dipenuhi aturan berikut:
1) semua substansi yang dikromatografi harus agak larut dalam fase gerak. Jika substansi terlalu larut maka substansi tidak cukup untuk diadsorbsi.
2) Tingkat adsorbsi menengah. Jika substansi terikat terlalu kuat pada permukaan adsorben maka substansi akan berada tetap di tempat penotolan. Sebaliknya, jika substansi diadsorbsi secara lemah memungkinkan tidak adanya pemisahan. 3) Substansi yang dikromatografi dan solven tidak boleh beraksi satu sama lain
Berikut adalah tabel yang menampilkan indek polaritas pelarut:
Tabel I. Nilai sifat pelarut (Anonim4, 2007)
3. Aplikasi penotolan sampel
Hal yang harus diperhatikan dalam analisis dengan KLT adalah penotolan sampel. Penotolan sampel dalam jumlah banyak secara manual membutuhkan waktu lama dan menghasilkan reprodusibilitas yang rendah. Penotolan sampel secara otomatis lebih dipilih daripada penotolan secara manual terutama jika sampel yang ditotolkan lebih dari 15 µl. Parameter aplikasi yang direkomendasikan dalam penotolan sampel otomatis pada KLT tujuan densitometri adalah diameter bercak 2 mm untuk volume sampel 0,5 µl, konsentrasi sampel 0,02-0,2% dan banyaknya sampel 1-10 µg untuk KLT konvensional, 0,1-1 µg untuk KLT kinerja tinggi. Untuk memperoleh reprodusibilitas, volume sampel yang ditotolkan paling sedikit 0,5 µl (Rohman, 2009). Volume sampel yang dapat diaplikasikan sebagai titik adalah 0,5-5 µl pada KLT konvensional (Sherma, 1996).
4. Penilaian kromatogram
adsorben polar dari plat KLT (Anonim6, 2010). Nilai Rf berguna untuk mengidentifikasi senyawa. Nilai Rf untuk senyawa murni dapat dibandingkan dengan nilai Rf dari senyawa standar (Clark, 2007).
(1) Nilai Rf pada KLT dipengaruhi oleh banyak faktor seperti contohnya aktivitas lapisan, ketebalan, keseragaman, jarak elusi, jumlah sampel yang diaplikasikan, solven, kehadiran substansi lain, ukuran dan bentuk chamber, perubahan temperatur, dan lain sebagainya. Bentuk bercak hasil pemisahan juga dipengaruhi oleh banyak faktor seperti kelebihan jumlah sampel yang ditotolkan, penguapan kontinu dari fase gerak selama pengembangan, kehadiran substansi lain, perubahan temperatur, dan lain sebagainya (Gasparic, 1978).
Solut individual hasil pemisahan kromtografi akan membentuk profil Gaussian dalam arah aliran fase gerak. Profil ini berbentuk puncak atau pita secara perlahan akan melebar dan sering membentuk profil yang asimetrik karena solut melanjutkan migrasi ke fase diam. Pelebaran pucak kromatografi disebabkan oleh difusi eddy, difusi longitudinal atau aksial, dan transfer massa.
a. Difusi Eddy. Keadaan di mana beberapa molekul meninggalkan kolom tidak bersamaan akibat diversi selama perjalanan. Fenomena ini dapat dijelaskan dengan gambar 4.
sama dan berlawanan dengan aliran fase gerak. Fenomena ini dapat dijelaskan dengan gambar 5.
c. Transfer massa. Terjadi antara fase gerak, fase gerak stagnan, dan fase diam. Profil konsentrasi dalam fase diam tertinggal sedikit dibanding profil konsentrasi dalam fase gerak yang akan mengakibatkan adanya pelebaran puncak. Desorpsi yang lambat juga menghasilkan puncak yang asimetris atau condong. Distribusi aliran fase gerak yang mengalir di antara partikel fase diam dalam gerakan laminar. Keceparan alir fase gerak lebih cepat jika melalui pusat saluran dibanding fase gerak di dekat artikel fase diam (Rohman, 2009). Fenomena ini terlihat pada gambar 6.
Gambar 4. Ilustrasi pengaruh difusi Eddy pada pelebaran puncak (Honrath, 1995)
Gambar 5. Ilustrasi pengaruh difusi longitudinal pada pelebaran puncak (Scott, 2008)
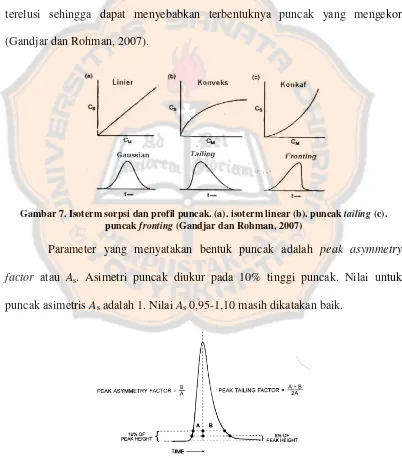
Profil konsentrasi solut yang bermigrasi akan simetris jika rasio distribusi solut (D) konstan selama kisaran konsentrasi keseluruhan puncak, seperti ditunjukkan oleh isoterm sorpsi yang linear berupa plot konsentrasi solut dalam fase diam (Cs) tehadap konsentrasi solut dalam fase gerak (Cm). Adanya puncak asimetri dapat disebabkan oleh ukuran sampel yang dianalisis terlalu besar, interaksi yang kuat antara solut dengan fase diam dapat menyebabkan solut sukar terelusi sehingga dapat menyebabkan terbentuknya puncak yang mengekor (Gandjar dan Rohman, 2007).
Gambar 7. Isoterm sorpsi dan profil puncak. (a). isoterm linear (b). puncak tailing (c). puncak fronting (Gandjar dan Rohman, 2007)
Parameter yang menyatakan bentuk puncak adalah peak asymmetry factor atau As. Asimetri puncak diukur pada 10% tinggi puncak. Nilai untuk puncak asimetris As adalah 1. Nilai As 0,95-1,10 masih dikatakan baik.
Resolusi (Rs) adalah parameter yang menggambarkan rentang pemisahan 2 puncak yang saling berdekatan. Nilai Rs harus mendekati atau lebih dari 1,5 karena akan memberikan pemisahan puncak yang baik (base line resolution) (Gandjar dan Rohman, 2007).
)
Dari persamaan (2) dapat diketahui bahwa yang sangat berpengaruh terhadap pemisahan suatu komponen adalah Rf maksimummasing-masing solut (max Rf1 dan max Rf2) serta lebar puncak masing-masing komponen yang dipisahkan (W1 dan W2). W1 dihitung dari selisih nilai endRf1 dikurangi start Rf1. W2 dihitung dari selisih nilai endRf2 dikurangi startRf2. Pemisahan dua senyawa dapat digambarkan sebagai berikut:
Gambar 9. Pemisahan dua senyawa (Sherma dan Fried, 1996)
F. Densitometri
Salganicoff, Polak, Goodall, Goldman, dan Ebel berhasil mengembangkan densitometer sebagai alat untuk pengukuran kuantitatif in situ
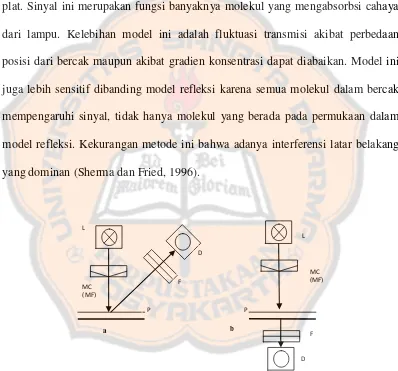
dari substansi yang dipisahkan dengan KLT. Densitometri adalah metode analisis instrumental berdasarkan interaksi radiasi elekromagnetik dengan analit berupa bercak hasil pemisahan KLT. Densitometri mengevaluasi bercak analit hasil KLT dalam kadar kecil secara kuantitatif. Bercak dideteksi dengan sumber sinar dalam celah (slit) yang dapat diatur panjang dan lebarnya. Sinar yang dipantulkan atau ditransmisikan diukur dengan fotosensor. Banyaknya analit yang terbaca adalah berdasarkan perbedaan antara sinyal optik daerah yang tidak mengandung bercak dengan daerah yang mengandung bercak dalam lempeng yang sama (Rohman, 2009).
Secara umum, densitometri terbagi menjadi 2 model pembacaan yakni model refleksi dan transmitan (Sherma dan Fried, 1996). Model refleksi mengukur jumlah cahaya yang dipantulkan dari permukaan dengan menggunakan lampu yang berbeda sebagai sumber cahaya UV/Vis. Lampu halogen dan tungsten untuk menghasilkan cahaya visibel sedangkan lampu xenon menghasilkan cahaya UV. Lampu merkuri umumnya digunakan untuk menghasilkan cahaya dalam kisaran UV dan visibel. Monokromator digunakan untuk menghasilkan cahaya monokromatik. Cahaya yang direfleksikan kemudian diukur dengan
perbedaan konsentrasi profil sampel dan standar. Begitu pula perlakuan terhadap plat setelah dikromatografi juga menyebabkan adanya variasi (Sherma dan Fried, 1996).
Model transmitan mengukur absorbansi substansi dalam kisaran visibel. Detektor fotometrik mengukur intensitas cahaya yang ditransmisikan pada sisi plat. Sinyal ini merupakan fungsi banyaknya molekul yang mengabsorbsi cahaya dari lampu. Kelebihan model ini adalah fluktuasi transmisi akibat perbedaan posisi dari bercak maupun akibat gradien konsentrasi dapat diabaikan. Model ini juga lebih sensitif dibanding model refleksi karena semua molekul dalam bercak mempengaruhi sinyal, tidak hanya molekul yang berada pada permukaan dalam model refleksi. Kekurangan metode ini bahwa adanya interferensi latar belakang yang dominan (Sherma dan Fried, 1996).
Gambar 10. Ilustrasi skematis model deteksi. (a). refleksi dan (b). transmisi. L=lamp, D=detector, F=cut-off filter (for fluorescence), P=plate, MF=monochromatic filter,
MC=monochromator (Sherma dan Fried, 1996)
G. Landasan Teori
Kombinasi kloramfenikol dan lidokain HCl membantu mengurangi rasa nyeri infeksi bakteri otitis eksterna dan media. Salah satu produk yang mengandung kombinasi kloramfenikol dan lidokain HCl adalah obat tetes telinga
Colme®. Kloramfenikol adalah basa yang sukar larut dalam air, mudah larut dalam etanol, propilen glikol, aseton dan dalam etil asetat. Kloramfenikol dalam tetes telinga mengandung tidak kurang dari 90,0% dan tidak lebih dari 130,0% C11H12Cl2N2O5 dari jumlah yang tertera pada etiket. Kloramfenikol dalam air memiliki λmaks 278 nm, 1%
1cm
E 298 dan dalam natrium hidroksida memiliki λmaks 276 nm, 1%
1cm
E 200. Larutan topikal lidokain HCl mengandung C14H22N2O.HCl tidak kurang dari 95,0% dan tidak lebih dari 105,0% dari jumlah yang tertera pada etiket. Lidokain HCl adalah suatu garam yang sangat mudah larut dalam air dan dalam etanol, larut dalam kloroform, tidak larut dalam eter. Lidokain dalam etanol memiliki λmaks 263 nm, 1%
1cm
E 13,5 dan λmaks 278 nm, E1cm1% 2,2.
H. Hipotesis
20
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis rancangan penelitian eksperimental analitik yang pada subjek uji diberikan perlakuan yaitu jenis dan komposisi fase gerak.
B. Variabel Penelitian
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah jenis dan perbandingan komposisi fase gerak yaitu n-heksana:etil asetat, n-heksana:toluena:dietilamin, dan n-heksana:toluena:metanol:dietilamin.
2. Variabel tergantung
Variabel tergantung pada penelitian ini adalah pemisahan puncak kloramfenikol dan lidokain HCl dalam sediaan obat tetes telinga Colme® yang dilihat dari bentuk puncak termasuk nilai As, nilai Rf, nilai Rs, dan KV dari nilai
As, Rf, dan Rs.
3. Variabel pengacau terkendali
a. Kemurnian pelarut yang digunakan, untuk mengatasinya digunakan pelarut
pro analysis.
C. Definisi Operasional
1. Kloramfenikol dan lidokain HCl merupakan senyawa aktif yang berada dalam sediaan obat tetes telinga Colme®.
2. Sistem kromatografi lapis tipis (KLT) yang digunakan adalah sistem KLT fase normal dengan fase diam silika gel dan fase gerak n-heksana:etil asetat (8,75:16,75), n-heksana:toluena:dietilamin (3,75:19,75:1,5), n-heksana:toluena:metanol:dietilamin (3,75:19,75:6:1,5), dan n-heksana:toluena:metanol:dietilamin (3,75:19,75:5:1,5).
3. Optimasi dilakukan dengan mengubah-ubah jenis dan komposisi fase gerak. 4. Parameter pemisahan optimum komponen dengan KLT densitometri adalah
bentuk puncak termasuk peak asymmetry factor (As), nilai faktor retardasi (Rf), nilai resolusi (Rs), dan KV dari nilai As, Rf, dan Rs.
D. Bahan Penelitian
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah neraca analitik (OHAUS Carat Series PAJ 1003, max 60/120 g, min 0,001 g, d = 0,01/0,1 mg, e = 1 mg), densitometer (CAMAG TLC Scanner 3 CAT. No. 027.6485 SER. No. 160602),
autosampler (Linomat 5 No. 170610), perangkat lunak WinCats (V.1.4.4), mikropipet Scorex, bejana kromatografi, dan alat-alat gelas.
F. Tata Cara Penelitian
1. Pembuatan larutan baku kloramfenikol
a. Pembuatan larutan stok. Baku kloramfenikol ditimbang seksama lebih kurang 10 mg. Baku kloramfenikol dimasukkan dalam labu takar 10 ml dan dilarutkan dalam etanol sampai batas tanda sehingga diperoleh larutan stok kloramfenikol 1000 ppm.
b. Pembuatan seri larutan baku. Larutan stok baku kloramfenikol dipipet sebanyak 1,5 ml, dimasukkan ke dalam labu takar 5,0 ml, dan dilarutkan dalam etanol sampai batas tanda sehingga diperoleh konsentrasi 300 ppm. Larutan baku siap untuk ditotolkan.
2. Pembuatan larutan baku lidokain HCl
3. Pembuatan larutan campuran baku kloramfenikol dan lidokain HCl
Larutan stok baku kloramfenikol 1000 ppm diambil sebanyak 1,5 ml dan dimasukkan dalam labu takar 5,0 ml bersama lebih kurang 15 mg baku lidokain HCl kemudian dilarutkan dalam etanol sampai batas tanda 5,0 ml.
4. Preparasi sampel
Preparasi sampel dilakukan dua kali yakni preparasi larutan sampel untuk analisis lidokain HCl dan kloramfenikol.
a. Larutan sampel untuk analisis lidokain HCl. Satu sampel obat tetes telinga Colme® dikeluarkan isinya dan dihomogenkan. Sebanyak 0,75 ml sampel dipipet dan dimasukkan ke dalam labu takar 5 ml, dilarutkan dalam etanol sampai batas tanda (campuran A). Larutan ini siap untuk ditotolkan.
b. Larutan sampel untuk analisis kloramfenikol. Campuran A diambil 0,2 ml, dimasukkan ke dalam labu takar 5 ml, dan dilarutkan dalam etanol sampai batas tanda. Larutan ini siap untuk ditotolkan.
5. Penentuan panjang gelombang pengamatan kloramfenikol dan lidokain
HCl
spektra absorbsi masing-masing seri jumlah pada daerah panjang gelombang 200-400 nm menggunakan densitometer. Menentukan overlapping spektra absorbsi masimasing seri jumlah kloramfenikol-lidokain HCl 300 3000 ng, 600 ng-6000 ng, dan 900 ng-9000 ng.
6. Optimasi metode KLT densitometri
a. Pembuatan fase gerak. Masing-masing fase gerak diambil sebanyak volume yang tertera pada tabel II dan dicampur dalam labu takar 50 ml. Fase gerak yang digunakan untuk optimasi adalah sebagai berikut:
Tabel II. Jenis dan perbandingan komposisi fase gerak dan nilai indeks polaritas fase gerak
Fase gerak (ml) N-heksana
p.a. (IP =
b. Optimasi pemilihan fase gerak pemisahan baku kloramfenikol dan lidokain HCl sebagai zat aktif dalam obat tetes telinga Colme®. Larutan baku kloramfenikol dan baku lidokain HCl masing-masing ditotolkan sebanyak 1 µl, 2 µl, dan 3 µl pada lempeng silika gel berukuran 20x12 cm. Semua penotolan dilakukan pada jarak 1 cm antar totolan. Plat dikembangkan dalam bejana kromatografi yang telah dijenuhi oleh masing-masing jenis dan fase gerak yang akan dioptimasi. Pengembangan dilakukan setinggi 10 cm. Lempeng silika gel dikeluarkan, ditunggu kering dan bercak analit dideteksi pada panjang gelombang pengamatan hasil poin 4 menggunakan densitometer.
dan lidokain HCl masing-masing ditotolkan sebanyak 1 µl, 2 µl, dan 3 µl pada lempeng silika gel berukuran 20x12 cm. Tiga replikasi larutan sediaan obat tetes telinga Colme® yang telah dipreparasi juga ditotolkan sebanyak 1 µl pada lempeng silika gel tersebut. Semua penotolan dilakukan pada jarak 1 cm antar totolan. Plat dikembangkan dalam bejana kromatografi yang telah dijenuhi oleh fase gerak dan jarak elusi hasil optimasi. Lempeng silika gel dikeluarkan, ditunggu kering dan bercak analit dideteksi pada panjang gelombang pengamatan hasil poin 4 menggunakan densitometer. Parameter optimum dihitung nilai KV dari nilai peak asymmetry factor (As), faktor retardasi (Rf), dan resolusi (Rs) puncak hasil pemisahan yang didapat dari 3 kali replikasi larutan sediaan obat tetes telinga Colme®.
G. Analisis Hasil
Hasil optimasi metode pemisahan kloramfenikol dan lidokain HCl dalam sediaan obat tetes telinga Colme® dinilai dari densitogram hasil pemisahan dengan variasi jenis dan komposisi fase gerak. Parameter pemisahan yang baik dilihat dari bentuk puncak, faktor retardasi, resolusi, koefisien variansi nilai As, Rf, dan Rs.
1.Bentuk puncak
Gambar 11. Menentukan puncak asimetris dan faktor pengekoran (Snyder, Kirkland, dan Glajch, 1997)
di mana: As= faktor asimetris puncak
B = lebar setelah puncak pada ketinggian 10% dari bawah A = lebar sebelum puncak pada ketinggian 10% dari bawah
2.Faktor retardasi
Nilai Rfdapat dihitung dengan cara sebagai berikut:
Rf = a/b (3)
di mana: Rf = faktor retardasi
a = jarak rambat bercak yang dihasilkan oleh fase gerak b = jarak rambat elusi fase gerak (Clark, 2007).
3. Resolusi
Nilai resolusi dapat dihitung dengan cara sebagai berikut:
)
4. Koefisien variansi
Nilai % koefisien variansi dari nilai peak asymmetry factor (As), faktor retardasi (Rf), dan resolusi (Rs) puncak dihitung dengan cara sebagai berikut:
di mana: % KV = koefisien variansi SD = standard deviasi
28
BAB IV
HASIL DAN PEMBAHASAN
A. Jenis dan Komposisi Fase Gerak
Optimasi metode pemisahan berarti memeriksa dan memperkirakan faktor-faktor yang mempengaruhi sistem kromatografi. Faktor-faktor tersebut termasuk jenis dan komposisi fase gerak. Optimasi menjadi hal yang penting karena efektifitas metode KLT sangat ditentukan oleh optimalnya suatu prosedur analitik yang memungkinkan pemisahan suatu analit terhadap yang lain. Variasi jenis dan komposisi fase gerak akan memberikan perbedaan nilai indeks polaritas. Perbedaan nilai indeks polaritas akan mempengaruhi pemisahan oleh karenanya perlu dilakukan optimasi jenis dan komposisi fase gerak.
Jenis dan komposisi fase gerak yang akan dioptimasi dalam penelitian ini tercantum dalam tabel II. Pemilihan komposisi fase gerak didasarkan pada penelitian sebelumnya yaitu penelitian pengembangan dan validasi metode kuantifikasi residu kloramfenikol yang dilakukan oleh Vovk dan Simonovska (2005) dengan fase gerak n-heksana:etil asetat (35:65) dan penelitian pengembangan metode identifikasi lidokain, kokain, dan benzoilecgonine yang dilakukan oleh Kiszka dan Madro (2002) dengan fase gerak n-heksana:toluena:dietilamin (65:20:5).
gerak yang akan membawanya secara serentak dan terpisah dengan senyawa lainnya.
B. Pembuatan Larutan Baku
Larutan baku dibuat dari baku kloramfenikol, baku lidokain HCl, dan baku campuran kloramfenikol dan lidokain HCl. Larutan baku dibuat dengan pelarut etanol. Larutan baku tunggal dibuat sebagai pembanding untuk memastikan adanya analit yang dituju dalam sampel dengan menilai kesamaan Rf baku dan sampel. Pembuatan larutan baku campuran bertujuan mensimulasi keadaan sampel sediaan obat tetes telinga Colme® yang terdiri dari campuran senyawa aktif kloramfenikol dan lidokain HCl. Optimasi dilakukan pada larutan baku campuran karena apabila keadaan sistem yang optimal telah tertetapkan pada campuran baku maka kondisi yang serupa juga dapat diaplikasikan pada sampel untuk memperoleh pemisahan dan bentuk puncak yang dinilai optimal.
memvariasikan volume penotolan yakni untuk seri jumlah rendah, menengah, dan tinggi dilakukan penotolan 1, 2, dan 3 µl.
Pembuatan larutan baku seharusnya mengikuti perbandingan konsentrasi kloramfenikol dan lidokain HCl 5:2 dalam volume sediaan obat tetes telinga
Colme® 8 ml namun berdasarkan orientasi lidokain HCl tidak dapat terdeteksi untuk konsentrasi serendah itu (0,8% b/v). Lidokain HCl dalam etanol memiliki λmaks 263 nm, 1%
1cm
E 13,5 dan λmaks 278 nm, 1% 1cm
E 2,2 (Clarke, 1986). Nilai ε
lidokain HCl adalah 317,53 l/mol.cm. Nilai ε untuk memberikan absorbansi yang
dapat terbaca adalah minimal 1000 l/mol cm yang dinyatakan sebagai absorbansi lemah. Lidokain HCl dalam sampel terdapat dalam jumlah yang kecil sehingga ketika dideteksi dengan densitometer tidak terbaca sebagai puncak. Puncak yang terlalu kecil dapat terganggu oleh noise alat dan plat.
C. Optimasi Metode Pemisahan Kloramfenikol dan Lidokain HCl dalam
Sediaan Obat Tetes Telinga Colme® dengan KLT Densitometri
1. Penentuan panjang gelombang pengamatan kloramfenikol dan lidokain
HCl
Penentuan panjang gelombang pengamatan dilakukan dengan deteksi masing-masing baku kloramfenikol dan lidokain HCl. Deteksi dilakukan pada panjang gelombang 200-400 nm yang termasuk panjang gelombang ultraviolet (UV). Syarat senyawa yang dapat dianalisis dengan panjang gelombang tersebut harus memiliki gugus kromofor dan auksokrom (Rohman dan Gandjar, 2007). Gugus kromofor akan memberikan serapan ketika dipaparkan sinar UV sehingga terbaca sebagai puncak dalam densitogram. Gugus auksokrom berperan dalam pergeseran panjang gelombang dan intensitas serapan maksimal senyawa. Berikut ini merupakan gugus kromofor dan auksokrom yang terdapat pada struktur kloramfenikol dan lidokain HCl:
Berikut adalah spektra absorbsi baku kloramfenikol dan lidokain HCl:
Gambar 13. Pola spektra absorbsi seri larutan baku kloramfenikol dan lidokain HCl pada panjang gelombang 200-400 nm
A1. Spektra absorbsi baku kloramfenikol 300 ng (seri bawah) A2. Spektra absorbsi baku kloramfenikol 600 ng (seri menegah) A3. Spektra absorbsi baku kloramfenikol 900 ng (seri atas) B1. Spektra absorbsi baku lidokain HCl 3000 ng (seri bawah) B2. Spektra absorbsi baku lidokain HCl 6000 ng (seri menengah) B3. Spektra absorbsi baku lidokain HCl 9000 ng (seri atas)
Panjang gelombang serapan maksimal (λmaks) dari kloramfenikol yang diperoleh dari densitogram (gambar 13) adalah 281 nm. Menurut Clarke (1986) serapan maksimal kloramfenikol dalam air adalah 278 nm. Hasil pengukuran yang didapat menunjukkan adanya pergeseran sebesar 3 nm antara panjang gelombang hasil pengamatan dan literatur. Pergeseran panjang gelombang hasil penelitian adalah sebesar 1 nm dari pergeseran yang diijinkan yakni 278±2 nm (Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995). Pergeseran panjang gelombang diakibatkan oleh perbedaan kondisi pengujian saat penelitian dengan kondisi pengujian literatur seperti instrumen analisis. Dalam percobaan digunakan
B3
B2 B1
A1 A3 A2
281 nm
densitometer untuk mengukur λmaks kloramfenikol sedangkan dalam literatur
digunakan spektrofotometer UV.
Lidokain HCl, dilihat dari densitogram (gambar 13), memiliki panjang gelombang serapan maksimal (λmaks) sebesar 263 nm. Serapan maksimal lidokain dalam etanol adalah 263 nm (Clarke, 1986). Hal ini menunjukkan tidak ada pergeseran panjang gelombang yang diperoleh dibanding dengan panjang gelombang literatur.
Setelah diperoleh spektra absorbsi masing-masing senyawa, maka dapat ditentukan panjang gelombang pengamatan yakni dengan melihat spektra
overlapping dari kedua senyawa seperti berikut:
Gambar 14. Pola spektra absorbsi larutan baku kloramfenikol 600 ng dan lidokain 6000 ng pada pengukuran panjang gelombang pengamatan
Tabel III. Data pengukuran panjang gelombang pengamatankloramfenikol dan lidokain HCl
Baku Panjang gelombang pengamatan Baku kloramfenikol 300 ng dan lidokain HCl 3000 ng 242 nm
Baku kloramfenikol 600 ng dan lidokain HCl 6000 ng 242 nm Baku kloramfenikol 900 ng dan lidokain HCl 9000 ng 242 nm
Pada penelitian ini panjang gelombang pengamatan yang digunakan merupakan hasil perpotongan antara spektra absorbsi baku kloramfenikol dan baku lidokain HCl pada masing-masing seri jumlah 300 ng, 600 ng, dan 900 ng untuk kloramfenikol dan pada masing-masing seri jumlah 3000 ng, 6000 ng, dan 9000 ng untuk lidokain HCl. Berdasarkan data tabel III maka panjang gelombang pengamatan yang digunakan adalah 242 nm. Penggunaan panjang gelombang 242 nm mempertimbangkan penampilan puncak kloramfenikol agar tidak terlalu besar dan puncak lidokain HCl dengan tinggi yang hampir berbanding dengan kloramfenikol.
2. Optimasi fase gerak untuk pemisahan kloramfenikol dan lidokain HCl
dalam sediaan obat tetes telinga Colme® dengan KLT densitometri
Optimasi dilakukan dengan KLT densitometri pada panjang gelombang pengamatan 242 nm. Pelarut pada baku dan sampel adalah etanol. Kromatografi teknik ascending digunakan dengan jarak pengembangan 10 cm dalam chamber
yang terjenuhkan oleh fase gerak. Puncak baku yang muncul dalam densitogram digunakan untuk analisa reprodusibilitas data As, Rf, dan Rs sebagai respon untuk mendefinisikan kondisi yang optimal.
Baku
Tabel IV memaparkan bentuk puncak, nilai Rf, dan As dari puncak hasil elusi baku kloramfenikol dan lidokain HCl secara KLT dengan deteksi densitometer pada beberapa jenis dan komposisi fase gerak. Perbedaan jenis dan komposisi fase gerak menyebabkan perbedaan bentuk puncak, nilai Rf, dan As karena adanya perbedaan indek polaritas fase gerak. Penjelasan di bawah akan membahas hasil elusi kloramfenikol dan lidokain HCl dengan masing-masing modifikasi jenis dan komposisi fase gerak.
Gambar 15. Puncakbaku kloramfenikol 600 ng dan puncak baku lidokain HCl 6000 ng dengan fase gerak n-heksana:etil asetat (8,75:16,75)
A. Baku kloramfenikol 600 ng (seri menengah) B. Baku lidokain HCl 6000 ng (seri menengah)
C. Puncak yang dihasilkan pada jalur plat silika gel tanpa totolan baku setelah dielusi
Komposisi fase gerak I ini tidak menghasilkan puncak baku kloramfenikol dan lidokain HCl yang memenuhi persyaratan asimetrisitas yang baik yakni 0,95-1,10. Puncak lidokain HCl tidak terelusi sempurna, masih terdapat bercak lidokain HCl di area penotolan (Rf = 0) sehingga bercak mengekor. Hal ini menunjukkan bahwa lidokain HCl terikat lebih kuat terhadap fase diam dibanding fase gerak. N-heksana akan menurunkan polaritas fase gerak sehingga senyawa akan terikat lebih kuat ke fase diam karena lidokain HCl bersifat relatif polar. Fase gerak tidak memiliki elution strength dan kepolaran yang cocok untuk mengelusi bercak lidokain HCl dan membawanya sebagai bercak bulat utuh agar terdeteksi sebagai puncak yang simetris. Puncak di akhir fase diam (gambar 15 C) merupakan kontaminan dari fase diam atau fase gerak
A B
yang ikut menyerap sinar UV sehingga terbaca sebagai puncak. Puncak tersebut bukan merupakan puncak baku karena memiliki bentuk, AUC, dan Rf yang sama untuk tiap jalur pengembangan di fase diam yang digunakan. Berdasarkan hasil elusi maka fase gerak ini tidak digunakan dalam penelitian ini untuk pemisahan kloramfenikol dan lidokain HCl.
b. Hasil elusi kloramfenikol dan lidokain HCl dengan fase gerak n-heksana:toluena:dietilamin (3,75:19,75:1,5). Penggunaan fase gerak ini berdasarkan penelitian Kiszka dan Madro (2002) yang mengembangkan metode pemisahan lidokain, kokain, dan benzoilecgonine. Berikut adalah densitogram baku kloramfenikol dan lidokain HCl setelah dielusi dan gambaran plat KLT di bawah sinar UV 254 nm setelah dielusi:
Gambar 16. Puncakbaku kloramfenikol 600 ng dan puncak baku lidokain HCl 6000 ng dengan fase gerak n-heksana:toluena:dietilamin (3,75:19,75:1,5)
A. Baku kloramfenikol 600 ng (seri menengah) B. Baku lidokain HCl 6000 ng (seri menengah)
C. Puncak yang dihasilkan pada jalur plat silika gel tanpa totolan baku setelah dielusi
A B
Komposisi fase gerak II membawa totolan lidokain HCl sebagai puncak simetris (As 1) yang terbaca pada Rf 0,47 (masuk ke dalam kisaran Rf 0,2-0,8). Fase gerak tidak mampu mengelusi kloramfenikol sehingga Rf totolan adalah 0,01. Nilai As puncak kloramfenikol tidak dapat ditentukan karena totolan belum terelusi untuk terdeteksi sebagai puncak pada jarak pengembangan 10 cm. Tidak terelusinya kloramfenikol dapat disebabkan karena komposisi fase gerak memiliki kepolaran yang tidak cocok dengan kepolaran senyawa sehingga kloramfenikol akan terikat lebih kuat kepada fase diam.
Berdasarkan hasil di atas maka perlu dilakukan usaha untuk meningkatkan Rf kloramfenikol. Usaha-usaha yang dapat ditempuh meliputi modifikasi fase gerak atau dengan meningkatkan jarak elusi. Usaha yang pertama ditempuh adalah modifikasi fase gerak dengan pertimbangan efisiensi waktu analisis dan pemakaian plat KLT. Untuk meningkatkan nilai Rf kloramfenikol diperlukan peningkatan banyaknya interaksi kloramfenikol dengan fase gerak sehingga dapat terelusi naik ke range Rf 0,2-0,8 untuk memaksimalkan pemisahan (Gandjar dan Rohman, 2007). Bercak hasil pemisahan yang berada dalam 1/5 dari jarak elusi akan memberikan tempat atau kesempatan kemungkinan munculnya puncak di belakang analit dan bercak yang berada dalam 4/5 dari jarak elusi akan memberikan cukup tempat untuk kemungkinan munculnya puncak setelah analit.
c. Hasil elusi kloramfenikol dan lidokain HCl dengan fase gerak n-heksana:toluena:metanol:dietilamin (3,75:19,75:6:1,5). Fase gerak ini merupakan hasil modifikasi untuk meningkatkan kepolaran fase gerak dari 2,019 menjadi 2,615 dengan penambahan 6,0 ml metanol yang memiliki indeks polaritas 5,1. Metanol dapat melarutkan baik kloramfenikol dan lidokain HCl. Metanol perlu ditambahkan karena fase gerak n-heksana:toluena:dietilamin belum memiliki indeks polaritas yang sesuai dengan polaritas kloramfenikol. Berikut adalah densitogram baku kloramfenikol dan lidokain HCl setelah dielusi:
Gambar 17. Puncakbaku kloramfenikol 300 ng, 600 ng, dan puncak baku lidokain HCl 6000 ng dengan fase gerak n-heksana:toluena:metanol:dietilamin (3,75:19,75:6:1,5) A1. Baku kloramfenikol 300 ng (seri bawah)
A2. Baku kloramfenikol 600 ng (seri menengah) B. Baku lidokain HCl 6000 ng (seri menengah)
Komposisi fase gerak III meningkatkan nilai Rf kloramfenikol dan lidokain HCl sehingga masuk dalam kisaran Rf 0,2-0,8. Puncak lidokain HCl hasil elusi dengan fase gerak ini menghasilkan puncak yang simetris dengan nilai As 1. Hasil elusi totolan kloramfenikol menampakkan puncak yang lebar, tidak halus,
A1 A2
dan tidak memenuhi persyaratan nilai As, berada di luar range 0,95-1,10. Hal ini dapat disebabkan kepolaran fase gerak yang tidak sesuai dengan kepolaran kloramfenikol.
Puncak kloramfenikol yang melebar, tidak halus, dan asimetris ini dapat disebabkan karena kelarutan kloramfenikol yang besar pada fase gerak akibat penambahan metanol yang terlalu banyak. Hal ini mengakibatkan interaksi kloramfenikol terhadap fase diam berkurang. Untuk pencapaian puncak yang simetri, runcing, dan sempit diperlukan kesetimbangan sorpsi dan desorpsi senyawa pada fase diam yang paling optimal. Kesetimbangan ini dapat dicapai bila fase gerak yang digunakan memungkinkan hal demikian, dalam artian bahwa kloramfenikol harus agak larut dalam fase gerak namun tidak terlalu larut agar dapat cukup untuk diadsorbsi fase diam. Fase gerak ini tidak dapat digunakan untuk pemisahan kloramfenikol dan lidokain HCl sehingga perlu dilakukan modifikasi lanjut yakni dengan mengurangi volume metanol untuk mengurangi kepolaran fase gerak.
Gambar 18. Puncakbaku kloramfenikol 600 ng dan puncak baku lidokain HCl 6000 ng dengan fase gerak n-heksana:toluena:metanol:dietilamin(3,75:19,75:5:1,5) A. Baku kloramfenikol 600 ng (seri menengah)
B. Baku lidokain HCl 6000 ng (seri menengah)
Komposisi fase gerak IV memiliki kepolaran yang paling optimal untuk dapat mengelusi kloramfenikol secara serentak, begitu juga halnya dengan lidokain HCl sehingga menghasilkan puncak simetris dan runcing. Interaksi kloramfenikol dan lidokain HCl terhadap fase gerak lebih besar dibanding fase diam sehingga senyawa dapat terelusi dan terpisah dalam kecepatan migrasi serta menghasilkan nilai Rf yang berbeda.
Berdasarkan hasil optimasi yang dilakukan, dari keempat komposisi fase gerak, komposisi fase gerak n-heksana:toluena:metanol:dietilamin (3,75:19,75:5:1,5) memenuhi kriteria puncak yang paling baik sehingga merupakan fase gerak yang optimal.Hasil elusi (gambar 18) menunjukkan bentuk puncak yang simetris, sempit, dan runcing dengan nilai As berada dalam kisaran 0,95-1,10 dan nilai Rf yang berada dalam kisaran 0,2-0,8 yakni Rf 0,26 untuk baku kloramfenikol dan Rf 0,47 untuk baku lidokain HCl.
Pemisahan antara senyawa dapat terjadi karena adanya interaksi antara senyawa dengan fase diam dan fase gerak. Terdapat interaksi antara kloramfenikol dan lidokain HCl dengan fase diam sehingga diperlukan fase gerak dengan
kepolaran yang sesuai untuk memutus sebagian interaksi ini. Berikut adalah gambaran interaksi kloramfenikol dan lidokain HCl dengan fase diam:
O
Gambar 19. Interaksi kloramfenikol dengan fase diam Interaksi hidrogen
Kloramfenikol bersifat lebih polar dan memiliki interaksi hidrogen lebih banyak dengan fase diam silika dibandingkan lidokain sehingga setelah elusi dengan fase gerak, nilai Rf lidokain akan lebih besar dibanding kloramfenikol.
Gugusan polar dari kloramfenikol dan lidokain HCl akan mengadakan interaksi hidrogen dengan metanol. Gugus non polar dari kloramfenikol dan lidokain HCl mengadakan interaksi hidrofobik dengan toluena dan n-heksana. Dari gambar interaksi (gambar 21 dan 22) dapat dilihat bahwa interaksi yang terjadi antara lidokain HCl dengan penyusun fase gerak terbesar yakni toluena adalah lebih banyak dibanding kloramfenikol. Lidokain, bersifat lebih non polar dibanding kloramfenikol, akan terlarut dan terbawa oleh fase gerak lebih cepat dibanding kloramfenikol sehingga Rf lidokain akan lebih besar dibanding kloramfenikol. Penambahan dietilamin, suatu senyawa basa dengan pKb 2,9 (Quin, 2000), dalam fase gerak akan membentuk molekul lidokain basa sesuai dengan reaksi pada gambar 22.
N HC
Gambar 21. Interaksi kloramfenikol dengan fase gerak n-heksana:toluena:metanol:dietilamin(3,75:19,75:5:1,5)
CH3
Gambar 22. Reaksi asam basa antara lidokain HCl dengan dietilamin dan interaksi lidokain dengan fase gerak n-heksana:toluena:metanol:dietilamin (3,75:19,75:5:1,5)
Interaki van der Waals Interaksi hidrogen
Penentuan reprodusibilitas nilai Rf senyawa dilakukan dengan pemisahan baku campuran kloramfenikol dan lidokain HCl (untuk masing-masing seri rendah, menengah, dan tinggi) serta larutan sampel sebanyak tiga kali replikasi. Sampel yang digunakan adalah sediaan obat tetes telinga Colme® volume 8 ml yang terdiri dari zat aktif kloramfenikol 10% dan lidokain HCl 4% dengan pembawa propilen glikol. Sediaan kental ini dipipet untuk mengambil sejumlah volume sampel.
sediaan. Digunakannya sampel dalam tahapan optimasi bertujuan untuk meyakinkan bahwa kondisi optimal yang diperoleh dapat digunakan untuk tahapan selanjutnya yakni validasi metode dan pada akhirnya penetapan kadar analit dalam sediaan.
Preparasi sampel diperlukan untuk memperoleh keseluruhan zat aktif analit dari sediaan untuk dianalisis kadarnya. Preparasi sampel dilakukan dua kali yaitu preparasi untuk analisis lidokain HCl dan preparasi lanjut untuk analisis kloramfenikol. Preparasi sampel dimulai dengan mengambil sejumlah volume sampel yang telah dicampur secara homogen, agar cuplikan yang dianalisis menggambarkan keadaan keseluruhan analit dalam sediaan, kemudian diencerkan (campuran A). Totolan 1 µl dari campuran A memiliki jumlah teoritis 6000 ng lidokain HCl. Berdasarkan seri jumlah yang digunakan dalam tahap optimasi, jumlah minimal 3000 ng sampai jumlah maksimal 9000 ng lidokain HCl menampakkan puncak yang baik. Puncak nomor 2 dalam sampel (gambar 23 C2) memiliki nilai Rf yang mirip dengan baku lidokain HCl sehingga puncak tersebut adalah puncak lidokain HCl. Preparasi sampel untuk menampilkan puncak lidokain HCl menghasilkan puncak simetris dan runcing sedangkan puncak kloramfenikol mengekor. Totolan sampel mengandung jumlah kloramfenikol yang terlalu banyak sehingga fase gerak tidak mampu mengelusi kloramfenikol secara serentak.
agar menampakkan puncak kloramfenikol 600 ng yang tidak terlalu besar. Berdasarkan seri jumlah yang digunakan dalam tahap optimasi, jumlah minimal 300 ng sampai jumlah maksimal 900 ng kloramfenikol menampakkan puncak yang baik. Puncak dalam sampel (gambar 23 C1) memiliki nilai Rf yang mirip dengan baku kloramfenikol sehingga puncak tersebut adalah puncak kloramfenikol. Preparasi sampel untuk menampilkan puncak kloramfenikol menghasilkan puncak simetris dan runcing. Densitogram hanya menampilkan satu puncak yakni kloramfenikol karena preparasi sampel tahap ini menyebabkan jumlah lidokain HCl yang terlalu kecil untuk dapat dideteksi sebagai puncak.
Hasil elusi larutan baku campuran kloramfenikol dan lidokain HCl serta larutan sampel sediaan obat tetes telinga Colme® adalah sebagai berikut:
Gambar 23. Hasil pemisahanbaku campuran kloramfenikol 600 ng dan lidokain HCl 6000 ng, serta pemisahan sampel obat tetes telinga Colme® dengan fase gerak
n-heksana:toluena:metanol:dietilamin (3,75:19,75:5:1,5) A. Baku kloramfenikol 600 ng (seri menengah)
B. Baku lidokain HCl 6000 ng (seri menengah)
C1. Puncak kloramfenikol dalam sampel obat tetes telinga Colme® (plat I) C2. Puncak lidokain HCl dalam sampel obat tetes telinga Colme® (plat II)
D. Puncak yang dihasilkan pada jalur plat II silika gel tanpa totolan sampel setelah dielusi B
A B
A C1
Puncak di akhir fase diam (gambar 23D) merupakan kontaminan dari fase diam atau fase gerak yang ikut menyerap sinar UV sehingga terbaca sebagai puncak. Berikut adalah penjabaran hasil elusi baku campuran kloramfenikol dan lidokain HCl serta larutan sampel sediaan obat tetes telinga Colme®:
Tabel V. Tabel nilai Rf, As, Rs dan AUC larutan baku campuran kloramfenikol dan lidokain
HCl serta sampel Colme® dengan fase gerak n-heksana:toluena:metanol:dietilamin (3,75:19,75:5:1,5) Seri rendah Seri menengah Seri tinggi
Kloram